保健食品评价试验项目、试验原则及结果判定
保健食品在安全性和功能性以及毒理学技术审评和功能试验

保健食品试验项目选择原则
以普通食品(含药食两用品种、营养 强化剂)为原料,但服用量大于常量 的,进行急性毒性试验、三项致突变 试验和30天喂养试验,必要时作传统 致畸试验。
保健食品试验项目选择原则
以普通食品(含药食两用品种、营养强化剂) 为原料,使用新工艺生产的,应进行第一、 二阶段毒性试验。根据试验结果确定是否进 行下一步的毒性试验。
保健食品的特征
特征:特定保健功能、调节机体功能、 不治疗疾病、食品
营养素补充剂:补充维生素、矿物质
保健食品原料的安全性管理
普通食品可作为生产保健食品的原辅料。 申请注册的保健食品中涉及食品添加剂的
,应符合《食品添加剂使用卫生标准》的 规定,即所用品种为列入《食品添加剂使 用卫生标准》(GB2760)、《食品营养强 化剂使用卫生标准》(GB14880)或卫生部 公告名单中的食品添加剂新品种。
毒理学主要概念
半数致死剂量(LD50):试验中,引起一 半动物死亡的剂量,用来表述受试物的毒 性大小。急性分级的依据。
末观察到有害作用剂量(NOAEL):动物实 验中,敏感指标和敏感方法观察到的剂量, 是制定标准(安全限值)的依据。
毒理学主要概念
剂量-量反应关系:表示化学物质的剂 量与个体中发生的量反应强度之间的 关系。
首次使用的新资源除对产品进行毒性试验外, 还应对食品新资源进行毒性试验。
保健食品试验项目选择原则
产品配方中加入某一已批准用于食品的物质, 按本程序有关条款的规定设置试验剂量时, 如该物质的剂量达到已知的毒作用剂量,则 应去除该物质或降低该物质剂量(如降至最 大未观察到有害作用剂量,NOAEL),再就该 保健食品中其它成分的毒性作用及该物质与 其它成分的联合毒性作用作出评价。
保健食品评价试验项目、试验原则及结果判定

保健食品评价试验项目、试验原则及结果判定增强免疫力功能1.1 试验项目1.1.1 体重1.1.2 脏器/ 体重比值测定:胸腺/ 体重比值,脾脏/ 体重比值1.1.3 细胞免疫功能测定:小鼠脾淋巴细胞转化实验,迟发型变态反应实验1.1.4 体液免疫功能测定:抗体生成细胞检测,血清溶血素测定1.1.5 单核—巨噬细胞功能测定:小鼠碳廓清实验,小鼠腹腔巨噬细胞吞噬鸡红细胞实验1.1.6 NK 细胞活性测定1.2.1 所列指标均为必做项目。
1.2.2 采用正常或免疫功能低下的模型动物进行实验。
1.3 结果判定增强免疫力功能判定:在细胞免疫功能、体液免疫功能、单核—巨噬细胞功能、NK 细胞活性四个方面任两个方面结果阳性,可判定该受试样品具有增强免疫力功能作用。
其中细胞免疫功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定细胞免疫功能测定结果阳性。
体液免疫功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定体液免疫功能测定结果阳性。
单核—巨噬细胞功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定单核—巨噬细胞功能结果阳性。
NK 细胞活性测定实验的一个以上剂量组结果阳性,可判定NK 细胞活性结果阳性。
辅助降血糖功能1.1 试验项目1.1.1 动物实验1.1.1.1 体重1.1.1.2 空腹血糖1.1.1.3 糖耐量1.1.2 人体试食试验1.1.2.1 空腹血糖1.1.2.2 餐后1 小时血糖1.1.2.3 尿糖2.1 试验原则2.1.1 动物实验和人体试食试验所列指标均为必做项目。
2.1.2 除对高血糖模型动物进行所列指标的检测外,应进行受试样品对正常动物空腹血糖影响的观察。
2.1.3 人体试食试验应在临床治疗的基础上进行。
2.1.4 应对临床症状和体征进行观察。
2.1.5 在进行人体试食试验时,应对受试样品的食用安全性作进一步的观察。
命名,申请、对化学性肝损伤有辅助保护功能评价方法

附件对化学性肝损伤有辅助保护功能评价方法(修订稿)保健食品评价试验项目、试验原则及结果判定Items, Principles and Result Assessment1试验项目动物实验分为方案一(刀豆蛋白A急性肝损伤模型)、方案二(急性酒精性肝损伤模型)和方案三(亚急性酒精性肝损伤模型)三种1.1 方案一(刀豆蛋白A急性肝损伤模型)1.1.1体重1.1.2血清中谷丙转氨酶(ALT)1.1.3血清中谷草转氨酶(AST)1.1.4血清中乳酸脱氢酶(LDH)1.1.5 肝组织病理学检查1.2 方案二(急性酒精性肝损伤模型)1.2.1体重1.2.2血清甘油三酯(TG)1.2.3血清极低密度脂蛋白(VLDL)1.2.4肝组织病理学检查1.3 方案三(亚急性酒精性肝损伤模型)1.3.1体重1.3.2血清中胆固醇(CHOL)1.3.3血清中低密度脂蛋白胆固醇(LDL)1.3.4血清中胆红素(TBIL)1.3.5肝组织病理学检查2 试验原则2.1所列指标均为必做项目。
2.2根据受试样品作用原理的不同,方案一、方案二和方案三任选其一进行动物实验。
3 结果判定方案一(刀豆蛋白A急性肝损伤模型)在模型成立的前提下,ALT、AST和LDH中任两项血液生化指标阳性和病理结果阳性,可判定受试样品对化学性肝损伤有辅助保护功能。
方案二(急性酒精性肝损伤模型):血清中TG、VLDL指标阳性和病理组织学检查结果阳性,可判定该受试样品具有对急性酒精性肝损伤有辅助保护功能功能。
方案三(亚急性酒精性肝损伤模型):①血清中CHOL、LDL和TBIL三项检测指标结果阳性,可判定该受试样品具有对亚急性酒精性肝损伤有辅助保护功能作用;②血清中CHOL、LDL和TBIL三项指标中任两项结果阳性,且肝脏病理组织学检查结果阳性,可判定该受试样品具有对亚急性酒精性肝损伤有辅助保护功能功能。
在急性或亚急性酒精性肝损伤结果判定中,任何一项方案为阳性时,可认为该受试物具有降低酒精性肝损伤危害功能。
保健食品检验与评价技术规范

保健食品检验与评价技术规范1. 引言保健食品是指具有特定保健功能,适合人类日常膳食补充的食品。
针对保健食品的质量安全和保健功能有效性的评价,需要一套科学规范的检验与评价技术。
本文档旨在详细介绍保健食品检验与评价的技术规范,以保障消费者的购买权益和人体健康。
2. 保健食品检验技术规范2.1 保健食品质量检验保健食品质量检验主要包括以下方面:•检验项目:对保健食品的成分含量、添加剂使用量、微生物污染、重金属、农药残留等进行检测。
•检验方法:采用适当的分析仪器和方法,如高效液相色谱法、气相色谱法、质谱法等,对各项指标进行准确测定。
•检验标准:依据国家相关标准以及行业标准,对保健食品进行检验评价,确定其质量合格与否。
2.2 保健食品真实性检验保健食品的真实性检验主要涉及产品包装和宣传资料的准确性与合法性,包括:•包装标签:检查保健食品的包装标签是否符合国家相关法规要求,是否标注了真实的成分、含量和功能等信息。
•宣传资料:对保健食品的广告宣传、网站介绍等进行核查,确保宣传内容与实际情况一致。
3. 保健食品评价技术规范3.1 保健食品营养评价保健食品的营养评价主要从以下几个方面进行:•营养成分:对保健食品中的主要营养成分进行分析,并与人体所需的营养素摄入标准进行对比,判断其是否满足健康需求。
•生物活性物质:对保健食品中的生物活性物质进行评估,例如抗氧化物质、功能性多糖等,确定其对人体健康的价值。
3.2 保健食品安全性评价保健食品的安全性评价主要关注以下内容:•毒理学评价:对保健食品中可能存在的毒理作用进行研究,评估其剂量安全范围和潜在危害。
•长期食用评价:通过动物实验和人体临床试验等方法,对保健食品的长期食用安全性进行评估。
3.3 保健食品功能评价保健食品的功能评价主要包括以下方面:•临床试验:通过随机对照试验等方法,评估保健食品对人体特定疾病或生理功能的影响。
•人群调研:通过问卷调查等手段,调查保健食品使用人群的满意度和效果反馈,评估其功能有效性。
缓解视疲劳功能评价方法-中国保健协会

缓解视疲劳功能评价方法(征求意见稿)保健食品评价试验项目、试验原则及结果判定Items, Principles and Result Assessment缓解视疲劳功能1 人体试食试验项目1.1 分别于试食前后进行眼部症状及眼底检查,血、尿常规检查,肝、肾功能检查,症状询问、用眼情况调查;于试验前进行一次胸透、心电图、腹部B超检查;。
1.2 明视持久度1.3 视力2 试验原则2.1 受试样品试食时间为60d。
2.2 所列指标均为必做项目。
2.3 在进行人体试食试验时,应对受试样品的食用安全性作进一步的观察。
3 结果判定3.1试验组自身比较或试验组与对照组组间比较,症状改善且症状总积分差异有显著性(p<0.05)。
3.2试验组自身比较或试验组与对照组组间比较,明视持久度差异有显著性(p<0.05),且平均明视持久度提高大于等于10%。
具备3.1及3.2可判定该受试物具有缓解视疲劳功能。
缓解视疲劳功能检验方法Method for the Assessment of AlleviatingEye Fatigue Function1受试者纳入标准1.1 18岁~65岁的成人。
1.2长期用眼,视力易疲劳者。
2受试者排除标准2.1患有感染性、外伤性眼部疾患者。
进行眼部手术不足3个月者。
2.2患有角膜、晶体、玻璃体、眼底病变等内外眼疾患者。
2.3患有心血管、脑血管、肝、肾、造血系统等疾病者。
2.4妊娠或哺乳期妇女、过敏体质患者。
2.5 短期内服用与受试功能有关的物品,影响到对结果的判定者。
2.6.长期服用有关治疗视力的药物,保健品或使用其他治疗方法未能终止者。
2.7不符合纳入标准,未按规定食用受试物者,或资料不全等影响功效或安全性判断者。
3 试验设计及分组要求采用自身和组间两种对照设计。
根据随机、双盲的要求进行分组,分组时根据症状及视力检查情况,使试食组和对照组的症状及视力水平均衡。
同时要考虑年龄、性别等因素,使两组具有可比性。
保健食品功能学评价程序和检验方法

保健食品功能学评价程序和检验方法(1996年7月18日卫监发[1996]38号发布,自发布之日起实行1.主题内容和适用范围本程序和检验方法规定了评价食品保健作用的统一程序和检验方法。
本程序和检验方法适用于评价食品的免疫调节、延缓衰老、改善记忆、促进生长发育、抗疲劳、减肥、耐缺氧、抗辐射、抗突变、抑制肿瘤、调节血脂、改善性功能等作用。
本程序和检验方法规定了评价食品保健作用的人体试食试验规程。
2.进行食品保健作用评价的基本要求2.1对受试物的要求2.1.1提供受试物的物理、化学性质(包括化学结构、纯度、稳定性等)等有关资料。
2.1.2受试物必须是规格化的产品,即符合既定的生产工艺、配方及质量标准。
2.1.3提供受试物安全性毒理学评价的资料,受试物必须是已经过食品安全性毒理学评价确认为安全的物质。
2.2对实验动物的要求2.2.1根据各种试验的具体要求,合理选择实验动物。
常用大鼠和小鼠,品系不限,推荐使用近交系动物。
2.2.2 动物的性别不限,可根据试验需要进行选择。
动物的数量的要求为小鼠每组至少10只(单一性别),大鼠每组至少8只(单一性别)。
动物的年龄可根据具体试验需要而定。
2.2.3 动物应达到二级实验动物的要求。
2.3 给受试物的剂量及时间2.3.1 各种试验至少应设3个剂量组,1个对照组,必要时可设阳性对照组。
剂量选择应合理,尽可能找出最低有效剂量。
在3个剂量组中,其中一个剂量应相当于人推荐摄入量的5-10倍左右。
2.3.2 给受试物的时间应根据具体试验而定,原则上至少1个月。
3.试验项目、试验原则及结果判定3.1 免疫调节作用3.1.1 试验项目3.1.1.1.1 脏器/体重比值胸腺/体重比值脾脏/体重比值3.1.1.1.2 细胞免疫功能测定小鼠脾淋巴细胞转化实验迟发型变态反应3.1.1.1.3 体液免疫功能测定抗体生成细胞检测血清溶血素测定3.1.1.1.4 单核-巨噬细胞功能测定小鼠碳廓清试验小鼠腹腔巨噬细胞吞噬鸡红细胞试验3.1.1.1.5 N细胞活性测定3.1.1.2 人体试食试验3.1.1.2.1 细胞免疫功能测定外周血淋巴细胞转化试验3.1.1.2.2 体液免疫功能试验单向免疫扩散法测定IgG、IgA、IgM3.1.1.2.3 非特异性免疫功能测定吞噬与杀菌试验3.1.1.2.4 N细胞活性测定3.1.2 试验原则要求选择一组能够全面反映免疫系统各方面功能的试验,其中细胞免疫、体液免疫、单核-巨噬细胞功能三个方面至少各选择1种试验,在确保安全的前提下尽可能进行人体试食试验。
保健食品试验与检验

以卫生部规定允许用于保健食品的动植物或动植物提取物(卫法监发[2002]51号附件2)或微生物(卫法监发[2001]84号附件2和5) ,应进行急性毒性试验、三项致突变试验和30天喂养试验,必要时进行传统致畸试验和第三阶段毒性试验。
人参、人参叶、人参果、三七、土茯苓、大蓟、女贞子、山茱萸、川牛膝、川贝母、川芎、马鹿胎、马鹿茸、马鹿骨、丹参、五加皮、五味子、升麻、天门冬、天麻、太子参、巴戟天、木香、木贼、牛蒡子、牛蒡根、车前子、车前草、北沙参、平贝母、玄参、生地黄、生何首乌、白芨、白术、白芍、白豆蔻、石决明、石斛(需提供可使用证明)、地骨皮、当归、竹茹、红花、红景天、西洋参、吴茱萸、怀牛膝、杜仲、杜仲叶、沙苑子、牡丹皮、芦荟、苍术、补骨脂、 诃子、赤芍、远志、麦门冬、龟甲、佩兰、侧柏叶、制大黄、制何首乌、刺五加、刺玫果、泽兰、泽泻、玫瑰花、玫瑰茄、知母、罗布麻、苦丁茶、金荞麦、金撄子、青皮、厚朴、厚朴花、姜黄、枳壳、枳实、柏子仁、珍珠、绞股蓝、葫芦巴、茜草、荜茇韭菜子、首乌藤、香附、骨碎补、党参、桑白皮、桑枝、浙贝母、益母草、积雪草、淫羊藿、菟丝子、野菊花、银杏叶、黄芪、湖北贝母、番泻叶、蛤蚧、越橘、槐实、蒲黄、蒺藜、蜂胶、酸角、墨旱莲、熟大黄、熟地黄、鳖甲 )
13、黑龙江省疾病预防控制中心 14、四川省疾病预防控制中心 15、四川大学华西公共卫生学院分析测试中心 16、福建省疾病预防控制中心 17、广西疾病预防控制中心 18、湖北省疾病预防控制中心 19、同济医科大学 20、山东省疾病预防控制中心 21、山东大学卫生分析测试中心
安全性毒理学检验机构名单
稳定性试验
安全性毒理学评价
功能学评价
检验时限(月)
动物
人体
祛黄褐斑功能
○
○
增加骨密度评价方法(征求意见稿)

附件6:增加骨密度功能评价方法(征求意见稿)保健食品评价试验项目、试验原则及结果判定Items, Principles and Result Assessment1试验项目:动物试验:分为方案一(补钙为主的受试物)和方案二(骨代谢有关的其它功效成份,如以内分泌调节等作用为主的不含钙或不以补钙为主的受试物)两种。
方案二仅适用于每日钙摄入量在100mg以下的受试物,其它受试物均采用方案一。
1.1 体重1.2 骨干重1.3 骨钙含量1.4 骨密度1.5 骨组织病理形态2 试验原则:2.3 根据受试样品作用原理的不同,方案一和方案二任选其一进行动物试验。
2.2 所列指标均为必做项目。
2.3 样品使用未批准用于食品的含钙化合物,必须进行钙吸收代谢试验;样品使用属营养强化剂范围内的钙源及来自普通食品的钙源(如可食动物的骨、奶等),可以不进行钙吸收代谢试验。
3 结果判定3.1 方案一:a) 生长发育指标(体重、身长、股骨干重)中至少一项显著高于低钙对照组;b) 股骨骨钙含量或骨密度显著高于低钙对照组,且病理学上(骨组织学结构或钙沉积)两方面结果中的任一方面优于低钙对照组;c) 进行钙吸收试验时,钙吸收率显著高于低钙对照组,且高剂量组不低于相应钙含量的碳酸钙对照组。
符合以上三项要求,可判定受试物具有“有助于增加骨密度功能”的作用。
3.2 方案二:受试物试验组的股骨骨钙含量或骨密度显著高于模型对照组,且骨组织形态学指标较去势模型对照组有显著性改善,方可判定受试物具有“有助于增加骨密度功能”的作用。
增加骨密度功能检验方法Method for the Assessment of IncreasingBone Density Function有助于增加骨密度功能作用的检验方法根据受试样品作用原理的不同,分为方案一(补钙为主的受试物)和方案二(骨代谢有关的其它功效成份,如以内分泌调节等作用为主的不含钙或不以补钙为主的受试物)两种。
保健食品检测试验(DOC)
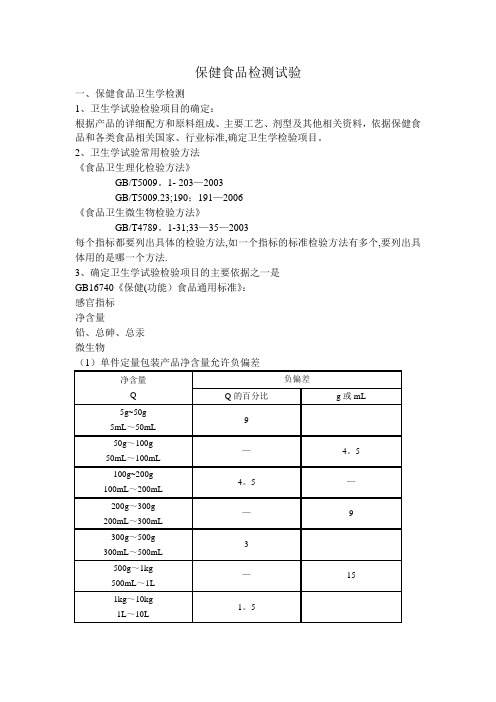
保健食品检测试验一、保健食品卫生学检测1、卫生学试验检验项目的确定:根据产品的详细配方和原料组成、主要工艺、剂型及其他相关资料,依据保健食品和各类食品相关国家、行业标准,确定卫生学检验项目。
2、卫生学试验常用检验方法《食品卫生理化检验方法》GB/T5009。
1- 203—2003GB/T5009.23;190;191—2006《食品卫生微生物检验方法》GB/T4789。
1-31;33—35—2003每个指标都要列出具体的检验方法,如一个指标的标准检验方法有多个,要列出具体用的是哪一个方法.3、确定卫生学试验检验项目的主要依据之一是GB16740《保健(功能)食品通用标准》:感官指标净含量铅、总砷、总汞微生物(1)单件定量包装产品净含量允许负偏差(2)铅、总砷、总汞检测方法:铅GB/T5009。
12-2003第一法:石墨炉原子吸收光谱法第二法:氢化物原子荧光光谱法第三法:火焰原子吸收光谱法总砷GB/T5009。
11-2003第一法:氢化物原子荧光光度法第二法:银盐法第三法:砷斑法总汞GB/T5009.17-2003第一法:原子荧光光谱法第二法:冷原子吸收光谱法(3)微生物指标检测方法:菌落总数:GB/T4789。
2-2003大肠菌群:GB/T4789。
3—2003霉菌:GB/T4789。
15-2003酵母:GB/T4789.15—2003致病菌(指肠道致病菌和致病性球菌)沙门氏菌:GB/T4789。
4—2003志贺氏菌:GB/T4789.5—2003金黄色葡萄球菌:GB/T4789.10-2003溶血性链球菌:GB/T4789。
11—2003从安全性角度出发,测定胶囊类样品的铅、总砷、总汞、微生物指标时须包括胶囊皮。
(4)其他经常检测的卫生学指标注:不同剂型水分指标要求(5)不同原料的卫生学指标检测要求二、稳定性检测(1)稳定性试验的方式保温加速试验:3批样品,37—40℃、75%相对湿度下保存90天,每30天检测一次;稳定性试验报告包括:3批样品保温前(卫生学)、保温30天、60天、90天的样品检验结果;规定保质期2年。
保健食品功能学评价程序和检验方法

保健食品功能学评价程序和检验方法1主题内容和适用范围本程序和检验方法规定了评价食品保健作用的统一程序和检验方法。
本程序和检验方法适用于评价食品的免疫调节、延缓衰老、改善记忆、促进生长发育、抗疲劳、减肥、耐缺氧、抗辐射、抗突变、抑制肿瘤、调节血脂、改善性功能等作用。
本程序和检验方法规定了评价食品保健作用的人体试食试验规程。
2进行食品保健作用评价的基本要求2.1对受试物的要求2.1.1提供受试物的物理、化学性质(包括化学结构、纯度、稳定性等)等有关资料。
2.1.2受试物必须是规格化的产品,即符合既定的生产工艺、配方及质量标准。
2.1.3提供受试物安全性毒理学评价的资料,受试物必须是已经过食品安全性毒理学评价确认为安全的物质。
2.2对实验动物的要求2.2.1根据各种试验的具体要求,合理选择实验动物。
常用大鼠和小鼠,品系不限,推荐使用近交系动物。
2.2.2动物的性别不限,可根据试验要进行选择。
动物的数量的要求为小鼠每组至少10只(单一性别),大鼠每组至少8只(单一性别)。
动物的年龄可根据具体试验要而定。
2.2.3动物应达到二级实验动物的要求。
2.3给受试物的剂量及时间2.3.1各种试验至少应设3个剂量组,1个对照组,必要时可设阳性对照组。
剂量选择应合理,尽可能找出最低有效剂量。
在3个剂量组中,其中一个剂量应相当于人推荐摄入量的5-10倍左右。
2.3.2给受试物的时间应根据具体试验而定,原则上至少1个月。
3试验项目、试验原则及结果判定3.1免疫调节作用3.1.1.1.1脏器/体重比值胸腺/体重比值脾脏/体重比值3.1.1.1.2细胞免疫功能测定小鼠脾淋巴细胞转化实验迟发型变态反应3.1.1.1.3体液免疫功能测定抗体生成细胞检测血清溶血素测定3.1.1.1.4单核-巨噬细胞功能测定小鼠碳廓清试验小鼠腹腔巨噬细胞吞噬鸡红细胞试验3.1.1.1.5NK细胞活性测定3.1.1.2人体试食试验3.1.1.2.1细胞免疫功能测定外周血淋巴细胞转化试验3.1.1.2.2体液免疫功能试验单向免疫扩散法测定IgG、IgA、IgM 3.1.1.2.3非特异性免疫功能测定吞噬与杀菌试验3.1.1.2.4NK细胞活性测定要求选择一组能够全面反映免疫系统各方面功能的试验,其中细胞免疫、体液免疫入单核-巨噬细胞功能三个方面至少各选择1种试验,在确保安全的前提下尽可能进行人体试食试验。
保健食品评价试验项目试验原则及结果判定

保健食品评价试验项目试验原则及结果判定保健食品是指具有维持人体健康、增强抵抗力、延缓衰老的功能,不以治疗疾病为目的的食品。
为了确保保健食品的质量和安全性,需要进行评价试验来确保其功效和适用性。
下面将介绍保健食品评价试验的项目、试验原则及结果判定。
一、评价试验项目1.化学成分分析:对保健食品进行化学成分分析,包括营养成分、添加剂和污染物等。
2.安全性评价:通过动物实验和临床试验评价保健食品的安全性,包括急性和亚急性毒性、致癌性、致畸性和致突变性等。
3.功能评价:评价保健食品的功能效果,包括改善各种疾病症状、提高免疫力和延缓衰老等。
4.消化吸收评价:通过口服给药来评价保健食品的消化吸收特性,包括吸收速度、生物利用度和血浆药物浓度等。
5.群体试验:通过对大样本人群进行试验,评价保健食品在人群中的有效性和安全性。
二、试验原则1.安全性优先:评价试验中,安全性是首要考虑的因素,保健食品必须在一定剂量范围内安全无毒。
2.科学性:试验应依据科学的方法和原则进行设计,严格按照国家和行业的标准进行操作。
3.严谨性:试验应严格控制随机性和干预因素,保证试验结果的可靠性。
4.伦理性:针对人体试验,必须尊重试验对象的自愿性和知情同意,尽可能减少对试验对象的危害。
三、结果判定根据评价试验的结果,可以对保健食品进行结果判定。
1.化学成分分析:根据分析结果,判断保健食品的成分是否符合规定标准,是否存在添加剂或污染物。
2.安全性评价:根据毒性试验和临床试验结果,判断保健食品是否安全,如是否引起急性或慢性毒性反应。
3.功能评价:根据功能试验结果,判断保健食品对疾病症状的改善程度、免疫力的提高和衰老的延缓程度。
4.消化吸收评价:根据消化吸收试验结果,判断保健食品的吸收速度、生物利用度和血浆药物浓度等参数。
5.群体试验:根据大样本人群试验的结果,评价保健食品在人群中的有效性和安全性。
综上所述,保健食品评价试验需要进行化学成分分析、安全性评价、功能评价、消化吸收评价和群体试验等项目。
功能(保健)食品的检验与评价-保健食品注册检验机构的管理

第二阶段 30天喂养试验
结果判断
△ C.若最小观察到有害作用剂量小于或等于人的可能摄入 量的100倍,或观察到毒性反应的最小剂量组其受试物 在饲料中的比例小于或等于10%,且剂量又小于或等于 人的可能摄入量的100倍,原则上应放弃该受试物用于 保健食品。但对某些特殊原料和功能的保健食品,在小 于或等于人的可能摄入量的100倍剂量组,如果个别指 标实验组与对照组出现有生物学意义的差异,要对其各 项试验结果和受试物的配方、理化性质及功能和接触人 群范围等因素综合分析后,决定该受试物可否用于保健 食品或进入下一阶段毒性试验。
c.大于或等于300倍者则不必进行慢性试验, 可进行安全性评价。
第三阶段 代谢试验
目的
了解受试物在体内的吸收、分布 和排泄速度以及蓄积性,寻找可 能的靶器官,为选择慢性毒性试 验的合适动物种系提供依据
第四阶段 慢性毒性(包括致癌)试验
目的
了解经长期接触受试物后出现的毒性作 用以及致癌作用;最后确定最大未观察到 有害作用剂量和致癌的可能性,受试物能 否应用于保健食品的最终评价提供依据。
第二阶段 传统致畸试验 目的
了解受试物对胎儿是否具有致畸作用。
第二阶段 传统致畸试验
结果判断
以LD50或30天喂养实验的最大未观察到有 害作用剂量设计的受试物各剂量组,如果在 任何一个剂量组观察到受试物的致畸作用, 则应放弃该受试物用于保健食品,如果观察 到有胚胎毒性作用,则应进行进一步的繁殖 试验。
第三阶段 90天喂养试验、繁殖试验
保健食品稳定性试验指导原则

保健食品稳定性试验指导原则保健食品注册检验机构应按照国家相关规定和标准等要求,根据样品具体情况,合理地进行稳定性试验设计和研究。
一、基本原则(一)保健食品稳定性试验是指保健食品通过一定程序和方法的试验,考察样品的感官、化学、物理及生物学的变化情况。
(二)通过稳定性试验,考察样品在不同环境条件下(如温度、相对湿度等)的感官、化学、物理及生物学随时间增加其变化程度和规律,从而判断样品包装、贮存条件和保质期内的稳定性。
(三)根据样品特性不同,稳定性试验可采取短期试验、长期试验或加速试验。
1.短期试验:该类样品保质期一般在6个月以内(含6个月),在常温或说明书规定的贮存条件下考察其稳定性。
2.长期试验:该类样品一般保质期为6个月以上,在说明书规定的条件下考察样品稳定性。
3.加速试验:该类样品一般保质期为2年,为缩短考察时间,可在加速条件下进行稳定性试验,在加速条件下考察样品的感官、化学、物理及生物学方面的变化。
二、试验要求(一)样品分类。
1.普通样品。
对贮存条件没有特殊要求的样品,可在常温条件下贮存,如固体类样品(片剂、胶囊剂、颗粒剂、粉剂等);液体类样品(口服液、饮料、酒剂等)。
2.特殊样品。
对贮存条件有特殊要求的样品,如益生菌类、鲜蜂王浆类等。
(二)样品批次、取样和用量。
应符合现行法规,满足稳定性试验的要求。
(三)样品包装及试验放置条件。
稳定性试验的样品所用包装材料、规格和封装条件应与产品质量标准、说明书中的要求一致。
1.普通样品。
加速试验应置于温度37±2℃、相对湿度RH75±5%、避免光线直射的条件下贮存3个月。
短期试验、长期试验应在说明书规定的储存条件下贮存,贮存时间根据产品质量标准及说明书声称的保质期而定。
2.特殊样品。
在说明书规定的贮存条件下贮存。
(四)试验时间。
稳定性试验中应设置多个考察时间点,其考察时间点应根据对样品的性质(感官、理化、生物学)了解及其变化的趋势设定。
保健食品安全性评价及功效成分检测

体内与体外相结合。体细胞和生殖细胞相结合。 Ames实验;骨髓细胞微核实验 (染色体畸变实验)。 精子畸形实验或睾丸染色体畸变分析
30天喂养实验: 传统致畸实验:
2024/2/16
2
亚慢性毒性实验:
90天喂养实验、繁殖实验、代谢实验
慢性毒性实验:包括致癌实验
2024/2/16
况,了解代谢产物的形成,寻找可能的靶器 官,为慢性实验选择动物提供依据。
2024/2/16
8
7)慢性毒性实验: 了解长期接触后出现的毒性作用及致癌 作用,确定最大未观察到有害作用剂量 和致癌的可能性。为受试物是否可用的 最终评价依据
2024/2/16
9
4.结果判定
1)急性毒性实验:
LD50>人体剂量的100倍 未出现死亡剂量>10g/kgBW9(涵人体剂量的100倍) 最大耐受剂量未出现死亡 进行下一步实验
又有资料证明质量与国外一致的。(如第1、2阶段实验结
果与国外一致,既不需进行进一步的毒性实验否则既应进
行)
D)需要进行三阶段毒性实验的
非普通食品(含药食同源)且在卫生部51号文件容许作为
保健食品原料以外的,仅在国外少数地区或国内局部地区
有食用历史。(必要时做四阶段)
2024/2/16
5
E)需进行四阶段毒性实验的
5)90天喂养,繁殖实验
国内外部分地域有食用历史的
最大未观察到有害剂量>人体推荐剂量的100倍,可结合其他实 验结果作出安全性评价
最小观察到有害剂量<人体推荐量100倍,或观察到毒性的最小 剂量组在饲料中的比例<10%,且剂量<100倍人体剂量,应放 弃该受试物为保健食品
保健食品安全性毒理学评价

国外少数国家或地区食用的原料或成分
水提取物,大于常规服用量
用水提以外的其它常用工艺生产的,大于常规用量
选择毒理学试验的基本原则
6.需进行一至四阶段毒性试验的原料和成分
国内外均无食用先例
7.敏感指标及敏感试验的保健食品
不同食用人群和(或)不同功能的保健食品
在进行乙醇浓度调整时必须用原酒基
样品的预处理原则
5.膨胀系数较高的受试物
选择可溶性介质 给受试物的方法:灌胃 其最高浓度最大灌胃量时达不到人体推荐量的100倍, 按实际达到的倍数 标明受试物的膨胀系数
样品的预处理原则
6.益生菌等微生物类保健食品
在进行 Ames试验或体外细胞试验时需将受试物灭活。 需浓缩的应采用低温干燥法或由企业提供所需浓度的受试物(附方 法、技术参数)。
急性联合毒性:两种或两种以上的受试物,可能发生拮抗、相
加或协同的联合方式,可以根据一定的公式计算和判定标准来 确定这三种不同的作用。
急性经口毒性试验
时间周期:一般为3周
3-5天,大、小鼠适应期
7-14天,染毒及实验观察期 发生动物死亡时,应进行大体解剖 观察和评价指标: 毒性反应症状:各器官系统的反常表现(中枢、自主神经、呼 吸、心血管、胃肠、生殖泌尿系统、皮毛、粘膜等)及体重变 化 死亡情况:死亡的时间、数量、性别、表现等。
新原料安全性毒理学试验项目的选择
⑤ 已知化学物: ⑤-1 可只做二阶段实验的包括 已有权威机构进行系统的毒理学安全性评价 有资料证明所用原料与其一致 ⑤-2 如试验结果与权威机构进行的评价不一致, 需进入下阶段的试验
⑥ 有新原料的保健食品: 根据试验结果综合分析。
对受试保健食品的要求
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
保健食品评价试验项目、试验原则及结果判定保健食品评价试验项目、试验原则及结果判定增强免疫力功能1.1 试验项目1.1.1 体重1.1.2 脏器/ 体重比值测定:胸腺/ 体重比值,脾脏/ 体重比值1.1.3 细胞免疫功能测定:小鼠脾淋巴细胞转化实验,迟发型变态反应实验1.1.4 体液免疫功能测定:抗体生成细胞检测,血清溶血素测定1.1.5 单核—巨噬细胞功能测定:小鼠碳廓清实验,小鼠腹腔巨噬细胞吞噬鸡红细胞实验1.1.6 NK 细胞活性测定1.2.1 所列指标均为必做项目。
1.2.2 采用正常或免疫功能低下的模型动物进行实验。
1.3 结果判定增强免疫力功能判定:在细胞免疫功能、体液免疫功能、单核—巨噬细胞功能、NK 细胞活性四个方面任两个方面结果阳性,可判定该受试样品具有增强免疫力功能作用。
其中细胞免疫功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定细胞免疫功能测定结果阳性。
体液免疫功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定体液免疫功能测定结果阳性。
单核—巨噬细胞功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定单核—巨噬细胞功能结果阳性。
NK 细胞活性测定实验的一个以上剂量组结果阳性,可判定NK 细胞活性结果阳性。
辅助降血糖功能1.1 试验项目1.1.1 动物实验1.1.1.1 体重1.1.1.2 空腹血糖1.1.1.3 糖耐量1.1.2 人体试食试验1.1.2.1 空腹血糖1.1.2.2 餐后1 小时血糖1.1.2.3 尿糖2.1 试验原则2.1.1 动物实验和人体试食试验所列指标均为必做项目。
2.1.2 除对高血糖模型动物进行所列指标的检测外,应进行受试样品对正常动物空腹血糖影响的观察。
2.1.3 人体试食试验应在临床治疗的基础上进行。
2.1.4 应对临床症状和体征进行观察。
2.1.5 在进行人体试食试验时,应对受试样品的食用安全性作进一步的观察。
3.1 结果判定3.1.1 动物实验:空腹血糖和糖耐量二项指标中一项指标阳性,且对正常动物空腹血糖无影响,即可判定该受试样品辅助降血糖功能动物实验结果阳性。
3.1.2 人体试食试验:空腹血糖、餐后1 个时血糖两项指标中一项指标阳性,可判定该受试样品具有辅助降血糖功能的作用。
提高缺氧耐受力功能1.1 试验项目1.1.1 体重1.1.2 常压耐缺氧实验1.1.3 亚硝酸钠中毒存活实验1.1.4 急性脑缺血性缺氧实验1.2 试验原则所列指标均为必做项目。
2.1 结果判定常压耐缺氧实验、亚硝酸钠中毒存活实验、急性脑缺血性缺氧实验三项实验中任二项实验结果阳性,可判定该受试样品具有提高缺氧耐受力功能的作用。
缓解体力疲劳功能1.1 实验项目1.1.1 动物体重1.1.2 负重游泳实验1.1.3 血乳酸1.1.4 血清尿素1.1.5’肝糖原或肌糖原2.1 试验原则2.1.1 动物实验所列指标均为必做项目。
2.1.2 实验前必须对同批受试样品进行违禁药物的检测。
2.1.3 运动实验与生化指标检测相结合。
3.1 结果判定负重游泳实验结果阳性,血乳酸、血清尿素、肝糖元/肌糖元三项生化指标中任二项指标阳性,可判定该受试样品具有缓解体力疲劳功能的作用。
改善营养性贫血功能1.1 试验项目1.1.1 动物实验1.1.1.1 体重1.1.1.2 血红蛋白1.1.1.3 红细胞内游离原卟啉1.1.2 人体试食试验1.1.2.1 血红蛋白1.1.2.2 血清铁蛋白1.1.2.3 红细胞内游离原卟啉& 血清运铁蛋白饱和度2.1 试验原则2.1.1 动物实验和人体试食试验所列的指标均为必做项目。
2.1.2 针对儿童的人体试食试验,只测血红蛋白和红细胞内游离原卟啉。
2.1.3 在进行人体试食试验时,应对受试样品的食用安全性作进一步的观察。
3.1 结果判定3.1.1 动物实验:血红蛋白和红细胞内游离原卟啉二项指标阳性,可判定该受试样品改善养性贫血功能动物实验结果阳性。
3.1.2 人体试食试验3.1.2.1 针对改善儿童营养性贫血功能的,血红蛋白、红细胞内游离原卟啉两项指标阳性,可判定该受试样品具有改善营养性贫血功能作用。
3.1.2.2 针对改善成人营养性贫血功能的,血红蛋白指标阳性,血清铁蛋白、红细胞内游离原卟啉’血清运铁蛋白饱和度二项指标一项指标阳性,可判定该受试样品具有改善营养性贫血功能作用。
对化学性肝损伤有辅助保护功能1.1 试验项目动物实验分为方案一(四氯化碳肝损伤模型)和方案二(酒精肝损伤模型)两种。
1.1.1 方案一(四氯化碳肝损伤模型)1.1.1.1 谷丙转氨酶(ALT)1.1.1.2 谷草转氨酶(AST)1.1.1.3- 肝组织病理学检查1.1.2 方案二(酒精肝损伤模型)1.1.2.1. 体重1.1.2.2 丙二醛(MDA))1.1.2.3 还原型谷胱甘肽(GSH)1.1.2.4- 甘油三酯(TG)1.1.2.5 肝组织病理学检查2.1 试验原则2.1.1 所列指标均为必做项目。
2.1.2 根据受试样品作用原理的不同,方案一和方案二任选其一进行动物实验。
3.1 结果判定方案一(四氯化碳肝损伤模型):病理结果阳性,谷丙转氨酶和谷草转氨酶二指标中任一项指标阳性,可判定该受试样品具有对化学性肝损伤有辅助保护功能作用。
方案二(酒精肝损伤模型):1,肝脏MDA、GSH、TG 三项指标结果阳性,可判定该受试样品对乙醇引起的肝损伤有辅助保护功能,2,肝脏MDA、GSH、TG 三指标中任二项指标阳性,且肝脏病理结果阳性,可判定该受试样品具有对乙醇引起的肝损伤有辅助保护功能作用促进消化功能1.1 试验项目1.1.1 动物实验1.1.1.1 体重、体重增重、摄食量和食物利用率1.1.1.2 小肠运动实验1.1.1.3 消化酶测定1.1.2 人体试食试验1.1.2.1 儿童方案1.1.2.1.1 食欲1.1.2.1.2 食量1.1.2.1.3 偏食状况1.1.2.1.4 体重1.1.2.1.5 血红蛋白含量1.1.2.2 成人方案1.1.2.2.1 临床症状观察1.1.2.2.2 胃’肠运动实验2.1 试验原则2.1.1 动物实验和人体试食试验所列指标均为必做项目。
2.1.2 根据受试样品的适用人群特点在人体试食试验方案中任选其一。
2.1.3 在进行人体试食试验时,应对受试样品的食用安全性作进一步的观察。
3.1 结果判定3.1.1 动物实验:动物体重、体重增重、摄食量、食物利用率,小肠运动实验和消化酶测定三方面中任二方面实验结果阳性,可判定该受试样品促进消化功能动物实验结果阳性。
3.1.2 人体试食试验3.1.2.1 针对改善儿童消化功能的,食欲、进食量、偏食改善结果阳性,体重和血红蛋白二项指标中任一项指标结果阳性,可判定该受试样品具有促进消化功能的作用。
3.1.2.2 针对改善成人消化功能的,临床症状明显改善,胃’肠运动实验结果阳性,可判定该受试样品具有促进消化功能的作用。
辅助降血脂功能功能1.1 试验项目1.1.1 动物实验1.1.1.1 体重1.1.1.2 血清总胆固醇1.1.1.3 甘油三酯1.1.1.4 高密度脂蛋白胆固醇1.1.2 人体试食试验1.1.2.1 血清总胆固醇1.1.2.1 甘油三酯1.1.2.1 高密度脂蛋白胆固醇2.1 试验原则:2.1.1 动物实验和人体试食试验所列指标均为必测项目。
2.1.2 动物实验选用脂代谢紊乱模型法,预防性或治疗性任选一种。
2.1.3 在进行人体试食试验时,应对受试样品的食用安全性作进一步的观察。
3.1 结果判定3.1.1 动物实验:3.1.1.1 辅助降血脂功能结果判定:在血清总胆固醇、甘油三酯、高密度脂蛋白胆固醇三项指标检测中血清总胆固醇和甘油三酯二项指标阳性,可判定该受试样品辅助降血脂功能动物实验结果阳性。
3.1.1.2 辅助降低甘油三酯结果判定:!甘油三酯二个剂量组结果阳性;"甘油三酯一个剂量组结果阳性,同时高密度脂蛋白胆固醇结果阳性,可判定该受试样品辅助降低甘油三酯动物实验结果阳性。
3.1.1.3 辅助降低血清总胆固醇结果判定:血清总胆固醇二个剂量组结果阳性;"血清总胆固醇一个剂量组结果阳性,同时高密度脂蛋白胆固醇结果阳性,可判定该受试样品辅助降3.1.2 人体试食试验:血清总胆固醇、甘油三酯二项指标阳性,高密度脂蛋白胆固醇不显著低于对照组,可判定该受试样品具有辅助降血脂功能的作用;"血清总胆固醇、甘油三酯二项指标中一项指标阳性,高密度脂蛋白胆固醇不显著低于对照组,可判定该受试样品具有辅助降低血清总胆固醇或辅助降低甘油三酯作用。
辅助降血糖功能1.1 试验项目1.1.1 动物实验1.1.1.1 体重1.1.1.2 空腹血糖1.1.1.3 糖耐量1.1.2 人体试食试验1.1.2.1 空腹血糖1.1.2.1 餐后1 小时血糖1.1.2.2 尿糖2.1 试验原则2.1.1 动物实验和人体试食试验所列指标均为必做项目。
2.1.2 除对高血糖模型动物进行所列指标的检测外,应进行受试样品对正常动物空腹血糖影响的观察。
2.1.3 人体试食试验应在临床治疗的基础上进行。
2.1.3 应对临床症状和体征进行观察。
3.1 结果判定3.1.1 动物实验:空腹血糖和糖耐量二项指标中一项指标阳性,且对正常动物空腹血糖无影响,即可判定该受试样品辅助降血糖功能动物实验结果阳性。
3.1.2 人体试食试验:空腹血糖、餐后1 个时血糖两项指标中一项指标阳性,可判定该受试样品具有辅助降血糖功能的作用。
