必修二碱金属卤素
4.1.2碱金属和卤族课件高一上学期化学人教版

置是
AC
A.第三周期 B.第二周期
C.第Ⅳ主族 D.第Ⅴ主族
6.下列各氢化物中,稳定性由强到弱的顺序正确的是( C )
A. AsH3>NH3>PH3 B. PH3>AsH3 >NH3 C. NH3>PH3>AsH3 D. NH3>AsH3 >PH3
元素的非金属性的判断依据
1.根据元素周期表判断:同一主族从上到下非金属性减弱 2.根据元素单质与氢气反应的难易(易~强)
3.根据氢化物的稳定性 (稳定~强) 4.根据元素最高价氧化物的水化物(含氧酸) 的酸性强弱 (强~强) 5.根据置换反应 6、对应阴离子的还原性强弱判断。非金属阴离子还原性越弱, 则元素非金属性越强。
Li
3
Na 11
K
19
Rb 37
Cs 55
原子半径增大 电子层数递增
核电荷数增大
1
2
1
3
1
4
1
5
1
6
相似性: 最外层都有1个电子,都易失电子,化学性质 相似,表现金属性(单质:还原性)。 随着核电荷数递增,原子电子层数递增,原子半径
逐渐增大,原子核对最外层电子的引力逐渐减 弱,金属性逐渐增强。
(1实)钠验、现钾象与:O2金的属反钾应被加热后熔成金属小球,并且剧 烈燃烧,发出紫色火焰。生成黄色固体 只是其中一个反应
(2)钠、钾与H20的反应
实验现象: 金属钾浮在水面上, 剧烈反应,听到微弱 的爆鸣声,并且出现 紫色的火光。
比钠剧烈
碱金属与氧气、水反应比较
单质
与O2反应
与水反应
Li
Li2O
剧烈 产生氢气
Na Na2O、Na2O2 更剧烈 产生氢气
K K2O、K2O2、KO2 轻微爆炸
(完整word版)化学:第一章第一节碱金属元素和卤素学案(人教版新课标必修2)
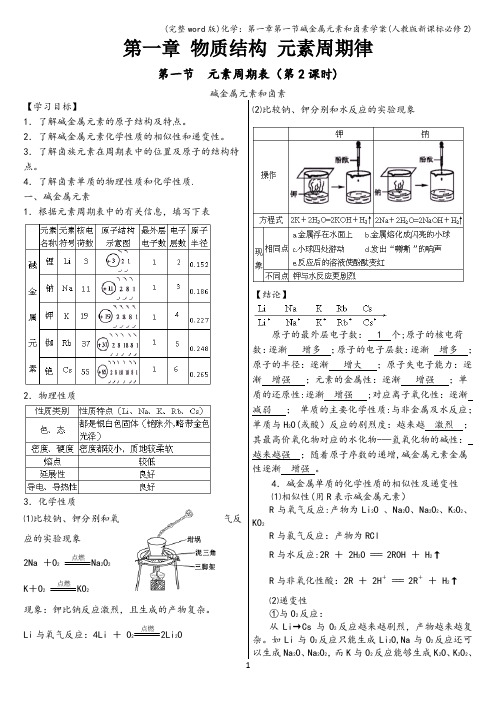
第一章物质结构元素周期律第一节元素周期表(第2课时)碱金属元素和卤素【学习目标】1.了解碱金属元素的原子结构及特点。
2.了解碱金属元素化学性质的相似性和递变性。
3.了解卤族元素在周期表中的位置及原子的结构特点。
4.了解卤素单质的物理性质和化学性质.一、碱金属元素1.根据元素周期表中的有关信息,填写下表2.物理性质3.化学性质⑴比较钠、钾分别和氧气反应的实验现象2Na +O2点燃Na2O2K+O2点燃KO2现象:钾比钠反应激烈,且生成的产物复杂。
Li与氧气反应:4Li + O2点燃2Li2O ⑵比较钠、钾分别和水反应的实验现象【结论】原子的最外层电子数: 1 个;原子的核电荷数:逐渐增多;原子的电子层数:逐渐增多;原子的半径:逐渐增大;原子失电子能力:逐渐增强;元素的金属性:逐渐增强;单质的还原性:逐渐增强 ;对应离子氧化性:逐渐减弱;单质的主要化学性质:与非金属及水反应;单质与H2O(或酸)反应的剧烈度:越来越激烈;其最高价氧化物对应的水化物-—氢氧化物的碱性:越来越强;随着原子序数的递增,碱金属元素金属性逐渐增强。
4.碱金属单质的化学性质的相似性及递变性⑴相似性(用R表示碱金属元素)R与氧气反应:产物为Li2O 、Na2O、Na2O2、K2O2、KO2R与氯气反应:产物为RClR与水反应:2R + 2H2O === 2ROH + H2↑R与非氧化性酸:2R + 2H+=== 2R++ H2↑⑵递变性①与O2反应:从Li→Cs与O2反应越来越剧烈,产物越来越复杂。
如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O、Na2O2,而K与O2反应能够生成K2O、K2O2、KO2等。
②与H2O(或酸)的反应:从Li→Cs,与H2O(或酸)反应越来越剧烈,如K 与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
③最高价氧化物对应水化物的碱性:碱性:LiOH〈NaOH〈KOH<RbOH<CsOH。
高中化学课件必修二《第一章 第一节 元素周期表-碱金属和卤素 课时3》精品课件

Br2 + H2O = HBr + HBrO
Cl2 + H2O = HCl + HClO
(4)卤素单质与金属的反应
3 X2 + 2Fe == 2FeX3
△
△
I2 + Fe == FeI2
(X=F、Cl、Br 但≠I )
4、卤素的递变规律
★从F → I ,元素的非金属性逐渐减弱。
(3)卤素单质与水的反应
2F2 + 2H2O = 4HF + O2 (剧烈反应)
逐渐困难
通式:X2 + H2O = HX + HXO (X=Cl、Br、I 但≠F)
I2 + H2O = HI + HIO
1
1
1
1
1
2
3
4
5
6
+ 3
2 1
+11
2 8 1
+19
2 8 8 1
+37
2 8 18 8 1
+55
2 8 18 18 8 1
[思考]碱金属元素其原子结构有何特点?其原子结构的相似性和递变性会对其性质产生哪些影响?
最外层电子数均为 ,均易 电子,具有强 性;离子具有弱 性
(1)相似性:
(2)递变性:
有颜色,密度小,熔沸点都较低。
阅读教材P8:资料卡片
颜色:
状态:
密度:
熔沸点:逐渐加深气 源自液→固逐渐增大依次增高
★卤素单质性质特殊性:
2、Br2是易挥发的深红棕色液体,是中学阶段唯一一种液态非金属单质,其保存通常加入少量的水,即“液封”;
碱金属 卤素

②与水的反应
2Na + 2H2O = 2NaOH + H2↑ 2K + 2H2O = 2KOH + H2↑
通式:2R +2H2O = 2ROH + H2↑
(2)碱金属元素从上到下(Li 、Na、K、 Rb、Cs),随着核电荷数的增加,碱金属 元素原子的电子层数逐渐 增多 ,原子核 对 最外层电子 的引力逐渐减弱,原子失 电子的能力逐渐 增强 。 元素的 金属性 逐渐 增强 ,与水和氧气 的反应越来越 剧烈 ,生成的氧化物越来 越 复杂 。最高价氧化物对应水化物的碱 性越来越 强 。
结论: 氧化性:Cl2>Br2>I2 还原性:I->Br->Cl-
小 结
卤素原子结构的相似性,决定了单质化学性质的相似性。
与金属反应,生成卤化物。 与氢气反应,生成卤化氢。 与水反应,生成卤化氢和次卤酸。
卤素原子结构的差异性,决定了单质化学性质的差异 性和递变性
与氢反应的能力渐弱 氢化物的稳定性渐弱 与水反应的能力渐弱
卤素单质物理性质的变化规律单质密度熔沸点颜色浅黄绿色黄绿色深红棕色紫黑色状态溶解性卤素与金属的反应br2na2nabr3br生成氢化物的稳定性2hfhf很稳定cl2hclhcl稳定br2hbr较不稳定2hihi很不稳定续加热500光照卤素与氢气的反应或点燃方程式反应条件名称br特例clohclhclo卤素与水的反应溴和水反应比氯气和水更弱而碘和水反应只能微弱的进行实验11将少量新制的饱和氯水分别注入盛有nabr溶液和ki溶液的试管中用力震荡后再注入少量四氯化碳震荡
①相同点:碱金属元素原子结构的 最外层电子数 相同, 都为 1个 。 ②递变性:从Li→Cs,碱金属元素 的原子结构中, 电子层数 增多。 依次
高一复习课件碱金属和卤素

(3)特殊性
① 氟元素只有–1价,没有正价;② 氟单 质与水反应生成氧气;③ 氢氟酸是弱酸, 其余三种为强酸;④ 氟化银溶于水,其 余三种不溶于水也不溶于硝酸;⑤ 氟化 钙不溶于水,其余三种可溶于水;⑥ 液 溴易挥发,固体碘易升华;⑦ 碘单质遇 淀粉溶液显蓝色;⑧ 因为I–的强还原性, 碘与铁形成的化合物只有FeI2。
2、 次氯酸
化学性质: 弱酸性、不稳定性、强氧化性 制法: 工业上制得的漂白粉遇稀酸或空气 中的二氧化碳便可发生复分解反应生成 次氯酸
3、过氧化钠
淡黄色固体,具有强氧化性、漂白性, 与CO2、H2O反应都有氧气放出。
典型实验
1、 氯气的性质、制备实验(装置、操作、现 象等)。对实验现象的描述要准确到位,如 烟、雾、烟雾等现象各是氯气与哪些物质反 应时产生的。 2、 萃取实验。重点是实验现象的描述,对操 作方法要了解。 3、 X2、X–的检验。包括反应原理、检验方法、 实验现象。 4、钠与水的反应。
例7.18世纪70年代,瑞典化学家舍勒在 研究一种白色的盐时发现,在黑暗中此 盐并无气味,而 在光照时开始变黑并 有刺激性气味,此盐是 A.AgF B.AgCl C.AgBr D.AgI
例8.用自来水养金鱼,在将水注入鱼缸之 前,常需把水在阳光下曝晒一段时间, 其目的是( ) A.增加水中含氧量 B.起到杀菌作用 C.使水中的次氯酸分解 D.使水中的硬度减小
(2)递变性
由锂到铯: ① 密度呈增大趋势; ② 熔沸点逐渐降低; ③ 与氧气反应的能力增强,产物更复杂 ④ 与水反应越来越剧烈。
(3)特殊性
① 锂的密度只有0.53g· ─3,不能保存在煤油 cm 里(保存在石蜡中),K的密度比Na略小。 ② 铯略呈金色。 ③ “反应”一般指化学变化,但焰色反应属于物 理变化。 ④ 锂与氧气反应生成的是普通的氧化物。 ⑤ Na等活泼金属与不活泼金属的盐溶液反应时, 不能置换出不活泼金属,而是置换出水中的氢。
高中化学(碱金属、卤素等)课件

碱金属 / 第二章 碱金属
二、碱金属--
2.6 碳酸钠 & 碳酸氢钠
物理性质: 碳酸钠,俗名纯碱、苏打,白色、易溶于水,含10个结晶水的固体, 在空气中易失去结晶水,颜色发暗、碎裂成粉末,即无水碳酸钠; 碳酸氢钠:是酸式盐,俗名小苏打,比碳酸钠更易溶于水(酸式碳 酸盐比碳酸盐更易溶于水)。 化学性质:碳酸氢钠不稳定,受热易分解出CO2;可以与酸反应。 ① 与酸反应:放出CO2。
2.7 侯氏联合制碱法 (1)传统制碱法: 1862年,比利时人索尔维发明制取
碳酸钠的氨碱法,使用食盐、氨和二氧化碳。
NaCl + NH3 + H2O + CO2 = NaHCO3↓+NH4Cl 2NaHCO3 = Na2CO3 + H2O + CO2 ↑ 索尔维制碱法:食盐利用率低,成本高,废渣、废液多。
化学
(第二讲)
二零零九年五月
第一册 目录
绪言 化学——人类进步的关键 第一章 化学反应及其能量变化
氧化还原反应 离子反应 能量变化
第二章 碱金属
钠 钠的化合物 碱金属元素
第三章 物质的量
物质的量 气体摩尔体积 物质的量浓度
第四章 非金属 氢和水 卤素
目录
说明:本次课所讲内容,以红色字体表示。
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ NaHCO3 + 2HCl == NaCl + H2O + CO2 ↑ ② 碳酸氢钠热分解:生成碳酸钠,放出CO2(鉴别二者的方法) 2NaHCO3 == Na2CO3 +H2O + CO2 ↑
碱金属 / 第二章 碱金属
2018-2019学年高中化学 专题03 碱金属和卤族元素(知识讲解)(含解析)
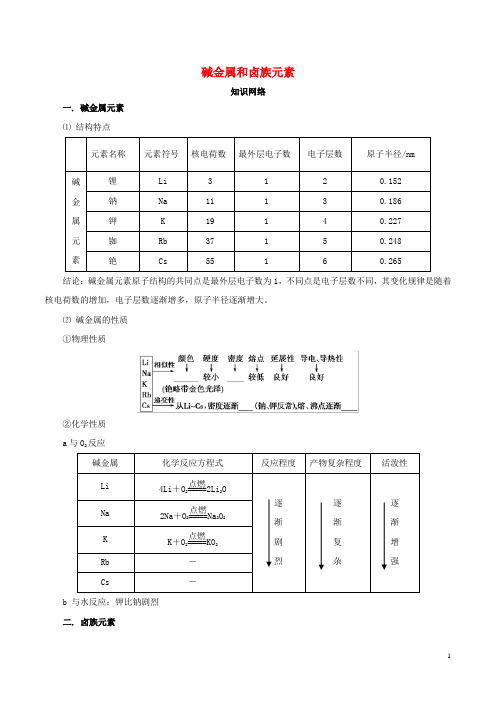
碱金属和卤族元素知识网络一. 碱金属元素 ⑴ 结构特点元素名称元素符号 核电荷数 最外层电子数电子层数原子半径/nm 碱金属 元素锂 Li 3 1 2 0.152 钠 Na 11 1 3 0.186 钾 K 19 1 4 0.227 铷 Rb 37 1 5 0.248 铯Cs55160.265结论:碱金属元素原子结构的共同点是最外层电子数为1,不同点是电子层数不同,其变化规律是随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
⑵ 碱金属的性质 ①物理性质②化学性质 a 与O 2反应碱金属 化学反应方程式 反应程度产物复杂程度活泼性Li 4Li +O 2=====点燃2Li 2O 逐 渐 剧 烈逐 渐 复 杂逐 渐 增 强Na 2Na +O 2=====点燃Na 2O 2 K K +O 2=====点燃KO 2Rb - Cs-b 与水反应:钾比钠剧烈 二. 卤族元素⑴原子结构元素名称 氟(F) 氯(Cl) 溴(Br) 碘(I) 原子序数 9 17 35 53 最外层电子数 7 7 7 7 电子层数2345结论:卤族元素原子结构的共同点是最外层电子数为7,不同点是电子层数不同,其变化规律是随着原子序数增大,电子层数逐渐增多,原子半径逐渐增大。
⑵ 卤族元素单质的性质 ①物理性质F 2 Cl 2 Br 2 I 2颜色: ———————————————————→浅黄绿色 黄绿色 深红棕色 紫黑色颜色变深 熔、沸点:———————————————————→ 气体 气体 液体 固体 逐渐升高 密度:———————————————————→ 逐渐 增大 水溶性:———————————————————→反应 溶解 溶解 微溶 逐渐减小 ②化学性质 a 与H 2反应反应条件 化学方程式 产物稳定性 F 2 无 H 2+F 2=2HF 最稳定 Cl 2 光或点燃 H 2+Cl 2=2HCl 稳定 Br 2 加热 H 2+Br 2=2HBr 较稳定I 2加热H 2+I 22HI 较不稳定,可逆结论:从F 2到I 2,与H 2反应所需要的条件逐渐升高,反应剧烈程度依次减弱,生成气态氢化物的稳定性依次减弱。
人教版化学必修2 1.1.3 卤族元素

单质沸点升高,碘为固态
卤族元素
第 17 页
2、下列不能说明氯元素的非金属性比硫元素强的事实是(A )
①HCl比H2S稳定 氢化物稳定,非金属性强 能说明
化学 · 必修2
卤族元素
卤族元素
第2 页
碱金属元素的原子结构和性质递变规律
电子 原子 原子失电子 元素的 单质的 最高价氧化
Li 层数 半径
能力
金属性 还原性 物对应水化
物的碱性
增增 多大
渐 增
渐 增
增 强
渐 增
Fr
卤族元素
第3 页
下列关于碱金属的叙述中,不正确的是 ( B )
A.随着原子序数的增加,元素的金属性逐渐增强 B.随着原子序数的减小,单质的还原性逐渐增强
C.熔点高的也是相对原子质量最小的
D.密度最小的也是金属性最弱的
卤族元素
F2 Br2
第4 页
I2
卤族元素
第5 页
1.卤素单质的物理性质
单质 F2 Cl2 Br2 I2
颜色、状态 密度 熔点/℃ 沸点/℃
淡黄绿色
气体 黄绿色
颜 色
气体 逐
1.69
g/L 密 3.124 度 g/L 逐
-219.6
第 19 页
1.基于原子得电子难易或周期表位置进行理论说明
2.基于元素最高价氧化物对应水化物酸性强弱、气态氢化物稳 定性等经验性判断 3.基于单质氧化性强弱进行实验验证
核电荷数递增 得电子变易 不同点
碱金属和卤族元素

I +53 2 8 1818 7
分析卤族元素的原子结构,试推测一下
F、Cl、Br、I在化学性质上表现的相似性和递变性?
2、化学性质:
(1)与H2的反应
H2+F2=2HF 暗处反应爆炸;HF很稳定 H2+Cl2=2HCl 光照或点燃;HCl较稳定 H2+Br2=2HBr 加热500℃;HBr不稳定 H2+I2 2HI 需不断加热;HI同时分解
Cl2
Br2
I2
无 黄绿色 深红棕色 紫黑色
水 浅黄绿色
橙黄色 棕黄色
苯或汽油(上层) CCl4(下层) 黄绿色
橙红色
紫红色
【课堂检测】
1.氟、氯、溴、碘四种元素,它们的下列性质不符合 递变规律的是( D)
A、单质的密度依次增大 B、单质的熔、沸点依次升高 C、Cl2可从KBr溶液中还原出Br2 D、F2不可从NaCl溶液中还原出Cl2
加
增
深 4.93g/cm3大
-219.6 熔 -101 点
逐 7.2 渐
升 113.5 高
-188.1 沸 -34.6 点
逐 58.78 渐
升 184.4 高
1、卤族元素的原子结构及特点
1
( 氟(F)
)
卤
族 元
氯(Cl)
素
原
子 溴(Br)
结
构
示 碘(I)
意
图
F +9 2 7
Cl +17 2 8 7
Cs
外)
二、.卤族元素
F2
Br2
I2
阅读P8资料卡片,总结卤素单质物理性质的递变规律。
碱金属和卤族元素

不同现 后熔化并燃烧,火焰呈黄色 先熔化并燃烧,火焰呈紫色 象
产物 结论 Na2O2 更复杂的氧化物(KO2) ①K与Na都能与氧气发生反应; ②K比Na反应更加剧烈,金属性:K>Na
从实验中可获得的其他信息: ①K的保存(密度)②K的熔点(比Na更低) ③碱金属与氧气反应的产物越来越复杂 (写出Li在氧气中点燃的方程式)
0.534 0.97 0.86 1.532 1.879
180.5 97.81 63.65 38.89 28.40
1347 882.9 774 688 678.4
铯
Cs
55
提取信息:碱金属在物性哪些相似点,不同之处有什么规律?
相似性:色(铯略带金色)、软、轻、 低、导 递变性(从上到下):ρ增大 (K与Na反常); 熔、沸点降低。
二、卤族元素 Ⅶ A族 1、原子结构: 结构
最外层7个电子 核电荷数递增
F
+9 2 7
Cl
+17 2 8 7
Br
+35 2 8 18 7
+53
I
2 8 18 18 7
决定
性质
易得一个电子,具氧化性 原子核对外来电子的引力减弱
得电子能力(非金属性)减弱 单质氧化性逐渐减弱 氧化性:F2 > Cl2 > Br2 > I2
化学方程 2Na+2H2O=2NaOH+H2↑ 2K+2H2O=2KOH+H2↑ 式
思考:为了保证结论的准确性,还需补充哪些实验? 如果是Li、Rb、Cs与水反应,现象又会如何? 试写出反应的化学方程式。
3、碱金属元素性质小结
人教版高中化学精品系列 必修二 碱金属元素和卤素 课件

难 反应,生成氢化物越来越不稳定 。
【应用:元素非金属性强弱判断依据】
比较元素非金属性强弱,其实质是看元素 原子得电子的难易,越容易得电子,非金属性 越强,反之非金属性越弱(方法3种) (1)非金属单质与氢气化合的难易程度;形成 气态氢化物的稳定性;氢化物稳定性越强,非 金属性越强; (2)最高价氧化物对应水化物酸性强弱; (3)单质间的置换反应。
【简单记忆】
同主族金属,最外层电子数相同,从上到 下,电子层数增多,半径增大。 从上到下
失电子能力增强,还原性增强,越活泼。
(金属性强,还原性强,失电子能力强)
VIIA族——卤族元素
(简称卤素)
【学与问】
卤素原子结构示意图:
交流· 探究:卤素在化学性质上的相似性和递变性?
【卤素原子结构特点】 (1)相似性:
【碱金属单质物理性质】
元 素 名 称 锂 钠 钾 铷 铯 元 素 符 号 Li Na K Rb Cs 颜色 核 电 和 荷 状态 数 3 银白色,柔软 11 银白色,柔软 19 银白色,柔软 37 银白色,柔软 55 略带金色光泽, 柔软
密度 熔点 g· cm-3 ℃ 0.534 0.97 0.86 1.532 1.879
最外层电子数均为 7 ,均易 得到 电子, 化合价 降低 ,被 还电荷数的递增,电子层数渐 增多 , 原子半径逐渐 增大 。
【卤素单质化学性质】
金属越容易失去电子,越活泼,还原性 越强,反应越剧烈。那么非金属呢?
由F到I,非金属性逐渐
减弱
。
化学反应越来越 剧烈
随着核电荷数的递增,电子层数逐渐 增多, 原子半径逐渐 增大 ,越来越容易失去电子。
【碱金属元素原子结构特点】
碱金属、卤素

金属(jiǎn jīn shǔ)是元素周期表中第IA族元素锂、钠、钾、铷、铯、钫六种金属元素的统称,也是它们对应单质的统称。
(钫因为是放射性元素所以通常不予考虑)因它们的氢氧化物都易溶于水(除LiOH溶解度稍小外),且呈强碱性,故此命名为碱金属。
氢虽然是第IA族元素,但它在普通状况下是双原子气体,不会呈金属状态。
只有在极端情况下(1.4兆大压力),电子可在不同氢原子之间流动,变成金属氢。
碱金属盐类溶解性的最大特点是易溶性,它们的盐类大都易溶于水。
已知LiF,Li2CO3,Li3PO4及固体Li2SiO3是难溶(微溶)的,少数大的阴离子的碱金属盐也是难溶的,如Na2C2H5N4O3(脲酸钠)、Na[Sb(OH)6](六羟基合锑酸钠)、K2PtCl6(氯铂酸钾)、KClO4(高氯酸钾)、KHC4H4O6(酒石酸氢钾)等。
它们在溶液中完全电离。
碱金属都是银白色的(铯略带金黄色),比较软的金属,密度比较小,熔点和沸点都比较低。
他们生成化合物时都是正一价阳离子,碱金属原子失去电子变为离子时最外层一般是8个电子,但锂离子最外层只有2个电子。
在古代埃及把天然的碳酸钠叫做neter或nitrum,在洗涤时使用。
14世纪时,阿拉伯人称植物的灰烬为kali,逐渐演变到叫做碱,但这时钠和钾的区别还不清楚,统称为苏打(soda)。
一直到18世纪才分清从食盐得到的泡碱和从植物灰得到的钾碱不是同一种东西。
碱金属都能和水发生激烈的反应,生成强碱性的氢氧化物,随原子量增大反应能力越强。
在氢气中,碱金属都生成白色粉末状的氢化物。
碱金属都可在氯气中燃烧,而碱金属中只有锂能在常温下与氮气反应。
由于碱金属化学性质都很活泼,为了防止与空气中的水发生反应,一般将他们放在煤油或石蜡中保存。
碱金属都是活泼金属。
碱金属单质以金属键相结合。
因原子体积较大,只有一个电子参加成键,所以在固体中原子间相互作用较弱。
碱金属的熔点和沸点都较低,硬度较小(如钠和钾可用小刀切割)。
碱金属卤素递变规律

二、卤族元素性质的递变规律1.卤素单质的物理性质氟、氯、溴、碘单质的颜色逐渐加深,密度逐渐加大,熔沸点逐渐升高,水溶性逐渐减小(氯除外)。
2.卤素的化学性质按氯、氯、溴、碘的顺序,元素的非金属性,单质的氧化性、与氢化合的能力、与水反应的程度均逐渐减弱。
(1)与金属反应:氟(F2)可以与所有的金属反应;氯(Cl2)可以与绝大多数金属反应;溴、碘也可以与大多数金属反应。
例如:2Fe+3Cl2== 2FeCl3而Fe+I2 == FeI2(2)与氢气反应:反应条件由易到难;反应程度由剧烈变为缓慢;卤化氢的稳定性逐渐减弱。
(3)与水反应:氟特殊,氯、溴、碘相似。
反应的剧烈程度逐渐减弱。
(4)卤素单质间的置换反应Cl2 + 2Br-= 2Cl-+ Br2氧化性:Cl2 > Br2 还原性: Br-> Cl-Cl2 + 2I-= 2Cl-+ I2氧化性:Cl2 > I2 还原性: I- > Cl-Br2 + 2I-= 2Br-+ I2氧化性:Br2 > I2 还原性: I- > Br-结论:单质氧化性:F2>CI2>Br2>I2离子还原性:F-<CI-<Br-<I-3.卤化氢的性质氢卤酸的酸性其中氢氟酸为弱酸。
、卤化氢的还原性按HF、HCl、HBr、HI的顺序依次增强,其稳定性依次减弱,4.氯的含氧酸次氯酸(HClO):仅存于溶液中,具有不稳定性,强氧化性。
其酸性比碳酸还弱。
其盐类中,次氯酸钙[Ca(ClO)2]是漂白粉中的有效成分。
高氯酸(HClO4):是已知酸中酸性最强的一种酸。
LI NA K Rb Cs 熔沸点依次降低。
1.相似性:最外层电子数为12.递变性:1.电子层数逐渐增多;2.熔点逐渐降低;3.沸点逐渐降低;4.密度呈增大趋势(但NA>K);5.金属性逐渐增强。
3.碱金属元素的主要化学性质:1.与氧气反应。
都可以与氧气反应,但Li的燃烧产物为普通氧化物Li2O,而Na的燃烧产物为过氧化物Na2O2,K,Rb,Cs的燃烧产物更复杂。
碱金属元素和卤素

的 能
性 增
Na
力强K
逐
渐 Rb
增
强 Cs
Fr
最 外
原子F
层半
的 C径l
吸逐
引B渐r
力增
逐 大I
渐,
减 A原t
小子
核
对
.
得
非电
金子
属 性
的 能 力
减逐
弱渐
减
弱
29
练习1:砹(At)是卤族元素中位于碘后面的元素,试推 测砹和砹的化合物最不可能具备性质 ( B ) A.砹易溶于某些有机溶剂 B.砹化氢很稳定不易分解 C.砹是有色固体 D.砹化银不溶于水或稀HNO3
LiOH< NaOH < KOH < RbOH < CsOH
.
7
③与酸反应
相似性:均比与水反应剧烈,均是先与酸反应, 酸不足时,把酸反应完再与水反应
2R+2H+=2R++ H2↑ 递变性:反应越来越剧烈
④与盐溶液反应 先与水反应,产生的碱再与盐溶液反应
即,水溶液中均不可置换出金属单质
特殊反应:
熔融 Na+KCl====NaCl+ K↑
F2+ 2H2O=4HF+O2 HF+NaOH=NaF+H2O
(6)卤素单质和一些还原剂反应
还原性:S2->SO32->I->Fe2+>Br->Cl->F-
X2 + SO2 + 2H2O=H2SO4 + 2HX(X=Cl、Br、I)
.
24
卤族元素从上到下(从F到I),随着核电
荷数的增加,原子的电子层数逐渐
人教版化学必修二112碱金属and卤族元素课件共26张

☆☆☆元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的
难易程度。置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱
性强弱 。碱性越强,则原金属元素的金属性
越强。
已知NaOH为强碱、 Mg(OH) 2 为中强碱、 Al(OH) 3为两性氢氧
Br 2
高温
H 2+Br 2======2HBr
HCl 稳定 较不稳定
I2
高温、持
H2+I 2======2HI
HI 很不稳定
续加热
卤素与水的反应
反
应
2F2+2H2O=====4HF +O2 (特例) 越
来
Cl2 +H2O=====HCl +HClO
越
Br2+ H2O=====HBr +HBrO
难 以
②与水的反应
2Na + 2H 2O = 2NaOH + H 2↑ 2K + 2H2O = 2KOH + H 2↑
通式: 2R +2H 2O = 2ROH + H2↑
(2)碱金属元素从上到下( Li 、Na、K、
Rb 、Cs),随着核电荷数的增加,碱金
属元素原子的电子层数逐渐增多 ,原子
核对最外层电子 的引力逐渐减弱,原子
元素的性质主要取决于原子的 最外 层电子数 ,从碱金属原子的结构可推知
其化学性质如何?是否完全相同?
最外层上都只有一个电子,化学反应 中易失去一个电子,表现还原性,形成 +1 价的阳离子,并 能与氧气等非金属元 素及水发生化学反应。
钠、钾化学性质比较 →P6
钠
与氧气 剧烈燃烧,火焰呈
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5.已知钡的活动性介于钠和钾之间,下列叙述正确的是 ( ) A.钡与水反应不如钠与水反应剧烈 B.钡可以从KCl溶液中置换出钾 C.氧化性:K+>Ba2+>Na+ D.碱性:KOH>Ba(OH)2>NaOH
[解析]
A中由于钡的活动性比钠强,所以钡与水反应比钠
与水反应更剧烈,故A错;B中钡的活动性不如钾且先与水发生 反应,故不能置换出钾,故B错;C中由于金属性: K>Ba>Na,故氧化性为Na+>Ba2+>K+,故C错;D中元素的金 属性越强,其对应的最高价氧化物的水化物的碱性越强,故 KOH>Ba(OH)2>NaOH,D项说法正确。
【正确解答】 BC
误区警示
碱金属元素的性质具有相似性,同时,元素周期表中主族 元素从上到下性质有一定递变规律,把握这两点,结合学过的 有关碱金属及其化合物的性质,问题即可迎刃而解。
金属钫(Fr)具有放射性,它是碱金属元素中最重的元素, 根据在周期表中的位置预言其性质,其中不正确的是( A.在已知金属元素中它具有最大的原子半径 B.在空气中燃烧时,只生成分子式为Fr2O的氧化物 C.氧化物的水化物的化学式为FrOH,它应是极强的碱 D.能与水反应生成氢气 )
例1 下列对碱金属性质的叙述中正确的是(
)
A.都是银白色的柔软金属(除铯外),密度都小于水 B.单质的熔沸点随原子序数的增加而升高 C.原子半径随核电荷数的增大而增大 D.还原能力最强的是钠原子
【解析】
A选项中密度均比水小不正确,铷、铯的密度
比水大。碱金属单质的熔沸点随着原子序数的增加而逐渐降 低,B不正确。还原能力最强的是铯原子,D不正确。
+ +
Cu<Fe。
例2 ( )
下列叙述中肯定能说明金属A比金属B活泼性强的是
A.A原子最外层电子数比B原子的最外层电子数少 B.A原子电子层数比B原子的电子层数多 C.1 mol A从酸中置换生成的H2比1 mol B从酸中置换生成 的H2多 D.常温时,A能从酸中置换出氢,而B不能
【解析】
比较金属的活泼性强弱时应根据失去电子的难
②化学反应方程式(按K、Na顺序书写)
2K+2H2O===2KOH+H2↑ ________________________________ ;
2Na+2H2O===2NaOH+H2↑ ________________________________ 。
③结论 与水反应的剧烈程度:K>Na;金属活泼性:K>Na。
3.碱金属的原子结构与化学性质的递变规律
增多→原子 从Li→Cs,随核电荷数增加,电子层数逐渐______ 减弱 →元素 增大 →原子核对最外层电子引力逐渐______ 半径逐渐______ 增强 。 金属性逐渐_______
问题探究2:根据碱金属元素性质的递变性比较:锂与水反 应、钠与水反应、钾与水反应的剧烈程度。
【错因分析】
根据碱金属元素的原子结构示意图,可以
看出碱金属原子最外层都只有一个电子,原子半径逐渐增大, 在化学反应中容易失去一个电子表现出强还原性;它们与水反 应的剧烈程度逐渐增强;根据碱金属的物理性质变化规律,碱 金属单质的密度钾比钠密度小,是特殊性。有同学认为B选项 对,只选C;而K以后的碱金属有可能生成KO2或KO3,有同学 只选B不选C。金属锂在氧气中燃烧生成普通氧化物:4Li+ 点燃 O2=====2Li2O。
+ +
(5)碱金属元素的最高价氧化物对应水化物中只有LiOH微 溶,其他均为易溶于水的强碱。 (6)碱金属元素从Li→Cs,密度逐渐增大,但K的密度小于 Na。
下列关于碱金属元素的原子结构和性质的叙述正确的是 ( ) A.碱金属元素原子的最外层都只有1个电子,在化学反应 中容易失去 B.碱金属单质都是强还原剂 C.碱金属单质都能在氧气中燃烧生成过氧化物 D.碱金属单质都能与水反应生成碱
【答数】 B
易错盘点
(对应学生用书P6)
易错点
相似性与递变性理解不清而致错
典例下列关于碱金属按Li、Na、K、Rb、Cs的顺序叙述中 不正确的是( )
A.碱金属元素原子最外层都只有一个电子,在化学反应 中容易失去电子表现出强还原性 B.单质的密度依次增大
C.单质都能与水反应生成碱,都能在空气中燃烧生成过 氧化物 D.原子半径逐渐增大,单质与水反应的剧烈程度逐渐增 强 【错解】 B或C
【答案】 C
要点二
元素金属性强弱的比较
判断元素金属性强弱,根本依据是元素原子失去电子的能 力,金属越易失去电子,则其金属性越强,反之亦然。 1.从元素原子结构(或元素周期表)判断 (1)当最外层电子数相同时,电子层数越多,原子半径越 大,越易失电子,金属性越强。 即:同一主族,自上至下,元素金属性逐渐增强。
【答案】 C
方法指导
在分析碱金属元素单质及其化合物有关题目时,既要注意 应用碱金属元素的相似性、递变性,还要注意其个体差异。 (1)Na、K通常保存在煤油中,Li通常用石蜡密封。 (2)碱金属还原性最强的是Cs,还原性最弱的是Li。 (3)碱金属阳离子氧化性最弱的是Cs ,最强的是Li 。 (4)碱金属元素只有Li与O2反应的产物为Li2O一种,其他元 素与O2反应的产物至少有两种。
[答案] C钾与水反应时要放出热 量;④钾与水反应后溶液呈碱性。某学生将一小块金属钾投入 滴有酚酞试液的水中,实验能证明上述四点性质中的( A.①④
[答案] D
)
B.①②④
C.①③④
D.①②③④
3.按Li、Na、K、Rb、Cs的顺序,下列性质逐渐减弱(或 降低)的是( ) B.元素的金属性 D.单质的熔点
提示:从Li→K,元素失电子能力逐渐增强,其单质的化 学性质越来越活泼,钾与水反应比钠与水反应剧烈,钠与水反 应比锂与水反应剧烈。
要点一
碱金属单质的化学性质的相似性及递变性
1.相似性(用R表示碱金属元素)
2.递变性
(1)与O2反应 从Li→Cs,与O2反应越来越剧烈,产物越来越复杂。 如Li与O2反应只能生成Li2O,Na与O2反应还可以生成 Na2O2,而K与O2反应能够生成KO2等。
【解析】
碱金属元素原子的最外层都有1个电子,在反应
中易失去这个电子,表现为强还原性,故A、B两项正确;金属 Li在氧气中生成Li2O,金属Na燃烧生成Na2O2,金属K、Rb、 Cs燃烧生成更复杂的氧化物,故C项不正确;碱金属单质与 H2O的反应都可表示为2R+2H2O===2ROH+H2↑,故D项正 确。
A.单质的还原性 C.单质的密度
[答案] D
4.钾的金属活动性比钠强,根本原因是( A.钾的密度比钠的小 B.钾原子的电子层数比钠原子多一层 C.钾与水反应比钠与水反应剧烈 D.加热时,钾比钠更易气化
)
[解析] 钾的金属性比钠强的根本原因是原子结构的不 同,钾多一个电子层,比钠活泼,B正确。
[答案] B
(2)与H2O(或酸)的反应 从Li→Cs,与H2O(或酸)反应越来越剧烈,如K与H2O反应 可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。 (3)最高价氧化物对应水化物的碱性 碱性:LiOH<NaOH<KOH<RbOH<CsOH。
特别提醒
Na、K与盐溶液的反应 因Na、K等很活泼的金属易与H2O反应,故当Na、K投入到 盐溶液中时,不是从溶液中置换出相对不活泼的金属,而是先 与水发生反应生成碱与氢气,然后生成的碱再与盐发生复分解 反应(若不符合复分解反应的条件,则只发生金属与水的反应)。
课前提问
• 1、写出过氧化钠与水、二氧化碳反应的化 学方程式(从氧化还原角度分析) • 2、写出下列元素在周期表中的位置H、C、 N、O、F、Na、Mg、Al、Si、P、S、Cl、 Ar、K、Ca
第二课时
元素的性质和原子结构(一)——碱金属元素
目标导航
[学习目标] 1.了解碱金属元素的原子结构及特点。 2.了解碱金属元素化学性质的相似性及递变性。 3.认识碱金属元素化学性质与原子结构特点的关系。
K>Na ;产物的复杂程度: 与O2反应的剧烈程度:_________ K>Na ;金属活泼性:_________ K>Na 。 ________
(2)K、Na与H2O的反应 ①K与H2O反应
金属浮在水面上 a._________________ 金属熔化成闪亮的小球 b.____________________ 酚酞 c.小球四处游动 试液 “嘶嘶”的声音 现d.发出________________ → 象e.反应后的溶液 变红 使酚酞______ f.剧烈程度比钠与 强烈 水的反应______
问题探究1:能将金属锂放在煤油中保存吗?金属钾呢?为 什么?
提示:锂的密度比煤油小,不能放在煤油中,钾可以放在 煤油中。
二、碱金属的性质 1.物理性质 性质类别 色、态 硬度 密度 熔点 性质特点
银白色 固体(铯例外,略带金色光泽 都是________ _________) 柔软 质地较______ 较小 ,从Li→Cs,密度逐渐______ 增大 ______ 较低 ,从Li→Cs,熔点逐渐______ 降低 ______
下列事实不能用于判断金属性强弱的是( A.金属间发生的置换反应
)
B.1 mol 金属单质在反应中失去电子的多少 C.金属元素的最高价氧化物对应水化物的碱性强弱 D.金属元素的单质与水(或酸)反应置换出氢气的难易程度
【解析】
金属单质在反应中失去电子的多少,不能作为
判断金属性强弱的依据,如1 mol Al反应失去的电子比1 mol Mg 多,但Al的金属性比Mg弱,1 mol Na反应失去的电子比1 mol Ca少,但Ca的金属性比Na弱。
(2)当电子层数相同时,核电荷数越多越难失电子,金属性 越弱(后面学习)。 即:同一周期,自左至右,元素金属性逐渐减弱。 2.从元素单质及其化合物的相关性质判断 (1)金属单质与水(或酸)反应越剧烈,元素金属性越强。 (2)最高价氧化物对应水化物的碱性越强,元素金属性越 强。
