元素周期表之碱金属和卤素
元素化学——科普向:卤素

At:这是个人工合成的元素…
by pancake
卤素单质:物理性质
常温常压下,F和Cl是气态,溴是易挥发的液体,碘在 常温下是固体,加热状态下不熔化直接升华
从F到I,颜色依次加深 F为浅黄色,Cl为黄绿色,Br为棕色,I为紫色
所有卤素均具有刺激性气味,强烈刺激眼、耳、鼻
气管等黏膜,吸入较多蒸汽时会发生严重中毒,甚
思考
电解制氟时为什么不用KF水溶液?
by pancake
思考:答案
因为氟的化学性质异常活泼,它与水激烈反应: F2+H2O=2HF+O2
by pancake
极化作用
电流通过电池或电解池时,由于电极上发生副作用而改变电极性质称 为极化作用。极化的结果是使电流减弱
by pancake
蒙乃尔合金
又称镍合金,是一种以金属镍为基体添加铜、铁、锰等其它元 素而成的合金。蒙乃尔合金耐腐蚀性好,呈银白色,适合作边丝材料。
by pancake
氯的制备
by pancake
氯的制备:实验室制法
实验室里将氧化剂MnO2、KMnO4与浓盐酸反应制氯气
MnO2 4 HCl MnCl2 2H 2O Cl2 2KMnO4 16 HCl 2 KCl 2MnCl2 8H 2O 5Cl2
第三类是氧化反应,天然物质被辐照而产生自由基或纯态氧(又称 单一氧)等中间体,这些中间体又与化合物作用而生成转化的产物。
此处的光解是指液氧和液氟中的化学键分别断裂又重新形成生成 O2F2的光解反应 by pancake
卤素氧化物:Cl2O
用新制的黄色HgO和Cl2(用干燥空气稀释或溶解在CCl4中)反应 即可制得Cl2O
by pancake
高中化学必修2 第1章 《物质结构 元素周期表》核心知识点

第一章物质结构元素周期表第一节 元素周期表一、周期表原子序数 = 核电荷数 = 质子数 = 核外电子数1、依据横行:电子层数相同元素按原子序数递增从左到右排列纵行:最外层电子数相同的元素按电子层数递增从上向下排列2、结构周期序数=核外电子层数主族序数=最外层电子数短周期(第 1、2、3 周期)周期:7 个(共七个横行)周期表长周期(第 4、5、6、7 周期)主族 7 个:ⅠA -ⅦA族:16 个(共 18 个纵行)副族 7 个:IB-ⅦB第Ⅷ族 1 个(3 个纵行)过渡元素零族(1 个)稀有气体元素二.元素的性质和原子结构(一)碱金属元素:1、原子结构 相似性:最外层电子数相同,都为 1 个递变性:从上到下,随着核电核数的增大,电子层数增多,原子半径增大2、物理性质的相似性和递变性:(1)相似性:银白色固体、硬度小、密度小(轻金属) 熔点低、易导热、导电、有展性。
(2)递变性(从锂到铯):①密度逐渐增大(K 反常)②熔点、沸点逐渐降低结论:碱金属原子结构的相似性和递变性,导致物理性质同样存在相似性和递变性。
3、化学性质(1)相似性:(金属锂只有一种氧化物)4Li + O 2 点燃 Li 2O2Na + O 2 点燃 Na 2O 22 Na + 2H 2O = 2NaOH + H 2↑2K + 2H 2O = 2KOH + H 2↑2R + 2 H 2O = 2 ROH + H 2 ↑产物中,碱金属元素的化合价都为+1价。
结论:碱金属元素原子的最外层上都只有 1 个电子,因此,它们的化学性质相似。
(2)递变性:①与氧气反应越来越容易②与水反应越来越剧烈结论:①金属性逐渐增强②原子结构的递变性导致化学性质的递变性。
总结:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。
所以从Li到Cs的金属性逐渐增强。
元素周期表.

(三)卤素的通性:
1、都能与金属反应生成金属卤化物
Cl2
Fe
FeCl3
FeBr3
Br2
I2
FeI2
(三)卤素的通性:
(3)都能与水反应
特殊:2F2 + 2 H2O =4HF+O2
通式:X2+H2O=HX+HXO (X:Cl、Br、I)
(4)都能与碱反应
X2+2NaOH=NaX+NaXO+H2O
②从上到下,碱金属的密度逐渐增大(钾例外),熔、 沸点逐渐降低,硬度逐渐减小。
(五)元素金属性强弱的判断 1 、根据金属活动顺序表判断。
2 、根据金属单质与水或者与酸 反应置换出氢的难易程度判断。
3、可以根据最高价氧化物对应 的水化物碱性的强弱判断。
二、卤族元素 (一)卤族原子结构 F ①相同点:
(四)元素非金属性强弱的判断 元素
1、元素单质与氢气反应的 难易程度
2、气态氢化物的稳定性强弱
非金
属性
3、可以根据最高价氧化物对
应的水化物酸性的强弱判断。
同主族:元素金属性、非金属性的递变
原因:同一主族的元素中, 各元素的最外层电子数相同, IA ⅦA 由于从上到下电子层数增多, Li F 非 原子半径增大,原子核对外 金 Na Cl 层电子的引力 减弱,失电子 属 能力逐渐增强,得电子能力 K Br 性 逐渐减弱。 Rb I 减 弱 Cs At
浮在水面上、 熔 成银白色、在水 H2O 面上四处 游、滴 入酚酞溶液呈 红 色
(四)碱金属通性
(1)碱金属与与O2的反应
Li只生成Li2O Na有Na2O、Na2O2 K有K2O、K2O2、KO2等
八卦解读元素周期表

八卦解读元素周期表本文选编自《文明的对话》作者:吴见非元素周期表是由俄国科学家门捷列夫绘出。
后人根据这个表格发现了一些新元素。
我发现这个表格俨然就是先天八卦图,两者惊人地吻合。
元素周期表和八卦从左到右的对应氢 1 氦 2 相当于天一地二之数,故氢氦配属乾坤。
碱金属——乾卦碱金属外层电子数为1,化学性质极其活跃。
钠、钾是食盐的主要原料。
锂及其合金是高能燃料,手机上运用高能锂电池。
这族元素对光十分敏感。
乾先天数为1,乾为健,健就是活跃的意思。
人们不吃盐、缺盐身体就没劲。
健代表能量,所以对应高能。
《说卦传》“离为乾卦”,所以对光敏感。
碱土金属——兑卦碱土金属外层电子数为2,代表元素有镁、钙。
钙是骨质的关键。
成人缺钙可引起骨质软化症和骨质疏松症,引起抽搐及凝血功能不全等。
镁、钙是很多酶的激活剂。
镁具有拮抗作用,和钾相互拮抗维持正常的心跳节律。
兑数为2,兑为悦,为毁折,其于地也,为刚卤。
兑卦代表正秋,有肃降收敛之象,因此钙是骨质的关键,成人缺钙则骨质软化、疏松,还能引起抽搐和凝血功能不全。
兑卦为悦,悦意味着诱激作用,所以能作酶的激活剂。
镁的诱激作用和钾的主宰(乾为君)作用相互拮抗,下兑上乾合为履卦,履意味着步调,所以能维持正常的心跳节律。
铝族元素——离卦铝族元素外层电子数为3,代表元素有铝。
铝导电性强,延展性、导热性好。
铝热剂能产生高热。
铝对神经系统、免疫系统的毒性作用,是产生早老性痴呆症、帕金森病的病原学因素。
离数为3,离为丽,为热,为电,有发射、传播的含义。
所以铝的导电性、导热性良好。
离卦代表热能,因而铝热剂高热。
铝能够干扰神经系统等生物电信号的传导,所以有毒性。
碳族元素——震卦碳族元素外层电子数为4,代表元素有碳。
碳的晶体态有金刚石、石墨,金刚石硬度最大。
无定形碳有吸附作用。
碳的同位素对活体含量恒定,死亡后一直衰变,以此可以用于考古测定生物年代。
碳是有机物的基本元素。
震数为4,震为动,代表生命之所出。
03-第一单元 元素周期律和元素周期表-课时3 碱金属元素与卤素 3年9考高中化学必修第一册苏教版

过基础 教材必备知识精练 过能力 学科关键能力构建
第一单元 元素周期律和元素周期表
课时3 碱金属元素与卤素 3年9考
过基础 教材必备知识精练
知识点1 碱金属元素及其相似性与递变性
1.下列有关说法错误的是( C ) A.碱金属元素最外层电子数都是1,化学性质均较活泼 B.碱金属元素从上到下随着电子层数的增多,金属性依次增强 C.碱金属单质都是银白色的,都比较柔软 D.碱金属单质从上到下熔沸点逐渐降低
【解析】 碱金属单质的沸点随着核电荷数的递增而降低,A项错误;碱金属 元素的金属性随着原子序数的递增依次增强,碱金属单质与氧气在加热条 件下可反应,如锂生成Li2O、钠生成Na2O2,B项错误;同主族元素从上到下, 非金属性逐渐减弱,对应气态氢化物的热稳定性逐渐减弱,C项正确;根据F、 Cl、Br、I的非金属性依次减弱,可推出HF、HCl、HBr、HI的还原性依次增 强,D项错误。
气的氧化性大于砹单质,所以砹单质不能从NaCl溶液中置换出氯单质,故
D项错误。
9.甲、乙、丙三种溶液各含有一种X−(X−为Cl−、Br−或I−),向甲中加淀粉
溶液和新制的氯水,溶液变为橙色,再加入丙溶液,溶液颜色无明显变化。 则甲、乙、丙依次含有( B ) A.Br−、Cl−、I− B.Br−、I−、Cl− C.I−、Br−、Cl− D.Cl−、I−、Br− 【解析】 单质氧化性Cl2 > Br2 > I2,而对应阴离子的还原性: I− > Br− > Cl−。碘单质可使淀粉变蓝,溴水颜色为橙色。向甲中加入淀 粉溶液和新制氯水后溶液变为橙色而不是蓝色,说明甲中含有Br−,发生 反应2Br− + Cl2 Br2 + 2Cl−;再加入丙溶液无明显变化,则说明丙溶 液中无I−,丙含Cl−。
元素周期表中各元素介绍

元素周期表中各元素介绍氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是“水素”。
氢是由英国化学家卡文迪许在1766年发现,称之为可燃空气,并证明它在空气中燃烧生成水。
1787年法国化学家拉瓦锡证明氢是一种单质并命名。
氢在地壳中的丰度很高,按原子组成占15.4%,但重量仅占1%。
在宇宙中,氢是最丰富的元素。
在地球上氢主要以化和态存在于水和有机物中。
有三种同位素:氕、氘、氚。
氢在通常条件下为无色、无味的气体;气体分子由双原子组成;熔点-259.14°C,沸点-252.8°C,临界温度33.19K,临界压力12.98大气压,气体密度0.0899克/升;水溶解度21.4厘米?/千克水(0°C),稍溶于有机溶剂。
在常温下,氢比较不活泼,但可用合适的催化剂使之活化。
在高温下,氢是高度活泼的。
除稀有气体元素外,几乎所有的元素都能与氢生成化合物。
非金属元素的氢化物通常称为某化氢,如卤化氢、硫化氢等;金属元素的氢化物称为金属氢化物,如氢化锂、氢化钙等。
氢是重要的工业原料,又是未来的能源。
氦,原子序数2,原子量4.002602,为稀有气体的一种。
元素名来源于希腊文,原意是“太阳”。
1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。
后有人用无机酸处理沥青铀矿时得到一种不活泼气体,1895年英国科学家拉姆赛用光谱证明就是氦。
以后又陆续从其他矿石、空气和天然气中发现了氦。
氦在地壳中的含量极少,在整个宇宙中按质量计占23%,仅次于氢。
氦在空气中的含量为0.0005%。
氦有两种天然同位素:氦3、氦4,自然界中存在的氦基本上全是氦4。
氦在通常情况下为无色、无味的气体;熔点-272.2°C(25个大气压),沸点-268.9°C;密度0.1785克/升,临界温度-267.8°C,临界压力2.26大气压;水中溶解度8.61厘米?/千克水。
《 元素周期表》课件

Cs 略带金属光泽, 1.879 柔软
熔点 /0C 180.5 97.81 63.65 38.89 28.40
沸点 /0C 1347 882.9 774 688 678.4
碱金属元素的性质与结构
相似性
递变性
名称
最外 层电 子数
物理 性质
化学 性质
电子 层数
密度Biblioteka 熔点沸点元素 性质
锂Li 钠Na
钾K 1
大段--入破时,只见吹笛人呼吸盘旋回转,指法粉碎如雨敲窗。再听笛声犹如千军万马撕杀奔吼,又如雨打沙滩辟 罗有声。游徒崾??馕豢腿死氪??ィ?哟瞬恢?侣洹?p>还有一次,李谟因故请假去越州。到了越州后,当地的达官名
素,推测砹或砹的化合物最不可能具有 士或设公宴、或设私宴请他,为的是能亲耳聆听到他吹奏的笛声。当时,正逢越州新有十几位生员考中了进士。这
A、砹化氢HAt很稳定 酒宴开始后,只见湖水澄碧、波光荡漾,芳草修林,景物非凡。李谟以手拂笛,立于船边。在桨声中,舟船渐
移湖心。此时轻云笼湖,微风拂浪,波澜陡起。李谟捧笛吹奏,笛声初发,风云齐开,水明林秀,上下澄碧,仿佛 如有鬼神之工使之如此!船上的宾客都赞叹不已,纷纷说:“就是敬天的神乐也没有这么大的神力啊!”独孤丈一言未 发。与会的人都脸现不快。李谟也认为这个老丈轻视自己,也怨愤不语。过了好一会儿,才又静思一曲吹奏出来。
铷Rb 铯Cs
单质
软 具有
白 轻
强还 逐
原性, 与大
渐
低
多数 非金
导 属、
增 多
水反
应
呈逐
增 大 趋
渐 降
势低
逐 渐 降 低
金 属 性 逐 渐 增 强
碱金属的原子结构示意图
元素周期表-碱金属和卤素

碱金属和卤素对未来科技发展的影响
碱金属和卤素在许多领域中都有着广泛的应用,例如电子 、通讯、医疗等。随着科技的不断发展,这些元素将在更 多领域中发挥重要作用。
碱金属和卤素对未来科技发展的影响将越来越大,例如在 人工智能、量子计算等领域中,这些元素将发挥关键作用 。同时,随着新材料的不断涌现,碱金属和卤素在新材料 领域中的应用也将更加广泛。
THANKS FOR WATCHING
感谢您的观看
卤素元素具有强烈的氧化性和 化学反应活性,是化学反应的 重要参与者。
卤素元素在周期表中的位置
01
卤素元素在周期表中位于第17族 ,属于第2周期和第3周期的元素 。
02
卤素元素在周期表中的位置反映 了它们的电子结构和化学性质。
卤素元素的物理和化学性质
卤素元素具有较低的熔点和沸点,以 及较高的蒸气压。
卤素能够与金属发生置换反应, 生成相应的卤化物。
与非金属的反应
卤素能够与非金属发生取代反应, 如氯气与甲烷反应生成一氯甲烷和 氯化氢。
与水的反应
卤素与水反应会生成相应的氢卤酸 和次卤酸。
04 碱金属和卤素的应用
碱金属在工业中的应用
钠
用于制造氢氧化钠、氢气和钠的 化合物,如食盐、苏打等。
钾
用于制造钾肥、氢氧化钾、氢气 和钾的化合物,如硝酸钾等。
锂
用于制造锂电池、合金、氢气和 锂的化合物,如氢化锂等。
卤素在工业中的应用
氟
用于制造氟化物、氟代烃、 氟利昂等,还用作玻璃蚀刻 剂和某些反应的催化剂。
氯
初中化学元素周期表:碱金属和卤素的性质

初中化学元素周期表:碱金属和卤素的性质一、碱金属的性质1. 碱金属的基本特点碱金属是元素周期表中位于第ⅠA族的六种金属元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
碱金属具有以下基本特点:- 电子排布:碱金属原子具有一个外层电子,这个外层电子容易失去形成离子。
- 亲电性:碱金属的亲电性很强,即它们喜欢与非金属形成离子键。
- 密度和熔点:由于原子半径大、原子间距小,因此碱金属具有较低的密度和较低的熔点。
- 反应活泼:由于它们易失去外层电子形成阳离子,在水和氧气等常见物质中也能进行激烈反应。
2. 碱金属与水的反应碱金属与水发生剧烈反应,并放出大量氢气。
以钠与水反应为例:2Na(s) + 2H₂O(l) → 2NaOH(aq) + H₂(g)该反应产生了氢氧化钠溶液和氢气。
反应过程中会出现发烟、冒火、溅射的现象。
3. 碱金属与酸的反应碱金属与酸产生中和反应,生成相应的盐和水。
以钠与盐酸反应为例:2Na(s) + 2HCl(aq) → 2NaCl(aq) + H₂(g)该反应生成了氯化钠盐和氢气。
4. 碱金属离子的颜色特点碱金属离子在化合物中具有不同的颜色特点。
例如,铷离子(Rb⁺)在溶液中呈紫色,锂离子(Li⁺)呈红色。
二、卤素的性质1. 卤素的基本特点卤素是元素周期表第ⅦA族五种非金属元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和铯(Cl)。
卤素具有以下特点:- 在自然界中多以单质形式存在。
- 高电负性:由于原子结构中外层电子云稳定且容易吸引电子,因此卤素都具有很高的电负性。
- 卤素分子是由两个相同原子组成的双原值分子。
2. 卤素的物理性质卤素在常温下呈现不同的颜色,氟元素无色、氯元素淡黄绿色、溴元素深红褐色和碘元素紫黑色。
此外,卤素具有以下物理性质:- 摩尔质量:由于原子量的增加,摩尔质量也相应增大。
- 密度:随着原子半径增加,密度也会增加。
- 熔点和沸点:从氟到碘,熔点和沸点依次升高。
元素周期表

元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的
去一个电子,形成+1价的阳离子,并能与氧气
等非金属元素及水发生化学反应。
实验1:取一小块钾,擦干表面的煤油后放在石
棉网上加热,观察现象。同钠与氧气的反应比较。 实验2:在烧杯中放入一些水,然后取绿豆大小 的钾,用滤纸吸干表面的煤油,投入烧杯中,观察 现象。
钠、钾化学性质比较
钠 钾
与氧气 剧烈燃烧,火焰呈 黄 剧烈燃烧,火焰 反应 色,生成 淡黄色 色 呈 紫 色 的固体 与水反 应(绿 豆大一 块) 熔 成银 浮 在水面上、熔 浮在水面上、 白色、在水面上四 成银白色、在水面 处游动 、滴入酚酞溶液 上四处 游动 、滴入酚 呈 红 色 酞溶液呈 红 色, 有微弱爆炸
第1周期:
短周期
第2周期:
周期
(横向)
第3周期:
第4周期:
四长
三短
长周期
第5周期:
第6周期: 第7周期:
类别
周期 序数
起止元素
包括元素 种类数
核外电 子层数
1 短周期
2 3 4 5 6 7
H—He Li—Ne
2 8 8 18
18 32
1 2 3 4
5 6
Na—Ar
K—Kr Rb—Xe Cs—Rn
(1)碱金属元素原子的最外层 都有1个电子,它们的化学性质 相似 ①与O2的反应
碱金属与氧气反应比较
单质 Li Na K Rb Cs 与O2反应 Li2O Na2O、Na2O2 K2O、K2O2、KO2 更为复杂 更为复杂 反应程度
越 来 越 剧 烈
(1)碱金属元素原子的最外层 都有1个电子,它们的化学性质 相似 Li、Rb、Cs ①与O2的反应 又如何呢?
元素周期表中的族性规律

元素周期表中的族性规律元素周期表是描述化学元素的一种图表形式,它按照元素的原子序数、原子量和元素性质的周期性规律进行排列。
在元素周期表中,元素的性质往往与其所属的族有很大的关系。
本文将探讨元素周期表中的族性规律,并展示不同族元素的性质特点。
1. 第一族:碱金属第一族元素是最活泼的金属元素,包括氢(H)、锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素具有低电离能和低电负性,因此易于失去电子形成阳离子。
它们在水中与水分子反应剧烈,并放出氢气。
此外,碱金属在氧气和水蒸气中也会燃烧。
碱金属的性质由上至下逐渐活泼增强。
2. 第二族:碱土金属第二族元素包括:铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
这些元素也是金属,但相对于第一族来说较不活泼。
它们的电离能比碱金属高,但仍然易于失去外层电子形成阳离子。
碱土金属与水反应较活泼,但没有碱金属那么剧烈。
此外,碱土金属的硬度和熔点较高。
3. 第十三族:硼族硼族元素包括硼(B)、铝(Al)、镓(Ga)、铟(In)和铊(Tl)。
这些元素的共同特点是外层电子配置为ns2np1。
硼金属的硬度很高,但是在常温下较脆且不导电。
铝是最常见的硼族元素,它具有良好的导电性和热导性。
硼族元素的氧化态通常为+3,但也可以呈现较小的氧化态。
4. 第十四族:碳族碳族元素包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)和铅(Pb)。
这些元素的外层电子配置为ns2np2。
碳族元素具有较强的非金属性,它们能够与非金属或其他元素形成共价键。
碳是许多有机化合物的基础,具有广泛的应用。
碳族元素还表现出降低氧化态的趋势,其中碳的氧化态可以为+4或-4。
5. 第十五族:氮族氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)和铋(Bi)。
氮族元素的外层电子配置为ns2np3,它们通常形成带有负电荷的离子或形成共价键。
氮族元素具有较高的电负性,并且在氧化反应中可以呈现多种氧化态。
元素周期表中的化学族

元素周期表中的化学族化学族指的是元素周期表中具有相似化学性质的一组元素。
根据元素周期表的分布规律,我们可以将周期表中的元素分为不同的化学族,如碱金属族、碱土金属族、卤素族、氧族等。
这些化学族在化学性质上具有相似的特点,对于我们理解元素的性质和化学反应有着重要的意义。
一、碱金属族碱金属族是元素周期表中的第一族,包括氢(H)、锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这一族元素具有低密度、低熔点和较强的金属性质。
它们在常温下都是固体,具有较低的密度和较低的熔点,容易形成离子化合物。
碱金属与水反应时会产生氢气,同时也会产生碱性溶液,因此被称为碱金属。
二、碱土金属族碱土金属族是元素周期表中的第二族,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
碱土金属具有较高的熔点和较硬的性质,比碱金属更具金属特性。
碱土金属的离子易失去2个价电子,形成+2的离子。
它们的化合物在溶液中能够释放出钙离子,对生物体内的骨骼生长和维持神经传导起着重要作用。
三、卤素族卤素族是元素周期表中的第七族,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
卤素族元素具有非常强烈的氧化性,它们可以与金属反应,形成离子化合物。
此外,卤素族元素在自然界中主要以单质形式存在,可以与金属形成盐类。
卤素在有机化学中也有着广泛的应用。
四、氧族氧族是元素周期表中的第六族,包括氧(O)、硫(S)、硒(Se)、碲(Te)和钋(Po)。
氧族元素有着较高的电负性,是化学反应中常见的活泼元素。
氧族元素在化合物中常以-2的价态存在,可以与许多其他元素形成不同类型的化合物。
氧族元素在地球上的存在和生物体内的各种生命过程紧密相关。
五、稀有气体稀有气体是元素周期表中的第十八族,包括氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)和氡(Rn)。
稀有气体具有高稳定性,不易与其他元素反应,因此被称为“稀有”。
高中 元素周期表

课时1 元素周期表一、元素周期表的结构1.诞生:1869年俄国化学家__________首次完成2.编排原则:①按_______________递增的顺序从左到右排列②将______________相同..。
(周期序数=__________________)..的各元素从左到右排成一横行③把______________相同..的元素按电子层数递增的顺序从上到下排成一纵行..。
(主族序数=_______)3.结构特点:核外电子层数元素种类0族原子序数第一周期 1 ___种元素_______周期第二周期 2 ___种元素_____ 周期第三周期 3 ___种元素_____元(___个横行)第四周期 4 ___种元素_____素(___个周期)第五周期 5 ___种元素_____周__周期第六周期 6 ___种元素_____期第七周期7 ___种元素)_____表主族:ⅠA~ⅦA共_____个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共____个副族(___个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(___个族)零族:稀有气体4.请画出元素周期表结构框架:课时2 元素的性质与原子结构1.碱金属元素(1)碱金属元素的原子结构元素名称元素符号原子结构示意图最外层电子数电子层数原子半径由上至下变化规律原子结构特点如下:①相似性:最外层电子数都是____。
②递变性:Li―→Cs,核电荷数_______,电子层数_______,原子半径_______。
(2)碱金属单质的物理性质(3)碱金属单质的化学性质性质或化学方程式相似性与O2①锂与氧气:________________②钠与氧气:(常温)_________________;(加热)______________________(所需仪器名称:________________)。
与H2O①锂与H2O:______________________②钠与H2O:______________________(实验现象:_________________)③钾与H2O:_______________________与盐溶液反应规律___________________________________________________________差异性与O2产物不同:Li-氧化物______;Na-氧化物_____、过氧化物______(颜色:______);钾~铯生成更复杂的氧化物与H2O 由锂到铯反应越来越_________保存方法:钠、钾保存在__________________,锂常保存在__________________。
化学元素周期表高清详细颜色分区19版

# 1
Palladium
1 0
Silver
# 1
Cadmium
# 2
Indium
# 3
锡
Tin
锑 碲 碘 氙 8
8
8
8
8L
#
#
#
#
#M
# 3
Antimony
# 5
Tellurium
# 6
Iodine
# 7
Xenon
#N 8O
85.4678
87.62
88.90585
91.224
92.90638
95.96
铪
8 #
钽
8 #
钨
8 #
铼
8 #
锇
8 #
铱
8 #
铂
8 #
金
8 #
汞
8 #
铊
8 #
铅
8 #
铋
8 #
钋
8 #
砹*
8 #
氡
8L #M
Hafnium
# #
Tantalum
# #
Tungsten
# 8
Rhenium
# #
Osmium
# #
Iridium
# #
Platinum
# #
Gold
# #
Mercury
# #
Thallium
# #
Lead
# #
Bismuth
# #
Polonium
# #
Astatine
# #
Radon
#N #O
178.49
2 180.9479 2 183.84
化学元素周期表

烯烃
不饱和烃
烯烃是一种不饱和烃,其分子中至少有一个碳碳 双键。
命名
烯烃的命名通常以“烯”为词根,根据其分子中 碳原子的数目来命名,如乙烯、丙烯、丁烯等。
性质
烯烃通常是无色、有刺激性气味、易燃的液体或 气体,具有不溶于水但可溶于有机溶剂的特性。
炔烃
01
不饱和烃
炔烃是一种不饱和烃,其分子中至少 有一个碳碳三键。
性质
碘元素是周期表中紫黑色固体,具有弱氧化性和腐蚀性,可与大多数金属形成碘化物。
用途
碘元素主要应用于化工、医药、农业和食品等领域,如碘化银用于人工降雨、碘化钾用于治疗甲状腺疾病、碘化钠用于农 业杀菌等。
05
过渡金属元素
钛元素
物理性质
钛是一种银白色过渡金属元素,具有轻盈的特性 ,是所有金属中最轻的。
溴元素由德国化学家巴里于19世 纪发现,并以其拉丁名 “brom”命名。
性质
溴元素是周期表中唯一的非金属 液体,具有强氧化性和腐蚀性, 可与大多数金属形成溴化物。
用途
溴元素主要应用于化工、医药、 电子和灭火等领域,如溴化银用 于摄影、溴化钠用于治疗神经病 痛、电子元件和灭火剂等。
碘元素
发现与命名
碘元素由法国化学家库特瓦于19世纪发现,并以其拉丁名“iod”命名。
砷(As)
砷是一种剧毒的重金属元素,长期接触砷会影响人体神经系统、心血管系统和造血系统的 正常功能,严重时可危及生命。
有害有机物
01
多氯联苯(PCBs)
多氯联苯是一种常见的有害有机物,长期接触PCB会引发肝脏损伤、
免疫系统抑制和神经系统损伤等多种健康问题。
02
二噁英(Dioxins)
二噁英是一种剧毒的有机化合物,长期接触二噁英会对人体免疫系统
碱金属元素和卤素

的 能
性 增
Na
力强K
逐
渐 Rb
增
强 Cs
Fr
最 外
原子F
层半
的 C径l
吸逐
引B渐r
力增
逐 大I
渐,
减 A原t
小子
核
对
.
得
非电
金子
属 性
的 能 力
减逐
弱渐
减
弱
29
练习1:砹(At)是卤族元素中位于碘后面的元素,试推 测砹和砹的化合物最不可能具备性质 ( B ) A.砹易溶于某些有机溶剂 B.砹化氢很稳定不易分解 C.砹是有色固体 D.砹化银不溶于水或稀HNO3
LiOH< NaOH < KOH < RbOH < CsOH
.
7
③与酸反应
相似性:均比与水反应剧烈,均是先与酸反应, 酸不足时,把酸反应完再与水反应
2R+2H+=2R++ H2↑ 递变性:反应越来越剧烈
④与盐溶液反应 先与水反应,产生的碱再与盐溶液反应
即,水溶液中均不可置换出金属单质
特殊反应:
熔融 Na+KCl====NaCl+ K↑
F2+ 2H2O=4HF+O2 HF+NaOH=NaF+H2O
(6)卤素单质和一些还原剂反应
还原性:S2->SO32->I->Fe2+>Br->Cl->F-
X2 + SO2 + 2H2O=H2SO4 + 2HX(X=Cl、Br、I)
.
24
卤族元素从上到下(从F到I),随着核电
荷数的增加,原子的电子层数逐渐
碱金属元素性质总结讲解
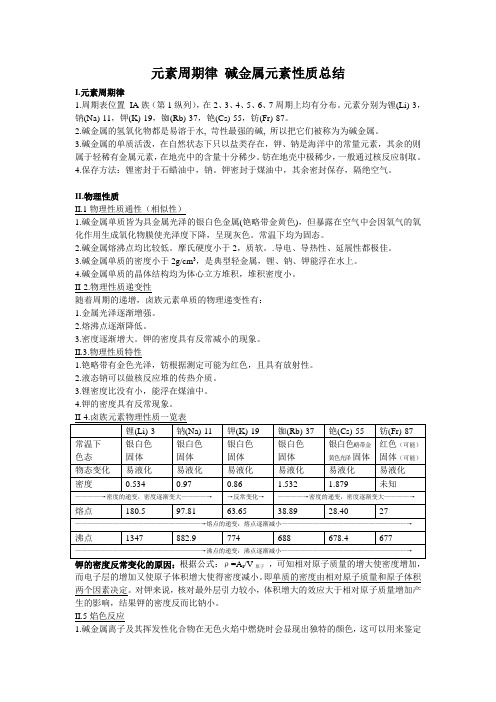
元素周期律碱金属元素性质总结I.元素周期律1.周期表位置IA族(第1纵列),在2、3、4、5、6、7周期上均有分布。
元素分别为锂(Li)-3,钠(Na)-11,钾(K)-19,铷(Rb)-37,铯(Cs)-55,钫(Fr)-87。
2.碱金属的氢氧化物都是易溶于水, 苛性最强的碱, 所以把它们被称为为碱金属。
3.碱金属的单质活泼,在自然状态下只以盐类存在,钾、钠是海洋中的常量元素,其余的则属于轻稀有金属元素,在地壳中的含量十分稀少。
钫在地壳中极稀少,一般通过核反应制取。
4.保存方法:锂密封于石蜡油中,钠。
钾密封于煤油中,其余密封保存,隔绝空气。
II.物理性质II.1物理性质通性(相似性)1.碱金属单质皆为具金属光泽的银白色金属(铯略带金黄色),但暴露在空气中会因氧气的氧化作用生成氧化物膜使光泽度下降,呈现灰色。
常温下均为固态。
2.碱金属熔沸点均比较低。
摩氏硬度小于2,质软。
.导电、导热性、延展性都极佳。
3.碱金属单质的密度小于2g/cm3,是典型轻金属,锂、钠、钾能浮在水上。
4.碱金属单质的晶体结构均为体心立方堆积,堆积密度小。
II-2.物理性质递变性随着周期的递增,卤族元素单质的物理递变性有:1.金属光泽逐渐增强。
2.熔沸点逐渐降低。
3.密度逐渐增大。
钾的密度具有反常减小的现象。
II.3.物理性质特性1.铯略带有金色光泽,钫根据测定可能为红色,且具有放射性。
2.液态钠可以做核反应堆的传热介质。
3.锂密度比没有小,能浮在煤油中。
4.钾的密度具有反常现象。
钾的密度反常变化的原因:根据公式:ρ=A r/V原子,可知相对原子质量的增大使密度增加,而电子层的增加又使原子体积增大使得密度减小。
即单质的密度由相对原子质量和原子体积两个因素决定。
对钾来说,核对最外层引力较小,体积增大的效应大于相对原子质量增加产生的影响,结果钾的密度反而比钠小。
II.5焰色反应1.碱金属离子及其挥发性化合物在无色火焰中燃烧时会显现出独特的颜色,这可以用来鉴定碱金属离子的存在,锂、铷、铯也是这样被化学家发现的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化性逐渐减弱
F- Cl- Br- I-
还原性逐渐增强
总结:根据实验比较非金属元素的非金属性强弱
①与H2化合的难易程度:越易化合非金属性越强。 氢化物的稳定性:越稳定,则非金属性越强。
②最高价氧化物对应的水化物的酸性越强,则元素的非金 属性越强。
③ 根据非金属之间的相互置换:A能置换出B,则A的非金属 性强于B。
加入硝酸银和稀硝酸, 有白色沉淀生成
五、Cl-、Br-、I-的检验
演示实验:
• 方法一:滴加AgNO3溶液,再加稀 HNO3
• 方法二:①氯水
Cl2+2NaBr→2NaCl+Br2 Cl2+2KI→2KCl+I2
②再加苯或四氯化碳,振荡 ( 若检验I-还可加淀粉试液)
六、卤化银的特性
(1)卤化银(AgX)的不稳定性—— 感光性
液溴:深红棕色 溴水:溴的溶解度比较小,所以是橙色 溴的四氯化碳溶液:溴的溶解度较大,所以是橙红色,甚 至可以是红棕色
极臭的液体,剧毒。
碘(I2)易升华
遇(I2)淀粉变蓝色
固体:紫黑色 气体:紫红色 碘水:黄---棕黄色 碘的CCl4:紫色
卤素单质在水溶液 和 CCl4中的颜色
Br2
橙黄色 橙红色
碱性:LiOH<NaOH < KOH < RbOH < CsOH 还原性(金属性):Li<Na< K< Rb< Cs 阳离子的氧化性: Li+>Na+> K+> Rb+> Cs+
卤素性质的递变规律
下列对Br2应具有的化学性质的推测正确的是
(1)X2+ 金属 = 金属氯化物 3X2+2Fe=2FeX3
1.画周期表的的轮廓,用元素符号注明碱金属、卤素在 周期表的位置,画出金属与非金属分界线
2.元素X,它的原子最外层电子数是次外层电子数的2倍。
元素在周期表中的位置: _________ 第二周期
3.下列说法中正确的是(C )
ⅣA族
A.每一周期的元素都是从碱金属开始,最后以稀 有气体结束
B.同一周期中(除第一周期外),从左到右,各元 素原子核的电子数都是从1个逐渐增加到8个
X2不包 括F2
二 卤素单质的化学性质
实验设计:氯、溴、碘的活泼性
试 现有化学试剂:氯水 溴水 碘水 四氯化碳
一
NaCl(aq) NaBr(aq) KI(aq)
试 设计实验方案:证明卤素单质的活泼性。
实验:
(1)2mLNaCl(aq)+2mL溴水,再加入1mL CCl4 2mLNaCl(aq)+2mL碘水,再加入1mL CCl4
0.152 0.186 0.227
0.248
0.265
(3)卤化氢(HX)的性质 ①卤化氢均为无色,刺激性气体 ②卤化氢均极易溶于水,生成氢卤酸,故易在空 气中形成白雾(酸雾)
③卤素气态氢化物稳定性递变规律:
HF ﹥HCl﹥HBr﹥HI
④氢卤酸酸性递变规律:HF <HCl<HBr<HI ⑤氢化物还原性递变规律: HF <HCl<HBr<HI
4e
*常温、黑暗下:2F2 + 2H2O → 4HF + O2
氧化剂 还原剂
∴ F2置换出O2,活泼性:F2 ﹥ O2
氟气与碱反应:
4NaOH 2F2 O2 4NaF 2H2O
• H2和F2黑暗中爆炸
H2 F2 2HF
HF溶于水形成氢氟酸,氢氟酸是弱酸,有腐蚀性,能 腐蚀玻璃,(要用塑料瓶保存),腐蚀原理如下:
2.最高价氧化物的酸性: HClO4 > HBr04 > HI04
卤离子的鉴定方法
• Cl-的鉴定方法
思考:检验Cl-时如何排除CO32-的干扰?
加入硝酸银和稀硝酸, 有白色沉淀生成
卤离子的鉴定方法
•I-的鉴定方法
1.加入硝酸银和稀硝酸, 有黄色沉淀生成
2.加入氯水和四氯化碳, 下层的四氯化碳呈紫红色
(2)2mLNaBr(aq)+2mL氯水,再加入1mL CCl4 2mLNaBr(aq)+2mL碘水,再加入1mL CCl4
(3)2mLKI(aq)+2mL氯水,再加入1mL CCl4 2mLKI(aq)+2mL溴水,再加入1mL CCl4
Cl2 + 2NaBr → 2NaCl + Br2 Cl2 + 2KI → 2KCl + I2 Br2 + 2KI → 2KBr + I2
I2
黄色 紫色
碱金属在物理性质上的相似性和规律性。
颜色 相
硬度 似
密度 点 熔沸点
导电导热性 递 密度变化 变 性 熔沸点变化
Li Na K Rb Cs 均为银白色(Cs略带金色)
柔软 较小 较低 很好 逐渐增大(K特殊) 单质的熔沸点逐渐降低
• Cl-的鉴定方法
思考:检验Cl-时如何排除CO32-的干 扰?
4HF SiO2 SiF4 2H2O
卤素单质共性
用X2表示卤素单质,它们的化学反应方程式可归纳为:
1)与非金属单质反应: H 2 X 2 2HX
HF
2)与金属单质反应: 2Na X 2 2NaX
3)与水反应: X2 + H2O
HX + HXO
4)与碱反应:2NaOH X 2 NaX NaXO H2O
遇水立 遇水立 即燃烧, 即燃烧, 爆炸 爆炸
结论
金属性逐渐增强
总结:根据实验比较元素金属性强弱的方法
①与水(或酸)反应——难易程度: 越易反应,则对应金属元素的金属性越强。
②与盐溶液的置换反应。 A置换出B,则A对应的金属元素比B对应的金 属元素金属性强
③最高价氧化物对应水化物的碱性越强则对应金 属元 素的金属性越强。
(2)X2+ H2 = 2HX
I2除外
(3)X2 + H2O HX + HXO
(F2除外)
(4)X2 + 2OH— = X —+ XO—+ H2O (F2除外)
是所有卤素单质的共性吗?
Fe+ I2=FeI2
2F2 + 2H2O = 4HF + O2
(2)卤素与氢气的反应
单 质
反应条件
F2 冷暗处爆炸
碱金属元素属于___金_元属素(填金属、非金属),其单质在 反应中表现_____性(填还氧原化、还原),易__电子(填得或 失),是因为________________ 元素原子的的最外层 ___电__子__数__少__,__仅__1_个__。__失__电__子__容__易__,__得__电__子__难
1、与O2反应
2、与水反应
二、元素的性质与原子结构
卤族元素属于___非__金_元属素(填金属、非金属),其单质在 反应中表现_____性(填氧氧化化、还原),易__电子(填得或 失得),是因为________________ 元素原子的最外层 ___电__子__数__多__,__有__7_个__。__得__电__子__容__易__,__失__电__子__难
2AgX 光照 2Ag + X2
一、卤素单质物理性质
1 . 递变规律
单质 颜色
F2 Cl2 Br2
浅黄绿色 黄绿色 深红棕色
I2
紫黑色
状态
气态 气态
密度
熔沸点
液态
固态
逐渐增大
逐渐升高
试一试:能否根据氯、溴、碘的物理性质推测氟
的物理性质?
2.氟(F2)的物理性质 状态: 气体 颜色: 很淡的黄绿色 气味: 刺激性 毒性: 剧毒 溶解性:与水剧烈反应
最外层填充两个电子已达饱和,性质与ⅡA族的元素 完全不同。
性质
体现 结构
决定
反映 决定
原子序数=质子数 主族序数=最外层电子数 周期数=电子层数
决定 体现
位置
二、元素的性质与原子结构
根据预习的内容填空
结论:同族元素的化性____相_又似______规__律__性__递_ 变
1.碱金属元素单质的化学 性质与Na_____相_,似都有
可见,物质的性质由结构决定
2、Li、Na、K、Rb、Cs性质预测:
实验验证:
与Na相似,活泼性递变
(1)Na、K与氧气反应进行对比
(2)Na、K与水反应进行对比
总结.比较元素金属性强弱的方法 (1)根据原子结构 原子半径(电子层数)越大,最外层电子数越少,金属性越 强,反之越弱。
(2)根据在周期表中的位置 ①同周期元素,从左至右随原子序数的增加,金属性减弱, 非金属性增强; ②同主族元素,从上至下,随着原子序数的增加,金属性增 强,非金属性减弱。
HF为弱酸!
【推测2】根据氟、氯溴、碘跟水反应的程度
三、卤素化合物的化学性质 1.卤化氢(HX)的性质
(1)卤化氢均为无色,刺激性气体
(2)卤化氢均极易溶于水,生成氢卤酸,故易在空
气中形成白雾(酸雾)
(3)酸性:HF < HCl < HBr < HI 酸性
弱酸
强酸
增强
(4)还原性:HF < HCl < HBr < HI
C.第二、三周期上下相邻元素的原子核外电子数 相差8个
D.第七周期只有23种元素
IA
1 H IIA
2 Li
3 Na 4K
IIIBIVB VB VIBVIIB VIII
5 Rb
6 Cs
7 Fr
0
IIIAIVAVA VIAVIIA 2
B
F8
IB IIB Al
Cl 8 Br 18
I 18
