高二化学水的电离和溶液的酸碱性2
高二化学上学期水的电离和溶液的ph2

记。 ③晨曦微亮,不必急于晨起,和衣而坐,望向邻近的窗棂,你会惊喜地发现,整个窗玻璃上冰窗花葳蕤①如春,轻轻地凑近鼻息,似乎能嗅出冰窗花散发着馥郁的馨香,冰洁,剔透,令人心灵震颤。手指轻轻抚摸上去,冰窗花棱角分明,如一朵朵雪花,被夜神的手指悄悄安抚上去,
灵动而又精美,既有花之妩媚造型,亦有花之悄然神韵,不是俗世那一双巧手能够裁剪得出的。面对如此精美的自然神物,又有谁忍心去擦拭呢?但又有谁能长久地屏息凝视,而不凑近鼻息呵气顽皮呢?于是,悄然撮圆了嘴唇,凑上前去,吹灰般轻吹一口气,冰窗花随着热气消融开来,
果?) 答:? (2)男人说,这是应该的,你是为人民服务的,我是为你服务的。(这句话有何意味?) 答:? ○小说●写法探究 7.小说详细描述了黎鸣第一次搭车的情景,这样写有何作用?(3 分) 答:? ○小说●内容评价 8.文中马厅长、公安局长没有对黎鸣的违纪行为进行严肃
处理。你是否认同他们的做法?请结合文本和生活经验,陈述观点和理由。(5 分) 答:? 代谢:(一)(15 分)5.(3 分)(1)感到便捷(优越感) (2)黎鸣成为副科长后,在市里交通枢纽的路边搭车,搭上了公安厅长的车;他们将其送到了家。 ?6.(4 分)(1)(2 分)代
展 到从市内开始搭车即是明代谢。 (2017代谢) 四、(本大题共4小题,共15分) 阅读《冰窗花》一文,回答16-19题。 冰窗花 任随平 ①冰窗花盛开在冬日的窗棂上,是一道绝美的风景。尤其是在久居乡下的那些日子里。 ②于是,每到冬日,我会有意无意念起熨帖在冬日木格窗棂
上的冰窗花。冬日的居室里,总会生了炉火,白日里,落了雪,一家人和和暖暖地或斜倚、或平躺在温热的土炕上,母亲选了废旧的布料,熬了浆糊,炕头置一炕桌,安安静静地做着鞋垫。父亲借了炉火,熬着罐罐茶,火苗间或跳出来,舔舐着茶罐,茶水滋滋地发着声响,茶香随着响声
水的电离和溶液的酸碱性典型例题及习题
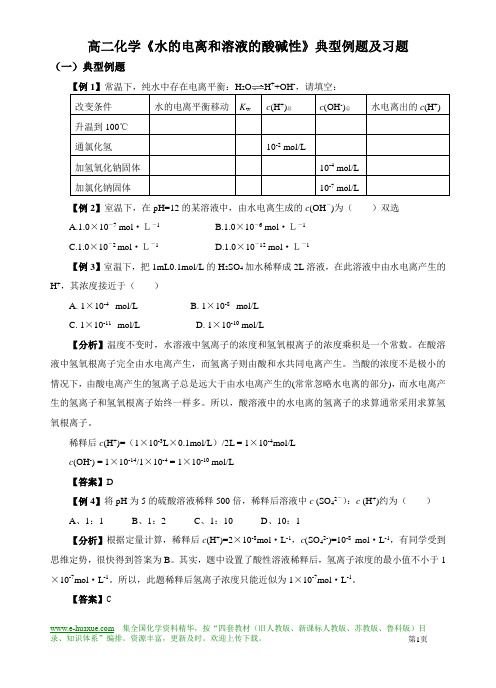
高二化学《水的电离和溶液的酸碱性》典型例题及习题(一)典型例题【例1】常温下,纯水中存在电离平衡:H+-,请填空:改变条件水的电离平衡移动K w c(H+)总c(OH-)总水电离出的c(H+) 升温到100℃通氯化氢10-2 mol/L加氢氧化钠固体10-4 mol/L加氯化钠固体10-7 mol/L【例2】室温下,在pH=12的某溶液中,由水电离生成的c(OH-)为()双选A.1.0×10-7 mol·L-1B.1.0×10-6 mol·L-1C.1.0×10-2 mol·L-1D.1.0×10-12 mol·L-1【例3】室温下,把1mL0.1mol/L的H2SO4加水稀释成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于()A. 1×10-4 mol/LB. 1×10-8 mol/LC. 1×10-11 mol/LD. 1×10-10 mol/L【分析】温度不变时,水溶液中氢离子的浓度和氢氧根离子的浓度乘积是一个常数。
在酸溶液中氢氧根离子完全由水电离产生,而氢离子则由酸和水共同电离产生。
当酸的浓度不是极小的情况下,由酸电离产生的氢离子总是远大于由水电离产生的(常常忽略水电离的部分),而水电离产生的氢离子和氢氧根离子始终一样多。
所以,酸溶液中的水电离的氢离子的求算通常采用求算氢氧根离子。
稀释后c(H+)=(1×10-3L×0.1mol/L)/2L = 1×10-4mol/Lc(OH-) = 1×10-14/1×10-4 = 1×10-10 mol/L【答案】D【例4】将pH为5的硫酸溶液稀释500倍,稀释后溶液中c (SO42-):c (H+)约为()A、1:1B、1:2C、1:10D、10:1【分析】根据定量计算,稀释后c(H+)=2×10-8mol·L-1,c(SO42-)=10-8mol·L-1,有同学受到思维定势,很快得到答案为B。
【优教通】高二人教版化学选修四教案设计:3-2-1《水的电离和溶液的酸碱性》

其次节水的电离和溶液的酸碱性第1课时水的电离和溶液的酸碱性●课标要求1.知道水的离子积常数。
2.初步把握pH测定的方法,知道溶液pH的调控在工农业生产和科学争辩中的重要应用。
●课标解读1.了解水的电离及水的离子积常数。
2.了解溶液的酸碱性与pH的意义。
●教学地位本课时介绍了水是一种弱电解质,在确定条件下水的离子积是常数。
了解测定溶液pH的方法。
利用pH,c(H +),c(OH-)等推断水溶液的酸碱性是本章的基础。
●新课导入建议追求健康长寿是人类共同的愿望。
人们首先要拥有健康,才有可能获得财宝、地位和幸福。
健康从哪里来呢?水是生命之源,假如没有水,就不行能有生命。
风靡日本、欧美等国的活性离子水是一种高品质的饮用水。
离子水比一般水分子团直径小,渗透作用快,有利于消退体内过多的自由基,能够延缓机体年轻,且对多种疾病有预防和挂念治疗的作用。
它的诞生,在全世界掀起了一场饮水领域的革命,善待生命,从水开头。
你知道水中有哪些粒子吗?【提示】水中有H2O、H+、OH-三种微粒。
●教学流程设计课前预习支配:(1)看教材P45~46,填写【课前自主导学】中的“学问1,水的电离”,并完成【思考沟通1】;(2)看教材P46~47页,填写【课前自主导学】中的“学问2,溶液的酸碱性与pH”,并完成【思考沟通2】。
⇒步骤1:导入新课并对本课时教材地位分析。
⇒步骤2:建议对【思考沟通1、2】多提问几个同学,使80%以上的同学都能把握该内容,以利于下一步对该重点学问的探究。
⇓步骤5:在老师指导下同学自主完成【变式训练1】和【当堂双基达标】中的1、4、5三题,验证同学对探究点的理解把握状况。
⇐步骤4:老师通过【例1】和教材P45~46页的讲解研析,对“探究1”的内容进行总结。
⇐步骤3:师生互动完成“探究1,影响水电离平衡的因素及水的离子积”可利用【问题导思】的设问由浅入深的进行,建议老师除【例1】外,再变换一下命题角度,可接受【老师备课资源】,以拓展同学的思路。
易错题解题方法集锦系列高二化学(选修4)下册:专题二 水的电离和溶液的酸碱性 Word版含解析

易错点一:水的电离【易错题典例】25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线ac所示,下列判断错)误的是(B.b、d线段上任意一点对应的溶液都呈中性C.d点对应溶液的温度高于25℃,pH<7D.CH3COONa溶液不可能位于c点D【答案】【解题指导】水解平衡同样可以利用平衡移动原理解释,影响水的电离平衡的因素可归纳如下:易错点二:离子积常数【易错题典例】水的电离平衡曲线如图所示,下列说法不正确的是( )A.图中四点K W间的关系:A=D<C<BB.若从A点到C点,可采用温度不变在水中加少量CH3COONa固体C.若从A点到D点,可采用温度不变在水中加少量酸D.若处在B点所在的温度,将pH=2的硫酸与pH=10的NaOH的两种溶液等体积混合后,溶液显中性【答案】B【错因分析】考查水的电离平衡移动问题,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c (H+)和c(OH-)的大小,易错点包括:①K w=c(H+)•c(OH-),式中c(H+)和c(OH-)均指的是溶液中的c(H+)、c(OH-).例如,常温下,pH=2的盐酸溶液中,c(H+)=10-2mol/L,则溶液中c(OH-)=10-12mol/L(也就是由水电离出的c(OH-)),由水电离的c(H+)=10-12mol/L=c(OH-)=10-12mol/L;②要区分由水电离出的c(H+)、c(OH-)和溶液中c(H+)、c(OH-):a、酸性溶液中,溶液中的c(H+)不等于由水电离出的c(H+),但溶液中的c(OH-)等于由水电离出的c(OH-);b、碱性溶液中,溶液中的c(OH-)不等于由水电离出的c(OH-),但溶液中的c(H+)等于由水电离出的c(H+);c、任何溶液中由水电离的c(H+)与c(OH-)总是相等的。
③水的离子积不仅适用于纯水,也适用于酸、碱、盐稀溶液。
【解题指导】明确离子积常数的定义及影响因素是解答此类题的关键;离子积常数的影响因素①K w只受温度影响,水的电离吸热过程,温度升高,水的电离程度增大,K w增大,25℃时K w=1×10-14,100℃时K w约为1×10-12;②水的离子积不仅适用于纯水,也适用于其他稀溶液.不论是纯水还是稀酸、碱、盐溶液,只要温度不变,K w就不变;特别提醒]:水的离子积不仅适用于纯水,还适用于稀的电解质溶液。
第3章第2节水的电离和溶液的酸碱性

2011-2012学年高二化学选修4(人教版)同步练习第三章第二节水的电离和溶液的酸碱性一. 教学内容:水的电离和溶液的酸碱性二.重点、难点:1. 本节的重点是水的离子积,氢离子浓度、pH与溶液酸碱性的关系2. 本节的难点是水的离子积,相关溶液pH的简单计算三. 具体内容:(一)水的电离1. 水的电离2. 水的电离水准3. 电离平衡常数4. 水的离子积5. 需注意的6. 影响水的电离平衡的因素(二)溶液的酸碱性与pH1. Kw在电解质溶液中的存有2. 溶液的酸碱性与c(H+)、c(OH-)的关系3. 溶液的酸、碱性与pH的关系4. 溶液酸碱性的表示方法5. pH的测量(三)pH的应用1. 医疗上2. 生活上3. 环保领域中4. 农业生产中5. 科学实验和工业生产中(四)酸碱质子理论A. 溶液pH的计算方法B. 实验测定酸碱滴定曲线1. 实验2. 酸碱指示剂在中和滴定中的应用【典型例题】[例1] 将pH=4的酸溶液与pH=10的NaOH溶液等体积混合后,溶液的pH可能是()A. 等于7B. 大于7C. 小于7D. 无法确定答案:AC解析:考虑弱电解质电离的特点和pH的计算。
[例2] 今有HA、H2B、H3C三种弱酸,根据强酸制弱酸的反应规律,它们之间发生以下反应:HA+HC2-(少量)=A-+H2C-;H2B(少量)+2A-=B2-+2HA;H2B(少量)+ H2C-=HB-+H3C,回答以下问题:(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是____;(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最容易结合质子(H+)的是_____,最难结合质子的是_____;(3)完成以下反应的离子方程式①H3C+OH-(过量)_______________;②HA(过量)+C3-________________。
答案:(1)H2B;(2)C3-;HB-;(3)H3C+3OH-=C3-+3H2O;2HA+C3-=2A-+H2C-解析:掌握酸碱质子理论。
水的电离和溶液的酸碱性学案(第二课时)

第三节 水的电离与溶液的酸碱性(二)制作:田宇 审核:高二化学组【知识探究】一、溶液pH 的计算基本类型1、单一溶液的pH 计算例:分别求0.05mol/LH 2SO 4溶液和0.05mol/L Ba(OH)2溶液的pH ?请尝试自己总结出pH 计算的基本规律:2、酸、碱混合pH 计算①两强酸混合:例:将pH =4的盐酸溶液与pH =6的盐酸溶液等体积混合后溶液的PH=___________; ②两强碱混合:例:pH =8的氢氧化钠溶液与pH =10的氢氧化钠溶液等体积混合后,溶液中的氢离子 浓度最接近于( )A. 21010108--+mol·L -1B. 2101046--+mol·L -1 C.(10-8+10-10)mol·L -1 D.2×10-10 mol·L -1例:室温下将n 体积pH=10和m 体积pH=13两种NaOH 溶液混合得pH=12的NaOH 溶液,则n :m=__________③强酸与强碱溶液混合后pH 的计算例:1体积pH=2的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH 等于( )A .9.0B .10.0C .11.0D .12.03、酸、碱加水稀释后溶液的PH例:常温下,将pH=1的H 2SO 4溶液和pH=13的NaOH 溶液分别稀释1000倍,求所得 溶液的pH 。
4、特殊稀释情况①对于强酸溶液,每稀释10n 倍,pH 个单位。
②对于强碱溶液,每稀释10n 倍,pH 个单位。
③常温下不论任何溶液,稀释时pH 均向 靠近;无限稀释后pH 均为 。
例: 常温下,10-4mol/L 的盐酸溶液中,c (OH -)= mol/L ,将上述盐酸稀释10倍,溶液中c (H +)= mol/L 、c (OH -)= mol/L ;将上述溶液稀释10000倍,溶液中c (H +)= mol/L 、c (OH -)= mol/L 。
水的电离和溶液的pH(第二课时)_高二化学教案_模板

水的电离和溶液的pH(第二课时)_高二化学教案_模板[教学目标]1.知识目标(1)理解溶液的pH。
理解溶液的pH跟溶液中c(H+)之间的关系。
(2)有关pH的简单计算。
(3)了解溶液pH的简单测定方法。
2.能力和方法目标(1)通过各种类型溶液pH的计算,掌握电解质溶液pH计算方法。
(2)通过不同溶液混合后pH的计算,掌握具体情况具体分析的思考方法,提高分析问题解决问题能力。
(3)通过溶液pH的测试方法,掌握实验室测试溶液酸碱性的方法。
3.情感和价值观目标通过用pH表示溶液的酸碱性,理解化学学科中对极小数值的表示方法,让学生体会化学学科的特有价值。
[教学重点和难点]各类溶液、各类混合后的c(H+)、pH的计算。
[教学过程]见ppt文件。
[课堂练习]1.将pH为5的硫酸溶液稀释500倍,稀释后溶液中c(SO )和c(H+)之比约为()。
(A)1:1 (B)1:2 (C)1:10 (D)10:12.向VmLBaCl2溶液中加入一定体积的0.05mol/L硫酸溶液,两者恰好完全反应,且反应后溶液的pH为3.0。
则原BaCl2溶液的物质的量浓度为()。
(A)5.05×10-4 mol·L-1 (B)5.05×10-3 mol·L-1(C)1.01×10-4 mol·L-1 (D)1.01×10-3 mol·L-1[1] [2] [3] 下一页1-2-1 氨、铵盐(第一课时)[教学目标]1.知识目标(1)掌握氨气分子的结构、性质、用途及相互关系。
(2)掌握氨水的性质、掌握有关氨气溶于水的计算。
(3)了解氨水、液氨的区别,能分析氨水溶液中存在有关平衡问题。
2.能力和方法目标(1)通过氨水、液氨成分的比较,培养学生的分析、对比能力。
(2)通过氨的结构、性质和用途相互关系的理解,提高推理能力。
(3)通过有关计算训练数学计算和推理能力。
高二化学水的电离和溶液的酸碱性试题答案及解析

高二化学水的电离和溶液的酸碱性试题答案及解析1.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是()A.向水中投入一小块金属钠B.将水加热煮沸C.向水中通入CO2气体D.向水中加食盐晶体【答案】C【解析】:A项中加入Na,Na与H2O反应生成NaOH,使c(OH-)>c(H+);B项中c(H+)=c(OH-);C项中通入CO2,CO2+H2O H2CO3,故c(H+)>c(OH-);而D项中c(H+)=c(OH-),故选C项。
【考点】水的电离溶液的酸碱性2.如下图是常见仪器的部分结构。
(1)写出仪器名称A,B,C,D。
(2)使用前需检查是否漏水的仪器有。
【答案】(1)量筒容量瓶滴定管温度计;(2)BC【解析】(1)A没有0刻度,刻度自下而上由小到大,是量筒。
B中只有一刻度,上部有塞子为容量瓶。
C刻度自上而下由小到大为滴定管。
D中有0刻度在中间,有负值,为温度计。
(2)是在第(1)题判断的基础上考查对容量瓶和滴定管使用前查漏的问题。
【考点】酸碱中和滴定3.常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于()A.1.7B.2.0C.12.0D.12.4【答案】B【解析】:混合后,酸过量,c(H+)= mol·L-1=0.01 mol·L-1;pH="-lg" c(H+)=-lg0.01=2.0。
【考点】pH的计算4.某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为A.13B.12C.11D.10【答案】B【解析】由于在该温度下由水电离出的c(H+)·c(OH-)=10-22,c(H+)=1.0×10-11;Kw= c(H+)·c(OH -)=1.0×10-11×0.01=1.0×10-13,c(NaOH)= 0.1mol/L,c(OH-)=0.1mol/L,所以c(H+)=Kw÷c(OH-)=10-13÷0.1=1.0×10-12;所以pH=12,因此选项是B。
高二化学上学期水的电离和溶液的ph2

练习:
1、在0.1mol/L的HCl溶液中,c(H+)= (OH -)= mol/L,由水电离的c(H+)= mol/L。
mol/L,c
2、在0.1 mol/L的氢氧化钠溶液中,由水电离的c(OH-)
注意:pH=0 并非无H+,而是c(H+)=1mol/L, pH=14 并非无OH -,而是c(OH -)=1mol/L
注意:pOH -----采用OH -的物质的量浓度的负对数来 表示溶液的酸碱性
pOH + pH ==14
硬木办公家具保养的方法 硬木办公家具的因其性能耐性比较强,广受人们的喜爱,但是,对于樱木办公家具的保养,许多人却知之甚少,以下是博瑞办公家具经验人员,经过多年的实践总结出来的十大硬木办公家具的保 供大家参考!
Kw=c(H+)·c(OH-)
(2) 注意点:
A、水的电离过程是吸热,升高温度, Kw将增大 25℃时,Kw=c(H+)·c(OH-) =1×10-14 B、水的离子积不仅适用纯水,也适用于酸、碱、盐 的稀溶液
(3 )影响因素:
A、酸、碱:温度不变,在纯水中加入酸或碱,均使水 的电离左移 , Kw不变 ,α(H2O) 变小
一、水的电离
1、水的电离方程式 H2O+H2O H3O++OH-
结论(1)水是极弱的电解质,它能微弱“自身”电离 生成H+与OH-
(2)水的电离是可逆的,存在电离平衡,它的逆反应 为中和反应
2、水的离子积常数Kw
(1)、定义:在一定温度下,水中c(H+)和c(OH-)的 乘积Kw是一个常数,这个常数叫做水的离子积常数。
《水的电离和溶液的酸碱性》 说课稿

《水的电离和溶液的酸碱性》说课稿尊敬的各位评委老师:大家好!今天我说课的题目是《水的电离和溶液的酸碱性》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析(一)教材的地位和作用“水的电离和溶液的酸碱性”是人教版高中化学选修 4《化学反应原理》第三章第二节的内容。
本节课是在学生已经学习了化学平衡和弱电解质的电离平衡等知识的基础上,进一步深入探讨水溶液中的离子平衡问题。
水的电离是弱电解质电离平衡的延伸和拓展,溶液的酸碱性则是水的电离平衡在实际中的应用。
通过本节课的学习,学生能够更加全面地理解水溶液中的离子行为,为后续学习盐类的水解等知识奠定基础。
(二)教学内容本节课主要包括水的电离、水的离子积常数、溶液的酸碱性与 pH 等内容。
其中,水的电离平衡是理解溶液酸碱性的关键,水的离子积常数则是定量描述水的电离程度的重要物理量,溶液的酸碱性与 pH 的关系则是将抽象的离子浓度转化为直观的数值,便于实际应用。
二、学情分析(一)知识基础学生在必修 1 中已经初步了解了溶液的酸碱性和 pH 的概念,在选修4 第一章和第二章中学习了化学平衡和弱电解质的电离平衡等知识,具备了一定的平衡思维和分析问题的能力。
(二)学习能力高二学生已经具备了较强的自主学习能力和一定的实验探究能力,但对于抽象的理论知识理解起来可能还存在一定的困难,需要通过具体的实例和实验来帮助他们理解。
(三)学习兴趣学生对于与生活实际密切相关的化学知识往往具有较高的学习兴趣,溶液的酸碱性在日常生活和工农业生产中有着广泛的应用,因此可以通过联系实际来激发学生的学习积极性。
三、教学目标(一)知识与技能目标1、理解水的电离平衡及其影响因素。
2、掌握水的离子积常数的表达式及意义。
3、了解溶液的酸碱性与 pH 的关系,能够进行 pH 的简单计算。
(二)过程与方法目标1、通过实验探究和数据分析,培养学生的观察能力、实验操作能力和数据分析能力。
高二化学水的电离和溶液的ph

水的电离和溶液的pH
一、知识及能力要点:
1、水的电离和水的离子积 2、影响水的电离平衡的因素 3、溶液的酸碱性 4、有关pH的简单计算
二、水的电离
1、水是极弱的电解质,因此也存在电离平衡。
+
+
H2O + H2O H3O++HO-
H2O
H++OH-
2、常温时,水的电离程度:
250C,55.6×107个水分子才有1个电离,及一 升水中只有10-7molH2O分子发生电离。
因此,水的电离程度增加,H+和OH-的浓度增加,所 以KW也是增大的。
注意2:1、Kw与温度有关,温度变,Kw变。
2、Kw不仅适用于纯水,还适用于酸、 碱、盐的稀溶液
知爵士:“嗯嗯,真的好玩!蘑菇王子:“哈哈!咱们换个玩法怎么样,爵士同学!”知知爵士:“好的好的!真过瘾啊!”这时,蘑菇王子超然像亮白色的五肾圣地雁 一样长喘了一声,突然来了一出曲身狂跳的特技神功,身上顷刻生出了九只犹如钢条似的火橙色眼睛。接着演了一套,摇雁水波翻两千五百二十度外加牛啸锅铲旋十五 周半的招数,接着又耍了一套,云体驴窜冲天翻七百二十度外加狂转十九周的恬淡招式。紧接着古树般的嘴唇整个狂跳蜕变起来……齐整有序、兔子一样显赫的大白牙 跃出墨紫色的缕缕丑云……缺乏锻炼的、好像木乃伊般精瘦的胸部透出纯黄色的丝丝怪热!最后转起警觉清瘦、可以转动的怪耳朵一挥,威猛地从里面跳出一道余辉, 他抓住余辉温柔地一摆,一件灰叽叽、明晃晃的咒符☆混天怪鸡诀☆便显露出来,只见这个这件宝器儿,一边振颤,一边发出“呜呜”的怪音!骤然间蘑菇王子旋风般 地让自己忧郁深沉的脑袋奇闪出墨紫色的牛怪声,只见他缺乏锻炼的、好像木乃伊般精瘦的胸部中,飘然射出九团抖舞着☆变态转轮枪☆的尾巴状的铁砧,随着知知爵 士的甩动,尾巴状的铁砧像瓜皮一样在身后豪华地搞出缕缕光雾……紧接着蘑菇王子又扭起仿佛刚刚经历怪异风光的灰白皮肤,只见他活跃有神的、很像猴子一样的瘦 弱肩膀中,酷酷地飞出九缕蚯蚓状的精灵,随着知知爵士的扭动,蚯蚓状的精灵像弹头一样,朝着湖蝎翡翠桌上面悬浮着的胶状体横抓过去……紧跟着蘑菇王子也窜耍 着咒符像图纸般的怪影一样向湖蝎翡翠桌上面悬浮着的胶状体横抓过去。……随着∈神音蘑菇咒←的猛烈冲撞,七只哈巴狗瞬间变成了由多如牛毛的古朴玉沫构成的片 片中灰色的,很像小子般的,有着尖细时尚质感的沥青状物体。随着沥青状物体的抖动旋转……只见其间又闪出一串青兰花色的泥浆状物体……接着蘑菇王子又让自己 忧郁深沉的脑袋奇闪出墨紫色的牛怪声,只见他缺乏锻炼的、好像木乃伊般精瘦的胸部中,飘然射出九团抖舞着☆变态转轮枪☆的尾巴状的铁砧,随着知知爵士的甩动 ,尾巴状的铁砧像瓜皮一样飘动。接着他念动咒语:“海湾嚷噎唷,神童嚷噎唷,海湾神童嚷噎唷……混天怪鸡!高人!高人!高人!”只见知知爵士的身影射出一片 墨紫色亮光,这时偏西方向酷酷地出现了二片厉声尖叫的亮黑色光狐,似奇影一样直奔墨紫色银光而来……。只听一声古怪虚幻的声音划过,五只很像刚健轻盈的身形 般的沥青状的片片闪光物体中,突然同时窜出五道整整齐齐的亮紫色飞沫,这些整整齐齐的亮紫色飞沫被光一窜,立刻化作闪耀的云丝,不一会儿这些云丝就飘浮着飘 向巨硕烟
高二化学水的电离和溶液的ph省名师优质课赛课获奖课件市赛课一等奖课件

三、水旳离子积常数
25℃时,纯水中H+和OH- 旳浓度均为10-7
mol/L
KW = C(H+)×C(OH-)= 1× 10-14
注意1: 250C时纯水中,H+和OH-旳浓度积 总是1×10-14,温度不变时,它是一种定值。
思索:假如升高温度Kw会怎样变化?为何?
分析:水旳电离是吸热旳,升高温度有利于水旳电离, 所以,水旳电离程度增长,H+和OH-旳浓度增长,所 以KW也是增大旳。
Ph 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
酸性
中性
碱性
注意:高浓度旳酸碱溶液,浓度较大,就不用
pH来表达,直接用浓度来表达。
七、课堂练习
思索并回答下列问题:
1、一定条件下 pH值越大,溶液旳酸性越强。 2、用pH值表达任何溶液旳酸碱性都很以便。 3、强酸溶液旳pH值一定大。 4、pH值等于6是一种弱酸体系。
3、碱性溶液:C(H+)<C(OH-)<1×10-7
注意: 在中性、酸性和碱性溶液中,均存在H+和 OH-,只是浓度旳不同而已。
在溶液中,H+旳浓度越大,溶液旳酸性就 越强;OH-旳浓度越大,溶液旳碱性就越强。
所以,我们表达溶液旳酸碱性,完全能够 用H+旳浓度来表达,但是,稀溶液中,H+旳浓度 旳值太小,表达起来很不以便。所以要找一种以 便旳表达措施。
水旳电离和溶液旳pH
一、知识及能力要点:
1、水旳电离和水旳离子积 2、影响水旳电离平衡旳原因 3、溶液旳酸碱性 4、有关pH旳简朴计算
二、水旳电离
1、水是极弱旳电解质,所以也存在电离平衡。
+
+
高二化学水的电离和溶液的pH知识精讲

高二化学水的电离和溶液的pH【本讲主要内容】水的电离和溶液的pH1. 水的电离平衡及其影响因素,离子积常数2. 溶液的酸碱性和pH3. 溶液pH的简单计算【知识掌握】【知识点精析】一. 水的电离1. 水的电离精确实验证明:水是一种极弱电解质,它能微弱的电离,生成H3O+和OH-。
水中存在电离平衡:H2O +H2O H3O++OH-或H2O H++OH-说明:水的电离有如下特点:①水分子和水分子之间的相互作用而引起电离的发生。
②极难电离,通常只有极少数的水分子发生电离。
③水分子电离出的H+和OH-数目相等。
④水的电离过程是可逆的,吸热的。
2. 水的离子积(1)实验测得:在25℃时,1L纯水中(即55.56mol/L)只有1×10-7mol/L H2O发生电离。
则水中①C(H+)=1×10-7mol/L ②C(OH-)=1×10-7mol/L ③C(H+)=C(OH-)=1×10-7水的离子积定义:在一定温度时,水中C(H+)与C(OH-)的乘积是一个常数,称之为水的离子积常数(写作K W),简称为水的离子积。
即K W=C(H+)×C(OH-)在25°C时,有C(H+)=C(OH-)=1×10-7,K W=1×10-14在100°C时,有C(H+)=C(OH-)=1×10-6,K W=1×10-12说明:任何水溶液中均存在着水的电离平衡,即任何水溶液中均存在着C(H+)与C(OH-)。
水的离子积是水电离平衡时具有的性质,不仅适用于纯水,也适用于其他稀水溶液。
如酸、碱、盐溶液中都有K W=C(H+)×C(OH-)=1×10-14(常温)。
其中C(H+)、C(OH -)均代表整个溶液中的C(H+)和C(OH-)。
①在酸溶液中,C(H+)近似看成是酸电离出来的H+浓度,C(OH-)则来自于水的电离。
高二化学水的电离和溶液的酸碱性试题答案及解析

高二化学水的电离和溶液的酸碱性试题答案及解析1.下列说法正确的是()A.水的电离方程式:H2O H++OH-B.升高温度,水的电离程度增大C.在NaOH溶液中没有H+,在HCl溶液中没有OH-D.纯水中c(H+)=10-7 mol·L-1【答案】B【解析】水是极弱的电解质,只有少部分电离,应用“”表示,故A错;水的电离是吸热的,所以升高温度,电离程度增大,B正确;在NaOH溶液中c(OH-)>c(H+),在HCl溶液中c(OH-)<c(H+),在酸碱溶液中都同时存在H+、OH-,所以C错;在常温下,纯水中c(H+)=10-7 mol·L-1。
【考点】水的电离溶液的酸碱性2.有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测:(1)该学生的操作是(填“正确的”或“错误的”),其理由是。
(2)若用此方法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是,原因是。
(3)该学生以上述方式测定下列溶液的pH,无误差的是()A.NaOH B.CH3COONa C.NaCl D.NaHSO4【答案】(1)错误的润湿后,稀释了原溶液,使其浓度减小,导致测量误差(2)盐酸盐酸是强电解质,醋酸是弱电解质,在溶液中存在CH3COOH CH3COO-+H+,稀释时平衡右移,继续电离出H+,稀释时Δc(H+)较小,ΔpH较小,故误差较小(3)C【解析】用pH试纸测定溶液酸碱性时,不能用水润湿。
若润湿,会使待测液浓度下降,结果出现误差。
但是用pH试纸测定中性溶液时,对结果一般没影响。
【考点】pH的计算3.(10分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。
下表是4种常见指示剂的变色范围:(1)该实验应选用作指示剂。
(2)右图表示50 mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为。
高二化学水的电离和溶液的酸碱性试题答案及解析

高二化学水的电离和溶液的酸碱性试题答案及解析1. 实验室现有3种酸碱指示剂,其pH 变色范围如下甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0 用0.100 0 mol·L -1 NaOH 溶液滴定未知浓度的CH 3COOH 溶液,反应恰好完全时,下列叙述中正确的是( )A .溶液呈中性,可选用甲基橙或酚酞作指示剂B .溶液呈中性,只能选用石蕊作指示剂C .溶液呈碱性,可选用甲基橙或酚酞作指示剂D .溶液呈碱性,只能选用酚酞作指示剂【答案】D【解析】 NaOH 溶液和CH 3COOH 溶液恰好反应生成CH 3COONa 时,CH 3COO -水解显碱性,而酚酞的变色范围为8.2~10.0,比较接近,因此答案为D 。
【考点】酸碱中和滴定2. 中和滴定实验中,标准NaOH 溶液的浓度通常用H 2C 2O 4·H 2O 为基准物质进行标定。
基准物质必须具备的条件:①物质纯度要高,②相对分子质量较大,③性质稳定,如不易分解、不风化、不潮解、不跟空气中的CO 2、O 2等反应。
实验室标定盐酸的浓度时,选择的基准物质最好是( ) A .NaOH B .NaHCO 3 C .Na 2CO 3 D .Na 2CO 3·10H 2O【答案】:C【解析】只有Na 2CO 3满足要求。
【考点】酸碱中和滴定3. (9分)下表是不同温度下水的离子积常数:(1)若25℃<t 1<t 2,则K W __________1×10-14(填“>”、“<”或“=”),判断的理由是 。
(2)25℃ 下,将pH =13的氢氧化钠溶液V 1 L 与pH =1的稀盐酸V 2 L 混合(设混合后溶液的体积为:V 1+V 2),所得混合溶液的pH =2,则V 1 : V 2=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”、“中性”或“碱性”),溶液中c(Na +) c(CH 3COO -)(填“>”、“=”或“<”)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、水的电离 3.利用Kw的定量计算
1)判断正误:
√ 1)任何水溶液中都存在水的电离平衡。 × 2)任何水溶液中(不论酸、碱或中性) 都存在Kw=10-14 。 × 3)某温度下,某液体c(H+)= 10-7mol/L,则该溶液一定是纯水。
2)0.01mol/L盐酸溶液中。 c(H+)、 c(OH-)分别为多少? 由水电离出的c(H+) H2O、 c(OH-) H2O分别是多少?为什么? 3)0.01mol/L NaOH溶液中. c(H+) 、 c(OH-)分别为多少? 由水电离出的c(H+) H2O、 c(OH-) H2O分别是多少?为什么?
碱性溶液
>7
溶液的pH值
酸 性 增 强 碱 性 增 强
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
100 10—1 10—2 10—3 10—4 10—5 10—6 10—7 10—8 10—9 10—10 10—11 10—12 10—13 10—14
pH值测定方法 测定方法:酸碱指示剂法、pH试纸法、pH计法等。
HA> HB > HC
溶液pH计算的类型 1、溶液稀释的pH计算 + (1)pH=1的H2SO4 1ml稀释至100ml,pH=? C(H ) 如何变化?C(OH - )如何变化? 对于强酸溶液( pH=a )每稀释10n倍, pH增大n 个单位,即pH=a+n
+
(2)pH=12的NaOH 1ml稀释至100ml ,pH=?C(H ) 如何变化?C(OH - )如何变化? 对于强碱溶液( pH=b )每稀释10n倍, pH减小n个 单位,即pH=a-n
讨论 1、某溶液中由水电离产生的c(H+) H O= 10-12 mol/L ,则该 溶液呈酸性还是碱性?并求算该溶液中 c(H+)的可能值 ?
2
解答: c(H+) H2O= c(OH-) H2O= 10-12 mol/L
若c(H+) aq= c(H+) HБайду номын сангаасO= 10-12 mol/L 则 c(OH-) 液显碱性
1、100℃时纯水的pH值为6,小于7,因而此时纯水呈酸性
2、10℃时纯水的pH值比60℃时纯水的pH值大 3、25℃相同物质的量浓度的NaOH溶液和盐酸的pH值之和为14 4、 25℃ pH=3的醋酸溶液中的[H+]与pH=11的氨水中[OH-]相等。 练习 HA、HB、HC三种浓度均为0.1mol/L的一元弱酸,HA溶液的 pH值为2.7,HB溶液中[OH-]=2×10-12mol/L,HC溶液中 [H+]/[OH-]的值为108。则三种酸由强到弱的顺序为________。
△pH≥2 时, pH混≈ pH大- 0.3
2、溶液混合的pH计算
(3)强酸与强碱混合
在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的NaOH 溶液混合后,溶液的pH值等于多少? NaOH+HCl=NaCl+H2O 0.04 0.06 在25℃时,100ml 0.4mol/L的盐酸与等体积0.6mol/L的NaOH 溶液混合后,溶液的pH值等于多少? NaOH+HCl=NaCl+H2O 0.06 0.04
例:将 pH=8的氢氧化钠溶液与 pH=10的氢氧化钠溶液等体积 混合后,溶液中的氢离子浓度最接近于 (D )
108 1010 A、 mol· L-1 2
B、
106 104 mol· L-1 2
C、(10-8+10-10)mol· L-1
D、2×10-10 mol· L-1
[OH-]=( 1 × 10—6 +1×10—4) / (1+1) = 5×10-5 mol/L pH=-lgKW/[OH—]
注意:对于中性水,尽管温度升高Kw增大,电 离程度增大,但仍是中性。 温度升高时Kw增大,所以说Kw时要强调温度。
练习
1.水的电离过程为H2O H+ + OH-,在不同温度下其离子积 为KW25℃=1×10-14, KW35℃ =2.1 ×10-14。则下列叙述正确的是: A、c(H+)随着温度的升高而降低 B、在35℃时,纯水中 c(H+) >c(OH-) C、水的电离常数K25 ℃ >K35 ℃ D、水的电离是一个吸热过程
1: 1 ; 中性。则V1:V2= _________ 把pH=11的NaOH溶液V1 和 pH=2的HCl溶液V2混合后,溶液呈 10:1 ; 中性。则V1:V2= _________ 把pH=13 的NaOH溶液V1 和 pH=2的HCl溶液V2混合后,溶液呈 1:10 ; 中性。则V1:V2= _________
aq=
10-2 mol/L 溶
若c(OH-) aq= c(OH-) H2O= 10-12 mol/L 则 c(H+) aq= 10-2 mol/L 溶 液显酸性
2、浓度均为0.1mol/L的下列溶液中由水电离出的 c(H+) H O大小关系为:①盐酸 ②醋酸溶液 ③硫 酸溶液 ④氢氧化钠溶液 ② > ① =④ > ③
酸碱指示剂一般是弱的有机酸或弱的有机碱,他们的颜 色变化是在一定的pH值范围内发生的。我们把指示剂发 生颜色变化的pH值范围叫做指示剂的变色范围。
pH 甲基橙 1 2 3 4 5 红色 橙 色 6 7 8 9 10 11 12 13 14 黄色
石蕊
酚酞
红色
无色
紫色
浅红色
蓝色
红色
3、有关pH简单计算 例题:计算pH=2的H2SO4溶液中H2SO4物质的量 浓度及溶液中OH- 的物质的量浓度。 判断:
2、溶液的酸碱性与pH
(1)溶液的pH :pH的数学表达式 pH=-㏒﹛c(H )﹜ 练习: 1、计算0.1mol/L的盐酸的pH。
+
2、 pH=12的NaOH溶液中c(H+)、c(OH-)分别为多少?
3、有甲、乙两种溶液,甲溶液的pH值是乙溶液的两倍, 则甲溶液中[H+]与乙溶液中[H+]的比值为 ( ) A、2∶1 B、100∶1 C、1∶100 D、无法确定
=-lg(10-14/ 5×10-5 ) =-lg(2×10-10 ) =10 - lg2 = 9.7 关键:抓住OH- 进行计算!再转化为H+
2、溶液混合的pH计算
(2)强碱与强碱混合
1、pH=13 的Ba(OH)2 溶液与pH=10的NaOH溶液体积比按 1∶3混合后的pH值______。 2、pH=13 的Ba(OH)2 溶液与pH=10的NaOH溶液体积比按 1∶1混合后的pH值______。 两种pH值不同的强碱等体积混合时
关键:
1、抓住氢离子进行计算!如果是碱则先求c(OH-), 再由Kw求c(H+) 2、当酸提供的c(H+)、c(OH-)很小时,不能忽略水电离 出的c(H+)、c(OH-)
练习
1、有相同pH的三种酸HX、HY、HZ的溶液,稀释相同倍数后, pH的变化值依次增大,则HX、HY、HZ的酸性由强到弱的顺 序是 ( )B A、HX. HY. HZ B、HZ. HY. HX C、HX. HZ. HY D、HY. HZ. HX 2、pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL, 其pH值与溶液体积V的关系如图所示。下列说法正确的是: A. A、B两酸溶液的物质的量浓度一定相等 C、D B. 稀释后,A溶液的酸性比B溶液强 pH C. a=5时,A是强酸,B是弱酸 7 a A D. 若A、B都是弱酸,则5>a>2 B
H2O的电离常数 K电离=
= 1.8×10-16
一、水的电离
2.水的离子积常数 Kw= c(H+) . c(OH-) 1)表达式:
KW 叫做水的离子积常数,简称水的离子积。
在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中 都是H+、OH-共存的。
任何水溶液中都存在Kw=c(H+) . c(OH-)
讨论:对常温下的纯水进行下列操作,完成下表:
加入试剂 酸碱 性 加 热
水的电离平 衡移动方向
c(H+) c(OH-) c(H+) 与c(OH-)
大小关系
中性
右 左 左
↑
↑
=
> <
HCl气体 NaOH
酸性
碱性
↑
↓
↓
↑
小结:加入酸或碱都抑制水的电离
定量分析:
实验测定:纯水中
25℃ c(H+)= c(OH-)=1×10-7mol/L 100℃ c(H+)= c(OH-)= 1×10-6mol/L
2 1
1000
V/mL
2、溶液混合的pH计算
(1)强酸与强酸混合
pH=2的盐酸和pH=4的盐酸溶液等体积混合后,所得溶液的 pH= 。
pH=2的盐酸和pH=5的硫酸溶液等体积混合后,所得溶液的 pH= 。
两种pH值不同的强酸等体积混合时 △pH≥2时, pH混≈ pH小+0.3
2、溶液混合的pH计算 (2)强碱与强碱混合
关键:酸过量抓住氢离子进行计算! 碱过量抓住氢氧跟离子进行计算!
2、溶液混合的pH计算
(4)强酸与强碱混合—— 一般中和
把pH=13的NaOH溶液与pH=2的硫酸溶液混合后,所得溶 1:10 液的pH=11,则NaOH溶液和硫酸溶液的体积之比为_____ 。 练习: 把pH=12 的NaOH溶液V1 和 pH=2的HCl溶液V2混合后,溶液呈
思考与交流: 1.将pH为5的硫酸溶液稀释100倍,稀释后溶液中 pH为多少? 无论是酸还是碱,无限稀释始终还是酸和碱 2、将pH为3的硫酸溶液和醋酸溶液同时稀释100倍, 稀释后二者的pH分别为多少? 弱酸弱碱稀释时,必须考虑弱酸弱碱的电离平衡。 3、现有失去标签,pH相等的两试剂瓶的NaOH溶 液和氨水,请你设计实验将其鉴别。
