DNA链获金纳米粒子晶体
金纳米粒子在生物医学中的应用

金纳米粒子在生物医学中的应用随着纳米技术的不断发展,金纳米粒子在医学领域应用逐渐广泛。
金纳米粒子不仅具有良好的可控性、生物相容性和生物吸附性,同时还具有高度的稳定性,并且能够通过表面修饰实现特定的生物识别和作用。
因此它成为了生物医学中的一种重要的纳米材料。
本文将介绍金纳米粒子在生物医学中的应用,主要包括生物成像、药物传输和生物识别等方面。
一、生物成像生物成像是一种无创性的诊断方法,通过对生物样本进行扫描、检测、记录等过程,获得有关其组织、器官、病变等信息。
金纳米粒子在生物成像中具有较好的应用前景,主要表现在以下几个方面:1. 磁共振成像金纳米粒子能够提供高对比度图像,因此是一种优秀的MRI(磁共振成像)对比剂。
通过修饰金纳米粒子的表面,可以实现靶向MRI成像,并且可根据不同的需要进行大小、形状等方面的调整。
2. CT成像金纳米粒子在CT(计算机断层成像)成像中也有很好的应用。
由于其高原子数,可以吸收X射线并提供强对比度图像,因此是一种适用于CT分析的滚动剂。
3. 光学成像金纳米粒子还可参与光学成像。
通过修饰金纳米粒子的表面,可以实现生物标记物的高灵敏度检测,并且其显色性质也可以在界面材料的自组装过程中得到应用。
二、药物传输金纳米粒子在药物传输方面的应用是其最为突出的特点之一。
金纳米粒子具有的较大比表面积和高度的稳定性,可以实现在溶液中有效载药和靶向传输,从而实现更精确、高效和安全的药物治疗。
1. 去除药物毒副作用传统的药物治疗常常存在毒副作用,纳米粒子则可以通过改变药物的释放率、靶向性和固定化等过程来减少这些副作用。
例如,纳米粒子可以被控制在一个靶向生物材料中,并将药物放置在特定的位置上,从而实现精确的治疗效果。
2. 生物膜透过生物样品表面通常具有一定的惰性和选择性,使得药物的转运和分布变得更为麻烦。
金纳米粒子则可以通过薄膜渗透和微管道扩散,实现有效的药物输送和固定化。
三、生物识别金纳米粒子的表面特征和改变其表面化学功能的能力,使其成为进行生物识别的一种理想纳米材料。
14.1 DNA功能化的金纳米粒子及其应用

DNA功能化的金纳米粒子1 DNA功能化的金纳米粒子及其应用用DNA分子修饰无机纳米粒子为其在传感,药物和基因传输,光学和能源领域的应用带来了新的机遇。
同时利用DNA对纳米颗粒间相互作用的控制,基于DNA的平台也能为构建复杂纳米粒子组装结构提供灵活性和多样性。
DNA金纳米粒子复合物(DNA-AuNPs)是一种纳米生物复合物,由内层的纳米粒子和外层的DNA组成,起到了连接生物体系和纳米材料的作用。
上世纪九十年代中期,Mirkin研究组和Alivisatos研究组在他们的开创性工作中,首次报道了DNA功能化的金纳米粒子体系。
Mirkin等人合成了13 nm的金纳米粒子(在溶液中呈现均一的红色,紫外吸收峰波长为520 nm),然后将末端为巯基修饰的DNA通过S-Au化学键相互作用固定到金纳米粒子表面得到DNA.金纳米粒子复合物(图1.9),后来他们将这种复合物重新命名为球形核酸(spherical nucleic acid,SNA)。
由于这种DNA修饰的金纳米粒子复合物既具有金纳米粒子的光学和物理化学特性,又具有DNA分子的可编程特性和生物特性,自从Mirkin等人的开创性工作发表以来,DNA功能化的金纳米粒子发展应用迅速,已经被广泛应用于生物传感,离子检测,核酸比色检测,金纳米粒子结晶组装,生物成像等领域。
图1.9 Spherical nucleic acid(SNA) conjugates.1.1 DNA功能化的金纳米粒子在核酸检测中的应用基因突变的检测可以为诊断提供重要的目树,使人们对用于包括癌症在内的许多疾病早期诊断的核酸检测越来越感兴趣。
荧光和放射性检测读出方法(如PCR,PT-PCR,分子印迹法,以及高密度微阵列法等)是传统的核酸检测方法。
金纳米粒子比色法已经被证明是核酸目标链检测方面的一种极具竞争力的检测技术。
在金纳米粒子比色法中,待检测目标物直接或者间接的引发金纳米粒子聚集,并且导致金纳米粒子的吸收波长在可见光区域内发生红移。
生物DNA调控生长出金纳米花

粒具有不 同的光学吸收性能 ,其在光谱中 显示为不 同特征曲线 ,因此可以用 它获得
实时和多功能的医学光谱影像 。
旅韩 中国学者马兴毅博士作为主要研
获得 了该 成果 。
控合成出具有特定分枝数量 的星状纳米颗
母形态的金纳米颗粒 ;另一些原核细胞 中
粒; 一些原核细胞质粒 D N A调控合成 出水 究者之一 ,与韩 国和美国的研究人员共 同
性。
分 校科 学家合作 ,首次 3 D打 印出受热收 缩 的全新超材料。这个新型结构在降温后 制作温度变化较大环境 中所需要的精密操
MI T力 学 工程 教 授方 绚 莱带 领 的研究
团队承担了该研究 的 3 D打印部分 的工作。 示 ,他们采用 的是显微立体光刻 3 D打印
还可恢复之前体积 ,能反复使用 ,适用于 方绚莱在接受科技 日 报记者邮件采访 中表 作部件 ,如微芯片和高精光学仪器等。
的质粒 D N A则调控合成出金纳米花 , 花瓣
热胀冷缩 ?超材料受热竟收缩 !
“ 热胀冷缩”一词或将改写。美 国劳 伦斯利物莫尔国家实验室 ( Ⅱ. N L) 发布公 告 称 ,该 实验 室工程 师和麻省 理工学 院 ( M I T)、南加州大学 、加州大学洛杉矶 个部分 , 因不同材料受热时相对位移不 同, 使得连接点处向内拉伸 ,带动整个 晶格结 构向内拉伸 , 从而表现 出独有的热收缩特
为受 热膨胀 、遇冷收缩 ,而这次获得的超 材料完全相反 ,它在受热时会收缩。该材
料是用聚酯和另一种掺杂铜的聚酯打印出 来的微 晶格结构 ,包含横梁和空心点阵两
・
技术 ,类似喷墨打印机和数字曝光机 的结
口上 ,再通过数字投影机把图案分别投射 在需要 固化的液滴背面。被光照过的区域 就形成 固体片状结构 ,附着在一个样 品支
3.7 金纳米粒子的合成方法

1 金纳米粒子的合成方法1.1 物理法物理法即采用高能消耗的方式将块体金细化成为纳米级小颗粒,主要包括块状固体粉碎法(又称为磨球法或机械研磨法)、气相法、电弧法、金属蒸汽溶剂化法、辐照分解和热分解等。
辐照分解包括近红外辐照和紫外辐照。
近红外辐照通过使硫醇包裹的纳米粒子的粒径变大,从而可以获得粒径较大的金纳米粒子;紫外辐照通过影响种子和胶束的协同作用,从而控制金纳米粒子的合成。
另外,激光消融通过对温度、反应器位置、异丙醇用量、超声场等实验条件的控制,可以合成形貌,粒径不同的金纳米粒子。
总之,金纳米粒子合成的关键在于同时精确地控制其尺寸和形貌。
通过物理法制备的金纳米粒子虽然纯度较高,但其产量低下,设备成本极高。
1.2 化学法化学法主要是以金盐为原料,利用还原反应生成金纳米粒子,在形成过程中通过控制粒子的生长从而控制其尺寸。
化学法主要包括水相氧化还原法、相转移法(主要为Brust法)、晶种生长法(又称种金生长法)、模板法、反相胶束法、湿化学合成法、电化学法、光化学法。
相对物理法而言,化学法制备金纳米粒子所得到的产物粒径均匀、稳定性高,并且易于控制形貌,是最为方便和经济的方法。
1.2.1 水相氧化还原法水相氧化还原法合成金纳米粒子主要是指在含有Au3+的溶液中,利用适当的还原剂(例如鞣酸,柠檬酸等,还原剂的选择根据所要合成的金纳米粒子的粒径而定),将Au3+还原成零价,从而聚集成粒径为纳米级的金纳米粒子。
常见的方法有AA还原法、白磷还原法、柠檬酸钠还原法和鞣酸-柠檬酸钠还原法。
制备粒径在5~12nm的金纳米粒子,一般采用AA还原或白磷还原HAuCl4溶液;制备粒径在大于12nm的金纳米粒子,则采用柠檬酸钠还原HAuCl4溶液。
柠檬酸钠法还原Au3+合成金纳米粒子是最早且应用最为广泛的方法。
1951年,Turkevitch首次报道了柠檬酸钠还原HAuCl4溶液的方法制备金纳米粒子,其粒径分布在20nm左右。
纳米金的应用

纳米金的应用拓少杰(陕西理工学院化学与环境科学学院应用化学1202班,陕西汉中723001)指导教师:吴睿[摘要]纳米金作为纳米家族的重要成员,除了具有纳米材料的一般性质外,还具有良好的光学特性、生物相容性及催化活性等独特的物理、化学性质。
纳米金这些特殊的性质,使其在化学、生物、医药、食品等领域具有广泛的应用。
本文重点就纳米金在食品安全检测领域、生物医药领域的应用作了详细综述,并对其未来的发展进行了展望。
[关键词]纳米金;应用;食品安全检测;生物医学The application of gold nanoparticlesShaojie Tuo(Grade 12, Class 1202, Major in Applied Chemistry, School of Chemical & Environment science, Shaanxi University of Technology, Hanzhong 723001, Shaanxi)Tutor: Rui WuAbstract: As an important member of the nanoparticle family, gold nanoparticles have the general properties of nanometer materials and other good unique physical and chemical properties such as optical properties, biocompatibility, catalytic activity. Gold nanoparticles have a wide range of applications in the chemical, biomedicine, food and other fields. Based on these special properties, we mainly reviewed the application of gold nanoparticles in the field of Food safety inspection and biomedicine, as well as the development in the future was prospected.Key words: gold nanoparticles; application; Food safety inspection; biomedicine引言纳米材料是指三维空间中至少有一维处于纳米尺度范围或由它们作为基本单元构成的材料[1]。
金纳米粒子用于DNA检测
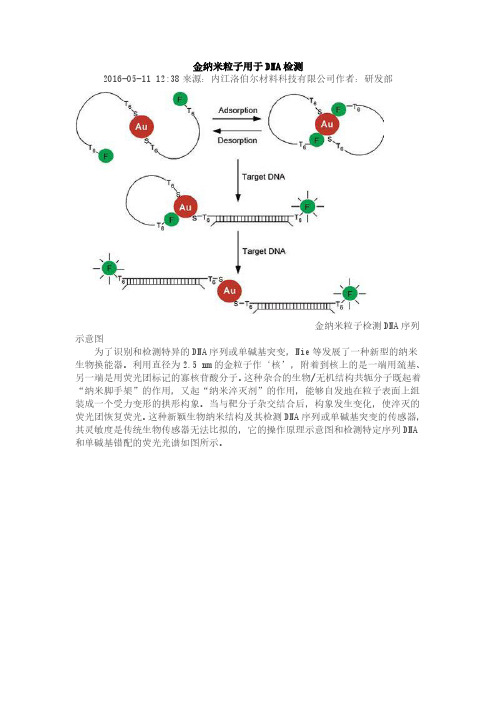
金纳米粒子用于DNA检测
2016-05-11 12:38来源:内江洛伯尔材料科技有限公司作者:研发部
金纳米粒子检测DNA序列示意图
为了识别和检测特异的DNA序列或单碱基突变,Nie等发展了一种新型的纳米生物换能器。
利用直径为2.5 nm的金粒子作‘核’,附着到核上的是一端用巯基、另一端是用荧光团标记的寡核苷酸分子。
这种杂合的生物/无机结构共轭分子既起着“纳米脚手架”的作用,又起“纳米淬灭剂”的作用,能够自发地在粒子表面上组装成一个受力变形的拱形构象。
当与靶分子杂交结合后,构象发生变化,使淬灭的荧光团恢复荧光。
这种新颖生物纳米结构及其检测DNA序列或单碱基突变的传感器,其灵敏度是传统生物传感器无法比拟的,它的操作原理示意图和检测特定序列DNA 和单碱基错配的荧光光谱如图所示。
-世界最黑材料可吸收99_9_光线
-----------------------------------Docin Choose -----------------------------------豆 丁 推 荐↓精 品 文 档The Best Literature----------------------------------The Best Literature定剂,采用凝胶自燃烧法制备了Bi0.5Na0.5TiO3超细粉体,平均粒径为40 nm。
(2) 合成的超细粉体在600 ℃保温2 h即可获得晶相单一的立方钙钛矿结构BNT纳米粉。
(3) 用所合成的粉末压片,1 125 ℃烧结2 h即可获得致密的烧结体,其相对密度较传统的固相法和sol-gel法等所得陶瓷密度有所增加,可得到98.1%的理论密度,SEM观察陶瓷颗粒的平均粒径为2 µm。
参考文献:[1] 电子信息材料咨询研究组. 电子信息材料咨询报告 [M]. 北京: 电子工业出版社, 2000.[2] 肖定全.压电、热释电与铁电材料 [M].天津: 天津大学出版社, 2000.[3] 尹奇异, 廖运文. 无铅压电陶瓷的器件应用分析 [J]. 压电与声光, 2006,28(2): 164-166.[4] 肖定全, 赁敦敏. 新型无铅压电陶瓷的研制 [J]. 电子元件与材料, 2004,23(11): 13-15. [5] 苏鑫明, 张梅. (Bi0.5Na0.5)TiO3(BNT)基无铅压电陶瓷研究进展 [J].材料导报, 2006, 20(5): 37-40.[6] 肖定全, 赁敦敏. Bi0.5Na0.5TiO3基A位多重复合无铅压电陶瓷的研制[J].高技术通讯, 2005, 15(5): 54-5.[7] 赁敦敏, 肖定全. Bi0.5(Na1–x–y K x Li y)0.5TiO3陶瓷的介电性能与微观结构[J].电子元件与材料, 2004, 23(11): 22-27.[8] 杜鹃, 王矜奉. Bi过量和Mn掺杂的钛酸铋钠基无铅压电陶瓷 [J]. 电子元件与材料, 2006, 25(4): 1-3.[9] 李月明, 陈文. Na0.5Bi0.5TiO3-K0.5Bi0.5TiO3系无铅压电陶瓷的制备工艺研究 [J]. 陶瓷学报, 2004, 25(1): 6-10.[10] 廖运文, 赁敦敏. 高性能无铅压电陶瓷(Na0.5Bi0.5)0.94Ba0.06TiO3的制备与性能 [J]. 功能材料, 2006, 37(6): 886-892.[11] 赵明磊, 王春雷. Sol-gel法制备Bi0.5 Na0.5 TiO3陶瓷其电学特性 [J].物理学报, 2004, 53(1): 229-232.[12] 鄢洪建, 肖定全. 柠檬酸盐法制备(Bi0.5Na0.5)0.94Ba0.06TiO3无铅压电陶瓷的研究 [J]. 高技术通讯, 2004, 5: 5-8.[13] 朱刚强, 苗鸿雁. 纳米Na0.5Bi0.5TiO3粉体的水热合成研究 [J]. 陕西科技大学学报, 2005, 23(2): 27-31.[14] 王燕. Bi1/2Na1/2TiO3基无铅压电陶瓷的水热合成、结构与性能研究 [D].武汉: 武汉理工大学, 2005.[15] 史慧. Sol-gel法制备(NaBi)1/2TiO3压电陶瓷及性能分析 [D]. 北京: 清华大学, 2004.(编辑:曾革)ÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑÑ美利用DNA链获得金纳米粒子晶体美国科学家1月31日表示,他们借助DNA链成功地获得了由金纳米粒子构成的3维晶体结构,在新出版的《自然》杂志封面文章中,科学家称,利用该技术能构建各种具有特殊性质的晶体物质,并可广泛用于医学、光学、电子或催化领域。
金纳米颗粒dna环化

金纳米颗粒dna环化
金纳米颗粒DNA环化是指将金纳米颗粒与DNA相互作用,
形成一种特定的结构。
金纳米颗粒具有特殊的光学、电学和磁学性质,在医学、生物学和材料科学等领域有着重要的应用。
金纳米颗粒DNA环化的过程通常包括以下步骤:
1. DNA修饰:将金纳米颗粒表面修饰功能化分子,例如,亲
水分子或亲疏水分子,以调控金纳米颗粒与DNA的相互作用。
2. DNA吸附:将DNA溶液与金纳米颗粒接触,利用DNA的
亲合性使其吸附在金纳米颗粒表面。
3. 链接:通过DNA链来连接金纳米颗粒,形成DNA环化结构,使其相互连接成链状。
4. 稳定性调节:通过控制DNA链的长度和序列,以及金纳米
颗粒表面的修饰分子,调节DNA环化结构的稳定性。
金纳米颗粒DNA环化可以用于制备具有可控结构和性质的纳
米材料,例如,纳米电路、纳米催化剂、纳米传感器等。
此外,金纳米颗粒DNA环化还可以用于基因诊断、药物传递和生物
成像等领域的研究和应用。
dna金属化 方法

dna金属化方法DNA金属化是一种独特的技术,它将DNA与金属结合起来,产生一种新的材料,具有极好的导电性和化学稳定性,这种新材料可以应用于许多领域,如传感器、电子器件、生物医学等。
DNA金属化的原理DNA金属化的原理是将DNA与金属离子配合,形成一种DNA-金属复合物,这种复合物可以通过化学还原或电化学还原的方法,将金属离子还原成金属纳米粒子,从而形成DNA-金属纳米复合物。
DNA金属化的方法DNA金属化的方法包括化学还原法和电化学还原法。
化学还原法:将DNA与金属离子混合,加入还原剂,如氢气、氢氧化钠等,使金属离子还原成金属纳米粒子,从而形成DNA-金属纳米复合物。
电化学还原法:将DNA与金属离子放置于电解质中,通过施加电压,使金属离子还原成金属纳米粒子,从而形成DNA-金属纳米复合物。
DNA金属化的应用DNA金属化的应用非常广泛,如下:1. 传感器:DNA金属化材料可以制成高灵敏度的传感器,用于检测环境中的污染物质、生物分子等。
2. 电子器件:DNA金属化材料可以制成高性能的电子器件,如场效应晶体管、发光二极管等。
3. 生物医学:DNA金属化材料可以用于制备生物医学材料,如人工心脏瓣膜、人工血管等。
DNA金属化的优势DNA金属化具有许多优势,如下:1. 优异的导电性:DNA金属化材料具有极好的导电性,可以应用于电子器件和传感器等领域。
2. 高度的化学稳定性:DNA金属化材料具有高度的化学稳定性,可以在广泛的环境条件下使用。
3. 生物相容性:DNA金属化材料具有良好的生物相容性,可以用于生物医学领域。
结论DNA金属化是一种非常有前途的技术,它将DNA与金属结合起来,产生一种新的材料,具有极好的导电性和化学稳定性,可以应用于许多领域,如传感器、电子器件、生物医学等。
随着技术的不断发展,DNA金属化材料的应用前景将会越来越广阔。
《金属和生物分子DNA传感器的设计与构建》范文

《金属和生物分子DNA传感器的设计与构建》篇一一、引言随着生物技术的飞速发展,生物传感器已成为科研领域的重要工具。
其中,DNA传感器以其高灵敏度、高特异性及非侵入性等特点,在生物医学、环境监测、药物研发等领域具有广泛的应用前景。
本文将重点探讨金属和生物分子在DNA传感器设计与构建中的应用,以及其在现代科学研究中的重要性。
二、金属在DNA传感器中的应用金属元素在生物传感器中扮演着重要的角色,尤其是贵金属如金、银和铂等。
这些金属可以用于制备电极材料,通过与DNA 分子的相互作用,实现信号的转换和放大。
首先,金属纳米材料具有优异的导电性能和生物相容性,可以有效地提高DNA传感器的灵敏度和稳定性。
例如,金纳米粒子可以用于制备高灵敏度的电化学DNA传感器,通过捕获目标DNA并产生电流信号,实现对目标DNA的检测。
其次,金属还可以与DNA分子形成特定的配位作用,提高传感器的选择性。
例如,银离子可以与DNA中的磷酸基团形成配位键,从而增强传感器对特定序列DNA的识别能力。
三、生物分子在DNA传感器中的应用生物分子如蛋白质、酶和抗体等在DNA传感器中发挥着关键作用。
这些生物分子具有高度的特异性和亲和力,可以与DNA 分子进行精确的相互作用,从而提高传感器的性能。
首先,蛋白质和酶可以用于构建酶联免疫吸附反应(ELISA)等生物分析方法。
这些方法通过蛋白质-DNA或酶-DNA的相互作用来检测特定序列的DNA。
此外,还可以利用DNA适体或肽核酸等人工合成的核酸类似物作为识别元件,进一步提高传感器的灵敏度和选择性。
其次,抗体作为一种重要的生物分子,可以与特定的DNA 序列进行高亲和力的结合。
基于抗体的DNA传感器具有高特异性、高灵敏度和低背景信号等特点,被广泛应用于疾病诊断、药物研发等领域。
四、金属和生物分子DNA传感器的设计与构建金属和生物分子的结合为DNA传感器的设计与构建提供了丰富的可能性。
以下是一个典型的金属和生物分子DNA传感器的设计与构建过程:首先,根据需要检测的DNA序列,设计并合成特定的探针DNA分子。
《金纳米颗粒和生物分子的相互作用》

《金纳米颗粒和生物分子的相互作用》篇一一、引言金纳米颗粒(AuNPs)作为一种重要的纳米材料,因其独特的物理和化学性质,在生物医学、药物传递、生物传感等领域有着广泛的应用。
近年来,金纳米颗粒与生物分子的相互作用成为了研究的热点,这主要源于其在生物检测、诊断和治疗等方面的潜在应用价值。
本文将详细探讨金纳米颗粒与生物分子的相互作用机制及其应用。
二、金纳米颗粒的基本性质金纳米颗粒(AuNPs)是指尺寸在纳米尺度的金粒子,其具有独特的物理和化学性质。
金纳米颗粒的表面具有较高的反应活性,能够与多种生物分子发生相互作用。
此外,金纳米颗粒的光学性质也十分独特,能够在特定波长的光激发下产生表面增强拉曼散射(SERS)效应,这一特性使得金纳米颗粒在生物传感和检测方面具有广泛应用。
三、金纳米颗粒与生物分子的相互作用机制金纳米颗粒与生物分子的相互作用主要涉及静电作用、配体交换、生物识别等机制。
首先,金纳米颗粒的表面通常带有电荷,能够与带有相反电荷的生物分子通过静电作用相结合。
其次,金纳米颗粒表面的配体可以与生物分子发生配体交换,从而实现金纳米颗粒与生物分子的连接。
此外,生物分子之间的识别作用,如抗体与抗原的特异性结合,也可以用于金纳米颗粒与生物分子的连接。
四、金纳米颗粒与生物分子的相互作用应用1. 生物检测与诊断:金纳米颗粒与生物分子的相互作用可用于生物检测和诊断。
例如,通过将特异性抗体修饰在金纳米颗粒表面,可以实现对目标抗原的快速检测。
此外,金纳米颗粒的SERS效应也可用于生物分子的高灵敏度检测。
2. 药物传递:金纳米颗粒可以作为药物传递的载体,通过与生物分子的相互作用将药物传递到靶点。
例如,将抗癌药物与金纳米颗粒结合,通过特异性识别肿瘤细胞表面的生物分子,实现药物的精准传递。
3. 生物成像:金纳米颗粒具有较高的光学性质,可用于生物成像。
通过将金纳米颗粒与荧光染料等生物分子结合,可以实现高分辨率的生物成像。
五、结论金纳米颗粒与生物分子的相互作用具有广泛的应用前景。
《DNA功能化纳米探针的设计及在miRNA检测中的应用》范文

《DNA功能化纳米探针的设计及在miRNA检测中的应用》篇一一、引言随着纳米科技的飞速发展,DNA功能化纳米探针因其独特的生物相容性和高灵敏度在生物医学领域得到了广泛应用。
特别是在miRNA(微小RNA)检测方面,DNA功能化纳米探针的研发和应用更是推动了精准医疗和疾病早期诊断的进步。
本文将重点介绍DNA功能化纳米探针的设计原理及其在miRNA检测中的应用。
二、DNA功能化纳米探针的设计原理1. 纳米材料选择DNA功能化纳米探针通常以纳米材料为载体,如金纳米粒子、量子点、碳纳米管等。
这些材料具有优异的物理化学性质和生物相容性,可有效提高探针的灵敏度和稳定性。
2. DNA分子修饰在纳米材料表面修饰DNA分子是设计DNA功能化纳米探针的关键步骤。
通过化学或生物方法将DNA分子固定在纳米材料表面,形成稳定的结合体系。
修饰的DNA分子需具备高度特异性,以实现靶标miRNA的精确识别。
3. 探针结构设计DNA功能化纳米探针的结构设计需考虑其与靶标miRNA的结合能力、信号放大机制以及生物相容性等因素。
常见的结构设计包括发夹结构、链置换扩增结构等,这些结构能够在识别miRNA后引发信号放大,提高检测灵敏度。
三、DNA功能化纳米探针在miRNA检测中的应用1. 疾病诊断miRNA在多种疾病的发生、发展过程中发挥重要作用,因此其表达水平的检测对于疾病的早期诊断具有重要意义。
通过设计针对特定miRNA的DNA功能化纳米探针,可实现高灵敏度和高特异性的miRNA检测,为疾病的早期诊断提供有力支持。
2. 药物研发在药物研发过程中,需要对药物的作用机制进行深入研究。
DNA功能化纳米探针可用于监测药物对miRNA表达水平的影响,从而评估药物的治疗效果和副作用。
这有助于加速药物研发进程,提高药物研发效率。
3. 生物标志物研究miRNA可作为生物标志物,用于评估疾病的预后和复发风险。
DNA功能化纳米探针的高灵敏度和高特异性使其成为研究miRNA生物标志物的有力工具。
黄金化身癌症“信号灯”

癌症通常是由于基因发生突变,造成细胞发生癌变引起的疾病,同时也是一种让人“闻之色变”的疾病,因此许多人非常想知道自己是否患癌。
但要想提前检测出是否患癌,往往需要借助基因测序等设备,不仅操作复杂,成本还高。
根据一项新研究,使用比较容易获得的纳米金颗粒可以简单而快速地检测出是否患癌。
DNA甲基化是DNA化学修饰的一种形式,能在不改变DNA序列的前提下,影响基因表达的方式。
研究人员从DNA甲基化入手发现,癌细胞的DNA甲基化模式和正常细胞不同,癌症的DNA甲基化往往出现在某个特定的基因区域,而正常细胞的DNA甲基化在整个基因组分布得更加均匀。
不同的甲基化模型造成了不同结果:癌细胞DNA甲基化后,双螺旋结构的DNA会被折叠成和纳米黄金有强亲和力的三维结构,还会使黄金颗粒变色;而正常细胞DNA折叠成的结构不会使黄金颗粒变色。
之后,研究人员还对癌症患者和健康人的200个细胞样本进行了测试,发现这种方法在检测癌症方面的准确率可高达90%!不过,这种方法目前只能检测癌症的存在与否,并不能测出癌症的类型。
“将黄金作为癌症的标记是很有趣的事情,如果这项技术得到发展,黄金将不再是普通的贵金属,它将成为癌症的‘信号灯’。
”研究人员兴奋地说。
7月份的爱尔兰布鲁纳不像往常一样潮湿,它正经历一场历史性的干旱。
罕见的热浪和干燥虽然闷热难耐,但无法阻止研究人员对布鲁纳的探索。
他们一如既往地控制着无人机飞跃布鲁纳,看看在这个区域是否会有新发现。
“看!那是什么?”正在观察无人机拍摄画面的研究人员震惊地对他的朋友说。
只见画面中,布鲁纳的一个麦田里出现了一个直径超过150米的圆形轮廓,圆形轮廓的外围又由一个个小圆形组成。
“它几乎是凭空出现的。
”研究人员说,因为无人机曾多次拍摄过这片区域,但都没有发现它。
经考古学家证实,这是一个未知而古老的巨石阵的遗迹,它可能已经有5000年的历史了。
那为什么这个古老的巨石阵的遗迹到现在才凭空出现呢?原来,外围的小圆形是地面上放置柱子时形成的。
DNA纳米技术

DNA纳米技术(DNA Nanotechnology)概念DNA纳米技术专门研究利用脱氧核糖核酸或其他核酸的分子性质(如自组装的特性),来建构出可操控的新型纳米尺度结构或机械。
在这个领域,核酸被用作非生物的材料而不是在活细胞中那样作为遗传信息的载体。
严格的核酸碱基配对法则(使链上特定的碱基列相互连接以形成牢固的双螺旋结构)使这一技术成为可能。
这一技术允许合理的碱基链设计,从而严格地组合形成具有精密控制的纳米级特性的复杂的目标结构。
脱氧核糖核酸是常使用的优势材料,但包括其他核酸如核糖核酸和肽核酸也被用来构造结构,所以偶尔也用“核酸纳米技术”来概括这个领域。
发展DNA纳米技术概念的基础最先由纳德里安·西曼(Nadrian Seeman)在1980年代早期阐述,在2000年后开始引起广泛的关注。
这一领域的研究者已经构建了静止结构如二维和三维晶体结构、毫微管、多面体和其他任意的造型;和功能结构如纳米机器和DNA计算机。
一些组建方法被用来构建拼装结构、折叠结构和动态可重构结构。
现在,这种科技开始被用作解决在结构生物学和生物物理学中基础科学问题的工具;同时也被应用在结晶学和光谱学中来测定蛋白质结构。
这项技术在分子电子学和纳米医学中的应用仍在研究中。
历史莫里茨·科内利斯·埃舍尔的木刻作品《Depth》,据说这幅画启发了西曼想到用DNA三维晶格为难结晶分子标定方向,这导致了DNA纳米技术的开始。
DNA纳米技术概念的基础最先由纳德里安·西曼在八十年代早期阐述。
西曼的最初目的是创建一个三维的DNA晶格为其他大分子确定方向,这将去除获得纯净晶体的复杂过程,简化晶体学研究。
据说他在意识到莫里茨·科内利斯·埃舍尔的木刻Depth与大批的六节点DNA间的共同点后,产生了这个想法。
在当时,一些自然地有分支的DNA结构已被人们知晓包括复制叉和可移动的霍利迪交叉,但西曼认为不可动的核酸节点可以通过正确的碱基序列设计消除组合分子的对称性来制造。
金纳米粒子组装体的连续离散型纳米结构控制

金纳米粒子组装体的连续离散型纳米结构控制金萍;代昭;郭文娟;陈广平【摘要】采用柠檬酸钠还原氯金酸的方法,制备出粒径均一的金纳米粒子(AuNPs),通过加入二水合双(对-磺酰苯基)苯基膦化二钾盐(BSPP),增强了AuNPs体系的分散性与稳定性.选用直径为15和40 nm的AuNPs,用不同序列巯基修饰的单链DNA连接到其表面,通过DNA链的杂交,形成不同结构的金纳米粒子组装体.通过改变加入DNA延长连接单元的比例,可以控制金纳米粒子组装体具有连续离散型的1∶1,2∶1和3∶1纳米结构.【期刊名称】《高等学校化学学报》【年(卷),期】2015(036)005【总页数】6页(P844-849)【关键词】金纳米粒子;DNA连接体;组装体;纳米结构【作者】金萍;代昭;郭文娟;陈广平【作者单位】天津工业大学环境与化学工程学院,天津300387;天津工业大学环境与化学工程学院,天津300387;天津工业大学环境与化学工程学院,天津300387;Department of Physiological Science,College of Veterinary Medicine, Oklahoma State University, Stillwater OK 74078, USA【正文语种】中文【中图分类】O614金纳米粒子(AuNPs)具有独特的光、电性质和良好的化学稳定性、催化活性及生物亲和性等[1], 在表面增强拉曼散射[2]、催化[3]、电化学[4,5]、离子检测[6,7]、医疗诊断[8]和生物传感器[9]等领域发挥着日益重要的作用. 近年来, 越来越多的研究致力于构建不同结构类型的AuNPs组装体并研究其光电性质, 以进一步探索AuNPs在纳米科学中的应用[10,11]. 其中, DNA由于遵循严格的Waston-Crick碱基互补配对原则, 具备可预测的链杂交、清晰的双螺旋结构、柔韧的结合刚度和灵活性及可选择的自组装及可编程的优良特性, 被作为连接单元使用于纳米结构的构建中[12,13].目前, 使用杂交双链DNA作为连接单元是制备AuNPs组装体的常用方法, 这主要是利用巯基极易与AuNPs作用的特点, 使用2条巯基修饰且碱基序列互补的单链DNA分别与AuNPs连接, 再通过DNA的杂交作用形成AuNPs组装体. 但由于AuNPs表面拥有多个可以与巯基DNA连接的位点, 且以柠檬酸钠还原制备的AuNPs在水相中较容易由于离心、水洗等作用失去其表面的柠檬酸根负离子而稳定性变差, 导致AuNPs之间容易聚集, DNA与AuNPs之间的连接率偏低, 因此所得的AuNPs组装体一般是拥有多种纳米结构的混合物[14,15] , 若要得到某种单一纳米结构的组装体需要使用电泳[16]或高效液相色谱[17]等方法进行分离. 目前, 制备具有单一甚至连续离散型纳米结构(即金纳米粒子之间以1∶1, 1∶2, 1∶3这类连续离散型纳米结构存在)的AuNPs组装体成为研究热点之一[15~18]. 本课题组曾以固相有机合成为基础, 使用不对称合成法成功控制了单个无机纳米粒子(AuNPs与CdTe量子点)仅与一条单链DNA相连[19], 但这种方法需要对聚合物载体表面进行控制, 过程复杂.本文提出了一种更简单的对AuNPs组装体的纳米结构进行连续离散型控制的方法. 即首先使用分子较大的二水合双(对-磺酰苯基)苯基膦化二钾盐(BSPP)替代柠檬酸根作为AuNPs的新型配体和稳定剂, BSPP能与AuNPs形成较稳定的配体结构,极大地增强了AuNPs在水中的分散性[20], 随后引入一段双链DNA作为延长连接单元而不是采用直接杂交连接的方式将2种不同粒径(15与40 nm)的AuNPs连接起来, 在精确控制延长连接单元投入量的情况下, 获得了具有连续纳米结构的AuNPs组装体.1.1 试剂与仪器乙二胺四乙酸、硼酸、柠檬酸钠和氯化钠均为分析纯, 购于天津市科密欧化学试剂有限公司; 三羟甲基氨基甲烷(Tris, 纯度>99.8%)购于阿尔法莎中国有限公司; 氯金酸水合物(99.9%-Au)和BSPP(纯度>97%)购于百灵威科技有限公司; DNA购于上海英骏生物技术有限公司. DNA1(HS-DNA): 3′-HS-GGG GGG GGC TCT CTC TTG CTT ACT-5′; DNA2(HS-DNA): 3′-HS-AGT AAG CAA GAG AGA GCC -5′; DNA3: 3′-TTT ACA CCA CAA TTT AGT AAG CAA GAG AGA GCC -5′; DNA4: 3′-GGC TCT CTC TTG CTT ACT AAA TTG TGG TGT AAA-5′. DNA3与DNA4杂交后形成延长连接单元.H-7650型透射电子显微镜(TEM, 日本Hitachi公司); Helios-γ型紫外-可见分光光度计(UV-Vis, 美国热电公司).1.2 实验过程1.2.1 AuNPs的制备采用水相高温柠檬酸钠还原氯金酸的方法[19]制备AuNPs(Scheme 1): 将1 mL质量分数为1%的氯金酸溶液加入到100 mL超纯水中, 加热至亚沸腾, 充分搅拌下迅速加入0.9 mL(或2.5 mL)质量分数为1%的柠檬酸钠溶液, 加热至沸腾后继续搅拌30 min, 冷却后以10000 r/min的转速离心30 min, 弃去上清液, 加入超纯水, 即可得到粒径为40 nm(或15 nm)的AuNPs溶液(记为Au40或Au15). 将500 μL上述溶液与一定量的50 mg/mL的BSPP超纯水溶液加入微型管中, 于50 ℃反应1 h, 冷却后以10000 r/min的转速离心, 弃去上清液, 加入100 μL 1 mg/mL BSPP-0.5×Tris硼酸(TBE)缓冲液, 于4 ℃下保存备用.1.2.2 直接杂交法制备AuNPs组装体将巯基修饰的DNA1与柠檬酸或BSPP稳定的Au40按照摩尔比1∶1, 2∶1, 3∶1置于微型管中, 加入0.5×TBE-0.01 mol/L NaCl缓冲液, 反应10 h后, 将溶液中NaCl浓度提高到0.05 mol/L, 反应24 h后于10000 r/min转速下离心, 得到DNA1修饰的Au40(Au40-DNA1). DNA2修饰的15 nm AuNPs(Au15-DNA2)的制备与上述过程相同. 将Au15-DNA2和Au40-DNA1按AuNPs摩尔比为1∶1, 2∶1, 3∶1进行混合, 在0.5× TBE缓冲液中避光反应24 h后, 在10000 r/min转速下离心30 min, 弃去上清液, 保存在0.5× TBE缓冲溶液中, 即得到直接杂交的AuNPs组装体.1.2.3 通过延长连接单元制备AuNPs组装体首先使用直接杂交法制备Au40-DNA, 此时n(Au40)∶n(DNA1)=1∶10, 随后按照n(DNA3)∶n(Au40)=1∶1, 2∶1和3∶1投入DNA3与0.5×TBE, 于4 ℃下使DNA3与DNA1杂交反应24 h后, 避光保存备用, 得到DNA3修饰的Au40-DNA1(记为Au40-DNA1-DNA3). DNA4与Au15-DNA2的杂交连接过程相同, 得到Au15-DNA2-DNA4. 由于DNA3与DNA4的延长部分碱基序列互补, 因此将Au15-DNA2-DNA4与Au40-DNA1-DNA3按照n(Au15)∶n(Au40)=1∶1, 2∶1, 3∶1进行混合, 在0.5×TBE缓冲液中避光反应24 h, 在10000 r/min转速下离心30 min后弃去上清液, 保存在0.5× TBE缓冲溶液中, 即得到通过延长连接单元连接的AuNPs组装体(Scheme 2).2.1 BSPP对AuNPs分散体系稳定性的影响适量盐的加入有利于DNA在AuNPs表面的自组装, 但加入量过多会打破胶体体系的平衡从而引起聚沉[21], 而在DNA的杂交过程中需要一定浓度的盐, 因此为了控制单链DNA尽可能均匀分布在AuNPs表面, 需要尽可能地提高AuNPs的耐盐稳定性. BSPP是一种三芳基膦, 其较大的分子结构有利于纳米粒子的稳定[14]. 研究了BSPP对AuNPs耐盐稳定性的影响, 测试了Au15分散液的吸收光谱, 结果如图1所示.图1中谱线a0~a2是未加BSPP时体系的吸收光谱图. 无NaCl加入时体系的最大吸收峰在525 nm处, 随着NaCl浓度的增加, AuNPs分散液的吸收峰强度降低(谱线a), 并且当NaCl的浓度为100 mmol/L 时消失(谱线a2), 这表明NaCl对AuNPs的稳定性有强烈的破坏作用. 但是当向体系中添加50 mmol/L 的BSPP后(谱线b0~b2), 所得体系的吸收峰强度都有较大幅度的提高, 而此时的TEM照片(图2)表明, AuNPs从聚集状态[图2(A)]变成了单个的分散状态[图2(B)], 这是由于柠檬酸根稳定的AuNPs带有负电, 而BSPP在水中电离出的BSPP-离子拥有更大的分子结构, 它替代AuNPs表面的柠檬酸根离子后与AuNPs形成更稳定的配体络合物, 这将阻碍AuNPs粒子间因碰撞而发生的聚并, 大幅提高粒子的稳定性, 粒子对光的散射增强, 宏观上表现为吸收峰增强[22,23].2.2 BSPP对AuNPs组装体纳米结构的影响传统的AuNPs组装体一般采用直接杂交法制备, 即利用巯基修饰的单链DNA易与AuNPs进行反应的特点, 分别制备不同单链DNA修饰的AuNPs, 随后利用单链DNA的互补杂交作用, 将AuNPs组装起来[24]. 为了研究BSPP对AuNPs组装体的影响, 在不使用BSPP稳定剂和DNA延长连接单元的情况下, 使用DNA1对粒径为40 nm的AuNPs进行修饰, 使用DNA2对粒径为15 nm的AuNPs进行修饰, 再将二者按比例混合, 所得AuNPs组装体的TEM照片和吸收光谱如图3所示.TEM结果表明, 虽然精确按照比例进行混合, 但未使用BSPP作为稳定剂时, AuNPs组装体的纳米结构非常复杂和混乱, 且无论何种配比, 都有大量的Au15未能与Au40连接. 这表明使用传统方法制备的AuNPs组装体在没有BSPP稳定的情况下, 即使AuNPs与HS-DNA较易通过Au—S键反应, 但AuNPs粒子之间的团聚作用仍然严重阻碍了它们与DNA的连接, 导致它们之间的连接率很低, 因此很难观测到有序的AuNPS组装体的纳米结构. Au14和Au40的最大吸收峰分别位于525和535 nm, 从图3(D)可以看出, 当混合体系中Au15与Au40的摩尔比分别为1∶1, 2∶1和3∶1时, 组装体的吸收峰随着Au15比例的增加而增强; 当n(Au15)∶n(Au40)=1∶1和2∶1时, 其最大吸收峰峰位置与Au40一致, 均位于535 nm处; 当n(Au15)∶n(Au40)=3∶1时, 其最大吸收峰有了1 nm的蓝移, 位于534 nm, 这表明粒径较大的Au40对组装体的最大吸收峰位置起决定性作用(符合瑞丽散射定律), 而Au15比例的增加不仅使组装体的吸收峰增强, 还可以促使吸收峰蓝移(向Au15的吸收峰处移动), 但由于此时Au15和Au40的连接率较低, 因此吸收峰较宽, 且吸收峰的增强与蓝移程度均不大.在使用BSPP作为AuNPs稳定剂之后, 大部分Au40可以与Au15通过各自的表面单链DNA杂交连接(图4), 这表明均匀分散的AuNPs能够较容易地与HS-DNA 发生反应. 当混合体系中n(Au15)∶n(Au40)=1∶1时, 大约一半的Au40能与1个Au15连接, 获得1∶1的组装体[图4(A)]; 但是当混合体系中n(Au15)∶n(Au40)=2∶1和3∶1时, 与Au40相连接的Au15的数量虽然有所增加[图4(B)和图4(C)], 但仍有大量的Au15未能与Au40连接, 且纳米结构较混乱. 从吸收光谱[图4(D)]看, 总体上组装体的吸收峰强度依然呈现出随着Au15比例的增加而逐渐增强的趋势, 且吸收峰强度均比图3(D)中相应的各组装体的吸收峰强, 这表明BSPP也提高了组装体的分散性和稳定性; 混合体系中n(Au15)∶n(Au40)=1∶1, 2∶1和3∶1时, 组装体的最大吸收峰位为535, 533, 532 nm, 与不加BSPP相比[图3(D)]蓝移较明显, 吸收峰变窄, 表明组装体中Au15与Au40的连接情况有所改善.2.3 DNA延长连接单元对AuNPs组装体的影响考虑到制备n(Au15)∶n(Au40)=2∶1和3∶1组装体时的困难, 引入DNA延长连接单元来精确控制AuNPs组装体的纳米结构, 即在Au40与过量DNA1进行反应后, 精确投入碱基序列较长且可与DNA1杂交的DNA3作为延长连接单元, 得到Au40-DNA1-DNA3, 并使用类似的方法得到Au15-DNA2-DNA4. 利用DNA3与DNA4延长出的多余碱基链进行定量杂交(其原理如Scheme 2所示), 则可以对AuNPs组装体中的n(Au40)∶n(Au15)进行精确控制, 所得组装体的TEM照片与吸收光谱如图5所示. 从吸收光谱的结果看, 组装体的吸收峰较窄, 峰形较好, 吸收峰强度随着Au15比例的增加而逐渐增强, 增强幅度比较均衡, 且各组装体的吸收峰强度[尤其当是n(Au15)∶n(Au40)=1∶1时]比未使用DNA延长连接单元时[图4(D)]高, 这表明使用DNA延长连接单元可以较好地促使组装体获得更稳定的结构. 当n(Au15)∶n(Au40)=1∶1, 2∶1和3∶1时, 组装体的最大吸收峰位于535, 533, 532 nm处, 与无延长连接单元时[图4(D)]相同, 此时最大吸收峰的蓝移能够反映Au组装体纳米的结构发生了变化, 但难以具体衡量变化的程度. 而从TEM照片可以看出, 使用DNA延长连接单元可以促使AuNPs组装体拥有良好的连续离散型1∶1, 2∶1和3∶1纳米结构.综上, 本文以BSPP为AuNPs稳定剂, 研究了不同情况下BSPP与DNA连接单元对AuNPs组装体纳米结构的影响. 结果表明, BSPP可以改善AuNPS在水体系中的分散性, 并提高AuNPs与单链DNA的连接率; 在此基础上, 进一步使用DNA延长连接单元时, 可以成功地控制AuNPs组装体具有连续离散型的1∶1, 2∶1和3∶1纳米结构.【相关文献】[1] Daniel M. C., Astruc D., Chem. Rev., 2004, 104(1), 293—346[2] Qian X., Zhou X., Nie S., J. Am. Chem. Soc., 2008, 130(45), 14934—14935[3] Zhou K., Li Y., Angew. Chem. Int. Ed., 2012, 51(3), 602—613[4] Moreira H., Grisolia J., Sangeetha N. M., Decorde N., Farcau C., Viallet B., Chen K., ViauG., Ressier L., Nanotechnology, 2013, 24(9), 095701[5] Zheng Y., Yuan Y., Chai Y., Yuan R., Biosens. Bioelectron., 2015, 66, 585—589[6] Annadhasan M., Muthukumarasamyvel T., Sankar V. R., Rajendiran N., ACS SustainableChem. Eng., 2014, 2(4), 887—896[7] Zhang Z., Zhang J., Qu C., Pan D., Chen Z., Chen L., Analyst, 2012, 137(11), 2682—2686[8] Wang L., Wang L. P., Xu T. S., Guo C. R., Liu C. Z., Zhang H., Li J., Liang Z. Q., Chem. Res. Chinese Universities, 2014, 30(6), 959—964[9] Rao X. Y., Zhang J. J., Cui J., Hu Y., Liu T., Chai J. F., Cheng G. F., He P. G., Fang Y. Z., Chem. Res. Chinese Universities, 2013, 29(5), 868—873[10] Busson P. M., Rolly B., Stout B., Bonod N., Larqeut E., Polman A., Bidault S., Nano Lett., 2011, 11(11), 5060—5065[11] Wang H., Reinhard B. M., J. Phys. Chem. C, 2009, 113(26), 11215—11222[12] Ohshiro T., Zako T., Watanabe-Tamaki R., Tanaka T., Maeda M., Chem. Commun., 2010, 46(33), 6132—6134[13] Zhang C., Ma J., Yang J., Dong Y., Xu J., J. Colloid Interface Sci., 2014, 418(1), 31—36[14] Xu X., Rosi N. L., Wang Y., Huo F., Mirkin C. A., J. Am. Chem. Soc., 2006, 128(29), 9286—9287[15] Mastroianni A. J., Claridge S. A., Alivisatos A. P., J. Am. Chem. Soc., 2009, 131(24), 8455—8459[16] Zhang J., Wang L., Pan D., Song S., Boey F. Y., Zhang H., Fan C., Small, 2008, 4(8), 1196—1200[17] Claridge S. A., Liang H. W., Basu S. R., Fréchet J. M., Nano Lett., 2008, 8(4), 1202—1206[18] Wang Z. W., Lévy R., Fernig D. G., Brust M., Bioconjugate Chem., 2005, 16(3), 497—500[19] Dai Z., Li Y., Guo W. J., Qi D. L., Zhang J. M., Micro and Nano Lett., 2012, 7(2), 142—145[20] Han X., Goebl J., Lu Z., Yin Y., Langmuir, 2011, 27(9), 5282—5289[21] Zhang X., Servos M. R., Liu J., Langmuir, 2012, 28(8), 3896—3902[22] Zhang T., Yang Z., Liu D., Nanoscale, 2011, 3(10), 4015—4021[23] Haiss W., Thanh N. T. K., Aveyard J., Fernig D. G., Anal. Chem., 2007, 79(11), 4215—4221[24] Zanchet D., Micheel C. M., Parak W. J., Gerion D., Williams S. C., J. Phys. Chem. B, 2002, 106(45), 11758—11763。
DNA纳米装配原理及其在功能材料制备上的应用

DNA纳米装配原理及其在功能材料制备上的应用DNA纳米装配是一种以DNA作为材料的装配方式,利用DNA的自组装特性将DNA纳米链组装成特定的结构和形状。
DNA纳米装配原理基于DNA的双链互补配对特性,可以精确控制DNA链之间的相互作用,实现高度可控的纳米结构组装。
这种装配方法不仅能够制备各种形状的DNA纳米结构,还可以将DNA与其他材料相结合,实现功能材料的制备。
DNA纳米装配在材料科学领域展现出巨大的潜力和广阔的应用前景。
DNA纳米装配的原理可以简单概括为两个步骤:互补配对和杂交。
在互补配对过程中,两条DNA链通过碱基间的氢键形成稳定的双链结构。
通过设计DNA序列,可以使两条DNA链在特定区域上互补配对,而在其他区域上不互补配对。
这种互补配对特性可以用来实现DNA纳米链的连接和组装。
在杂交过程中,两条互补配对的DNA纳米链相互结合形成稳定的结构。
通过这种方式,可以将DNA纳米链组装成各种形状和结构,如纳米片、纳米管、纳米粒等。
DNA纳米装配在功能材料制备上具有广泛的应用。
首先,DNA纳米装配可以用来制备纳米电子器件。
通过设计DNA纳米链的序列,在特定位置上引入金属颗粒或者半导体纳米晶体,可以制备出高度可控的纳米电子器件,如纳米电路、纳米传感器等。
这些纳米电子器件具有尺寸小、响应灵敏的特点,可以应用于集成电路、生物传感、能源储存等领域。
其次,DNA纳米装配还可以用来制备纳米光子材料。
通过设计DNA纳米链的排列方式和结构,可以制备出具有特定光学性质的纳米结构。
例如,可以通过DNA纳米装配制备出具有特殊光学响应的纳米相控阵列,实现光学信号的调控和操控。
这种纳米光子材料在光通信、光学传感等领域具有重要的应用价值。
此外,DNA纳米装配还可以用来制备纳米载体系统。
通过将DNA纳米链组装到载体表面,可以实现纳米粒子的定向组装和精确控制。
这种纳米载体系统具有可调控的载体结构和尺寸,可以用于纳米药物传输、基因治疗等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
少 的能源 , 因此在 降低 成 本方 面 , 媲美 目 可 前 正在研 制 中的其 他 吸收 二 氧化碳 的实 验
材料。
D A链 获 金 纳 米 粒 子 地 获得 了 由金 N
纳 米粒 子 ( o n np rc ) 成 的 3维 晶 g l ao atl 构 d ie
精 准位 置 。 美 国西北 大学 研 究小 组 科 学 家通 过 将 合 成 D A的双链 附着 上 金 纳米 粒 子 , 得 N 获
20 0 8年 第 1期 ( 第 1 8期 ) 总 0
所 有的工 作 。
利用 由阿 贡 国家实 验 室先 进 的 光 子源
同步 加速 器所 产 生 的超 强 x射线 并辅 以计 算机模 拟 , 究 小 组 对 这 些 结 晶 体 进 行 了 研 影像 学研 究 , 确定 整 个 晶体 结 构 中各 个 粒
少来 自发 电厂 的二 氧化碳 排 放量 提供 了一 个潜 在 的廉 价方 式 。 由于新材 料 可使 用较
存 储气体 分子 , 在化 学 结构 上 , 它有 一个 类 似 于旋转 门的 薄 盖 , 够 让 大小 合 适 的 分 能 子进 入并 将 其 存 储 , 将 较 大 或 者 形 状 不 而
尔 ・ 希率领 的研 究 团 队研 制 的。雅 希是 雅
研究使用 复杂 微观 结 构制 作材 料 的知 名化 学家 。新 材 料 属 于 “ 沸石 咪 唑 酯 骨 架结 构 材料 ” ZF ) 由金 属原 子 桥联 多个 眯唑 类 ( Is ,
环型 有机分 子组成 。 这种材 料 具 有 多孔 和化 学稳 定 结构 ,
子 的准 确 位 置 。他 们 发 现 , 终 的 晶体 中 最
有大 约 10万 个 金 纳 米 粒 子 。米 尔 金 说 : 0
“ 作为 纳米科 学 家 , 我们 现 在 更接 近 了~ 个 梦想 , 即了解 如何 将 每 种 物 质 分 解 成 基 础 的组建 模 块 ( 我 们 来 说 就是 纳 米 粒 子 ) 对 , 并 将 它们重新 组 装 成我 们 所需 的拥 有特 定
ZF 晶体结 构 , 证 实其 中 3个 ( I 6 、 Is 并 ZF一 8
科学家在近期 出版的美国《 科学》 杂志上发 表 的一 项 最新 研 究 称 , 们 已开 发 出一种 他 能 够 隔 离 并 捕 获 二 氧 化 碳 分 子 的新 型材 料 , 减 少 二 氧化 碳 等 温 室气 体 排 放 技 术 对 有重 要作 用 , 能 使 发 电厂 在 无 需 使 用 有 也 毒材 料 的情 况 下 , 高 二 氧 化 碳 的捕 获 效 提
性 质 的各种 结构 。 ” 目前 , 究 小组 仅使 用 一 种组 建 模 块 , 研
了两种普 通但 又 极具 差 异 的 晶体 结 构 。在
两 种 晶体 结 构 中 , 纳 米 粒 子 取 代 了原 晶 金 体 结构 中 的原 子 。科 学 家 表 示 , 条 链 中 每
光 学精 密 机械
20 0 8年 第 l期 ( 第 1 8期 ) 总 0
对 二 氧化 碳 高 选 择 性 的 新 材 料
二 氧 化 碳 的 排 放 不 断助 长 着 全 球 变 暖 、 平 面 上 升 及 增 加 海 洋 的酸 度 。美 国 海 研 究 人 员 在 实 验 中共 合 成 了 2 5个
出吸收的二氧化碳。美国国家能源技术实
验室项 目经理 托 马斯 费 雷表 示 , 电厂 利 煤 用现有 方 法捕 捉 和压 缩 二 氧 化 碳 , 产 成 生
本 可增加 8 %至 9 % 。 O 0
使 得 其 拥 有 更 大 的表 面 积 来 吸 收 二 氧化 碳, 而且 在高 温下 加热 也 不会 分解 , 至在 甚 水 或 有 机 溶 液 中 煮 一 个 星 期 仍 能 保 持 稳 定 。在 1克重 的该材 料 中包 含 的表 面 积最
多可达 2 0 0 0平方米 。ZF材料 的 内部 可 以 I
研究 人员称 , 氧化 碳 的捕 获 和封存 , 二 对 减少 温 室 气 体 的 排 放 量 将 是 必 不 可 少 的, 特别是 对 像 美 国这 样 严 重 依 赖 于煤 发
电的 国家 。这 种 新 材 料 的 研 制成 功 , 为减
中 , 学家 称 , 科 利用 该 技术 能 构建各 种 具有 特殊 性质 的 晶体 物 质 , 可 广 泛 应用 于 医 并 学、 学、 光 电子或催 化领域 。
体 结构 , 新 出版 的 《自然 》 志封 面文 章 在 杂
・
1 ・ 6
光 学精 密 机 械
大多数 的宝石 , 钻石 、 宝 石 和 蓝 宝 如 红 石 皆为 晶体 物 质 。在 每 种 晶状 结 构 中 , 各 个 原子 都 处 在 精 准 的位 置 , 赋 予 了该 类 这 物 质独 特 的性 质 。 比如 钻石 的硬 度 及折 射 特 性就 是源 于其 结构 中每个 碳 原 子 所处 的
率。 该材料是 由加 州大 学 洛杉 矶 分校 奥 马
ZF一 9ZF一 0 对 捕 获二 氧化 碳具 有 高 I 6 、I 7 )
选 择 性 。雅 希 称 , Is对 二 氧化 碳 的选 择 ZF 性是 其他 一些材 料 不可 比拟 的。实验 证 明
了新 材料 能 吸 收 大 量 二 氧化 碳 , 并 不 吸 但
收其他气 体 。研 究表 明 , 0E和常压 下 , 在 ' 1 升这样 的材料 可储存 8 . 的二氧化碳 。 2 6升 从 发 电厂 烟 囱中捕 捉二 氧化 碳 的技 术
已经 存在 已久 , 但要 消 耗大 量 的能源 ( 占 约 到 电厂总 发 电量 的 1 % 至 2 % ) 5 0 。这 是 因 为现 有材料 , 如胺 , 须经 过加 热 才能 释放 必
