第一类医疗器械生产备案凭证
第一类医疗器械备案凭证

91440606MA52PKM175
备案人注册地址
广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)
生产地址
广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)
代理人
/
代理人注册地址
/
预期用途
用于对创面敷料或肢体提供束缚力,以起到包扎、固定作用。
备注
备案单位
和日期
佛山市顺德区市场监督管ห้องสมุดไป่ตู้局
备案日期: 2019年11月06日
变更情况
产品名称
三角巾
型号/规格
型号:FSR-IV、愈合型、修护型、保养型、清洁型规格:5cm×5cm×7cm、10cm×10cm×14cm、20cm×20cm×28cm、30cm×30cm×42cm
产品描述
通常为纺织加工而成的卷状、管状、三角形的材料。其形状可以通过绑扎的形式对创面敷料进行固定或限制肢体活动,以对创面愈合起到间接的辅助作用。部分具有弹力或自粘等特性。非无菌提供,一次性使用。不与创面直接接触。粘贴部位为完好皮肤。
第一类医疗器械备案凭证
叁零医(广东)医疗生物科技有限公司:
根据相关法规要求,对你单位第一类医疗器械:三角巾予以备案,备案号:粤顺械备20190044号。
佛山市顺德区市场监督管理局
日期:2019年11月06日
第一类医疗器械备案信息表
备案号:粤顺械备20190044号
备案人名称
叁零医(广东)医疗生物科技有限公司
第一类医疗器械生产备案 办理流程

第一类医疗器械生产备案
办理流程
在苏州市从事第一类医疗器械生产的企业应当具备与所生产产品相适应的生产条件,并通过苏州市行政服务中心网上申请平台填报资料,资料预审通过后,苏州市行政服务中心食药监窗口通知企业提交备案材料。
苏州市行政服务中心食药监窗口收到备案申请后,应按照要求,当场对企业提交材料的完整性进行核对。
证明性文件的原件与复印件核对后退回,复印件加盖公章后与电子版一并留存,并根据下列情况分别作出处理:
(一)符合规定的予以备案,并发给第一类医疗器械生产备案凭证。
第一类医疗器械生产备案采用江苏省局的备案凭证,并加盖苏州市食品药品监督管理局的备案专用章。
(二)对于缺少规定的资料、资料的内容不完整、资料中有明显错误、生产备案资料与产品备案资料不一致、未提供相关备案材料原件的、网上备案信息与书面备案材料不一致的,应要求企业改正。
对于可以当场改正的内容,允许企业当场改正。
对于无法当场改正的,市食品药品监督管理局可以出具《第一类医疗器械生产备案审查意见书》,并将备案材料(备案表除外)退回企业,告知企业补正材料后重新递交网上和书面备案申请。
(三)申请事项不属于本部门职权范围的,可当场作出不予受理的决定。
不予受理医疗器械生产备案的,出具加盖苏州市食品药品监督管理局的备案专用章并注明日期的不予受理通知书,相关备案材料(备案表除外)退回企业。
第一类医疗器械备案凭证

第一类医疗器械备案凭证
瑞海博医疗科技南通有限公司:
根据相关法规要求,对你单位第一类医疗器械:上肢综合训练器予以备案,备案号:苏通械备20190025号。
南通市行政审批局
(盖章)
日期:2019年9月29日
第一类医疗器械备案信息表
备案号:苏通械备20190025号
第一类医疗器械备案凭证
南通罗伯特医疗科技有限公司:
根据相关法规要求,对你单位第一类医疗器械:下颌骨牵引装置予以备案,备案号:苏通械备20190014号。
南通市行政审批局
(盖章)
日期:2019年9月27日
第一类医疗器械备案信息表
备案号:苏通械备20190014号
第一类医疗器械备案凭证
如皋市恒康医疗器材有限公司:
根据相关法规要求,对你单位第一类医疗器械:引流袋予以备案,备案号:苏通械备20170047号。
南通市行政审批局
(盖章)
日期:2019年10月8日
第一类医疗器械备案信息表
备案号:苏通械备20170047号。
第一类医疗器械备案凭证

第一类医疗器械备案信息表备案号:粤顺械备20190007号备案人名称叁零医(广东)医疗生物科技有限公司备案人统一社会信用代码91440606MA52PKM175备案人注册地址广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)生产地址广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)代理人/代理人注册地址/产品名称液体敷料型号/规格型号:紧致型、保养型、嫩红型、修护型、头部护理型、SPF30、创伤型、愈合型、无痕型规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g产品描述通常为溶液或软膏(不包括凝胶)。
所含成分不具有药理学作用。
所含成分不可被人体吸收。
非无菌提供。
预期用途通过在创面表面形成保护层,起物理屏障作用。
用于小创口、擦伤、切割伤等浅表性创面及周围皮肤的护理。
备注备案单位和日期佛山市顺德区食品药品监督管理局备案日期: 2019年03月20日变更情况型号或规格由“见附件”变更为“型号:紧致型、保养型、嫩红型、修护型、头皮护理型、SPF30 规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”变更时间2019年01月16日;型号或规格由“型号:紧致型、保养型、嫩红型、修护型、头皮护理型、SPF30 规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”变更为“型号:紧致型、保养型、嫩红型、修护型、头部护理型、SPF30、创伤型、愈合型、无痕型规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”。
第一类医疗器械生产备案凭证必须要产品列表

第一类医疗器械生产备案凭证必须要产品列表摘要:I.引言- 介绍医疗器械生产备案凭证的必要性II.第一类医疗器械生产备案凭证的要求- 详述第一类医疗器械的定义和范围- 解释为什么需要第一类医疗器械生产备案凭证- 说明第一类医疗器械生产备案凭证的申请流程III.产品列表的重要性- 阐述产品列表在医疗器械生产备案凭证中的作用- 分析产品列表对于医疗器械生产质量和安全性的影响IV.产品列表的内容- 介绍产品列表的具体内容和要求- 解释产品列表中各栏目的含义- 提供产品列表的模板或示例V.结论- 总结产品列表在第一类医疗器械生产备案凭证中的重要性- 强调产品列表对于医疗器械生产质量和安全性的重要性正文:引言医疗器械是直接或间接用于人体的设备、器具、材料和其他类似物品,其质量直接关系到人们的健康和生命安全。
为了确保医疗器械的质量和安全性,我国对医疗器械的生产、经营、使用等环节进行了严格的监管。
其中,第一类医疗器械生产备案凭证是医疗器械生产企业的必备证书。
本文将详细介绍第一类医疗器械生产备案凭证的要求和产品列表的重要性。
第一类医疗器械生产备案凭证的要求第一类医疗器械是指对人体具有潜在危险性的医疗器械,包括心脏起搏器、人工关节、人工心脏瓣膜等。
生产第一类医疗器械的企业必须获得医疗器械生产备案凭证。
申请第一类医疗器械生产备案凭证的企业需要提交一系列材料,包括企业营业执照、组织机构代码证、生产场地证明文件、生产设备清单、质量管理体系认证证书等。
此外,企业还需要提交产品列表,详细列出生产的所有第一类医疗器械产品。
产品列表的重要性产品列表是第一类医疗器械生产备案凭证的重要组成部分,是企业生产医疗器械的清单,也是监管部门对医疗器械质量监管的重要依据。
产品列表详细列出了企业生产的医疗器械产品,便于监管部门了解企业生产的医疗器械种类和数量,为监管提供便利。
此外,产品列表还对医疗器械生产质量和安全性具有重要的影响。
产品列表中的医疗器械产品必须符合国家相关标准和规定,企业必须对产品列表中的医疗器械产品进行严格的质量控制和检验,确保产品的质量和安全性。
第一类医疗器械生产备案凭证

第一类医疗器械生产备案凭证
我司(生产企业名称)于2020年12月20日于。
中国食品药品监督管理总局备案的第一类医疗器械XXX(器械名称),产品编号(注册证号)为XXXXXX。
经过严格检测,该产品材质符合《第一类医疗器械产品生产许可证》
要求,具有良好的功能、使用稳定性和安全性,使用安全,操作方便,适
用于XXXXX(应用范围)。
本次备案,证明我司产品安全,质量合格,经符合《中国食品药品监
督管理总局办公室关于审批第一类医疗器械产品生产企业备案实施细则
(依令发字[2007]170号)》规定办理完毕,特发此凭证以证明有关事项。
特此凭证!
(此处空白)。
xxx公司(审查部门)。
2020年12月20日。
第一类医疗器械生产备案凭证

第一类医疗器械生产备案凭证
备案号:粤顺食药监械生产备20150002号企业名称
住所佛山市顺德区陈村镇石洲村委会岗北工业区白陈路石洲段2号B1座三层之三生产场所佛山市顺德区陈村镇石洲村委会岗北工业区白陈路石洲段2号B1座三层之三法定代表人邱万桥企业负责人邱万桥
生产范围I类:6864医用卫生材料及敷料
生产产品列表产品名称产品备案号
是否
受托生产
备注检查手套
粤顺食药监械(准)
字2012第1660010
否
检查手套
粤顺食药监械(准)
字2012第1660011
否
备案部门(公章)
备案日期:2015年3月30日。
第一类医疗器械备案凭证

第一类医疗器械备案凭证佛山市顺德区德维医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:血细胞分析用染色液,予以备案,备案号:粤顺械备20150019号。
顺德区食品药品监督管理局日期: 2017年12月20日第一类医疗器械备案信息表备案号:粤顺械备20150019号备案人名称佛山市顺德区德维医疗器械有限公司备案人统一社会信用代码91440606559123167Q备案人注册地址佛山市顺德区均安镇均益路194号世友工业城4座501之一生产地址佛山市顺德区均安镇均益路194号世友工业城4座501之一代理人/代理人注册地址/产品名称血细胞分析用染色液型号/规格1、型号:DYEWDF,包装规格:22ml、22ml×2、42ml、42ml×2 2、型号:DYEWNR,包装规格:82ml、82ml×2 3、型号:DYERET,包装规格:12ml、12ml×2 4、型号:DYEWPC,包装规格:12ml、12ml×2 5、型号:DYEPLT,包装规格:12ml、12ml×2 6、型号:DYE4DS,包装规格:42ml、42ml×3 7、型号:DYERED,包装规格:12ml、1L+12ml、1.9L+380ml 8、型号:DYESNR,包装规格:12ml、1L+12ml 9 、型号:DYE-68FD,包装规格:12ml、12ml×4、48ml、48ml×4 10、型号:DYE-68FR,包装规格:12ml、12ml×4、48ml、48ml×4 11、型号:DYE-68FN,包装规格:12ml、12ml×4、48ml、48ml×4 12、型号:DYE-DD5,包装规格:42ml、42ml×2、42ml×3 13、型号:DYE-PRET,包装规格:1.9L+380ml 14、型号:DYE-LHRET,包装规格:1.9L+380ml 15、型号:DYE-EO,包装规格:1L、5L 16、型号:DYE-FIX,包装规格:1L、5L产品描述荧光染料、甲醇、乙二醇。
第一类医疗器械生产备案凭证

第一类医疗器械生产备案凭证备案编号:闽明食药监械生产备20140003号企业名称三明市和众生物技术有限公司住所三明市梅列区碧湖列西街道工业大楼四、五楼生产地址三明市三元区荆东工业园60号法定代表人陈隆玉企业负责人陈隆玉生产范围2002版:一类6840体外诊断试剂、6841医用化验基础设备器具。
2017版:09物理治疗器械、14注输、护理和防护器械说明、18妇产科、辅助生殖和避孕器械、22临床检验器械。
生产产品列表产品名称产品备案号登载日期备注缓冲液闽明械备20140013号2014-9-26样本密度分离液闽明械备20140014号2014-9-26糖原染色液(PAS) 闽明械备20140018号2014-12-16过氧化物酶(POX)染色液闽明械备20140019号2014-12-16吉姆萨染色液闽明械备20140020号2014-12-16α-醋酸萘酚酯酶(α-NAE)染色液闽明械备20140021号2014-12-16网织红细胞染色液闽明械备20140022号2014-12-16巴氏染色液闽明械备20150004号2015-5-7苏木素-伊红染色液(H-E)闽明械备20150005号2015-5-7液基薄层细胞制片机闽明械备20150006号2015-5-7液基细胞制片染色一体机闽明械备20150025号2015-7-28液基细胞分离制片染色一体机闽明械备20150026号2015-7-28宫颈细胞染色液闽明械备20150027号2015-8-20医用离心机闽明械备20160001号2016-6-19 抗酸染色液闽明械备20160002号2016-6-19生产产品列表刘氏染色液闽明械备20160003号2016-6-19 革兰染色液闽明械备20170004号2017-6-5 组织固定液闽明械备20170007号2017-6-5精子染色液(改良Diff-Quik法)闽明械备20170008号2017-6-5 精子染色液(shorr法)闽明械备20170009号2017-6-5 精子顶体染色液闽明械备20170010号2017-6-5 液基细胞处理保存试剂闽明械备20170011号2017-6-5 精子染色液(活体拒染法)闽明械备20170021号2017-10-23 精子染色液(巴氏染色法)闽明械备20170022号2017-10-23 精子DNA染色液(荧光染色法)闽明械备20170023号2017-10-23精子DNA碎片染色液(SCD染色法)闽明械备20170024号2017-10-23精子核蛋白染色液(苯胺蓝染色法)闽明械备20170025号2017-10-23 宫颈上皮组织脱落细胞染色液闽明械备20170026号2017-10-23 真菌荧光染色液(一步法)闽明械备20180001号2018-2-2 样本稀释液闽明械备20180002号2019-3-4 医用阴道给药器闽明械备20180003号2019-3-4 结核分枝杆菌染色液(荧光法)闽明械备20190001号2019-5-8 组织透明液(无苯型)闽明械备20190002号2019-5-8 口腔冷敷凝胶闽明械备20190004号2019-5-8医用冷敷贴闽明械备20190005号2019-6-25生产产品列表液体敷料闽明械备20190006号2019-11-04医用清洁敷料闽明械备20190007号2019-11-04医用湿巾闽明械备20190008号2019-11-04医用棉片闽明械备20190009号2019-11-04鼻腔液体敷料闽明械备201900010号2019-11-04口腔液体敷料闽明械备201900011号2019-11-04医用皮肤护理乳膏闽明械备201900012号2019-11-22备案部门:三明市市场监督管理局备案日期:2019年11月22日。
第一类医疗器械备案凭证

第一类医疗器械备案凭证佛山市顺德区德维医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:清洗液,予以备案,备案号:粤顺械备20150012号。
顺德区食品药品监督管理局日期: 2017年12月20日第一类医疗器械备案信息表备案号:粤顺械备20150012号备案人名称佛山市顺德区德维医疗器械有限公司备案人统一社会信用代码91440606559123167Q备案人注册地址佛山市顺德区均安镇均益路194号世友工业城4座501之一生产地址佛山市顺德区均安镇均益路194号世友工业城4座501之一代理人/代理人注册地址/产品名称清洗液型号/规格型号:URI-UF;规格:1L。
型号:URI-IQ;规格:425ml、500ml。
型号:URI-FUS;规格:500ml。
型号:URI-UR(A)、URI-UR(B)、URI-UR(C)、URI-UR(M);规格:100ml、500ml、1L、5L。
型号:URI-LX(D)、URI-LX(M);规格:60ml、400ml。
型号:URI-AVE、URI-AVE(A)、URI-AVE(B);规格:400ml、500ml、5L、10L。
型号:URI-US;规格:500ml、10L。
型号:URI-XS;规格:500ml。
型号:URI-EH(A)、URI-EH(B);规格:4L、5L。
型号:AutoClean-SYS、Clean-SYS;规格:4ml、4ml×20、50ml。
型号:Probe-BC、EZ-BC、Rinse-BC3、Rinse-BC5;规格:17ml、17ml×12、50ml、100ml、1L、1L×4、5L、5L×2、5.5L、5.5L×2、10L、20L。
型号:Clean-DY;规格:50ml、100ml。
型号:Rinse-BEK、Clean-BEK;规格:50ml、500ml、1L、5L。
型号:Clean-LW、Rinse-LW;规格:50ml、50ml×4、1L。
第一类医疗器械生产备案凭证
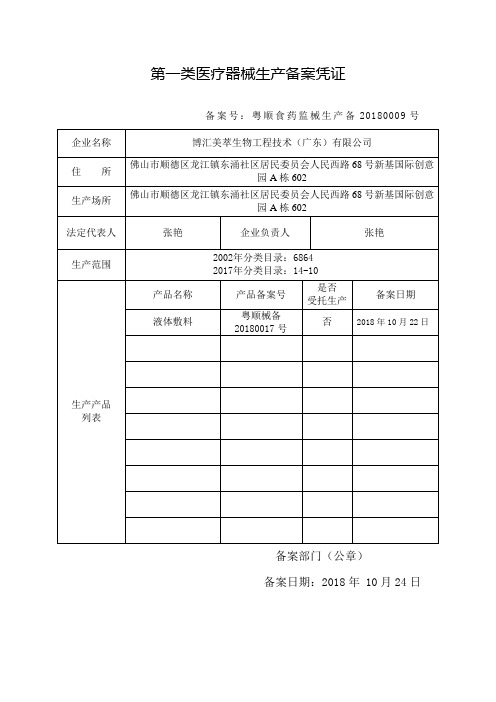
第一类医疗器械生产备案凭证
备案号:粤顺食药监械生产备20180009号企业名称博汇美萃生物工程技术(广东)有限公司
住所佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意
园A栋602
生产场所佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意
园A栋602
法定代表人张艳企业负责人张艳
生产范围 2002年分类目录:6864 2017年分类目录:14-10
生产产品列表产品名称产品备案号
是否
受托生产
备案日期
液体敷料
粤顺械备
20180017号
否2018年10月22日
备案部门(公章)
备案日期:2018年 10月24日。
第一类医疗器械生产备案凭证
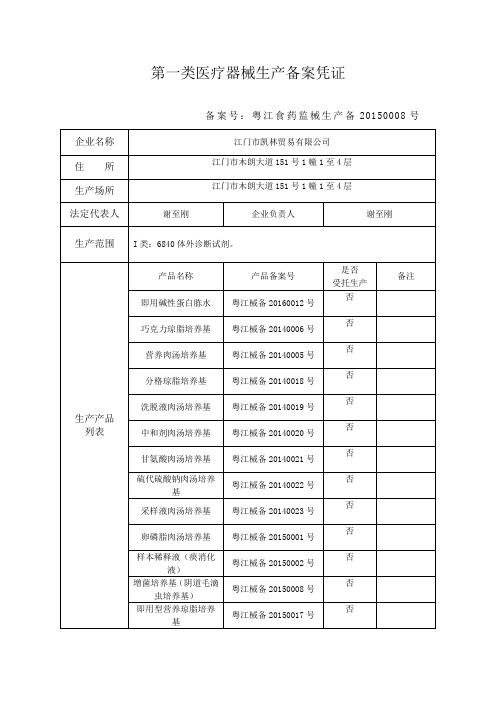
备案号:粤江食药监械生产备20150008号
企业名称
江门市凯林贸易有限公司
住所
江门市木朗大道151号1幢1至4层
生产场所
江门市木朗大道151号1幢1至4层
法定代表人
谢至刚
企业负责人
谢至刚
生产范围
I类:6840体外诊断试剂。
生产产品
列表
产品名称
产品备案号
是否
受托生产
备注
即用碱性蛋白胨水
粤江械备20140022号
否
采样液肉汤培养基
粤江械备20140023号
否
卵磷脂肉汤培养基
粤江械备20150001号
否
样本稀释液(痰消化液)
粤江械备20150002号
否
增菌培养基(阴道毛滴虫培养基)
粤江械备20150008号
否
即用型营养琼脂培养基
粤江械备20150017号
否
运送保存培养基
粤江械备20150016号
粤江械备20160012号
否
巧克力琼脂培养基
粤江械备20140006号
否
营养肉汤培养基
粤江械备20140005号
否
分格琼脂培养基
粤江械备20140018号
否
洗脱液肉汤培养基
粤江械备20140019号
否
中和剂肉汤培养基
粤江械备20140020号
否
甘氨酸肉汤培养基
粤江械备20140021号
否
硫代硫酸钠肉汤培养基
否
革兰染色液
粤江械备20190009号
否
备案部门(公章)
备案日期:2019年3月7日
否
第一类医疗器械生产备案凭证

备案号:粤顺食药监械生产备20180008号
企业名称
佛山市祺蕴医疗器械有限公司
住所
佛山市顺德区北滘镇碧江坤洲红门楼之三(即佛山市顺德区福安达医疗器械制造有限公司左侧)(住所申报)
生产场所
佛山市顺德区北滘镇碧江坤洲红门楼之三(即佛山市顺德区福安达医疗器械制造有限公司左侧)(住所申报)
法定代表人
冯锐坚
企业负责人
梁国潮
生产范围
2002年分类目录:6856
2017年分类目录:15-03
生产产品
列表
产品名称
产品手动病床
粤顺械备20180015号
否
2018年9月21日
备案部门(公章)
备案日期:2018年10月16日
第一类医疗器械生产备案凭证
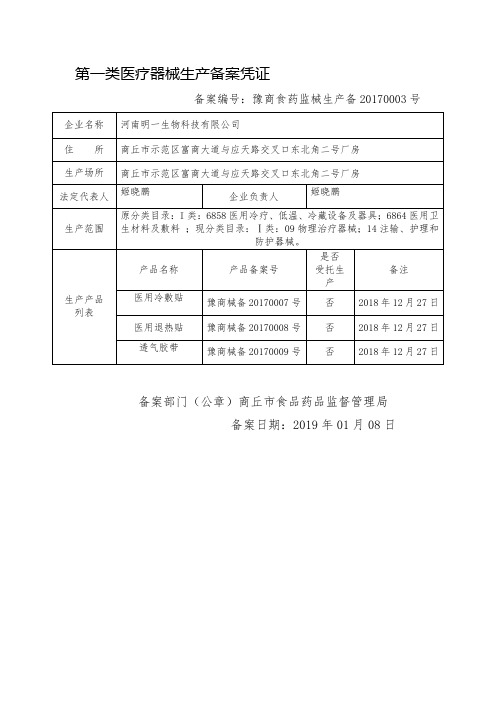
企业名称
河南正源医疗装备有限公司上海仙代生物科技(商丘)有限公司
住 所
民权县高新技术产业开发区富民六路66号
生产场所
民权县高新技术产业开发区富民六路66号
法定代表人
刘继青
企业负责人
刘继青
生产范围
原分类目录:Ⅰ类:6854手术室、急救室、诊疗室设备及器具 ;现分类目录:Ⅰ类:15患者承载器械。
生产产品
列表
产品名称
产品备案号
是否
受托生产
备注
医用冷敷贴
豫商械备20170007号
否
2018年12月27日
医用退热贴
豫商械备20170008号
否
2018年12月27日
透气胶带
豫商械备20170009号
否
2018年12月27日
备案部门(公章)商丘市食品药品监督管理局
备案日期:2019年01月08日
第一类医疗器械生产备案凭证
生产产品
列表
产品名称
产品备案号
是否
受托生产
备注
马镫形多功能腿架
豫商械备20170002号
否
2017年6月29日
备案部门(公章)商丘市食品药品监督管理局
备案日期:2019年01月16日
第一类医疗器械生产备案凭证
备案编号:豫商食药监械生产备20170003号
企业名称
河南明一生物科技有限公司上海仙代生物科技(商丘)有限公司
住 所
商丘市示范区富商大道与应天路交叉口东北角二号厂房
生产场所
商丘市示范区富商大道与应天路交叉口东北角二号厂房
法定代表人
姬晓鹏
