2010届高中化学竞赛专题辅导(三)晶体结构及答案
(完整word版)高中化学选修3第三章晶体结构与性质讲义及习题
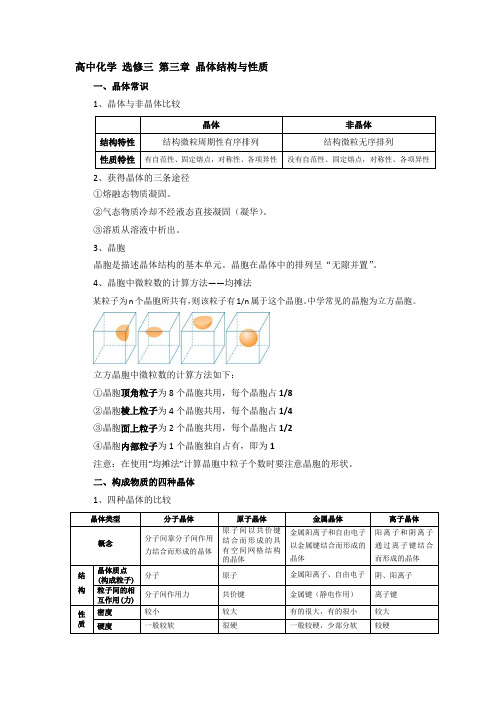
高中化学选修三第三章晶体结构与性质一、晶体常识1、晶体与非晶体比较2、获得晶体的三条途径①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
3、晶胞晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”。
4、晶胞中微粒数的计算方法——均摊法某粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学常见的晶胞为立方晶胞。
立方晶胞中微粒数的计算方法如下:①晶胞顶角粒子为8个晶胞共用,每个晶胞占1/8②晶胞棱上粒子为4个晶胞共用,每个晶胞占1/4③晶胞面上粒子为2个晶胞共用,每个晶胞占1/2④晶胞内部粒子为1个晶胞独自占有,即为1注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状。
二、构成物质的四种晶体1、四种晶体的比较晶体类型分子晶体原子晶体金属晶体离子晶体熔沸点很低很高一般较高,少部分低较高溶解性相似相溶难溶于任何溶剂难溶于常见溶剂(Na等与水反应)大多易溶于水等极性溶剂导电传热性一般不导电,溶于水后有的导电一般不具有导电性(除硅)电和热的良导体晶体不导电,水溶液或熔融态导电延展性无无良好无物质类别及实例气态氢化物、酸(如HCl、H2SO4)、大多数非金属单质(如P4、Cl2)、非金属氧化物(如SO2、CO2,SiO2除外)、绝大多数有机物(有机盐除外)一部分非金属单质(如金刚石、硅、晶体硼),一部分非金属化合物(如SiC、SiO2)金属单质与合金(Na、Mg、Al、青铜等)金属氧化物(如Na2O),强碱(如NaOH),绝大部分盐(如NaCl、CaCO3等)(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。
如熔点:金刚石>碳化硅>硅(3)离子晶体一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。
高中化学竞赛专题讲解之晶体结构

⑶平面点阵指标(或晶面指标、密勒指标)册门
空间点阵可以划分为一组相互平行、间距相等的平面点阵。
设一组平而点阵和三个坐标轴相交,其中一个平面在三个轴上的截距分别为畑sb, tc, t称为截数。有时平面会及某个轴平行,这时,在该轴上的截距为无穷大,为了避免易截数进一步化 作互质的整数力;匕r,
【例】三维实例:金属Na。每个Na原子的周围环境都相同,结构基元应只含有1个Na原子。左侧的立方体中含有2个N&原子(每个顶点提供1/8个Na原子,中心提供1个Na原子),它不是结构基元,右侧图中虚线部分包围的平行六面体给出了一种正确的选法。
【例】三维实例:金属Cu(左图所示立方体的每个顶点和每个面的中心有一个Cu原子)。 每个Cu原子的周围环境都相同,结构基元只含有1个Cu原子。右侧图中虚线部分所示 平行六面体为一个结构基元。
按照选择的素向量,将点阵点连上线,把空间点阵划分并置堆砌的平行六面体(这时,
每个顶点被八个平行六面体共有),空间点阵形成的由线连成的格子称为晶格。
划分出的每个平行六面体为一个单位。平行六而体单位顶点上的点阵点,对每个单位的
平均贡献为1/8;面上的点阵点对每个单位的贡献为1/2,内部的点阵点,对每个单位的
2.周期性
3席秒很Ml就1%眩
上而两个图形均表现出周期性:沿直线方向,每隔相同的距离,就会出现相同的图案。 如果在图形中划出一个最小的重复单位(阴影部分所示),通过平移,将该单位沿直线向 两端周期性重复排列,就构成了上而的图形。
最小重复单位的选择不是唯一的,例如,在图Q)中,下而任何一个图案都可以作为最 小的重复单位。
日常生活中接触到的食盐、糖、洗涤用碱、金属、岩石、砂子、水泥等都主要由晶体组 成,这些物质中的的晶粒大小不一,如,食盐中的晶粒大小以毫米计,金属中的晶粒大 小以微米计。晶体有着广泛的应用。从日常电器到科学仪器,很多部件都是由各种天然 或人工晶体而成,如,石英钟、晶体管,电视机屏幕上的荧光粉,激光器中的宝石,计 算机中的磁芯等等。
化学竞赛专题辅导资料——晶体结构

郴州市二中高一化奥班辅导资料——晶体结构(2008-05-28)【涉及概念和内容】根据《化学课程标准》和中学化学教材以及《物质结构与性质》选修教材,晶体结构涉及的内容包括:(1)基本概念:周期性有序排列、晶胞及晶胞类型、晶胞中粒子数的计算、配位数、空隙、堆积方式、晶格能、并置碓砌;(2)堆积方式:面心立方、六方、体心立方和简单立方堆积;(3)晶体种类和性质:金属晶体、离子晶体、分子晶体、原子晶体,自范性、各向异性、金属晶体的导电导热和延展性、X-射线衍射。
这些内容看似零碎,实际上它们有着密切的内在联系,了解和建立它们的关系,对于晶体结构的教与学,深刻理解晶体结构和性质,掌握核心、突出重点都是很重要的。
它们的联系可以用下面的结构表示,其中堆积类型是联系晶体基本概念、基本结构与不同晶体类型的结构和性质的桥梁。
面心立方最密堆积(A1)最密堆积六方最密堆积(A3)体心立方密堆积(A2)简单立方堆积金刚石型堆积(四面体堆积)(A4)一、晶体的结构1、晶体的概念晶体是质点(原子、分子、离子)在空间有规律周期性地重复排列,是具有规则的多面体固体物质。
2自范性:在一定条件下晶体能自动地呈现具有一定对称性的多面体的外形(晶体的形貌)。
非晶体不能呈现多面体的外形。
晶态石英的谱图非晶态石英的谱图3、晶体的点阵结构概念:在晶体内部原子或分子周期性地排列的每个重复单位的相同位置上定一个点,这些点按一定周期性规律排列在空间,这些点构成一个点阵。
点阵是一组无限的点,连结其中任意两点可得一矢量,将各个点阵按此矢量平移能使它复原。
点阵中每个点都具有完全相同的周围环境。
晶体结构= 点阵+ 结构基元结构基元:在晶体的点阵结构中每个点阵所代表的具体内容,包括原子或分子的种类和数量及其在空间按一定方式排列的结构。
(1)直线点阵(2)平面点阵(3)晶胞(晶胞是人为划定的,为平行六面体)空间点阵必可选择3个不相平行的连结相邻两个点阵点的单位矢量a,b,c,它们将点阵划分成并置的平行六面体单位,称为点阵单位。
高中化学竞赛辅导晶体结构专练精选精编试题并附有详细解答全国通用

晶体结构练习题1.(1)一种金属化合物中晶体结构为立方面心点阵,原子采用类似金刚石的排列,每4个原子形成四面体,相互之间共用顶点连接起来,排布在原子的空隙中。
请问该晶胞中有个原子,该金属化合物最简式为。
(2)以草酸铁和草酸锌为原料,按一定比例溶于水中充分搅拌混匀,加热并蒸去混合溶液的水分;逐渐共沉淀下来,产物几乎为3+及2+均匀分布的的固溶体型草酸盐混合物,过滤、灼烧,即成很好的固相反应原料“前驱物”的制备——即一种尖晶石型物质A:O2-作立方最密堆积,2+占据1/8的四面体空隙,3+占据1/2的八面体空隙。
请写出该反应的化学方程式。
2.属四方晶系,在其晶体中,原子和O原子分别以层状排布,其中O原子层及层之间能够完全重合,而原子则每隔一层重复一次,试画出的晶胞,并指出距最近的原子有几个,呈何种立体构型?3.经 X射线分析鉴定,某一离子晶体属于立方晶系,其晶胞参数 403。
晶胞顶点位置为4+所占,体心位置为2+所占,所有棱心位置为O2-所占。
请据此回答或计算:(1)用分数坐标表达各离子在晶胞中的位置。
(2)写出此晶体的化学式。
(3)指出晶体的点阵型式和结构基元。
(4)指出4+的氧配位数和2+的氧配位数。
(5)计算两种正离子的半径值(O2-半径为 140 )。
(6)2+和O2-联合组成哪种型式的堆积?(7)O2-的配位情况怎样?4.具有高硬度、高耐磨性、高耐腐蚀性及较高的高温强度等特点,已成为一种重要的工程材料。
其晶体具有六方型结构,晶胞参数为a=308,c=505,已知C原子的分数坐标为0,0,0和;原子的分数坐标为和(1)按比例画出六方晶胞。
(2)每个晶胞中含有个。
(3)晶体中的堆积型式是。
C填充的空隙类型是。
(4)列式计算C—键长。
5.实验表明,乙烯在很低的温度下能凝结成分子晶体,经射线分析鉴定,其晶体结构属于正交晶系,晶胞参数为:a = 4.87Å,b = 6.46 Å,c = 4.15 Å,晶体结构如图1所示。
全国高中化学竞赛教练员习题答案晶体结构

五、晶 体 结 构1. 因为立方晶系中,六个面都是等价的,若有底心立方晶胞存在,则必有面心立方晶胞存在,故立方晶系中不存在底心立方晶胞。
不带电荷的分子或原子(金属)之间的相互作用力小,若原子(非金属)以共价键连接,简单立方中的两个原子之间距离又太大,不利于共价键形成,所以不带电荷的分子或原子往往采取六方或立方最紧密堆积或立方体心密堆积结构。
由于六方最紧密堆积结构与立方紧密堆积的空间利用率相同,所以它们具有相同的密度。
在这两种紧密堆积中,原子的配位数为12。
2. Cu 为面心立方晶体,1个晶胞中Cu 原子个数=8×(18) + 6×(12)= 4(1)(2) =1.119 Å 3. ∵Fe 原子半径是相同的,在α型中,Fe3A 2M N a ααρ=g ,在γ型中, Fe γ3A γ4M N a ρ=g 在α型中,43r a α=,∴43a rα=;在γ型中,42r a γ=,∴22a r γ=∴Fe 3A (43)N rαρ=g ,Fe γ3A (22)N r ρ=g∴ 33γ(22)360.918682(43)r r αρρ===4. (1)(2) 原子堆积系数(100)=2222(4141)0.78544(22)r a r ππ⨯+=== 原子堆积系数(110)=22(414212)0.5554242r a π⨯+⨯== 原子堆积系数(111)= 22(316312)30.90696(12)(2)sin60r a ππ⨯+⨯==⨯o 23A 324A 463.548.936,8.97110(3.165)10m N V N ρ-⨯===⨯⨯⨯ 解得=Cu 42,24r a r a =∴=5. (1 ) MgO 与MnO 的d M —O 相差很大,这说明O 2–围成的正八面体空隙小,而Mg 2+、Mn 2+的半径差别大,导致d MnO >d MgO ;而S 2–和Se 2–半径大,围成的正八面体空隙既大于 ,又大于 ,所以d MgS ~d MnS ,d MgSe =d MnSe ,相当于Mg 2+和Mn 2+在S 2–和Se 2–围成的正八面体空隙中“扰动”。
全国高中化学竞赛晶体结构专项训练

全国高中化学竞赛专项训练—晶体结构提示:【初赛真题】选自98-08全国化学初赛试题,09暂无word版,望各选手自己收集整理【波波模拟】选自06-07胡波老师原创模拟题【冲刺模拟】选自2008化学岛第22届全国中学生化学竞赛(省级赛区)初赛模拟题冲刺【决赛真题】仅提供较简单的题目说明:1.本专项练习适用于2010年第24届全国初赛省级赛区;2.本资料为个人收集整理,均不为原创题;3.资料为个人所有,将不对外提供word版。
以图片形式向外出售;4.专项训练将于2010.1-2010.9由麦菊薇化学会陆续整理提供;5.培训教练应根据考情讲解重点;6.应试选手应仔细对阅参考答案及解析;7.欢迎提供更好资源及错误修改;警示:打击盗版,望各位培训教练及广大选手自重!若发现盗版,本资料将不予更新,并对盗版者处以严厉惩罚。
—麦菊薇化学会至上2010.01.25【初赛要求】晶胞。
原子坐标。
晶格能。
晶胞中原子数或分子数的计算及化学式的关系。
分子晶体、原子晶体、离子晶体和金属晶体。
配位数。
晶体的堆积与填隙模型。
常见的晶体结构类型,如NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、硒、冰、干冰、尿素、金红石、钙钛矿、钾、镁、铜等。
点阵的基本概念。
【初赛真题】第一题:(08第3题10分)X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。
该晶体的六方晶胞的参数:a=363.63pm,c=1766.63pm;p=2.53g·cm-3。
1.以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层型结构的堆积方式。
(5分)2.计算一个六方晶胞中“MgCl2”的单元数。
(3分)3.假定将该晶体中所有八面体空隙皆填满Mg 2+离子,将是哪种晶体结构类型?(2分)第二题:(07第5题5分)1963年在格陵兰峡湾发现一种水合碳酸钙矿物。
高中化学竞赛培训晶体结构共95页文档

36、自己的鞋子,自己知道紧在哪里。——西班牙
37、我们唯一不会改正的缺点是软弱。——拉罗什福科
xiexie! 38、我这个人走得很慢,但是我从不后退。——亚伯拉罕·林肯39、勿问成功的秘诀为何,尽全力做你应该做的事吧。——美华纳
40、学而不思则罔,思而不学则殆。——孔子
高中化学竞赛培训晶体结构
56、死去何所道,托体同山阿。 57、春秋多佳日,登高赋新诗。 58、种豆南山下,草盛豆苗稀。晨兴 理荒秽 ,带月 荷锄归 。道狭 草木长 ,夕露 沾我衣 。衣沾 不足惜 ,但使 愿无违 。 59、相见无杂言,但道桑麻长。 60、迢迢新秋夕,亭亭月将圆。
谢谢!
届高中化学竞赛专题辅导(三)晶体结构及答案

高中化学竞赛专题辅导(三)晶体结构一.(9分)下图所示为HgCl2和不同浓度NH3-NH4Cl反应得到的两种含汞的化合物A和B的微观结构重复单元图。
1.写出A、B的化学式和B的生成反应方程式;2.晶体A中,NH3、Cl的堆积方式是否相同,为什么?3.晶体A中Hg占据什么典型位置,占有率是多少?4.指出B中阴阳离子组成特点;5.比较A和B在水溶液中溶解性的大小。
二.(14分)钛酸锶是电子工业的重要原料,与BaTO3相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具有优良稳定性。
因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。
制备高纯、超细、均匀SrTiO3的方法研究日益受到重视。
我国研究者以偏钛酸为原料常压水热法合成纳米钛酸锶,粒子呈球形,粒径分布较均匀,平均22nm。
已知SrTiO3立方晶胞参数a=390.5pm。
1.写出水热法合成纳米钛酸锶的反应方程式;2.SrTiO3晶体的结构可看作由Sr2+和O2-在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由O2-构成,另一种由Sr2+和O2-一起构成,Ti4+只填充在O2-构成的八面体空隙中。
(1)画出该SrTiO3的一个晶胞(Ti4+用小球,O2-用大○球,Sr2+用大球)(2)容纳Ti4+的空隙占据所有八面体空隙的几分之几?(3)解释为什么Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙?(4)通过计算说明和O2-进行立方密堆积的是Sr2+而不是Ti4+的理由(已知O2-半径为140pm)3.计算22nm(直径)粒子的质量,并估算组成原子个数。
三.(10分)NH4Cl为CsCl型结构,晶胞中包含1个NH4+和1个Cl-,晶胞参数a=387pm。
把等物质的量的NH4Cl和HgCl2在密封管中一起加热时,生成NH4HgCl3晶体,晶胞参数a=b=419pm、c=794pm(结构如右图)。
全国化学竞赛初赛讲义——晶体结构

全国化学竞赛初赛讲义——晶体结构晶体结构是化学竞赛中的重要内容之一、晶体是指由具有有序排列的原子,分子或离子组成的固态物质,具有规则的几何形状。
晶体结构的了解对于理解物质的性质和反应机理非常重要。
下面是晶体结构的讲义。
一、晶体结构的基本概念晶体的结构由最小的重复单元所组成,这个最小重复单元称为晶胞。
晶体结构中的重复单元之间的关系是平移关系,即晶胞通过平移操作得到整个晶体。
晶体结构可以分为离子晶体结构、共价晶体结构和金属晶体结构三种。
离子晶体由阳离子和阴离子组成,通常具有高熔点和硬度,如NaCl、CaF2等。
共价晶体由原子通过共价键相连形成,通常具有高熔点和硬度,如钻石、石墨等。
金属晶体由金属离子通过金属键相连形成,通常具有良好的导电性和延展性,如Cu、Al等。
二、晶体结构的表示方法1.点阵表示法:用数学点阵表示晶体中原子的相对位置关系。
有三种常见的点阵表示方法:简单立方点阵、面心立方点阵和体心立方点阵。
(1)简单立方点阵:晶胞内只含一个原子,每个原子都在晶体的角落上。
(2)面心立方点阵:晶胞内含有4个原子,每个原子都在晶体的角落和晶胞的中心。
(3)体心立方点阵:晶胞内含有2个原子,其中一个原子在晶体的角落上,另一个原子在晶胞的中心。
2.坐标表示法:用坐标系表示晶体中原子的位置。
在二维平面上,可以使用直角坐标系或斜坐标系表示晶体中原子的位置。
直角坐标系中,原子的位置可以用x和y两个坐标表示;斜坐标系中,原子的位置可以用a和b两个坐标表示。
在三维空间中,晶体中原子的位置通常用直角坐标系表示,即通过x、y和z三个坐标来确定原子的位置。
三、晶体的常见缺陷与晶体的生长晶体中常见的缺陷有点缺陷、线缺陷和面缺陷。
1.点缺陷:晶体中原子在其位置上发生的缺失、置换、插入或附加等现象。
(1)缺失缺陷:晶体中缺少一个原子。
(2)置换缺陷:晶体中一个原子被其他原子所替代。
(3)插入缺陷:晶体中多了一个原子。
(4)附加缺陷:晶体中多了一个原子,同时缺少一个原子。
晶体结构考试(含答案)

高中化学竞赛专题考试——晶体结构1.008Zr Nb Mo T cRu Rh Pd Ag Cd In S n S b T e I Hf T a W Re OsIr Pt Au Hg T l Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl S i P Cl S K Ca S c T i V Cr Mn Fe Co Ni Cu Zn G a G e As S e BrRb Cs Fr S r Ba RaY LaLu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn相对原子质量Rf Db Sg Bh Hs Mt一 选择题(每题有一个或者两个正确选项,每题2分,共20分。
)1、下列各组物质汽化或熔化时,所克服的微粒间的作用力,属于同种类型的是( ) A .碘和干冰的升华 B .二氧化硅和生石灰的熔化 C .氯化钠晶体和铁的熔化 D .冰的融化和烧碱的熔化2、在结构中,表示成SiO 4,则该结构式的通式为 ( )A. (Si 2O 5)n 2n-B. (SiO 3)n 2n-C. (Si 6O 17)n 10n-D. (Si 6O 19)n 14n-3、某钾(·)的石墨嵌入化合物沿c 轴的投影图如图,该化合物的化学式为 ( ) A.KC 12 B. KC 10 C. KC 8 D. KC 64、下面二维平面晶体所表示的化学式为AX 3的是 ( )A B C D5.下面图像是从NaCl 或CsCl 晶体结构图中分割出来的部分结构图,试判断属于NaCl 晶体结构的是① ② ③ ④A 图①B 图②C 图③D 图④6 非整数比化合物Fe 0.95O 具有NaCl 型晶体结构,由于n (Fe )∶n (O )<1∶1,所以晶体存在缺陷。
(整理)高中化学竞赛——晶体结构和性质
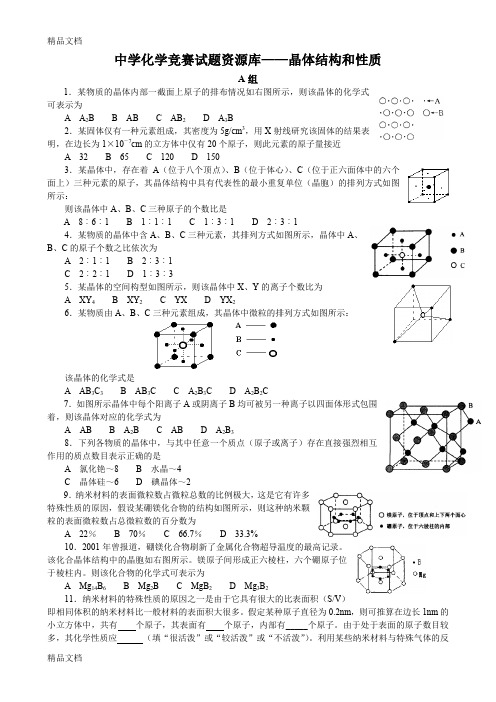
中学化学竞赛试题资源库——晶体结构和性质A组1.某物质的晶体内部一截面上原子的排布情况如右图所示,则该晶体的化学式可表示为A A2B B ABC AB2D A3B2.某固体仅有一种元素组成,其密度为5g/cm3,用X射线研究该固体的结果表明,在边长为1×10-7cm的立方体中仅有20个原子,则此元素的原子量接近A 32B 65C 120D 1503.某晶体中,存在着A(位于八个顶点)、B(位于体心)、C(位于正六面体中的六个面上)三种元素的原子,其晶体结构中具有代表性的最小重复单位(晶胞)的排列方式如图所示:则该晶体中A、B、C三种原子的个数比是A 8︰6︰1B 1︰1︰1C 1︰3︰1D 2︰3︰14.某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶体中A、B、C的原子个数之比依次为A 2︰1︰1B 2︰3︰1C 2︰2︰1D 1︰3︰35.某晶体的空间构型如图所示,则该晶体中X、Y的离子个数比为A XY4B XY2C YXD YX26.某物质由A、B、C三种元素组成,其晶体中微粒的排列方式如图所示:该晶体的化学式是A AB3C3B AB3C C A2B3CD A2B2C7.如图所示晶体中每个阳离子A或阴离子B均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为A AB B A2BC ABD A2B38.下列各物质的晶体中,与其中任意一个质点(原子或离子)存在直接强烈相互作用的质点数目表示正确的是A 氯化铯~8B 水晶~4C 晶体硅~6D 碘晶体~29.纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某硼镁化合物的结构如图所示,则这种纳米颗粒的表面微粒数占总微粒数的百分数为A 22%B 70%C 66.7%D 33.3%10.2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。
该化合晶体结构中的晶胞如右图所示。
镁原子间形成正六棱柱,六个硼原子位于棱柱内。
高中化学竞赛经典讲义——晶体结构

高中化学竞赛经典讲义——晶体结构晶体结构是高中化学竞赛中一个非常重要的知识点。
晶体是由一定数量的离子、分子或原子按照一定的几何排列方式所组成的固体,其最具有代表性的性质就是具有规则的几何形状。
晶体结构的了解对于理解晶体的性质、结构与合成具有重要意义。
晶体结构的揭示是通过实验技术以及理论研究来实现的。
其中最重要的实验手段是X射线衍射。
当X射线穿过晶体时,会产生衍射现象,出现一系列亮斑,这些亮斑的位置和强度依赖于晶体结构。
通过对衍射图像的解析,可以确定晶胞参数,揭示出晶体内部的几何排列。
理论上,可以使用动力学理论计算晶体的结构,得出一系列理论結构参数。
实验与理论的比较可以验证理论的正确性,并进一步完善理论模型。
晶体结构是有一定规律的,可以分为离子晶体和共价晶体两种类型。
离子晶体是由正离子和负离子通过离子键结合而成的晶体。
离子晶体的结构稳定,离子之间的排列有一定的规则。
若正离子与负离子的离子半径比较接近,离子晶体的结构会较紧密,例如氯化钠、氟化钙等。
若离子半径比差异较大,离子晶体的结构则会较为散松,例如氧化银、氧化铅等。
共价晶体是由原子通过共价键结合而成的晶体。
共价晶体的原子之间的键长和键角与几何排列有密切关系。
晶体结构可以通过晶胞参数来描述。
晶胞是晶体的最小重复单元,其正六面体的两边长度为a,与该边垂直的四棱面间的夹角为90°,而与该边相邻的两棱面间的夹角为120°。
晶胞参数a、b、c分别代表了晶体沿三个坐标轴方向的长度,而α、β、γ代表了晶体坐标轴之间的夹角。
晶体结构的描述还需要引入晶体结构中的间隙。
间隙是晶胞中没有原子、离子或分子占据的空隙,可以是正交的,也可以是六角形的。
晶胞中间隙的存在对于许多晶体性质有着重要影响,例如导电性、光学性质等。
为了更好的理解晶体结构,可以引入晶体结构分类的一些基本概念。
首先是晶格点的概念,晶格点是描述晶体排列的重要参考点。
晶格参数是晶体中两个晶格点之间的最短距离,而晶格的基元则是指两个相邻晶格点之间的最短距离。
高中化学竞赛-晶体结构-10年真题加完整答案

高中化学竞赛-晶体结构-10年真题加完整答案(2000)4.理想的宏观单一晶体呈规则的多面体外形。
多面体的面叫晶面。
今有一枚MgO单晶如附图1所示。
它有6个八角形晶面和8个正三角形晶面。
宏观晶体的晶面是与微观晶胞中一定取向的截面对应的。
已知MgO的晶体结构属NaCl型。
它的单晶的八角形面对应于它的晶胞的面。
请指出排列在正三角形晶面上的原子(用元素符号表示原子,至少画出6个原子,并用直线把这些原子连起,以显示它们的几何关系)。
(6分)【答案】;所有原子都是Mg(3分)所有原子都是O(3分)注:画更多原子者仍应有正确几何关系;右图给出了三角形与晶胞的关系,不是答案。
(2000)5.最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是______。
【答案】Ti14C13(2分)说明:凡按晶胞计算原子者得零分。
(2001)第5题(5分)今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。
在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,图5-1是该晶体微观空间中取出的部分原子沿C轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。
5-1由图5-1可确定硼化镁的化学式为:5-2在图5-l右边的方框里画出硼化镁的一个晶胞的透视图,标出该晶胞内面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球,硼原子用小黑球表示)。
图5-1硼化镁的晶体结构示意图第5题(5分)5-1MgB2(2分)(注:给出最简式才得分)或a=b≠c,c轴向上(3分)5-2(注:任何能准确表达出Mg︰B=1︰2的晶胞都得满分,但所取晶胞应满足晶胞是晶体微观空间基本平移单位的定义,例如晶胞的顶角应完全相同等。
)(2001)第10题(5分)最近有人用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60][CB11H6Cl6]。
高中化学竞赛总训练晶体结构

晶体结构训练1.(1)一种金属化合物中晶体结构为立方面心点阵,Mg原子采用类似金刚石的排列,每4个Cu原子形成四面体,相互之间共用顶点连接起来,排布在Mg原子的空隙中。
请问该晶胞中有个原子,该金属化合物最简式为。
(2)以草酸铁和草酸锌为原料,按一定比例溶于水中充分搅拌混匀,加热并蒸去混合溶液的水分;逐渐共沉淀下来,产物几乎为Fe3+与Zn2+均匀分布的的固溶体型草酸盐混合物,过滤、灼烧,即成很好的固相反应原料“前驱物”的制备——即一种尖晶石型物质A:O2-作立方最密堆积,Zn2+占据1/8的四面体空隙,Fe3+占据1/2的八面体空隙。
请写出该反应的化学方程式。
2.立方晶系中为什么不存在底心立方晶胞?为什么不带电荷的原子或分子都不以简单立方形成晶体?为什么对于相同的单质而言,六方紧密堆积(hcp)结构和立方紧密堆积(ccp)具有相同的密度?在这两种紧密堆积中,原子的配位数是多少?3.PdO属四方晶系,在其晶体中,Pd原子和O原子分别以层状排布,其中O原子层与层之间能够完全重合,而Pd原子则每隔一层重复一次,试画出PdO的晶胞,并指出距Pd最近的原子有几个,呈何种立体构型?4.已知Cu为立方面心结构,其原子量为63.54,密度ρ= 8.936g/cm3,晶胞参数为3.165Ǻ,试求:(1)阿佛加德罗数,(2)铜的金属半径5.铁存在几种晶型:体心立方的α型和面心立方的γ型等等,在910℃时,α型可以转变成γ型。
假设在转变温度条件下,最相邻的两个铁原子之间的距离是相同的,试计算在转变温度条件下,α型对γ型的密度之比为多少?6.金属Cu属于立方面心结构(1)分别画出(111)、(110)和(100)晶面上Cu原子的分布情况(2)计算这些面上的原子堆积系数(= 球数×球面积/球占面积)7.下列几种具有NaCl结构的化合物,它们之间的阳—阴离子距离列表如下:MgO 2.10ǺMgS 2.60 ǺMgSe 2.73 ǺMnO 2.24 ǺMnS 2.59 ǺMnSe 2.73 Ǻ(1)你如何解释这些数据?(2)从这些数据中,计算S2–离子的半径。
全国化学竞赛初赛讲义——晶体结构

全国化学竞赛初赛讲义——晶体结构一、晶体结构的概念和基本特点1.晶体结构的定义:晶体是由重复排列的原胞构成的固体。
2.晶体结构的基本特点:(1)有序性:晶体具有一定的有序性,原子、离子或分子排列有规律。
(2)三维性:晶体结构在三个维度上都有周期性重复性。
(3)稳定性:晶体结构对外界条件的变化具有较高的稳定性。
二、晶体结构的描述和表示方法1.晶胞:晶胞是由原胞重复平移所得到的一个最小重复单元,可以完全描述晶体的结构。
2.原胞:原胞是晶体中重复出现的、具有最简单结构的单元。
3.晶体参数:晶体参数包括晶胞的长度和夹角,用来描述晶体的形状和结构特征。
4.晶格:晶格是由原胞构成的、具有无限重复的空间点阵。
晶格可以用晶面和晶轴来表示。
三、晶体的结构类型和晶系分类1.结构类型:晶体的结构类型有离子晶体、共价晶体、金属晶体和分子晶体等。
2.晶系:晶系是根据晶格的对称性将晶体分为不同的类型。
晶系包括立方系、四方系、单斜系、正交系、斜方系、菱方系和三斜系。
四、晶体的基本结构单元1.离子晶体的基本结构单元是离子。
(1)离子晶体的特点:离子晶体由正、负离子通过电荷吸引力相互结合而成。
(2)离子晶体的类型:离子晶体包括简单离子晶体和复式离子晶体。
2.共价晶体的基本结构单元是原子。
(1)共价晶体的特点:共价晶体由共享电子键结合而成,键强较大。
(2)共价晶体的类型:共价晶体包括晶体分子、网络共价晶体和金刚石型晶体。
3.金属晶体的基本结构单元是金属离子。
(1)金属晶体的特点:金属晶体由金属阳离子和自由移动的电子云组成。
(2)金属晶体的类型:金属晶体包括简单金属晶体和合金。
4.分子晶体的基本结构单元是分子。
(1)分子晶体的特点:分子晶体由分子之间的相互作用力相互结合而成。
(2)分子晶体的类型:分子晶体包括极性分子晶体和非极性分子晶体。
五、晶体的性质与应用1.晶体的性质:晶体具有各向异性、光学性、热学性、电学性等特点。
2.晶体的应用:(1)光学应用:晶体在光学领域有着广泛的应用,如光学仪器、激光技术等。
2010届高中化学竞赛专题辅导(三)晶体结构及答案

2010届高中化学竞赛专题辅导(三)晶体结构一.(9分)下图所示为HgCl2和不同浓度NH3-NH4Cl反应得到的两种含汞的化合物A和B的微观结构重复单元图。
1.写出A、B的化学式和B的生成反应方程式;2.晶体A中,NH3、Cl的堆积方式是否相同,为什么?3.晶体A中Hg占据什么典型位置,占有率是多少?4.指出B中阴阳离子组成特点;5.比较A和B在水溶液中溶解性的大小。
二.(14分)钛酸锶是电子工业的重要原料,与BaTO3相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具有优良稳定性。
因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。
制备高纯、超细、均匀SrTiO3的方法研究日益受到重视。
我国研究者以偏钛酸为原料常压水热法合成纳米钛酸锶,粒子呈球形,粒径分布较均匀,平均22nm。
已知SrTiO3立方晶胞参数a=390.5pm。
1.写出水热法合成纳米钛酸锶的反应方程式;2.SrTiO3晶体的结构可看作由Sr2+和O2-在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由O2-构成,另一种由Sr2+和O2-一起构成,Ti4+只填充在O2-构成的八面体空隙中。
(1)画出该SrTiO3的一个晶胞(Ti4+用小球,O2-用大○球,Sr2+用大球)(2)容纳Ti4+的空隙占据所有八面体空隙的几分之几?(3)解释为什么Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙?(4)通过计算说明和O2-进行立方密堆积的是Sr2+而不是Ti4+的理由(已知O2-半径为140pm)3.计算22nm(直径)粒子的质量,并估算组成原子个数。
三.(10分)NH4Cl为CsCl型结构,晶胞中包含1个NH4+和1个Cl-,晶胞参数a=387pm。
把等物质的量的NH4Cl和HgCl2在密封管中一起加热时,生成NH4HgCl3晶体,晶胞参数a=b=419pm、c=794pm(结构如右图)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2010届高中化学竞赛专题辅导(三)晶体结构一.(9分)下图所示为HgCl2和不同浓度NH3-NH4Cl反应得到的两种含汞的化合物A和B的微观结构重复单元图。
1.写出A、B的化学式和B的生成反应方程式;2.晶体A中,NH3、Cl的堆积方式是否相同,为什么?3.晶体A中Hg占据什么典型位置,占有率是多少?4.指出B中阴阳离子组成特点;5.比较A和B在水溶液中溶解性的大小。
二.(14分)钛酸锶是电子工业的重要原料,与BaTO3相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具有优良稳定性。
因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。
制备高纯、超细、均匀SrTiO3的方法研究日益受到重视。
我国研究者以偏钛酸为原料常压水热法合成纳米钛酸锶,粒子呈球形,粒径分布较均匀,平均22nm。
已知SrTiO3立方晶胞参数a=390.5pm。
1.写出水热法合成纳米钛酸锶的反应方程式;2.SrTiO3晶体的结构可看作由Sr2+和O2-在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由O2-构成,另一种由Sr2+和O2-一起构成,Ti4+只填充在O2-构成的八面体空隙中。
(1)画出该SrTiO3的一个晶胞(Ti4+用小球,O2-用大○球,Sr2+用大球)(2)容纳Ti4+的空隙占据所有八面体空隙的几分之几?(3)解释为什么Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙?(4)通过计算说明和O2-进行立方密堆积的是Sr2+而不是Ti4+的理由(已知O2-半径为140pm)3.计算22nm(直径)粒子的质量,并估算组成原子个数。
三.(10分)NH4Cl为CsCl型结构,晶胞中包含1个NH4+和1个Cl-,晶胞参数a=387pm。
把等物质的量的NH4Cl和HgCl2在密封管中一起加热时,生成NH4HgCl3晶体,晶胞参数a=b=419pm、c=794pm(结构如右图)。
1.已知Cl-半径为181pm,求NH4+(视为球形离子)的半径。
2.计算NH4HgCl3晶体的密度;3.指出Hg2+和NH4+的Cl-具体配位形式;4.通过具体计算,指出晶体中Cl-与Cl-之间的最短距离是多少?四.(8分)金属铜的理想堆积模型为面心立方紧密堆积(CCP),设它的边长为acm。
在晶体中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)面。
1.请画出金属铜的晶胞(○表示Cu原子),并涂黑有代表性的1个(1,1,1)面上的Cu原子。
2.计算(1,1,1)面上Cu占整个面积的百分率以及Cu占整个体积的百分率(给出计算过程)。
3.在1个盛有CuSO4溶液的电解槽内电镀铜,其中阴极经过特殊处理,只有1个(1,1,1)面暴露在电解质溶液中,其余各面均被保护。
假设此面面积为bcm2,电镀时电流恒为I。
Cu2+在此面上做恒速率均匀沉积,tmin后,有一层Cu原子恰好在阴极上沉积完毕,求这是已沉积的第几层Cu原子?(阿伏加德罗常数为N A,法拉第常数为F)五.(10分)某钠盐X的阴离子为正八面体构型,由7个原子70个电子组成。
X晶体的结构有如下特点:阴离子的空间排列方式与NaCl晶体中的Na+(或Cl-)的排列方式完全一样,而Na+占据其全部四面体空隙中。
1.确定阳离子、阴离子个数比;2.确定X的化学式;3.如果X晶体的晶胞参数为a(cm),X的摩尔质量为M X(g/mol),写出X密度的表达式;4.X晶体中Na+的空间排列方式与CsCl晶体中的Cs+(或Cl-)的排列方式是否完全一样?如果将阴离子看作由Na+形成的空隙中,那么占有率为多大?5.如果晶胞的坐标原点为Na+,请画出该晶胞全部阴离子的空间构型(阴离子用●表示)6.某钾盐Y的阴离子组成和在晶胞中的排列方式与X相似,而K+填充在全部八面体空隙中,写出Y的化学式。
六.(5分)Na2O为反CaF2型结构,晶胞参数a=555pm。
1.计算Na+的半径(已知O2-半径为140pm);2.计算密度。
七.(8分)点阵素单位是指最小的重复单位,将最小重复单位的内容用一个点阵表示,最小重复单位中只含一个点阵点,称为素单位。
含2个或2个以上点阵点的单位称为复单位。
画出素单位的关键是能按该单位重复,与单位预角上是否有圆圈无关。
某平面周期性结构系按右图单位重复堆砌而成。
1.写出该素单位中白圈和黑圈的数目。
2.请画出2种点阵素单位,要求一种顶点无原子,另一种顶点有原子。
3.请画出石墨片层的3种点阵素单位。
八.(10分)最简单的二元硼氮化合物可以通过下列反应合成:B2O3(l)+2NH3(g) 2BN(s)+3H2O(g)反应产生的氮化硼的结构与石墨结构相类似,但上、下层平行,B、N原子相互交替(见图1),其层状六方氮化硼的晶胞如图2所示。
层内B-N核间距为145 pm,面间距为333 pm。
H 3BO 3的层状结构请回答下列问题:⑴写出晶胞中B 、N 原子的原子坐标。
B 原子: ,N 原子 。
⑵试列出求算层状六方氮化硼晶体的密度的计算式:(阿伏加德罗常数用N A 表示) 。
⑶在高压(60 kpa )、高温(2000℃)下,层状六方氮化硼晶体可转化为立方氮化硼, 它与金刚石有类似结构。
若立方氮化硼晶胞的边长为a pm ,试列出求算立方氮化硼晶体 中B -N 键键长的计算式: 。
九.(8分)正硼酸(H 3BO 3)是一种片层状结构白色晶体,层内的H 3BO 3分子通过氢键相连(如右图)。
1.正硼酸晶体属于 晶体;2.片层内微粒间的作用力是上面?片层间微粒间的作用力又是上面?3.含1mol H 3BO 3的晶体中有 mol 氢键;4.以1个片层为研究对象,画出其二维晶胞,并指出其所包含的内容。
十.(11分)Ar 、Xe 、CH 4、Cl 2等分子能和水形成气体水合物晶体。
在这种晶体中,水分子形成三维氢键骨架体系。
在骨架中有空穴,它可以容纳这些气体小分子形成笼型结构。
(1)甲烷的气体水合物晶体成为可燃冰。
已知每1m 3这种晶体能释放出164m 3的甲烷气体。
试估算晶体中水与甲烷的分子比。
(不足的数据由自己假定,只要假设合理均按正确论)(2)X -射线衍射分析表明,该晶体属于立方晶系,a =1200pm (即晶胞为立方体,边长为1200pm )。
晶胞中46个水分子围成两个五角十二面体和六个稍大的十四面体(2个六角形面,12个五角形面),八个CH 4分子可以进入这些多面体笼中。
计算甲烷和水的分子数之比和该晶体的密度。
(3)已知Cl 2的气体水合物晶体中,Cl 2和H 2O 的分子数之体为1︰8,在其晶体中水分子所围成的笼型结构与可燃冰相同。
推测它的结构。
十一.近年来对于三价铜的研究日益深入,特别随着是钇钡铜氧化物的研究的深入,三价铜化合物越来越受到化学家的重视。
起初发现的三价铜化合物为离子化合物,三价铜存在于阴离子[Cu 2O 6]6-中,目前所发现的三价铜配合物都是四配位的。
1.画出[Cu 2O 6]6-的结构;2.一种三价铜的稀土化合物LaCuO 3的晶格属立方晶系,氧离子位于棱心,阳离子各占据氧离子所构成的空隙中,其中三价铜离子的配位数是La(Ⅲ)的一半,试画出LaCuO 3的晶胞。
十二.(12分)Q 为多核电中性对称配合物,化学式可写成M 3A 3Cl 3,其中M 为中心原子,A 为一有机配体(由常见元素组成)。
A 为中性配体,不带电荷,M 的质量分数为30.70%。
空气中灼烧有白烟和刺激性气体生成,A 中也有一C 3轴。
将Q 溶解在液氨中得R ,分离溶液后蒸馏结晶再灼烧,得红褐色固体氧化物。
R 可由一常见白色难溶物(氯化物)溶解在液氨中制得。
1.M 为何种元素,指出其配位数;2.推出A 的化学式;3.画出Q的结构。
十三.(8分)发光材料Y2O2S的晶体属三方晶系,它的六方晶胞参数为:a=378.8pm,c=659.1pm。
在晶体中,每个Y原子由3个S原子和4个O原子和它配位,Y原子坐标为±(1/3,2/3,0.71),O原子坐标为±(1/3,2/3,0.36),试画出Y2O2S的晶胞。
十四.(14分)钛酸锶是电子工业的重要原料,与BaTO3相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具有优良稳定性。
因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。
制备高纯、超细、均匀SrTiO3的方法研究日益受到重视。
我国研究者以偏钛酸为原料常压水热法合成纳米钛酸锶,粒子呈球形,粒径分布较均匀,平均22nm。
已知SrTiO3立方晶胞参数a=390.5pm。
1.写出水热法合成纳米钛酸锶的反应方程式;2.SrTiO3晶体的结构可看作由Sr2+和O2-在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由O2-构成,另一种由Sr2+和O2-一起构成,Ti4+只填充在O2-构成的八面体空隙中。
(1)画出该SrTiO3的一个晶胞(Ti4+用小球,O2-用大○球,Sr2+用大球)(2)容纳Ti4+的空隙占据所有八面体空隙的几分之几?(3)解释为什么Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙?(4)通过计算说明和O2-进行立方密堆积的是Sr2+而不是Ti4+的理由(已知O2-半径为140pm)3.计算22nm(直径)粒子的质量,并估算组成原子个数。
十五.(11分)硫化锰MnS是赭色物质,用碱金属硫化物沉淀制得。
1.计算纯水中MnS的溶解度?已知MnS的K sp为3×10-14,H2S的K1和K2分别为1.0×10-7和1.2×10-132.α-MnS晶体属于立方晶系,用X射线粉末法测得该晶体晶胞参数a=522.4pm;(1)26℃测得该晶体的密度为4.05g/m3,请计算一个晶胞中的离子数;(2)若某α-MnS纳米颗粒形状为立方体,边长为α-MnS晶胞边长的10倍,请估算其表面原子占总原子数的百分比。
(已知S2-的半径0.184nm)十六.(6分)金属M的晶格是面心立方,密度为8.90g/cm3,计算:1.Ni晶体中最邻近的原子之间的距离。
2.能放入Ni晶体空隙中的最大原子半径是多少?2010届高中化学竞赛专题辅导(三)晶体结构答案一.(9分)下图所示为HgCl2和不同浓度NH3-NH4Cl反应得到的两种含汞的化合物A 和B的微观结构重复单元图。
1.写出A、B的化学式和B的生成反应方程式;2.晶体A中,NH3、Cl的堆积方式是否相同,为什么?3.晶体A中Hg占据什么典型位置,占有率是多少?4.指出B中阴阳离子组成特点;5.比较A和B在水溶液中溶解性的大小。
