高考化工流程试题专项训练
化工流程专题练习50题(含答案详解)

化学工艺流程1.明矾[KAl(SO4) 2·12H2O]易溶于水,不易溶于乙醇,在生产、生活中有广泛用途。
利用炼铝厂的废料——铝灰(含Al、Al2O3及少量的SiO2、FeO·xFe2O2)制备明矾的工艺流程如下:回答下列问题:(1)酸浸时为提高铝的浸取虑,可采取的措施是(填标号)。
a.改用同浓度的硝酸b.用硫酸多次浸取c.浸取时间缩短一半d.适当升高温度(2)滤渣1的成分是;滤渣2经过处理可以制得一种高效的无机高分子混凝剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为。
(3)检验滤液A中含有Fe2+的实验方案及现象是。
(4)已知常温下K sp[Fe(OH)3]=4.0×10-38,当调节溶液的pH=3时,溶液中c(Fe3+)= 。
(5)操作Ⅱ中包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,使用酒精洗涤明矾晶体的目的是;明矾净水的原理是(写离子方程式)。
(6)已知在pH=3和加热条件下,MnO4-可与Mn2+反应生成MnO2,则上述流程图中加入适量MnSO4发生反应的离子方程式为。
.(1)bd(2分)(2)SiO2(1分)+3(2分)(3)取少量滤液A于试管中,滴入几滴酸性高锰酸钾溶液,高锰酸钾溶液褪色,说明滤液A中含有Fe2+(或取少量滤液A于试管中,滴入几滴铁氰化钾溶液,产生蓝色沉淀,说明滤液A中含有Fe2+)(2分)(4)4.0×10-5 mol·L-1(2分)(5)利用乙醇的易挥发性带走水分,使产物快速变干(2分)Al3++3H2O Al(OH)3(胶体)+3H+(2分)(6)3Mn2++2MnO+2H2O=5MnO2↓+4H+(2分)2. 硫酸锌可用于制造锌钡白、印染媒染剂等。
用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:K sp[Fe(OH)3]=4.0×10−38,K sp[Cu(OH)2]=2.2×10−20(1)“滤渣1”的主要成分是(填化学式)。
高考化学专题复习—化工流程题精选

高考化学专题复习—化工流程题精选1. 某化工厂制备净水剂硫酸铁铵[NH4Fe(SO4)2﹒6H2O]晶体的一种方案如下:下列说法不正确的是A. 滤渣A的主要成分是CaSO4B. “系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等C. 相同条件下,硫酸铁铵溶解度比硫酸铁小D. “氧化”反应中试剂B可选NaClO2. 金属钛易于和肌肉长在一起,可用于制造各种人造关节。
工业上由钛铁矿主要成分为(FeTiO3,含少量Fe2O3),含少量制备海绵钛的工艺流程如下:下列说法错误的是A. 步骤①中粉碎钛铁矿可以提高原料利用率B. 步骤②中氧化剂和还原剂的物质的量之比为1:2C. 步骤③中应避免接触水D. 步骤④中采用的分离操作为过滤3. 我国化学家侯德榜改革国外的纯碱生产工艺,生产流程如图所示,下列说法不正确的是A. 在沉淀池中应先通入氨气,再通入二氧化碳气体B. 该反应原理:NH3 + CO2 + H2O ═ HCO-3+ NH4+C. 循环1中X是二氧化碳D. 在过滤后的母液中加入氯化钠粉末、通入氨气,搅拌,经冷却结晶后可得氯化铵晶体4. CuCl2·2H2O有如下的转化关系:下列说法错误的是A. 加热条件下,固体1与H2反应生成红色固体B. 气体2为Cl2C. 气体1遇氨气会产生“白烟”D. 固体2遇KI溶液生成黄色固体4、【答案】B【解析】二水氯化铜加热分解生成CuO,Cu(OH)2,HCl,H2O;A固体1是CuO,Cu(OH)2加热条件下与氢气反应生成铜,正确;B气体l是氯化氢和水蒸气,浓硫酸干燥氯化氢,不能氧化氧化氢,气体2为氯化氢,错误;C气体l是水蒸气和氯化氢的混合气体,遇氨气会生成氯化铵固体,正确;D固体2是氯化银,与Kl溶液反应生成碘化银,正确。
5.从海水中提取溴的流程如图所示,下列有关说法错误的是X试剂可以是SO2A.B.步骤Ⅲ反应的离子方程式为2Br - + Cl2 = Br2 + 2Cl -C.步骤IV包含萃取、分液和蒸馏D. 当生成1mol Br2时,需要消耗22.4L Cl26. 某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4某实验小组以废催化剂为原,料,回收锌和铜。
化工生产及流程题专项训练

化工生产及流程题专项训练1、海水的综合利用可以制备金属镁,其流程如下图所示:(1)若在空气中加热MgCl2·6H2O生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式;用电解法制取金属镁时,需要无水氯化镁。
写出用电解法制取金属镁的化学方程式。
(2)Mg(OH)2沉淀中混有Ca(OH)2应怎样除去?写出实验步骤。
________________________________________________________________________。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的目的:溶解时:_________________________________________________________;过滤时:_________________________________________________________;蒸发时:_________________________________________________________。
2、氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:依据上图,完成下列填空:(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为;与电源负极相连的电极附近,溶液PH (选填:不变、升高或下降)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为:。
(3)如果精盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是(选填:a、b、c);a.Ba(OH)2b.Ba(NO3)2c.BaCl2(4)为有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为(选填:a、b、c);a.先加NaOH,后加NaCO3,再加钡试剂b.先加NaOH,后加钡试剂,再加Na2CO3c.先加钡试剂,后加NaOH,再加Na2CO3(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过、冷却、(填操作名称)除去NaCl。
选择题中的化工流程(精简有答案)

【来源】河北省邢台市2019届高三上学期第四次月考化学试题
【解析】
【分析】
由流程图可知,电解饱和食盐水用以制备NaClO3溶液,电解NaClO3溶液用以制备含有少量NaClO3的NaClO4溶液,除去NaClO3杂质后,向溶液中加入NH4Cl,反应生成NH4ClO4和NaCl,结晶得到NH4ClO4粗品和含有氯化钠的母液。
故选C。
【点睛】
本题考查化学工艺流程,对元素及其化合物的主要性质的理解,结合题目获取新信息是解答关键,C选项为易错点,注意滤渣的组成为氢氧化铁和氢氧化铝,氢氧化铁不溶于氢氧化钠溶液。
2.C
【来源】河南省南阳市2019届高三上学期期末考试理科综合化学试题
【解析】
【详解】
A.FeS中铁元素显+2价,硫元素显-2价,都具有较强的还原性,在强酸性溶液中通入O2时都将被O2氧化,其离子方程式为4FeS+3O2+12H+=4Fe3++4S↓+6H2O,A项正确;
B.气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C.若调节溶液Z的pH偏小,将导致聚铁中铁的质量分数偏大D.溶液X转化为溶液Y需要加过量铁粉,再过滤
3.某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)下列叙述正确的是
2.实验室可利用硫酸厂炉渣(主要成分为铁的氧化物,还含有少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式为[Fe2( OH)n(SO4)3-0.5n]m,制备过程如图所示。下列说法不正确的是
A.炉渣中FeS与硫酸、氧气反应的离子方程式为4FeS+3O2+12H+=4Fe3++4S↓+6H2O
高三化学工业流程题典题汇总

化学工业流程题专题训练1. CoCl2·6H2O在饲料、医药工业上有广泛旳用途。
下列是以含钴废料(含少许Fe、Al等杂质)为原料制取CoCl2·6H2O旳一种新工艺流程:含钴废料盐酸已知:①钴与盐酸反应旳化学方程式为:Co+2HCl=CoCl2+H2↑②CoCl2·6H2O熔点86℃,易溶于水;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒旳无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液旳pH见下表:请回答问题:(1)加入碳酸钠调整pH至a,a旳范围是。
(2)操作Ⅰ包括3个基本试验操作,它们是、和过滤。
(3)制得旳CoCl2·6H2O需减压烘干旳原因是:。
(4)为测定产品中CoCl2·6H2O含量,某同学将一定量旳样品溶于水,再向其中加入足量旳AgNO3溶液,过滤,并将沉淀烘干后称量其质量。
通过计算发现产品中CoCl2·6H2O旳质量分数不小于100%,其原因也许是:。
(5)在试验室中,为了从上述产品中获得更纯净旳CoCl2·6H2O,措施是:。
(6)在上述新工艺中,用“盐酸”替代原工艺中“盐酸与硝酸旳混酸”直接溶解含钴废料,其重要长处为:。
原工艺较新工艺也有长处,其重要长处是。
2. 某化学研究性学习小组通过查阅资料,设计了如下图所示旳措施以含镍废催化剂为原料来制备NiSO4•7H2O。
已知某化工厂旳含镍催化剂重要具有Ni,还具有Al(31%)、Fe(1.3%)旳单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式完全沉淀时旳pH 如下: 沉淀物Al(OH)3 Fe(OH)3 Fe(OH)2 Ni(OH)2 pH5.2 3.2 9.7 9.2 (1)操作a 、c 中需使用旳仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要旳重要仪器为 。
(2)“碱浸”过程中发生旳离子方程式是 。
(3)“酸浸”时所加入旳酸是 (填化学式)。
化工流程练习及答案

高三化学专题—化工流程练习题1.硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如下图所示。
(1)为提高锌灰的浸取率,可采用的方法是____________(填序号)。
①研磨②多次浸取③升高温度④加压⑤搅拌(2)步骤Ⅱ所得滤渣中的物质是_______________(写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为____________ 。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是______________,②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取。
化学反应方式为_________________;③已知Na2SO4.10H2O及Na2SO4的溶解度随温度变化曲线如图。
从滤液中得到Na2SO4.10H2O的操作方法是________________________.(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。
则理论上所用锌灰中含有锌元素的质量为______。
2.高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。
其生产工艺如下:已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)③2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O回答下列问题:(1)该生产工艺应在(填“温度较高”或“温度较低”)情况下进行;(2)写出工业上制取Cl2的化学方程式;(3)K2 FeO4可作为新型多功能水处理剂的原因是;(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为;(5)在“反应液I”中加KOH固体的目的是:A.与“反应液I”中过量的Cl2继续反应,生成更多的KClOB.KOH固体溶解时会放出较多的热量,有利于提高反应速率C.为下一步反应提供反应物D.使副产物KClO3转化为KClO(6)从“反应液II”中分离出K2FeO4后,会有副产品(写化学式)。
(word完整版)化学工业流程高考题汇编(有标准),文档

化工生产真题训练2273+227〕。
1、〔 2021 山东高考〕工业上用重铬酸钠〔 Na Cr O〕结晶后的母液〔含少量杂质Fe 〕生产重铬酸钾〔 K Cr O工艺流程及相关物质溶解度曲线如图:(1〕由 Na2Cr2O7生产 K2Cr2O7的化学方程式为 ____________________________ ,经过冷却结晶析出大量K2Cr2O7的原因是 ____________________________ 。
(2〕向 Na2Cr2O7母液中加碱液调 PH的目的是 ____________________________ 。
〔 3〕固体 A 主要为 __________________ 〔填化学式〕,固体 B 主要为 ________〔填化学式〕。
〔 4〕用热水冲洗固体 A,回收的冲洗液转移到母液 ______ 〔填“ I 〞“ II 〞或“ III 〞〕中,既能提高产率又可使能耗最低。
Al 2O3、SiO2等〕2、〔 2021 年江苏高考〕烟气脱硫能有效减少二氧化硫的排放。
实验室用粉煤灰〔主要含制备碱式硫酸铝[Al 2(SO4) x(OH)6—2x] 溶液,并用于烟气脱硫研究。
〔 1〕酸浸时反响的化学方程式为;滤渣Ⅰ的主要成分为。
〔 2〕加 CaCO3调治溶液的 pH至 3.6 ,其目的是中和溶液中的酸,并使Al2(SO4)3转变成Al2(SO4)x(OH)6—2x。
滤渣Ⅱ的主要成分为〔填化学式〕;假设溶液的pH 偏高,将会以致溶液中铝元素的含量降低,其原因是〔用离子方程式表示〕。
〔 3〕上述流程中经完满热分解放出的SO2量总是小于吸取的SO2量,其主要原因是;与吸取 SO2前的溶液对照,热分解后循环利用的溶液的pH 将〔填“增大〞、“减小〞或“不1/113、〔 2021 年江苏高考〕实验室从含碘废液〔除H 2O 外,含有 CCl 4、 I 2、 I - 等〕中回收碘,其实验过程如下:〔 1〕向含碘废液中参加稍过分的 Na SO 溶液,将废液中的 I-;2复原为 I ,其离子方程式为2 3该操作将 I 2 复原为 I -的目的是 。
高三化学化工流程专题练习.doc

化工流程专题练1.(1)硫酸铁和硫酸铜的混合溶液中加入适量CuO,将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因(己知:Fe3♦开始沉淀时pH为2.7,沉淀完全时pH为3.7;Cu ?+开始沉淀时pH为4.7,沉淀完全时pH 为6.7):_______________________________________________________________________________________________________________________________________________________________________________________________ O (2)配平反应器中发生的反应方程式:口【2 + I~~KC1O3 + I (H2Q = I~~ 11(103)2 + O<C1 + I~~ L t(3)精制卤水中的MgCk与适量石灰乳反应合成碱式氯化镁[Mg(OH)2_xClx・mH2O],反应的化学方程式为。
2.4.氯苯胺可用来合成橡胶、化学试剂、染料、色素等化工产品,制备4.氯苯胺的原理如下:Cl^^VNOa +H2催化剂-甲醇、吗琳在1L密闭容器中加入4-氯硝基苯100g.雷尼镣(催化剂\少量吗琳(脱氯抑制剂,)及甲醇250mL (溶剂), 密封;先充入氮气,然后充入氢气至密闭容器中产生一定压强。
在一定压力、温度等条件下发生加氢反应,充分反应后,冷却、过滤、洗涤、蒸僧,并收集64~65。
0®分。
(1)开始时先通入N2的目的是__________________________________________________________________ (2)上述实验中过滤的目的是,洗涤所用的试剂是(3)蒸憎时除用到导管、锥形瓶、温度计外,还用到的玻璃仪器有:64〜65V时僧出液的主要成分是o3.邻苯甲酸丁基月桂酯是一种淡黄色透明油状液体,密度约为0.97g/cm3 ,不溶于水,能溶于有机溶剂,常用作聚氯乙烯等树脂的增塑剂。
高考化工流程题专题复习
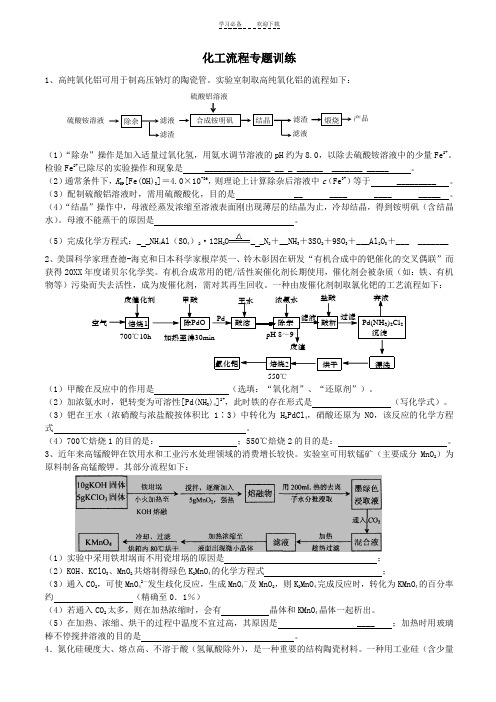
化工流程专题训练1、高纯氧化铝可用于制高压钠灯的陶瓷管。
实验室制取高纯氧化铝的流程如下:(1)“除杂”操作是加入适量过氧化氢,用氨水调节溶液的pH 约为8.0,以除去硫酸铵溶液中的少量Fe 2+。
检验Fe 2+已除尽的实验操作和现象是 _______________ __ _ ______ _______ _____ 。
(2)通常条件下,K SP [Fe(OH)3]=4.0×10-36,则理论上计算除杂后溶液中c (Fe 3+)等于 _________ 。
(3)配制硫酸铝溶液时,需用硫酸酸化,目的是 __ ____ ____ _____ 。
(4)“结晶”操作中,母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到铵明矾(含结晶水)。
母液不能蒸干的原因是 。
(5)完成化学方程式:_ _NH 4Al (SO 4)2·12H 2O_ _N 2+__NH 3+3SO 2+9SO 3+___Al 2O 3+___ _______2、美国科学家理查德-海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得20XX 年度诺贝尔化学奖。
有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收。
一种由废催化剂制取氯化钯的工艺流程如下:700℃10h加热至沸550℃空气(1)甲酸在反应中的作用是 (选填:“氧化剂”、“还原剂”)。
(2)加浓氨水时,钯转变为可溶性[Pd(NH 3)4]2+,此时铁的存在形式是 (写化学式)。
(3)钯在王水(浓硝酸与浓盐酸按体积比1∶3)中转化为H 2PdCl4,硝酸还原为NO ,该反应的化学方程式。
(4)700℃焙烧1的目的是:;550℃焙烧2的目的是: 。
3、近年来高锰酸钾在饮用水和工业污水处理领域的消费增长较快。
实验室可用软锰矿(主要成分MnO 2)为原料制备高锰酸钾。
高三化学总复习高考热点考题《化工流程图》专题训练 含答案

高三化学总复习高考热点考题《化工流程图》专题训练1、(2020年海淀)太阳能、风能发电逐渐得到广泛应用,在发电系统中安装储能装置有助于持续稳定供电,其构造的简化图如下:(1) 下列说法中,正确的是______( 填字母序号)。
a.太阳能、风能都是清洁能源b.太阳能电池组实现了太阳能到电能的转化c.控制系统能够控制储能系统是充电还是放电d.阳光或风力充足时,储能系统实现由化学能到电能的转化(2 )全钒液流电池是具有发展前景的、用作储能系统的蓄电池。
已知放电时V2+发生氧化反应,则放电时电极A 的电极反应式为__ ___;充电时电极B 做__ ____极。
(3) 含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+,Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:已知溶液pH 范围不同时,钒的化合价pH<2 pH>11+4价VO2+,VO(OH)+VO(OH)3-+5价VO2+VO43-①加入NaOH 调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH 后生成沉淀1的反应过程为__ _____、__ _____;所得滤液1中,铝元素的存在形式为___ _____。
②向碱性的滤液1( V的化合价为+4 )中加入H2O2的作用是________(用离子方程式表示)。
答案(1)abc(答对1~2个给1分)(2)VO2+ + e- + 2H+ VO2+ + H2O 阴(3)①Fe2+ + 2OH- Fe(OH)2↓ 4Fe(OH)2 + 2H2O + O2 4Fe(OH)3AlO2-(此空1分)② 2VO(OH)3- + H2O2 + 4OH- 2VO43-+ 6H2O2、(2020年海淀)铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为。
高考化工流程训练题
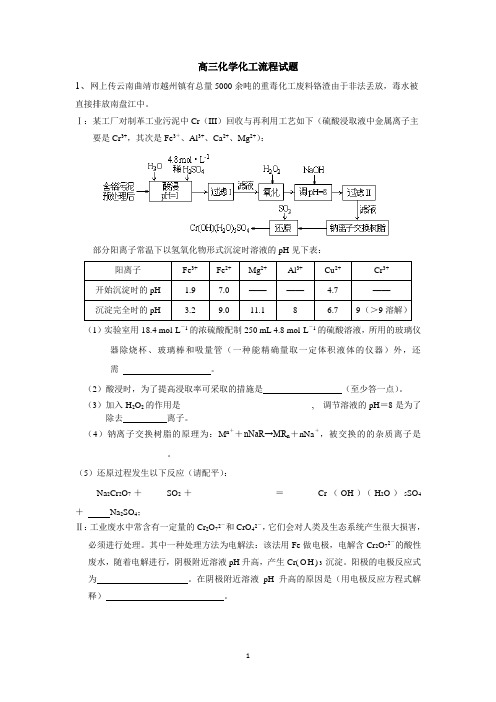
高三化学化工流程试题1、网上传云南曲靖市越州镇有总量5000余吨的重毒化工废料铬渣由于非法丢放,毒水被直接排放南盘江中。
Ⅰ:某工厂对制革工业污泥中Cr(III)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需。
(2)酸浸时,为了提高浸取率可采取的措施是(至少答一点)。
(3)加入H2O2的作用是______________________________, 调节溶液的pH=8是为了除去离子。
(4)钠离子交换树脂的原理为:M n++nNaR→MR n+nNa+,被交换的的杂质离子是____________。
(5)还原过程发生以下反应(请配平):_____Na2Cr2O7+_____SO2+____ ________ =____ Cr(OH)(H2O)5SO4+Na2SO4;Ⅱ:工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。
其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(O H)3沉淀。
阳极的电极反应式为。
在阴极附近溶液pH升高的原因是(用电极反应方程式解释)。
2、锂被誉为“高能金属”。
工业上用硫酸与β-锂辉矿(LiAlSi 2O 6和少量钙镁杂质)在一定条件下反应生成Li 2SO 4(以及MgSO 4、硅铝化合物等物质),进而制备金属锂,其生产流程如下:(1)用氧化物形式表示LiAlSi 2O 6的组成: 。
(2)沉淀X 主要成分为CaCO 3和 。
(3)写出盐酸与Li 2CO 3反应的离子方程式: 。
高考化工流程专项训练(带答案)

高考化工流程专项训练(带答案)1.海水资源丰富,海水中主要含有222433Na K Mg Cl SO Br CO HCO +++-----、、、、、、、等离子。
合理利用海水资源和保护环境是我国可持续发展的重要保证。
Ⅰ.火力发电燃煤排放的SO 2会造成一系列环境和生态问题。
利用海水脱硫是一种有效的方法,其工艺流程如下图所示:(1)天然海水的pH≈8,呈弱碱性。
用离子方程式解释原因___________________。
(2)天然海水吸收了含硫烟气后,要用O 2进行氧化处理,其反应的化学方程式是__________________________;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是___________________________。
Ⅱ.重金属离子对河流及海洋造成严重污染。
某化工厂废水(pH=2.0,p≈1g·mL -1)中含有Ag +、Pb 2+等重金属离子,其浓度各约为0.01mol·L -1。
排放前拟用沉淀法A .NaOHB .Na 2SC .KID .Ca(OH)2 (4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb 2+)=_________。
(5)如果用食盐处理其只含Ag +的废水,测得处理后的废水中NaCl 的质量分数为0.117%。
若环境要求排放标准为c(Ag +)低于1.0×l0-8mol·L-1,问该工厂处理后的废水中c(Ag +)=___,是否符合排放标准_____ (填“是”或“否”)。
已知Ksp(AgCl)=1.8×l0-10mol 2·L 2。
2.(16分)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
(1)①废水I 若采用CO 2处理,离子方程式是 。
②废水Ⅱ常用明矾处理。
实践中发现废水中的c (HCO 3-)越大,净水效果越好,这是因为 。
高考化工流程试题专项训练

化工流程试题专项训练【基础过关】增强你的自信心!【练1】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:请回答下列问题:(1)沉淀C 的化学式为_______,该物质除了用于金属冶炼以外,还可用作________。
(2)操作I 、操作II 、操作III 都是________________(填操作名称),实验室要洗涤Al (O H)3沉淀应该在________________装置中进行。
(3)生产过程中,除NaOH 、H 2O 可以循环使用外,还可以循环使用的物质有________(填化学式)。
用此法制取铝的副产品是________(填化学式)。
(4)写出N a2CO 3溶液与CaO 反应离子方程式:__________________________________。
(5)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:___ (填化学式)。
【练2】亚氯酸钠(NaCl O2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。
以下是过氧化氢法生产亚氯酸钠的工艺流程图:已知:①NaClO 2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO 2•3H2O。
②纯ClO 2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH 溶液是指160 gNaOH 固体溶于水所得溶液的体积为1L。
(1)160 g/L N aOH 溶液的物质的量浓度为 。
若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将S O2氧化成S O3,增强酸性; b.稀释ClO 2以防止爆炸;c .将NaClO 3氧化成ClO2(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaC lO 2比较稳定,所以吸收塔中应维持NaOH 稍过量,判断NaO H是否过量的简单实验方法是 。
专项训练 与金属锰有关的化工流程题
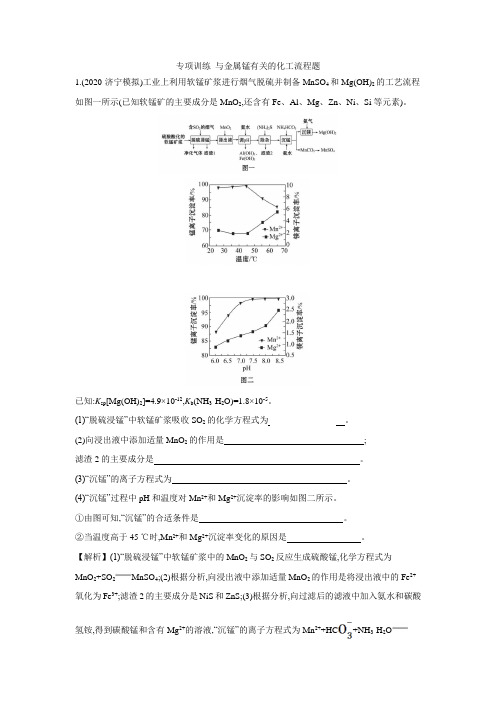
专项训练与金属锰有关的化工流程题1.(2020·济宁模拟)工业上利用软锰矿浆进行烟气脱硫并制备MnSO4和Mg(OH)2的工艺流程如图一所示(已知软锰矿的主要成分是MnO2,还含有Fe、Al、Mg、Zn、Ni、Si等元素)。
已知:K sp[Mg(OH)2]=4.9×10-12,K b(NH3·H2O)=1.8×10-5。
(1)“脱硫浸锰”中软锰矿浆吸收SO2的化学方程式为 _______________。
(2)向浸出液中添加适量MnO2的作用是______________________________;滤渣2的主要成分是_____________________________________________。
(3)“沉锰”的离子方程式为______________________________________。
(4)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图二所示。
①由图可知,“沉锰”的合适条件是_______________________________。
②当温度高于45 ℃时,Mn2+和Mg2+沉淀率变化的原因是_________________。
【解析】(1)“脱硫浸锰”中软锰矿浆中的MnO2与SO2反应生成硫酸锰,化学方程式为MnO2+SO2MnSO4;(2)根据分析,向浸出液中添加适量MnO2的作用是将浸出液中的Fe2+氧化为Fe3+;滤渣2的主要成分是NiS和ZnS;(3)根据分析,向过滤后的滤液中加入氨水和碳酸氢铵,得到碳酸锰和含有Mg2+的溶液,“沉锰”的离子方程式为Mn2++HC+NH3·H2OMnCO3↓+N+H2O;(4)①由图可知,“沉锰”的合适条件是温度控制在45 ℃左右,pH=7.5左右锰离子的沉淀率较高;②当温度高于45 ℃时,Mn2+和Mg2+沉淀率变化的原因是:沉锰是要加入碳酸氢铵,铵盐受热易分解,当温度高于45 ℃时,随着温度升高,NH4HCO3分解,c(C)下降,所以Mn2+沉淀率下降;同时随着温度升高,Mg2+水解生成Mg(OH)2程度增大,所以Mg2+沉淀率增大。
近五年化工流程题高考真题(含解析)
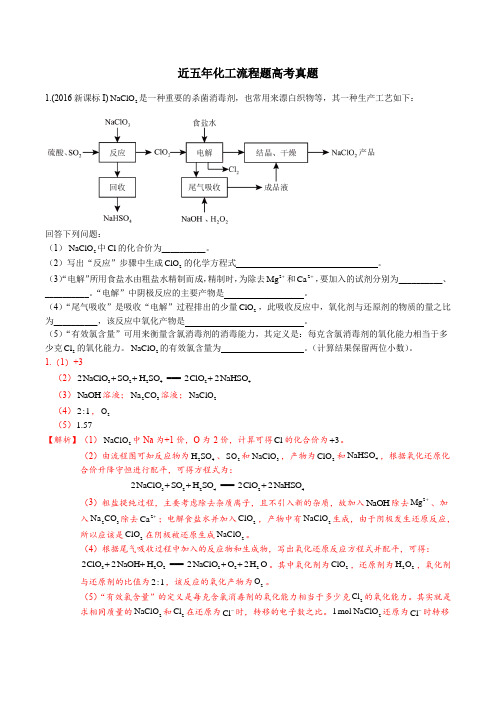
近五年化工流程题高考真题1.(2016新课标I)2NaClO 是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:回答下列问题:(1)2NaClO 中Cl 的化合价为__________。
(2)写出“反应”步骤中生成2ClO 的化学方程式 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去2Mg +和2Ca +,要加入的试剂分别为__________、__________。
“电解”中阴极反应的主要产物是。
(4)“尾气吸收”是吸收“电解”过程排出的少量2ClO ,此吸收反应中,氧化剂与还原剂的物质的量之比为__________,该反应中氧化产物是 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克2Cl 的氧化能力。
2NaClO 的有效氯含量为 。
(计算结果保留两位小数)。
1.(1)+3(2)3224242NaClO SO H SO ===2ClO 2NaHSO +++ (3)NaOH 溶液;23Na CO 溶液;2NaClO (4)2:1,2O (5)1.57【解析】(1)2NaClO 中Na 为+1价,O 为-2价,计算可得Cl 的化合价为3+。
(2)由流程图可知反应物为24H SO 、2SO 和3NaClO ,产物为2ClO 和4NaHSO ,根据氧化还原化合价升降守恒进行配平,可得方程式为:3224242NaClO SO H SO ===2ClO 2NaHSO +++(3)粗盐提纯过程,主要考虑除去杂质离子,且不引入新的杂质,故加入NaOH 除去2Mg +、加入23Na CO 除去2Ca +;电解食盐水并加入2ClO ,产物中有2NaClO 生成,由于阴极发生还原反应,所以应该是2ClO 在阴极被还原生成2NaClO 。
(4)根据尾气吸收过程中加入的反应物和生成物,写出氧化还原反应方程式并配平,可得:2222222ClO 2NaOH H O ===2NaClO O 2H O ++++。
高三化学《化工流程》专项训练(word含答案)

高三化学《化工流程》专项训练1. (14分)磷酸二氢钾( KH2PO4)可用于我国研制的巨型激光器“神光二号”。
某小组设计的以氟磷灰石[ Ca5(PO4)3F]为原料制备磷酸二氢钾晶体的工艺流程如下:已知:KCl+H3PO4=KH2PO4+HCl,其中HCl易溶于有机萃取剂。
回答下列问题:(1)写出氟磷灰石在高温下与SiO2、C反应的化学方程式,在该反应中的还原产物为。
(2)用烧碱溶液吸收尾气中的SiF4可生成两种盐,写出反应的离子方程式。
(3)写出副产品M的一种用途。
(4)从化学平衡角度分析,KCl和H3PO4反应制备KH2PO4时使用萃取剂的原因:。
(5)常温下,H3PO4的K a1=7.1×10-3、K a2=6.2×10-8、K a3=4.5×10-13。
通过计算解释KH2PO4溶液显酸性:。
(6)为避免水体富营养化,废水中的KH2PO4要先处理达标后再排放。
处理废水有两种方法:①沉淀法:向废水中加入石灰将磷元素全部转化成Ca3(PO4)2。
常温下,K sp[Ca3(PO4)2]=2.0×10-29。
一般地,溶液中离子浓度小于1.0×10-5mol·L-1时,被认为完全除去。
若废水中c(Ca2+)=1.0×10-3mol·L-1,则废水中c(PO43-)= mol·L-1(结果保留小数点后一位,2≈1.4)。
②电渗析法:用电渗析法从废水中提取KOH和H3PO4。
下列说法正确的是(填字母)。
A.膜1为阳离子交换膜,y极为正极B.c为稀KOH溶液,b为浓H3PO4溶液C.阳极反应式为2H2O+2e-=2OH-+H2↑D.每转移0.1 mol电子时理论上可以获得9.8 g H3PO42. (14 分)稀土元素钪广泛应用于冶金化工航空航天、超导、激光、核能等领域。
利用钛磁铁矿为原料(成分主要为Fe2O3、TiO2及少量Sc2O3等)提纯氧化钪并制备氯化钪的一种工艺流程如下:已知:①氯化钪化学式为ScCl3,无色易潮解的晶体,易溶于水和某些有机溶剂;②25℃时,草酸电离平衡常数为K a1 =5.0×10-2,K a2=5.4×10-5。
化工流程题练习题

“化工流程”练习题练习1:工业上用废铝(主要含Al和Fe)制备AlCl3晶体,请设计其生产流程,画出生产流程图。
练习2:工业生产纯碱的工艺流程示意图如下:完成下列填空:(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A B(2)实验室提纯粗盐的实验操作依次为:取样、、沉淀、、、冷却结晶、、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是。
碳酸化时没有析出碳酸钠晶体,其原因是。
(4)碳酸化后过滤,滤液D最主要的成分是(填写化学式),检验这一成分的阴离子的具体方法是:。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。
加石灰水后所发生的反应的离子方程式为:。
(6)产品纯碱中含有碳酸氢钠。
如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:(注明你的表达式中所用的有关符号的含义)在解决上面练习时思考如下问题:1.原材料和目标产物分别是什么?在生产过程中还涉及到哪些副产物?这些产物含有什么物质(或离子)?它们之间有什么联系?2.整个流程中,进行了几步化学反应?各步化学反应物质怎么变化?化学方程式怎么写?是否有涉及到课本中没有学过的化学方程式?如果有,怎么写?3.生产过程中进行了哪些工艺操作和处理方法(包括化学方法和物理方法),各步操作和处理方法的作用是什么?处理后的结果怎样?4.题目中提供了哪些信息?如何整理这些信息?在解决问题时,哪一步用到这些信息?5.在问题的解决中,是否涉及到分析、设计、评价、计算等问题?如果有,如何解决这些问题?练习3:七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。
硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH硼镁泥制取七水硫酸镁的工艺流程如下:根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为。
【高考复习】高考化学一轮复习化工流程专题练习(带答案)

【高考复习】高考化学一轮复习化工流程专题练习(带答案)学习知识重要的是为了应用在生活中,因此了解化工流程很有必要。
以下是化工流程专题练习,请考生注意做题质量。
(2022年广东省)32(16分)碳酸锂广泛应用于陶瓷和医药等领域。
已-锂辉石(主要成分为li2oal2o34sio2)为原材料制备li2co3的工艺流程如下:已知当Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、5.2、9.7和12.4;在303k下,Li2SO4、LiOH和Li2CO3的溶解度分别为34.2g、12.7g和1.3g。
(1)步骤ⅰ前,b-锂辉石要粉碎成细颗粒的目的是____________________________________(2)在第一步中,酸浸后得到的酸性溶液含有Li+、SO42-和其他杂质,如Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+,需要在搅拌下添加这些杂质(填充石灰石、氯化钙或稀硫酸),以将溶液的pH值调节到6.0~6.5,沉淀一些杂质离子,然后分离得到浸出液。
(3)步骤ⅱ中,将适量的h2o2溶液、石灰乳和na2co3溶液依次加入浸出液中,可除去的杂质金属离子有______________(4)在第三步中,生成沉淀的离子方程为________________________________________(5)从母液中可回收的主要物质是_____________(16分)(1)增加固液接触面积,加快浸出反应速度,提高浸出率(2)石灰石(3)fe2+、mg2+、ca2+(4)2li++co32-=li2co3(5)na2so4(广东)32(16分)由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。
工艺流程如下:(注:NaCl的熔点为801℃;AlCl3在181℃下升华)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①和②(2)将cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化工流程试题专项训练 1、工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:请回答下列问题:(1)沉淀C 的化学式为_______,该物质除了用于金属冶炼以外,还可用作________。
(2)操作I 、操作II 、操作III 都是________________(填操作名称),实验室要洗涤Al(OH)3沉淀应该在________________装置中进行。
(3)生产过程中,除NaOH 、H 2O 可以循环使用外,还可以循环使用的物质有________(填化学式)。
用此法制取铝的副产品是________(填化学式)。
(4)写出Na 2CO 3溶液与CaO 反应离子方程式:__________________________________。
(5)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:___ (填化学式)。
2、亚氯酸钠(NaClO 2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。
以下是过氧化氢法生产亚氯酸钠的工艺流程图:已知:①NaClO 2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO 2•3H 2O 。
②纯ClO 2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH 溶液是指160 gNaOH 固体溶于水所得溶液的体积为1L 。
(1)160 g/L NaOH 溶液的物质的量浓度为 。
若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a .将SO 2氧化成SO 3,增强酸性;b .稀释ClO 2以防止爆炸;c .将NaClO 3氧化成ClO 2溶解 吸收塔 NaClO 3配料ClO 2发生器H 2O 稀H 2SO 4160g/LNaOH SO 2和空 气混合气 H 2O 2 过滤 滤液NaClO 2•3H 2O(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO 2比较稳定,所以吸收塔中应维持NaOH 稍过量,判断NaOH 是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO 2被还原成NaCl ,所用还原剂的还原性应适中。
除H 2O 2外,还可以选择的还原剂是 (选填序号)。
a .Na 2O 2b .Na 2Sc .FeCl 2(6)从滤液中得到NaClO 2•3H 2O 粗晶体的实验操作依次是 (选填序号)。
a .蒸馏b .蒸发c .灼烧d .过滤e .冷却结晶要得到更纯的NaClO 2•3H 2O 晶体必须进行的操作是 (填操作名称)。
3、蛇纹石矿可以看作由MgO 、Fe 2O 3、Al 2O 3、SiO 2组成。
由蛇纹石制取碱式碳酸镁的实验步骤如下(1) 蛇纹石矿加盐酸溶解后,溶液里除了Mg 2+外,还含有的金属离子是________(2)进行Ⅰ操作时,控制溶液pH =7-8(有关氢氧化物沉淀的pH 见右表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_________沉淀溶解。
(3)从沉淀混合物A 中提取红色氧化物作颜料,先向沉淀物A 中加入 (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4)物质循环使用,能节约资源。
上述实验中,可以循环使用的物质是___________ (填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO 3·bMg(OH)2·cH 2O 中a 、b 、c 的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):①样品称量 ②高温分解 ③____________________________________④____________________________________ ⑤MgO 称量(6)18.2g 产品完全分解后,产生6.6gCO 2和8.0g MgO ,由此可知,产品的化学式中:a=_________ b =_________ C =_________4、生产着色铝片的工艺流程如下:请回答下列问题:⑴第①步中NaOH 溶液的作用是______________________________________。
⑵第②步HNO3的作用是对铝片进行抛光,写出其反应的的离子方程式______________________________________。
⑶在第④步电解是以铝为阴极,铝片为阳极,在硫酸介质中控制电压电流,使阳极放出O2与Al反应使铝表面形成一层致密的氧化膜。
写出有关的电极反应式:阴极:_____________________________,阳极:_____________________________。
⑷氧化膜质量的检验:取出铝片干燥,在氧化膜未经处理的铝片上分别滴一滴氧化膜质量检查液(3gK2CrO4+75mL水+25mL浓盐酸),判断氧化膜质量的依据是________。
A.铝片表面有无光滑B.比较颜色变化C.比较质量大小D.比较反应速率大小⑸将已着色的铝干燥后在水蒸气中进行封闭处理约20~30min,封闭的目的是使着色的氧化膜更加致密,有关反应化学方程式是_____________________________。
5、重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3 +7KCl+12H2O,试回答下列问题:⑴在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:。
⑵NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:。
⑶操作③的目的是什么,用简要的文字说明:。
⑷操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:。
⑸称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是:;②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)。
6、过碳酸钠俗称固体双氧水,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下:2Na2CO3+3H2O2=2Na2CO3·3H2O2ΔH<0回答下列问题:(1)与过碳酸钠的用途相关的化学性质是______________________________。
(2)下列物质可使过碳酸钠较快失效的是_______A.MnO2 B.H2SC.稀硫酸D.NaHCO3(3)加入NaCl的作用是_____________________________。
_____________________________。
(4)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与Fe3+生成稳定的配合物,Fe3+对反应的不良影响是_____________________________________________。
(5)反应的最佳温度控制在15℃~20℃,温度偏高时造成产率低的可能原因有________________________ _,温度偏低时造成产率低的可能原因有______ 。
(6)以上生产流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是________。
7、重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。
工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。
重晶石填料的生产工艺流程为:(1)在该流程中,为加快“漂白”速度,采取的措施有__________________。
(2)硫酸起到了“漂白”的作用。
请写出硫酸直接..起到该作用时的化学方程式:。
(3)铝粉也起到了“漂白”的作用。
你认为,铝粉是如何起到该作用的?_____________。
(4)有同学认为,既然两次水洗,那么铝粉的作用就不大。
你的解释是:_____________。
(5)煅烧的主要目的是_______________________________________。
(6)将煅烧后的固体磨细,使用的是加有刚玉(氧化铝)球的振动磨。
这说明刚玉具有很高的________ ___。
8、现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题:(1)本实验最适合的氧化剂X是__________A.K2Cr2O7B.NaClO C.H2O2 D.KMnO4含杂质的水溶液Ⅰ溶液Ⅱ溶液Ⅲ沉淀纯CuCl2·2H2O 加入氧化剂X 加入物质Y一定条件(2)物质Y不可以是___________A.CuO B.CuCl2C.Cu(OH)2 D.CuCO3(3)除去Fe3+的有关离子方程式是(物质Y在(2)中选择合适的选项):___________ (4)加入氧化剂的目的是____________________________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。
如不能,应如何操作?(如能,此空不填)________________________________________________。
9、以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。
近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐:4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O某工厂运用该原理生产铜和绿矾的工艺如下:Ⅴ回答下列问题:(1)固体A的成分为(写化学式);(2)写出反应Ⅲ的化学方程式;(3)试剂a为,试剂b为;(4)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为、、。
