物理化学第四版印永嘉第二章
物理化学第二章

卡诺热机工作原理
高低温热源 脱离高低温热源
p A
绝 热 压 缩
D
高温热源T2
等温膨胀
低温热源T1 等温压缩
B
绝 热 膨 胀
C
V
p
A (p1V1)
U=0, Q2=-W1=RT2ln(V2/V1)
Q=0 W4= U=CV(T2-T1)
D (p4V4)
B (p2V2)
Q=0 W2= U=CV(T1-T2)
• 化学变化及自然界发生的一切过 程进行的方向及其限度
• 第二定律是决定自然界发展方向 的根本规律
水的流动
• 水自发流动的方向:
• 从地势高的地方流向低的地方 • 自发从低处流向高处是不可能的
• 水从长江源头流至东海,损失了势能, 放出了热能。
• 1m3水从沱沱河(5000m)流到崇明岛(0m): • 热量=势能=5×107J=13.9度电能
• 常见的热机如: 汽车, 飞机, 轮船, 火力发电机等等.
• 卡诺设计了一种理想热机-卡诺热机, 此热机在高温 热源和等温热源间工作, 其工作介质是理想气体, 整 个循环过程均不存在摩擦力, 卡诺热机的循环由两个 绝热过程和两个等温过程组成.
• 卡诺证明了在相同两热源间工作的热机, 以卡诺热机 的效率为最大, 其它任何热机的效率不可能超过卡诺 热机.
• 欲长江黄河的水倒流,除非能将损失的 热量收集起来,使之全部转化为功,并 还给河水。实际上这是作不到的。
热的传递
• 长江三峡工程可将水的势能转化成清 洁的电能,每年可节约5000万吨煤。
• 三峡的电能归根到底来源于何处?
•
太阳
• 阳光普照大地,给地球送来了 光和热。
• 热:因温差而传递的能量
物理化学第四版_高职高专第二章 热力学第一定律

(iii) 只考虑不随时间而改变的平衡状态,而不涉及时 间变数。
第一节 热力学基本概念
热力学的优点和局限性都是显而易见的。热力学研究 所得结论具有统计意义,对于物质的微观性质无从作出解答。 热力学不涉及物质的微观结构和变化机理,因而虽应用广泛, 却无法解释变化发生的内在原因。热力学中没有时间概念, 因而无法判断变化何时发生以及以何种速率进行。
往往两个广度性质之比成为系统的强度性质。例如 体积质量(密度),它是质量与体积之比;摩尔体积,它是 体积与物质的量之比;摩尔热容,它是热容与物质的量 之比,而这些均是强度性质。
4. 物质的聚集状态和相 物质的聚集状态是在一定的条件下物质的存在形式,
简称物态。常见的聚集状态的符号如下:
系统中物理性质 及化学性质完全均匀一 致的部分称为相。在多 相系统中,相与相之间 有着明显的界面,越过 界面时,物理或化学性 质发生突变。
6. 热力学平衡态 在没有外界影响的条件下,系统的诸性质不随时间而
改变时,系统所处的状态称为热力学平衡态。热力学系统, 必须同时实现下列几个平衡,才能成为热力学平衡态
第一节 热力学基本概念
(i) 热平衡系统中没有绝热壁存在的情况下,系统各 部分温度相等。若系统不是绝热的,则系统与环境的温度 也相等。
等多种状态性质,这些性质之间存在着由理想气体状态方 程所反映的相互依赖关系:
所以,要确定系统的状态并不需要知道全部四个状 态性质,而只要知道其中三个就可以了。第四个状态性 质由状态方程即可确定。
第一节 热力学基本概念
原则上,任何一个状态性质既可作状态变数,又可 作状态函数。仍以理想气体为例:
印永嘉物理化学第四版答案

印永嘉物理化学第四版答案【篇一:参考书】class=txt>242 俄语(一外)《大学俄语》(1—2册全部)《大学俄语》(3册语法部分)外语教学与研究出版社北京外国语大学与莫斯科普希金俄语学院合编243 日语(一外) 《中日交流标准日本语》(初级上、下,中级上1---10课)人民教育出版社244 德语(一外) 《大学德语教学大纲》高等教育出版社《大学德语》(1—3册)高等教育出版社张书良主编245 法语(一外) 《法语》(1—3册)外语教学与研究出版社马晓宏等编《简明法语教程》(1—42课)商务印书馆出版孙辉编《大学法语》(1—3册)高等教育出版社李志清主编《大学法语简明教程》外语教学与研究出版社薛建成主编246 英语(一外) 《全国硕士研究生入学考试英语考试大纲(非英语专业)》大学英语教材《考硕词汇高效速记》王新国等360 数学(理学) 《高等数学》科学出版社,2005 西北工业大学高等数学教材编写组编《线性代数》科学出版社,2006 西北工业大学线性代数编写组编《高等数学常见题型解析及模拟题》西北工业大学出版社,2003陆全主编《线性代数辅导讲案》西北工业大学出版社, 2007 徐仲、张凯院主编361 数学分析数学分析科学出版社,1999 李成章等数学分析高等教育出版社,1999 陈记修等数学分析(第三版)高等教育出版社,2001 华东师范大学数学系735 英语水平测试(含词汇、阅读、翻译、写作)《英汉翻译教程》上外教社,2003.1 (40) 张培基编《实用英汉翻译教程》外语教研社,2002.2 (1) 申雨平编《英语写作手册》外语教学与研究出版社丁往道编《英语高级写作教程》国防工业出版社庾鲜海编736 马克思主义发展史西工大人文与经法学院自编教材738 物理化学《物理化学》西北工业大学、北京航天航空大学、北京理工大学、哈尔滨工业大学、哈尔滨工程大学出版社,2005 苏克和、胡小玲主编《物理化学》上、下册高等教育出版社,2000 傅献彩等编《物理化学简明教程》(第三版)高等教育出版社,1992 印永嘉等编740 艺术史《美的历程》安徽文艺出版社,1999年版李泽厚著《中国美术简史》高等教育出版社,1990年版中央美术学院美术史系编《外国美术简史》高等教育出版社,1990年版中央美术学院美术史系编741 设计理论《设计学概论》湖南科学技术出版社,2000 尹定邦编《工业设计概论》机械工业出版社,2000.2 程能林主编《工业设计方法学》北京理工大学出版社,1995.1 简召全编《计算机辅助工业设计》上海人民美术出版社,2004.1 张立群《设计数学基础》西北工业大学讲义余隋怀等742 建筑历史及城市建设史《中国建筑史》(第五版)中国建筑工业出版社,2003 潘谷西著《外国建筑史(十九世纪末以前)》(第三版) 中国建筑工业出版社,2003 陈志华著《外国近现代建筑史》(第二版)中国建筑工业出版社,2003 罗小未著《外国城市建筑史》中国建筑工业出版社沈玉麟编《中国城市建设史》中国建筑工业出版社董鉴泓编743 法学综合《法理学》北京大学出版社,高等教育出版社张文显主编《宪法学概论》北京大学出版社肖蔚云主编《民法》北京大学出版社,高等教育出版社魏振瀛主编《刑法》北京大学出版社,高等教育出版社高铭暄、马克昌主编745 行政管理学《行政管理学》(第三版)高等教育出版社、中山大学出版社,2003.8 夏书章主编《行政管理学概论》(第二版)北京大学出版社,2000.8 张国庆主编746 生物综合《生理学》(第6版)人民卫生出版社,2003年姚泰主编《生物化学》(第6版)人民卫生出版社,2003年周爱儒主编《医学分子生物学》人民卫生出版社,2005年冯作化主编《细胞生物学》高等教育出版社,2002 翟中和主编《现代遗传学》高等教育出版社,2004年赵寿元,乔守怡主编《微生物学教程》(第2版)高等教育出版社,2002 周德庆主编748 物理化学(医学)《物理化学》上、下册(第四版)高等教育出版社,2002年傅献彩《物理化学》第三版高等教育出版社,1992年天津大学物理化学教研室编《物理化学简明教程》高等教育出版社,1990年印永嘉、奚正楷等《物理化学》上、下册化学工业出版社,2006年何玉萼, 袁永明,薛英编相关的《物理化学》习题解析749 德语水平考试《德语语法专题》旅游教育出版社韩万衡《abc der schwachen/starken verben》 hueber verlagmei,klare u.a.《德汉同义词》外研社庄慧丽《德汉翻译基础教程》外研社张建琪《汉译德理论与实践》外研社钱文彩德语专业3-4年级教材802 水声学原理《水声学原理》哈尔滨船舶工程学院出版社,1993 刘伯胜,雷家煜主编《水声学基础》国防工业大学出版社,1981 顾金海,叶学千编著803 设施规划与设计《设施规划与设计》机械工业出版社,1995王家善、吴清一、周佳平编《现代生产物流及仿真》清华大学出版社,1998 张晓萍、颜永年、吴耀华、荆明编 804 电磁场与电磁波《电磁场与电磁波》《高等教育出版社2005年出版主编丁君 805 环境化学《环境化学》高等教育出版社,1997 戴树桂主编《环境化学》南京大学出版社,1993 王晓蓉编著806 工业设计《机械产品艺术造型基础》学术书刊出版社,1989.10 高敏编《工业设计概论》机械工业出版社,2000.2 程能林编《工业设计方法学》北京理工大学出版社,1995.1 简召全《计算机辅助工业设计》上海人民美术出版社,2004.1 张立群《设计数学基础》西北工业大学讲义余隋怀等807 电工技术与电子技术《电工技术》科学出版社,2004,9 史仪凯主编《电子技术》科学出版社,2005,1 史仪凯主编《电工电子应用技术》科学出版社,2005,1 史仪凯主编808 电气工程基础《电力电子技术》(第四版)机械工业出版社,2001 王兆安、黄俊编《电力电子技术》武汉理工大学出版社,2002 林辉、王辉编《电力电子技术典型题解析及自测试题》西北工业大学出版社,2002 吴小华、李玉忍等编《power electronic systems —theory and design》 tsinghua university press,2001 jai p.agrawal电机与拖动基础(第三版)清华大学出版社李发海王岩编著航空电机学国防工业出版刘迪吉电机学(第二版)机械工业出版社辜承林电机学(第三版)科学出版社朱东起李发海809 政治学原理《政治学原理》(第二版)高等教育出版社2006年第2版王惠岩主编《政治学基础》中国人民大学出版社,2002 ,王浦劬主编810 交通工程导论《交通工程总论》人民交通出版社徐吉谦编《交通工程学》人民交通出版社李作敏、杜颖主编《道路交通控制工程》人民交通出版社荆便顺主编811 管理学《管理学》清华大学出版社,2002 张德,徐国华,赵平编《管理学教程》北京大学出版社,2000.10 戴淑芬编812 现代西方经济学《西方经济学》(第三版)中国人民大学出版社,2005.3 高鸿业 813 中国近现代史《中国近代史》中华书局1994年李侃,李时岳等编《20世纪中国史》西北工业大学出版社2000年李云峰,陈舜卿主编814 运筹学《运筹学》清华大学出版社,2006 运筹学教材编写组815 医学图像处理《计算机图像处理与识别技术》高等教育出版社,2001 王耀南、李树涛、毛建旭《数字图像处理导论》西北工业大学出版社,2000 赵荣椿《数字图像处理》电子工业出版社,1998 kenneth.r.castleman816 数字信号处理《数字信号处理》(第二版)西北工业大学出版社,2002 俞卞章编《数字信号处理》(第二版)西安电子科技大学出版社,2001 丁玉美、高西全编《数字信号处理》(第二版)清华大学出版社,2001 程佩青编817 理论力学《理论力学》西北工业大学出版社,1998 西工大理论力学教研室《理论力学》(第六版)高等教育出版社,2002 哈工大理论力学教研室编,《理论力学习题集》西北工业大学2007 西工大理论力学教研室编《理论力学常见题型解析及模拟题》(第3版) 西北工业大学出版社,2003 支希哲818 中国特色社会主义理论与实践《邓小平理论和“三个代表”重要思想概论》中国人民大学出版社,2003.7 徐志宏、秦宣主编《邓小平理论和“三个代表”重要思想概论》高等教育出版社,2003.7 教育部社会科学研究与思想政治工作司主编819 动力装置原理《鱼雷活塞发动机原理》西北工业大学出版社,1991 赵连锋编820 艺术专业综合理论《设计学概论》湖南科学技术出版社,2000 尹定邦主编《美学与艺术鉴赏》上海人民出版社2001年版凌继尧张燕821 自动控制原理《自动控制原理》(第3版)国防工业出版社胡寿松主编824 计算机辅助制造《计算机辅助制造》科学出版社,2006年9月第二版卜昆等《数控加工理论与编程技术》机械工业出版社,2000 刘雄伟等编825 通信原理《通信原理》国防工业出版社,1995 樊昌信等编《信息传输基础》北京航空航天大学出版社,1995 欧阳长月等编《通信系统原理》西安电子科技大学出版社,1993 沈振元等编826 量子力学《量子力学教程》高等教育出版社,1979 周世勋编《量子力学教程》科学出版社,2003年版曾谨言827 信号与系统《信号与系统常见题型解析及模拟题》(第二版) 西北工业大学出版社,2001.5 范世贵等编《信号与线性系统分析》(第三版)高等教育出版社,1998.10 吴大正主编《信号与系统》西北工业大学出版社,1997 段哲民等编828 光学《光学》高等教育出版社赵建林编《光学》高等教育出版社赵凯华编《光学》高等教育出版社郭永康编《光学》山东大学出版社蔡履中等829 电子技术基础《电子技术》科学出版社,2005 史仪凯主编《电工学》下册电子技术(第五版)高等教育出版社,1999 秦曾煌主编《电子基础(模拟部分)》高等教育出版社,1998 康华光主编《电子基础(数字部分)》高等教育出版社,1998 康华光主编830结构力学(土建)《结构力学》高等教育出版社龙驭球(清华大学)编《结构力学》高等教育出版社杨弗康(湖南大学)编《结构力学》高等教育出版社杨天祥(天津大学)编831 噪声与振动控制《振动与噪声控制技术基础》科学出版社,2001 盛美萍等编著832 材料科学基础《材料科学基础》(第二版)西北工业大学出版社,2003 刘智恩《材料科学基础》上海交通大学出版社,2000 胡庚祥,蔡珣《材料科学基础》西安交通大学出版社,2000 石德珂《材料科学基础》清华大学出版社,1998 潘金生,仝健民833 物理化学《物理化学》西北工业大学、北京航空航天大学、北京理工大学、哈尔滨工业大学、哈尔滨工程大学出版社,2005 苏克和,胡小玲主编《物理化学简明教程》(第三版)高等教育出版社,1992 印永嘉等编《物理化学》(第四版)上、下册高等教育出版社,2000 傅献彩等编834 飞机总体设计原理《现代飞机总体设计》(中英对照)西北工业大学出版社,1995 王和平编“aircraft design: a conceptual approach”《现代飞机设计》 aiaa education series,1992国防工业出版社,1992 d.p.raymer,中译本:[美]雷曼尔著、钟定逵等译《飞机总体设计》航空工业出版社,1991 杨景佐等编《现代飞机总体综合设计》西北工业大学出版社,2001 李为吉等编835 有机化学《有机化学导论》天津大学出版社,1992 高鸿宾主编《有机化学》(第三版)高等教育出版社,2000 高鸿宾主编《有机化学》清华大学出版社,1995 王芹珠编《有机化学》(第二版)高等教育出版社,1999 邢其毅,徐瑞秋,周政编《有机化学简明教程》天津大学出版社,2001 高鸿宾主编836 航天器与导弹控制原理《航天器控制原理》西北工业大学出版社,2001.10 周军编《导弹控制系统原理》西北工业大学出版社,2000.10 杨军编837 气体动力学《气体动力学基础》西北工业大学出版社,2006王新月《流体力学》西北工业大学出版社,1994 张兆源、毛根旺编《气体动力学》西北工业大学出版社,1995 何洪庆、毛根旺编838 经济法《经济法》北京大学出版社杨紫煊主编《商法》北京大学出版社范健主编《劳动法学》中国政法大学出版社郭婕等主编839飞行器飞行力学《战术导弹轨迹与姿态动力学》西北工业大学出版社曾颖超、吕学富等编《飞行器飞行力学》西北工业大学出版社,1995.6 吕学富编《有翼导弹飞行力学》北京航空航天大学出版社,1983 周慧钟、李忠应、王瑾编《有翼导弹飞行动力学》西北工业大学出版社。
物理化学第四版课后答案

第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 C,另一个球则维持0 C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算用van der Waals计算,查表得知,对于N2气(附录七),用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 C,使部分水蒸气凝结为水。
物理化学简明教程(印永嘉) 热力学第二定律习题课

3 理想气体的atto循环由下面四个可逆步骤构成 (A)气体绝热可逆压缩; (B)恒容升温,气体从环境吸热; (C)气体经绝热可逆膨胀做功; (D)恒容降温回到原态。 该循环的T-S 图为( D )
T
S
4.某化学反应在300K, py于烧杯中进行时,放热60 kJ, 若在相同条件下在可逆电池中进行吸热6 kJ,则该系统的熵变为( D)J· K-1 (A) –200 (B)200 (C ) –20 (D)20 5. 上题中,可能做的最大有效功为(66 )kJ (A) –54 (B)54 (C ) –66 (D)66 6. 某气体状态方程为pV=nRT+bp(b>0),1mol该气 体等温下从V1V2,则Sm =( A)
√ √ √ √ √ √ √ √ √ √ √
√
Hale Waihona Puke 例2 选择和填空题1.下列四种表述中错误的是(C) ①定温定压下的可逆相变,系统的S=H/T ②系统经一自发过程总有S>0 ③自发过程的方向就是混乱度增加的方向 ④在绝热可逆过程中,系统的 S=0 (A )①② (B)③④ (C)②③ (D)①④ 2.定温定压下,某化学反应在电池中可逆进行时吸 热,据此可判断下列热力学量何者一定大于零( C ) (A) U (B) H (C) S (D) G
p1
p2
五、例题 例1 下列各过程中, U H S A G何者一定为零
U H
两种理想气体定温混合 理想气定温不可逆膨胀 理想气体绝热节流膨胀 实际气体绝热节流膨胀 实际气体绝热可逆膨胀 非理想气体卡诺循环 绝热( )p W’=0化学反应 0°C, py 的冰熔化成水
S A
G
√ √ √
二、热力学关系式
1 定义式:H=U + pV A=U TS G=H TS 2 热力学基本公式: dU=TdS pdV Wr’ dH=TdS + Vdp Wr’ dA= SdT pdV Wr’ dG= SdT + Vdp Wr’ 适用条件:密闭系统的任意过程
物理化学简明教程第四版(印永嘉)

-
21
热和功
• 热(heat):系统与环境间因温差的存在而传递的能量称为热. 热的符号为Q。
• Q的取号:系统放热为负;系统吸热为正。
• 热量总是从高温物体传至低温物体; • 当系统与环境温度相等时,达热平衡,没有热量的传递。
• 功(work)系统与环境之间传递的除热以外的其它能量都
称为功,用符号W表示。
-
2
系统与环境几个基本Fra bibliotek念• 系统 在科学研究时必须先确定研究对象,把一部分物质与
其余分开,这种分离可以是实际的,也可以是想象的。这种 被划定的研究对象称为系统,亦称为物系或体系。
• 环境 与系统密切相关、有相互作用或影响所能及的部分称为
环境或外界。
• 系统与环境之间的边界可以是实际的,也可以是想象的。
•第一定律是实践总结出的客观规律,它不是定义,也不能加 以证明,只能靠它推出的结论与实践相符来检验。
• 能量守恒与转化定律应用于热力学系统就是热力学第一定律。 • 能量守恒与转化定律的确立,绝不意味着该原理已告完成。
• 能量守恒与转化定律已经成为自然科学的一块基石,重要性 不言而喻,但决不是自然界唯一的法则。
-
29
小结:Δ与δ的差异
Δ,d 均表示变化
Δ表示大的、宏观的变化,例如从状态1变化到状态2,状态函 数的变化。 d表示微小的变化,全微分符号。 Δ、d后面为可以进行全微分的函数,包括所有状态函数。
δ表示微小量,后面为不可以直接进行全微(积)分的函数,包 括过程量,例如Q、W。
-
30
作业
Page 12:习题3;习题6
• 系统经历一过程的状态函数差值,只取决于系统的始末两态。 用数学 语言表达:状态函数在数学上具有全微分的性质,用符 号d表示,如dV、dp。
物理化学第四版印永嘉答案

物理化学第四版印永嘉答案【篇一:2、《物理化学》教学大纲(化学专业)】xt>一、课程基本信息(一)课程中文名称:物理化学(二)课程英文名称:physical chemistry (三)课程代码:15030100 15030101 (四)课程属性及模块:专业必修课(五)授课学院:理学院(六)开课学院:理学院(七)教材及参考书目教材:《物理化学》(第五版)上册,傅献彩,沈文霞等编,高等教育出版社,2005年《物理化学》(第五版)下册,傅献彩,沈文霞等编,高等教育出版社,2006年参考书:《物理化学核心教程》(第二版),沈文霞编,科学出版社,2009年《物理化学》,万洪文,詹正坤主编,高等教育出版社,2009年《物理化学简明教程》(第四版),印永嘉等编,高等教育出版社,2009年《物理化学学习指导》,孙德坤沈文霞等编,高等教育出版社,2009年《物理化学核心教程学习指导》,沈文霞等编,科学出版社,2009年《化学热力学基础》,李大珍编,北京师范大学出版社,1982年《物理化学》,朱文涛编,清华大学出版社,1995年《物理化学教程》(修订版),姚允斌,朱志昂编,湖南科技出版社,1995年(八)课程定位及课程简介《物理化学》是化学及相关学科的理论基础。
是化学、化工、冶金、材料等专业本科生必修的专业主干基础课之一。
它是从化学现象与物理现象的联系入手,借助数学、物理学等基础科学的理论及其提供的实验手段,来探求化学变化中最具普遍性的基本规律的一门学科。
它是先行课程无机化学、分析化学、有机化学普适规律的理论归纳和定量探讨,是后续专业知识深造和科研工作的理论基础,也是连接化学与其它学科的桥梁。
(九)课程设计基本理念依据“以学生为中心”的教育教学理念,本课程的教学目的主要是:(1)使学生在已学过的一些先行课程(无机化学、有机化学、分析化学、高等数学、普通物理学)的基础上,对化学运动作理论和定量探讨。
(2)使学生能系统地掌握物理化学的基本知识和基本原理,加深对自然现象本质的认识;(3)使学生学会物理化学的科学思维方法,培养学生提出问题、研究问题的能力,培养他们获取知识并用来解决实际问题的能力。
物理化学第四版第二章--热力学第一定律2013

7
状态函数的数学特征:Z是状态函数,
且 Z f ( x, y) ,则
dZ是全微分
dZ pdx Qdy
Z
Z2dZ
Z1
Z2
Z1
dZ 0
–
积分与路径无关,故可设计过程求其变化
(1)如关闭进出料阀,将料液及上空的气相作为系统 ________ (2)如反应釜一边进料、一边出料,仍以料液及上空的气相为系
统 ________。 (3)若把整个车间(动力电)、锅炉送气全划为系统 ________。
2024/8/23
6
2、状态和状态函数
状态:系统一切性质的总和
•状态函数:各种性质均为状态的函数
(ⅶ )自由膨胀过程(向真空膨胀过程)
如图所示, Psu=0
图1-1 气体向真空膨胀(自由膨胀)
气体
真空
18
§2.2 热力学第一定律
本质:能量的转化和守恒,是自然界 的基本规律。表示系统的热力学状态 发生变化时系统的热力学能与过程的 热和功的关系。
19
1.热和功
热与功是系统状态变化过程中和环境之间 进行能量交换的两种形式,它们随过程产 生;因过程而异,称为过程变量。
为热力学数据的建立、测定及应用,提供了理
论依据。
例:
C(石墨)
1 2
O2
(g)
Q V,a
CO
(g)
()
Q V,b
CO2
(g)
(b)
Q V,c
C(石墨) O2 (g) CO 2 (g)
(c)
物理化学简明教程(印永嘉) 热力学第二定律

第二章 热力学第二定律
返回目录
退出
8
§2.2 热力学第二定律的经典表述(经验总结)
19世纪初,资本主义工业生产已经很发 达,迫切需要解决动力问题。当时人们已 经认识到能量守恒原理,试图制造第一类 永动机已宣告失败,然而人们也认识到 能量是可以转换的。于是,人们就想到 空气和大海都含有大量的能量,应该是 取之不尽的。有人计算若从大海中取热 做功,使大海温度下降1℃,其能量可供 全世界使用100年…。
Q1 T1 W T2 T1 其中W为环境对致冷机所作的功;Q1为给致冷机作每 单位的功能从低温热源取出的热。
第二章 热力学第二定律
返回目录
退出
25
根据题给条件,此致冷机的可逆致冷效率为
253 5.62 298 253
而欲保持冷冻系统的温度为20℃,则每分钟必 须由低温热源取出104 J的热。因此需对致冷机作 的功应为 W=Q/=(104/5.62) J· min-1= 1780 J· min-1故 开动此致冷机所需之功率为
返回目录
退出
3
思路:找出决定这些自发过程的方向和限度 的共性的因素,然后判断个性的化学反应的方向 和限度。 在本章中,我们发现功和热的转换具有不可逆 性,也就是功向热转换的自发性。功和热是自然 界最普遍、最概括的两种能量形式,而且任何化 学过程都会伴随功和热的产生,因此如果从这里 面提取出一个函数就可以为方向的判断提供依据。
高温热源T2 吸热Q2 做出W’ 放热 吸热 QQ 22
I
放热Q1’
R
做功 W 做出 W 放热 Q 吸热 Q 11
低温热源T1
联合热机工作的总结果是:
第二章 热力学第二定律
《物理化学第4版》第二章2.7 亥姆赫兹函数和吉布斯函数ppt课件

即 -d(H -TS) ≥ -δW′
5
定义 G def H-TS G—吉布斯函数或吉布斯自由能。G 是状态函 数, 广度性质.
代入前式,得 -dGT,p ≥ -δW′ -△GT,p ≥-W′
6
-△GT,p ≥ - W′
§2-7 亥姆赫兹函数及吉布斯函数
一、亥姆赫兹函数(A)定义
热力学第一定律
得到
dU =δQ +δW
(W+W体积功)
δQ = dU –δW
热力学第二定律 dS Q
Texห้องสมุดไป่ตู้
不可逆过程 可逆过程
1
热力学第一、二定律结合,得到
dS (dU W )
Tex
TexdS dU-δW
写成 -(dU-TexdS) -δW 对等温过程,T=T1=T2=Tex ,
2. 等温等压,G >0,不自发过程,G <0,自发过程。G的正负号判断过程能否 自发进行。
8
三、热力学判据
1、熵判据
对隔离系统,δQ=0, 且环境也不能对它
做功,即隔离系统是等容、等热力学能的。
则:
dSU,V 0
> 自发 = 平衡
隔离系统发生一个不可逆过程,也一定是自 发过程。
熵判据判断过程是否为自发过程要用隔离系 统,既有系统的熵变,也有环境的熵变。
“=” 可逆过程,“>” 不可逆过程 等温可逆过程中系统亥姆赫兹函数A 的减少等于 系统所作的功(-W),不可逆过程中这个减少值大 于所作的功(-W)。也指最大功。
4
二、吉布斯函数 G定义
物理化学知识点总结[物理化学知识点归纳]
![物理化学知识点总结[物理化学知识点归纳]](https://img.taocdn.com/s3/m/ea35e0ce227916888586d7c1.png)
物理化学知识点总结[物理化学知识点归纳]热力学第一定律...............................................................................(1)第二章热力学第二定律. (3)第三章化学势 (7)第四章化学平衡 (10)第五章多相平衡 (12)第六章统计热力学基础 (14)第七章电化学 (16)第八章表面现象与分散系统 (20)第九章化学动力学基本原理 (24)第十章复合反应动力学 (27)物理化学知识点归纳根据印永嘉物理化学简明教程第四版编写,红色的公式要求重点掌握,蓝色的公式掌握。
第一章热力学第一定律本章讨论能量的转换和守恒,其目的主要解决变化过程的热量,求功的目的也是为了求热。
1. 热力学第一定律热力学第一定律的本质是能量守恒定律,对于封闭系统,其数学表达式为∆U =Q +W 微小过程变化:d U =δQ +δW只作体积功:d U =δQ −p e d V 理想气体的内能只是温度的函数。
2. 体积功的计算:δW V =−p 外d VW V =−∫p 外d VV 1V 2外压为0(向真空膨胀,向真空蒸发):W V =0;恒容过程:W V =0恒外压过程:W V =−p 外(V 2−V 1) 恒压过程:W V =−p (V 2−V 1) 可逆过程:W V =−∫V 2V 1p d V (主要计算理想气体等温可逆、绝热可逆过程的功)3. 焓和热容由于大多数化学反应是在等压下进行的,为了方便,定义一个新的函数焓:H =U +pV焓是状态函数,是广度性质,具有能量,本身没有物理意义,在等压下没有非体积功的热效应等于焓的改变量。
等容热容:C V = δQ V⎛∂U ⎛=⎛⎛ d T ⎛∂T ⎛V等压热容:C p =δQ p⎛∂H ⎛=⎛⎛ d T ⎛∂T ⎛p对于理想气体:C p −C V =nR4. 理想气体各基本过程中W 、Q 、∆U 、∆H 的计算5. 焦耳-汤姆逊系数µ=⎛⎛∂T ⎛1⎛∂H ⎛=−⎛⎛⎛,用于判断气体节流膨胀时的温度变化。
物理化学(印永嘉)-第二章-热力学第二定律

按理想气体的可逆绝热过程方程式 TVγ-1=常数,有
T1V2γ-1 =T2V3γ-1 T1V1γ-1 =T2V4γ-1 V2 /V1 V3 /V4
Q2=-W2 = -nRT2ln(V2 / V1 ) Carnot 循环过程中,系统对环境所作之功
H C and QA ' QA
(W W ') 0 即系统对环境做净功
又 QA (W QB ), QA ' (W 'QB ') (QB QB ') (W W ') 0 (QB QB ') (W W ') 0 即系统得到净热
总的结果是,偶合热机 HC 循环一周 后,从环境得到的热(QB + QB’)转 变成了等量的功(W + W’)。
物理化学
第二章 热力学第二定律
The Second Law of Thermodynamics
主编:印永嘉
热力学第二定律
热力学第二定律所要解决的问题 ①热与功的转化规律 ②物质变化过程的方向与限度。
§2.1 自发过程的共同特征
• 什么是自发过程? • 从不平衡态自发地移向平衡态的过程称
为自发过程,在没有外界影响下,这个过程 不可能逆转,是一个不可逆过程。 • 这种在一定条件下不需外界作功一经引 发就能自动进行的过程称为自发过程。
• 此定理可以用反证法进行证明。
卡诺定理的证明
TA
QA
QA’
W HH
W’ CC
QB
QB’
TB
图中 H 为任意热机,C 为可逆 热机(卡诺热机)。调整 C 的 大小使 |QA| = |QA’|
设 H > C, 使卡诺热机逆转。偶合热 机 HC 循环一周后,高温热源 TA 复原。
物理化学简明教程印永嘉电化学习题课ppt课件

例4、已知NaCl, KNO3, NaNO3在稀溶液中的m依次为 1.2610-2,1.4510-2,1.2110-2 Sm2mol-1。已知KCl溶
液中t+=t-,设在此浓度范围内, m不随浓度变化。 (1)试计算以上各离子的m (2)假定0.1mol dm-3HCl溶液电阻是0.01mol dm-3 NaCl
3.下列电解质溶液中(0.01mol·kg-1), 最大的是(A)
(A)NaCl (B)CaCl2 (C) LaCl3 (D) CuSO4
4.对于同一电解质水溶液,当其浓度逐渐增加时, 何种性质将随之增加( A)
(A)稀溶液范围内的 (B) m (C) (D) Kcell
5.某一电解质M+A-,则其a与a之间关系是( D) (A) a=a (B) a=a2 (C) a=a (D) a= a1/
(Fe2 / Fe) O (Fe2 / Fe) RT ln[Fe2 ] 0.470V
2F
(Cd 2 / Cd ) O (Cd 2 / Cd ) RT ln[Cd 2 ] 0.491V
2F 电极电势越低, 越易被氧化!
17. 电解水溶液时,在铜阳极上会发生( D ) (A)析出O2 (B)析出Cl2 (C)析出铜 (D)Cu极溶解.
8. 将Ag(s)Ag-Au(合金aAg=0.120)设计成电池: ____A_g_(s_)_|_A_g_+_|_A__g_-A_u_(_s_)______则该电池在25 ℃时的 电动势E=____-_0_.0_5_9_1__lg_a__=_0_._054V
6.解:I=(4×12+1×42)/2=10 mol ·kg-1
物理化学第四版印永嘉第二章

Q2 T2 Q1 T1 Q1 Q2 0 T1 T2
(不可逆) (可逆)
(不可逆) (可逆)
由无数小循环构成的不可逆循环: 结合卡诺循环有:
δQ T 0
δQir T 0
(不可逆) (可逆)
1
整个过程不可逆,所以有:
不可逆
可逆
2
2
δQir T 1
自发过程的共同特征:
(1) 自发过程必为不可逆过程; (2) 热功转化是有方向性的。
§2.2 热力学第二定律的经典表述
热力学第二定律的提出
这个问题的实质可归结为热只能从高温物
体自动传向低温物体,没有温差就取不出热
来(即从单一热源吸热)。
热力学第二定律的经典表述
(1)克劳修斯(Clausius, R) 说法:
放热Q1
做出功W
卡诺热机
p
V
1mol 理想气体的卡诺循环在pV图上可以分为四步: 过程1:定温(T2)可逆膨胀由p1,V1到p2,V2
U 1 0
V2 W1 RT2 ln V1
所作功பைடு நூலகம்AB曲线下的面积所示
Q2 W1
V2 RT2 ln V1
过程2:绝热可逆膨胀由p2 , V2 , T2到p3 , V3 , T1
不可能把热从低温物体 传到高温物体,而不引起 其它变化。
A T1 > T2
B
克劳修斯说法,反映了传热过程的不可逆性。
不可逆
A T1 > T2 B
(2)开尔文(Kelvin, L) 说法:
不可能从单一热源吸热使 之完全变为功而没有任何其 他变化。 (3)热力学第二定律的经典叙述可简化为:
物理化学第四版答案印永嘉

物理化学第四版答案印永嘉物理化学第四版答案印永嘉【篇一:2、《物理化学》教学大纲(化学专业)】xt>一、课程基本信息(一)课程中文名称:物理化学(二)课程英文名称:physical chemistry (三)课程代码:15030100 15030101 (四)课程属性及模块:专业必修课(五)授课学院:理学院(六)开课学院:理学院(七)教材及参考书目教材:《物理化学》(第五版)上册,傅献彩,沈文霞等编,高等教育出版社,2005年《物理化学》(第五版)下册,傅献彩,沈文霞等编,高等教育出版社,2006年参考书:《物理化学核心教程》(第二版),沈文霞编,科学出版社,2009年《物理化学》,万洪文,詹正坤主编,高等教育出版社,2009年《物理化学简明教程》(第四版),印永嘉等编,高等教育出版社,2009年《物理化学学习指导》,孙德坤沈文霞等编,高等教育出版社,2009年《物理化学核心教程学习指导》,沈文霞等编,科学出版社,2009年《化学热力学基础》,李大珍编,北京师范大学出版社,1982年《物理化学》,朱文涛编,清华大学出版社,1995年《物理化学教程》(修订版),姚允斌,朱志昂编,湖南科技出版社,1995年(八)课程定位及课程简介《物理化学》是化学及相关学科的理论基础。
是化学、化工、冶金、材料等专业本科生必修的专业主干基础课之一。
它是从化学现象与物理现象的联系入手,借助数学、物理学等基础科学的理论及其提供的实验手段,来探求化学变化中最具普遍性的基本规律的一门学科。
它是先行课程无机化学、分析化学、有机化学普适规律的理论归纳和定量探讨,是后续专业知识深造和科研工作的理论基础,也是连接化学与其它学科的桥梁。
(九)课程设计基本理念依据“以学生为中心”的教育教学理念,本课程的教学目的主要是:(1)使学生在已学过的一些先行课程(无机化学、有机化学、分析化学、高等数学、普通物理学)的基础上,对化学运动作理论和定量探讨。
物理化学第四版课后答案
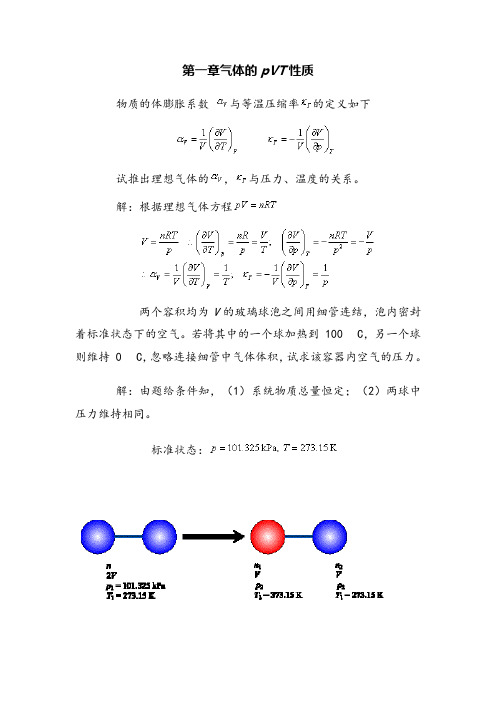
第一章气体的pVT性质物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到 100 C,另一个球则维持 0 C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义(3)根据分体积的定义对于分压室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
今有0 C, kPa的N2气体,分别用理想气体状态方程及van der Waals方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算用van der Waals计算,查表得知,对于N2气(附录七),用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果25 C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为 kPa,于恒定总压下冷却到10 C,使部分水蒸气凝结为水。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1) 热力学第二定律,熵S;衍生参量G、A 2) 温度对状态函数的影响:吉布斯—亥姆霍兹公式 3) 过程变化方向和限度的判据(主要:S、G ); 4) 第二定律的简单应用(S、G ):
简单状态变化中的应用 相变过程中的应用 化学反应过程中的应用
①热力学第一定律所要解决的问题 物理变化和化学变化中的能量效应。
卡
W Q1
Q1 Q2 Q1
T1 T2 T1
T2 > 0 K , 0 < <1 , Q不能全部变为W
T 大, 大; T 小, 小; T = 0,只有一个热源, = 0
卡诺循环是可逆过程构成的,所以卡诺热 机可以逆转:
外界做功 从低温热源 T2 吸热 Q2 向高温热源 T1 放热 Q1 ——制冷机
U1 0
W1
RT2
ln
V2 V1
Q2 W1
RT2
ln
V2 V1
所作功如AB曲线下的面积所示
过程2:绝热可逆膨胀由p2 , V2 , T2到p3 , V3 , T1
Q0
W2 U
T1 T2
CV
dT
CV (T1
T2 )
所作功如BC曲线下的面积所示
过程3:定温(T1)可逆压缩由p3,V3到p4,V4
§2.2 热力学第二定律的经典表述
热力学第二定律的提出 这个问题的实质可归结为热只能从高温物 体自动传向低温物体,没有温差就取不出热 来(即从单一热源吸热)。
热力学第二定律的经典表述
(1)克劳修斯(Clausius, R) 说法:
不可能把热从低温物体 传到高温物体,而不引起 其它变化。
A
B
T1 > T2
第一章 热力学Biblioteka 一定律本章学习的重点: 1) 热力学基本概念;状态函数法及其应用
2) 热力学第一定律,内能U;衍生参量H;
3) 温度对状态函数的影响:基希霍夫(Kirchhoff)定律 4) 热力学第一定律的简单应用:
简单状态变化中的应用 相变过程中的应用 化学反应过程中的应用
第二章 热力学第二定律
§2.4 熵的概念
• 可逆过程的热温商及熵函数的引出 • 不可逆过程的热温商 • 热力学第二定律的数学表达式——克劳修
卡诺定理
卡诺定理:所有工作于同温热源和同温冷源之间 的热机,其效率都不能超过可逆机,即可逆机的 效率最大。
卡诺定理推论:所有工作于同温热源与同温冷源 之间的可逆机,其热机效率都相等,即与热机的 工作物质无关。
卡诺定理的意义:(1)引入了一个不等号I R, 原则上解决了化学反应的方向问题;(2)解决了 热机效率的极限值问题。
W
Q2
整个过程:W = W1 + W2+ W3 + W4 = W1 + W3 Q = Q1 + Q2 = -W1 – W3 = -W
热机效率: η W Q1 Q2
Q2
Q2
卡诺热机:
Q2
W1
nRT2
ln
V2 V1
,
Q1
W3
nRT1
ln
V4 V3
两式相除:
W
W1 W 3
nRT2
ln
V2 V1
低温热源T1由于过程3得 到了热Q1;
经过一次循环系统所做 的总功W是四个过程功 的总和。
U 0 Q Q2 Q1 W W1 W2 W3 W4
根据热力学第一定律,在一次循环后,系统回到 原状,ΔU=0,故卡诺循环所做的总功W应等于系 统总的热效应、即
W Q1 Q2
从高温热源取出的热Q2转化为功的比例,称为 “热机效率”,用符号η表示,即
效的。
关于第二定律的几点说明 :
(1) 第二类永动机符合第一定律,但违反第二定律; (2)不是说热不可能完全变为功。强调的是:不可能在
热全部转化为功的同时不引起任何其它变化。 (3)任意一个过程中,令系统先由A变到B,再让它逆
向进行,假若在由B变到A时将能构成第二类永动 机,则可判断,该系统由A变到B的过程是自发的, 而由B自动变到A是不可能的。
克劳修斯说法,反映了传热过程的不可逆性。
不可逆
A
B
T1 > T2
(2)开尔文(Kelvin, L) 说法:
不可能从单一热源吸热使 之完全变为功而没有任何其 他变化。
(3)热力学第二定律的经典叙述可简化为:
第二类永动机不可能造成 实质:自发过程都是不可逆的。
Clausius的说法和 Kelvin的说法是等
U3 0
Q1
W3
nRT1
ln
V4 V3
环境对体系所作功如DC曲线下的面积所示
过程4:绝热可逆压缩由p4,V4,T1 到p1,V1,T2
Q 0
W4 U
T2 T1
CV dT
CV
(T2
T1)
环境对体系所作的功如DA曲线下的面积所示
整个卡诺循环:
气箱中的理想气体回复 了原状,没有任何变化;
高温热源T2由于过程1损 失了热Q2;
电解使反应逆向进行,系统恢复原状,•••
自发过程与可逆过程的区别在于热是否全 部转换为功而不引起任何其他变化。
人类经验总结:功可自发地全部转变为热, 但热不可能全部转变为功而不引起任何其他 变化。
结论:一切实际发生的宏观过程总是不可 逆的。
自发过程的共同特征: (1) 自发过程必为不可逆过程; (2) 热功转化是有方向性的。
nRT1 ln
V4 V3
nR(T2
T1
)
ln
V2 V1
于是,卡诺热机的效率应为:
W
R(T2
T1)
ln
V2 V1
T2 T1
Q2
RT2
ln
V2 V1
T2
另外: W Q1 Q2 T2 T1
Q2
Q2
T2
Q1 Q2 0 T1 T2
此式的含义为:卡诺热机在两个热源T1及T2之间 工作时,两个热源的“热温商” 之和等于零。
②热力学第二定律所要解决的问题 物质变化过程的方向与限度。
经验表明:一切自然界自动进行的自发过程是 有方向性和限度的。
§2.1 自发过程的共同特征
究竟什么因素在决 定自发过程的方向 和限度呢?
自发过程实例:
1. 理想气体向真空膨胀:
2. 热由高温物体传向低温物体:
3. 化学反应:Cd(s) + PbCl2(aq) = CdCl2(aq) + Pb(s)
从热功转换关系寻找新的热力学函数判断自发过程的方向 和限度。
§ 2.3 卡诺循环与卡诺定理 热机:在T1,T2两热源之间工作,将热转
化为功的机器。如蒸汽机、内燃机。
卡诺循环
吸热Q2 做出功W
放热Q1
卡诺热机
p V
1mol 理想气体的卡诺循环在pV图上可以分为四步: 过程1:定温(T2)可逆膨胀由p1,V1到p2,V2
