物理化学简明教程(印永嘉)-化学势ppt课件
物理化学1 PPT课件

首页 上页 下页 返回
第一章 热力学第一定律
(一)热力学概论
一、化学热力学简介 研究化学过程中能量相互转换所遵循规律的科学, 广义上说,研究热和其他形式的能量相互转换的关系。
首页 上页 下页 返回
§2 物理化学的研究方法
1.热力学方法(宏观方法) 以由大量质点(约1023个粒子)组成的宏观体系作 为研究对象,以热力学第一、第二定律为基础, 用一系列热力学函数及其变量,描述体系从始态 到终态的宏观变化,而不涉及变化的细节。因此 经典热力学方法只适用于平衡体系。
2. 动力学方法 (宏观+微观的方法) 宏观上,通过检测反应进程中物质的量随时间的 变化规律研究反应的动力学规律;微观上,采用 交叉分子束、光谱学等实验手段从分子层次上探 讨反应机理。
4
首页 上页 下页 返回
热机工作原理
卡诺循环和卡诺定理 --热力学第二定律
5
首页 上页 下页 返回
渗透原理
第三章 化学势 溶液依数性
6
首页 上页 下页 返回
金属防腐和电池
Zn
第七章 电化学 第九章 动力学
7
首页 上页 下页 返回
人工降雨和锄地保墒
SOS
第八章 表面现象
8
首页 上页 下页 返回
成绩分布: (1) 课后作业---10%
(2) 期中考试---20%
(3) 期末考试---70% 作业: 每人准备两个作业本,每次作业在下次上课之前交 本次作业:P12: 2/3/4/6 P16-18: 7/8/12/13/14
3
首页 上页 下页 返回
课程意义& 课程介绍
为什么要开设这门课?
物理化学和我们的日常生活密切相关,在生物、 医学、环境、工业、农业等诸多领域均具有重要 的应用价值!!! 化学教学的四大基础课之一 研究化学变化规律的科学 理论性强,应用范围广泛
物理化学简明教程第四版课件07-0

主要参考书
印永嘉 王学琳 奚正楷 张树永等编《物理化学简 明教程》例题与习题,高等教育1996.6 孙德坤,沈文霞,姚天杨,《物理化学解题指导》, 江苏教育出版社,1998.8. 王文清,高宏成,沈兴海编著,物理化学习题精解, 上下册,科学出版社,1999. 傅玉普主编,物理化学重点热点导引与解题训练, 大连理工大学出版社,2001. 李支敏,王保怀,高盘良编写,物理化学解题思路 和方法,北京大学出版社,2002.11. 朱文涛编著,物理化学中的公式与概念,清华大学 出版社,1998.
(2)多做习题,学会解题方法。很多东西只有通过解 题才能学到,不会解题,就不可能掌握物理化学。
(3)物理化学中出现的定理公式较多,学习时重要的 定理(定律)、公式及其使用条件、适用范围、 物理意义要牢记。抓住重点,自己动手推导公式。
(4)抓住每章重点,基本概念,基本公式;注意章节 之间的联系,做到融会贯通。
(4)有机物蒸馏时加沸石或废瓷石以防止暴沸?
(5)夏天将室内电冰箱门打开可以降低室温吗? (6)硅胶为何能作干燥剂?人工降雨有何原理?
(7)为什么食品通常采用低温保藏法?
对我的要求和意见?
Email: liuwenping11@ 没有规矩,不成方圆
我的要求和想法
考试和分数
学期总评成绩=平时×30%+期末×70% 平时成绩包括: 1.出勤10%,
物理化学主要研究对象
一)化学变化的方向与限度问题----化学热力学
举例:(1)碳 ? 金刚石 2NH3 2H2O
(2)N2 + 3H2 (--化学动力学
举例:当代三大环境问题:“遮阳伞”破了,“棉 被”太 厚了,雨水变酸了。解决的关键:机 理
§0.1 物理化学的研究对象及其重要意义
物理化学简明教程印永嘉化学动力学PPT课件

nB V
pB RT
18
第18页/共128页
以分压代替浓度 cB =pB /RT
r dc酯 1 dp酯 1 dp总
dt RT dt
RT dt
p酯=2p0 – p总
r 1 dc光 1 dp光 1 dp总 2 dt 2RT dt RT dt
p光气=2[p总– p0]
但对同样类型的反应如:C2H6(g) C2H4(g)+ H2(g) 由于副反应使产物中有一定量的甲烷存在,因此就不能 用系统总压力的增加来求算上述反应中各组分的分压, 亦即不能用压力这一物理性质来测量反应速率。
19
第19页/共128页
3. 反应速率的经验表达式:
微分式 :
r
f
(cB )
1
B
dcB dt
积分式:cB =f(t)
一般说来,只知道化学反应的计量方程式是不能预言其速
率公式的。反应速率公式的形式通常只能通过实验方可确
定。例如,H2与三种不同卤素的气相反应,其化学计量方 程式是类似的
H2 + I2
应当强调指出,反应分子数是针对基元反应而言的,表 示反应微观过程的特征。简单反应和复合反应是针对宏 观总反应而言的。这些概念不可混为一谈。
10
第10页/共128页
§9.2 反应速率和速率方程
1.反应速率的表示法 2.反应速率的实验测定 3.反应速率的经验表达式 4.反应级数 5.质量作用定律 6.速率常数
24
第24页/共128页
由质量作用定律可知,简单反应的反应级数与其相应 的基元反应的反应分子数是相同的。但值得注意的是, 反应级数与反应分子数毕竟是两个不同的概念。前者对 总反应而言,后者对基元反应而言。对于复合反应,说 其反应分子数是没有意义的。例如复合反应中有零级、 分数级或负数级反应,但反应分子数是不可能有零分子、 分数分子或负数分子反应的。
第三章 化学势

第三章 化学势第一次课:课程名称:物理化学本课内容:§3.1 偏摩尔量;§3.2 化学势;§3.3 气体物质的化学势授课时间: 90 分钟一、教学目的通过本次课的学习,使学生初步理解偏摩尔量和化学势的概念,掌握化学势的具体应用,了解气体物质化学势的表示式。
二、教学意义通过本次授课,使学生明确提出偏摩尔量和化学势概念的意义,掌握化学势的具体应用。
三、教学重点偏摩尔量和化学势的定义及物理意义;偏摩尔量集合公式;气体物质化学势的表示式。
四、教学难点气体的化学势的表示五、教学方式以电子课件为主,辅以少量板书的课堂讲授。
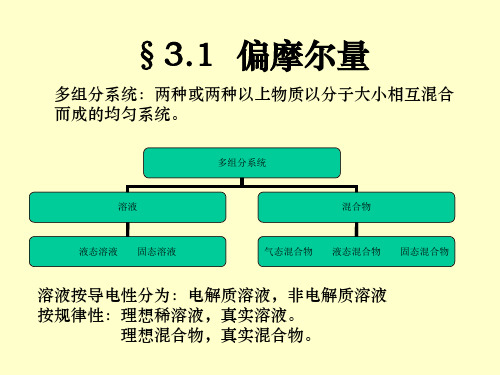
六、讲授内容§3.1 偏摩尔量(1) 偏摩尔量的定义(2) 偏摩尔量的集合公式§3.2 化学势(3) 化学势的定义(4) 化学势在多相平衡中的应用(5) 化学势在化学平衡中的应用§3.3 气体物质的化学势(6) 纯组分理想气体的化学势(7) 理想气体混合物的化学势(8) 实际气体的化学势—逸度的概念七、讲授方法§3.1 偏摩尔量前两章所讨论的热力学系统多数都是纯物质,称为单组分系统。
描述单组分密闭系统的状态,只需要两个状态性质就可以了。
但要描述一多组分均相系统的状态,除指明系统的温度和压力以外,还必须指明系统中每种物质的量(或浓度)。
为此,还需要引入一个新的概念——偏摩尔量。
(1)偏摩尔量的定义多组分系统的任一种容量性质X可以看作是温度T、压力p及各物质的量的函数,X = ƒ(T ,p ,n B ,n C ,n D ,…) 在定温定压条件下,dT =0,dp =0,并令BC ,,B B ≠⎟⎟⎠⎞⎜⎜⎝⎛∂∂=n p T n X X 则 dX = ΣX B dn B X B 称为物质B 的“偏摩尔量”。
偏摩尔量的物理意义是,在定温定压条件下,往无限大的系统中(可以看作其浓度不变)加入1mol 物质B 所引起的系统中某个热力学量X 的变化,实际上是一偏微商的概念。
物理化学简明教程课件

环境领域
电化学在环境领域的应用包括污 水处理、废气处理、土壤修复等
。
THANKS
感谢观看
相平衡条件与相图分析
相平衡条件
在一定的温度和压力下,不同相之间的化学成分和物理状态 达到平衡。
相图分析
通过分析多相体系的组成、温度、压力等因素的变化,判断 体系的相平衡状态。
化学平衡与相平衡的移动
化学平衡的移动
在一定条件下,化学反应的平衡状态受到外界条件的影响而发生变化。
相平衡的移动
在一定条件下,不同相之间的平衡状态受到外界条件的影响而发生变化。
性剂可以增加皮肤的吸收性,提高化妆品的效果。
06
CATALOGUE
电化学基础与应用
电极电位与电池电动势
电极电位
电极电位是表示电极反应达平衡时, 电极的电极电位值。
电池电动势
电池电动势是指单位正电荷在电源内 部从负极移到正极时非静电力所做的 功。
原电池与电解池的工作原理及计算方法
原电池工作原理
原电池是一种将化学能转变为电 能的装置,通过氧化还原反应将
物理化学简明教 程课件
汇报人: 202X-12-21
contents
目录
• 物理化学概述 • 热力学基础 • 化学反应动力学 • 化学平衡与相平衡 • 表面化学与胶体化学 • 电化学基础与应用
01
CATALOGUE
物理化学概述
定义与性质
定义
物理化学是研究物质在化学反应 中物理变化和化学变化的相互关 系的科学。
物理化学在各领域的应用
01
02
03
04
医药领域
物理化学在药物研发、药物分 析和药物作用机制研究中发挥
着重要作用。
物理化学简明教程第四版(印永嘉)

体积功的计算
• 基本公式:
•
W=-p外dV
• 注意: 体积功是系统反抗外压所作的功;•源自或者是环境施加于系统所作的功。
• W的数值不仅仅与系统的始末态有关,还与具体经历的途径 有关。
• 强度性质: 数值取决于系统自身的特点,与系统的数量无关, 不具有加和性,如温度、压力等。它在数学上是零次齐函数。
• 一般而言, 两个广度量的比值是一强度量,如
密 度: = m/V
摩尔体积:Vm = V/n • 指定了物质的量的容量性质即成为强度性质,如摩尔热容。
-
6
p,压力或者压强, N/m2(帕斯卡), Pa; 1pø=0.1MPa,热力学标准压力;常压101325 Pa T,温度,K , T/K= t/℃+273.15; V,体积,m3;
-
10
平衡态?稳态?
一金属棒分别与两个恒温热源相接触,经过一定时间后,金属 棒上各指定点的温度不再随时间而变化,此时金属棒是否处于 热力学平衡态?
T2
T1
-
11
过程和途径
• 热力学系统发生的任何状态变化称为过程。 • 完成某一过程的具体步骤称为途径。
如: pVT变化过程、相变化过程、化学变化过程
个量符合上述三个特征之一,可以判定有某一状态函数的存在。
-
9
热力学平衡态
• 系统与环境间必须同时达到以下四个条件时, 才可认为系统达 热力学平衡, 此时系统的状态称为热力学平衡态.
• 1.热平衡: 系统处处温度(T) 相等; • 2.力学平衡: 系统处处压力(p) 相等; • 3.相平衡:多相共存时,各相的组成和数量不随时间而改变; • 4.化学平衡: 系统内各化学反应达平衡.
-
物理化学(第四版)课件 印永嘉 等编 第3章 化学势

偏摩尔量
化学势
µ(g)
溶液
µ(sln)
依数性
非理想溶液
习题课
8
§3.2 化学势
一、化学势 1、定义: 、定义:
∂G µ i = Gi = ∂n i T , p ,n j 2、多组分系统基本公式 G = f(T, p, n1 , n2 , n3 ,… nk ) 、 …
习题课
4
二、偏摩尔量的物理意义
无限大的系统中加 1、由定义式可见:( )T,p 往无限大的系统中加 、由定义式可见: 入一摩尔i物质所引起的 的变化, 物质所引起的X的变化 入一摩尔 物质所引起的 的变化,即dX; ; 2、由偏微商的概念可理解为图中的曲线的斜率。 、由偏微商的概念可理解为图中的曲线的斜率。
µ = µ θ (T ) + RT ln ( f / pθ )
RT RTd ln f = p + α dp
Vm = RT / p + α
偏摩尔量
化学势
µ(g)
溶液
µ(sln)
依数性
θ
µθ(T):标准态(p=pθ)化学势,是温度的函数 (T):标准态( 化学势,
偏摩尔量
化学势
µ(g)
溶液
µ(sln)
依数性
非理想溶液
习题课
15
2、混合理想气体
pi µ i = µ i (T ) + RT ln θ p
θ
µθ(T):i 气体的标准态化学势(pi=pθ), : 气体的标准态化学势( pi:i 气体的分压。 气体的分压。 pi(分压 气体单独占有总体积时的压力称 分压):i气体单独占有总体积时的压力称 分压 气体的分压。 为i气体的分压。 气体的分压
物理化学简明教程(第四版)第三章-化学势
• 称为多组分均相系统中偏摩尔量的集合 公式。
§ 3.2 化学势
• (1)化学势的定义
• 偏摩尔吉布斯函数GB称为“化学势”,
用符号µB表示:
B
GB
G nB
T , p,nCB
• 对多组分系统
dG
G T
p,n
dT
G p
T ,n
dp
B
G nB
T , p,nCB
dnB
§ 3.2 化学势
pB pB* xB
• 体积具有加和性和没有热效应,即
mixV 0, mixH 0
(3)理想液态混合物中物质的化学 势
• 当此液态混合物与蒸气相达成平衡时,
B (l) B (g)
• 假定蒸气均遵守理想气体定律,
B (g)
B
(g)
RT
ln
pB p
• 因为 B (sln) B (g)
故
B (sln)
为p时,100g苯里溶解多少克HCl?
解题思路:先求出亨利系数。
§3.5 理想稀溶液中物质的化学势
解: 因为 pHCl=kx,HCl xHCl 所以 kx,HCl= pHCl /xHCl =1.013105Pa/0.0425 =2.38104Pa 又因为在293K时 p = pC6H6+ pHCl=1.013105Pa 所以 P*C6H6·xC6H6+ kx,HCl ·xHCl =1.013105Pa
别代表V,U,H,S,A,G等),可以
看作是温度T、压力p及各物质的量 nB, nC,…的函数,
•
X = ƒ(T,p,nB,nC,nD,…)
• 当系统的状态发生任意无限小量的变化
时,全微分dX可用下式表示
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章 化学势
返回目录 退出
14
dG(CCl4) = 碘(CCl4)( –dn碘) dG(H2O) = 碘(H2O)dn碘
H2O
dn
CCl4
总的吉布斯函数变化为
dG= [ 碘 (H2O) – 碘(CCl4)] dn碘
平衡时dG=0,
碘(CCl4)=碘(H2O)
第三章 化学势
返回目录 退出
15
推广到任意两相:
时,过程即达平衡。 (本质未变,只是由单组份演变为多组分)
因此化学势的物理意义是:物质的化学势是决 定物质传递方向和限度的强度因素。
第三章 化学势
返回目录 退出
13
2.化学势在多相平衡中的应用
化学势判据: 条件: 密闭系统,( )T, p , W’=0时
(dG)T,p=BdnB =0 可逆或平衡
现在有一系统: I2分别溶解在水和四氯化碳中成两相(如图)。
-----B物质的偏摩尔量(与 组成有关)
第三章 化学势
返回目录 退出
4
则在定温定压的条件下(dT, dp为0),上式可 表示为:
dX X BdnB
B
X是系统中任意一个容量性质。 如为体积,则此式的物理意义为:增加dn摩尔
物质所引起的V的变化,等于该组成下的摩尔体 积乘以该摩尔数。(不是与摩尔量的偏差)
dH = TdS + Vdp + Wr’
(2)
(dH)S,P= Wr’
第三章 化学势
返回目录 退出
11
②多组分系统基本公式:
G=f(T, p, nB , nC , nD , )
dG
G T
p,nB
dT
G p
T ,nB
dp
B
G nB
T
, p,nCB
dnB
SdT Vdp BdnB SdT Vdp δWr'
偏摩尔量 化学势
气体物质
理想液态混合物 稀溶液中物质
依数性 非理想多组分系
物理化学简明教程(印永嘉)
第三章 化学势
.
§3.1 偏摩尔量
1. 偏摩尔量的定义 2. 偏摩尔量的集合公式
第三章 化学势
返回目录 退出
2
为什么要提出偏摩尔量这个概念?
对于多组分系统, 系统状态不仅仅是温度压力的函数
如不同浓度的乙醇水溶液
B
(dG)T , p BdnB δWr'
B
即 BdnB是定温定压条件下一多组分均相系统
在发生状态变化时所能够做出的最大有效功。
第三章 化学势
返回目录 退出
12
如前所述,在不做其它功的条件下,多组分判 据就由(dG)T,p <0为能够进行的过程,变为
BdnB<0的过程为能够进行的过程;当BdnB=0
第三章 化学势
返回目录 退出
3
1. 偏摩尔量的定义
多组分(B、C、D……)系统中任一容量性质 X
X = f(T, p, nB , nC , nD , )
其全微分表达式为
dX
X T
dT p,nk
X p
dp T ,nk
X nB
T ,
p , nCB
dnB
令
XB
de f
X nB
T , p,nCB
第三章 化学势
返回目录 退出
16
3.化学势在化学平衡中的应用
例如( )T,p 反应 SO2(g) + 1/2O2(g) = SO3(g) dn(SO2) dn(O2) dn(SO3)
第三章 化学势
返回目录 退出
5Hale Waihona Puke 注意:XBde f
X nB
T , p,nCB
(1)只有容量性质有偏摩尔量;
(2)必须是等温等压条件;
(3)偏摩尔量本身是强度性质(两个容量性质之比);
(4)偏摩尔量除了与T, p有关外,还与浓度有关;
(5)单组分系统XB =Xm(如: VB =Vm , GB =Gm)
故由纯物质A(nA), B(nB)配置该系统: 连续加入A和B,并 保持系统组成不变,即dnA : dnB = nA : nB
则
V 0
dV
nA 0
VA
dnA
nB 0
VBdnB
第三章 化学势
返回目录 退出
8
制备过程中保持浓度不变,故VA,VB保持不变:
V 0
dV
VA
nA 0
dnA
VB
浓度 V水/cm3 V乙醇/cm3 V总/cm3 20.8% 150 50 195
44.1% 100 100 192
70.3% 50 150 193
原因:氢键
显然V总 nAVm,A + nBVm,B
当浓度确定后100 cm3 (20%)+100 cm3 (20%)=200 cm3
从上例可看出, 对于乙醇水溶液, 除了指定T, p外, 还须指定溶液的组成,才能确定系统的状态。
(dG)T, p =ΣB dnB =[B() – B() ]dnB
(dG)T, p
=0 B()= B() <0 B()> B() >0 B()< B()
相
dnB
相
即两相平衡
即从相向相转移 即从相向相转移
多相平衡条件:( )T, p B ()= B ()= ……
物质传递方向:从高化学势向低化学势传递, 限度:B物质在各相中的化学势相等。
44.1% 100 100 192
70.3% 50 150 193
单组份系统是 过原点的直线
nB
第三章 化学势
返回目录 退出
7
2. 偏摩尔量的集合公式(积分式)
若是二组分系统,则 dX=XAdnA+XBdnB 如:A和B的偏摩尔体积分别为VA ,VB, 则 ( )T,p dV=VAdnA+VBdnB 但VA,VB均为变量,不能直接积分。
第三章 化学势
返回目录 退出
10
1. 化学势的定义
①化学势的定义:
B
GB
G nB
T , p,nCB
化学势不仅仅是偏摩尔吉布斯函数,但以它最为
常用。
i
G nB
T , p,nCB
A nB
T ,V ,nCB
H nB
S , p,nCB
U nB
S ,V ,nCB
如何证明---利用最大有效功相同。如
nB 0
dnB
V = VAnA+ VBnB
X = XAnA+ XBnB ----------集合公式
若系统有多个组分,则多组分系统的集合公式为:
X X BnB
B
G GBnB
B
第三章 化学势
返回目录 退出
9
§3.2 化学势
1. 化学势的定义 2. 化学势在多相平衡中的应用
3. 化学势在化学平衡中的应用
第三章 化学势
返回目录 退出
6
偏摩尔量的物理意义:
(1)由定义式可见:定温定压时, 往无限大的系统中加入 1mol B物质所引起的X 的变化,即dX;
(2)由偏微商的概念可理解为图中的曲线的斜率。
VB
V nB
=斜率
T , p,nCB
V
浓度 V水/cm3 V乙醇/cm3 V总/cm3
20.8% 150 50 195
