药品器械监督文书空表
医疗设备监督管理记录表

检查科室:
序号
项目
存在问题及整改措施
1
重大医疗设备正常运行率≥98%,是否有巡查记录;
2
一般仪器设备正常运行率≥95%,是否有巡查记录;
3
设备的维护及保养情况,是否有维修记录
4
岗前培训情况,是否有记录;
5
机房环境安全防护情况,是否有记录
6
各种设备建档完好率100%;
7
购进医疗设备开箱验收、清点、登记程序履行率100%;
是□否□
6
仪器设备是否负责到人
是□否□
7
使用是否符合操作规程
是□否□
8
是否执行维护保养制度
是□否□
9
是否始终保持待用状态(急救类)
是□否□
10
发生故障维修人员是否及时维修
是□否□
11
需要紧急调配时是否启动紧急调配程序
是□否□
设备责任人
科室负责人
处理措施、指导意见
监管人员:
时程序符合率≥95%;
检查人签字:科室负责人签字:
时间:
医学装备管理监督记录表
科室
设备名称
监督内容
序号
项目
监管结果
1
购置是否按相关程序规定进行
是□否□
2
仪器设备是否按相关规定安装验收
是□否□
3
档案是否完备
是□否□
4
仪器设备处置过程是否符合规定
是□否□
5
仪器设备运转率是否符合规定
2022急救药品、器械督导检查记录

急救等备用药品管理情况督查科室参预人员1 备用药品数量同账目不符,2 科内均有不同程度的积余药物,且有混放现象,3 取用方法不统一,4 没有按日期顺序先后摆放5 备用药品种类繁多,有些备用药使用频率极低,6、每班清点药品流于形势,与基数不相符时未及时追查原因 原因分析1.科内的口服药管理仍存在一些艰难, 特别是一些检查后多出一 餐药等,药房不予退,2.临床医生开医嘱缺乏计划性,对领药造成一些艰难,科内护士 习惯备一些口服药以备急需,3.大输液每日常规发放一次,基数难以管理1. 每科根据实际情况重新确定备用药种类,取销不常用及不用 的备用药, 精减备用药种类, 真正起到备用作用, 提高工作效率, 合理利用资源,减少因过期产生的浪费。
2. 备用药原则上基数均备用 5 支,保证药品标签名称及数量清 晰,并按日期先后顺序摆放,从右到左取用。
3.每班保证备用药品数量与基数相符,使用后班内及时领回。
4.每周清洁药柜、药盒、冰箱及口服药车,统一冰箱内药品放置 规范,标签清晰5.凡需病人当日或者次日使用的药品均需贴上标签, 不能和备用药 混放在一起。
6.大输液上下午各发放一次,7.发完中餐餐后口服药后保证药车处于空车状态, 对于多余且不 继续服用的药品及时弃去, 需继续服用的通知秘书次日相应口服主题 时间 主持部门 存在问题整改措施药剂科医务科药少领。
8.每月各类药品检查后多余的药品交还给药房,并作登记,药房可根据药价适当地给科室补偿,或者因人为因素损失药品时予以调换科室整改措施追踪成效评价主管部门监管签字年月日本表一式二份,一联职能部门存档,一联反馈科室存档主题时间主持部门存在问题整改措施科室整改措施急救等备用药品管理情况督查科室药剂科医务科参预人员1.护士对药理知识虽然一知半解,但主动学习习惯不够2.护士对一些药物的作用和副作用不是太了解3.护士对药理知识较缺乏,导致对用药过程的观察不到位4.科室对科内常用药物的整理不够,普遍没有实用的专科药物使用手册原因分析1.药物手册不简洁明了,可读性不强,查询不方便,内容有待完整2.缺少相关知识培训以及护士培训缺少主动性。
县药械安全监督检查记录表

县药械安全监督检查表名称:负责人:地址:联系电话:类型:□医务室□诊所□卫生室□医院□乡镇卫生院□药店□批发公司项目检查情况证照与制度1.是否取得《药品经营许可证》、GSP证、《医疗器械经营许可证》、《第二类医疗器械经营备案凭证》并在效期内□2.是否取得《医疗机构执业许可证》并在效期内□3. 是否有《营业执照》□4.是否建立药品质量管理制度□机构与人员5.是否按规定设定质量管理机构或确定质量管理人员□6.药品从业人员是否进行法规及业务知识培训□7.药品从业人员是否每年进行了健康检查□设施设备8.经营企业是否建立计算机管理系统□9.经营或使用场所面积是否符合要求□10.是否配备空调、避光窗帘、换气扇、灭蝇灯、鼠夹、玻璃门等设施设备□11.设备运转是否正常□12.药品调配的计量器具(称)、温湿度计是否定期校准检定□13.温湿度记录是否真实完整□14.经营使用冷藏药品是否设置冷柜□15.药房是否宽敞、明亮、整洁、无污染物并执行色标管理□采购与验收16.是否能提供合法有效的购进票(查西药、中药、医疗器械)□17.能否提供合法的供货方资质材料□18.进口药品是否有中文说明书和标签□19.是否建立真实完整的验收记录(查西药、中药、医疗器械)□运输、贮存、养护20.经营使用冷藏药品是否保留在途运输温湿度记录□21.是否定期对储存药械进行检查养护□22.药品分类是否符合要求□23.分类标识是否清晰完整□24.是否有过期药械□25.中药饮片是否正名正字并放入合格证标签□26.拆零药品时是否裸手直接接触药品□27.拆零药品是否用保留原包装□28.药械不良反应是否上报□特殊药品29.特殊药品是否设专库或专柜贮存□30.是否安装监控和报警装置□31.是否做到五专管理(专柜.专帐.专册登记.双人双锁.专用红处方)□32.抽查特殊药品是否做到票、帐、物相符□33.是否现金交易□34.是否以文件形式规定麻醉药品和精神药品专管人员并进行专业培训□含特制剂35.含特殊药品复方制剂是否设置专柜并限量销售□36.是否凭身份证限量销售□37.药店是否销售终止妊娠药品□广告互联网巡查38.是否采用邮售、互联网交易、开架自选等方式销售处方药或配制的制剂□39.百度搜索被查企业是否在互联网上发布虚假药品信息□40.是否发布违法虚假药品或医疗、医疗器械广告□41.是否张贴违法广告□守法情况42.是否存在其它科室和医务人员自行采购药械□43.是否擅自使用临床实验药械□44.是否以非药品替代药品使用□45.是否从非法渠道购进药械□46.是否无证擅自配制制剂□47.连锁门店是否严格执行“六个统一”□48.连锁门店是否从连锁总部购进药品□49.是否未经许可私设仓库□检查结论违反项目说明:责令对不合格项目进行整改,于年月日前将整改报告交:1、本检查内容所有项目要做出肯定或否定的评定,是在□内打√,否在□内打×或标注缺项;2、该表一式两份,一份当场交相对人留存,一份由执法机关存档备案。
医院医疗设备管理监管记录表(汇编)

否
仪器设备是否负责到人
是
否
使用是否符合操作流程是ຫໍສະໝຸດ 否是否执行维护保养制度
是
否
是否始终保持待用状态(急救类)
是
否
发生故障是否及时报修并记录
是
否
发生故障维修人员是否及时维修
是
否
需要紧急调配时是否启动紧急调配程序
是
否
设备责任人
科室负责人
处理措施、指导意见
监管人员
时间
△infections adj.传染的△inject vt.注射医院医学装备管理
trend n.趋势;倾向;走向
thorough adj.彻底的;详尽的监管记录表
科室
设备名称
购置是否按相关程序规定进行
是
否
仪器设备是否按相关规定安装验收
是
否
档案是否完备
是
否
仪器设备处置过程是否符合规定
是
否
仪器设备运转率是否符合规定
医疗机构药品质量安全监督检查记录表
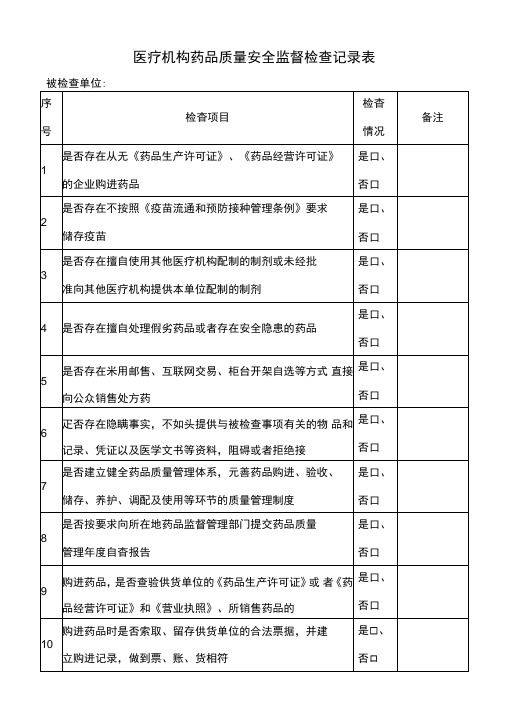
是口、
否口
8
是否按要求向所在地药品监督管理部门提交药品质量
管理年度自杳报告
是Hale Waihona Puke 、否口9购进药品,是否查验供货单位的《药品生产许可证》或 者《药品经营许可证》和《营业执照》、所销售药品的
是口、
否口
10
购进药品时是否索取、留存供货单位的合法票据,并建
立购进记录,做到票、账、货相符
医疗机构药品质量安全监督检查记录表
被检查单位:
序
号
检杳项目
检杳
情况
备注
1
是否存在从无《药品生产许可证》、《药品经营许可证》
的企业购进药品
是口、
否口
2
是否存在不按照《疫苗流通和预防接种管理条例》要求
储存疫苗
是口、
否口
3
是否存在擅自使用其他医疗机构配制的制剂或未经批
准向其他医疗机构提供本单位配制的制剂
是口、
是□、
否口
11
疋否建立和执仃进货验收制度,购进药口口疋否逐批验
收,并按规疋建立真头、完整的药品验收记录
是□、
否口
12
是否建立健全中药饮片米购制度, 按照国家有关规定购
进中药饮片
是口、
否口
13
是否按照规定储存药品
是□、
否口
14
是否按照规定养护药品
是□、
否口
15
是否按照规疋建立和执仃药品效期管理制度
是□、
否口
4
是否存在擅自处理假劣药品或者存在安全隐患的药品
是口、
否口
5
是否存在米用邮售、互联网交易、柜台开架自选等方式 直接向公众销售处方药
药品管理使用的各种表格模板

药品领取(调出)申请单常规/紧急单位名称: . 编号:填表人签字日期负责人签字日期备注:药品领取(调出)申请单的填表说明:1. 单位名称:填入单位名称2. 编号:填入申请单编号3. 药品名称:填入药品名称4. 计数单位:填入板或支5. 现有库存:填入库房药品数量,含门诊库房6. 平均月消耗量:填入从库存控制卡上获得的该数据7. 申请数量:可以通过EXCEL表格自动生成;如果需药品调出,必须填写药品批号及数量。
8. 批准发放数量:由上级药品管理人员核查后填写,有可能与申请数量不同9. 负责人签字:相关负责人签字药品接收单省市县接收单接收单位药品调拨/入库单编号计数单位填表人(单位盖章)日期药品接收单的填写说明:第一部分:药品接收报告,此为必填部分1. 接收单位:填入药品接收单位2. 药品调拨/入库单编号:将药品调拨/入库单编号填入3. 计数单位:如板、支等4. 药品名称:填写药品全称或代号,如HRZE5. 批号:填写药品的批号6. 经费来源:注明药品经费的来源,如中央转移支付、省级经费等7. 药品调拨/入库单数量:按照每批药品一行填入表格中8. 确认数量:将通过验货的药品数量填入表格中第二部分:货物拒收报告,当发现验收不合格的药品时填写9. 药品名称:填写药品全称或代号,如HRZE10. 拒收原因:注明拒收的原因,如破损、污染、不符合规格等11. 拒收数量:统计拒收的数量12. 单价(元):从药品调拨/入库单中获得13. 总价(元):用单价乘以拒收的数量第三部分:货物差异报告,当发现货物的数量和药品调拨/入库单不符合时填写14. 药品名称:填写药品全称或代号,如HRZE15. 药品调拨/入库单数量:填写药品调拨/入库单的数量16. 实际接收数量:填写经过清点实际接收到的数量17. 差异:用实际接收的数量减去药品调拨/入库单的数量计算,货物数量不足用负号表示,货物数量过量用正号表示18. 单价(元):从药品调拨/入库单中获得19. 总价(元):用单价乘以差异的数量20. 备注:填写差异的具体情况,如过量、不足、未申请等说明:如接收药品时,采用了自领模式,就不需要使用药品接收单。
医院药品质量管理监督检查表

医院药品质量管理监督检查表部门:1、特殊药品(麻醉药品、一类精神药品、医疗用毒性药品、贵重药品等)管理执行情况⑴“五专”管理:⑵数量管理:⑶处方书写等情况:2、药品质量控制、制度执行情况⑴含效期药品管理:⑵有无伪劣药品:⑶药品变质、霉烂、虫蛀、鼠患等现象:⑷有无中药串斗现象:⑸药品储存条件(尤其是需低温保存的药品):⑹药品摆放情况:3、《处方管理办法》、《医院中药饮片管理办法》等有关法律法规和规范落实情况⑴调配质量检查(现场查看已调配处方复核签字、调剂误差)调配人处方中药品总量西药种经复核调配人处方中药品总量西药种经复核调配人处方中药品总量中成药种经复核调配人处方中药品总量中草药味共克经回戥称量克误差%调配人处方中药品总量中草药味共克经回戥称量克误差%⑵处方书写质量状况与点评抽查年月日处方共张,处方书写不规范张,处方调配、复核等签名不完整张;用药不适宜张,超常处方张,共张,占处方总数%,合格处方张占处方总数%。
处方点评结果:中成药用药不合理张,其中无辨证诊断张、配伍不合理张、用法用量错误张。
(处方点评另见处方点评表)⑶中药煎药业务质量检查①煎药室卫生状况: ②用具、容器卫生状况:③包装材料是否符合规定:④煎药质量(有无糊状块、白心、硬心等):⑤有无错装、错发、漏发等情况:⑥急煎处方服务是否超过规定时限(二小时):3、服务质量状况⑴工作人员着装:⑵有无拒推处方现象:⑶有无病人及家属举报现象: ⑷发药交待是否清楚:⑸药袋书写情况:⑹药房环境卫生:⑺药品卫生状况:⑻病患对药剂服务质量的评价:当班人员:部门负责人:质量监督检查人:检查日期年月日药剂科对检查结果的处理意见:科主任:日期:。
医院药品质量管理监督检查表

医院药品质量管理监督检查表部门:1、 特殊药品(麻醉药品、一类精神药品、医疗用毒性药品、贵重药品等)管理执行情况 ⑴“五专”管理:⑵ 数量管理:⑶ 处方书写等情况:2、 药品质量控制、制度执行情况⑴ 含效期药品管理:⑵ 有无伪劣药品:⑶ 药品变质、霉烂、虫蛀、鼠患等现象 :⑷ 有无中药串斗现象:⑸ 药品储存条件(尤其是需低温保存的药品) :⑹ 药品摆放情况:3、《处方管理办法》 、《医院中药饮片管理办法》等有关法律法规和规范落实情况 张;用药不适宜 张,超常处方 张,共 张,占处方总数 占处方总数 %。
处方点评结果:中成药用药不合理 张,其中无辨证诊断 张、配伍不合理 张、用 法用量错误 张。
(处方点评另见处方点评表)⑶ 中药煎药业务质量检查① 煎药室卫生状况 : ② 用具、容器卫生状况:④ 煎药质量(有无糊状块、白心、硬心等) : ⑥ 急煎处方服务是否超过规定时限 ( 二小时 ) :⑵ 有无拒推处方现象:⑷ 发药交待是否清楚:⑹ 药房环境卫生: ⑻ 病患对药剂服务质量的评价:调配人 处方中药品总量 西药 种 经复核调配人处方中药品总量 西药 种 经复核 调配人处方中药品总量 中成药 种 经复核 调配人处方中药品总量 中草药 味 共 克 调配人 处方中药品总量 中草药 味 共 克 克 误差 克 误差 抽查 年 月 日处方共 张,处方书写不规范张,处方调配、 复核等签名不完整 ③ 包装材料是否符合规定:⑤ 有无错装、错发、漏发等情况: 3、 服务质量状况 ⑴ 工作人员着装: ⑶ 有无病人及家属举报现象 :⑸ 药袋书写情况:当班人员: 部门负责人: 质量监督检查人:检查日期 年 月 日%,合格处方 张⑴ 调配质量检查 (现场查看已调配处方复核签字、调剂误差) 经回戥称量 经回戥称量 ⑵ 处方书写质量状况与点评药剂科对检查结果的处理意见:科主任:日期:。
药品监督行政执法文书规范

药品监督行政执法文书规范第一条为了规范药品监督执法行为,根据《药品监督行政处罚程序规定》(国家食品药品监督管理局令第1号),制定本规范。
关联法规:第二条《药品监督行政执法文书》(以下简称文书)适用于药品、医疗器械监督检查和行政处罚等执法活动。
第三条各级药品监督管理部门应当按照《药品监督行政处罚程序规定》所附的36种文书样式印制使用。
省、自治区、直辖市药品监督管理部门可以根据工作需要补充相应文书。
关联法规:第四条设有编号的执法文书编号的形式为:地区简称+执法类别+执法性质+[年份]+顺序号。
如:(京朝)药行罚(2003)5号。
京朝→代表北京市药品监督管理局朝阳分局,药→代表执法类别为药品类案件(如械→代表医疗器械类案件),行罚→代表行政处罚决定书,2003→代表年份,5号→代表行政处罚决定书排序第5号。
第五条文书中预先设定的栏目,应当逐项填写(空项应当用杠线表示),不得遗漏或者涂改。
有选择项的应当将非选择项用杠线划去。
?当场填写的笔录文书当事人认为记录有误,要求修改的,应当在修改处由当事人签字或者按指纹。
第六条填写执法文书应当使用蓝黑色、黑色钢笔或者签字笔,要求字迹清楚,文字规范,用词准确,标点正确。
两联以上的文书应当使用无碳复写纸印制,第一联留存归档。
第七条文书设定的《( )副页》(附表36),是《现场检查笔录》、《调查笔录》、《案件合议记录》、《陈述申辩笔录》、《重大案件集体讨论记录》、《听证笔录》、《听证意见书》等文书的续页,( )中应当填写连接文书名称,如《(调查笔录)副页》。
第八条文书设定的《( )物品清单》(附表12),是《先行登记保存物品通知书》、《查封扣押物品通知书》、《解除先行登记保存物品通知书》、《解除查封扣押物品通知书》、《没收物品凭证》等文书的附件,( )中应当填写连接文书名称,如《(解除)物品清单》。
?第九条文书中“案由”应当按照《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》的“法律责任”和《医疗器械监督管理条例》的“罚则”及国家食品药品监督管理局行政规章中的规范用语填写。
药品、医疗器械使用单位日常监督检查记录

检查时间:年月日
单位名称
单位负责人
联系电话
使用药品、器械种类
中成药□化学药制剂□抗生素□生物制品□中药材□中药饮片□麻醉药品□精神药品(一类)□精神药品(二类)□医用氧□一类器械□二类器械□三类器械□(*备注:在对应项目后打“√”)
检查面目
检查基本情况(*在对应项目后打“√”)
符合规定
基本符
合规定
不符合
规定
备注
药品、器械各项管理制度
人员和培训情况
仓储设施、设备与库存药品是否相适应
药品、器械购进、验收、养护管理
药品、器械使用管理
有无使用终止妊娠药品
中药饮片使用情况其它来自检查结论检查人员签字:
企业负责人签字:
医疗机构药事管理督查表

五、处方审核与调配
5.1
处方审核制度是否完善
□完善□不完善
5.2
处方审核是否严格、准确
□是□否
5.3
药品调配是否准确、迅速
□是□否
5.4
药师对处方用药的指导是否到位
□到位□不到位
六、临床用药监测
6.1
临床用药监测制度是否完善
□完善□不完善
6.2
药品不良反应监测与报告是否及时
□及时□不及时
6.3
□健全□不健全
8.2
质量与安全监控记录是否完整
□完整□不完整
8.3
对发现的问题是否及时整改
□是□否
8.4
质量与安全事件的应急处理能力
□强□一般□弱
督查人员(签字):
□完善□不完善
3.6
药品严格执行零差率销售、公示
□是□否
四、药品储存与管理
4.1
药品储存条件是否符合规定
□符合□不符合
4.2
药品分类储存是否合理
□合理□不合理
4.3
药品效期管理是否严格
□严格□不严格
4.4
药品养护工作是否到位
□到位□不到位
4.5
麻、精、毒性药品存储保管是否规范
□是□否
4.6
药品进、销、存台帐是否真实、完整
□是□否
1.5
药事管理部门与其他部门的协调配合情况
□良好□较差
1.6
将药品使用和销售作为绩效分配依据
□是□否
二、人员配备与培训
2.1
药学技术人员配备是否充足(8%)
□充足□不足
2.2
药学技术人员职称结构是否合理
□合理□不合理
2.3
药品监督行政执法新文书参考模板

中华人民共和国药品监督行政执法文书涉嫌犯罪案件移送书涉刑移送〔〕号公安局:涉嫌一案,经初步调查,当事人涉嫌构成犯罪,根据《行政执法机关移送涉嫌犯罪案件的规定》第三条、《关于在行政执法中及时移送涉嫌犯罪案件的意见》第一条、《刑法》第条的规定,现移送你单位依法查处。
根据《行政执法机关移送涉嫌犯罪案件的规定》第八条的规定,你单位如认为当事人没有犯罪事实,或者犯罪事实显著轻微,不需要追究刑事责任,依法不予立案的,请说明理由,并书面通知我局,相应退回案卷材料。
根据《行政执法机关移送涉嫌犯罪案件的规定》第十二条的规定,我局将在接到你单位立案通知书之日起3个工作日内将涉案物品及与案件有关的其他材料移交你单位。
(公章)年月日附件:签收回执涉刑移送〔〕号《涉嫌犯罪案件移送书》已于年月日收到。
(公章)年月日注:本文书一式四份。
第一份由公安机关签收后留存;第二份由公安机关签收后由药品监督管理部门存档;第三份抄送公安机关的同级人民检察院,由人民检察院签收后留存;第四份由人民检察院签收后,药品监督管理部门存档。
中华人民共和国药品监督行政执法文书查封(扣押)物品移交通知书()查扣移〔〕号_ __:因你(单位)违法行为涉嫌犯罪,根据《中华人民共和国行政强制法》第二十一条之规定,我局决定对查封(扣押)的你(单位)的有关物品(见《()物品清单》)移交给公安局。
(公章)年月日本通知书已于年月日时分收到。
接收人签字:执法人员签字:、注:本文书一式二联,第一联由药品监督管理部门存档,第二联交当事人。
中华人民共和国药品监督行政执法文书查封(扣押)审批表()查扣审〔〕号案由:_ 当事人:法定代表人(负责人):地址:联系方式:根据《中华人民共和国药品管理法》第六十五条第二款、《医疗器械监督管理条例》第三十一条规定,该单位(人)违法,拟予以查封(扣押)。
查封(扣押)期限拟从年月日至年月日。
查封(扣押)物品保存地点:查封(扣押)物品保存条件:根据《中华人民共和国行政强制法》第十九条,需要紧急采取查封(扣押)措施、补办批准手续的说明:承办人:、年月日审批意见:主管领导:年月日中华人民共和国药品监督行政执法文书查封(扣押)决定书()查扣决〔〕号当事人:法定代表人(负责人):地址:联系方式:根据《中华人民共和国药品管理法》第六十五条第二款、《医疗器械监督管理条例》第三十一条规定,你(单位)可能危害人体健康,决定予以查封(扣押)。
医疗器械生产记录(空白表格)
产生原因
处
理
措
施
顾
客
评
价
及
需
求
顾客签名
及盖章
年月日
客户培训记录
编号:JL-7.2-10
用户名称
地址
电话
购置设备名称
规格型号
培训对象
培训时间及内容:
培训方式和效果:
用户意见:
培训教师:
合同更改通知单
编号:JL-7.2-11
用户名称
地址
电话
联系人
通知方式
邮编
合同更改内容:
记录人:日期:
部门意见:
编号:JL-7.3-04
项目名称
设计人
设计开发输入内容:
项目负责人:
参加评审人员
评审结论:
评审组长:日期:
设计开发输出清单
编号:JL-7.3-05
项目名称
项目负责人
设计开发输出清单:
1、
2、
3、
4、
5、
6、
7、
8、
设计人:项目负责人:日期:
备注:
编号:JL-7.3-06
设计和开发评审记录表
评审类别
项目名称
受控文件清单(1.质量文件)
编号:JL–4.2.3-011
序
号
文件名称
文件编号
版本号
发放号
保管部门
使用部门
发布引入日期
受控状态
记录:
受控文件清单(2.管理文件)
编号:JL–4.2.3-01
序
号
文件名称
文件编号
版本号
发放号
保管部门
使用部门
发布引入日期
药械监管交流材料汇总表格

药械监管交流材料汇总表格
1. 药械监管政策的实施情况分析
2. 药械生产企业安全管理措施
3. 药械经营企业的质量管理体系建设
4. 药械供应链中的相关责任方及其监管职责
5. 药械安全监测的方法和技术
6. 药械不良事件报告和监督处理措施
7. 药械监管的国际经验和合作
8. 药械监管机构的职责和权限
9. 药械监管法律法规的更新和修订
10. 药械市场准入和注册制度的改革措施
11. 药械广告和宣传的监管要求
12. 药械不合格产品的处置和召回程序
13. 药械注册申报材料的审核标准和流程
14. 药械生产和经营场所的规范要求
15. 药械业务人员的职业道德和行为准则
16. 药械监管信息系统的建设和应用
17. 药械进口和出口的监管程序和标准
18. 药械监管人员的培训和资质认证要求
19. 药械行业协会的作用和责任
20. 药械监管中的风险评估和风险管理措施。
(医疗药品管理)药品医疗器械执法文书填写规范

(医疗药品管理)药品医疗器械执法文书填写规范目录1.案件移送审批表2.案件移送书3.涉嫌犯罪案件移送书4.查封(扣押)物品移交通知书现场检查笔录5.举报登记表6.立案申请表7.调查笔录8.现场检查笔录9.先行登记保存物品审批表10.先行登记保存物品通知书11.查封(扣押)审批表12.查封(扣押)决定书13.封条14.()物品清单15.立案通知书16.解除先行登记保存物品通知书17.查封(扣押)延期审批表18.查封(扣押)延期通知书19.解除查封(扣押)决定书20.检验(检测、技术鉴定)告知书21.案件合议记录22.重大案件集体讨论记录23.撤案申请表24.行政处罚事先告知书25.陈述申辩笔录26.行政处罚审批表27.行政处罚决定书28.没收物品凭证29.没收物品处理审批表30.没收物品处理清单31.责令改正通知书32.听证告知书33.听证通知书34.听证笔录35.听证意见书36.当场行政处罚决定书37.送达回执38.延(分)期缴纳罚没款审批表39.履行行政处罚决定催告书40.陈述申辩复核意见书41.行政处罚强制执行申请书42.行政处罚结案报告43.()副页《案件移送审批表》一、概念及适用依据(一)《案件移送审批表》是指办案人员发现受理案件不属于本行政机关管辖,拟将案件移送给有管辖权的其他行政机关,请主管领导审查批准时所用的内部文书。
移送主要有三种情况:1、受理案件不属于自己管辖,而属于其他机关或食品药品监管部门管辖。
移送管辖是药品监督管理部门在发现案件不属于本部门主管或管辖时,采取的一种方法。
原则上,药品监督管理部门自受理涉案举报线索及交办案件之日起至做出行政处罚之日止,随时发现随时移送。
但是为了防止行政成本的浪费和提高行政效率,应尽量做到尽早发现,及时移送。
2、案件应属于其他机关管辖。
没有管辖权的主要包括以下情形:(1)属于其他机关主管的范围;(2)已构成犯罪需要追究刑事责任的,涉及药品刑事犯罪的法律依据主要是刑法140、141、142、149、150、225条;(3)不属于受案食品药品监督管理地域管辖的4案件中违法行为涉及食品药品部门管辖的,只对没有管辖权的部分移送。
2018年版医疗器械记录文本表格

医疗器械质量管理文件记录表格(2017年版)公司名称:XXXX药业有限责任公司修订日期:二〇一七年十月二十日XXXX药业有限责任公司医疗器械记录目录001、XXXX药业有限责任公司采购记录.... 错误!未定义书签。
002、XXXX药业有限责任公司验收记录 ..... 错误!未定义书签。
003、XXXX药业有限责任公司随货同行单 ... 错误!未定义书签。
004、XXXX药业有限责任公司温湿度记录 ... 错误!未定义书签。
005、XXXX药业有限责任公司入库记录 ..... 错误!未定义书签。
006、XXXX药业有限责任公司定期检查记录.. 错误!未定义书签。
007、XXXX药业有限责任公司出库复核记录.. 错误!未定义书签。
008、首营企业审批表.................... 错误!未定义书签。
009、客户资质审核表.................... 错误!未定义书签。
010、首营品种审批表.................... 错误!未定义书签。
011、XXXX药业有限责任公司销售记录 ..... 错误!未定义书签。
012、XXXX药业有限责任公司不合格品种销毁登记表错误!未定义书签。
013、拼箱单............................ 错误!未定义书签。
014、XXXX药业有限责任公司停售通知记录.. 错误!未定义书签。
015、XXXX药业有限责任公司召回记录 ..... 错误!未定义书签。
016、设施设备检查维护记录.............. 错误!未定义书签。
017、XXXX药业有限责任公司设施设备档案.. 错误!未定义书签。
018、仪器、设备使用记录................ 错误!未定义书签。
019、年度企业员工健康检查汇总表........ 错误!未定义书签。
020、员工健康档案...................... 错误!未定义书签。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中华人民共和国药品监督行政执法文书案件移送审批表()案移审[ ] 号案由:案件来源:当事人:法定代表人(负责人):地址:联系方式:受移送机关:主要案情及移送理由:经办人:年月日审批意见:主管领导:年月日中华人民共和国药品监督行政执法文书案件移送书()案移送[ ] 号____________________________:_____________________________一案,经初步调查,,根据《中华人民共和国行政处罚法》的规定,现移送你单位处理。
案件处理结果请函告我局。
附件:案情简介及有关材料件。
(公章)年月日注:本文书一式三联。
第一联存档,第二联交被移送单位,第三联备查。
中华人民共和国药品监督行政执法文书举报登记表()举登[ ] 号举报人:联系方式:举报形式:时间:举报内容:记录人:年月日处理意见:负责人:年月日中华人民共和国药品监督行政执法文书立案申请表(湘)食药立申[ 2 0 0 4 ] 7 2号案由:涉嫌生产销售(劣药)六一散当事人:长双鹤医药有限责任司法定代表人(负责人):地址:长沙市望联系方式:0 7 3 1—8111970案件来源:省药品检验所抽验案情摘要:该公司于2003年814日从武汉九鼎药业有限公司购入硫糖铝片4800瓶(20件),标示生产单位:上海(六安)华源制药股份有限公司,批号:030503,规格:0.25g﹡100S/;经省药品检验所抽验,性状不符合规定,至案发时止,已销售4038瓶(库存762瓶),销售价:1.5元/瓶,销售收入:6057元(货值:7085.7)。
经初步审查,当事人的行为涉嫌违反了《药品管理法》第四十九条第一款、第三款第(六)项的规定,申请予以立案。
经办人:李铁祥、董树峰2 0 0 4 年6 月1 8日审批意见:________________________________________,本案自年月日起立案,由、、承办。
主管领导:年月日中华人民共和国药品监督行政执法文书调查笔录第页共页━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━案由:调查地点:被调查人:___________性别:__ 职务:被调查人工作单位:__________________________被调查人联系方式:被调查人地址:调查人:、记录人:监督检查类别:调查时间:年月日时分至时分━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━我们是的执法人员执法证件名称、编号是:我们依法向你调查有关问题,请予配合。
调查记录:注:被调查人在检查笔录上逐页签字,在修改处签字或者按指纹,并在笔录终了处注明对笔录真实性的意见;调查人应在笔录终了处签字。
被调查人签字:中华人民共和国药品监督行政执法文书现场检查笔录第页共页被检查单位(人):检查现场:法定代表人(负责人):____________________________联系方式:检查人:记录人:监督检查类别:检查时间:年月日时分至时分我们是的执法人员、执法证件名称、编号是:我们依法就有关问题,进行现场检查,请予配合。
现场检查记录:注:本文书一式二联,第一联存档,第二联交被检查单位。
被检查人在检查笔录上逐页签字,在修改处签字或者按指纹,并在笔录终了处注明对笔录真实性的意见;检查人应在笔录终了处签字。
被检查人:中华人民共和国药品监督行政执法文书先行登记保存物品审批表()登保审[ ] 号━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━案由:当事人:法定代表人(负责人):地址:联系方式:━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━先行登记保存物品种类:根据《中华人民共和国行政处罚法》第三十七条第二款规定,拟对该单位(人)有关物品予以登记保存。
保存地点:保存条件:承办人:__________ 、__________年月日审批意见:主管领导:年月日中华人民共和国药品监督行政执法文书先行登记保存物品通知书()登保通[ ] 号━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━____________________________:根据《中华人民共和国行政处罚法》第三十七条第二款规定,我局决定对你(单位) 的有关物品(见《先行登记保存物品清单》)予以登记保存。
未经本局批准,不得使用、销毁或者转移。
保存地点:保存条件:附件:先行登记保存物品清单(公章)年月日本通知书已于年月日时分收到。
接收人签字:注:本文书一式二联,第一联存档,第二联交当事人。
中华人民共和国药品监督行政执法文书查封扣押物品审批表()查扣审[ ] 号案由:________________________________________________________________ __当事人:法定代表人(负责人):地址:联系方式:根据《中华人民共和国药品管理法》第六十五条第二款、《医疗器械监督管理条例》第三十一条,该单位(人)违法拟予以查封、扣押。
查封、扣押物品保存地点:查封、扣押物品保存条件:承办人:__________ 、年月日审批意见:主管领导:年月日中华人民共和国药品监督行政执法文书查封扣押物品通知书()查扣通[ ] 号━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━案由:_______________________________________________________________ ___当事人:法定代表人(负责人):地址:联系方式:━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━根据《中华人民共和国药品管理法》第六十五条第二款、《医疗器械监督管理条例》第三十一条规定,你单位(人)违法可能危害人体健康,决定予以查封、扣押。
在查封、扣押期间,未经本局批准,不得擅自使用、销毁或者转移。
如不服本决定,可依法申请行政复议或者行政诉讼。
查封、扣押物品保存地点:查封、扣押物品保存条件:附件:查封、扣押物品清单(公章)年月日本通知书于年月日时分收到。
接收人签字:注:本文书一式二联,第一联存档,第二联交当事人。
附表11XXX药品监督管理局封条年月日(盖章)附表12中华人民共和国药品监督行政执法文书()物品清单第页共页当事人:地址:上述物品品种、数量经核对无误:当事人签字(或盖章):执法人员签字:、年月日年月日注:本文书一式二联,第一联存档,第二联交当事人。
此清单用于先行登记保存、解除先行登记保存、查封扣押、解除查封扣押、没收物品时使用,在()中注明具体使用项目。
中华人民共和国药品监督行政执法文书行政处理通知书(湘)食药行处通[2004 ] 1 号━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━怀化新泰神医药有限责任公司:经初步调查(或检验)你(单位)销售劣药安胃片(批号:030903 )的行为,涉嫌违反了《药品管理法》第四十九条第一款、第三款第(六)项的规定,决定对你(单位) 立案调查。
《查封、扣押物品通知书》{(怀药)稽查扣通[2 0 0 4] 1 5 4号}查封、扣押物品的期限依法顺延。
特此通知。
(公章)2 0 0 4 年 5 月 2 6 日本通知书已于年月日时分收到。
接收人签字:注:本文书一式二联,第一联存档,第二联交当事人。
中华人民共和国药品监督行政执法文书解除先行登记保存物品通知书()解保通[ ]号__________________________________:我局于年月日,以《先行登记保存物品通知书》{( ) 登保通〔〕号}中对《先行登记保存物品清单》所列物品予以登记保存,现予以全部(或部分)解除登记保存。
附件:解除先行登记保存物品清单(公章)年月日本通知书于年月日时分收到。
接收人签字:注:本文书一式二联,第一联存档,第二联交当事人。
中华人民共和国药品监督行政执法文书解除查封扣押物品通知书()解扣通[ ]号__________________________________:我局于年月日,以《查封扣押物品通知书》{()查扣通[ ] 号}中对《查封扣押物品清单》所列物品予以查封扣押,现予以全部(或部分)解除封存。
附件:解除查封扣押物品清单(公章)年月日本通知书已于年月日时分收到。
接收人签字:注:本文书一式二联,第一联存档,第二联交当事人。
中华人民共和国药品监督行政执法文书案件合议记录第 1 页共 1 页案由:当事人:合议时间:2 0 0 4·6·18 主持人:吴公平地点:稽查办公室合议人员:彭旭明、李彩丽、李铁祥、汤智勇记录人:郑晓虹承办人员汇报案情(证据、依据、办案程序)证据:依据:《药品管理法》第四十九条第一款、第三款第六(项);第七十五条。
讨论记录:合议意见:主持人签字:合议人员签字:记录人签字:中华人民共和国药品监督行政执法文书撤案申请(湘)食药撤申[ 2004 ] 0 1号━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━案由:涉嫌销售劣药对乙酰氨基氛泡腾片当事人:湖南千金医药股份有限公司法定代表人(负责人):胡忠荣地址:株洲市炎帝广场商业街联系方式:0733--8891060案件来源:省药品检验所抽验立案时间:2 0 0 4 年 5 月8 日案情调查摘要:该公司于2003年5月7日从吉林敖东医药有限责任公司购入对乙酰氨基氛泡腾片500盒,标示生产单位:延边敖东保益生化制剂有限公司,批号:030402,规格:0.5g 经省药品检验所抽验,酸度不符合规定,定性为劣药;至案发时止,已销售460盒,销售价:10.29元/盒,销售收入:4733.4元。
撤案理由:检验标准已修改,国家药典委员会关于“修订对乙酰氨基氛泡腾片质量标准请示”复函[药典业发(1998)第35号],【检查】酸度将“PH值应为5.5~6.5”改为“PH值应为4.5~6.0”,按新标准为合格药品,省药品检验所已重新出具合格检验报告书。
承办人:李铁祥、胡成新2 0 0 4年5 月2 0 日中华人民共和国药品监督行政执法文书行政处罚事先告知书(湘)食药罚先告[ 2 0 0 4] 6 4 号湖南省药材有限责任公司中药饮片厂:你(单位) 于 2 0 0 4 年 3 月 1 日生产(加工)中药饮片穿山甲(批号:0 3 0 5 0 3 )并进行销售的行为,违反了《药品流管理法》第四十九条第一款、第三款第(六)项的规定。
依据《药品管理法》第七十五条的规定,我局拟对你(单位)进行行政处罚。
依据《中华人民共和国行政处罚法》第六条第一款、第三十一条规定,你(单位)可在2004 年7 月1 日之前到省食品药品监督管理局稽查办公室进行陈述和申辩。
