费歇尔吲哚合成
5 吲哚的合成解析
A. J. Peat and S. L. Buchwald, J. Am. Chem. Soc., 1996, 118, 1028.
K. Aoki, A. J. Peat and S. L. Buchwald, J. Am. Chem. Soc., 1998, 120, 3068.
2. Bartoli吲哚合成
4.Reissert吲哚合成
从邻硝基甲苯和草酸二乙酯合成吲哚及其衍生物。
用乙醇钾的反应效果较乙醇钠为好。 反应机理
首先邻硝基甲苯与草酸二乙酯反应生成邻硝基苯基丙酮酸乙酯,接下来用锌乙酸处理该产物,使之发生还原环化,得吲哚-2-羧酸。吲哚-2-羧酸还可脱羧产 生无取代的吲哚。
5.Bischler-Mohlau Indole Synthesis
三分子格氏试剂的作用:一 分子在第二步被消除,最终转化 为羰基化合物(6);一分子与氮上 的氢发生交换,生成烯烃 (11); 一分子成为吲哚环的C-2和C-3。
反应中的亚硝基芳烃中间体 (4)可以分离出来。它与两分子格 氏试剂反应,也可得到吲哚,说明它是反应的中间体。
Dobbs改进法
Adrian Dobbs 用邻位的溴作定位基成环,反应后再用偶氮二异丁腈和三丁 基锡烷将溴除去,生成 7-位无取代基的吲哚。
3.Leimgruber-Batcho吲哚合成
首先邻硝基甲苯与N,N-二甲基甲酰胺二甲缩醛和吡咯烷反应得到烯胺(2),然 后烯胺再发生还原环化,得到吲哚衍生物。
除上述提到的雷尼镍和肼外,钯碳加氢、氯化亚锡、连二亚硫酸钠以及铁-乙酸 都可用作还原一步的试剂。
反应机理
首先二甲基甲酰胺二甲缩醛受到吡咯烷的亲核进攻,二甲胺离去,产生一个活 性更强的试剂。它受到邻硝基甲苯甲基氢去质子化形成的碳负离子的进攻,失去甲 醇,得到上述烯胺。反应的此一步也可在无吡咯烷的条件下进行,这时反应经过 N,N-二甲基烯胺中间体,不过所需反应时间通常较长。这一步的产物烯胺类似于一 种分别在两侧连有吸电子和供电子取代基的烯烃,极性较强,而且常因分子中较大 的共轭范围而呈深红色。
吲哚的合成方法

吲哚的合成方法
嘿,朋友们!今天咱就来唠唠吲哚的合成方法。
这吲哚啊,可是个很有意思的东西呢!
你想想看,就好像搭积木一样,我们要把各种小零件巧妙地组合在一起,才能搭出我们想要的吲哚这个“小城堡”。
先说一个常见的方法,就像做菜一样,我们有了各种食材,通过一定的步骤就能做出美味佳肴。
比如费歇尔合成法,把苯肼和醛或酮放在一起,经过一系列反应,嘿,吲哚就慢慢出现啦!这就好像魔法一样神奇,不是吗?
还有一种方法呢,就像是走一条特别的小路。
通过邻硝基乙苯的反应,经过一些奇妙的变化,也能得到吲哚呢。
你说这是不是很有趣?就好像在一个神秘的化学世界里探险一样。
再说说从苯胺出发的方法,这就好比是从一个起点出发,沿着特定的路线前进,最终到达吲哚这个目的地。
这一路上啊,有各种反应和变化,就像我们在旅途中会遇到不同的风景一样。
有时候我就在想啊,这合成吲哚的过程,不就跟我们生活中的很多事情一样嘛。
需要耐心,需要技巧,还需要那么一点点运气。
就像我们要做成一件大事,得一步一个脚印,精心准备,才能迎来最后的成功。
而且啊,研究吲哚的合成方法,就像是打开了一扇通往奇妙世界的大门。
你能看到各种化学反应在那里奇妙地发生,就像一场精彩的演出。
咱可不能小瞧了这些合成方法,它们可是科学家们经过无数次尝试和探索才找到的呢。
就好像我们在生活中不断努力,才能找到属于自己的成功之路。
总之呢,吲哚的合成方法充满了神奇和魅力,让我们一起在这个化学的世界里尽情探索吧!不用去管什么复杂的步骤和困难,只要我们有热情,有好奇心,就一定能发现更多关于吲哚的奥秘!这就是我想说的,朋友们,你们觉得呢?。
吲哚的合成-060117

经典化学合成反应标准操作吲哚的合成目录2. Fischer 吲哚合成 (2)2.1 Fischer 吲哚合成反应示例 (2)3. 从硝基苯的衍生物出发合成吲哚 (3)3.1 邻甲基硝基苯衍生物合成吲哚 (4)3.1.1 邻甲基硝基苯衍生物合成吲哚示例 (4)3.2 邻甲酰基硝基苯衍生物合成吲哚 (4)3.1.2 邻甲酰基硝基苯衍生物合成吲哚示例 (5)3.3 邻氰甲酰基硝基苯衍生物合成吲哚示例 (5)3.4 邻乙烯基硝基苯衍生物合成吲哚示例 (6)3.5 邻位有氢的硝基苯衍生物直接用乙烯格氏试剂合成吲哚(Bartoli反应)示例74. 从苯胺的衍生物出发合成吲哚 (7)4.1苯胺经佛克烷基化再还原关环合成吲哚 (7)4.2 N-羟基苯胺DMAP催化下与丙炔酸酯缩合合成3-羧酸吲哚衍生物 (9)4.3 Nenitzescu吲哚合成 (9)5. 2-叠氮基-3-芳基丙烯酸酯环合合成2-羧酸吲哚衍生物 (10)5.1 2-叠氮基-3-芳基丙烯酸酯环合合成2-羧酸吲哚衍生物示例 (11)1. Introduction吲哚及其衍生物是一类非常有效的药物中间体。
已有不少相关综述报道其合成方法1。
我们将一些常用的合成方法简单的列举了出来,供大家在合成此类化合物的时候参考。
1 (a) G. W. Gribble, Contemp. Org. Synth., 1994, 145. (b) U. Pindur and R. Adam, J. Heterocycl. Chem., 1988, 25, 1. (c) C. J. Moody, Synlett , 1994, 681. (d) R. J. Sundberg, Indoles , Academic Press, San Diego, CA, 1996. (e) T. L. Gilchrist , J. Chem. Soc., Perkin Trans. 1, 1999, 2849. (f) G. W. Gribble, J. Chem. Soc ., Perkin Trans. 1, 2000, 1045.2. Fischer 吲哚合成Fischer 吲哚合成法是一个常见的吲哚合成方法。
Fischer吲哚合成法机理探究及其应用进展

e)在 18 r 83年 发 现 的 。反 应 是 用 苯 肼 与 醛 、酮 ( 一亚 甲 含
1 1 苯腙 的 烯肼化 .
关于烯肼 化 R bno o isn曾提 出这样 的假设 … :苯腙可能异 构
M e ha i m f Fi c e nd l y t e i nd is Ap lc to s c n s o s h r I o e S n h ss a t p i a i n
Z u n— u ,Y in HU G a h a ULa g—m n H NG Q ,Z A G Z i j ,L Xa i ,Z A i H N h - i a I i ( e a oa r f r eC e i r T er n eh ooy K yL brt yo i h m s y h o adT c n l ,Miir f d ct n o Ma n t y g ns o u ai , t y E o O enU i r t o hn ,S a dn ig a 6 10 hn ) ca nv sy f ia h n ogQn d o 6 0 ,C ia e i C 2
朱 官 花 ,于 良民 ,张 琦 ,张 智嘉 ,李 霞
( 中国海 洋大学海 洋化 学理论 与工程技 术教 育部 重点 实验 室 ,山 东 青 岛 2 6 0 ) 6 10
摘 要 :吲哚及其衍生物因其特殊的生物活性而广受关注,其合成方法很多,F ce法是合成该类化合物最经典和便捷的 i hr s
目前 被 广 泛 接 受 的 理 论 是 由 R bno ,G M 和 R bno , oi n . . s oisn R .在 12 提 出的 。可 简 要 概 括 为 三 步 : ( ) 苯 腙 的 烯 9 4年 1 肼 化 ; ( ) 新 C—C键 的 形 成 ; ( ) 释 放 氨 气 ,形 成 含 氮 五 元 2 3
吲哚合成方法

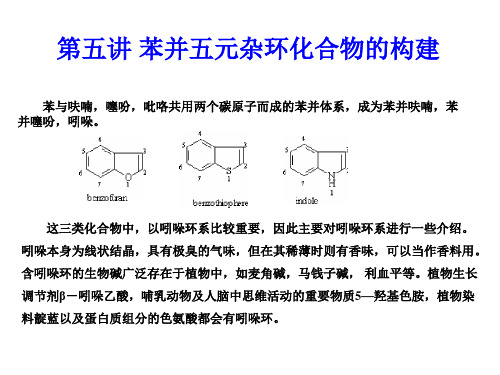
吲哚一词来源于印度的英文单词(India ):在十六世纪从印度进口的蓝色染料被称作靛篮。
将此染料化学降解可得到氧化的吲哚-吲哚酚和羟基吲哚。
吲哚在1866年通过在锌粉作用下蒸馏羟基吲哚第一次被制备出来。
吲哚可能是自然界中分布最广的杂环化合物。
色氨酸是必需的氨基酸,也是大多数蛋白质的组成部分。
它还可作为各种色胺、吲哚和2,3-二氢吲哚的生物合成前体。
2N H NH 2在动物中,存在于血液中的5-羟基色胺(5-HT )是中枢神经系统中非常重要的神经递质,在心血管和胃肠道中也起很大作用。
结构类似的激素褪黑素被认为能控制生理功能的昼夜节律。
NNH 2OH N H NHAcCH 3O植物王国中色胺酸衍生物包括3-吲哚基乙酸,它是一种有效的植物生长调节激素;以及大量不同结构的二级代谢产物-吲哚类生物碱,这一类化合物由于其有效的生理活性被广泛作为药物使用。
吲哚的结构单元也大量出现在许多人工合成的药物中,如具有消炎镇痛作用的环氧酶抑制剂吲哚美辛,止吐作用的5-HT 3受体拮抗剂昂丹司琼等。
NCH 3CH 3OOClCOOHNHON NMe由于吲哚在天然产物全合成和药物合成中的重要性,有机合成领域不断有大量关于吲哚环的全新合成方法和改进方法出现,已经形成了一个相当系统的合成框架,以下是一些目前可行的最重要的合成方法及示例。
1.通过醛和酮的苯腙的制备方法 (1) Fischer 合成法Fischer吲哚合成法发明于1883年,利用苯腙在酸或Lewis酸催化下通过重排反应,亲核关环,再消除氨而形成吲哚环N H NCH3NHPh1事实上,有时将醛或酮与苯肼在乙酸中一起加热即可发生“一锅煮”的反应2,生成的苯腙可不经分离直接发生重排反应。
甲基苯磺酸、阳离子交换树脂及三氯化磷都可有效地催化环化反应,有时在室温或更低的温度下反应也可进行3。
苯环上的供电基能提高Fischer环化反应的速率,而吸电基则降低反应速率。
但带有硝基的苯腙在合适的酸和反应条件下也可较好地发生反应,如甲苯与多聚磷酸的两相混合物4或三氟化硼的乙酸溶液5。
fisher吲哚合成法及反应机理

fisher吲哚合成法及反应机理
Fisher吲哚合成法是一种合成吲哚的方法,其反应机理如下:
首先,苯肼(或其衍生物)与含有两个α-氢的醛或酮在酸催化下缩合生成苯腙。
这个过程不需要分离,因为苯腙会立即在酸催化下发生异构化反应,生成烯胺。
烯胺又会发生一个[3,3]迁移反应,生成二亚胺。
之后,二亚胺芳构化后成环,得到一个缩醛胺(aminal)。
氨基质子化,放出氨,并失去一个质子生成芳香性的吲哚环。
在这个过程中,醛或酮必须是RCOCH₂R'类型的,其中R/R'为烷基、芳基或氢。
若醛酮的羰基有两个α-氢,则反应后一般得到两种产物的混合物。
此外,苯肼中的亚氨基氮原子(—NH—)在反应后转化为吲哚环中的氮,这一点已经得到同位素示踪实验的证实。
5-吲哚的合成-2011

维克多· 格林尼亚 1871 05.06 - 1935 12.13
反应机理 首先格氏试剂与硝基芳烃加成为中间体(3)。(3)自发分解为亚硝基芳烃(4)和醇 镁(5)。(5)在反应最后酸化时可以转化为羰基化合物(6)。(4)则与第二分子格氏试剂
加成为中间体(7),邻位取代基的位阻引发(7)的[3,3]-σ 迁移反应,使其转变为(8)。
Reaction mechanism The first two step involve the reaction of the α-bromo-acetophenone with molecules of aniline to form intermediate 4. The charged aniline forms a decent enough leaving group for an electrophilic cyclization to form intermediate 5, which quickly aromatizes and tautomerizes to give the desired indole 7.
The reaction mechanism is divided among three steps. The first step is the oxidation of the aniline 1 using (t-BuOCl) to give the chloramine 2. The second step is the addition of the ketone to give the sulfonium ion 3, and is typically done at low temperatures (-78 °C). The third and final step is the addition of a base, which in this case is triethylamine. Upon warming to room temperature, the base will deprotonate the sulfonium ion creating the sulfonium ylide 4, which quickly undergoes a [2,3]-sigmatropic rearrangement to give the ketone 5. The ketone 5 will undergo a facile condensation to give the desired 3thiomethylindole 6.
Fischer法合成2,5-二甲基吲哚的工艺研究

,
1 实验
1 . 1 试 剂与 仪器
在5 0 0 mL烧杯 中加 入 4 0 . 0 g ( 约0 . 2 5 oo t 1 ) 4 一 甲 基苯肼 盐 酸盐 ( 经 HP L C检测 纯度 为 9 7 . 2 9 , 6 ) 、 4 0 m除低沸点物
质, 即得 4 一 甲基 丙 酮 苯 腙 粗 品 3 O . 6 g , 不 经处 理 直 接
1 . 2 . 1 4 一 甲基苯 肼 的合成
收 稿 日期 : 2 0 1 3 —0 3 一O 2
作者简介 : 徐 小军( 1 9 7 2 一) ・ 男・ 湖 北红安人 。 工程师 。 研 究方向: 应用化 学; 通讯作者 : 喻 宗沅, 研究员 。 E - ma i l ; y u z y l s @g ma i lcom
亿
与 生 物 互程 2 0 1 3 , V o 1 . 3 0 N o . 4
Ch e mi s t r y & Bi o e n g i n e er i n g
囝
F i s c h e r法 合成 2 , 5 一 二 甲基 吲 哚 的 工艺 研 究
徐 小军 。 尤庆 亮I , Z 。 余朋 高 。 喻宗沅
关键词 : F i s c h e r法 ; 2 。 5 一 二 甲基 吲 哚 ; 合 成
中图 分 类 号 : TQ 2 5 1 . 3 4 0 6 2 6 . 1 3
文献标识码 : A
文章编号 : 1 6 7 2 —5 4 2 5 ( 2 0 1 3 ) 0 4 —0 o 5 9 一O 4
Fischer法合成2_3_环戊基吲哚的工艺研究

as high as 98% and t he t ot al yield reached 72% .
Keywords: F ischer m et hod; sy nt hesis; 2, 3 cyclopent yl indole
( 上接第 12 页)
[ 23] 付晶晶, 孙 卫东. 蔗糖 酯分 离提纯 研究 进展 [ J ] . 食 品研 究与 开 发, 2008, 29( 12) : 157 159.
LI Mei xiang
( J ining V ocat ional T echnol ogy Col lege, J i ni ng 272037, Chi na)
Abstract: 2, 3 Cy clopent yl indole w as synt hesized f rom pheny lhy drazine and cy clo pent anone by Fischer
ex hibit ed t he opt im um cat alyt ic capabilit y. Wit h it as the cat alyst and t hro ug h t he r eact ion of 5 h, t he object
com po und w it h y ield o f 90 0% and cont ent of 94. 1% w as obt ained. By r ef ining, the purit y o f product reached
收率/ %
4
36. 9
89. 0
75. 0
5
42. 0
94. 1
90. 0
6
42. 3
94. 1
90. 2
常见吲哚类化合物合成方法简介_孙微微

CH2CH2NH2 Cl Cat.
N
N
H
H
1.4 Fischer法[8](药物合成反应) 此法是以苯肼与醛或酮为原料,先生成苯腙中
间体,然后与催化剂(常用Lewis acid,如ZnCl2) 一起加热,失去一分子氨而得到吲哚,此即为 Fischer吲哚合成法,反应中要涉及到[3,3]-σ迁移重 排和双亚胺的结构互变。由于原料中可以是结构较
NH2
CH3 N H
2.2 Fischer法[8] 3-甲基吲哚工业上采用常采用Fischer法生产,
即用丙醛、苯肼为原料,先加热脱去一分子水后得 到丙醛苯腙,然后在氯化锌或稀硫酸催化作用下,
N NH2 + H
H O
加热脱去一分子氨,环合得到粗品3-甲基吲哚。结 合分子蒸馏、重结晶等技术,可制得高纯度的3-甲 基吲哚,其合成反应式如下:
由于原料中可以是结构较为丰富的各种醛或酮所以可以合成23位上连有同取代基的各种结构的吲哚衍生物此法是实验室合成吲哚及其衍生物的最普遍方法之一常用于各种结构复杂的吲哚类化合物的合成
宁波化工 Ningbo Chemical Industry
2011 年第 1 期
常见吲哚类化合物合成方法简介
孙微微
(河北科技大学 化学与制药工程学院,石家庄 050018)
Key words: synthetic method; Indole and its derivative
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
新材料可解玻璃防水雾难题
据报道,加拿大拉瓦尔大学的科学家成功研制出一种新型玻璃防水雾涂层材料,涂层不会对玻璃的光 学性质产生任何影响。他们认为该材料可以最终解决汽车玻璃、眼镜片以及光学镜头的防水雾难题。
吲哚合成实验报告

一、实验目的1. 熟悉吲哚的合成方法及实验操作步骤;2. 掌握有机合成实验的基本技能,提高实验操作能力;3. 熟悉吲哚的物理性质和化学性质,为后续研究打下基础。
二、实验原理吲哚是一种重要的含氮杂环化合物,广泛存在于天然产物、药物、农用化学品和功能材料中。
吲哚的合成方法主要有以下几种:1. Bartoli吲哚合成法:通过邻硝基苯与乙烯基格氏试剂在低温下反应,环化生成吲哚;2. Armido Studer自由基合成法:利用光催化活化硝基芳烃,在室温下合成吲哚;3. 硼烷催化硼化/氢负转移串联反应:以吲哚为原料,一步合成C5-硼化吲哚。
本次实验采用Bartoli吲哚合成法,通过邻硝基苯与乙烯基格氏试剂在低温下反应,环化生成吲哚。
三、实验仪器与试剂1. 仪器:反应瓶、磁力搅拌器、恒温水浴、真空泵、蒸馏装置、分析天平、红外光谱仪、核磁共振波谱仪等;2. 试剂:邻硝基苯、乙烯基格氏试剂、无水乙醚、无水氯化钙、碳酸钠、氢氧化钠、水等。
四、实验步骤1. 配制邻硝基苯溶液:将邻硝基苯溶解于无水乙醚中,配制成0.1 mol/L的溶液;2. 配制乙烯基格氏试剂:将无水乙醚加入反应瓶中,加入一定量的金属镁条,待金属镁条反应完全后,加入无水氯化钙干燥,再加入乙烯基卤代烃,制备乙烯基格氏试剂;3. 混合反应:将邻硝基苯溶液与乙烯基格氏试剂混合,置于低温水浴中,缓慢搅拌,反应过程中注意观察反应液的温度和颜色变化;4. 后处理:反应结束后,将反应液转移至另一反应瓶中,加入适量碳酸钠,搅拌,使反应液呈碱性。
然后加入适量水,搅拌,使有机层与水层分离。
分去有机层,水层用盐酸调节pH至2-3,再用水洗至中性。
将水层浓缩干燥,得到粗产品;5. 纯化:将粗产品用柱色谱进行纯化,选择合适的洗脱剂,得到目标产物。
五、实验结果与分析1. 反应液颜色变化:反应过程中,反应液颜色由无色逐渐变为深蓝色,表明反应正在进行;2. 后处理过程中,有机层与水层分离较好,表明反应产物主要存在于有机层中;3. 纯化后,得到淡黄色固体,产率为60%;4. 红外光谱和核磁共振波谱分析表明,目标产物与理论结构一致。
吲哚的化学反应

吲哚的化学反应
吲哚是一种亚胺,具有弱碱性,其化学反应主要有以下几种:
1. 亲电取代反应:在特殊的条件下,吲哚能进行芳香亲电取代反应,3位上的氢优先被取代,如用磺酰氯反应,可以得到3-氯吲哚。
3位上还可发生多种反应,如形成格氏试剂,与醛缩合,以及发生曼尼希反应等。
2. 与乙炔加成:吲哚在碱性催化剂(如醇钾、氢氧化钾、氰化钾等)存在时,可以和乙炔发生加成反应。
3. 在强酸的作用下可发生二聚合和三聚合作用。
除了以上反应之外,吲哚及其同系物可用多种方法合成,其中以费歇尔合成法最普遍,它是用酮或醛的芳香腙在酸性条件作用,发生重排反应而制成。
在这一反应中,所用的酮必须有一个一级碳原子与羰基相连,才能得到吲哚。
磺酰氯及吲哚的合成-MA070905

13
1.1.2.4 芳香磺酸或盐氯化制备芳香磺 酰氯示例
芳香磺酸或盐氯化制备芳香磺酰氯示例
NC SO3Na POCl3 NC SO2Cl
芳香环磺化反应示例
NO2 NH2 HNO3 H2SO4 NO2 N2HSO4 Cu, FeSO4 SO2 NO2 SO3H
萘的磺化也和甲苯类似。低温,小于80℃磺化,主 要生成α-萘磺酸,这时由动力学控制;一旦达到 160℃的反应温度,主要产生β-萘磺酸。这时由热 力学控制。
SO3H 50 oC H2SO4
170 oC
SO3H
10
1.1.2.1 磺化举例
磺化反应的可逆性的一个重要应用是将磺酸基先临时占据芳 环某特定位臵,然后再进行其他的反应,待反应完成后,再 在稀硫酸中加热,以移去磺酸基。例如β-溴代萘的合成。
3
1.1 芳香磺酰氯的制备
芳香磺酰氯的制备一般分为以下几种方法:
1.直接氯磺化法制备芳香磺酰氯。 2.芳香磺酸或盐经氯化制备芳香磺酰氯。 3.芳香硫醇及相关衍生物氯化,氧化合成芳香磺酰氯。 4.Sandermeyer反应由芳胺合成芳香磺酰氯。
4
1.1.1 直接氯磺化法制备芳香磺酰氯
氯磺酸是一类比较常用的直接氯磺化试剂,氯磺酸的活性比浓硫酸 大,反应温度较低,同时可以直接得磺酰氯。氯磺化也是亲电反应 ,选择性也遵循芳环取代基定位效应及其规则,有规律可循。如果 希望反应比较缓和,可以用氯仿或其它卤代烷烃作为稀释剂。反应 温度一般都控制在0至20℃。
Br + KSCOOC2H5 Acetone SCOOC2H5 LiAH4/(C2H5)2O SH
fischer吲哚合成反应机理

fischer吲哚合成反应机理
Fischer吲哚合成反应,又称为Fischer-Hepp反应,是指在碘化物和酸的催化下,将肼与醛、羰基化合物等经过缩合反应合成吲哚的过程。
该反应机理比较复杂,下面就来详细介绍一下。
反应前期:首先,碘化物会将醛、羰基化合物等中的一个羰基氧离子亲近攻击,形成加合物。
随后,该加合物中的氧离子与碘形成复合物,并脱离出羰基。
这个过程中,产生了单电子的碘正离子和单电子的羰基负离子。
反应中期:羰基负离子与与肼分子反应,这个过程中,由于羰基的电子云被肼分子中的氮原子亲近吸引,使得羰基负离子的负电荷密度降低,从而羰基中的氧离子与一个氢离子结合,脱离出水分子。
此时,出现了被稳定的亚胺离子。
亚胺离子中,羰基碳原子上的孤对电子会被肼中的氮原子吸引,使得碳原子上的负电荷密度降低,从而与碘形成化学键,此时的羰基已经脱离出亚胺离子。
反应后期:亚胺离子中的氮原子中有两对孤对电子,其中的一对电子会抽离出异闪光灯中的负电子,形成自由基。
此时,自由基可以通过重复之前的碱催化步骤,使得自身上的羰基继续与肼反应,并形成新的亚胺离子。
另一方面,自由基上的孤对电子会吸引与羰基碳原子的电子云,使得它们形成共价键。
随后,氢离子可以与亚胺离子中的羰基碳原子上的一个孤对电子结合,形成最终产物——吲哚。
总之,Fischer吲哚合成反应是一种以缩合为主要反应机理的反应。
在该反应中,
碘化物和酸是必要的催化剂,可以极大提高反应速率和产物得率。
fisher吲哚合成法

fisher吲哚合成法Fischer indole synthesis是由德国化学家Emil Fischer于1883年发明的一种合成有机化合物的方法,用于合成芳香咪唑衍生物的经典反应。
在此反应中,一种含氮原子的芳香烃分子(例如苯甲酸)与一个含氮原子的醛(例如乙醛)反应,生成一种含氮原子的芳香环(吲哚),即所需要的吲哚衍生物。
Fischer indole synthesis反应一般发生在一种芳香烃(一般为苯甲酸)和一种醛(一般为乙醛)之间,以生成一种含氮原子的芳香环(吲哚)。
该反应的最常见形式是将芳香烃(苯甲酸)与醛(乙醛)反应在温和的条件下,以生成吲哚衍生物。
该反应的机理如下:1、苯甲酸经过热处理,使它的羰基水解成一氧化二氢和乙酸;2、一氧化二氢受热后再次水解,释放出氢气;3、乙酸受热后,其羰基聚合反应,生成一种含有两个氢原子的较小的芳香环;4、这种芳香环受到乙醛的活化作用后,再经过热处理,使其上的一个氢原子被乙醛替代,生成了所需要的吲哚衍生物。
Fischer indole synthesis是一种常见的、可大规模生产的合成方法,可以用于合成各种芳香咪唑衍生物,如对照药物、抗肿瘤药物和酶调节剂等。
它的优点是反应时间短、反应条件简单、成本低廉,而且可以以高产率合成出复杂的芳香咪唑衍生物。
相反,Fischer indole synthesis反应的缺点也是很明显的,这种合成方法需要使用苯甲酸作为原料,而苯甲酸的毒性和生态污染性较强,因此必须对使用的苯甲酸加以严格控制,避免造成环境污染。
因此,Fischer indole synthesis反应是一种有效、经济、环保的合成方法,可以用于合成芳香咪唑衍生物,如药物和生物活性物质等。
但是,为了避免苯甲酸造成环境污染,必须采取有效的控制措施和技术措施,以保证该反应的经济性和环保性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
费歇尔吲哚合成
费歇尔吲哚合成是一种重要的有机合成反应,可以用于制备吲哚衍生物。
本文将从反应机理、反应条件和用途三个方面来介绍费歇尔吲哚的合成。
一、反应机理
费歇尔吲哚合成是一种经典的有机合成反应,形成吲哚骨架的过程中,酮类化合物通过酰亚胺中间体受亲核试剂的取代,最终生成吲哚结构。
反应机理如下:
首先酮类化合物与氨水或者胺发生加成反应,形成酰亚胺中间体。
然后中间体中的氮原子上的负电荷受到亲核试剂的攻击,形成一个新的碳-碳键,使酰亚胺环缩合成吲哚环。
最后通过水解反应,得到目标产物吲哚。
二、反应条件
1. 氨水或胺的使用量
氨水或胺的使用量直接影响到反应的效率和产率。
过多的氨水或胺会影响反应速率,而使用过少会产生杂质。
2. 催化剂
众所周知,催化剂可以提高反应速率和产物收率。
研究表明,不同的催化剂会对反应有不同的影响。
传统的催化剂有硼酸、三氯化铝、氧化铝等等,近年来,还有各种催化剂的开发和应用。
3. 反应溶剂
反应溶剂可以影响反应的效率和产率。
一般情况下,有机溶剂如乙醇、二甲基甲酰胺、二氯甲烷等可以作为反应溶剂。
4. 反应温度
反应温度也是影响反应速率和产物收率的重要因素。
一般反应温度在室温下或者略高于室温下进行,根据反应条件的不同,反应温度也会有所改变。
三、用途
1. 吲哚衍生物的合成
费歇尔吲哚合成是制备吲哚衍生物的重要方法。
吲哚及其衍生物在生物活性分子中具有广泛的应用。
2. 药物的合成
吲哚化合物在许多药物中被广泛应用,例如小檗碱、鹅观草碱等药物都是吲哚类衍生物。
利用费歇尔吲哚合成,可以合成具有特定结构和活性的药物。
3. 杂环化合物的合成
在特定的硬件条件下,费歇尔吲哚合成可用于获得不含氮或含氮杂环的化合物,从而制备出新的生物活性分子。
总结:
费歇尔吲哚合成是合成吲哚衍生物重要的方法之一,适用范围广泛,可以应用于合成化合物和杂环化合物等。
合成反应机理相对简单,但反应条件和催化剂等仍然需要根据实验的需要进行选择。
同时也可以进一步发展该反应来实现更广泛的应用,例如应用于特定类生物合成研究。
