药品不良反应检索申请表
药品不良反应报告表填写示例及填写说明
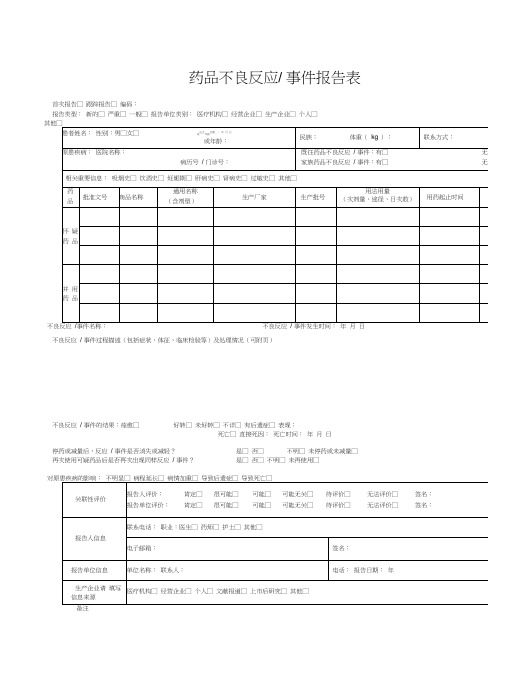
药品不良反应/ 事件报告表首次报告□ 跟踪报告□ 编码:报告类型:新的□ 严重□ 一般□ 报告单位类别:医疗机构□ 经营企业□ 生产企业□ 个人□不良反应事件名称:不良反应事件发生时间:年月日不良反应/ 事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页)不良反应/ 事件的结果:痊愈□好转□ 未好转□ 不详□ 有后遗症□ 表现:死亡□ 直接死因:死亡时间:年月日停药或减量后,反应/ 事件是否消失或减轻?是□ 否□不明□ 未停药或未减量□再次使用可疑药品后是否再次出现同样反应/ 事件?是□ 否□ 不明□ 未再使用□电子邮箱: 签名:×××药 品 不 良 反 应 / 事 件 报 告 表示例不良反应 / 事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页) 一般格式为:患者因×××疾病于×××月×××日(必要时应详细到×××时分)以×××途径给予×××药品,×××剂量,用药×× ×时间出现×××反应(反应描述须明确、具体) ,×××时间后给予是否停药及×××处理(包括以×××途径给予×××药品及×××剂 和其他处理措施) ,处理后×××时间患者转归情况。
对原患疾病的影响: 不明显□ 病程延长□ 病情加重□ 导致后遗症□ 导致死亡□报告人评价: 肯定□ 很可能□ 可能□ 可能无关□ 待评价□ 无法评价□ 签名:××× 报告单位评价:肯定□很可能□可能□可能无关□待评价□无法评价□签名:×××报告人信息患者姓名:×××性别:男□女□出生日期: 年 月 日 或年龄: ××民族:××体重( kg ):××联系方式:××××××原患疾病:指患者此次入 诊的主要疾病(如果有多 疾病可以补充在相关重要 是备注里面),不能写字院或就 种慢性信息或 母缩写。
药品不良反应报告表(空表)(药品生产企业使用)20180320
附件
联系方式:
原患疾病:
医院名称:
病历号/门诊号:
既往药品不良反应/事件:○不详无○○有药品通用名称:不良反应名称:
家族药品不良反 应/事件:○不详无○○有与患者关系:药品通用名称:不良反应名称:
相关重要信息:□吸烟史□饮酒史□妊娠期□肝病史□肾病史□过敏史□其他
怀疑用药(可添加栏)
批准文号
商品名称
通用名称
药品不良反应/事件报告表
报告类型:○新的○一般○严重(严重程度请选择:□导致死亡;□危及生命;□致癌、致畸、致出生缺陷;□导致显著的或者永久的人体伤残或者器官功能的损伤;□导致住院或者住院时间延长;□导致其他重要医学事件。)
患者姓名:
性别:○男○女○不详
出生日期:年 月 日
或年龄:
民族:
体重(kg):
不良反应/事件的结果:○痊愈○好转○未好转○不详○有后遗症表现:
○死亡直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻:
○是○否○不明○未停药或未减量
再次使用可疑药品后是否再次出现同样反应/事件:
○是○否○不明○未再使用
对原患疾病的影响:
○不明显○病程延长○病情加重○导致后遗症○导致死亡
关联性评价
Hale Waihona Puke 报告人:○肯定○很可能○可能○可能无关○待评价○无法评价
签名:
报告单位:
○肯定○很可能○可能○可能无关○待评价○无法评价
签名:
报告人信息
联系电话:
职业:○医生○药师○护士○其他
电子邮箱:
签名:
报告单位信息
单位名称:
联系人:
电话:
报告日期:
药品不良反应报告表模板
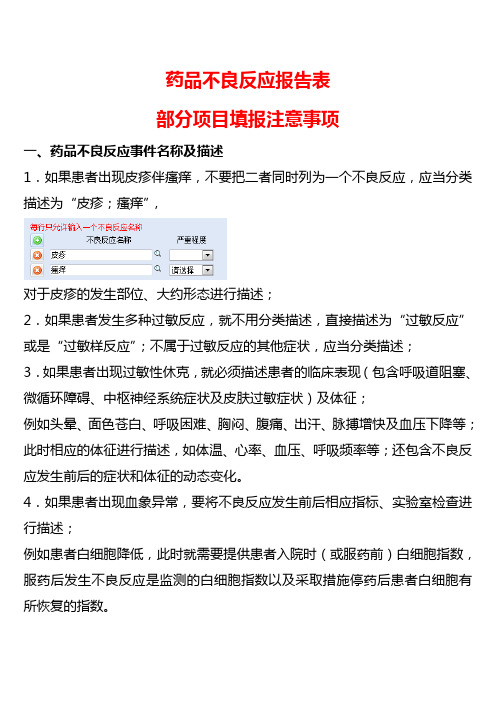
药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。
大家应当按照规定时限完整的对药品不良反应进行上报。
备注:提供一个药品不良反应/事件报告表填写模板(见附表),供大家参考。
附表药品不良反应 / 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□联系电话:职业:医生□药师□护士□其他□报告人信息电子邮箱:签名:报告单位信息单位名称:联系人:电话:报告日期:年月日生产企业请医疗机构□经营企业□个人□文献报道□上市后研究□其他□填写信息来源备注。
药品不良反应报告表范例

药品不良反应/ 事件报告表
新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□单位名称:部门:电话:报告日期:年月日
不良反应
分析
1.用药与不良反应的出现有无合理的时间关系?有√无□
2.反应是否符合该药已知的不良反应类型?是√否□不明□
3.停药或减量后,反应是否消失或减轻?是√否□不明□未停药或未减量□
4.再次使用可疑药品后是否再次出现同样反应?是□否□不明□未再使用√
5.反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否√不明□
报告人职业(医疗机构):医生□药师□护士□其他□报告人职务职称(企业):报告人签名:。
药品不良反应报告表、填写示例及填写说明
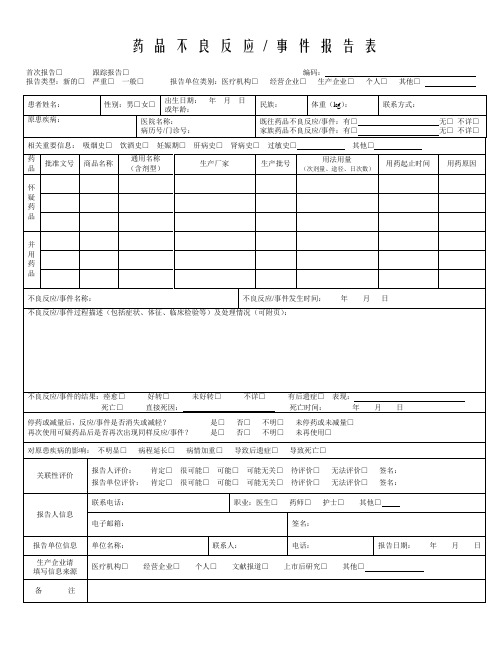
药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□药品不良反应/ 事件报告表示例首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□《药品不良反应/事件报告表》填写说明1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□(1)新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。
新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。
有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。
如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
药品不良反应登记表格模板

关联性评价
报告人:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
省级药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
药品不良反应/事件报告表
新的□严重□一般□医疗卫生机构□生产企业□经营企业□个人□编码
单位名称:部门:电话:报告日期:年月日
患者姓名:
性别:
男□女□
出生日期:
年月日
民族:
体重(㎏)
联系方式:
家庭药品不良反应/事件:有□无□不详□
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名称:
不良反应/事件发生时间:
国家药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告人职业(医疗机构):医生□药师□护士□报告人职务职称(企业):报告人签名:
病历号/门诊号
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
商品名称
通用名称(含剂型,监用药起
止时间
用药原因
怀疑
药品
并用
药品
不良反应/事件的结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日
原患疾病:
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现:
药品不良反应报告表、填写示例及填写说明
药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□药品不良反应 / 事件报告表示例首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□《药品不良反应/事件报告表》填写说明1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□(1)新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显着的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。
新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。
有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。
如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
药品不良反应报告表(示范模板)

附表1药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降(80/50mmHg)等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一下相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。
附表8 药品不良反应

患者1.2日以“间断咳嗽,咳痰21年,活动后胸闷4年,再发加重1天”为主诉入院。1.4日患者发热38.7℃,给予布洛芬混悬液(10mL/次,once,po)退热,服药约40min后,患者出现恶心,烧心的症状,考虑为布洛芬混悬液所致,遂停用该药物,后患者症状减轻。后患者未再使用该药物。
9
患者以咳嗽、咳痰3天为主诉入院,患者1.13日晚上八点左右,左手手面出现散在的点状红斑,伴瘙痒,但可忍受,考虑为乳酸左氧氟沙星氯化钠注射液所致皮疹,鉴于1.13日左氧氟沙星医嘱已经执行,1.14日停用乳酸左氧氟沙星氯化钠注射液。后患者未再出现皮疹的不良反应。与左氧氟沙星同时使用的还有多索茶碱,布地奈德雾化液和孟鲁司特钠片,查阅该药物相关资料,孟鲁司特同样会导致皮疹的发生,但患者1.15日出现皮疹后继续使用此两种药物,皮疹未加重,即皮疹与孟鲁司特的使用关系不大。且患者支气管哮喘急性发作期不会引起皮疹的发生,所以排除患者病情的影响。患者入院时无皮疹。
6
患者以发热伴咳嗽、咳痰半个月为主诉入院,2021.12.29)在我院住院时诊断为“双肺间质纤维化、双肺肺气肿和肺大泡”,尚未接受治疗。患有“阵发性心房颤动”1年,曾规律口服“胺碘酮片半片/次1次/日”和“利伐沙班片10mg 1次/日”治疗,20天前上述药物已停用。
2022.1.1,患者无明显诱因开始出现发热,测体温最高达37.5℃,伴咳嗽、咳痰,呈阵发性,咳少量黄白痰,痰粘不易咳出,伴胸闷、气短,活动时加重,伴纳差、乏力。院期间患者查胸部CT示:间质性改变。遂停用胺碘酮片。
药品不良反应/事件登记表
序号
分析与评价要点
1
患者11.4日以“间断胸闷、气短4年,加重2天”为主诉入院。11.9-11.13日给予哌拉西林他做巴坦钠(4.5g/次,q8h),11.12日晚,患者诉大便次数增多(3次),为稀便,患者既往无腹泻史,考虑为哌拉西林他做巴坦钠引起的腹泻,更换哌拉西林他做巴坦钠为盐酸左氧氟沙星氯化钠注射液,并给予蒙脱石散(1袋/次,tid),枯草杆菌二联活菌肠溶胶囊(0.25g/次,bid)对症处理,后未再出现腹泻。
药品不良反应报告表(国家)

药品不良反应报告表(国家)
制表单位:国家食品药品监督管理局
药品不良反应/事件报告表
新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□
单位名称:部门:电话:报告日期:年月日
患者姓名
性别:男□女□
出生日期:年月日
民族
体重
(kg)
联系方式
家族药品不良反 应/事件:有□无□不详□
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名称:
不良反应/事件发生时间:
年月日
病历号/门诊号(企业填写医院名称)
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
个人报告单位编码一栏填写6000
◇注:通用名称一栏,首次获准进口5年内的进口品种用*注明
国家药品不良反应监测中心药品不良反应监测中心
通信地址:北京市崇文区法华南里11号楼二层通信地址:
邮编:100061邮编:
电话:(010)67164979电话:
传真:(010)67184951传真:
E–mail:report@E–mail:
6.国内上年度的销售量和销售范围;
7.境外使用情况(包括注册国家、注册时间);
8.变更情况(药品成分或处方、质量标准、生产工艺、说明书变更情况);
9.国内外临床安全性研究及有关文献报道情况;
10.除第1、2项以外,其他项目一年之内如无变更,可以免报。
新的、严重的药品不良反应/事件病例报告要求
药品生产企业报告要求
药品不良反应登记表

病历号/门诊号
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
商 品 名 称
通用名称(含剂型,监测期内品种用﹡注明)
生 产 厂 家
批 号
用法用量
用药起
止时间
用药原因
怀疑
药品
并用
药品
不良反应/事件的结果:治愈□好转□ 有后遗症□ 表现: 死亡□ 直接死因: 死亡时间: 年 月 日
省级药品不良反应监测机构:肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□ 签名:
国家药品不良反应监测机构:肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□ 签名:
报告人职业(医疗机构):医生□ 药师□ 护士□ 报告人职务职称(企业): 报告人签名:
原患疾病:
对原患疾病的影响:不明显□病程延长□ 病情加重□ 导致后遗症□ 表现:
国内有无类似不良反应(包括文献报道):有□ 无□ 不详□,国外有无类似不良反应(包括文献报道):有□ 无□ 不详□
关联性评价
报告人: 肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□签名:
报告单位:肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□ 签名:
药品不良反应/事件报告表
新的□ 严重□ 一般□医疗卫生机构□ 生产企业□经营企业□个人□ 编码
单位名称:部门:电话:报告日期:年月日
患者姓名:
性别:
男□女□
出生日期:ቤተ መጻሕፍቲ ባይዱ
年 月 日
民族:
体重(㎏)
联系方式:
家庭药品不良反应/事件:有□无□不详□
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名称:
药品不良反应登记表

新地□严重□一般□医疗卫生机构□生产企业□经营企业□个人□编码
单位名称:部门:电话:报告日期:年月日文档来自于网络搜索
患者姓名:
性别:
男□女□
出生日期:
年月日
民族:
体重(㎏)
联系方式:
家庭药品不良反应事件:有□无□不详□
既往药品不良反应事件情况:有□无□不详□
不良反应事件
名称:
不良反应事件发生时间:
病历号门诊号
不良反应事件过程描述(包括症状、体征、临床检验等)及处理情况:
商品名称
通用名称(含剂型,监测期内品种用﹡注明)
生产厂家
批号
用法用量
用药起
止不良反应事件地结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日
原患疾病:
对原患疾病地影响:不明显□病程延长□病情加重□导致后遗症□表现:
国内有无类似不良反应(包括文献报道):有□无□不详□,国外有无类似不良反应(包括文献报道):有□无□不详□
关联性评价
报告人:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
省级药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
国家药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告人职业(医疗机构):医生□药师□护士□报告人职务职称(企业):报告人签名:文档来自于网络搜索
药品不良反应登记表

对原患疾病的影响:不明显□病程延长□ 病情加重□ 导致后遗症□ 表现:
国内有无类似不良反应(包括文献报道):有□ 无□ 不详□,国外有无类似不良反应(包括文献报道):有□ 无□ 不详□
关联性评价
报告人: 肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□签名:
报告单位:肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□ 签名:
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名称:
不良反应/事件发生时间:
病历号/门诊号
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
商 品 名 称
通用名称(含剂型,监测期内品种用﹡注明)
生 产 厂 家
批 号
用法用量
用药起
止时间
用药原因
怀疑
药品
并用
药品
不良反应/事件的结果:治愈□好转□ 有后遗症□ 表现: 死亡□ 直接死因: 死亡时间: 年 月 日
通用名称含剂型监测期内品种用注明用法用量用药起止时间用药原因怀疑药品并用药品不良反应事件的结果
药品不良反应/事件报告表
新的□ 严重□ 一般□医疗卫生机构□ 生产企业□经营企业□个人□ 编码
单位名称:部门:电话:报告日期:年月日
患者姓名:
性别:男□女□源自出生日期:年 月 日民族:
体重(㎏)
联系方式:
家庭药品不良反应/事件:有□无□不详□
省级药品不良反应监测机构:肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□ 签名:
国家药品不良反应监测机构:肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□ 签名:
报告人职业(医疗机构):医生□ 药师□ 护士□ 报告人职务职称(企业): 报告人签名:
药品不良反应报告表(模板)

药品不良反应/ 事件报告表
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显着的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
药品不良反应报告表(模版)

附表1药品不良反应 / 事件报告表(书写模版) 首次报告□跟踪报告□编码:药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1。
如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹得发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或就是“过敏样反应”;不属于过敏反应得其她症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者得临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应得体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后得症状与体征得动态变化。
4、如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应就是监测得白细胞指数以及采取措施停药后患者白细胞有所恢复得指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关得症状; 例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物就是什么。
二、药品不良反应发生后采取得措施及转归1、药品不良反应发生以后,主要采取得治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体得治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗得药物及剂量。
2、药品不良反应得转归,要尽量描述采取对症治疗之后患者得转归。
有得医疗机构在患者刚刚发生不良反应,采取措施尚未缓解得时候就立即上报,这种就是不规范得、国家规定药品不良反应报告得上报时限。
大家应当按照规定时限完整得对药品不良反应进行上报、。
药品不良反应监测报告表格
死亡口直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是口否口不明口未停药或未减量口
再次使用可疑药品后是否再次出现同样反应/事件?是口否口不明口未再使用口
对原患疾病的影响:不明显口病程延长口病情加重口导致后遗症口导致死亡口
附表1
药品不良反应/事件报告表
首次报告口跟踪报告口编码:
报告类型:新的口严重口 一般口报告单位类别:医疗机构口 经营企业口 生个人口 其他口
患者姓名:
性别:男□女口
出生日期:年 月曰
或年龄:
民族:
体重(kg):
联系方式:
原患疾病:
医院名: 病历号/门诊号:
既往药品不良反应/事件:有口无口 不详口
家族药品不良反应/事件:有口无口 不详口
相关重要信息:吸烟史口 饮酒史口 妊娠期口 肝病史口 肾病史口 过敏史口其他口
药 品
批准文号
商品名称
通用名称
(含剂型)
生产厂家
生产批号
用法用量
(次剂量、途径、日次数)
用药起止时间
用药原因
怀 疑 药 品
并 用 药 品
不良反应/事件名称:不良反应/事件发生时间:年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
关联性评价
报告人评价:肯定口很可能口可能口可能无关口待评价口无法评价口签名:
报告单位评价:肯定口很可能口可能口可能无关口待评价口无法评价口签名:
报告人信息
联系电话:职业:医生口药师口护士口其他口
电子邮箱:
签名:
报告单位信息
单位名称:
药品不良反应文献检索申请表

药品不良反应文献检索申请表
编号:
药品名称
通用名称
商品名称
INN
药品类别
国家基本药物□化学药品□生物制品□
中药□国家中药保护品种□中药保健药品□
进口药品□非处方药□
批准文号
上市时间
不良反应
情况
(如空间不够可另附页)
检索目的
交送材料
1.药品生产批件□2.药品质量标准□
3.药品使用说明书□4.处方药品转非处方药申报证明□
申请单位
通讯地址
邮政编码
(单位盖章)
申请时间:年月日
联系人
联系电话
说明:
1.申请单位应按照要求完整、准确地填写表中各项内容;
2.送交申请表时,请附该药品的生产批件、标准和说明书等有关材料;
3.申请单位在递交申请表10个工作日后领取检索报告。
4.联系电话:*************
*.联系人:***
6.Email:*
药品不良反应收集表填表说明

药品不良反应收集表填表说明药品不良反应收集表填表说明重要提示:只有左炔诺孕酮硅胶棒(II)使用者发生的不良反应/事件才应报告给上海达华有限有限公司。
一、报告基本情况1.严重报告:报告中任意一个不良反应符合以下任意一条严重性标准的报告为严重报告:(1)导致死亡;(2)危及生命;(3)导致住院或住院时间延长;(4)导致永久或显著的残疾/功能丧失;(5)先天性异常/出生缺陷;(6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
二、患者信息1.患者姓名:必填项。
尽可能填写患者真实全名。
如无法获得全名,则尽量填写可识别患者的相关信息(如临床试验患者编号、姓名拼音缩写,或患者姓氏,如张先生);如果无法获得患者姓名信息,填写“不详”,如相关法规不允许提供相关信息,填写“隐藏”。
2.性别:必填项,填写男、女或不详。
3.出生日期:必填项。
出生日期填写格式为年/月/日。
4.年龄:必填项。
如患者的出生日期不详,填写不良反应发生时的年龄。
年龄以“岁”为单位。
5.民族:根据实际情况填写。
6.身高:不良反应发生时患者的身高,单位为厘米。
如果不知道准确的身高,请做一个最佳的估计。
7.体重:必填项。
不良反应发生时患者的体重,单位为千克(公斤)。
如果不知道准确的体重,请做一个最佳的估计。
8.联系电话:可联系到患者进行随访的电话,可填写手机号码或固定电话号码,固定电话需要填写区号。
9.医疗机构:请填写患者埋植剂植入的医疗机构名称。
10.病历号/门诊号:根据实际情况填写,如未知,可填写“不详”。
11.既往药品不良反应及药物过敏史:指患者既往发生的和使用某种或几种药物有关的不良反应(如药物性肝损伤)和药物过敏反应。
如有,应具体列出相关药物,不良反应发生时间及表现症状等。
12.相关重要信息:1)吸烟:请尽可能填写日均吸烟支数及吸烟年数。
2)饮酒:请尽可能填写日均饮酒量及饮酒年数。
3)其他过敏史:填写除药物过敏史以外其他过敏史,如食物,花粉等过敏。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药品不良反应检索申请表
药品基本情况
药品名称
药
品
类
别
非处方药□国家基本药物□商品名化学药品□进口药品□英文名生物制品□医保品种□剂型中药□国家中药保护品种□规格批准文号
药品标准上市时间
处方/配方
不良反应/
禁忌
国内外ADR
情况
申请单位单位名称
通讯地址
联系人邮编电话传真
检索信息检索目的
是否加急是□否□
企业签章交送材料
药品说
明书
电子版□药品质
量标准
电子版□
纸质□纸质□
备注1、选定项在小方框内打√。
2、内容填写可使用A4纸附。
