电解法制备高纯铁的电极过程研究
常考题空6 工艺流程中Ksp的相关计算 (附答案解析)-高考化学大题

常考题空6 工艺流程中Ksp 的相关计算溶度积常数反映了难溶电解质在水中的溶解能力,高考试题中溶度积常数的考查常结合化工流程题,在化工流程题中考查溶度积常数是近年高考的热点,化工流程中常常需要控制条件进行离子的分离或除杂,通过溶度积常数计算溶液中金属离子的浓度、离子完全沉淀时的pH 、判断废水排放是否符合标准、沉淀完全转化时所需离子浓度。
常见题型有:一、计算难溶电解质的Ksp 以“Am B n (s)m A n +(aq)+n B m -(aq)”为例:K sp (A m B n )=c m (A n +)·c n (B m -),式中的浓度都是平衡浓度【对点训练1】1.溴酸镉[Cd(BrO 3)2]常用作分析试剂、生产荧光粉等。
以镉铁矿(成分为 CdO 2、Fe 2O 3、FeO 及少量的Al 2O 3 和SiO 2)为原料制备[Cd(BrO 3)2]的工艺流程如下:已知:Cd(SO 4)2 溶于水实际工业生产中,有时还采用阳离子交换树脂法来测定沉镉后溶液中 Cd 2+的含量,其原理:Cd 2++ 2NaR===2Na ++ CdR 2 ,其中NaR 为阳离子交换树脂。
常温下,将沉镉后的溶液(此时溶液 pH =6)经过阳离子交换树脂后,测得溶液中的 Na +比交换前增加了 0.055 2 g·L -1,则该条件下Cd(OH)2 的K sp 值为_________2.从化工厂铬渣中提取硫酸钠的工艺如下:已知:①铬渣含有Na 2SO 4及少量Cr 2O 2-7、Fe 3+②Fe 3+、Cr 3+完全沉淀(c ≤1.0×10-5mol·L -1)时pH 分别为3.6和5Cr(OH)3的溶度积常数K sp [Cr(OH)3]=____________二、计算沉淀转化反应的平衡常数及其完全转化时所需浓度依据沉淀的转化反应和K sp ,计算该反应的平衡常数,K 值越大,转化反应越易进行,转化程度越大如:对于反应Cu 2+(aq)+ZnS(s)CuS(s)+Zn 2+(aq)该反应的平衡常数K =)()(22++Cu c Zn c =)()()()(2222-+-+∙∙S c Cu c S c Zn c =K sp (ZnS )K sp (CuS )【对点训练2】1.某科研课题小组研究利用含H +、Na +、Zn 2+、Mn 2+、Fe 2+、Fe 3+、SO 2-4的工业废电解质溶液,制备高纯的ZnO 、MnO 2、Fe 2O 3,设计实验流程如下:已知常温下,K sp (MnS)=3.0×10-14,K sp (ZnS)=1.5×10-24,在除锌时发生沉淀转化反应为:MnS(s)+Zn 2+(aq)ZnS(s)+Mn 2+(aq),其平衡常数K =____________2.软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O 的流程如下:已知:①部分金属阳离子完全沉淀时的pH如下表金属阳离子Fe3+Al3+Mn2+Mg2+完全沉淀时的pH 3.2 5.210.412.4②温度高于27 ℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
人教版高二化学选修一同步精品课堂4.2.2 电解原理的应用 练习(解析版)

4.2.2 电解原理的应用 练习(解析版)1、海水提镁的最后一步是将氯化镁电解获取金属镁,下列有关该电解过程的叙述中,正确的是( )A 、两个电极必须都用惰性电极B 、阳极可以用金属电极,阴极必须是惰性电极C 、电解熔融状态的氯化镁D 、电解氯化镁的水溶液[正确答案] C[解析]电解MgCl 2获取金属镁,也就是说镁离子需要得电子,如果在水溶液中,水电离的氢离子会优先得电子,因此只能在熔融状态下进行。
在阴极发生的是镁离子得到电子的反应,对电极材料没有要求,在阳极上发生失电子的反应,如果使用活性电极时会优先失电子,所以阳极必须用惰性电极。
2、下列金属只能用电解法冶炼获得的是( )A 、NaB 、CuC 、FeD 、Au[正确答案]A[解析]Cu 、Fe 用热还原法获取,Au 用富集获取;2NaCl(熔融)=====电解2Na +Cl 2↑。
3、某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu,则下列说法正确的是( )A 、电子移动:电极Ⅰ→电极Ⅰ→电极Ⅰ→电极ⅠB 、电极Ⅰ发生还原反应C 、电极Ⅰ逐渐溶解D 、电极Ⅰ的电极反应:Cu -2e -===Cu 2+[正确答案]D[解析]左池为原电池,右池为电解池。
A 项,电子不能通过电解质溶液,即不能实现电极Ⅰ→电极Ⅰ;B 项,电极 Ⅰ 发生氧化反应:Zn -2e -===Zn 2+;C 项,电极Ⅰ:Cu 2++2e -===Cu 。
4、金属镍有广泛的用途,粗镍中含有少量的Fe 、Zn 、Cu 、Pt 等杂质,用电解法制备高纯度的镍,下列叙述中正确的是( )A 、阳极发生还原反应,其电极反应式为:Ni 2++2e -===NiB 、电解过程中,阳极减少的质量与阴极增加的质量相等C 、电解后,溶液中存在的金属阳离子只有Fe 2+和Zn 2+D 、电解后,电解槽底部的阳极泥中只有Cu 和Pt[正确答案]D[解析]本题为“电解精炼铜”的迁移应用,A 项,阳极应发生氧化反应。
高中总复习优化设计 化学 第一轮 考点规范练18 电解池 金属的电化学腐蚀与防护 含答案

考点规范练18电解池金属的电化学腐蚀与防护(时间:45分钟满分:100分)一、选择题(本题共8小题,每小题6分,共48分。
每小题只有一个选项符合题目要求)1.(2020全国Ⅱ)电致变色器件可智能调控太阳光透过率,从而实现节能。
下图是某电致变色器件的示意图。
当通电时,Ag+注入无色WO3薄膜中,生成Ag x WO3,器件呈现蓝色。
对于该变化过程,下列叙述错误的是()。
A.Ag为阳极B.Ag+由银电极向变色层迁移C.W元素的化合价升高WO3+x Ag Ag x WO3答案:C解析:由题意知,银电极为阳极,Ag失电子生成Ag+,Ag+移向阴极与WO3反应生成Ag x WO3,则总反应为WO3+x Ag Ag x WO3,反应过程中W的化合价降低,A、B、D正确,C错误。
2.为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是()。
A.正极的电极反应式为O2+2H2O+4e-4OH-B.将石墨电极改成Mg电极,难以观察到铁锈生成C.若向自来水中加入少量NaCl(s),可较快地看到铁锈O2,前者铁锈出现较快,失电子被氧化成Fe2+,在正极氧气得电子发生还原反应生成OH-,故将氧气吹向石墨,A项正确、D项错误;若将石墨电极换成Mg电极,则负极为Mg,Fe被保护,难以看到铁生锈,B项正确;向自来水中加入NaCl(s),可使电解质溶液的导电能力增强,加快腐蚀速率,C 项正确。
3.普通电解精炼铜的方法所制备的铜中仍含杂质,利用下面的双膜(阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。
下列有关叙述中正确的是()。
A.电极a为粗铜,电极b为精铜B.甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区C.乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区1 mol电子时,可生成32 g精铜,电极a是阴极,为精铜,电极b是阳极,为粗铜,A项错误;甲膜为阴离子,可阻止杂质阳离子进入阴极区,B项错误;乙膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区,C项错误;当电路中通过1mol电子时,可生成0.5mol精铜,其质量为32g,D项正确。
电化学测试技术实验精简版

1、了解电化学交流阻抗的原理 2、学会用阻抗技术检测电化学工作站仪器
(二) 实验原理
电化学阻抗谱方法是一种以小振幅的正弦波电位(或电流)为扰动信号的电化学测量 方法。由于以小振幅的电信号对体系扰动,一方面对体系产生大的影响,另一方面也使得扰 动于体系的响应之间近似呈线性关系,这就似测量结果的数学处理变得简单。同时,电化学 阻抗谱方法又是一种频率域的测量方法, 它以测量得到的频率范围很宽的阻抗谱来研究电极 系统,因而能比其他常规的电化学方法得到更多的动力学信息及电极界面结构的信息。如: 可以从阻抗谱中含有的时间常数个数及其数值大小推算影响电极过程的状态变量的情况; 可 以从阻抗谱观察电极过程中有无传质过程的影响等等。 即使对于简单的电极系统, 也可以从 测得的一个时间常数的阻抗谱中, 在不同的频率范围得到有关从参比电极到工作电极之间的 溶液电阻、电双层电容以及电极反应电阻的信息。 电化学阻抗谱是研究电极过程动力学、电极表面现象和测定固体电解质电导率的重 要手段。阻抗谱图有Nyquist图、导纳图、复数电容图、Bode图和Warburg图等,其中Nyquist 图是以阻抗虚部-Z”对阻抗的实部Z’做的图。 1) 阻抗谱解析 交流阻抗谱的解析一般是通过等效电路来进行的,其中基本的元件包括:纯电阻R, 纯电容C,阻抗值为1/jC,纯电感L,其阻抗值为jL。实际测量中,将某一频率为的微扰 正弦波信号施加到电解池,这是可把双电层看成一个电容,把电极本身、溶液及电极反应所 引起的阻力均视为电阻,则等效电路如图 3所示.相应的阻抗谱方程图式(2)。
0.0005
I (Amps/cm2)
-0.0005
-0.0015 -0.25
0
0.25
0.50
0.75
自编电解锰生产工艺流程

4、电解锰的作用
(4)剥落:剥落就是将金属锰成品与阴极板分离。按照外观 质量分级剥落。
(5)包装:产品剥落完后,取样送检,然后按产品外观质量 分别装桶、称重、包装。
(6)阴极板处理:将剥离后的阴极板放入阳极液中浸泡,溶 去阴极板上的残锰,然后放入洗液(7%HNO3+3%K2Cr2O7)中浸 泡1分钟,取出后用自来水洗净;表面光亮平整的阴极板返回 使用,表面不整洁的阴极板完全晾干后送抛光室进行抛光处 理。
5、电解锰的用途。
①锰是冶炼工业不可缺少的添加剂。电解锰加工成粉状后是生产四 氧化三锰的主要原料,电子工业广泛使用的磁性材料原件就是四氧化 三锰生产的,市场需求量每年增长15%左右。
②近些年,世界铝工业成为电解锰的主要用户,铝锰合金为现代轻 美型建筑材料、装饰工程材料和地下工程防腐和保护材料,铝锰合 金门窗等已进入普通居民住宅,大大地扩大了金属锰的市场。
四、工艺流程
4、 电解工序
电解:合格液槽中的新液经溜槽进入电解槽进行电解作 业,电解时槽温控制在38~42℃,平均阴极电流密度370~ 380A/m2,同极距68mm,阴极锰析出周期24h。电解时加入少 量二氧化硒添加剂以利于电解作业稳定,加入部分氨水以调 节pH值。为带走电解时电流通过在槽中产生的热量以维持正 常的电解温度,在电解槽内设冷却管,通入冷却水进行冷却, 维持电解槽温在正常范围内。电解时,电解液不断加入,阳 极液流入阳极液溜槽自流到浸出工序。 在电解过程中发生了 如下化学反应。
高中化学选择性必修一第4章第2节 电解池 第二课时 电解原理的应用 基础练习

第二课时电解原理的应用同步基础练习题1.工业上电解食盐水的阴极区产物是( )A.氯气B.氢气和氯气C.氢气和氢氧化钠D.氯气和氢氧化钠2.关于镀铜和电解精炼铜,下列说法中正确的是( )A.都用粗铜作阳极、纯铜作阴极B.电解液的成分都保持不变C.阳极反应都只有Cu-2e-=Cu2+D.阴极反应都只有Cu2++2e-=Cu3.(双选)下列描述中,不符合生产实际的是( )A.电解熔融的氧化铝制取金属铝,用铁作阳极B.电解法精炼粗铜,用纯铜作阴极C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极D.在镀件上电镀锌,用锌作阴极4.如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )A.装置中出口①处的物质是氯气,出口②处的物质是氢气B.该离子交换膜只能让阳离子通过,不能让阴离子通过C.装置中发生反应的离子方程式为2Cl-+2H+电解Cl2↑+H2↑D.该装置是将电能转化为化学能5.利用如图所示装置可以在铜牌表面电镀一层银。
下列有关说法正确的是( )A.通电后,Ag+向阳极移动B.银片与电源负极相连C.该电解池的阴极反应可表示为Ag++e-=AgD.当电镀一段时间后,将电源反接,铜牌可恢复如初6.在冶金工业中,钠、镁、铝等金属常用电解法得到,其原因是( )A.都属于轻金属B.都属于活泼金属C.成本低廉D.这些金属的化合物熔点较低7.如图所示,能验证氯化钠溶液(含酚酞)电解产物的装置是( )8.金属镍有广泛的用途,粗镍中含有少量的Fe、Zn、Cu、Pt等杂质,用电解法制备高纯度的镍,下列叙述中正确的是( )A.阳极发生还原反应,其电极反应式为:Ni2++2e-=NiB.电解过程中,阳极减少的质量与阴极增加的质量相等C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+D.电解后,电解槽底部的阳极泥中只有Cu和Pt9.中学阶段介绍的应用电解法制备物质主要有三种:一是铝的工业制备,二是氯碱工业,三是金属钠的制备。
专题03 电能转化为化学能——电解 (考题猜想)(9大题型)(解析版)

专题03 电能转化为化学能——电解题型1电解池及其判断题型2电解规律及其应用【例1】关于如图所示①①两个装置的叙述正确的是()A.装置名称:①是原电池,①是电解池B.硫酸浓度变化:①增大,①减小C.电极反应式:①中阳极:2H2O-4e-===4H++O2↑,①中正极:Zn-2e-===Zn2+D.离子移动方向:①中H+向阴极方向移动,①中H+向负极方向移动【答案】B【解析】①为电解池,电解水,阳极反应式为2H2O-4e-===4H++O2↑,硫酸的浓度增大;①为原电池,溶液中的氢离子移向正极,正极反应式为2H++2e-===H2↑,硫酸的浓度减小。
【变式1-1】下列关于电解池工作原理的说法中,错误的是()A.电解池是一种将电能转化成化学能的装置B.电解池中发生的反应是非自发的氧化还原反应C.电解池工作时,阳极发生氧化反应,阴极发生还原反应D.与原电池不同,电解池放电时,电极本身不会参加电极反应【答案】D【解析】如果阳极是活泼电极,电极本身失去电子,发生氧化反应。
【变式1-2】如图所示是电解CuCl2溶液的装置,其中c、d为石墨电极。
则下列有关判断正确的是()A.a为负极、b为正极B.a为阳极、b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度不变【答案】C【解析】电流从电源的正极流出,因此a为正极,b为负极,则c为阳极,d为阴极。
电解CuCl2溶液的电极反应分别为阳极(c电极):2Cl--2e-===Cl2↑,阴极(d电极):Cu2++2e-===Cu,故C项正确。
【变式1-3】某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在图中,下列有关分析完全正确的是()【答案】B【解析】根据题图知,该装置有外接电源,所以属于电解池,根据电子流向知,c是负极,d是正极,a是阴极,b是阳极,电解时,电解质溶液中阳离子向阴极移动,阴离子向阳极移动,则Q离子是阳离子,P离子是阴离子,故B正确。
第四章 电解和库仑分析法

第四章电解和库仑分析法[教学要求]1.了解电解分析法和库仑分析法的基本原理、基本仪器装置和各种方法的特点及应用。
2.掌握分解电压、析出电位、极化现象和过电位等基本概念。
3 掌握法拉弟电解定律,恒电流库仑滴定。
[教学重点]1.电解分析法与库仑分析法基本原理及定量方法。
2. 电解时离子的析出次序及完全程度的计算过程。
[教学难点]死停终点法。
[教学时数] 7 学时[教学方法] 采用多媒体课件讲授,并结合实验进行辅助教学。
[教学内容]电解分析法:是将被测溶液置于电解装置中进行电解,使被测离子在电极上以金属或其它形式析出,由电解所增加的重量求算出其含量的方法。
这种方法实质上是重量分析法,因而又称为电重量分析法。
另外电解分析用于物质的分离,则叫电解分离法。
库仑分析法:是在电解分析法的基础上发展起来的一种分析方法。
它不是通过称量电解析出物的重量,而是通过测量被测物质在100%电流效率下电解所消耗的电量来进行定量分析的方法。
共同点:分析时不需要基准物质和标准溶液,是一种绝对的分析方法,并且准确度高。
不同点:电重量法只能用来测量高含量物质,而库仑分析法特别适用于微量、痕量成分的测定。
本章讨论的方法遵守Faraday电解定律。
采用大面积电极,即A/V比值大,电解期间尽可能减小或消除浓差极化现象,使溶液中被测物质的浓度发生很大的变化或趋于零。
按实验所控制的参数(E或i)不同,本章的方法可分为控制电位法和控制电流法。
控制电位法是控制电极电位在某一恒定值,使电位有一定差值的几种离子能够分别进行测定,因而选择性较高,但分析时间较长;控制电流法是控制通过电解池的电流,一般为2~5A,电解速度较快,分析时间较短,但选择性较差,需要有适当的指示电解完全或电流效率100%的方法。
第一节电解分析法电解过程电流与电压的关系、分解电压与析出电位、过电压与过电位、电解时离子的析出次序及完全程度。
一、电解分析的基本原理(一) 电解过程中电流和电压的关系当外加电压很小时,有一个逐渐增加的微小电流通过电解池,这个微小电流称为残余电流(主要由电解液中杂质的电解产生)。
电解法制备精细化学品

汇报人:停云 2024-02-04
目录
• 电解法基本原理及设备 • 精细化学品概述及市场需求 • 电解法制备技术进展及应用领域 • 实验操作规范与安全生产要求 • 产品检测方法与质量标准体系建立 • 环境保护、资源循环利用及可持续发展策
略
01
电解法基本原理及设备
电解法定义与分类
应用领域
传统电解法在制备氢气、氧气、氯气等工业气体以及金属 冶炼等领域有广泛应用,但由于能耗高、环境污染等问题 ,其应用受到一定限制。
新型电解法制备技术介绍
01
离子液体电解
离子液体电解是一种新型电解技术,具有高温稳定性、低蒸汽压、可调
酸碱性等优点,可用于高纯度化学品和中间体的制备。
02
隔膜电解
隔膜电解技术通过在阳极和阴极之间引入隔膜,将电解过程分为两个独
01
对实验过程中可能出现的事故类型进行分析和预测,制定相应
的应对措施。
制定应急处理流程
02
明确事故发生后的应急处理流程,包括事故报告、现场处置、
伤员救治、事故调查等环节。
配备应急设备和器材
03
根据实验需要,配备相应的应急设备和器材,如灭火器、急救
箱、泄漏应急处理工具等。
05
产品检测方法与质量标准体系建立
对电解过程中产生的余热、余压 等能源进行回收利用,提高能源 利用效率。
水资源循环利用
采用闭路循环水系统,减少新鲜 水用量和废水排放量,实现水资 源的循环利用。
可持续发展策略探讨
绿色化学理念
在电解法制备精细化学品过程中引入绿色化 学理念,采用低毒、低害、低污染的原料和 工艺。
清洁生产技术
推广清洁生产技术,减少电解过程中的污染物排放 ,提高产品质量和降低能耗。
新教材2020-2021学年人教版化学选择性必修第一册学案:4.2第2课时电解原理的应用

第2课时电解原理的应用学习目标核心素养1.了解电解原理在工业生产中的应用。
2.认识电解在实现物质转化和储存能量中的具体应用。
1.通过对氯碱工业、电镀、电解精炼铜、电冶金等原理的分析,培养变化观念与平衡思想。
2.建立电解应用问题的分析思维模型,培养证据推理与模型认知的能力。
新课情境呈现电镀的妙用电镀在工业上的应用已经遍及国民经济各个生产领域中,如机械制造、无线电通讯、交通运输及轻工业系统,这些工业系统中使用金属镀层的目的是多种多样的。
其中应用最多的是为了防止金属制品及其组合件的腐蚀。
例如,一辆解放牌载重汽车上,零部件的受镀面积可达10 m2左右,其主要目的是防止金属锈蚀。
一些产品使用金属镀层则具有防护和装饰的双重目的,像自行车、钟表等。
在一些特殊情况下,电镀金属层则是为了赋予制品一定的物理、机械性能,如增加金属表面反光能力、提高表面导电能力、增加抗磨损能力、提高金属的热稳定性等。
让我们走进教材,一起学习电解原理的应用。
课前素能奠基新知预习一、氯碱工业1.概念:用电解__饱和氯化钠溶液__的方法来制取__氢氧化钠、氢气和氯气__,并以它们为原料生产一系列化工产品的工业,称为氯碱工业。
2.原理:(1)阳极反应:__2Cl--2e-===Cl2↑__(__氧化__反应)(2)阴极反应:__2H2O+2e-===H2↑+2OH-__(__还原__反应)(3)总反应:①化学方程式:__2NaCl +2H 2O=====电解2NaOH +H 2↑+Cl 2↑__ ②离子方程式:__2Cl -+2H 2O=====电解2OH -+H 2↑+Cl 2↑__ 二、电镀1.概念:应用__电解__原理在某些金属表面镀上一薄层其他__金属__或合金的加工工艺。
2.目的:使金属增强__抗腐蚀__能力,增加美观度和表面硬度。
3.实例(在铁件上镀铜)。
材料 电极反应式 阴极 __Fe__ Cu 2++2e -===Cu 阳极 __Cu__Cu -2e -===Cu 2+电解质溶液__CuSO 4__溶液1.概念:粗铜中往往含有铁、锌、银、金等多种杂质,常用电解的方法进行精炼。
电解精炼
(2004广东11)PH=a的某电解质溶液中,插
入两支惰性电极通直流电一段时间后,溶液的
pH>a,则该电解质可能是
A.NaOH C.AgNO3
B.H2SO4 D.Na2SO4
500mlKNO3和Cu(NO3)2的混合溶液中c(NO3-) =6.0mol/L,用石墨电极电解此溶液,当通电一
段时间后,两极均收到22.4L气体(标况),假
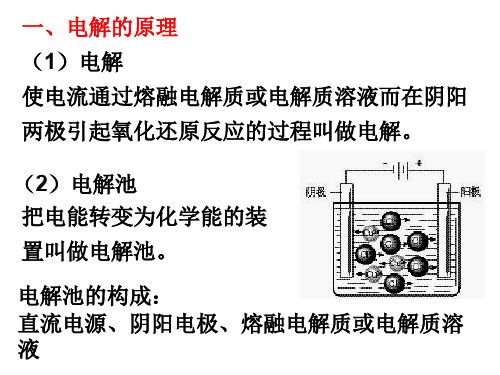
一、电解的原理 (1)电解 使电流通过熔融电解质或电解质溶液而在阴阳 两极引起氧化还原反应的过程叫做电解。
(2)电解池 把电能转变为化学能的装 置叫做电解池。
电解池的构成: 直流电源、阴阳电极、熔融电解质或电解质溶 液
(3)电解池的电极和电极反应
阳极:与电源正极相连接的电极。物质在该电
极上失去电子发生氧化反应。
阴极:与电源负极相连接的电极。物质在该电
电
极上得到电子发生还原反应。
极
惰性电极:石墨、Pt、Au、Ti等作电极叫惰性
电极
活泼电极:除石墨、Pt、Au 、Ti等以外的其
他材料作电极叫活泼电极
惰性电极作阳极时,电解质或电解质溶液中的 离子在阳极发生氧化反应,活泼电极作阳极时, 则为电极材料本身被氧化。
用石墨电极电解熔融的NaCl:
(4)离子的放电顺序 ①阳极若是活泼电极时,金属在阳极失电子被氧 化成阳离子进入溶液,阴离子不容易在电极上放 电。若是惰性电极,溶液中阴离子放电顺序是: S2->I->Br->Cl->OH->含氧酸根离子>F-。 ②阴极无论是什么电极,电极本身都不参与电极 反应,阳离子在阴极上放电顺序是:Ag+>Hg2+ >Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+> Al3+>Mg2+>Na+>Ca2+>K+。
新教材高中化学第四章化学反应与电能第二节电解池第2课时电解原理的应用课后习题新人教版选择性必修1

第2课时电解原理的应用基础巩固1.在给定条件下,下列选项所示的物质间转化,均能通过一步化学反应实现的是( )。
A.NaCl Cl2漂白粉B.Cu2(OH)2CO3CuO Cu(OH)2C.MgCO3MgCl2溶液MgD.Fe3O4Fe FeCl3答案:A解析:2NaCl+2H2O2NaOH+H2↑+Cl2↑,2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O,A项正确。
CuO与H2O不能直接化合生成Cu(OH)2,B项错误。
电解MgCl2溶液时,阴极得不到Mg单质,C 项错误。
Fe与HCl反应生成FeCl2,D项错误。
2.用电解法制取KIO3的方法是以石墨和铁为电极电解KI溶液,电解反应方程式为KI+3H2O KIO3+3H2↑。
下列说法中正确的是( )。
A.电解时石墨作阴极B.电解时阳极上产生H2C.电解过程中阴极溶液pH升高D.阴极电极反应式:I6e+3H2O I+6H+答案:C解析:电解时,铁作阴极,石墨作阳极,若铁作阳极,则铁放电,A项错误;阳极发生氧化反应,I 失电子被氧化,电极反应为I6e+3H2O I+6H+,B、D两项错误;阴极上水放电,2H2O+2e H2↑+2OH,阴极溶液的pH升高,C项正确。
3.欲在铁制品上镀上一定厚度的锌层,以下设计方案正确的是( )。
A.锌作阳极,铁制品作阴极,ZnSO4溶液作电镀液B.锌作阴极,铁制品作阳极,ZnCl2溶液作电镀液C.锌作阳极,铁制品作阴极,FeSO4溶液作电镀液D.锌作阴极,铁制品作阳极,Fe(NO3)2溶液作电镀液答案:A解析:根据电镀的一般原理,镀件(铁制品)作阴极,镀层金属(锌)作阳极,含锌离子的溶液作电镀液。
只有A项符合。
4.将烧碱吸收H2S后的溶液加入如图所示的电解池的阳极区进行电解,以实现H2S转化为S的目的。
下列判断错误的是( )。
A.电解过程中阳极区发生如下反应:S22e S↓,(n1)S+S2B.电解时阴极的电极反应式:2H2O+2e H2↑+2OHC.该装置的离子交换膜为阳离子交换膜D.电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成+2H+n S↓+H2↑答案:D解析:电解过程中阳极区发生氧化反应,得到硫单质,然后是硫单质和硫离子之间的反应,即S22e S↓,(n1)S+S2,A项正确。
电解的原理

电解的原理1.电解和电解池(1)电解:在电流作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。
(2)电解池:电能转化为化学能的装置。
(3)电解池的构成①有与电源相连的两个电极。
②电解质溶液(或熔融电解质)。
③形成闭合回路。
2.电解池的工作原理(1)电极名称及电极反应式(电解CuCl 2溶液为例)总反应式:CuCl 2=====电解Cu +Cl 2↑ (2)电子和离子的移动方向①电子:从电源负极流出后,流向电解池阴极;从电解池的阳极流出后流向电源的正极。
②离子:阳离子移向电解池的阴极,阴离子移向电解池的阳极。
3.阴阳两极上放电顺序(1)阴极:(与电极材料无关)。
氧化性强的先放电,放电顺序:(2)阳极:若是活性电极作阳极,则活性电极首先失电子,发生氧化反应。
若是惰性电极作阳极,放电顺序为注意 ①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。
②最常用、最重要的放电顺序为阳极:Cl ->OH -;阴极:Ag +>Cu 2+>H +。
③电解水溶液时,K +~Al 3+不可能在阴极放电,即不可能用电解水溶液的方法得到K 、Ca 、Na 、Mg 、Al 等金属。
4.用惰性电极电解电解质溶液的规律答案 4H ++4e -===2H 2↑ 4OH --4e -===2H 2O +O 2↑ 减小 增大 不变 水 2Cl --2e -===Cl 2↑ 增大 HCl CuCl 2 H 2(或H 2、NaOH) Cl 2 增大 HCl Ag ++e -===Ag O 2 减小 Ag 2O(1)电解质溶液的导电过程就是电解质溶液被电解的过程(√) (2)某些不能自发进行的氧化还原反应,通过电解可以实现(√) (3)直流电源跟电解池连接后,电子从电源负极流向电解池阳极(×) (4)电解稀硫酸制H 2、O 2时,可用不活泼的铜作阳极(×)(5)电解CuCl 2溶液,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝色(×) (6)电解盐酸、硫酸等溶液,H +放电,溶液的pH 均增大(×)1.根据金属活动性顺序表,Cu 和稀H 2SO 4不反应,怎样根据电化学的原理实现Cu 和稀H 2SO 4反应产生H 2?答案 Cu 作阳极,C 作阴极,稀H 2SO 4作电解质溶液,通入直流电就可以实现该反应。
高纯度金属的制备与应用

高纯度金属的制备与应用金属是重要的工业原材料,被广泛应用于制造汽车、航空航天、电子产品等领域。
而高纯度金属则是一种特殊的金属材料,具有极高的纯度和良好的物理性能,被广泛应用于半导体、光电子、核工程等领域。
本文将介绍高纯度金属的制备方法和应用领域。
一、高纯度金属的制备方法金属从矿石中提取出来后,通常需要经过多次的冶炼和精炼才能得到高纯度金属。
高纯度金属的制备方法因金属种类和用途不同而有所区别。
下面介绍一些常用的高纯度金属制备方法。
1. 熔融电解法熔融电解法是一种常用的制备高纯度金属的方法。
该方法将金属熔融后,通过电解的方式将杂质分离出来。
该方法可用于制备钨、铜、铁等金属。
2. 气相沉积法气相沉积法是一种制备高纯度金属薄膜的方法。
该方法将金属材料加热到高温后,通过气体扩散或反应沉积在基材上。
该方法可用于制备铝、锡、镍等金属薄膜。
3. 水热法水热法是一种制备高纯度氧化物金属的方法。
该方法将金属盐在水热条件下加热反应,形成高纯度氧化物金属颗粒。
该方法可用于制备氧化铝、氧化镁等金属氧化物。
二、高纯度金属的应用领域1. 半导体领域高纯度金属是半导体工业中不可或缺的材料。
在芯片制造过程中,高纯度金属可以用于制造线路、电极和金属导线等。
例如,高纯度铝可用于制造抗电子束辐射掩膜,高纯度硅可用于制造晶体管和太阳能电池。
2. 光电子领域高纯度金属在光电子领域中也有广泛的应用。
例如,高纯度金属可用于制造光纤、激光器、光电二极管、光伏电池等。
其中,高纯度银可用于制造反射镜和导电膜,高纯度锗可用于制造红外探测器和光谱仪。
3. 核工程领域高纯度金属在核工程领域中也有重要的应用。
例如,高纯度铀可用于制造核燃料,高纯度锆可用于制造核反应堆包层材料。
此外,高纯度金属还可用于制造防护装置和辐射探测器等。
三、总结高纯度金属的制备和应用领域涉及多个学科和领域,包括化学、物理、半导体、光电子、核工程等。
随着科技的进步和工业技术的不断发展,高纯度金属的应用领域将不断扩大,成为推动各个领域发展的重要材料。
电解工艺流程

电解工艺流程
《电解工艺流程》
电解工艺是一种通过电流将金属离子转化为金属原子的生产过程。
它通常用于提取金属、精炼金属或制造金属产品。
电解工艺流程可以分为几个基本步骤。
首先,需要准备电解液。
电解液是一种含有溶解的金属离子的液体。
在电解过程中,金属离子将被还原成金属原子,并在阳极两侧析出。
然后,需要准备阳极和阴极。
阳极是一个带有金属离子的金属材料,通常是用于产生金属的原材料。
阴极是一个带有电子的材料,当电解液中的离子接触到它时,它们会接受电子并转化为金属原子。
接下来是电解过程。
在电解过程中,电流通过电解液并在阳极和阴极之间流动。
这导致金属离子在阳极处失去电子,并在阴极处获得电子,从而被还原。
最后,通过调节电流和电解时间,可以控制金属的析出量和纯度。
一旦电解完成,金属可以被收集并进一步加工成所需的形式。
电解工艺流程是一种高效、可控制的生产方法,已被广泛应用于金属工业和化工行业。
通过不断改进工艺流程和技术,电解
工艺已成为一种环保、节能的生产方式,为我们的现代工业生产提供了重要的支持。
化学解答题练习(五)解析版-2021年高考化学解答题专练(元素化合物与工艺流程)
化学解答题练习(五)解析版1.新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)作电极材料。
对LiFePO4废旧电极(含杂质A1、石墨粉)回收并获得高纯Li2CO3的工业流程图:资料:碳酸锂在水中溶解度:(1)“过程i”除研磨粉碎外,请再写出一种可以提高过程ii溶解速率的措施:____。
(2)“过程ii”加入足量NaOH 溶液的离子反应方程式是________。
(3)“过程iii ”采用不同氧化剂分别进行实验,均采用Li含量为3.7% 的原料,控制pH 为3.5,浸取1.5h后,实验结果如表所示:①实验2中,NaC1O3与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为_______。
②“过程iii”得到的浸出液循环两次的目的是________ 。
(4)浸出液中存在大量H2PO4-和HPO24-,已知:H2PO4-⇌HPO24-+H+,HPO24-⇌PO34-+H+,结合平衡移动....原理,解释“过程iv”得到磷酸铁晶体的原因:___。
(5)“过程v”中,若“沉锂”中c(Li + )=1.0mo1·L -1,加入等体积饱和 Na 2CO 3溶液(浓度约为1.78mo1/L),此时实验所得沉锂率为___ (已知Li 2CO 3的K sp 为9.0×10-4)。
(6)简述“过程vi”的操作:_________________。
【答案】(1)升高温度或适当提高 NaOH 溶液浓度 (2) 2Al+2OH -+2H 2O=2AlO 2-+3H 2↑ (3)ClO -+5Cl -+6H + =3Cl 2↑+3H 2O 提高浸出液中Li +浓度(或提高氧化剂和酸的利用率或节约后续纯碱的用量) (4) CO 23-结合H +,c(H +)减小,H 2PO 4-⇌HPO 24-+H +,(5)HPO 24-⇌PO 34-+H +,两电离平衡均向右移动,c(PO 34- )增大,与Fe 3+结合形成磷酸铁晶体 (5)96.25% (6)用热水洗涤,干燥【解析】(1)“过程i”中适当加热、搅拌及增大NaOH 溶液的浓度均可提高溶解速率; (2)“过程ii”加入足量NaOH 溶液,铝与氢氧化钠反应,离子反应方程式是2Al+2OH -+2H 2O=2AlO 2-+3H 2↑;(3)①NaC1O 3与盐酸反应归中反应生成黄绿色气体,离子方程式为ClO -+5Cl -+6H + =3Cl 2↑+3H 2O ;②“过程iii”得到的浸出液循环两次可提高锂的浸出率,提高酸及氧化剂的使用率,节约成本;(4)向浸出液中加入碳酸钠,碳酸根离子可结合磷酸二氢根离子或磷酸一氢根离子电离出的氢离子,导致磷酸二氢根离子或磷酸一氢根离子电离平衡正向移动,溶液中磷酸根离子浓度增大,则与铁离子结合生成磷酸铁晶体;(5)“过程v”中,发生2Li ++23CO -= Li 2CO 3,溶液中剩余c(23CO -)=1.78mol /L 0.5mol /L 2-=0.64mol/L ,K sp (Li 2CO 3)=c 2(Li +)×c(23CO -),c 2(Li +)=49.0100.64mol /L-⨯,c(Li +)=3.75×10-2mol/L ,沉锂率=(1.0mol/L -3.75×10-2mol/L)÷1.0mol/L×100%=96.25%;(6)根据碳酸锂在水中溶解度,温度越高溶解度越小,则用热水洗涤,干燥即可。
电解法制备高纯铁的电极过程研究

电解法制备咼纯铁的电极过程研究电解法制备高纯铁的电极过程研究电化学机理硏究采用二电极体系,如图娴辰齒I比为电源.m \为电流花i为电压從电源R、电7/LmA和乜丿」衣E都是电化学工作站的部分+由电化学工件站控轨图中:个电换分別为工作电扱•辅助电极和参比电极瓦中.匸作电极和辅助电极Z问冇电減迪过.用电记录通过工作电极的电流:H作电扱和参比电极之间没有电流通过,用电压表E记录工作电极棺購于参比电极的电位.侵电极电旳隔时间线株变化.从鈕扌T电位扫至某一电位・然后丈从这一电<4反杓回起皓电位,测址电流崎电位I咸时间1的曲线“即循环伏安曲线・加下图所歩.1-^ 3.2站坏狀-安由践图从图3.2屮町以得到乞种电化学参数,如阳极的叫电流咯、阳极的蜂电位E“、阳极半峰电位Epg以及阴极的蜂电流Lc、阴极的峰电位氐、阴极半峰电位Epc:等。
根据循环伏安曲线的特征.可以刈断研究电极反应的训逆件、反应产枷的稳定性以及电极反应的机理.对『•产物心阴极I:析出的反应,有"IF判断依据.a可逆反应$(1)邮电位Ep与切描速度v无关;(2)那电流ip与打描速度的平方根的比值与扫描速度v无关。
b不叮逆反冈:(1)婷电位Ep随舸描速度v的变化而变化:(2)峰电流ip与知描速度的平方根v" 的比值与扫描速侵v无关:(3)在阴杈波范曲不出现阳极波:(4 ) u问為C准可逆反应:(l)E p随扫描速率v的变化而变化,相比于不可逆反应,这种移动程度狡小;⑵ ip/戶实际与v无关;(3) 仅在a=0.5时为1。
线性扌T描伏安法与循环伏安法蚕似,只是没有反扌I描的过程.使电极电位禰时间线性变化•测帚电流与电位(或时间)的曲线,即线性扫描伏安曲线.线性扫描伏安法一般采用慢扫描法,得到不同汛度的阳极或者阴极伯极化曲线,根据极化曲线的分析,可以得到同过电位卜•反应的活化能,从而可以刈断化学反应的控制步骤,3・2实验原料、试剂与设备本实验所用的原料是分析纯七水合硫酸亚铁试剂,分子ft足278.01,含量不少于990%.本丈验所用的水均为白制的二次去离子水.实輪试剂与材料如下表3」所示, 实验设备如下衣3.2所示.*3」实怡材料丈脸材料4曲位铜电极北京仔色令属研尤总険切电械机州界奥斯也匕学实验器材自国公词饱和片汞也械杭州赛舆斯吐化学尖验器材有限公词二电极电池体系杭州赛奧師电化即丈掘器材百柬公祠盐載(HC1)北京化「•厂乙簡(CjHyOH)北京化1J •鋭气(Ar)北京化T•厂附注1):以上化学试剂均为分析純农]・实验册用攻备2实验设条生产单位电化学丄件站CHI660C上淄嚴华仪器公司恒阳仪R/K浴開1•洵树立仪能仪农杠限公刚电了天平BS-224S it ;加多利斯仪/系统行限公司33实验方法实驰采用三电极电池体系,以铜电极为硏尢电极,肖•從为0.8mm-人面枳的柏片为辅助电极,饱和甘汞电极为参比电极。
