第四章气体吸收练习
化工原理(少学时)思考题答案

因为容器内壁给了流体向下的力,使内部压强大于外部压强。 问题 5. 图示两密闭容器内盛有同种液体,各接一 U 形压差计,读数分别为 R1、R2,两压差计间 用一橡皮管相连接,现将容器 A 连同 U 形压差计一起向下移动一段距离,试问读数 R1 与 R2有何 变化?(说明理由)
答 5.容器 A 的液体势能下降,使它与容器 B 的液体势能差减小,从而 R2 减小。R1 不变,因 为该 U 形管两边同时降低,势能差不变。 问题 6. 伯努利方程的应用条件有哪些?
问题 13. 图示的管路系统中,原 1, 2 ,3 阀全部全开,现关小 1 阀开度,则总流量 V 和各支管
流量 V1, V2, V3 将如何变化? 答 13.qV、qV1 下降,qV2、qV3 上升。 问题 14. 什么是液体输送机械的压头或扬程?
答 14.流体输送机械向单位重量流体所提供的能量(J/N)。
答 24.通风机施给每立方米气体的能量称为全压,其中动能部分称为动风压。离心泵 的丫头单位是 J/N(米液柱),全风压的单位是为 N/m2,两者单位不同,若按ΔP=ρgh表 示,可知高度h与密度ρ无关时,压差ΔP 与密度ρ成正比。
第二章 传热
问题 1. 传热过程有哪三种基本方式? 答 1.直接接触式、间壁式、蓄热式。 问题 2. 传热按机理分为哪几种? 答 2.传导、对流、热辐射。 问题 3. 物体的导热系数与哪些主要因素有关? 答 3.与物质聚集状态、温度有关。
化工原理(少学时)思考题答案
第一章 流体流动与输送机械
问题 1. 什么是连续性假定? 质点的含义是什么? 有什么条件? 答 1.假定流体是由大量质点组成的、彼此间没有间隙、完全充满所占空间的连续介质。
质点是含有大量分子的流体微团,其尺寸远小于设备尺寸,但比起分子自由程却要大得 多。 问题 2 粘性的物理本质是什么? 为什么温度上升, 气体粘度上升, 而液体粘度下降? 答 2.分子间的引力和分子的热运动。
第四章综合练习浙教版八年级下册科学

八下第四章一、选择题1.下列有关生产实践的说法,错误的是()A.带土移植减少根部损伤提高成活率B.合理密植充分利用太阳光C.移栽剪枝降低蒸腾作用减少水分散失D.树怕扒皮导管受损减弱无机盐的运输2.学校花园内今年新移栽了两株银杏树。
在移栽过程中,园林工人截去了银杏树的大部分枝叶,根部保留着大的土坨,栽好后还在其茎上进行了挂瓶输液,这些做法的主要目的是()①促进蒸腾作用②阻止光合作用③减弱蒸腾作用④减少对根毛的损害⑤补充水分和无机盐⑥补充有机营养A.③⑤⑧B.①④⑤C.②③④D.③④⑤3.气孔是氧气、二氧化碳出入及水分散失的门户,当保卫细胞含水量多时气孔大(如图甲),含水量少时气孔小甚至关闭(如图乙)。
下列叙述中正确的是()A.将叶片浸入浓盐水中,气孔将如图甲所示B.保卫细胞的形状能改变是因为没有细胞壁C.植物体蒸腾作用强弱与保卫细胞的含水量有关D.植物体光合作用强弱与保卫细胞的含水量无关4.下列植物有攀援茎的是()A.牵牛花B.草莓C.松树D.葡萄5.叶是植物重要的营养器官,如图为叶的结构示意图。
下列叙述中与实际相符的是()A.图中③为气体进出的门户B.植物可以通过③吸收水分和无机盐C.植物的上表皮细胞③中分布大量的叶绿体D.植物的光合作用主要发生在③中的叶绿体中6.下列关于根毛的叙述中,不正确的是()A.根毛是由根毛区的表皮细胞向外突起形成的B.根毛是唯一具有吸收水分和无机盐功能的结构C.根毛细胞液的溶质质量分数较大,正常情况下能够吸水D.根毛大大增加了表皮细胞的吸收面积7.如图为豌豆的叶表皮气孔两种状态图,下列有关叙述错误的是()A.夜幕降临时,叶片中大多数气孔呈③状态B.气孔处于③状态时,叶肉细胞的呼吸作用会停止C.气孔处于③状态时,叶肉细胞的光合作用会减弱或停止D.气孔③→③状态的转变会减慢无机盐运输的速度8.为探究“大棚中二氧化碳含量变化”,某兴趣小组制作了如图甲所示装置:用干燥、透明的密闭容器模拟大棚,其内放有一株吊兰,用传感器测定容器中二氧化碳含量。
第四章 习题答案

第四章的习题及答案4-1 设有一台锅炉,水流入锅炉是之焓为62.7kJ ·kg -1,蒸汽流出时的焓为2717 kJ ·kg -1,锅炉的效率为70%,每千克煤可发生29260kJ 的热量,锅炉蒸发量为4.5t ·h -1,试计算每小时的煤消耗量。
解:锅炉中的水处于稳态流动过程,可由稳态流动体系能量衡算方程:Q W Z g u H s +=∆+∆+∆221体系与环境间没有功的交换:0=s W ,并忽 动能和位能的变化, 所以: Q H =∆设需要煤mkg ,则有:%7029260)7.622717(105.43⨯=-⨯m解得:kg m 2.583=4-2 一发明者称他设计了一台热机,热机消耗热值为42000kJ ·kg -1的油料0.5kg ·min -1,其产生的输出功率为170kW ,规定这热机的高温与低温分别为670K 与330K ,试判断此设计是否合理?解:可逆热机效率最大,可逆热机效率:507.06703301112max =-=-=T T η 热机吸收的热量:1m in210005.042000-⋅=⨯=kJ Q热机所做功为:1m in 102000m in)/(60)/(170-⋅-=⨯-=kJ s s kJ W该热机效率为:486.02100010200==-=Q W η 该热机效率小于可逆热机效率,所以有一定合理性。
4-3 1 kg 的水在1×105 Pa 的恒压下可逆加热到沸点,并在沸点下完全蒸发。
试问加给水的热量有多少可能转变为功?环境温度为293 K 。
解:查水蒸气表可得始态1对应的焓和熵为:H 1=83.93kJ/kg, S 1=0.2962kJ/kg.K 末态2对应的焓和熵为:H 2=2675.9kJ/kg, S 2=7.3609kJ/kg.K)/(0.259293.839.267512kg kJ H H Q =-=-=)/(0.522)2962.03609.7(15.2930.25920kg kJ S T H W sys id =-⨯-=∆-∆=4-4如果上题中所需热量来自温度为533 K 的炉子,此加热过程的总熵变为多少?由于过程的不可逆性损失了多少功? 解:此时系统的熵变不变)./(0647.7K kg kJ S sys =∆炉子的熵变为)./(86.45330.2592K kg kJ T H T Q S sur -=-=∆-==∆ )./(205.286.40647.7K kg kJ S t =-=∆ )/(0.646205.215.2930kg kJ S T W t l =⨯=∆=4-5 1mol 理想气体,400K 下在气缸内进行恒温不可逆压缩,由0.1013MPa 压缩到1.013MPa 。
分离工程 第四章 气体吸收

ln
V
f2 x2
ln
H2
V
V m,2 ( p RT
p10 )
对于理想溶液,V
V m,2
0
V
则 f 2 H2 x2
V
在低压下,用平衡分压p2代替 f 2 ,变成亨
利定律的表达形式
p2
H
' 2
x2
若以浓度c2代替x2,则有 p2 H 2c2
• 亨利定律仅适用于理想溶液;
• 对于难溶气体,亨利定律有足够的正确性;
吸 收
• 1、吸收、解吸作用发生的条件
和
解 吸
吸收:溶质由气相溶于液相
过
程 简 捷
pi pi*
yi
y
* i
计 算
解吸:溶质由液相转入气相
pi
p
* i
yi
y
* i
2、吸收过程的限度
(Limitation of Absorption process)
4.3 多 组 分
• 塔釜: yi,N 1 Ki xi,N
分 • 每个级上由于组成改变而引起的温度变化,
析
可用泡露点方程定出
• 吸收要采用热量衡算来确定温度的分布
吸收和精馏的比较
4.1 多 组
• 吸收是根据各组分溶解度不同进行分 离的
分
吸 • 精馏利用组分间相对挥发度不同使组
收 和
分分离
解
吸
过 程
• 精馏有简单塔和复杂塔
分 析
• 最简单的吸收为复杂塔
4.1 多
⑷按吸收量的多少
组 分
①贫气吸收
吸 收
• 吸收量不大
和 解
• 恒摩尔流
大学物理课后答案第四章

第四章 气体动理论一、基本要求1.理解平衡态的概念。
2.了解气体分子热运动图像和理想气体分子的微观模型,能从宏观和统计意义上理解压强、温度、内能等概念。
3.初步掌握气体动理论的研究方法,了解系统的宏观性质是微观运动的统计表现。
4.理解麦克斯韦速率分布律、速率分布函数和速率分布曲线的物理意义,理解气体分子运动的最概然速率、平均速率、方均根速率的意义,了解玻尔兹曼能量分布律。
5.理解能量按自由度均分定理及内能的概念,会用能量均分定理计算理想气体的内能。
6.了解气体分子平均碰撞频率及平均自由程的意义及其简单的计算。
二、基本内容1. 平衡态在不受外界影响的条件下,一个系统的宏观性质不随时间改变的状态。
2. 理想气体状态方程在平衡态下,理想气体各参量之间满足关系式pV vRT =或 n k T p =式中v 为气体摩尔数,R 为摩尔气体常量 118.31R J mol K --=⋅⋅,k 为玻尔兹曼常量 2311.3810k J K --=⨯⋅3. 理想气体压强的微观公式21233t p nm n ε==v4. 温度及其微观统计意义温度是决定一个系统能否与其它系统处于热平衡的宏观性质,在微观统计上32t kT ε=5. 能量均分定理在平衡态下,分子热运动的每个自由度的平均动能都相等,且等于2kT 。
以i 表示分子热运动的总自由度,则一个分子的总平均动能为2t i kT ε=6. 速率分布函数()dNf Nd =v v麦克斯韦速率分布函数232/22()4()2m kT m f e kTππ-=v v v7. 三种速率最概然速率p =≈v 平均速率==≈v 方均根速率==≈8. 玻尔兹曼分布律平衡态下某状态区间(粒子能量为ε)的粒子数正比于kT e /ε-。
重力场中粒子数密度按高度的分布(温度均匀):kT m gh e n n /0-=9. 范德瓦尔斯方程采用相互作用的刚性球分子模型,对于1mol 气体RT b V V ap m m=-+))((2 10. 气体分子的平均自由程λ==11. 输运过程 内摩擦dS dz du df z 0)(η-=, 1133mn ηλρλ==v v 热传导dSdt dz dT dQ z 0)(κ-= 13v c κρλ=v 扩散dSdt dz d D dM z 0)(ρ-= 13D λ=v三、习题选解4-1 一根铜棒的两端分别与冰水混合物和沸水接触,经过足够长的时间后,系统也可以达到一个宏观性质不随时间变化的状态。
初中人教版七年级生物上册第四章绿色植物是生物圈中有机物的制造者作业测试习题(含答案解析) (38)
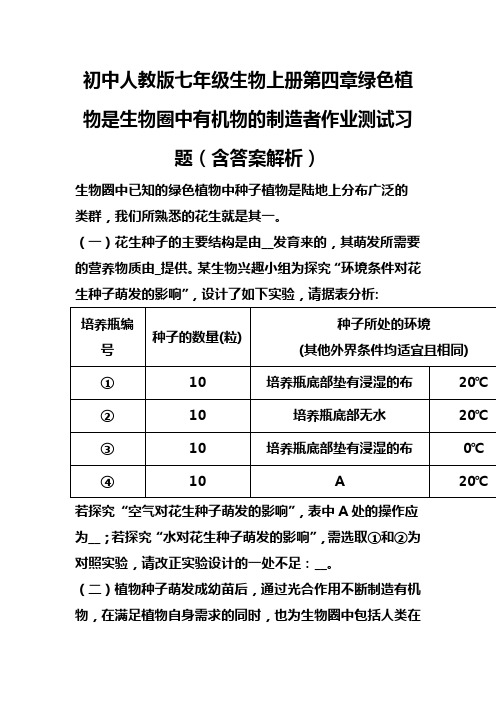
初中人教版七年级生物上册第四章绿色植物是生物圈中有机物的制造者作业测试习题(含答案解析)生物圈中已知的绿色植物中种子植物是陆地上分布广泛的类群,我们所熟悉的花生就是其一。
(一)花生种子的主要结构是由__发育来的,其萌发所需要的营养物质由_提供。
某生物兴趣小组为探究“环境条件对花生种子萌发的影响”,设计了如下实验,请据表分析:若探究“空气对花生种子萌发的影响”,表中A处的操作应为__;若探究“水对花生种子萌发的影响”,需选取①和②为对照实验,请改正实验设计的一处不足:__。
(二)植物种子萌发成幼苗后,通过光合作用不断制造有机物,在满足植物自身需求的同时,也为生物圈中包括人类在内的其他生物提供了基本的食物来源。
(1)图甲是花生叶片的结构示意图,与①细胞相比,②细胞在结构上的不同点是:有_。
图乙是在封闭的环境中,花生幼苗一昼夜二氧化碳的吸收和释放的相对含量图。
d点产生的原因与图甲中结构④部分的关闭有关,这一变化主要是为了__。
一天内花生幼苗有机物积累最少和最多的点分别是图乙中的_(填字母)。
(2)为了进一步探究花生的生理活动,兴趣小组设计了图丙所示的实验装置。
实验过程如下:①首先关闭阀门,在黑暗处放置一段时间后,玻璃管中的红色小液滴会向__移动。
②将此装置在黑暗处放置一昼夜后,移到阳光下,打开阀门并移走氢氧化钠溶液。
一段时间后取下叶片甲,除去叶绿素后滴加碘液,观察到的实验现象及结论是__。
【答案】受精卵子叶培养瓶底部的水将种子完全浸没培养瓶底部垫有无水的布叶绿体降低植物的蒸腾作用(或减少植物体内水分的散失) b、f 左叶片变蓝,说明绿叶在光下制造淀粉(或有机物)【分析】花生属于双子叶植物,花生种子的基本结构包括种皮和胚两部分,胚是种子的主要部分,是幼小的生命体,它能发育成新的植物体。
胚由胚轴、胚芽、胚根、子叶四部分组成,营养物质贮存在子叶里。
图甲中,①是表皮细胞,②是叶肉细胞,③是叶脉,④是气孔。
【详解】(一)种子一般包括种皮(有保护作用)和胚(包括胚根、胚芽、胚轴、子叶)。
环境工程原理-环境工程原理课后思考题解答4吸收

第四章 吸 收1、什么是分子扩散和涡流扩散?答:分子扩散是凭籍流体分子无规则热运动而传递物质的。
发生在静止或滞流流体里的扩散就是分子扩散。
在流动的流体中不仅有分子扩散,而且流体宏观流动也将导致物质的传递。
涡流扩散是凭籍流体质点的湍动和漩涡传递物质的。
2、简述菲克定律的物理意义和适用条件。
菲克定律是对物质分子扩散现象基本规律的描述,表示物质A 在介质B 中发生分子扩散时,任一点处物质A 的分子扩散速率J A 与该位置上组分A 的浓度梯度成正比。
3、简述温度、压力对气体和液体分子扩散速率的影响。
答:由于分子扩散速率与分子扩散系数相关,而分子扩散系数是物质的物性常数之一。
通常气体中的扩散系数与扩散系统温度T 的1.5次方成正比,与其分压p 成反比。
吸收质在液体中的扩散系数与物质的种类、温度有关,同时与溶液的浓度密切相关。
通常,液体中的扩散系数与温度T 成正比,与液体的粘度成反比。
4、对于双组分气体物系,当总压和温度提高1倍时,分子扩散速率将如何变化? 答:对于气体扩散系数,但温度和压强改变时,可用下式估算:5.1000))((T T P P D D = 故,当温度和压强均增大一倍的时候,扩散速率应增大21.5/2=20.5。
5、分析湍流流动中组分的传质机理。
答:对于湍流流动来说,在流动的流体中不仅有分子扩散,而且流体宏观流动也将导致物质的传递。
dzdc D J A AB A -=6、什么是总体流动?分析总体流动和分子扩散的关系。
答:在吸收过程中,当气液界面上组分A 被溶剂S 溶解后,在界面上将留下空位,因溶剂S 不能逆向通过,只能由气相主体的混合气体来填补空位,因而产生趋向于相界面的“总体流动”。
总体流动是由于分子扩散本身所引起的,而不是由于外力(例如压强差)作用的结果。
7、在A 、B 双组分混合气体的单向分子扩散中,组分A 的宏观运动速度和扩散速度的关系? 答:N A :传质速率,J A ,J B :扩散速率8、简述对流传质的机理和传质阻力的分布。
工程热力学习题答案第四章-

第四章4-1 1kg 空气在可逆多变过程中吸热40kJ ,其容积增大为1102v v =,压力降低为8/12p p =,设比热为定值,求过程中内能的变化、膨胀功、轴功以及焓和熵的变化。
解:热力系是1kg 空气 过程特征:多变过程)10/1ln()8/1ln()2/1ln()1/2ln(==v v p p n =0.9 因为T c q n ∆=内能变化为R c v 25==717.5)/(K kg J ∙ v p c R c 5727===1004.5)/(K kg J ∙=n c ==--v vc n kn c 51=3587.5)/(K kg J ∙ n v v c qc T c u /=∆=∆=8×103J膨胀功:u q w ∆-==32 ×103J 轴功:==nw w s 28.8 ×103J焓变:u k T c h p ∆=∆=∆=1.4×8=11.2 ×103J熵变:12ln 12ln p p c v v c s v p +=∆=0.82×103)/(K kg J ∙ 4-2有1kg 空气、初始状态为MPa p 5.01=,1501=t ℃,进行下列过程:(1)可逆绝热膨胀到MPa p 1.02=;(2)不可逆绝热膨胀到MPa p 1.02=,K T 3002=; (3)可逆等温膨胀到MPa p 1.02=;(4)可逆多变膨胀到MPa p 1.02=,多变指数2=n ;试求上述各过程中的膨胀功及熵的变化,并将各过程的相对位置画在同一张v p -图和s T -图上解:热力系1kg 空气(1) 膨胀功:])12(1[111kk p p k RT w ---==111.9×103J熵变为0(2))21(T T c u w v -=∆-==88.3×103J12ln12lnp p R T T c s p -=∆=116.8)/(K kg J ∙ (3)21ln1p p RT w ==195.4×103)/(K kg J ∙ 21lnp p R s =∆=0.462×103)/(K kg J ∙ (4)])12(1[111nn p p n RT w ---==67.1×103Jnn p p T T 1)12(12-==189.2K12ln 12lnp p R T T c s p -=∆=-346.4)/(K kg J ∙4-3 具有1kmol 空气的闭口系统,其初始容积为1m 3,终态容积为10 m 3,当初态和终态温度均100℃时,试计算该闭口系统对外所作的功及熵的变化。
最新化工原理杨祖荣1-7章习题答案(完美排版)

化工原理杨祖荣1-7章习题答案(完美排版)目录第一章流体流动与输送机械 (2)第二章非均相物系分离 (32)第三章传热 (42)第四章蒸发 (69)第五章气体吸收 (73)第六章蒸馏 (95)第七章固体干燥 (119)第三章 传热1、某加热器外面包了一层厚为300mm 的绝缘材料,该材料的导热系数为0.16W/(m ⋅℃),已测得该绝缘层外缘温度为30℃,距加热器外壁250mm 处为75℃,试求加热器外壁面温度为多少? 解:22321121λλb t t b t t A Q -=-=C 3007516.025.016.005.03075o 21122321=+⨯-=+λ⨯λ-=∴t b b t tt2、某燃烧炉的平壁由下列三种砖依次砌成;耐火砖 b 1=230mm , λ1=1.05 W/(m·℃)绝热砖 b 2=230mm , λ2=0.151W/(m·℃)建筑砖 b 3=240mm , λ3=0.93W/(m·℃)已知耐火砖内侧温度为1000℃,耐火砖与绝热砖界面处的温度为940℃,要求绝热砖与建筑砖界面处的温度不得超过138℃,试求:(1) 绝热层需几块绝热砖;(2) 普通砖外侧温度为多少?解:(1)b 2=?m442.09.273151.013894005.123.094010002222321121=∴=-=-λ-=λ-=b b b t t b t t A Q230mm<b 2=442mm<230×2mm则:绝热层需两块绝热砖。
校核t 2=? C C t t o o 1386.1059.273151.046.094022<=∴=- (2)t 4=?C9.3493.024.06.1059.273o 443343=∴-==λ-=t t b t t A Q 3、Φ50×5㎜的不锈钢管,导热系数λ1=16W/(m·K),外面包裹厚度为30mm 导热系数λ2=0.2W/(m·K)的石棉保温层。
第四章气体动理论

第四章 气体动理论2-4-1选择题:1、处于平衡状态的一瓶氦气和一瓶氮气的分子数密度相同,分子的平均平动动能也相同,都处于平衡态。
以下说法正确的是:(A )它们的温度、压强均不相同。
(B )它们的温度相同,但氦气压强大于氮气压强。
(C )它们的温度、压强都相同。
(D) 它们的温度相同,但氦气压强小于氮气压强。
2、三个容器A 、B 、C 中装有同种理想气体,其分子数密度n 相同,方均根速率之比4:2:1::222=C B A v v v ,则其压强之比C B A p p p ::为:(A) 1 : 2 : 4 (B) 1 : 4 : 8 (C) 1 : 4 : 16 (D) 4 : 2 : 13、一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m . 根据理想气体的分子模型和统计假设,分子速度在x 方向的分量平方的平均值为: (A) 2xv =m kT 3 (B) 2x v = m kT331 (C) 2xv = m kT 3 (D) 2x v = m kT4、关于温度的意义,有下列几种说法:(1) 气体的温度是分子热运动平均平动动能的量度.(2) 气体的温度是大量气体分子热运动的集体表现,具有统计意义.(3) 温度的高低反映物质内部分子热运动剧烈程度的不同.(4) 从微观上看,气体的温度表示每个气体分子的冷热程度.上述说法中正确的是(A ) (1)、(2)、(4) (B ) (1)、(2)、(3)(C ) (2)、(3)、(4) (D) (1)、(3)、(4)5、两容器内分别盛有氢气和氦气,若它们的温度和质量分别相等,则:(A) 两种气体分子的平均平动动能相等.(B) 两种气体分子的平均动能相等.(C) 两种气体分子的方均根速率相等.(D) 两种气体的内能相等.6、一容器内装有N 1个单原子理想气体分子和N 2个刚性双原子理想气体分子,当该系统处在温度为T 的平衡态时,其内能为(A)⎪⎭⎫ ⎝⎛++kT kT N N 2523)(21 (B) ⎪⎭⎫ ⎝⎛++kT kT N N 2523)(2121(C)kT N kT N 252321+ (D) kT N kT N 232521+7、有一截面均匀的封闭圆筒,中间被一光滑的活塞分割成两边,如果其中的一边装有0.1kg 某一温度的氢气,为了使活塞停留在圆筒的正中央则另一边应装入同一温度的氧气质量为:(A ) kg 161 (B) 0.8 kg (C ) 1.6 kg (D) 3.2 kg8、若室内生火炉以后,温度从15°C 升高到27°C ,而室内的气压不变,则此时室内的分子数减少了:(A) 0.5% (B) 4% (C) 9% (D) 21%9、有容积不同的A 、B 两个容器,A 中装有单原子分子理想气体,B 中装有双原子分子理想气体。
化工传质分离工程课后习题答案

目录第一章绪论 (1)第二章单级平衡过程 (6)第三章多组分精馏和特殊精馏 (19)第四章气体吸收 (24)第五章液液萃取 (27)第六章多组分多级分离的严格计算 (28)第七章吸附 (34)第八章结晶 (35)第九章膜分离 (36)第十章分离过程与设备的选择与放大 (37)第一章绪论1.列出5种使用ESA和5种使用MSA的分离操作。
答:属于ESA分离操作的有精馏、萃取精馏、吸收蒸出、再沸蒸出、共沸精馏。
属于MSA分离操作的有萃取精馏、液-液萃取、液-液萃取(双溶剂)、吸收、吸附。
2.比较使用ESA与MSA分离方法的优缺点。
答:当被分离组分间相对挥发度很小,必须采用具有大量塔板数的精馏塔才能分离时,就要考虑采用萃取精馏(MSA),但萃取精馏需要加入大量萃取剂,萃取剂的分离比较困难,需要消耗较多能量,因此,分离混合物优先选择能量媒介(ESA)方法。
3.气体分离与渗透蒸发这两种膜分离过程有何区别?答:气体分离与渗透蒸发式两种正在开发应用中的膜技术。
气体分离更成熟些,渗透蒸发是有相变的膜分离过程,利用混合液体中不同组分在膜中溶解与扩散性能的差别而实现分离。
4. 海水的渗透压由下式近似计算:π=RTC/M ,式中C 为溶解盐的浓度,g/cm 3;M 为离子状态的各种溶剂的平均分子量。
若从含盐0.035 g/cm 3的海水中制取纯水,M=31.5,操作温度为298K 。
问反渗透膜两侧的最小压差应为多少kPa? 答:渗透压π=RTC/M =8.314×298×0.035/31.5=2.753kPa 。
所以反渗透膜两侧的最小压差应为2.753kPa 。
5. 假定有一绝热平衡闪蒸过程,所有变量表示在所附简图中。
求: (1) 总变更量数Nv;(2) 有关变更量的独立方程数Nc ; (3) 设计变量数Ni;(4) 固定和可调设计变量数Nx ,Na ;(5) 对典型的绝热闪蒸过程,你将推荐规定哪些变量?思路1:3股物流均视为单相物流, 总变量数Nv=3(C+2)=3c+6 独立方程数Nc 物料衡算式 C 个热量衡算式1个 相平衡组成关系式C 个 1个平衡温度等式1个平衡压力等式 共2C+3个 故设计变量Ni=Nv-Ni=3C+6-(2C+3)=C+3固定设计变量Nx =C+2,加上节流后的压力,共C+3个 可调设计变量Na =0 解:(1) Nv = 3 ( c+2 )(2) Nc 物 c 能 1 相 cF ziT F P FV , yi ,T v , P vL , x i , T L , P L习题5附图内在(P ,T) 2 Nc = 2c+3 (3) Ni = Nv – Nc = c+3 (4) Nxu = ( c+2 )+1 = c+3 (5) Nau = c+3 – ( c+3 ) = 0 思路2:输出的两股物流看成是相平衡物流,所以总变量数Nv=2(C+2) 独立方程数Nc :物料衡算式 C 个 ,热量衡算式1个 ,共 C+1个 设计变量数 Ni=Nv-Ni=2C+4-(C+1)=C+3固定设计变量Nx:有 C+2个加上节流后的压力共C+3个 可调设计变量Na :有06. 满足下列要求而设计再沸汽提塔见附图,求: (1) 设计变更量数是多少? (2) 如果有,请指出哪些附加变量需要规定?解: N x u 进料 c+2压力 9 c+11=7+11=18N a u 串级单元 1 传热 1 合计 2 N V U = N x u +N a u = 20 附加变量:总理论板数。
化工原理第四章习题及答案

第四章传热一、名词解释1、导热若物体各部分之间不发生相对位移,仅借分子、原子和自由电子等微观粒子的热运动而引起的热量传递称为热传导(导热)。
2、对流传热热对流是指流体各部分之间发生相对位移、冷热流体质点相互掺混所引起的热量传递。
热对流仅发生在流体之中, 而且必然伴随有导热现象。
3、辐射传热任何物体, 只要其绝对温度不为零度(0K), 都会不停地以电磁波的形式向外界辐射能量, 同时又不断地吸收来自外界物体的辐射能, 当物体向外界辐射的能量与其从外界吸收的辐射能不相等时, 该物体就与外界产生热量的传递。
这种传热方式称为热辐射。
4、传热速率单位时间通过单位传热面积所传递的热量(W/m2)5、等温面温度场中将温度相同的点连起来,形成等温面。
等温面不相交。
二、单选择题1、判断下面的说法哪一种是错误的()。
BA 在一定的温度下,辐射能力越大的物体,其黑度越大;B 在同一温度下,物体吸收率A与黑度ε在数值上相等,因此A与ε的物理意义相同;C 黑度越大的物体吸收热辐射的能力越强;D 黑度反映了实际物体接近黑体的程度。
2、在房间中利用火炉进行取暖时,其传热方式为_______ 。
CA 传导和对流B 传导和辐射C 对流和辐射3、沸腾传热的壁面与沸腾流体温度增大,其给热系数_________。
CA 增大B 减小C 只在某范围变大D 沸腾传热系数与过热度无关4、在温度T时,已知耐火砖辐射能力大于磨光铜的辐射能力,耐火砖的黑度是下列三数值之一,其黑度为_______。
AA 0.85B 0.03C 15、已知当温度为T时,耐火砖的辐射能力大于铝板的辐射能力,则铝的黑度______耐火砖的黑度。
DA 大于B 等于C 不能确定是否大于D 小于6、多层间壁传热时,各层的温度降与各相应层的热阻_____。
AA 成正比B 成反比C 没关系7、在列管换热器中,用饱和蒸汽加热空气,下面两项判断是否正确: A甲、传热管的壁温将接近加热蒸汽温度;乙、换热器总传热系数K将接近空气侧的对流给热系数。
工程热力学经典例题-第四章_secret

4.4 典型例题精解4.4.1 判断过程的方向性,求极值例题 4-1 欲设计一热机,使之能从温度为973K 的高温热源吸热2000kJ ,并向温度为303K 的冷源放热800kJ 。
(1)问此循环能否实现?(2)若把此热机当制冷机用,从冷源吸热800K ,能否可能向热源放热2000kJ ?欲使之从冷源吸热800kJ,至少需耗多少功?解 (1)方法1:利用克劳修斯积分式来判断循环是否可行。
如图4-5a 所示。
12r12||||2000kJ 800kJ-=-0.585kJ/K <0973K 303KQQ Q T T T δ=-=⎰所以此循环能实现,且为不可逆循环。
方法2:利用孤立系统熵增原理来判断循环是否可行。
如图4-5a 所示,孤立系由热源、冷源及热机组成,因此iso H L E E 0S S S S S ∆=∆+∆+∆∆= (a )式中:和分别为热源及冷源的熵变;为循环的熵变,即工质的熵变。
因为工质经循环恢复到原来状态,所以E 0S ∆= (b ) 而热源放热,所以 1H 1||2000kJ2.055kJ/K 973KQ S T ∆=-=-=- (c ) 冷源吸热,则 2L 2||800kJ 2.640kJ/K 303KQ S T ∆=== (d ) 将式(b )、(c )、(d )代入式(a ),得( 2.055 2.6400)kJ/K 0sio S ∆=-++> 所以此循环能实现。
方法3:利用卡诺定理来判断循环是否可行。
若在1T 和2T 之间是一卡诺循环,则循环效率为2c 1303K 1168.9%973KT T η=-=-= 而欲设计循环的热效率为12t 11||||||||W Q Q Q Q η-== c 800kJ160%2000kJη=-=<即欲设计循环的热效率比同温度限间卡诺循环的低,所以循环可行。
(2)若将此热机当制冷机用,使其逆行,显然不可能进行,因为根据上面的分析,此热机循环是不可逆循环。
人教版高一化学必修1练习:第四章 第三节 第2课时 二氧化氮、一氧化氮及酸雨含答案

第2课时二氧化氮、一氧化氮及酸雨课后篇巩固提升基础巩固1.下列关于NO2和SO2的说法中错误的是( )A.它们都是易溶于水的有色气体B.它们都是具有刺激性气味的有毒气体C.大气中的NO2和SO2可以形成酸雨D.提高机动车尾气排放标准有利于提高空气质量,二氧化氮是红棕色气体,A项错误;NO2和SO2都是具有刺激性气味的有毒气体,B项正确;SO2溶于水会与水反应生成亚硫酸,亚硫酸易被氧化为硫酸,NO2溶于水会与水反应生成硝酸和一氧化氮,因此大气中的NO2和SO2可以形成酸雨,C项正确;提高机动车尾气排放标准可以减少二氧化硫和二氧化氮等气体的排放,因此有利于提高空气质量,D项正确。
2.某集气瓶中的气体呈红棕色,加入足量水,盖上玻璃片振荡,得橙色溶液,气体颜色消失。
再拿走玻璃片后,瓶中气体又变为红棕色,则该气体可能是下列混合气体中的( )A.N2、NO2、Br2B.NO2、NO、N2C.NO2、NO、O2D.N2、O2、Br2NO2和Br2中的至少一种,溶于水得橙色溶液说明气体中必定含有溴蒸气,所得无色气体遇空气重新变为红棕色说明无色气体含NO。
原气体可能既有NO2也有Br2。
3.在一定温度和压强下,将装有N2和NO2混合气体的试管倒立在水中,经足够长时间后,试管内气体,则原混合气体中N2与NO2的体积比是( ) 体积缩小为原体积的35A.2∶3B.3∶2C.3∶5D.5∶32与水反应使气体的体积减小,设原混合气体的体积为5mL,则:3NO2+H2O2HNO3+NO ΔV3 1 2V(NO2) 5mL×(1-3)5V(NO2)=3mLV(N2)∶V(NO2)=(5mL-3mL)∶3mL=2∶34.下列关于试剂保存或除杂试剂选择的叙述不正确的是( )A.金属钠应该保存在煤油中B.漂白粉可以敞开存放C.除去NO中混有的NO2:排水集气D.除去Cl2中混有的HCl气体:饱和食盐水洗气,钠不与煤油反应,密度大于煤油,因此金属钠可保存在煤油中,A项正确;次氯酸钙容易吸收空气中的水和二氧化碳转化为次氯酸,次氯酸易分解而使漂白粉变质,所以漂白粉不可以敞开存放,B项错误;二氧化氮溶于水生成硝酸和NO,则除去NO中混有的NO2可以用蒸馏水洗气的方法,C项正确;氯化氢极易溶于水,则除去Cl2中混有的HCl气体可以用饱和食盐水洗气,D 项正确。
物理化学第四章第五章练习题

第四章 单元练习1. 液体B 与液体C 可以形成理想液态混合物。
在常压及25℃下,向总量n =10 mol ,组成x c =0.4的B ,C 液态混合物中加入14mol 的纯液体C ,形成新的混合物。
求过程的△G ,△S 。
2. A 、B 两液体能形成理想液态混合物。
已知在t 时纯A 的饱和蒸气压*Ap =40kPa ,纯B 的饱和蒸气压*B p =120kPa 。
(1)在温度t 下,于气缸中将组成为y (A )=0.4的A 、B 混合气体恒温缓慢压缩,求凝结出第一滴微细液滴时总压及该液滴的组成(以摩尔分数表示)为多少?(2)若将A 、B 两液体混合,并使此混合物在100kPa 、温度t 下开始沸腾,求该液态混合物的组成及沸腾时饱和蒸气的组成(摩尔分数)?3. H 2、N 2与100g 水在40℃时处于平衡,平衡总压力为105.4kPa 。
平衡蒸气经干燥后的组成为体积分数=)(2H ϕ40%。
假设溶液的水蒸气可以认为等于纯水的蒸气压,即40℃时的7.33kPa 。
已知40℃时H 2、N 2在水中亨利常数分别为7.61GPa 及10.5GPa 。
求40℃时水中能溶解H 2和N 2的质量。
4. 20℃下HCl 溶于苯中达平衡,气相中HCl 的分压为101.325kPa 时,溶液中HCl 的摩尔分数为0.0425,已知20℃时苯的饱和蒸气压为10.0kPa 。
若20℃时HCl 和苯蒸气总压为101.325kPa ,求100g 苯中溶解多少克HCl 。
5. 25g 的CCl 4中溶有0.5455g 某溶质,与此溶液成平衡的CCl 4蒸气分压为11.1888kPa ,而在同一温度时纯CCl 4的饱和蒸气压为11.4008kPa 。
(1)求此溶质的相对摩尔质量Mr 。
(2)根据元素分析结果,溶质中含C 为94.34%,含H 为5.66%(质量百分数),确定溶质的化学式。
6. 在100g 苯中加入13.76g 联苯(C 6H 5C 6H 5),所形成溶液的沸点为82.4℃。
气体吸收习题

第九章 气体吸收一、本章学习的目的、应掌握的内容和学习注意事项1. 本章学习的目的通过本章的学习,掌握气体吸收与解吸的基本概念和气体吸收过程的基本计算方法。
2. 本章重点掌握的内容(1)气体吸收过程的平衡关系 (2)气体吸收过程的速率关系 (3)低浓度气体吸收过程的计算 本章应掌握的内容(1)费克定律和分子传质问题的求解方法 (2)双膜模型本章一般了解的内容(1)溶质渗透模型和表面更新模型 (2)吸收系数3. 本章学习应注意的问题(1)表示吸收过程的平衡关系为亨利定律,亨利定律有不同的表达形式,学习中应注意把握它们之间的联系。
(2)表示吸收过程的速率关系为吸收速率方程,吸收速率方程有不同的表达形式,学习中应注意把握它们之间的联系。
(3)学习分子传质,不要机械地记忆各过程的求解结果,应注意把握求解的思路和应用背景。
(4)学习中应注意把握传质机理和吸收过程机理之间的联系,注意体会讲述传质机理和吸收过程机理的目的和意义。
二、例题解析9-1 惰性气与CO 2的混合气中CO 2体积分数为30%,在表压1MPa 下用水吸收。
设吸收塔底水中溶解的CO 2达到饱和,此吸收液在膨胀槽中减压至表压20kPa ,放出大部分CO 2,然后再在解吸塔中吹气解吸。
设全部操作范围内水与CO 2的平衡关系服从亨利定律,操作温度为25℃。
求1kg 水在膨胀槽中最多能放出多少千克CO 2气体。
解:依题意,在全部操作范围内水与CO 2的平衡关系服从亨利定律,查附录二得25℃下CO 2溶于水时的亨力系数为MPa 1066.12⨯=E方法一:对膨胀槽作CO 2物料平衡(以1kg 水为衡算基准) 入膨胀槽吸收液中CO 2的组成321110990.11066.1/3.01013.1/-⨯=⨯⨯==E p x设此液1kg 水中溶解CO 2的kg 数为W 1,则有:kg 10875.410990.118/144/44/313111--⨯=⇒⨯=+=W W W x出膨胀槽吸收液中CO 2的组成422210307.71066.1/)020.01013.0(/-⨯=⨯+==E p x设此液1kg 水中溶解CO 2的kg 数为W 2,则有:kg 10788.110307.718/144/44/324222--⨯=⇒⨯=+=W W W x故1kg 水在膨胀槽中最多能释放出CO 2的kg 数为O /kgH kgCO 1009.310)788.1875.4(223321--⨯=⨯-=-=W W W方法二:不考虑气流夹带走的水量,则膨胀槽内水的量恒定不变,于是1kg 水在膨胀槽中最多能放出CO 2气体的的千克数为O/kgH kgCO 00308.010*******)3.1213.03.1101(1/)()()(223CO 21CO 21CO 21222=⨯⨯⨯-⨯⨯=-=-≈-=E M p p L M x x L M X X L m s s s9-2 某水杯中初始水面离杯上缘1cm ,水温30℃,水汽扩散进入大气。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• ⑵各组分的平衡常数;
看看答案?
计算题
• ⑶吸收因子、吸收率; • ⑷尾气的组成。 • 操作条件下各组分的平衡常数如下: • 乙烷: K = 0.13333t + 5.46667 • 丙烷: K = 0.06667t + 1.3333 • 正丁烷:K = 0.02857t + 0.08571(t的单位为
• 试计算:
• ⑴最小液气比;
• ⑵操作液气比为最小液气比的1.5倍时所需的理论 级数
• ⑶各组分的吸收率和塔顶尾气的数量和组成;
• ⑷塔顶应加入的吸收剂量。
看看答案?
计算题
• 3、某原料气组成如下:
组分 C01
C02
C03
iC04 nC04 iC05 nC05 nC06 ∑
Vn+1 0.765 0.045 0.035 0.025 0.045 0.015 0.025 0.045 1.00
• 13、在板式塔的吸收中,原料中的平衡常数小的 组分主要在( )被吸收
• a. 塔上部少数几块板;b. 塔下部少数几块板;c. 塔中部少数几块板;d. 全塔所有板。
看看答案?
选择题
• 14、在板式塔的吸收中,原料中关键组分组分主 要在( )被吸收
• a. 塔上部少数几块板;b. 塔下部少数几块板;c. 塔中部少数几块板;d. 全塔所有板。
C10
C20
C30
nC40
nC50
nC80
∑
0.03 0.22 1.82 4.47 8.59 84.87 100.0
进料为1000kmol/h,温度为121℃。蒸出用气体 为149 ℃和345kPa的过热水蒸气,其量为 100kmol/h。用平均蒸出因子法计算液体和富气
现拟用不挥发烃类液体为吸收剂在板式塔内进行 吸收,平均吸收温度为38℃,压力为1.013MPa, 如果要将iC04
回收90%,试求:
看看答案?
计算题
• ⑴为完成此吸收任务所需最小液气比; • ⑵操作液气比为最小液气比的1.1倍时,为
完成吸收任务所需理论板数; • ⑶各组分吸收分率和离塔气体组成; • ⑷塔底吸收液量; • ⑸若改吸收温度为30℃进行上述各项计
组分
A
B
C
D
E
F
组成/mol% 15
10
20
15
25
15
相平衡常数K 13
3
1.5 0.7 0.4 0.2
现拟用新鲜的不挥发液体为吸收剂在板式塔内进 行吸收,在操作条件下要求D的回收率为99%。 试求:⑴完成该分离任务所需最小液气比;⑵当 操作液气比为最小液气比的1.4倍时,完成此吸收 过程所需理论级数;⑶求组分C和E的回收率。
• 14、化学吸收按反应类型又分为为( )和 ( )两类。
看看答案?
选择题
• 选择题
• 1、平均吸收因子法的适用范围是( )
• a. 单组分吸收; b. 恒摩尔流; c. 贫气吸收;d. 富 气吸收。
• 2、吸收作用发生的条件为( )
• a.pi<pi* ;b.pi>pi* ;c. yi<yi* ;d. pi=pi*。 • 3、吸收由于是单向传质,吸收塔每个级的温度的
组分主要在塔顶的几个级上吸收?
看看答案?
简答题
• 7、给出吸收因子法的基本方程,并说明计算方
法。
• 8、多组分吸收过程,不同组分和不同塔段的吸收
程度有何不同?
• 9、吸收过程中液体物流的热容量与气体物流的热
容量的相对大小对吸收塔内温度分布有何影响?
• 10、化学吸收与物理吸收相比有何优缺点?
• 11、平均吸收因子法计算公式推导中引入了那些
• a. 恒温操作;b. 恒摩尔流; c. 贫气吸收;d. 富气 吸收。
• 6、吸收过程各组分的吸收量主要发生在( )
• a. 每个级均匀吸收;b. 主要在塔顶一级和塔釜一
个理论级;
• c. 主要在塔釜;d. 塔中部。
看看答案?
选择题
• 7、当体系的yi=yi*时( ) • a. 发生解吸过程;b. 发生吸收过程;c. 发生精馏过程;d.
• 1、严格计算精馏和吸收过程每个级的温度分布分 别采用什么方法确定,为什么?
• 2、怎样用简捷法计算吸收过程的理论级数。
• 3、简述精馏和吸收过程的主要不同点。
• 4、组分的吸收因子是怎样定义的,推导i组分的 吸收相平衡方程。
• 5、精馏有两个关键组分,而吸收只有一个关键组 分,为什么?
• 6、请解释对于一般多组分吸收塔,为什么不易挥 发的组分主要在塔釜几个级上吸收,而易挥发的
℃)
看看答案?
计算题
• 6、含C2H60.86,C3H80.09,n-C4H10 0.05 (mol%)的混合气体在吸收塔中用分子量为l80 的烃油吸收。塔压为0.2943MPa,平均操作温度 38℃。操作条件下各组分的值为C2H610.5, C3H83.7,n-C4H101.15。要求正丁烷的吸收率为 0.9。试用平均吸收因子法计算:⑴液气比;⑵平 衡级数:⑶贫气组成;⑷每1000m3/h富气所需的 吸收油量。
编号 组分1 CH4 Nhomakorabea2 C2H6
3 C3H8
4
n-
5 C4nH- 10 6 C5nH- 12
ΣC6H12
Vi,N+1 70 15 10 4 1 0
100
Li,0
Ki
0 12.991
0 2.1808
0 0.0359
0 0.18856
0 0.02536
20
9
20
看看答案?
计算题
• 8、采用吸收过程处理某混合气,混合气的组成及 各组分在操作温度、压力下的相平衡常数K见表
没有物质的净转移。 • 8、关于吸收的描述下列哪一个不正确( ) • a. 根据溶解度的差异分离混合物;b. 适合处理大量气体的
分离; • c. 效率比精馏低;d. 能得到高纯度的气体。 • 9、通常对物理吸收操作最有利的操作条件是( ) • a. 高温高压;b. 低温高压;c. 低温低压;d. 高温低压。 • 10、在多组分吸收中,吸收主要发生于塔顶附近几个级的
级数; ⑶求A和B的吸收率。
看看答案?
计算题
• 10、具有三块理论板的板式吸收塔,用来处理下 列组成的气体(VN+1),贫油和气体入口温度按塔 的平均温度顶为32℃,塔压2.128MPa,富气流率 为100kmol/h,式分别用平均吸收因子法和有效吸 收因子法确定净化气(V1)中各组分的流率。
组分 vN+1
• 8、吸收过程主要由( )完成的。 • 9、蒸出因子定义式为( ),其值可反映蒸出过
程( )。 • 10、相对吸收率与吸收率相等的条件是( )。 • 11、吸收剂的再生常采用的是( ),( ),
( )。 • 12、吸收过程中通常气体为( ),液体为
( )。
看看答案?
填空题
• 13、化学吸收的增强因子就是与相同条件 下化学吸收与物理吸收的( )之比,其定 义式为( )。
• 4、吸收过程在塔顶的限度为( ),它决定了尾 气中( )。
• 5、吸收操作中,最小液气比下,关键组分的吸收 因子和关键组分的吸收率在数值上( )。
• 6、多组分吸收过程液气比一般取最小液气比的
( )~( )倍。
看看答案?
填空题
• 7、吸收操作中,最小液气比是指在无穷多塔级 下,达到规定分离要求时,1kmol进料气所需要 ( )的kmol数。
第第四四章章 主主要要内内容容
1
填空题
2
选择题
3
简答题
4
计算题
填空题
• 填空题
• 1、用于吸收的相平衡表达式为( ),当( ) 降低,( )升高时有利于吸收。
• 2、应用平均吸收因子法进行计算时,假设各平衡 级的( )相等。
• 3、通常多组分精馏有( )个关键组分,多组分 吸收有( )个关键组分。
看看答案?
计算题
• 9、用新鲜的S作吸收剂采用吸收法回收混合气中 C,操作压力为1.8MPa(绝),操作温度为20℃,C 的回收率为0.95。进吸收塔气体组成和各组分的 相平衡常数Ki如下:
组分
A
B
C
Σ
mol%
12.6
87.0
0.4
100.0
Ki
3.0
2.0
0.3
试求:⑴完成此任务所需的最小液气比; ⑵取操作液气比为最小液气比的1.2倍时所需平衡
假设?
看看答案?
计算题
• 计算题 • 1、拟进行吸收的某厂裂解气的组成及在吸收塔内
操作压力为1MPa操作温度为308K下的相平衡常 数如下:
组分 甲烷 乙烷 丙烷 异丁烷
yN+1
26.5
6.5
Ki
19
3.6
4.5
12.5
1.2
0.53
⑴计算操作液气比为最小液气比的1.15倍时异丁
烷组分被吸收90%时所需的理论级数;
l0 Ki
C10
C20
C30
nC40
nC50
nC80
∑
70
15
10
4
1
0
100
0
0
0
0
0
20
20
12.911 2.181 0.636 0.186 0.0537 0.00136
看看答案?
计算题
• 11、一蒸出塔操作压力为345MPa,有三个平衡 级,用来蒸出分离具有下列摩尔组成的液体:
组分
xi/mol%
看看答案?
