工艺装备验证书(模板)
产品工艺验证模版

产品⼯艺验证模版甲苯咪唑⽚⼯艺验证草案Process Validation Protocol甲苯咪唑⽚100mg制造⼯艺验证⽬录CONTENT TABLE⽬录CONTENT TABLE (2)1.背景介绍INTRODUCTION (4)1.1验证产品基本信息BASIC INFORMATION OF VALIATIONED PRODUCT (4)1.2背景Background (4)1.3⽬的Purpose (4)1.4范围Scope (5)2.责任RESPONSIBILITY (7)3.⽅法APPROACH (8)3.1⼯艺验证与验证批释放Process validation and release of the validation batch 83.2Comparison to biobatch (8)3.3稳定性研究Stability study to this process validation (8)3.4与⼯艺验证相关的清洁验证Cleaning validation related to this process validation (8) 3.5分析⽅法与IPC/释放标准Analytical method overview including IPC/release specifications (9)3.6结果记录与评估的⽅法Methods for recording & evalusting results (9)4.⼯艺介绍PROCESS (10)4.1产品处⽅Product Formulation (10)4.1.1 处⽅Formulation (10)4.1.2 原材料合格供户清单Qualified suppliers List of raw materials 114.2接触容器Immediate containers (12)4.3⽣产设备和设施Manufacturing Equipment and Facility (12)4.4⼯艺流程图Process Flow Diagram (13)4.5关键⼯艺参数与变量Critical Process Parameters and Variables (14)5⼯艺验证过程PROCESS VALIDATION (15)5.1粘合液制备Prepare binding solution (15)5.2⼲混⼯序Dry-mixing (Pre-mixing) (17)5.3湿法制粒和⼲燥⼯序Wet Granulation and Drying (19)5.4整粒⼯序Breaking (22)5.5不加硬脂酸镁的混合Mixing without Magnesium stearate (23)5.6加硬脂酸镁的混合Mixing with Magnesium stearate (25)5.7中间体桶料In drums (29)5.8压⽚⼯序The tableting process (31)5.9贮存时间Holding time study (35)6验证中偏差/变更处理DEVIATION AND CHANGE HANDLING (37)7培训TRAINING (37)8参考⽂献REFERENCE ................................. 错误!未定义书签。
工艺设计验证报告模板

工艺验证报告文件编码:起草人:姓名:部门:日期:审核人:姓名:部门:日期:批准人:姓名:部门:日期:目录1.介绍 (3)2.验证目的 (3)3.验证范围 (3)4.验证类型 (3)5.验证日期与相关批号 (3)6.验证小组成员及职责 (3)7.简单工艺描述(略) (4)8.胺化工艺验证 (4)8.1.工艺参数 (4)8.2.验证人员及日期 (4)验证标准、分析方法 ............................................................................. 58.3.验证数据8.4 (5)验证结果分析、评价及建议 .................................................................. 68.5.9.纯化工艺验证 (6)9.1.工艺参数 (6)9.2.验证人员及日期 (7)验证标准、分析方法 ............................................................................. 79.3.验证数据9.4 (7)验证结果分析、评价及建议9.5. (9)10.成盐工艺验证 (10)10.1.工艺参数 (10)110.2.验证人员及日期 (11)10.3.验证标准 (11)10.4.分析方法 (11)10.5.验证数据 (11)10.6.验证结果分析、评价及建议 (13)11.验证结果批准、会签及日期 (13)2介绍 1.在验证生产过程中发生偏差与异常情况,我们按“偏差处理程序--SOP-ZL-9004-02”进行了处理。
验证目的 2.证明本工艺路线在预定的工艺参数范围内运行能持续有效地生产出高质量的合格的硫酸羟基氯喹。
验证范围 3.验证类型 4.前瞻性验证验证日期与相关批号 5.验证日期:2007 年03 月20 日至2007年04 月20 日验证批号:070402、070403、070404验证小组成员及职责 6.人员职务职责负责整个验证和协调工注册部经负责工艺验证方案、验证报告的审核、批准工作Q经监督验证的实技术主负责生产工艺及其变更等验证方案的制定、起草工3作,验证工作的实施负责分析方法的验证,配合验证工作的各项取样及主管QC 检测,检验方法负责验证工作的实施及资料的收集,报告的整理工车间主任作简单工艺描述(略)7. SMP-ZL-7244-00。
工艺验证报告范文

工艺验证报告范文一、前言。
大家好!今天我们来聊聊[工艺名称]的工艺验证。
这就像是一场对工艺这个小伙伴的超级大考验,看看它是不是真的像我们期待的那样靠谱又厉害。
二、验证目的。
简单说呢,我们就是想确定这个工艺在正常操作的情况下,能不能稳定地生产出符合要求的产品。
这就好比我们要检查一个厨师,是不是每次都能做出美味又合格的菜肴一样。
三、验证范围。
这次验证涵盖了从原材料进入生产线,到最后成品出来的整个过程。
就像我们跟着一个小零件,看它在工艺这个大工厂里的奇妙之旅,每个角落都不放过。
四、验证小组。
我们有一个超棒的验证小组。
组长[组长名字]就像一个超级队长,带领着一群各有所长的小伙伴。
有擅长设备操作的[操作员名字],对质量检查特别在行的[质检员名字],还有能把数据处理得井井有条的[数据员名字]。
大家就像复仇者联盟一样,为了工艺验证这个共同目标而努力。
五、验证依据。
我们的依据主要是产品的规格要求、相关的行业标准,还有公司内部制定的一些严格的操作指南。
这些依据就像是游戏规则,我们要确保工艺这个玩家完全按照规则来玩。
六、工艺描述。
这个[工艺名称]工艺啊,说起来还挺有趣的。
原材料就像一群小士兵,整整齐齐地排队进入第一道工序[工序名称1]。
在这里,它们会经过[具体操作1],就像是被施了魔法一样,发生了[变化描述1]。
然后,它们继续前进到[工序名称2],这里又有新的挑战,要经历[具体操作2],最后才变成我们期待的成品。
整个过程就像一场精彩的冒险故事。
七、验证内容及结果。
# (一)设备运行验证。
1. 设备选型。
我们选用的设备那可都是精挑细选的。
[设备名称]设备就像一个强壮的大力士,它的功率、精度等参数都完全满足工艺要求。
比如说,它的功率能让整个生产过程像小跑车一样顺畅,不会出现动力不足的情况。
2. 设备稳定性。
在连续运行的测试中,设备就像一个不知疲倦的小超人。
我们观察了[运行时长],设备没有出现任何故障,各个部件都稳稳当当的。
工艺验证报告范文

工艺验证报告范文一、项目背景工艺验证是指根据产品生产的需要,通过实际生产过程进行验证,以确保产品的制造符合设计要求和技术要求。
工艺验证旨在通过实际生产条件下的实验和数据分析,验证生产工艺的可靠性和稳定性,以确保产品质量,并为产品生产提供重要参考依据。
二、工艺验证目标1.验证生产工艺的可行性和稳定性。
2.验证工艺参数和工艺流程的合理性。
3.验证生产设备的可靠性和稳定性。
4.验证产品质量控制体系的有效性和合理性。
三、工艺验证方法1.定义验证目标和验证指标。
2.设计验证实验方案和验证样本。
3.进行实际生产操作和数据采集。
4.对生产数据进行统计和分析。
5.结果评价和报告撰写。
四、工艺验证实验1.确定验证目标:本次工艺验证的目标是验证新的生产工艺对产品质量和生产效率的影响。
2.设计验证实验方案:根据产品特性和生产要求,设计了新的工艺参数和工艺流程,并与原有工艺进行对比。
3.选择验证样本:从生产线上随机选取一批产品作为验证样本。
4.执行实际生产操作:按照新的工艺参数和工艺流程进行生产,并记录关键数据。
5.数据采集和分析:对生产过程中的关键数据进行采集并进行统计分析,包括产品尺寸、材料使用量、生产时间等指标。
6.结果评价和报告撰写:根据实验结果和分析,评价新工艺的可行性和稳定性,并撰写工艺验证报告。
五、工艺验证结果1.产品质量:根据验证实验结果,新的工艺参数和工艺流程能够满足产品质量要求,产品尺寸精度和表面光洁度优于原有工艺。
2.生产效率:新的工艺参数和工艺流程能够显著提高生产效率,生产时间缩短了30%,材料使用量减少了20%。
3.工艺稳定性:在多次验证实验中,新的工艺参数和工艺流程表现出良好的稳定性,各项指标的变异系数小于5%。
4.质量控制体系:通过工艺验证,证明质量控制体系的有效性和合理性,能够准确控制产品质量。
六、工艺验证结论本次工艺验证结果表明,新的工艺参数和工艺流程能够显著改善产品质量和生产效率,具有良好的可行性和稳定性。
焊装工艺验证模板
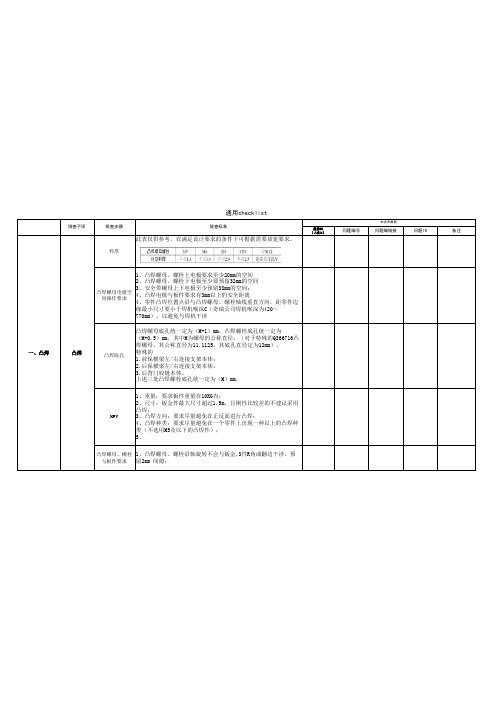
是否OK(√或×)问题编号问题编链接问题ID备注料厚此表仅供参考,在满足设计要求的条件下可根据需要放宽要求。
凸焊螺母电极空间操作要求1、凸焊螺母、螺栓上电极要求至少20mm的空间2、凸焊螺母、螺栓下电极至少要预留32mm的空间3、安全带螺母上下电极至少预留38mm的空间;4、凸焊电极与板件要求有3mm以上的安全距离4、零件凸焊位置点沿与凸焊螺母、螺栓轴线垂直方向,距零件边缘最小尺寸要小于焊机喉深C(奇瑞公司焊机喉深为420~770mm),以避免与焊机干涉凸焊底孔凸焊螺母底孔统一定为(M+1)mm,凸焊螺栓底孔统一定为(M+0.5)mm,其中M为螺母的公称直径;(对于特殊的Q366716凸焊螺母,其公称直径为11.1125,其底孔直径定为12mm)。
特殊的1.前保横梁左/右连接支架本体;2.后保横梁左/右连接支架本体;3.后背门铰链本体。
上述三处凸焊螺栓底孔统一定为(M)mm,HPV 1、重量:要求钣件重量在10KG内;2、尺寸:钣金件最大尺寸超过1.5m,且刚性比较差的不建议采用凸焊;3、凸焊方向:要求尽量避免在正反面进行凸焊;4、凸焊种类:要求尽量避免在一个零件上出现一种以上的凸焊种类(不选用M5及以下的凸焊件);5、凸焊螺母、螺栓与板件要求1、凸焊螺母、螺栓沿轴旋转不会与钣金,3件R角或翻边干涉,预留2mm 间隙;通用checklist排查子项排查步骤排查标准M1发布数据一、凸焊凸焊(√或×)问题编号问题编链接问题ID备注零部件形状搬运性,工位器具性1、三级以下总成避免出现过长、过大的零件以及刚性不好的零件;2、零件在工位器具上能够稳定的位置放置。
约束过多1、零件的搭接关系复杂,搭接面型面过于复杂,难以保证装配到位,建议产品设计局部贴合,在点焊的地方做贴合其他位置放开2、避免4面搭接以上的搭接面出现。
装配过程中零件是否干涉零件相互安全距离1、分析零件在沿定位孔法向运动时,是否会与其他零件干涉。
工艺验证方案(范例)

工艺验证方案(范例)工艺验证方案是用于验证工艺流程和工艺参数是否能够满足产品设计要求的方案。
下面是一个工艺验证方案的范例:1. 目标:验证工艺流程和工艺参数是否能够生产出符合设计要求的产品。
2. 参与人员:工艺工程师、质量工程师、生产工程师、设计工程师。
3. 测试样品:选择代表性的产品样品,包括各种不同规格和型号的产品。
4. 测试设备和工具:根据产品的特点和要求,确定需要使用的测试设备和工具。
例如,计量工具、设备和仪器。
5. 测试方法:根据产品的特点和要求,确定合适的测试方法。
例如,尺寸测量、测试使用寿命、性能测试等。
6. 工艺参数:根据产品的特点和要求,确定合适的工艺参数进行测试。
例如,温度、压力、时间等。
7. 测试方案:- 准备工作:检查和准备所需的测试设备和工具,确保其正常工作和校准。
- 设定工艺参数:根据产品的要求,设定合适的工艺参数。
- 生产工艺验证:按照设定的工艺参数进行生产,记录生产过程中的关键参数和数据。
- 产品检验:对生产出的产品进行尺寸测量、测试使用寿命、性能测试等,记录测试结果。
- 数据分析:对测试结果进行分析,评估工艺流程和工艺参数的合理性和可靠性。
- 结果评定:根据测试结果评定工艺流程和工艺参数是否能够满足产品设计要求,是否需要进行调整或改进。
8. 结论和建议:根据测试结果,给出对工艺流程和工艺参数的评价,并提出调整或改进的建议。
以上是一个工艺验证方案的范例,可以根据具体的产品和工艺要求进行调整和完善。
工艺验证方案的目的是确保生产的产品能够满足设计要求,提高产品的质量和可靠性。
工艺装备验收书模版

工艺装备验收书
JD/SP1-2-03☐新工装验证☐量产工装检定NO.工装名称工装编号
产品图号产品名称
制造单位制造日期
工装主要尺寸检查序号尺寸允差实测备注序号尺寸允差实测备注17
28
39
410
511
612
其它
检测
检验人员
检验日期
结论☐合格
☐让步使用☐报废
会
签
名
检验员使用部门日期
工艺装备验收书
JD/SP1-2-03☐新工装验证☐量产工装检定NO.工装名称工装编号
产品图号产品名称
制造单位制造日期
工装主要尺寸检查序号尺寸允差实测备注序号尺寸允差实测备注17
28
39
410
511
612
其它
检测
检验人员
检验日期
结论☐合格
☐让步使用☐报废
会
签
名
检验员使用部门日期。
工艺验证资料范文

工艺验证资料范文
涵盖工艺验证的所有要点
工艺验证
一、目的
1.确定药品制造过程的基础稳定性,以便确保药品质量的可控性和可靠性;
2.确保各参数的操作范围能满足质量要求,指导生产操作,并确定产品质量;
3.控制制药过程的变异性,维持工艺稳定性;
4.及早发现工艺存在的不良特性,并制定相应的改善措施。
二、工艺确认
1.确定设备参数操作范围;
2.确定原料及添加物质和其他物料的均匀性、稳定性和有效性;
3.确定生产工艺过程及其参数;
4.确定设备清洗和消毒方案;
5.确定药品的其他特性,如粒度、湿度、pH等。
三、工艺验证
1.验证机器及设备是否能适应定位技术条件,是否能满足杂质控制和生产技术要求;
2.验证原料、添加剂和其他物料的有效性和稳定性;
3.验证生产过程的有效性和可控性(如:反应时间、温度、湿度、搅拌时间、黏度、压力、流量、混合时间、混合方式等);
4.验证清洗和消毒方案的有效性:
5.验证药品的其他性质是否满足要求,如:粒度、湿度、pH值等;
6.验证药品的稳定性和变异性:
7.验证改进措施的有效性:。
工艺验证方案模板
Verification department (department):验证科室(部门):Verify completion date:验证完成日期:Validity:有效期:Index 目录1.Purpose目的 (5)2.Scope范围 (5)3.Responsibility职责 (5)3.1 AAA responsibilities AAA的职责 (5)3.2 XXX responsibilities XXX的职责 (6)4.Regulation and Guidance 法规和指南 (8)5.Abbreviations缩略语 (9)6.Protocol Description方案说明 (11)7.Product And Process Description产品和工艺描述 (14)7.1 Product specification (14)7.2 Drug approval No. (14)7.3 Standard Followed: (14)7.4 Raw Materials and Adjuvants原辅料情况 (14)7.5 Process description: (16)7.6 Process Recipe工艺处方: (21)7.7 List of Production Plants生产车间一览 (26)7.8 List of Production Equipment 生产设备一览 (29)7.9 Process Flow Diagram 工艺流程图 (33)7.10 CPP Identification CPP确认 (34)7.11 Validation Plan验证计划 (49)8.Validation prerequisite验证先决条件 (51)8.1 Personal Identification人员确认 (51)8.2 Process Documentation Verification 生产文件确认 (51)8.3 Training Verification 培训确认 (52)8.4 System and Equipment Instruments Calibration Verification 系统和设备仪表校验确认.. 528.5 System and Equipment Instruments Calibration Verification 生产相关验证状态确认 (53)8.6 Test Instruments Calibration Verification 测试仪器和仪表校验确认 (53)8.7 Testing Method Validation Verification检验方法验证的确认 (54)8.8 Raw Material and Excipient Verification原辅料确认 (54)9.Sampling Plan and Evaluation Criteria取样计划及评估标准 (56)10.Sample Coding Method样品编码原则 (70)11.Process Validation Test Execution 工艺验证执行 (72)11.1 Liquid Preparation 液体配制 (72)11.2 Cell Resurrection and Passage细胞复苏及传代 (74)11.3 Harvest liquid test 收获液检测 (81)11.4 Clarification Filtration Efficacy Test 澄清过滤效果检测 (83)11.5 UF Concentration 1 Efficacy Test超滤浓缩1效果检测 (83)11.6 Ammonium sulfate precipitation efficacy test 硫酸铵沉淀效果检测 (84)11.7 Potassium bromide extraction efficacy test 溴化钾提取效果检测 (85)11.8 First density gradient centrifugation efficacy test 一次密度梯度离心效果检测 (86)11.9 Second density gradient centrifugation efficacy test 二次密度梯度离心效果检测 (87)11.10 UF Concentration 2 Efficacy Test 超滤浓缩2效果检测 (88)11.11 Chromatography purification product test 层析纯化产物检测 (90)12.Bulk Determination原液检验 (92)13.Process Validation Summarization工艺验证总结 (93)14.PV Report工艺验证报告 (94)14.1 Process Validation Report 工艺验证报告 (94)14.2 Process Validation Analysis and Evaluation 工艺验证分析与评价 (94)15.Requirements on Execution Records 执行记录要求 (95)16.Deviation Handling 偏差处理 (95)17.Change Handling 变更处理 (95)18.Test Form测试表 (96)表格1 缩略语 (9)表格2原辅料质量标准表 (11)表格3物料消耗表1 (21)表格4物料消耗表2 (21)表格5所用液体配料表 (22)表格6生产车间一览表 (26)表格7主要生产设备一览表 (29)表格8工艺风险分析表 (33)表格9工艺时间表 (49)表格10取样计划表 (56)表格11样品编码原则 (70)表格12配液取样检测信息表 (72)表格13复苏和传代取样表 (74)表格14复苏和传代样品编码 (80)表格15收获液标准 (81)表格16澄清过滤标准 (83)表格17超滤浓缩1标准 (83)表格18硫酸铵沉淀标准 (85)表格19溴化钾提取标准 (86)表格20一次密度梯度离心标准 (87)表格21二次密度梯度离心标准 (88)表格22超滤浓缩2标准 (89)表格23纯化产物标准 (90)表格24原液标准 (92)表格25测试表列表 (96)1. Purpose目的This purpose of this process validation is to provide documented evidence to show that the combination of the personnel, materials, equipment, methods, environmental conditions and the other related utilities XXX Co., LTD (XXX) can ensure the consistent production of products conforming to the enterprise internal standards and the national standards, and the processes are reliable and conforming to the GMP requirements. The process validation and the test results are to be documented based on this validation protocol.本工艺验证用于提供文件化的证据,证明XXX疫苗一室生产XXX原液的人员、材料、设备、方法、环境条件以及其它有关公用设施的组合可以始终如一的生产出符合企业内控标准及国家法定标准的产品,工艺稳定可靠,符合GMP要求,工艺验证的过程和检查的结果将按照该验证方案进行记录。
工艺验证方案模板
Verification department (department):验证科室(部门):Verify completion date:验证完成日期:Validity:有效期:Index 目录1.Purpose目的 (5)2.Scope范围 (5)3.Responsibility职责 (5)3.1 AAA responsibilities AAA的职责 (5)3.2 XXX responsibilities XXX的职责 (5)4.Regulation and Guidance 法规和指南 (7)5.Abbreviations缩略语 (8)6.Protocol Description方案说明 (10)7.Product And Process Description产品和工艺描述 (12)7.1 Product specification (12)7.2 Drug approval No. (12)7.3 Standard Followed: (12)7.4 Raw Materials and Adjuvants原辅料情况 (12)7.5 Process description: (14)7.6 Process Recipe工艺处方: (18)7.7 List of Production Plants生产车间一览 (23)7.8 List of Production Equipment 生产设备一览 (25)7.9 Process Flow Diagram 工艺流程图 (28)7.10 CPP Identification CPP确认 (28)7.11 Validation Plan验证计划 (42)8.Validation prerequisite验证先决条件 (44)8.1 Personal Identification人员确认 (44)8.2 Process Documentation Verification 生产文件确认 (44)8.3 Training Verification 培训确认 (45)8.4 System and Equipment Instruments Calibration Verification 系统和设备仪表校验确认.. 458.5 System and Equipment Instruments Calibration Verification 生产相关验证状态确认 (46)8.6 Test Instruments Calibration Verification 测试仪器和仪表校验确认 (46)8.7 Testing Method Validation Verification检验方法验证的确认 (46)8.8 Raw Material and Excipient Verification原辅料确认 (47)9.Sampling Plan and Evaluation Criteria取样计划及评估标准 (49)10.Sample Coding Method样品编码原则 (62)11.Process Validation Test Execution 工艺验证执行 (64)11.1 Liquid Preparation 液体配制 (64)11.2 Cell Resurrection and Passage细胞复苏及传代 (66)11.3 Harvest liquid test 收获液检测 (72)11.4 Clarification Filtration Efficacy Test 澄清过滤效果检测 (73)11.5 UF Concentration 1 Efficacy Test超滤浓缩1效果检测 (74)11.6 Ammonium sulfate precipitation efficacy test 硫酸铵沉淀效果检测 (75)11.7 Potassium bromide extraction efficacy test 溴化钾提取效果检测 (76)11.8 First density gradient centrifugation efficacy test 一次密度梯度离心效果检测 (77)11.9 Second density gradient centrifugation efficacy test 二次密度梯度离心效果检测 (78)11.10 UF Concentration 2 Efficacy Test 超滤浓缩2效果检测 (79)11.11 Chromatography purification product test 层析纯化产物检测 (80)12.Bulk Determination原液检验 (82)13.Process Validation Summarization工艺验证总结 (83)14.PV Report工艺验证报告 (83)14.1 Process Validation Report 工艺验证报告 (83)14.2 Process Validation Analysis and Evaluation 工艺验证分析与评价 (84)15.Requirements on Execution Records 执行记录要求 (84)16.Deviation Handling 偏差处理 (84)17.Change Handling 变更处理 (85)18.Test Form测试表 (86)表格1 缩略语 (8)表格2原辅料质量标准表 (10)表格3物料消耗表1 (18)表格4物料消耗表2 (18)表格5所用液体配料表 (19)表格6生产车间一览表 (23)表格7主要生产设备一览表 (25)表格8工艺风险分析表 (33)表格9工艺时间表 (42)表格10取样计划表 (49)表格11样品编码原则 (62)表格12配液取样检测信息表 (64)表格13复苏和传代取样表 (66)表格14复苏和传代样品编码 (72)表格15收获液标准 (73)表格16澄清过滤标准 (74)表格17超滤浓缩1标准 (74)表格18硫酸铵沉淀标准 (75)表格19溴化钾提取标准 (76)表格20一次密度梯度离心标准 (77)表格21二次密度梯度离心标准 (78)表格22超滤浓缩2标准 (79)表格23纯化产物标准 (80)表格24原液标准 (82)表格25测试表列表 (86)1. Purpose目的This purpose of this process validation is to provide documented evidence to show that the combination of the personnel, materials, equipment, methods, environmental conditions and the other related utilities XXX Co., LTD (XXX) can ensure the consistent production of products conforming to the enterprise internal standards and the national standards, and the processes are reliable and conforming to the GMP requirements. The process validation and the test results are to be documented based on this validation protocol.本工艺验证用于提供文件化的证据,证明XXX疫苗一室生产XXX原液的人员、材料、设备、方法、环境条件以及其它有关公用设施的组合可以始终如一的生产出符合企业内控标准及国家法定标准的产品,工艺稳定可靠,符合GMP要求,工艺验证的过程和检查的结果将按照该验证方案进行记录。
生产工艺验证方案及报告范例

生产工艺验证方案及报告范例1. 引言嘿,朋友们!今天咱们来聊聊一个听上去有点复杂,但其实很有趣的话题——生产工艺验证方案。
这听起来像是个高大上的东西,其实就像做饭一样,只要你掌握了步骤和诀窍,保证能做出美味佳肴!所以,别紧张,咱们一块儿来捋一捋。
2. 生产工艺验证的意义2.1 为啥要验证?首先,咱们得问问自己:为什么要搞这个验证呢?其实,这就像你做菜前先看看配方一样。
假如你直接上手,可能盐放多了,或者火候掌握不好,结果就是一锅糊糊。
生产工艺验证的目的,就是为了确保每一步都走得稳妥,保证产品的质量,避免浪费时间和材料,毕竟“早起的鸟儿有虫吃”嘛。
2.2 验证的好处说到好处,那可就多了。
验证可以帮助咱们发现潜在问题,就像在菜里发现了小虫子,及时处理了,才能吃得安心。
而且,经过验证的工艺,不仅能提高生产效率,还能降低成本,简直是一举多得!对公司来说,这就像找到了一个能赚大钱的生意,谁不乐意呢?3. 验证方案的基本结构3.1 方案概述好了,咱们进入正题,来看看一个完整的验证方案应该怎么写。
首先,你得有个概述,就像写作文时的开头,要引人入胜。
这里要清楚地告诉大家,咱们要验证什么,为什么要验证。
比如,你可以说:“我们这次要验证的是某种新材料的生产工艺,因为市场对它的需求不断增加,我们要确保它的质量稳定。
”3.2 详细步骤接下来就是详细步骤了。
可以分成几个小点来写,确保读的人一目了然。
比如:1. 材料准备:先准备好你需要的所有材料,就像备齐了食材,才能开始做菜。
2. 设备检查:确保所有设备都运转正常,万一机器出故障,那可就闹笑话了。
3. 工艺流程:清楚每一个生产环节,确保每一步都按部就班,别像做饭时心急火燎,一下子把火开到最大。
4. 测试与记录:在生产过程中,及时进行测试,记录下每一个数据,确保万无一失。
就像是给你的菜品打分,看哪些地方需要改进。
5. 结果分析:最后,得对结果进行分析,看看是不是达到了预期的效果,找到不足之处,这样下次才能做得更好。
工艺验证报告【范本模板】

*******有限公司西洋参片生产工艺验证报告文件编号:*****西洋参生产工艺验证报告1.目的为确定普通中药饮片西洋参片生产工艺的可靠性,有依据的确定该类中药材从中间产品、半成品、成品炮制的整个工艺流程和质量标准中各检测项目,原药材、中间产品检测成品检测项目和炮制的整个流程和质量标准中各检测项目,我们特制定《西洋参片生产工艺同步验证方案》,凭借对此方案的验证,进行切片生产工艺的同步验证和评价。
2.适用范围本方案适用于生产批量定量的前提下,饮用水系统、电力系统、计量器具按国家规定校验合格后的中药饮片车间西洋参片的生产工艺同步验证,同时对相关设备的性能进行同步验证及评价。
3。
职责3.1验证小组:负责验证方案的起草、实施,验证周期的确认工作。
3。
2 验证小组相关人员:参与验证方案的讨论,确立、验证方案的会签工作。
3.3 验证小组组长:负责批准验证方案。
3.4质量管理部职责3.4.1负责验证过程的监控。
3。
4。
2负责取样、分析、检测及试验后数据收集、记录。
3。
5生产管理部职责3.5。
1负责验证方案的起草及具体实施以及判定炮制中各项技术指标是否符合要求.3.5.2参加验证方案的会审、会签。
3。
5.3负责提供验证的全部技术参数.3。
5.4参加验证报告,验证结果的会审、会签。
3。
6设备科职责3。
6.1负责保证设备处于完好状态。
3。
6。
2参加验证方案的会审、会签.3。
6。
3负责组织试验所需仪器、设备的验证,负责仪器、仪表、量具等的校正,负责设备的维护保养。
3.6.4 参加验证报告,验证结果的会审、会签。
4。
产品情况4.1概述:中药饮片生产工艺包括工艺条件、操作规程和设备使用三个方面,文件执行依据是《西洋参工艺规程》、相关设备使用、维护保养、清洁标准操作规程、批生产记录。
工艺验证的目的是证明上述文件规定的工艺条件、操作规程、设备、原药材能适合生产环境的生产,能生产出符合质量要求的产品,并有良好的重现性及可靠性。
XXX工艺验证方案模板

ProcessVa1idationProtoco1forXXXX XXXX工艺验证方案Protoco1Approva1方案批准批准意味着本设计确认方案已经被审核并且是完整和可接受的。
TAB1EOFCONTENTS目录1Purpose目的 (4)2Scope范围 (4)3Responsibi1ity职责 (4)4Define定义 (5)5Re1evantDocuments相关文件 (5)6ProcessProfi1e工艺概要 (5)7RiskAna1ysis风险分析 (7)1Purpose目的将由研究所研发确定的工艺和处方在口服固体制剂车间进行放大生产,评估和确认其可行性并确定最佳工艺参数。
2Scope范围本方案适用于XXXX工艺验证。
依据相应的工艺规程草案和工艺批生产记录,进行工验证,并拟于下列工序中取样,以进行关键性指标之测定。
关键性工序如下:预混、制粒、干燥、总混和压片。
4Define定义无5Re1evantDocuments相关文件5.1体系文件5.2法律法规和指南文件5.2.1中国药典2010版;5.2.2药品生产质量管理规范(2010年修订);5.2.3USP35/美国药典35版;5.2.4CGMP/美国现行GMP;5.2.5药品生产验证指南(2003)。
6ProcessProfi1e工艺概要6.1ManufacturingEquipment生产设备7RiskAna1ysis7.2风险分析评分标准7.1.1从风险的严重性、频率数和检测性三方面对工艺存在的风险进行分析评估,由三者评分的乘积得到风险优先数(RPN=SXOxD),根据RPN的大小和严重性的分数判断是否需要在工艺性能确认方案中进行评估,判定标准如下:7.3风险评估结论8ProcessVa1idationcondition工艺验证条件8.1本次工艺放大所用到的厂房设施、生产设备、检测设备已验证合格,见附录1。
8.2工艺放大涉及到的检验,测量仪器、仪表都已校验合格,见附录2。
工艺验证报告

工艺验证报告工艺验证报告项目代号:实施单位:编制:审核:批准:___年月工艺验证报告No.共页第1页一、工艺验证时间工艺验证完成时间:年月日至年月日二、工艺验证类别首台份(OTS样车)□___线□小批(PP节拍认证\FEU)□SOP批量提升□现产品改进□零部件三、验证地点冲压□焊装□涂装□总装四、验证依据产品设计技术标准,工艺设计指标、工艺方案、工艺路线、流程、生产纲领、工艺文件。
五、验证人员及资质验证组组长:验证组成员:姓名单位职务/职称姓名单位职务/职称六、验证情况一)工艺路线、流程验证该项目工艺路线、流程经过试制验证基本符合工艺设计要求,但需要进行流程修订,包括冲压、焊装、涂装和总装。
详见[工艺流程修订表]。
二)工艺装备验证1、冲压模具本项目共有模具套数,其中大型模具套和小冲模具套。
在本次验证中,共验证了套模具,其中存在问题项,包括严重不合格项、一般不合格项、可接受项和需整改再验收项。
详见[模具验证记录表]。
2、工装本项目共有工装套数,在本次验证中,共验证了套工装,其中存在问题项,包括严重不合格项、一般不合格项、可接受项和需整改再验收项。
详见[工装验证记录表]。
3、设备冲压设备与模具匹配满足生产要求。
冲压设备部分与模具不匹配,不能满足生产需求,详见[冲压设备验证记录表]。
焊装设备型号、数量满足生产需求。
焊装设备型号、数量不满足生产需求,详见[焊装设备验证记录表]。
涂装设备满足生产需求。
涂装设备不满足生产需求,详见[涂装设备验证记录表]。
总装设备满足生产需求。
总装设备不满足生产需求,详见[总装设备验证记录表]。
4、工位器具冲压共需种,本次验证种,合格满足使用要求的种,需进行改进的种,详见[冲压工位器具验证记录表]。
焊装共需种,本次验证种,合格满足使用要求的种,需进行改进的种,详见[焊装工位器具验证记录表]。
涂装共需种,本次验证种,合格满足使用要求的种,需进行改进的种,详见[涂装工位器具验证记录表]。
