高考化学不可不知的60大考点考点15晶体结构与性质
高考化学物质结构与性质
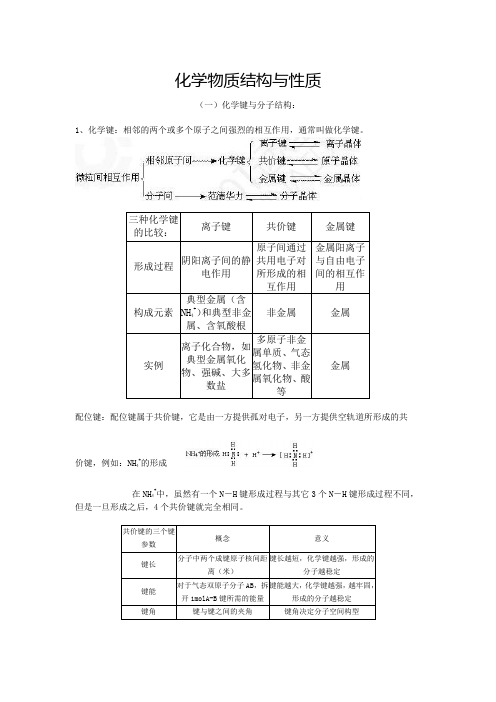
化学物质结构与性质(一)化学键与分子结构:1、化学键:相邻的两个或多个原子之间强烈的相互作用,通常叫做化学键。
配位键:配位键属于共价键,它是由一方提供孤对电子,另一方提供空轨道所形成的共价键,例如:NH 4+的形成在NH 4+中,虽然有一个N -H 键形成过程与其它3个N -H 键形成过程不同,但是一旦形成之后,4个共价键就完全相同。
键长、键能决定共价键的强弱和分子的稳定性:原子半径越小,键长越短,键能越大,分子越稳定。
共价键按成键形式可分为σ键和π键两种,σ键主要存在于单键中,π键主要存在于双键、叁键以及环状化合物中。
σ键较稳定,而π键一般较不稳定。
共价键具有饱和性和方向性两大特征。
2、分子结构:价层电子对互斥理论:把分子分成两大类:一类是中心原子上的价电子都用于形成共价键。
如CO2、CH2O、CH4等分子中的C原子。
它们的立体结构可用中心原子周围的原子数来预测,概括如下:另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
如H2O和NH3中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。
因而H2O分子呈V型,NH3分子呈三角锥型。
杂化轨道理论:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。
据参与杂化的s轨道与p轨道的数目,存在sp3、sp2、sp三种杂化。
杂化轨道理论分析多原子分子(离子)的立体结构价层电子对互斥模型判断简单分子或离子的空间构型说明:(1)等电子原理是指原子总数相同,价电子总数相同的分子或离子,对于主族元素而言,价电子就是其最外层电子数,即为最外层电子总数相等。
这一类分子或离子具有相似的化学键特征、分子结构以及部分物理性质相似,但一般情况下,化学性质并不相似。
同样,化学键相似,并不是指键角等一定相同。
利用等电子原理可判断一些简单分子或离子的主体构型,如:CO2、CNS-、NO2+、N3-的原子总数均为3,价电子总数均为16,因此,它们的空间构型均为直线型。
高考化学一轮复习晶体的结构与性质专项训练知识点及练习题含答案
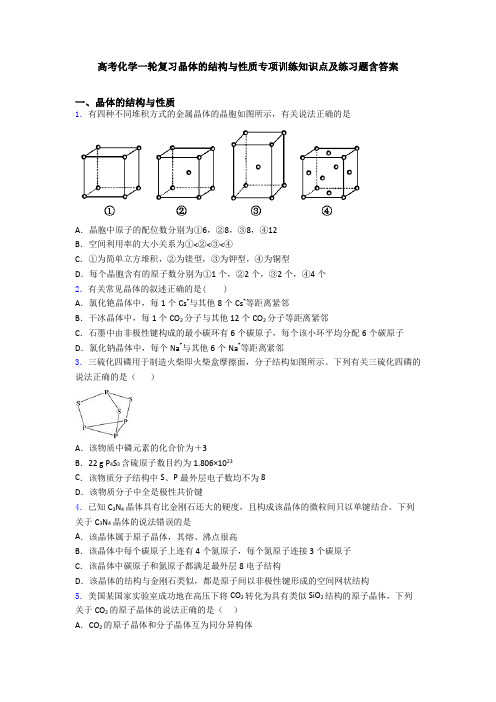
高考化学一轮复习晶体的结构与性质专项训练知识点及练习题含答案一、晶体的结构与性质1.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是A.晶胞中原子的配位数分别为①6,②8,③8,④12B.空间利用率的大小关系为①<②<③<④C.①为简单立方堆积,②为镁型,③为钾型,④为铜型D.每个晶胞含有的原子数分别为①1个,②2个,③2个,④4个2.有关常见晶体的叙述正确的是( )A.氯化铯晶体中,每1个Cs+与其他8个Cs+等距离紧邻B.干冰晶体中,每1个CO2分子与其他12个CO2分子等距离紧邻C.石墨中由非极性键构成的最小碳环有6个碳原子,每个该小环平均分配6个碳原子D.氯化钠晶体中,每个Na+与其他6个Na+等距离紧邻3.三硫化四磷用于制造火柴即火柴盒摩擦面,分子结构如图所示。
下列有关三硫化四磷的说法正确的是()A.该物质中磷元素的化合价为+3B.22 g P4S3含硫原子数目约为1.806×1023C.该物质分子结构中S、P最外层电子数均不为8D.该物质分子中全是极性共价键4.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。
下列关于C3N4晶体的说法错误的是A.该晶体属于原子晶体,其熔、沸点很高B.该晶体中每个碳原子上连有4个氮原子,每个氮原子连接3个碳原子C.该晶体中碳原子和氮原子都满足最外层8电子结构D.该晶体的结构与金刚石类似,都是原子间以非极性键形成的空间网状结构5.美国某国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体的说法正确的是()A.CO2的原子晶体和分子晶体互为同分异构体B.在一定条件下,CO2的原子晶体转化为分子晶体是物理变化C.CO2的原子晶体和分子晶体具有相同的物理性质D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与2个碳原子结合6.下列叙述正确的是A.离子晶体中,只存在离子健,不可能存在其它化学键B.可燃冰中甲烷分子与水分子之间存在氢键C.Na2O2、NaHSO4晶体中的阴、阳离子个数比均为12D.晶体熔点:金刚石>食盐>冰>干冰7.氟在自然界中常以CaF2的形式存在。
知识清单16 晶体结构与性质(教师版) 2025年高考化学一轮复习知识清单
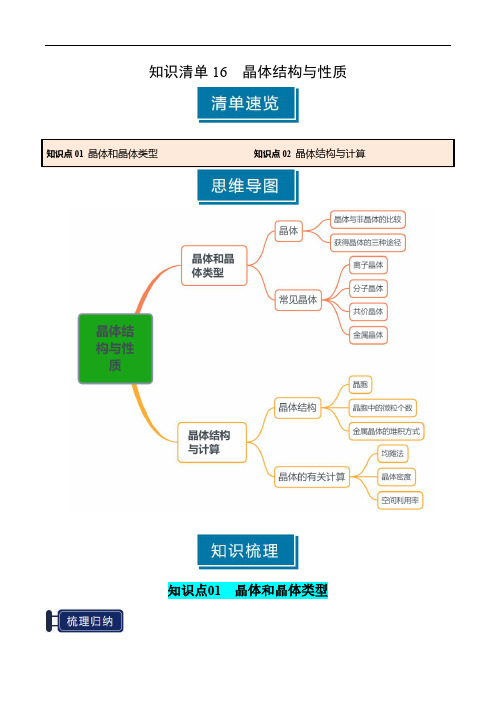
知识清单16晶体结构与性质知识点01晶体和晶体类型一、晶体1.晶体与非晶体的比较比较晶体非晶体结构特征结构微粒(原子、离子或分子)在三维空间里呈_周期性有序__排列结构微粒(原子、离子或分子)_无序__排列性质特征自范性_有___无__熔点_固定___不固定__异同表现_各向异性___无各向异性__实例水、NaCl、Fe玻璃、石蜡两者区别方法间接方法:测定其是否有固定的_熔点__科学方法:对固体进行_X-射线衍射__实验2.获得晶体的三种途径。
①熔融态物质凝固。
②气态物质冷却不经液态直接_凝固(凝华)__。
③溶质从溶液中析出。
3.非晶体、等离子体和液晶的比较聚集状态组成与结构特征主要性能非晶体内部微粒的排列呈现杂乱无章(长程无序,短程有序)的分布状态的固体某些非晶体合金强度和硬度高、耐腐蚀性强,非晶态硅对光的吸收系数大等离子体由电子、阳离子和电中性粒子组成,整体上呈电中性,带电离子能自由移动具有良好的导电性和流动性液晶内部分子的排列沿分子长轴方向呈现出有序的状态既具有液体的流动性、黏度、形变性,又具有晶体的导热性、光学性质等二、离子晶体1.离子晶体构成微粒_阴、阳离子__粒子间的相互作用力_离子键__方向性和饱和性没有方向性,没有饱和性离子键强弱阴、阳离子半径越小,所带电荷数越多,离子键越强。
硬度较大熔、沸点较高溶解性大多易溶于水等极性溶剂导电、导热性晶体不导电,水溶液或熔融态导电物质类别及举例金属氧化物(如K2O、Na2O)、强碱(如KOH、NaOH)、绝大部分盐(如NaCl)2.离子晶体的性质性质原因熔沸点离子晶体中有较强的离子键,熔化或升华时需消耗较多的能量。
所以离子晶体有较高的熔、沸点和难挥发性。
通常情况下,同种类型的离子晶体,离子半径越小,离子键越强,熔、沸点越高硬度硬而脆。
离子晶体表现出较高的硬度。
当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎导电性不导电,但熔融或溶于水后能导电。
高中化学人教版晶体结构与性质知识点总结

晶体结构与性质一、晶体常识1.晶体与非晶体(1)熔融态物质凝固。
(2)气态物质冷却不经液态直接凝固(凝华)。
(3)溶质从溶液中析出。
3.晶胞(1)概念:描述晶体结构的基本单元。
(2)晶体中晶胞的排列——无隙并置①无隙:相邻晶胞之间没有任何间隙。
②并置:所有晶胞平行排列、取向相同。
4.与晶体有关的计算晶体结构的计算常常涉及如下数据:晶体密度、N A、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。
解答这类题时,一要掌握晶体“均摊法”的原理,二要有扎实的立体几何知识,三要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
(1)“均摊法”原理晶胞中任意位置上的一个原子如果被n个晶胞所共有,则每个晶胞对这个原子分得的份额就是1n。
非平行六面体形晶胞中粒子数目的计算同样可用“均摊法”,其关键仍然是确定一个粒子为几个晶胞所共有。
例如,石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为13,那么一个六边形实际有6×13=2个碳原子。
又如,在六棱柱晶胞(如右图所示的MgB2晶胞)中,顶点上的原子为6个晶胞(同层3个,上层或下层3个)共有,面上的原子为2个晶胞共有,因此镁原子个数为12×16+2×12=3,硼原子个数为6。
(2)晶体微粒与M、ρ之间的关系若1个晶胞中含有x个微粒,则1 mol该晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);又1个晶胞的质量为ρa3g(a3为晶胞的体积),则1 mol晶胞的质量为ρa3N A g,因此有xM=ρa3N A。
5.四类晶体的比较类型比较分子晶体原子晶体金属晶体离子晶体构成粒子分子原子金属阳离子、自由电子阴、阳离子粒子间的相互作用力分子间作用力共价键金属键离子键硬度较小很大有的很大,有的很小较大熔、沸点较低很高有的很高,有的很低较高溶解性相似相溶难溶于任何溶剂常见溶剂难溶大多数易溶于水等极性溶剂导电、导热性一般不导电,溶于水后有的导电一般不具有导电性,个别为半导体电和热的良导体晶体不导电,水溶液或熔融态导电物质类别及举例所有非金属氢化物(如水、硫化氢)、部分非金属单质(如卤素X2)、部分非金属氧化物(如CO2、SO2)、几乎所有的酸、绝大多数有机物(有机盐除外)部分非金属单质(如金刚石、硅、晶体硼),部分非金属化合物(如SiC、SiO2)金属单质与合金(如Na、Al、Fe、青铜)金属氧化物(如K2O、Na2O)、强碱(如KOH、NaOH)、绝大部分盐(如NaCl)二、离子晶体1.离子晶体的晶格能(1)定义:气态离子形成1摩离子晶体释放的能量,通常取正值,单位:kJ·mol-1。
高考化学 一轮复习 物质结构与性质 第3讲 晶体结构与性质(选修3)

溶解性
相似相溶
难溶于任 何溶剂
常见溶剂 难溶
大多易溶 于水等极
性溶剂
一般不导
晶体 不导
导电、 电,溶于水 一般不具 电和热的 电,水溶液
传热性 后有的导 有导电性 良导体 或熔融态
电
导电
大多数非金 部分非金 金属氧化物
属单质、气态 属单质(如 物质 氢化物、酸、 金刚石、 金属单质 (如 K2O、 类别 非金属氧化 硅、晶体 与合金(如 Na2O)、强
A.BaTi8O12
B.BaTi4O6
C.BaTi2O4
D.BaTiO3
解析:选 D。Ba 在立方体的中心,完全属于该晶胞;Ti 处于
立方体的 8 个顶点,每个 Ti 为与之相连的 8 个立方体所共用,即
只有18属于该晶胞;O 处于立方体的 12 条棱的中点,每条棱为四
个立方体共用,故每个
O
只
有
1 4
考点二 四类晶体的组成和性质比较
1.四类晶体的比较
类型 分子晶体 原子晶体 金属晶体 离子晶体
比较
构成 粒子
分子
原子
金属阳 离子 、自 阴、阳离子 由电子
粒子间 范德华力
的相互 (某些含氢 共价键 金属键 离子键
作用力 键)
硬度
较小
很大
有的很大, 较
大
有的很小
熔、沸点 较低 很 高
有的很高, 较高
由题意知,该晶胞中含有12个 XY2 或 Y2X,设晶胞的边长为 a
cm,则有 ρ a3NA=12M,a= 3 2ρMNA,则晶体中两个距离最近的 X
之间的距离为
2
3
M 2ρNA
cm。
高考化学物质结构与性质讲解

高考化学物质结构与性质讲解在高考化学中,“物质结构与性质”这一板块可是非常重要的一部分。
它就像是一座神秘的科学城堡,里面藏着许多关于物质世界的秘密。
今天,咱们就一起来揭开这座城堡的神秘面纱,好好探索一下物质结构与性质的奇妙世界。
首先,咱们得搞清楚原子结构。
原子就像是一个小小的宇宙,原子核居于中心,就像太阳一样,而电子则围绕着原子核运动,就像行星绕着太阳转。
原子核由质子和中子组成,质子带正电,中子不带电。
而电子带负电,它们在不同的轨道上运动。
原子的核外电子排布可是有规律可循的。
我们有个叫“能层”的概念,能层就像是楼层,从低到高分别是 K、L、M、N 等。
每个能层又分成不同的能级,比如s、p、d、f 能级。
电子总是先填充能量较低的轨道,这就是所谓的“能量最低原理”。
比如说,1s 轨道填满了,才会去填 2s轨道。
接下来,咱们再聊聊化学键。
化学键就像是把原子们连接在一起的桥梁。
化学键主要有离子键、共价键和金属键。
离子键是由阴阳离子之间的静电作用形成的,一般存在于活泼金属和活泼非金属组成的化合物中。
而共价键呢,则是原子之间通过共用电子对形成的,像氢气、氧气这些分子就是通过共价键结合在一起的。
共价键又有不同的类型,比如极性共价键和非极性共价键。
如果两个原子吸引电子的能力不同,形成的就是极性共价键;如果两个原子吸引电子的能力相同,那就是非极性共价键。
然后是分子的结构和性质。
分子的形状可是多种多样的,这取决于原子之间的成键方式和原子的排列方式。
我们通过价层电子对互斥理论和杂化轨道理论来解释分子的空间结构。
比如说,甲烷分子是正四面体结构,这是因为碳原子发生了 sp3 杂化,形成了四个等价的杂化轨道,分别与四个氢原子成键。
再来说说晶体结构。
晶体是由原子、离子或分子在空间按一定规律周期性地排列形成的。
常见的晶体类型有离子晶体、原子晶体、分子晶体和金属晶体。
离子晶体的特点是硬度较大、熔点较高,比如氯化钠就是典型的离子晶体。
高考化学专项复习--晶体结构与性质(含答案解析)

高考化学专项复习--晶体结构与性质(含答案解析)1.[2021·辽宁卷]单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。
下列说法错误的是()A.S位于元素周期表p区B.该物质的化学式为H3SC.S位于H构成的八面体空隙中D.该晶体属于分子晶体2.[2021·湖北卷]某立方晶系的锑钾(SbK)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。
下列说法正确的是()A.该晶胞的体积为a3×10-36 cm3B.K和Sb原子数之比为3∶1C.与Sb最邻近的K原子数为4D.K和Sb之间的最短距离为a pm3.[2022·高三专项测试]关于晶体的下列说法正确的是()A.化学键都具有饱和性和方向性B.晶体中只要有阴离子,就一定有阳离子C.氢键具有方向性和饱和性,也属于一种化学键D.金属键由于无法描述其键长、键角,故不属于化学键4.下列关于晶体的说法中,不正确的是()①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性②含有金属阳离子的晶体一定是离子晶体③共价键可决定分子晶体的熔、沸点④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6。
A.①②③ B.②③④C.④⑤⑥ D.②③⑦5.下列有关离子晶体的数据大小比较不正确的是()A.熔点:NaF>MgF2>AlF3B.晶格能:NaF>NaCl>NaBrC.阴离子的配位数:CsCl>NaCl>CaF2D.硬度:MgO>CaO>BaO6.据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构。
2024届高考化学晶体结构与性质复习

2024届高考化学晶体结构与性质复习化学晶体结构与性质是高中化学中的一门重要知识,对于理解物质的结构以及性质具有重要的作用。
以下是关于高考化学晶体结构与性质的复习内容,总计1200字以上。
1.晶体的定义和特点晶体是由有序排列的原子、离子或分子组成的固体。
晶体具有一些特点:(1)具有明显的外形和规则的几何构型。
(2)具有阶梯状的层面结构。
(3)具有特定的折射、散射和衍射现象。
(4)可以通过两个平行面之间的距离和角度来描述其晶体结构。
2.晶体的基本结构类型晶体的基本结构类型包括简单晶体、离子晶体、共价晶体和金属晶体。
(1)简单晶体是由一种原子构成的晶体,如金刚石、石盐等。
(2)离子晶体是由正负离子构成的晶体,如氯化钠、碳酸钙等。
(3)共价晶体是由非金属原子之间的共价键构成的晶体,如硅酸盐、石英等。
(4)金属晶体是由金属原子排列而成的晶体,如铜、铁等。
3.晶体的晶格和晶胞晶格是指晶体中原子、离子或分子排列的规则几何模式,晶格由晶胞组成。
晶胞是晶格中最小的重复单位,是一个有限的几何体,通过平移来得到整个晶格。
4.晶体的结构描述方法(1)点阵法:在立方晶系中,晶体的分子、离子或原子通常占据立方点阵的平面上。
(2)分子间距和键长:描述晶体中分子间距和键长特征,分子间距和键长足以唯一确定晶体结构。
(3)空间对称元素:通过描述晶体中的对称元素,如镜面对称、旋转轴等来确定晶体结构。
(4)晶体的空间群:描述晶格的对称性,通过晶体的对称元素和晶格的对称性来确定晶体的空间群。
5.晶体的常见性质晶体的性质包括物理性质和化学性质:(1)物理性质:包括光学性质、热学性质、电学性质等。
(2)化学性质:包括晶体的溶解性、反应性等。
6.晶体的应用晶体具有很多重要的应用:(1)光学应用:晶体的光学性质使其在光学器件中有广泛的应用,如激光、光纤通信等。
(2)电子应用:晶体的电学性质使其在电子器件中有重要的应用,如晶体管、集成电路等。
(3)材料科学:晶体作为一种材料,具有独特的物理性质,广泛应用于材料科学领域,如半导体材料、催化剂等。
化学选修3晶体结构与性质知识点

化学选修3晶体结构与性质知识点晶体的特点为有规则的几何构型、有固定的熔点、各向异性。
晶胞是晶体结构的基本单位,有晶胞可确定化学式。
下面是店铺为你整理的化学选修3晶体结构与性质知识点,一起来看看吧。
晶体结构与性质知识点一、晶体固体可以分为两种存在形式:晶体和非晶体。
晶体的分布非常广泛,自然界的固体物质中,绝大多数是晶体。
气体、液体和非晶体在一定条件下也可转变为晶体。
晶体是经过结晶过程而形成的具有规则的几何外形的固体。
晶体中原子或分子在空间按一定规律周期性重复的排列,从而使晶体内部各个部分的宏观性质是相同的,而且具有固定的熔点和规则的几何外形。
二、晶体结构1.几种晶体的结构、性质比较2.几种典型的晶体结构:(1)NaCl晶体(如图1):每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,离子个数比为1:1。
(2)CsCl晶体(如图2):每个Cl-周围有8个Cs+,每个Cs+周围有8个Cl-;距离Cs+最近的且距离相等的Cs+有6个,距离每个Cl-最近的且距离相等的Cl-也有6个,Cs+和Cl-的离子个数比为1:1。
(3)金刚石(如图3):每个碳原子都被相邻的四个碳原子包围,以共价键结合成为正四面体结构并向空间发展,键角都是109o28',最小的碳环上有六个碳原子。
(4)石墨(如图4、5):层状结构,每一层内,碳原子以正六边形排列成平面的网状结构,每个正六边形平均拥有两个碳原子。
片层间存在范德华力,是混合型晶体。
熔点比金刚石高。
(5)干冰(如图6):分子晶体,每个CO2分子周围紧邻其他12个CO2分子。
晶体结构与性质习题1.要使金属晶体熔化必须破坏其中的金属键,金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,由此判断下列说法正确的是( )A.金属镁的熔点高于金属铝B.碱金属单质的熔、沸点从Li到Cs是逐渐升高的C.金属镁的硬度小于金属钙D.金属铝的硬度大于金属钠【答案】D【解析】试题分析:A.因为镁离子所带2个正电荷,而铝离子带3个正电荷,所以镁的金属键比铝弱,所以镁的熔点低于金属铝,故A错误;B.碱金属都属于金属晶体,从Li到Cs金属阳离子半径增大,对外层电子束缚能力减弱,金属键减弱,所以熔沸点降低,故B错误;C.因为镁离子的半径比钙离子小,所以镁的金属键比钙强,则镁的硬度大于金属钙,故C错误;D.因为镁离子所带2个正电荷,而钠离子带1个正电荷,所以镁的金属键比钠强,则铝的硬度大于金属钠,故D正确;故选D。
2020高考化学 考题 晶体结构与性质

晶体结构与性质1.硫和锌及其化合物用途广泛。
回答下列问题:(1)基态硫原子的价电子排布图为__________________。
(2)已知基态锌、铜的电离能如表所示:电离能/kJ·mol1I1I2Cu 746 1958Zn 906 1733由表格数据知,I2(Cu)>I2(Zn)的原因是____________________________________。
(3)H2O分子中的键长比H2S中的键长__________(填“长”或“短”)。
H2O分子的键角比H2S的键角大,其原因是____________________________________。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为__________________。
(5)噻吩()广泛应用于合成医药、农药、染料工业。
π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的①噻吩分子中的大π键可用符号nmπ,则噻吩分子中的大π键应表示为______________。
电子数(如苯分子中的大π键可表示为66②噻吩的沸点为84 ℃,吡咯()的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。
1 mol吡咯含__________mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。
已知:硫化锌晶体密度为d g·cm-3,N A代表阿伏加德罗常数的值,则Zn2+和S2-之间的最短核间距(x)为__________nm(用代数式表示)。
2.下图表示一些晶体中的某些结构,请回答下列问题:(1)代表金刚石的是(填编号字母,下同)_____,其中每个碳原子与_____个碳原子最近且距离相等。
(2)代表石墨的是_____,每个正六边形占有的碳原子数平均为_____个。
(3)代表NaCl 的是_________,每个Na+周围与它最近且距离相等的Cl-有_____个。
高考化学物质结构与性质考点

简单立方晶胞中,每个小球的配位数为6(C.N.=6)每 个小球处于它上、下、左、右、前、后6个小球围成一个八面 体。由于这种堆积方式的配位数很低,对大多数金属来说, 这是一种不稳定的结构。只有少数金属,如Po,采取这种堆 积方式。
c
a
b
aP
本页部分内容引自网络资源: 周坤.晶体结构(2017)
➢ 布拉维系晶胞
为什么没有“底心四方”“面心四方”“底心立方”这样的 晶胞形式?
➢晶体中原子的分数坐标
(0 (a,b,c)<1
OP=ax+by+cz
晶胞中各个原子的位置可用原子的分数 坐标表示。原子的分数坐标是指晶胞中的原 子坐标只能取分数或零。因为1即是0!
C-底心(C-face centred)
本页部分内容引自网络资源: 周坤.晶体结构(2017)
➢ 布拉维系晶胞
c
b a
mP
mC
单斜 monoclinic (P C) a≠b≠c α=γ = 9 0 ° , β≠90o
三斜anorthic(P) (triclinic) a≠b≠c α≠β≠γ ≠ 9 0 °
➢等径圆球的堆积二维模型
1
2
4
3
非密置层 C.N.=4
16
2
5
34
密置层 C.N.=6
➢等径圆球的堆积二维模型
划分出一个最小的平行四边形——二维晶胞——作研究对象
每个圆对晶胞的贡献为1/4,一个晶胞中含有1个圆
非密置层中圆的面堆积系数:
4 1 πr2
4 (2r)2
π 4
非密置层中圆只围成一种空穴,一个晶胞中,圆∶空穴=1∶1
将晶体中的微粒(分子、原子、离子)看作刚性小球在空间中由于 相互作用(范德华力、氢键、共价结合、离子性结合等)而进行堆积。
高考化学复习 化学键 晶体结构

魁夺市安身阳光实验学校高考化学复习化学键晶体结构一、理解离子键、共价键的含义。
理解极性键和非极性键。
了解极性分子和非极性分子。
了解分子间作用力。
初步了解氢键。
二、了解几种晶体类型(离子晶体、原子晶体、分子晶体、金属晶体)及其性质。
物质结构的理论是高考的热点之一。
要求理解1.化学键、离子键的概念2.共价键3.极性分子和非极性分子4.晶体的结构与性质5.化学键与分子间力的比较六、如何比较物质的熔、沸点1.由晶体结构来确定.首先分析物质所属的晶体类型,其次抓住决定同一类晶体熔、沸点高低的决定因素.①一般规律:原子晶体>离子晶体>分子晶体如:SiO2>NaCl>CO2(干冰)②同属原子晶体,一般键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.如:石>砂>晶体硅③同类型的离子晶体,离子电荷数越大,阴、阳离子核间距越小,则离子键越牢固,晶体的熔、沸点一般越高.如:MgO>NaCl④分子组成和结构相似的分子晶体,一般分子量越大,分子间作用力越强,晶体熔、沸点越高.如:F2<Cl2<Br2<I2⑤金属晶体:金属原子的价电子数越多,原子半径越小,金属键越强,熔、沸点越高.如:Na<Mg<Al2.根据物质在同条件下的状态不同.一般熔、沸点:固>液>气.如果常温下即为气态或液态的物质,其晶体应属分子晶体(Hg除外).如惰性气体,虽然构成物质的微粒为原子,但应看作为单原子分子.因为相互间的作用为范德华力,而并非共价键.1.(2008全国Ⅰ卷)下列化合物,按其品体的熔点由高到低排列正确的是()A.SiO2 CaCl CBr4 CF2 B.SiO2 CsCl CF4 CBr4C.CsCl SiO2 CBr4 CF4 D.CF4 CBr4 CsCl SiO2解析:物质的熔点的高低与晶体的类型有关,一般来说:原子晶体>离子晶体>分子晶体;即:SiO2>CsCl>CBr4、CF4。
当晶体的类型相同时,原子晶体与原子半径有关;离子晶体与离子的半径和离子所带的电荷有关;分子晶体当组成和结构相似时,与相对分子质量的大小有关,一般来说,相对分子质量大的,熔点高,即CBr4>CF4。
高考化学晶体的结构与性质专项训练知识归纳总结含答案

高考化学晶体的结构与性质专项训练知识归纳总结含答案一、晶体的结构与性质1.下列有关晶体的说法中正确的是A.原子晶体中只存在非极性共价键B.稀有气体形成的晶体属于原子晶体C.在晶体中有阳离子的同时不一定有阴离子D.非金属氧化物固态时都属于分子晶体2.下列晶体中,化学键种类相同,晶体类型也相同的是A.SO2与 SiO2B.CO2与 H2O C.金刚石与 C60D.SiCl4与 KCl3.下列说法中错误的是()A.离子晶体在熔化状态下能导电B.在晶体中只要有阴离子就一定有阳离子C.原子晶体中一定有非极性共价键D.分子晶体中不一定含有共价键4.纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。
假设某纳米颗粒的大小和形状恰好与某晶体晶胞的大小和形状(如图)相同,则这种纳米颗粒的表面粒子数占总粒子数的百分数为()A.87.5% B.88.9% C.96.3% D.100%5.金刚石的熔点为a℃,晶体硅的熔点为b℃,足球烯(分子式为C)的熔点为c℃,a、b、c的大小关系是()A.a>b>c B.b>a>c C.c>a>b D.c>b>a6.根据下列叙述,推测可能属于金属晶体的是()A.由分子间作用力结合而成,熔点很低B.固体或熔融状态下易导电,熔点在1000℃左右C.由共价键结合成空间网状结构,熔点很高D.固体不导电,熔融状态下亦不导电,但溶于水后能导电7.图甲和图乙表示的是元素的某种性质随原子序数的变化。
下列说法正确的是( )A .图甲可能表示的是元素原子的第一电离能随原子序数的变化关系B .图甲可能表示的是元素单质的熔点随原子序数的变化关系 C .图乙可能表示的是元素原子的半径随原子序数的变化关系 D .图乙不可能表示同族元素的电负性随原子序数的变化关系8.下列有关原子晶体的叙述错误的是( )A .原子晶体中,原子不遵循紧密堆积原理B .原子晶体具有空间网状结构C .原子晶体中不存在独立的分子D .原子晶体熔化时不破坏共价键 9.在某晶体中,与某一种微粒x 距离最近且等距离的另一种微粒y 所围成的空间构型为正八面体型(如图)。
高二化学选修晶体结构与性质全章

钠、锌晶胞都是:8×1/8+1=2; 碘:(8×1/8+6×1/2)×2=8; 金刚石:8×1/8+6×1/2+4=8。
◆
典例分析 例:2001年报道的硼和镁形成的化合物刷新了 金属化合物超导温度的最高记录。如图所示的是 该化合物的晶体结构单元:镁原子间形成正六棱 柱,且棱柱的上下底面还各有1个镁原子,6个硼 原子位于棱柱内。则该化合物的化学式可表示为
◆
6、图是超导化合物一钙钛矿晶体中最小重复单元(晶 胞)的结构.请回答: (1)该化合物的化学式为_C_a_T_i_O_3_. (2)在该化合物晶体中,与某个钛离 子距离最近且相等的其他钛离子共
有____6______个.
(3)设该化合物的相对分子质量为M, 密度为 ag / cm3 阿伏加德罗常数为
氧(O2)的晶体结构
碳60的晶胞
(与每个分子距离最近的相同分子共有12个 )
干冰的晶体结构图
分子的密堆积
(与CO2分子距离最近的 CO2分子共有12个 )
冰中1个水分子周围有4个水分子
冰的结构
4、晶体结构特征
(1)密堆积 只有范德华力,无分子间氢键——分子
密堆积。这类晶体每个分子周围一般有12 个紧邻的分子,如:C60、干冰 、I2、O2。 (2)非密堆积
NA,则晶体中钙离子与钛离子之间 的最短距离为_______.
7、如图是CsCl晶体的晶胞(晶体中最小的重复单元) 已知晶体中2个最近的Cs+核间距离为acm,氯化铯 的相对分子质量为M,NA为阿佛加德
罗常数,则CsCl晶体的密度为
(单位:克/cm3)
A、8M/a3NA C、M/a3NA
第3章 晶体结构与性质-高中化学全册必背章节知识清单(新人教版选择性必修2)(教师版)

第三章晶体结构与性质第一节物质的聚集状态与晶体的常识一、物质的聚集状态1、20世纪前,人们以为分子是所有化学物质能够保持其性质的最小粒子,物质固、液、气三态的相互转化只是分子间距离发生了变化。
2、20世纪初,通过X射线衍射等实验手段,发现许多常见的晶体中并无分子,如氯化钠、石墨、二氧化硅、金刚石以及各种金属等。
3、气态和液态物质不一定都是由分子构成。
如等离子体是由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的气态物质;离子液体是熔点不高的仅由离子组成的液体物质。
4、其他物质聚集状态,如晶态、非晶态、塑晶态、液晶态等。
二、晶体与非晶体1、晶体与非晶体的本质差异2(1)实验探究加热时,烧杯内产生大量紫色气体,没有出现液态的碘,停止加热,烧杯内的紫色气体渐渐消褪,最后消失,表面皿底部出现紫黑色晶体颗粒在烧杯底部慢慢析出立方体的无色晶体颗粒(2)获得晶体的三条途径 ① 熔融态 物质凝固。
② 气态 物质冷却不经液态直接 凝固 (凝华)。
③ 溶质 从溶液中析出。
3、晶体的特性(1)自范性:晶体能自发地呈现 多面体 外形的性质。
(2)各向异性:晶体在不同方向上表现出不同的 物理 性质。
(3)固定的熔点。
4、晶体与非晶体的测定方法三、晶胞 1、概念描述晶体结构的基本单元。
2、晶胞与晶体的关系一般来说,晶胞都是 平行六面 体,整块晶体可以看作是数量巨大的晶胞“ 无隙 并置”而成。
(1)“无隙”是指相邻晶胞之间 无任何 间隙。
(2)“并置”是指所有晶胞都是 平行 排列的,取向 相同 。
(3)所有晶胞的 形状 及其内部的原子 种类、个数 及几何排列是完全相同的。
3、晶胞中粒子数目的计算 (1)铜晶胞①位于顶角上的铜原子为 8 个晶胞共有。
②位于面心上的铜原子为 2 个晶胞共有。
因此晶体铜中完全属于某一晶胞的铜原子数是8×18+6×12= 4 。
(2)NaCl 晶胞①Cl-位于顶点和面心,共有 4 个。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考点15 晶体结构与性质
考点聚焦
1.了解晶体与非晶体的区别
2.了解常见晶体类型及不同类型晶体的主要性质
3
.掌握关于晶胞的简单计算
知识梳理
一、晶体特征及分类:
(1)晶体是内部微粒(原子、离子、分子)在空间按一定规则做构成的物质,晶体区别于非晶体的三个特征是:具有的几何外形,各向和具有固定的。
(2)根据晶体内部微粒的的微粒间的不同可以将晶体分为通过离子键形成的晶体,以金属键基本作用形成的晶体,通过价键形成的晶体和通过分子间相互作用形成的晶体。
(3)常见晶体类型比较:
二、晶体的堆积模型
分子晶体中分子间尽可能采用紧密排列方式,分子的排列方式与其形状的关;离子晶体可视为不等径圆球的密堆积,离子晶体中正负离子的配位数主要由正负电荷的(几何因素)、正负电荷的 (电荷因素)以及离子键的纯粹程度(键性因素)决定;金属晶体的结构可以归结为等径圆球的堆积,可分为Po的简单立方堆积、型、型和型。
三、晶胞
1.概念:描述叫做晶胞;整块晶体由晶胞“无隙并置”而成;晶胞①中Ti、O、Ca原子数分别为、、;晶胞②中A、B、C、D原子数分别为、、、。
晶体类型
类型
比较
分子晶体原子晶体离子晶体金属晶体
构成晶体
微粒
形成晶体微
粒间作用力
作用力大小
决定因素
物
理
性
质
熔沸点
硬度
导电性
传热性
延展性
溶解性
典型实例P4、干冰、硫金刚石、SiO2NaCl、KOH、NH4Cl 金属单质
①②
2.常见晶体的结构
在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,这5个碳原子形成的是结构,两个碳碳单键的键角为,其中的碳原子采取杂化,金刚石晶体中C原子数与C-C键数之比为,晶体中最小的环上上的碳原子数为;石墨晶体中C原子数与C-C键数之比为;N aCl晶体中Na+的配位数为,Cl-的配位数为,每个Na+的周围距离最近且相等的Na+的个数为,CsCl晶体中Cs+的配位数为,Cl-的配位数为,每个Cs+的周围距离最近且相等的Cs+的个数为;二氧化硅晶体中每个硅原子与个氧原子相连,在二氧化硅晶体中最小的环中有个
原子,1mol二氧化硅晶体中,Si-O的数目为。
思考:右图是二氧化硅晶体的一部分,立方体体心的黑点表示一个硅原子,
在图中画出与硅原子相连的氧原子所在的位置。
三、晶体熔、沸点高低比较
(1)不同类型的晶体:一般而言,熔、沸点高低顺序为原子晶体>离子晶体和金属晶体>分子晶体
(2)同类晶体:
①原子晶体的熔、沸点取决于共价键的键长和键能,键长越短、键越大,熔、沸点越高,如金刚石>金刚砂>晶体硅
②离子晶体的熔、沸点取决于离子键的强弱,通常离子半径越小、离子所带电荷数大,离子键越强,熔、沸点高,如KF>KCl>KBr、NaCl>KCl;
晶格能是指形成1摩离子晶体释放的能量,通常取正值,晶格能越大,形成的离子晶体越,且熔沸点
③分子晶体的熔、沸点取决于分子间作用力的大小,通常分子极性越强、相对分子质量越大,分子间作用力越强,熔、沸越高,有氢键的分子晶体,还要考虑氢键的强弱
④同类金属晶体中,金属离子半径越小,阳离子带电荷数越高,金属键越强,熔、沸点越高,如Li>Na>K, Na<Mg<Al
试题枚举
【例1】晶体具有各向异性。
如蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨在与层垂直的方向上的导电率与层平行的方向上的导电率1∕104。
晶体的各向异性主要表现在是:()
①硬度②导热性③导电性④光学性质
A.①③
B.②④
C.①②③
D.①②③④
答案:D
【例2】下列属于分子晶体的一组物质是
A. CaO、NO、CO B .CC l4、H2O2、He
C .CO2、SO2、NaCl
D .CH4、O2、Na2O
解析:固态金属是金属晶体;大多数的盐、碱和金属氧化物是离子晶体;熟记常见的原子晶体;其它常见物质大多是分子晶体
答案:B。
【例3】下列性质符合分子晶体的是
A . 熔点1070℃,易熔于水,水溶液能导电
B. 熔点是10.31℃,液体不导电,水溶液能导电
C. 熔点97.81℃,质软,能导电,密度是0.97g/cm3
D. 熔点973℃,熔化时能导电,水溶液也能导电
解析:A、D中的物质熔点较高,D中物质熔化时能导电,都是离子化合物;C中物质固态能导电,应为金属单质
答案:B
【例4】下列大小关系正确的是()
A.晶格能:NaCl<NaBr
B.硬度:MgO>CaO
C.熔点:NaI>NaBr
D.熔沸点:CO2>NaCl
解析:离子半径 Cl-<Br-离子键 NaCl>NaBr,晶格能NaCl>NaBr,A项错误;MgO、CaO 均为离子晶体,离子半径Mg2+<Ca2+,MgO中离子键强,键能大,晶格能大,硬度大,B正确;C 类似;D中CO2分子晶体,NaCl是离子晶体,熔沸点:CO2<NaCl
答案:B
【例5】金属能导电的原因是
A. 金属晶体中金属阳离子与自由电子间的相互作用较弱
B.金属晶体中的自由电子在外加电场作用下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
解析:金属晶体中金属阳离子与自由电子间的相互作用属于静电作用,是强烈的相互作用,A错误;金属晶体在外加电场作用下电子定向移动,不会失去。
答案:B
【例6】现有甲、乙、丙、丁四种晶胞(如图所示),可推知:甲晶体中A与B的离子个数比为;乙晶体的化学式为;丙晶体的化学式为______;丁晶体的化学式为______。
解析:立方晶胞体心的微粒一个晶胞所有,面心的微粒为两个晶胞是共有,每个微粒有1/2属于该晶胞,棱边的微粒为4个晶胞共有,每个微粒有1/4属于该晶胞,顶点的微粒为个8晶胞共有,每个微粒有1/8属于该晶胞。
答案:1∶1 C2D EF XY3Z。
