食醋中总酸量的测定图文稿
食醋中总酸含量的测定ppt课件

22
6、用中和滴定法测定某烧碱的纯度。 ⑴配制待测液:将1.7g含有少量杂质(不与盐酸反应)的固
体烧碱样品配制成200mL溶液,所用的主要仪器有 _______烧_杯__、__2_0_0m__L_容__量_瓶__、__玻__璃_棒__、__药__匙_、__滴__管__。 ⑵滴定:①盛装0.20mol/L盐酸标准液应该用____酸___式滴 定管,滴定管洗涤干净的标准是_滴__定__管_内__壁__上_____ ____________的__水__均_匀__了__,__既_不__聚__成_水__滴__也__不_成__股__流_。下 ②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过 程中两眼应该注视__锥_形__瓶__内__溶_液__的__颜__色_变_,化滴定终点时,
m/M = c(NaOH)×V(NaOH)
14
小结
仪器的洗涤
实验准备
★NaOH标准溶液配制
一 、
溶液的装配
实
验
中和滴定
指示剂的选择
方
滴定与记录
案
数据处理与结论
数据处理
误差分析
15
注意事项
食醋的 选择
1.白醋:效果较好 2.香醋:稀释10倍 3.陈醋: 颜色很深
消除CO2对 实验的影响
配制NaOH溶液和稀释食醋的蒸馏水 在实验前应加热煮沸2~3分钟,以 尽可能除去溶解的CO2,并快速冷却 至室温。
11
三、实验数据的处理:
m(CH3COOH) = c(NaOH)·V(NaOH)·M (CH3COOH) 100mL食醋中所含醋酸的质量为: m′(CH3COOH) = c(NaOH)·V(NaOH)· M(CH3COOH)× ×
食醋总酸度的测定ppt课件

酸式滴定管(玻璃旋塞):用于盛放酸性溶液、
中性
和氧化性溶液。
碱式滴定管(橡皮管+玻璃珠):用于盛放碱性和 无氧化性溶液。
酸式滴定管的玻璃活塞
碱式滴定管的玻璃珠
使用前准备
使用前检查是否漏水,酸式管活塞转动是否灵活,
涂凡士林;碱式管更换胶皮管或玻璃球; 洗涤时要求管壁湿润洁净,不挂水珠; 用待装液润洗2~3次,每次约10mL; 装液至0.00刻度以上; 排气泡; 调节初读数为0.00,或近0的任一刻度,以减小体
食醋总酸度的 测定
实验目的
1、掌握食醋总酸度测定的原理和方法; 2、掌握强碱滴定弱酸的滴定过程、突跃范围及
指示剂的选择原理。
实验原理
食醋是混合酸,其主要成分是HAc(Ka=1.8×10-5,CKa>10-5 ),
HAc NaOH NaAc H O 2
计量点时,溶液pH约为8.72,选用酚酞作指示剂,滴定至微红色。
端深入瓶口约1cm,同一方向圆周运动,边滴边摇动;
逐滴连续滴加,临近滴定终点时,使液滴悬而未落, 轻
碰锥形瓶壁,即加半滴,用蒸馏水冲下或用溶液涮下;
滴定至终点后,将滴定管从架上取下,用右手大拇指和
食指捏住无刻度处,保持垂直,视线与凹液面底部平行 (深色溶液读两侧最高点),数值保留两位小数;
滴定结束后,滴定管内剩余溶液应弃去,洗净滴定管, 并误差。
滴定操作
酸式滴定管:左手无名指和小指向手心弯曲,其余三
指,拇指在前,食指、中指在后,轻扣活塞; 碱式滴定管:左手无名指及小指夹住尖嘴管,拇指与 食指捏乳胶管,使玻璃球向手心移动,停止时,先松 拇指和食指;
食醋总酸含量的测定ppt5 苏教版

交流与讨论 2)如果滴定的终点没有控制好,即氢氧化钠 滴加过量,溶液显红色,你有没有补救的 办法?
交流与讨论 3)为什么要预先用少量待装溶液润洗滴定管 3次?锥形瓶是否用稀食醋溶液润洗? 4)如果要测定食醋的总酸含量,但无酸式滴 定管,可用什么玻璃仪器来代替?该仪器 是否要用待装溶液润洗3次?
拓展课题:配制并标定 NaOH溶液浓度
4.对于容积为25 mL的量筒和酸式滴定管的 刻度,说法正确的是 C A. 最上方刻度都是25; B. B. 量筒最下方刻度是0; C. 酸式滴定管最下方刻度是25; D. 量筒最上方刻度是25
交流与讨论 5、下列操作会导致待测食醋总酸量偏低的是 A、酸式滴定管用蒸馏水洗过后,未用食醋溶 液润洗 B、配制碱液时,称量后固体吸湿 C、碱式滴定管滴定前平视,滴定后仰视 D、滴定过程中不慎将锥形瓶中的少量食醋液 体摇出 E、酸式滴定管取样前有气泡,取样后气泡消 失
常见的移液管 移液管:标有温度和容量
实验中移液管的操作
用途: 准确移取一定体积的液体 操作: 洗涤、润洗、移液、洗涤干净 注意事项: 1.润洗2-3次 2.洗耳球吸取操作 3.放液时,容器倾斜,移液管垂直,使尖 嘴与接收容器内壁接触
实验中容量瓶的操作
• 常见规格:100mL、250mL、500mL、1000mL • 操作步骤: 洗涤、检漏、称量、溶解、转移、洗涤、稀释、定容、 摇匀 • 注意事项: 1.玻棒引流,玻棒位置 2.胶头滴管定容 3.视线造成的误差
食醋的总酸含量
• 食醋的总酸含量是指每100mL食醋中含酸 (以醋酸计)的质量,也称食醋的酸度。 • 国家标准规定酿造食醋总酸含量不得低于 3.5g/100mL.
问题探讨
1、如何测定食醋的总酸含量? 利用滴定分析法,用已知浓度的氢氧化钠溶液 滴定待测食醋样品溶液
食醋中总酸含量的测定

食醋中总酸含量的测定
《食醋中总酸含量的测定》
嘿,同学们!你们知道吗?食醋里的学问可大啦!今天咱们就来聊聊食醋中总酸含量的测定。
有一天上科学课,老师突然神秘兮兮地拿出一瓶食醋,问我们:“你们知道这瓶食醋里到底有多少酸吗?”大家都一脸茫然,摇摇头。
老师笑着说:“那咱们今天就一起来搞清楚!”
老师先给我们介绍了一堆仪器,什么滴定管啦,容量瓶啦,听得我脑袋都晕乎乎的。
我心里直犯嘀咕:“这可真复杂,能弄明白吗?”
然后老师开始一步一步地教我们怎么做实验。
先把食醋小心翼翼地倒进容量瓶里,那认真的样子,就好像在对待一件超级珍贵的宝贝。
我在旁边看着,手都痒痒了,好想自己动手试试。
我旁边的小明可着急了,不停地问:“老师,什么时候轮到我呀?”老师笑着说:“别着急,一个一个来。
”
终于轮到我操作啦!我紧张得手都有点抖,心里像揣了只小兔子,怦怦直跳。
我慢慢地把标准溶液滴进滴定管里,眼睛紧紧地盯着刻度,生怕出错。
这时候,同桌小红在旁边给我加油:“加油加油,你一定行的!”我深吸一口气,继续专注地做实验。
经过一番努力,我们终于得出了结果。
哎呀,这过程可不轻松啊!
这测定食醋中总酸含量的实验,就像一场刺激的冒险!我们在科学的海洋里探索,寻找着答案。
这不就像我们在生活中,努力去解开一个个谜团吗?
通过这次实验,我明白了科学可不是随便玩玩的,需要我们认真、细心,还得有耐心。
只有这样,我们才能发现那些隐藏在生活中的小秘密。
所以呀,以后遇到问题,咱们可不能轻易放弃,要像这次实验一样,坚持到底,才能找到答案!。
食醋总酸含量的测定完美版PPT

定量分析实验的一般思路:
提出问题
分析问题
提出可能的方案
优化选择
设计可行 的方案
动手实验
数据记录 和处理
误差分析
交流与讨论:如何选择指示剂?
一、知识预备 3、指示剂的选择
根据滴定终点时溶液的酸碱性来选择
• 强酸强碱滴定:酚酞溶液、甲基橙 • 强酸滴定弱碱: 甲基橙 • 强碱滴定弱酸:酚酞
一、知识预备
4、移液管的使用
• 常见移液管:标有温度和容量
• 用途:准确移取一定体积的液体
• •
操注意作事:项洗:涤、润洗、移液、洗涤干净
在滴定分析中,要设法减少读数的误差。 00 ml左右,测定误差较小。
滴定管是一种精确仪器,量取2.00ml的食醋, 根据滴定终点时溶液的酸碱性来选择
1000mol·L-1 NaOH溶液滴定0.
00ml左误右,应差量取还食醋2是. 比较大的。为了提高实验的精确度, 往往使消耗标准液的体积和量取待测液的体积 相当。所以要将食醋稀释10倍。
酸碱滴定时选用的指示剂
指示剂
变色范围
酚酞
8.0—10.0
甲基橙
3.1—4.4
颜色变化
一、知识预备
3、指示剂的选择
根据滴定终点时溶液的酸碱性来选择
中和滴定曲线
pH
12
10
8 酚酞
PH突变范围
6
4 甲基橙
2
0 10 20 30 40 V(NaOH)mL
氢氧化钠滴定醋酸
滴定突跃:7.74—9.70 指示剂选择:酚酞
食醋总酸含量的平均值(g/100mL)
《实验3-6 食醋中总酸量的测定》PPT课件(部级优课)

人教版高中化学(选修6)
实验3―6:食醋中总酸量的测定
小组活动1 学习小组成员拍摄的食醋图片。
食醋的成分简介
1 mol
1 mol
c测 V测
c标 V标
c 测
c标 V标 V
测
食醋原液浓度为c测
10 c标 V标 V测
食醋总酸量=
10
c标 V测
V标
0.1L
60g
mol1
=
60 c标 V标 (单位为g V测
/ 100mL)
若待测液体积为 20.00mL,则食醋总酸量 = 3c标V标(单位为g / 100mL)
60 g
22.4 L
x
x
60 V
22.4
g
V(折合标况)
x 值即为食醋中总酸量。
第三小组实验方案设计:
重量法
取100 mL的食醋于烧杯中,加入已准确称量且足
量的CaCO3粉末m1g,充分反应后过滤、洗涤、烘干、 称量,得到剩余CaCO3粉末质量为m2g,然后代入方程 式中进行计算:
CaCO3 + 2CH3COOH== (CH3COO)2Ca + H2O + CO2↑
一、主要成分 食醋的主要成分是醋酸,化学名称是乙酸。 1.分子式: C2H4O2 2.结构简式:CH3COOH 3.官能团: -COOH 4.主要化学性质:(1).体现弱酸性;(2).发生酯化反应
食醋的成分简介
二、其他成分
酿造食醋主要是以粮食为原料经发酵制得。
食用醋酸总酸量测定-实验报告范文模板食醋总酸量的测定

食用醋酸总酸量测定-实验报告范文模板食醋总酸量的测定一、实验目的1.学习碱溶液浓度的标定方法。
2.进一步练习滴定操作及天平减量法称量。
3.学会用标准溶液来测定未知物含量。
4.熟悉移液管、吸量管和容量瓶的使用,巩固滴定操作。
二、实验原理1.常用于标定碱的基准物质有邻苯二甲酸氢钾、草酸等。
本实验选用邻苯二甲酸氢钾作基准物,其反应为KHC8H4O4+NaOH=KNaC8H4O4+H2O由于产物是弱碱,可选用酚酞作指示剂。
2.醋酸(CH3COOH,简记为HAc)为一元弱酸,解离常数Ka=1.8某10 -5,可用NaOH标准溶液直接滴定,滴定时用酚酞作指示剂。
食用醋酸中酸的主要成分为醋酸,但也可能含有少量其他的酸,所以测定的是总酸量,测定结果用CHAc(g·L-1)表示。
三、主要试剂NaOH(AR),邻苯二甲酸氢钾(AR),酚酞指示剂,食用醋酸四、实验步骤(可用简洁的文字、箭头或框图等表示,自己整理,更富有创意)1.0.2mol·L-1NaOH溶液浓度的标定减量法准确称取已烘干的邻苯二甲酸氢钾三份,每份重形瓶中,各加水50mL,温热使之溶解,冷却后,加入1~2滴酚酞指示剂,用0.2mol·L-1NaOH溶液滴定至呈现微红色(30不褪色),即为终点。
用一清洁的25mL移液管吸取25.00mL试液于250mL锥形瓶中,加入酚酞指示剂1~2滴,用0.2mol·L-1NaOH溶液滴定至溶液恰好出现微红色,于半分钟内不褪色,即为终点。
平行测定3次。
根据NaOH标准溶液的浓度和滴定时消耗的体积,计算醋酸中的总酸量。
五、结果记录与数据处理表1NaOH标准溶液的标定滴定序号123KHC8H4O4质量(g)NaOH标准溶液初读数V1(mL)NaOH标准溶液末读数V2(mL)NaOH标准溶液用量V(mL)测定浓度(molL-1)NaOH标准溶液平均浓度(molL-1)相对平均偏差表2滴定序号123醋酸试液体积(mL)NaOH标准溶液精确浓度(molL-1)NaOH标准溶液初读数V1(mL)NaOH标准溶液末读数V2(mL)NaOH标准溶液用量V(mL)个别测定值醋酸总酸量平均值CHAc(g·L-1)相对平均偏差六、讨论与心得(可写实验体会、成功经验、失败教训、改进设想、注意事项等。
食醋中总酸度的测定实验报告数据

食醋中总酸度的测定实验报告数据一、实验目的1.学习用氢氧化钠溶液滴定醋酸的原理;2.用酸碱滴定法测定醋酸中总酸含量,学习用化学定量分析法解决实际问题。
二、实验原理醋酸中含醋酸(HAc)3%~5%,此外还含有其他有机酸,用氢氧化钠溶液滴定时,实际测出的是总酸量,测定结果表示用醋酸表示。
与NaOH溶液反应的方程式如下:NaOH+CH3COOH=CH3COONa+H2OnNaOH+HnA(有机酸)=NanAc+nH2O由于是强碱滴定弱酸,理论上化学计量点的pH在8.7左右,因此选择酚酞指示剂,滴定至出现微红色30s不褪色即为滴定终点。
根据滴定消耗NaOH溶液的体积和浓度,计算食醋样品中总酸含量。
三、实验用品0.1mol/LNaOH溶液、0.1%酚酞指示剂溶液、白醋。
锥形瓶、容量瓶、移液管、滴定管、洗耳球。
四、实验内容及步骤1.配制待测食醋溶液用25mL移液管移取25.00mL食醋,于250mL容量瓶中稀释至刻度,摇匀。
2.将0.1mol/LNaOH溶液转入滴定管中将滴定管洗净后,用氢氧化钠溶液润洗滴定管3次,每次用溶液3-4mL。
排除气泡,调节液面位于“0”刻度线以下。
静置,读取滴定管读数,记为氢氧化钠溶液体积初读数。
3.待测食醋溶液的测定用25mL移液管移取25.00mL食醋待测溶液于250mL洗净的锥形瓶中,加入2滴酚酞指示剂溶液,逐滴加入氢氧化钠溶液,边滴边摇,在临近滴定终点时,减慢滴定速度,当溶液的粉红色在30s内不褪色时,即为滴定终点。
静置后读取滴定管读数,记为氢氧化钠溶液体积终读数。
4.数据记录及处理氢氧化钠溶液测定食醋数据记录五、问题与讨论1.稀释食醋所用的去离子水为什么要除CO2?如何去除?2.为何选用白醋为测定样品?若选有颜色的食醋,应当如何测定?。
食醋中总酸量的测定_3
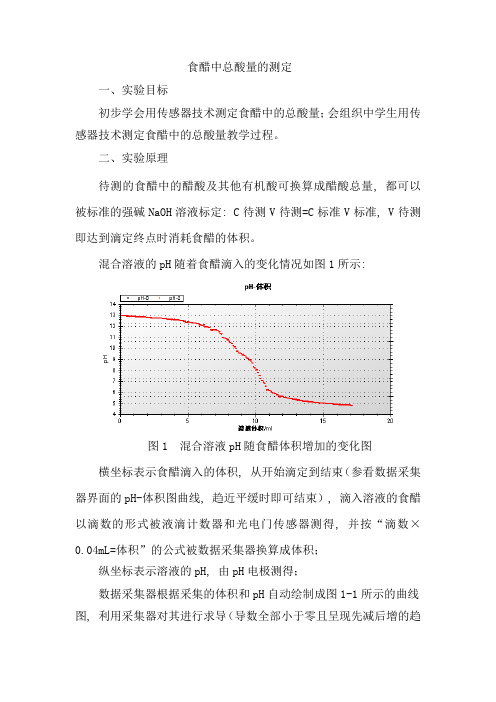
食醋中总酸量的测定一、实验目标初步学会用传感器技术测定食醋中的总酸量;会组织中学生用传感器技术测定食醋中的总酸量教学过程。
二、实验原理待测的食醋中的醋酸及其他有机酸可换算成醋酸总量, 都可以被标准的强碱NaOH溶液标定: C待测V待测=C标准V标准, V待测即达到滴定终点时消耗食醋的体积。
混合溶液的pH随着食醋滴入的变化情况如图1所示:图1 混合溶液pH随食醋体积增加的变化图横坐标表示食醋滴入的体积, 从开始滴定到结束(参看数据采集器界面的pH-体积图曲线, 趋近平缓时即可结束), 滴入溶液的食醋以滴数的形式被液滴计数器和光电门传感器测得, 并按“滴数×0.04mL=体积”的公式被数据采集器换算成体积;纵坐标表示溶液的pH, 由pH电极测得;数据采集器根据采集的体积和pH自动绘制成图1-1所示的曲线图, 利用采集器对其进行求导(导数全部小于零且呈现先减后增的趋势), 找出导数最小值处即pH发生突跃点, 即滴定终点, 此点对应的横坐标食醋体积即V待测, 代入公式C待测=C标准V标准/V待测可得食醋中的总酸量。
三、仪器与药品仪器: pH传感器, 光电门传感器, 液滴计数器, 数据采集器, 电磁搅拌器, 50mL酸式滴定管, 铁架台, 250mL烧杯, 量筒;药品:有色食醋原液, 0.1mol/LNaOH溶液, 去CO2的蒸馏水。
实验装置:(1)电源开关键(2)重启键(3)电源指示灯(4)传感器指示灯(5)传感器接口图2 实验装置图图3 数据采集器四、实验操作过程1.设备连接按要测的物理量分, 本实验的设备连接课分为: 测食醋体积部分、测溶液pH部分。
测食醋体积部分: 如图2示, 分别将酸式滴定管和液滴计数器固定在铁架台上。
(注意酸式滴定管一定要垂直桌面, 液滴计数器要平, 这样食醋液滴下的时候正好挡住液滴计数器内的小孔, 才能被光电门传感器感知信号并计数成功。
)然后依次连接起液滴计数器和光电门传感器, 光电门传感器和连接导线, 再将连接导线插到数据采集器的USB接口上。
食醋总酸含量的测定完整版课件

滴定终点指示剂的选择
1. 常用指示剂的变色范围
酸色 pH 中间色 pH 碱色
甲基橙 甲基红
红色 3.1 橙色 红色 4.4 橙色
4.4 黄色 6.2 黄色
酚 酞 无色 8.2 浅红色 10.0 红色
2. 指示剂的选择原则
(1)指示剂的pH变色范围尽可能接近中和时的pH (2)颜色变化明显(因此不可用石蕊)
3. 常用中和滴定指示剂
酚酞
甲基橙
思考:1.碘水滴 定硫代硫酸钠 溶液 ? 2.高锰酸钾溶液 滴定草酸溶液 ?
【课堂热身】
1.已知常温常压下,饱和CO2溶液的pH为3.9,当用盐酸滴定NaHCO3溶液时 ,选取指示剂及终点时溶液颜色变化正确的是
A、石蕊 蓝变红
B、酚酞 红色变无
C、甲基橙 橙变黄
D、甲基橙 黄变橙
4.误差分析
已知 c(标)×v(标)
读数
c(待)=
v(待)
已知
用已知浓度的盐酸滴定未知浓度的NaOH溶液 (1)锥形瓶用蒸馏水冲洗后,再用待测液润洗,使滴定结果_偏__高__。
(2)滴定前酸式滴定管尖嘴处有气泡未排出,滴定后气泡定前仰视滴定管刻度线,滴定终点俯视刻度线,使滴定结果_偏__低__
A.NaOH与盐酸恰好完全反应时,pH=7 B.选择变色范围在pH突变范围内的指示剂,可
减小实验误差
√ C.选择甲基红指示反应终点,误差比甲基橙的大
D.V(NaOH)=30.00 mL时,pH=12.3
滴定终点的判断 :以酚酞作指示剂,用氢氧化钠溶液滴定醋酸,滴定终点如何 确定? 用高锰酸钾溶液滴定氯化亚铁溶液,滴定终点如何确定?
D
当用盐酸滴定Na2CO3溶液时,若用酚酞为指示剂,发生反应的化学方
《实验3-6 食醋中总酸量的测定》PPT课件(广东省省级优课)

滴定次数
第一次 第二次 第三次
待测体积(mL)
20.00 20.00 20.00
标准KMnO4溶液体积(mL)
滴定前读数 滴定后读数
0.40
20.40
2.00
24.10
4.00
24.00
注意:应舍去第二次数据
√2、KMnO4溶液和H2C2O4溶液分别使用什么滴定管盛装或量取? 酸式滴定管:酸性溶液、氧化性溶液 碱式滴定管:碱性溶液
3、如何判断滴定终点? 当滴入最后一滴KMnO4溶液时,锥形瓶内溶液颜色由无色 变为紫红色且30s内不变化。
4、根据下列数据,请计算待测H2C2O4的浓度:0.2500 mol·L-1。
2、滴定 (左右手、加入指示剂、眼睛、滴定终点的判断、记录V终) 3、重复2-3次实验(平行实验) 4、数据处理
•数据记录与处理:稀原释溶1液0倍中,,
C酸=0.0650 mol/L C酸=0.6500 mol/L
(
)滴定管
实验
白醋的体积 /mL
滴定前 读数
滴定后 NaOH溶液的体积溶
读数
液的体积/mL
C碱 V碱 = C酸 V酸
•实验仪器与试剂:
1、主要玻璃仪器:
酸式滴定管、碱式滴定管、锥形瓶、(烧杯)
2、试剂:
经标定的0.1000 mol/L NaOH溶液、20.00 mL稀 释10倍后待测的食用白醋溶液、酚酞溶液
•实验步骤与现象:
1、实验前处理: 验漏——洗涤——润洗——装液(瓶底衬一张白纸) ——排气泡——调零(或以下)读V始
1 2 3
整根个据实验理过,程代中入,公式,
可得能出引食起醋酸中的总浓酸度量为: 偏(大写/出偏计小算的过原程因)?
4-食醋中总酸度的测定

实验四 食醋中总酸度的测定1. 方法提要以酚酞为指示剂,氢氧化钠为标准滴定溶液滴定食醋中的总酸,当溶液出现淡淡的紫色时即为滴定终点。
根据消耗的氢氧化钠标准溶液的体积,计算食醋的含量。
2. 试剂2.1酚酞指示剂:0.2%乙醇溶液。
2.2邻苯二甲酸氢钾(KHP):基准物质,110~120℃烘干恒重。
2.3 氢氧化钠标准滴定溶液台秤称取2.0g 氢氧化钠于500mL 烧杯中,加入适量新煮沸冷却的蒸馏水1溶解。
溶解完全后,加水至500ml ,转移到具有橡胶塞的试剂瓶中,摇匀。
浓度约为0.1mol/L 。
2.4 氢氧化钠标准溶液的标定用减量法准确称取邻苯二甲酸氢钾(2.2)0.4~0.5g ,称准至0.0001g ,置于250mL 锥形瓶中,加入50mL 水,适当加热,待溶解完全并冷却后,加入1~2滴酚酞指示剂(2.1),用氢氧化钠标准溶液滴定至溶液刚好由无色变为淡淡的粉色,并保持30s 不褪色即为终点。
根据消耗的氢氧化钠标准溶液体积和邻苯二甲酸氢钾的质量,计算氢氧化钠标准溶液的浓度。
要求平行测定三份。
3. 试样市售食醋。
4. 分析步骤3.1食醋试液的准备用移液管准确移取醋试液10.00mL 于250mL 容量瓶中,以新煮沸并冷却的蒸馏水稀释至刻度,摇匀。
3.2食醋含量的测定用移液管移取25.00mL 醋试液(3.1)于250mL 锥形瓶中,加入25mL 新煮沸并冷却的蒸馏水2,加入1~2滴酚酞指示剂(2.1),用氢氧化钠标准溶液滴定至溶液刚好由无色变为淡淡的粉色,并保持30s 不褪色即为终点。
根据氢氧化钠溶液的用量,计算食醋的总酸度。
要求平行测定三份5. 结果计算5.1 按下式计算氢氧化钠标准溶液的浓度式中:c —氢氧化钠标准溶液的浓度,mol/L ;1测定醋酸含量时,所用的蒸馏水不能含有CO 2,否则CO 2溶于水生成H 2CO 3,将同时被滴定。
2食醋中醋酸的浓度较大,必须稀释后再滴定。
稀释后的食醋中加入25mL 新煮沸并冷却的蒸馏水使被滴定体系体积与NaOH 标准溶液标定时溶液体积一致,减小由体积变化引起的指示剂终点误差。
实验1食醋中总酸量的测定

实验1食醋中总酸量的测定实验1 食醋中总酸量的测定一、实验目的1.学习移液管和容量瓶的正确使用方法。
2.练习酸碱滴定的基本操作,了解其应用。
3.熟悉液体试样中浓度含量的测定方法。
二、移液管的使用移液管有各种形状,最普通的是中部吹成圆柱形,圆柱形以上及以下为较细的管颈,下部的管颈拉尖,上部的管颈刻有一环状刻度。
移液管为精密转移一定体积溶液时用的。
1.使用时,应先将移液管洗净,自然沥干,并用待量取的溶液少许荡洗3次。
2.然后以右手拇指及中指捏住管颈标线以上的地方,将移液管插入供试品溶液液面下约1cm,不应伸入太多,以免管尖外壁粘有溶液过多,也不应伸入太少,以免液面下降后而吸空。
这时,左手拿橡皮吸球(一般用60ml洗耳球)轻轻将溶液吸上,眼睛注意正在上升的液面位置,移液管应随容器内液面下降而下降,当液面上升到刻度标线以上约1cm时,迅速用右手食指堵住管口,取出移液管,用滤纸条拭干移液管下端外壁,并使与地面垂直,稍微松开右手食指,使液面缓缓下降,此时视线应平视标线,直到弯月面与标线相切,立即按紧食指,使液体不再流出,并使出口尖端接触容器外壁,以除去尖端外残留溶液。
3.再将移液管移入准备接受溶液的容器中,使其出口尖端接触器壁,使容器微倾斜,而使移液管直立,然后放松右手食指,使溶液自由地顺壁流下,待溶液停止流出后,一般等待15秒钟拿出。
4.注意此时移液管尖端仍残留有一滴液体,不可吹出。
【练习用移液管移取2mL、5mL、10mL、25mL的水于小烧杯中。
】三、容量瓶和滴定管的使用(1)容量瓶容量瓶主要是用来精确地配制一定体积和浓度的溶液的量器,一般有50,100,250,500,1000cm3等规格。
当用浓溶液(尤其是浓硫酸)配制稀溶液时,应先在烧杯中加入少量去离子水,将一定体积的浓溶液沿玻璃棒分数次慢慢地注入水中,每次加入浓溶液后,应搅拌使之均匀。
如果是用固体溶质配制溶液,则应先将固体溶质放入烧杯中,用少量去离子水溶解,然后将杯中的溶液沿玻璃棒小心地注入容量瓶中(参见图2-24),再从洗瓶中挤出少量水淋洗烧杯及玻璃棒2~3次,并将每次淋洗的水都注入容量瓶中,最后,加水到标线处。
食醋中总酸量的测定实验报告

食醋中总酸量的测定实验报告引言食醋是一种常见的调味品,由于其酸性味道使其具有一定的防腐作用。
在食品制作和烹饪过程中,食醋的使用频率非常高。
然而,不同品牌和制造工艺的食醋其酸度可能存在差异,因此需要进行测定才能确定其质量和适用性。
总酸量是测定食醋酸度的一个重要参数,也是评价醋酸及其盐类含量的指标之一。
本实验旨在通过滴定法测定食醋中总酸量,并通过计算得出食醋中醋酸的质量分数。
实验材料和仪器实验材料•食醋样品•进口有机溶剂•NaOH标准溶液•10毫升量筒•钢制漏斗•pHS-3C酸度计•10毫升滴定管•硼砂玻璃片实验原理食醋中的醋酸可以与碳酸氢钠(NaHCO3)反应生成二氧化碳和水。
根据反应的平衡方程式可知,醋酸与碳酸氢钠的摩尔比为1:1,因此可以通过滴定法测定食醋中醋酸的质量分数。
实验中,首先需要将食醋用适量进口有机溶剂稀释,然后使用pHS-3C酸度计测定溶液的酸度,得到粗测值后进行精确测定。
接下来,通过滴定实验使用NaOH标准溶液滴定稀释后的食醋样品溶液,直至酸度指示剂的颜色转变。
根据滴定过程中所使用的NaOH标准溶液的体积和浓度,以及醋酸与碳酸氢钠反应的摩尔比,可以计算出食醋中醋酸的质量分数。
1.准备工作:清洗和干燥实验仪器,将食醋用适量进口有机溶剂稀释。
2.使用pHS-3C酸度计测定稀释后食醋样品溶液的酸度,并记录测定值。
3.取适量NaOH标准溶液于滴定管中。
4.将稀释后的食醋样品溶液倒入滴定瓶中,并加入两滴酸度指示剂。
5.慢慢滴加NaOH标准溶液至酸度指示剂的颜色转变,记录NaOH溶液的体积。
6.重复实验3-5步骤两次,取平均值。
7.根据NaOH标准溶液的浓度和滴定过程中消耗的体积,计算食醋中醋酸的质量分数。
数据处理与结果分析根据实验数据可得,滴定过程中使用的NaOH标准溶液体积为10.2毫升。
根据NaOH标准溶液的浓度和滴定过程中消耗的体积,可以计算出食醋中醋酸的质量分数。
根据滴定计算公式:滴定计算公式滴定计算公式其中V2为标定溶液消耗的体积,c为标定溶液的浓度,m 为稀释样品溶液的质量,M为醋酸的摩尔质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
食醋中总酸量的测定文件管理序列号:[K8UY-K9IO69-O6M243-OL889-F88688]
食醋中总酸量的测定
实验目的
1、学习强碱滴定弱酸的基本原理及指示剂的选择原则。
2、掌握食醋中总酸量的测定原理和方法。
3、熟悉移液管和容量瓶的正确使用方法。
实验原理
食醋中的主要成分是醋酸(CH 3COOH )常简写为HAc ,此外还含有少量其
他有机弱酸,如乳酸等。
当以NaOH 标准溶液滴定时,凡是C 810-〉θ
a
K 的弱酸均可以被滴定,因此测出的是总酸量,但分析结果通常用含量最多的HAc 表示。
CH 3COOH 与NaOH 的反应为:NaOH + CH 3COOH = CH 3COONa + H 2O
由于这是强碱滴定弱酸,计量点时生成CH 3COONa ,溶液的pH 大约为8.7,故可选用酚酞作指示剂,但必须注意CO 2对反应的影响。
食醋是液体样品,通常是量其体积而不是称其质量,因而测定结果一般以每升或每100mL 样品所含CH 3COOH 的质量表示,即以醋酸的密度ρ(HAc)表示,其单位为g ·L -1或g/100mL 。
食用醋往往有颜色,会干扰滴定,应先经稀释或加入活性炭脱色后,再进行测定。
食醋中含CH 3COOH 的质量分数一般在3%~5%,应适当稀释后再进行滴定。
仪器与试剂
碱式滴定管(50mL ),移液管(10mL ,25 mL ),容量瓶(250mL ),锥形瓶(250mL ),洗耳球。
0.1 mol ·L -1 NaOH 标准溶液(要求实验前标定),0.2%酚酞乙醇溶液, 食醋(白醋)样品。
实验步骤
用移液管吸取25.00 mL 食醋样品,放入250 mL 容量瓶中,然后用无CO 2
的蒸馏水稀释容至刻度,摇匀备用。
用移液管吸取25.00 mL 已稀释的食醋样品于250mL 锥形瓶中,滴加2~3滴酚酞指示剂。
用NaOH 标准溶液滴定到溶液呈微红色,30s 内不褪色即为终点,记录所消耗NaOH 标准溶液的体积。
平行测定3次,要求每次测定结果的相对平均偏差不大于0.3%,计算食醋的总酸量ρ(HAc),ρ(HAc)按下式计算:
ρ(HAc)=
)(1)
()()(-⨯⨯⋅⨯L g f V HAc M NaOH V NaOH c 样
式中:V 样—滴定时所取稀释后样品的体积,mL ;
C(NaOH)—NaOH 标准溶液的浓度,mol ·L -1
; V(NaOH)—滴定时消耗NaOH 标准溶液的体积,mL ; M(HAc)—HAc 的摩尔质量,g ·mol -1
; f —稀释比。
数据记录与结果处理
注意事项
1、由于NaOH 固体易吸收空气中的CO 2和水分,不能直接配制碱标准溶液,
而必须用标定法。
2、NaOH 吸收空气中的CO 2,使配得的溶液中含有少量Na 2CO 3,含有碳酸盐
碱溶液,使滴定反应
复杂化,甚至使测定发生一定误差,因此,应配制不含碳酸盐的碱溶液。
3、酸碱滴定中CO2的影响有时不能忽略,终点时pH 值越低,CO 2影响越
小,一般说,pH 小于
5时的影响可忽略。
如用甲基橙为指示剂,终点pH 约为4,CO 2基本上不被
滴定,而碱标准溶
液中的CO 32-也基本被中和成CO 2,用酚酞为指示剂,终点pH 约为9,CO 32-
被滴定为HCO 3-,(包
括空气中溶解的CO 2形成的CO 32-) 思考题
1、测定食用白醋含量时,为什么选用酚酞为指示剂,能否选用甲基橙或甲基红为指示剂?
答:本实验为强碱滴定弱酸,滴定结果是强碱弱酸盐,呈弱碱性,滴定终点在碱性范围内,故选用酚酞为指示剂,变色范围为8.2-10,甲基红、橙变色范围为3.1-4.4,甲基红变色范围为4.4-6.2,均在酸性范围内,故不可选用。
2、酚酞指示剂由无色变为微红时,溶液的pH为多少变红的溶液在空气中放置后又变为无色的原因是什么
答:酚酞指示剂由无色变为微红时,溶液的pH约为9,变红的溶液在空气。
中放置后又变为无色是因为吸收了空气中的CO
2。
