2018高中生物第六章蛋白质和DNA技术61蛋白质的提取和分离(1)素材中图版1!
中图版选修1高一生物第六章第1节课件:蛋白质的提取和分离

中图版选修1高一生物第六章第1节课件:蛋白质
的提取和分离
导读:本文中图版选修1高一生物第六章第1节课件:蛋白质的提取和分离,仅供参考,如果觉得很不错,欢迎点评和分享。
中图版选修1第六章第1节《蛋白质的提取和分离》ppt 学习导航
1.知道蛋白质分离和提取技术的基本原理。
2.尝试蛋白质的提取和分离。
[重、难点]
一、蛋白质分离提纯技术
1.将生物体内的蛋白质提取出来并加以分离,就可以得到高纯度的、甚至是___________的蛋白质。
2.包括离心技术、层析技术和电泳技术等。
其中,______技术最为快捷灵敏、简便易行。
本站课件均从网络收集或是会员上传,版权归原作者所有,请大家尊重作者的劳动成果,并积极上传自己的作品与大家一起分享交流,帮助别人就是帮助自己!
普通下载。
高中生物同步课件:61蛋白质的提取和分离中图版选修

实验材料:选择新鲜、无污染的蛋白质样品 实验步骤:严格按照实验步骤进行,避免遗漏或错误 实验环境:保持实验室清洁、干燥、通风良好 实验安全:注意实验过程中的安全操作,避免受伤或污染实验环境
实验结果和结论
蛋白质的提取和分离成功 蛋白质的纯度较高 蛋白质的分子量分布均匀 蛋白质的活性保持良好
实验结果:成功提取和分离蛋白质 结论:蛋白质提取和分离的方法是可行的 分析:实验过程中需要注意的问题和注意事项 结论:蛋白质提取和分离的方法对于生物学研究和应用具有重要意义
高中生物同步课件: 61蛋白质的提取和分 离汇中报人:图版选修
目录
添加目录标题
蛋白质提取和分离 的原理
实验材料和步骤
实验结果和结论
实验问题和改进
实验拓展和思考
添加章节标题
蛋白质提取和分离 的原理
氨基酸组成:蛋白质由氨基酸通过肽键连接而成 结构多样性:蛋白质具有多种结构,如α-螺旋、β-折叠等 功能多样性:蛋白质在生物体内具有多种功能,如催化、运输、免疫等 热稳定性:蛋白质在高温下会变性,失去活性 酸碱稳定性:蛋白质在酸性或碱性环境中会变性,失去活性 酶解稳定性:蛋白质在酶的作用下会分解,失去活性
实验改进:对实验过程中的问题进行反思, 提出改进措施
实验应用:探讨蛋白质提取和分离在生物技 术、医学等领域的应用
实验总结:总结实验过程中的收获和体会, 提高实验技能和思维能力
感谢您的观看
汇报人:
离心法:利用蛋白质密度差异,通过离 心作用将其分离
凝胶过滤法:利用蛋白质分子大小差异, 通过凝胶过滤将其分离
实验材料和步骤
● 实验材料:蛋白质提取试剂、离心管、离心机、电泳仪、电泳槽、电泳缓冲液、电泳凝胶、电泳仪电源、电泳仪电 极、电泳仪电极架、电泳仪电极夹、电泳仪电极导线、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、 电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极 导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电 泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导 线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳 仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线 夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪 电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、 电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极 导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹、电 泳仪电极导线夹、电泳仪电极导线夹、电泳仪电极导线夹
高中生物第六章蛋白质和DNA技术6.1蛋白质的提取和分离1素材中图版选修1

6.1 蛋白质的提取和分离问题:斐林试剂和双缩脲试剂成份相同,为什么斐林试剂不能用来检测蛋白质?(1)溶液浓度不同斐林试剂中乙液为0.05g/ml的CuSO4溶液,双缩脲试剂中CuSO4溶液为0.01g/ml(2)使用原理不同斐林试剂是新配制的溶液,它在加热条件下与醛基反应,被还原成砖红色的沉淀,可用于鉴定可溶性还原糖的存在。
用斐林试剂鉴定可溶性还原糖时,溶液的颜色变化过程为:浅蓝色→棕色→砖红色(沉淀)。
鉴定生物组织中是否含有蛋白质时,常用双缩脲法,使用的是双缩脲试剂,发生的是双缩脲反应。
双缩脲反应实质是在碱性环境下的与双缩脲试剂发生的紫色反应。
而蛋白质分子中含有很多与双缩脲结构相似的肽键,所以蛋白质都能与双缩脲试剂发生颜色反应,可以用双缩脲试剂鉴定蛋白质的存在。
(3)使用方法不同斐林试剂使用时,先反溶液和溶液混合(将滴溶液滴入溶液中),而后立即使用,需要加热。
双缩脲试剂使用时,先加入溶液(2mL),振荡摇匀,造成碱性的反应环境,然后再加入3~4滴溶液,振荡摇匀后观察现象。
(4)颜色反应不同斐林试剂与还原糖混合是产生砖红色沉淀,双缩脲试剂与蛋白质反应产生紫色反应。
一、植物组织蛋白质提取方法1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。
2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4小时)。
3、用离心机离心8000rpm40min4℃或11100rpm20min4℃4、提取上清液,样品制备完成。
蛋白质提取液:300ml1、1Mtris-HCl(PH8) 45ml2、甘油(Glycerol)75ml3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g这种方法针对SDS-PAGE,垂直板电泳!二、植物组织蛋白质提取方法氯醋酸—丙酮沉淀法1、在液氮中研磨叶片2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm以上1小时)弃上清。
蛋白质提取、分离、纯化及鉴定(共14张PPT)

原理
蛋白质分子吸附某种盐类离子后,带电层使蛋白质分
子彼此排斥,而蛋白质分子与水分子间相互作用增强, 因而溶解度增加
盐析的影响因素
➢蛋白质的种类:
分子量越大,沉淀所需盐的量越少(卵球蛋白>卵清蛋白)
蛋白质分子不对称性越大,越容易沉淀
➢温度:
高离子强度溶液中,升高温度有利于蛋白质的失水沉淀 低离子强度溶液或纯水中,蛋白质的溶解度在一定温度范
常为凝胶柱床体积的1%-10% ➢洗脱速度要恒定
➢实验完毕后,将凝胶全部回收处理,以备下次实验使用,
严禁将凝胶丢弃或倒入水池中
实验三脱盐后离子测定及蛋白浓度测定
1.硫酸根离子浓度测定
(决定是否停止洗脱)
醋酸钡与溶液中的硫酸根离子可以形成白色的沉淀,同时不能同蛋 白质形成沉淀。
➢从每管洗脱液中取1滴加在黑瓷板上,加入1滴醋酸钡溶液,观察沉淀 ➢实验中设阴性对照(双蒸水)和阳性对照(硫酸铵溶液)
➢SephadexG-25:吸水量2.5ml/g,干粒子直径100-300µm,筛 孔40-60。大部分蛋白质分子从外水体积流出,盐等小分子
从内水体积流出。
实验一卵清球蛋白的盐析分离
0.7ml卵清+0.7ml饱和硫酸铵溶液(每组2个EP管)
混合均匀(避免产生气泡)
静置3-5分钟,蛋白质析出
3000rห้องสมุดไป่ตู้m,离心3分钟 用移液枪去除上清(含卵清白蛋白)
蛋白质提取、分离、纯化及鉴定
➢材料(取材一定要新鲜,在低温下操作)
➢前处理及裂解细胞(匀浆器、研钵、超声波、反复冻融、
酶解等) ➢蛋白质粗分级分离(水、盐溶液、稀酸、稀碱、有机溶剂、
盐析、有机溶剂分级分离、等电点分离)
第六章第1节《蛋白质的提取和分离》ppt-中图版选修1PPT课件

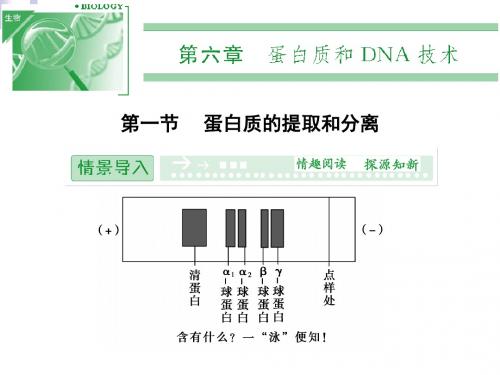
2.卵清蛋白质的分离 选取鸡、鸭、鹅、鹌鹑等动物的新鲜_卵__清__做 实验材料。采用__电__泳__法分离卵清蛋白质。
想一想 可否利用蛋白质的提取与分离技术快速诊断 早期癌变? 【提示】 可以。只需从早期患者的尿液、 血液或细胞裂解液中提取少量蛋白质样品,采 用蛋白质指纹图谱技术,就可以更加快速、 简便、准确地对细胞癌变作出诊断。
例1 关于电泳的说法不正确的是( ) A.电泳是指带电粒子在电场的作用下发生迁 移的过程 B.带电分子会向着与其所带电荷相反的电极 移动 C.蛋白质在聚丙烯酰胺凝胶中的迁移率取决 于它所带净电荷的多少 D.用SDS-聚丙烯酰胺凝胶电泳,蛋白质的 电泳迁移率完全取决于分子的大小
【解析】 蛋白质在聚丙烯酰胺凝胶中的迁 移率取决于它所带净电荷的多少以及分子的 大小等因素,SDS能与各种蛋白质形成蛋白 质-SDS复合物,SDS所带负电荷的量大大 超过了蛋白质分子原有的电荷量,因而掩盖 了不同种蛋白质间的电荷差异,使电泳迁移 率完全取决于分子的大小。
2.电泳 3. 染 色 : 用 质 量 分 数 为 0.05% 的 _考__马__斯__亮__蓝__R__25_0_染色液对凝胶进行染色。 4.脱色:用体积分数为7%的__醋__酸__溶__液__对凝 胶板进行浸泡漂洗数次,直至底色脱净。 5.制干胶板:将已_脱__色__的凝胶板放在_保__存__液_ 中浸泡3 h~4 h后,放在两层透气的_玻__璃__纸__ 中间自然干燥。
________________________________________ ________________________________________ ___________________________________。
3.结果分析 (1)不同蛋白质的混合溶液,在经过同一个电 场电泳后,会在凝胶上形成不同的带纹,每 一种带纹可能就是一种蛋白质。 (2)如果要对每一条带纹作进一步的研究,只 需将带纹剪下,分别予以洗脱,然后对洗脱 液中的蛋白质做进一步分离。
高中生物 第六章 蛋白质和DNA技术 第一节 蛋白质的提取和分离自我小测 中图版选修1

第六章蛋白质和DNA技术第一节蛋白质的提取和分离1.下列关于蛋白质的分离方法的叙述,错误的是()A.分离主要是根据蛋白质以及蛋白质与其他物质之间的理化性质的差异进行的B.透析技术可去除小分子化合物杂质,原理是不同分子所携带净电荷不同C.通过控制离心速率可使分子大小、密度不同的蛋白质沉降分层,从而分离不同的蛋白质D.不同的物质在同一电场中的泳动速度不同,因此可用电泳法分离蛋白质2.离心技术是分离蛋白质的方法之一,在这一过程中蛋白质会分层,这一现象与蛋白质的何种性质有关?()A.酸碱性B.所带电荷多少C.分子大小和密度D.种类3.下列有关电泳现象的叙述,错误的是()A.相同蛋白质的溶液,经过同一个电场电泳后,会在支持物凝胶上形成相同的带纹B.不同蛋白质的混合溶液,经过同一个电场电泳后,会在支持物凝胶上形成不同的带纹C.每一种带纹可能就是一种蛋白质D.每一种带纹一定不是一种蛋白质4.下列关于聚丙烯酰胺凝胶电泳的叙述,错误的是()A.是最早使用的电泳技术B.是区带电泳的一种C.凝胶上层加浓缩胶可提高分离效果D.分离血清蛋白质可以得到20种以上的组分5.电泳过程中,什么样的分子迁移速度最快?()A.纤维状、大分子B.纤维状、小分子C.球状、大分子D.球状、小分子6.在血清蛋白的提取和分离过程中,所使用的染色液是()A.新制血清5 μLB.质量浓度为0.4 g/mL的蔗糖溶液C.质量分数为0.05%的考马斯亮蓝R250染色液D.质量分数为0.1%的溴酚蓝指示剂7.下面说法不正确的是()A.分离胶和浓缩胶单独存在时具有神经毒性,应避免接触皮肤B.电泳需要支持物,常用的是聚丙烯酰胺凝胶C.电泳是指带电粒子在电场的作用下发生迁移的过程D.蛋白质是两性电解质,不带电荷8.电泳法分离蛋白质时,应保证凝胶的pH()A.不断降低B.不断升高C.先降低后升高D.不变且适宜9.下面说法不正确的是()A.在一定范围内,缓冲溶液能够抵制外界的酸、碱对溶液pH的影响,维持pH基本不变B.缓冲溶液通常由1~2种缓冲剂溶解于水中配制而成C.电泳是指带电粒子在电场的作用下发生迁移的过程D.透析袋能使大分子自由进出,而将小分子保留在袋内10.有一混合蛋白质溶液,各种蛋白质的pH分别为4.5、5.2、6.6、7.2,电泳时欲使其中三种泳向正极,缓冲液的pH应该是()A.2.0 B.5.0C.6.0 D.7.011.下列关于“血清蛋白的提取和分离”的活动顺序正确的是()①染色②电泳③点样④脱色⑤制干胶板A.①②③⑤④ B.⑤②①③④C.④①②③⑤ D.③②①④⑤12.各种动物血清内乳酸脱氢酶同工酶的组成是不同的。
高中生物 1.6蛋白质和DNA技术课件 中图版选修1

答案:(1)①15/16 ②三 (2)①引物Ⅰ和引物Ⅱ局部发生碱基互补配对(pèi duì)而失效 ②引物Ⅰ′自身折叠后会出现局部碱基互补配对(pèi duì)而失效 (3)DNA聚合酶只能将单个脱氧核苷酸连续结合到双链DNA片段的引物 链上 (4)见图
第二十二页,共50页。
第三页,共50页。
【高考(ɡāo kǎo)警示钟】 1.电泳时,带电的颗粒向与其电性相反的电极方向移动。 2.电泳时,蛋白质所带的电荷数越多,移动得越快;电荷数相同时, 分子量越小,则移动越快。
第四页,共50页。
DNA片段的扩增 1.细胞内DNA复制(fùzhì)与PCR技术的比较
第五页,共50页。
(1)加热使DNA双链间的___键完全打开,称为___;而在细胞中是在___酶的 作用下进行的。 (2)如果只需要大量克隆模板DNA中间的某个特定区段,应该加入___种特定 的引物。 (3)PCR技术的必需条件,除了(chú le)模板、原料、酶之外,至少还有三个 条件,即液体环境、适宜的___和___,前者由___自动调控,后者则靠来___ 维持。 (4)通过PCR技术使DNA分子大量复制,如果将一个用15N标记的DNA分子放入 试管中,以14N标记的脱氧核苷酸为原料,连续复制四次之后,则15N标记的 DNA分子占全部DNA分子总数的比例是___。
第三十三页,共50页。
答案:(1)生理盐水 渗透原理(当外界溶液浓度低于动物细胞内液浓度 时,细胞吸水涨破) (2)除去小分子杂质 增加缓冲液的量或及时更换缓冲液 (3)带电(dài diàn)性质以及分子大小、形状 (4)2 携带者具有(控制血红蛋白的)一对等位基因,可以控制合成两 种不同的蛋白质
第六章 蛋白质和DNA技术(jìshù)
高中生物同步课件:6.1 蛋白质的提取和分离(中图版选修1)

蛋白质和DNA技术
第六章
蛋白质和DNA技术
第六章
蛋白质和DNA技术
第1节
蛋白质的提取和分离
第六章
蛋白质和DNA技术
学习导航
1.知道蛋白质分离和提取技术的基本原理。
2.尝试蛋白质的提取和分离。 [重、难点]
第六章
蛋白质和DNA技术
新知初探思维启动
一、蛋白质分离提纯技术
1.将生物体内的蛋白质提取出来并加以分离, 单一种类 就可以得到高纯度的、甚至是___________的
永久性记录,可对凝胶进行拍照,或将凝胶
干燥成胶片。
第六章
蛋白质和DNA技术
例2 有A、B、C三种蛋白质,在pH为7的条
件下进行电泳,结果如图所示:
第六章
蛋白质和DNA技术
请据图回答:
(1) 在 pH 为 7 时 , 带 电 荷 数 最 多 的 是 ____________,最少的是________________。 原因是__________________________________ ________________________________________ ________________________________________ ___________________________________。
【答案】
C
第六章
蛋白质和DNA技术
变式训练 在蛋白质的分离提纯技术中,最为简捷灵敏
的是(
)
B.层析技术 D.盐析
A.离心技术 C.电泳技术
解析:选C。常用的蛋白质分离提纯技术,
包括离心技术、层析技术和电泳技术等,其 中电泳技术最为快捷灵敏、简便易行。盐析 可用来提取蛋白质,而不能分离蛋白质。
高中生物 第6章 蛋白质和DNA技术 第1节 蛋白质的提取和分离教案 高二生物教案

第一节蛋白质的提取和分离一、蛋白质分离提纯技术常用的蛋白质分离提纯技术包括离心技术、层析技术和电泳技术等。
其中电泳技术最为快捷灵敏、简便易行。
二、电泳技术分离蛋白质的原理1.蛋白质中含有游离的氨基和羧基,是两性电解质,在一定pH条件下带有电荷。
2.蛋白质在电场中可以向与其自身所带电荷相反的电极方向移动。
3.蛋白质所带的电荷数越多,移动得越快;电荷数相同时,分子量越小,移动越快。
三、结果分析不同蛋白质的混合溶液经过同一电场电泳后,会在凝胶上形成不同的带纹,每种带纹可能就是一种蛋白质。
四、“血清蛋白的提取和分离”活动程序1.点样:取新制血清5微升、质量浓度为0.4克/毫升的蔗糖溶液和质量分数为0.1%的溴酚蓝指示剂等体积混匀后,用微量加样器吸取5 μL样品加到电泳样品槽的胶面上。
2.电泳。
3.染色:用质量分数为0.05%的考马斯亮蓝R250染色液对凝胶进行染色。
4.脱色:用体积分数为7%的醋酸溶液对凝胶板进行浸泡漂洗,至底色脱净。
5.制干胶板:将已脱色的凝胶板放在保存液中浸泡3 h~4 h后,放在两层透气的玻璃纸中间自然干燥。
预习完成后,请把你认为难以解决的问题记录在下面的表格中1.蛋白质分离的基本过程破碎细胞―→抽提(粗制品)―→纯化蛋白质2.破碎细胞的方法在分离与纯化蛋白质之前,必须采用适当的方法使蛋白质呈溶解状态释放出来:通常先将生物组织进行机械破碎,再根据细胞的特点,选择不同的破碎细胞方法(常用的有研磨法、超声波法、酶解法)。
3.抽提细胞破碎后,各种蛋白质被释放出来,再根据蛋白质的不同性质,选择不同的溶剂进行抽提。
4.纯化(1)原理:纯化主要是指根据蛋白质之间以及蛋白质与其他物质之间在分子大小、溶解度大小、所带电荷的多少、吸附性质等方面存在的差异进行的。
(2)方法:①透析法——分子大小②离心沉淀法——分子大小、密度大小③电泳——所带电荷多少二、“血清蛋白质的分离”实验中应注意的问题1.由于制备凝胶的丙烯酰胺和双丙烯酰胺具有很强的神经毒性,并且容易被皮肤吸收,因此操作必须在通风橱内或通风处进行。
6.1 蛋白质的提取和分离 课件(中图版选修1)
2.蛋白质提取与分离的实践意义
胰岛素 ,救助了数千 (1)加拿大科学家班廷等人发现和提纯了_______ 万的糖尿病患者。 尿液 、 _____ 血液 或 (2)在癌变检测中,现在只需从早期患者的_____ 蛋白质指纹图谱 技 细胞裂解液 中提取少量蛋白质样品,采用_______________ ___________ 细胞癌变 作出诊断。 术,就可以更加快速、简便、准确地对_________ 变异基因 ,从而为患者做出及时的 能够提前3~5年发现一些_________ 肿瘤预警,争得更多宝贵的治疗时间。
[思维激活2] 除了上述分离方法,你还知道哪种方法可以分 离蛋白质?它依据的原理是什么? 提示 透析法。依据的原理是半透膜只允许小分子透过, 不允许大分子透过。
血清蛋白的提取与分离
(1)点样:取新制血清5 μL、与质量分数为0.4 g/mL蔗糖溶 液及质量分数为0.1%的溴酚蓝指示剂等体积混合均匀后, 用微量加样器取5 μL样品,小心地将样品加到样品糟的胶 面上(如下图所示)。
带电泳。该凝胶由丙烯Hale Waihona Puke 胺(Acr)和交联剂N,N′—甲基双
丙烯聚酰胺(Bis)聚合而成。Acr和Bis单独存在或混合在一 起时是稳定的,且具有神经毒性,操作时应戴手套,避免 接触皮肤,但在具有自由基团体系时就能聚合。引发自由 基团的方法有化学法和光化学法两种。采用不同浓度的
Acr、Bis、Ap、TEMED使之聚合,产生不同孔径的凝胶。
相对分子质量_____越小 ,移动_____越快 。
(3)结果 同一个电场 电泳后,会在 不同蛋白质的混合溶液,经___________ 凝胶 上形成不同的_____ 带纹 。 _____
[思维激活1] 洗脱法分离蛋白质利用的原理是什么?它与电 泳技术的原理有何不同? 提示 洗脱法是依据蛋白质分子质量大小,利用凝胶色谱
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6.1 蛋白质的提取和分离
问题:斐林试剂和双缩脲试剂成份相同,为什么斐林试剂不能用来检测蛋白质?
(1)溶液浓度不同
斐林试剂中乙液为0.05g/ml的CuSO4溶液,双缩脲试剂中CuSO4溶液为0.01g/ml
(2)使用原理不同
斐林试剂是新配制的溶液,它在加热条件下与醛基反应,被还原成砖红色的沉淀,可用于鉴定可溶性还原糖的存在。
用斐林试剂鉴定可溶性还原糖时,溶液的颜色变化过程为:浅蓝色→棕色→砖红色(沉淀)。
鉴定生物组织中是否含有蛋白质时,常用双缩脲法,使用的是双缩脲试剂,发生的是双缩脲反应。
双缩脲反应实质是在碱性环境下的与双缩脲试剂发生的紫色反应。
而蛋白质分子中含有很多与双缩脲结构相似的肽键,所以蛋白质都能与双缩脲试剂发生颜色反应,可以用双缩脲试剂鉴定蛋白质的存在。
(3)使用方法不同
斐林试剂使用时,先反溶液和溶液混合(将滴溶液滴入溶液中),而后立即使用,需要加热。
双缩脲试剂使用时,先加入溶液(2mL),振荡摇匀,造成碱性的反应环境,然后再加入3~4滴溶液,振荡摇匀后观察现象。
(4)颜色反应不同
斐林试剂与还原糖混合是产生砖红色沉淀,双缩脲试剂与蛋白质反应产生紫色反应。
一、植物组织蛋白质提取方法
1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。
2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4小时)。
3、用离心机离心8000rpm40min4℃或11100rpm20min4℃
4、提取上清液,样品制备完成。
蛋白质提取液:300ml
1、1Mtris-HCl(PH8) 45ml
2、甘油(Glycerol)75ml
3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g
这种方法针对SDS-PAGE,垂直板电泳!
二、植物组织蛋白质提取方法
氯醋酸—丙酮沉淀法
1、在液氮中研磨叶片
2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm以上1小时)弃上清。
3、加入等体积的冰浴丙酮(含0.07%的β-巯基乙醇),摇匀后离心(4℃8000rpm以上1小时),然后真空干燥沉淀,备用。
4、上样前加入裂解液,室温放置30分钟,使蛋白充分溶于裂解液中,然后离心(15℃8000rpm 以上1小时或更长时间以没有沉淀为标准),可临时保存在4℃待用。
5、用Brandford法定量蛋白,然后可分装放入-80℃备用。
药品:提取液:含10%TCA和0.07%的β-巯基乙醇的丙酮。
裂解液:2.7g尿素0.2gCHAPS 溶于3ml灭菌的去离子水中(终体积为5ml),使用前再加入1M的DTT65ul/ml。
这种方法针对双向电泳,杂质少,离子浓度小的特点!当然单向电泳也同样适用,只是电泳的条带会减少!
三、植物材料:水稻苗,叶鞘,根
1、200毫克样品置于冰上磨碎
2、加lysis buffer,离心,10000rpm,4度,5min取上清
3、重复离心5min
lysis buffer:urea np-40 ampholine 2-me pvp-40
四、蛋白质样品制备
秧苗蛋白质样品的提取按Davermal等(1986)的方法进行。
100mg材料剪碎后加入10mgPVP-40(聚乙烯吡咯烷酮)及少量石英砂,用液氮研磨成粉,加入1.5 ml 10% 三氯乙酸(丙酮配制,含10mM即0.07%β-巯基乙醇),混匀,-20℃沉淀1
小时,4℃,15000 r/min离心15 min,弃上清,沉淀复溶于1.5ml冷丙酮(含10 mMβ-巯基乙醇),再于-20℃沉淀1小时,同上离心弃上清,(有必要再用80%丙酮(含10 mMβ-巯基乙醇所得沉淀低温冷冻真空抽干。
按每mg干粉加入20μl(可调) UKS液[9.5 M尿素,5mM碳酸钾,1.25%SDS,0.5%DTT(二硫苏糖醇),2% Ampholine (Amersham Pharmacia Biotech Inc,pH3.5-10),6% Triton X-100],37℃温育30min,期间搅动几次,28度(温度低,高浓度的尿素会让溶液结冰)16000 r/min 离心15 min,离心力越大时间长一点越好!上清即可上样电泳。
或者-70度保存
五、植物根中蛋白质的抽取
(1) sample, 液氮研磨
(2) 装1.5 ml centrifuge 用tube
(3) 加 1M KH2PO4 K2HPO4 700 ul
(4) 12000 rpm, 4度, 10-15minite
(5) 取上层液,蛋白质就在里面。
