有机化学 第十一章
大学有机化学重点知识总结第十一章 醛、酮
—制备增加2个C原子的伯醇:
+
H2C CH2
-+
RM gBr
O -
(C2H5)2O
R C H 2 C H 2 O M g B r
H 3O + H O C H 2C H 2R
精选可编辑ppt
42
33.
CH3 ( NBS )
CH2Br
Mg
(
干醚
CH2MgBr )
① O / 干醚
(
② H3O+
CH2CH2CH2OH )
R C O R '+H 2 O H +
R CO +2 R 'O H
(R '')HO R '
(R '')H
精选可编辑ppt
33
H +
O O C H 3
( )+ ( )
O
CH2CH2CH2CH CH3OH
HO
O
O
O
C OCH3 H
O O
C OCH3
H OC H2CH 2OH
精选可编辑ppt
34
(3)活性:醛>酮 酮一般用原甲酸三乙酯形成缩酮
O C
羰基
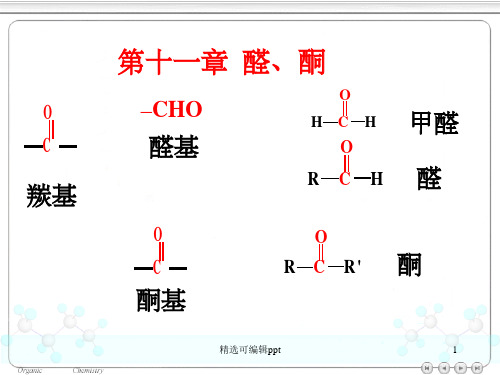
第十一章 醛、酮
–CHO
醛基
O HCH
O
RCH
甲醛 醛
O
C
酮基
O
R C R' 酮
精选可编辑ppt
1
烃基
脂肪族醛和酮 芳香族醛和酮
醛和酮
饱和醛和酮
的分类 烃基是否饱和 不饱和醛和酮
一元醛和酮
羰基个数 二元醛和酮
多元醛和酮
大学有机化学第11章__醛和酮

O C CH3
苯乙酮
(乙酰苯)
共九十一页
2)系统(xìtǒng)命名 法
O
5
CH3
CH3CH2-C-CH2-CH-CH2CH3
CH3-CH-CH2CH2CHO
HO-CH-CH3
6
4-甲基戊醛
5-乙基-6-羟基 3-庚酮
- (qiǎngjī)
共九十一页
C H 3
C H O
C H 2 C H 2 C H C H O O H C C H 2 C H C H 2 C H O
共九十一页
加成-消除(xiāochú)历程
R’
R—C=O + H2N—G
H+
R’ R-C — N—G
H+ -H2O
R’ R-C=N—G
OH H
(N-取代(qǔdài)亚胺)
这种加成-消除实际上可以看成由分子间脱去一分子水:
R’
R—C=O + H2 N—G
R’ R-C=N—G + H2O
共九十一页
加成-缩合产物(chǎnwù)的结构及名称:
加成-缩合产物的结构(jiégòu)及名称:
R’ R—C=O +
R’
H2N—R H2N—OH
R—C = N-R Schiff base R’
R—C = N-OH 肟(oxime)
H2N—NH2 H2N—NH-
O
R’
R—C=N-NH2 腙(hydrazone) R’
R-C=N-NH-C6H5 苯腙
H2N—NH-C-NH2
R’
R-C=N-NH-CO-NH2 缩氨脲
共九十一页
6) 与格氏试剂加成
有机化学第十一章

羰基化合物的活性次序(电子效应和空间效应): 羰基化合物的活性次序(电子效应和空间效应):
HCHO > CH3CHO > ArCHO > CH3COCH3 > CH3COR> CH3COAr > RCOR' > ArCOAr'
O 2N CHO > CHO
>
H 3C
CHO
1、与HCN的加成 、 的加成
维纶
4、与金属有机试剂的加成 、
(1)格氏试剂 )格氏试剂: H2CO +
MgCl 无水 乙醚
CH2OH 64-96%
H2O CH2OMgCl H SO 2 4
CH3 无水 乙醚 CH3COPh + PhCH2MgCl PhCH2 C OMgCl Ph CH3 H2O PhCH2 C OH NH4Cl Ph 92% Grignard: 1912 Nobel Prize
异 丙 醇 铝 ,丙 酮 丙 苯,回流
80%
CHCH CCH CH2 CH3
CH3 C CH CHCH CCH CH2 CH3 O
Oppenauer氧化: 异丙醇铝是催化剂 反应中双键不受影响。 氧化: 异丙醇铝是催化剂, 反应中双键不受影响。 氧化
脱氢:醇在适当的催化剂条件下脱去一分子氢 生成醛酮。 脱氢:醇在适当的催化剂条件下脱去一分子氢,生成醛酮。
CH3OH 浓H2SO4
COOCH3
CH2 C COOCH3 CH3 90%
过氧化苯甲酰
CH2 C CH3
n
甲基丙烯酸甲酯
聚甲基丙烯酸甲酯 (有机玻璃) 有机玻璃)
2、与NaHSO3的加成 、
加成生成a-羟基磺酸钠 羟基磺酸钠: 醛和甲基酮与饱和的NaHSO3加成生成 羟基磺酸钠: 醛和甲基酮与饱和的
有机化学--第十一章 醛 和 酮

等氧化剂所氧化,例如:
常把次卤酸钠的碱溶液与醛或酮作用生成三卤甲烷的 反应称为卤仿反应。
52
如果用次碘酸钠(碘加氢氧化钠)作试剂,产生具有特殊气味的黄
色结晶的碘仿(CHI3),这个反应称为碘仿反应。可通过碘仿反应来 鉴定具有 构的醛和酮,以及 结构的醇,因为次
碘酸钠又是一个氧化剂,能将
结构的醛或酮:
结构的醇氧化成含
53
生成α-羟基腈,此法优点是可避免使用有毒的氰化氢,
而且其产率也较高。例如:
33
3.与醇加成
在干燥氯化氢或浓硫酸的作用下,一分子醛或酮与
一分子醇发生加成反应,生成的化合物分别称为半缩醛
或半缩酮。
34
半缩醛(酮)一般是不稳定的,它易分解成原来的醛
(酮),因此不易分离出来,但环状的半缩醛较稳定,能
够分离得到。例如:
当醛、酮进行加成反应时,一般是试剂带负电荷
(亲核)的部分先向羰基碳原子进攻,然后是带正电荷
(亲电)的部分加到羰基氧原子上。决定反应速率的是第 一步,即亲核的一步,所以称为亲核加成反应。
18
亲核加成反应的难易取决于羰基碳原子的亲电性的
强弱、亲核试剂亲核性的强弱,以及电子效应和空间效
应等因素。芳香族羰基化合物进行亲核加成反应困难的 原因是羰基与芳环共轭;同时芳环有较大的体积,能产
14
脂肪醛及芳醛分子中,与羰基相连接的氢在核磁共振谱中的特
征吸收峰出现在极低的低场,化学位移值δ=9~10。醛基质子的化学 位移值是很特征的,这一区域内的吸收峰可用来证实醛基(—CHO)的
存在。
15
与其它吸电基一样,羰基对于与其直接相连的碳原子上的质 子也产生一定的去屏蔽效应。
16
有机化学 第11章 羧酸

C O C
2.两个羧基相隔2~3个碳原子的二元酸,不需要任 何脱水剂,加热就能脱水生成五元或六元环酐。
O H H C C C OH C OH O 150℃ H H C C O C O C O + H2 O
(三)酯的生成
酯化是可逆反应。为了提高酯的产率,通常采用加 过量的酸或醇。
§11-1 羧酸的分类和命名法
分子中含有羧基 一、分类
按照与羧基所连的烃基: (—COOH)的化合物。 脂肪酸和芳香酸。 通式:RCOOH和 按照分子中所含羧基数目: ArCOOH表示。
一元羧酸和多元羧酸。
二、命名
(一)脂肪酸
CH3 CH3CHCH2COOH 3-甲基丁酸 β-甲基丁酸
_ H3 O+
CH3(CH2)3CHCHO CH2CH3
KMnO4,OHH 2O
CH3(CH2)3CHCOO CH2CH3
CH3(CH2)3CHCOOH CH2CH3 (78%)
二、腈水解
HOCH2CH2Cl NaCN HOCH2CH2CN (1)OH-,H2O (2)H3O
+
HOCH2CH2COOH
α-C有强吸电子基时容易脱羧,二元羧酸也较容易 发生脱羧反应。芳基作为拉电子基,使芳酸的脱羧 比脂肪酸容易。
COOH O2N NO2 NO2 ~100℃ H2O O2N NO2 NO2 + CO2
五、烃基上的反应
(一)α-H卤化 羧基与羰基类似,能使α-H活化。但羧基的致活作 用比羰基小得多,必须在碘、硫或红磷等催化剂存 在下α-H才能被卤原子取代。
《有机化学》第十一章 羧酸及其衍生物的结构与性质

第十一章羧酸及其衍生物的结构与性质引言羧基()是羧酸的官能团,是由羰基和羟基组成的。
由于羰基的碳氧双键与羟基氧原子的共轭效应的作用,使羟基中氧原子电子向羰基转移,羟基的氢易离解而显酸性。
羧基中羟基也能被其它基团取代生成羧酸衍生物。
羧基是吸电子基,α-H具有活性,可以被卤代。
此外羧酸还能被还原和发生脱羧反应。
这里所讨论的羧酸衍生物主要是指羧基中羟基被取代后生成的酰卤(),酸酐(),酯(),酰胺()以及由酰胺脱水后生成的产物腈()。
在羧酸衍生物中羰基与卤素,酰胺基,烷氧基和氨基相连,由于卤素,氧原子和氮原子的负电性以及孤对电子的作用,使羰基碳上正电性不同,因此它们发生亲核反应性质也有差别。
羧酸衍生物还能发生还原反应。
11.1 羧酸的酸性羧酸是弱酸,能与强碱反应生成盐:羧酸酸性的强弱与所连的基团有关,连吸电子基团的羧酸酸性较强,而连供电子基团的酸性相对较弱。
如下列化合物酸性强弱顺序为:11.2 羧酸衍生物的生成羧基中的羟基被卤素、酰胺基、烷氧基和氨基取代形成酰卤、酸酐、酯和酰胺等羧酸衍生物。
1、酰卤的形成羧酸与SO2Cl,PCl5,PCl3等氯化剂直接反应生成酰卤:因为POCl3沸点低易除去,此法可制备高沸点的酰氯。
H3PO3沸点高,可制备低沸点的酰氯。
该法产生的SO2,HCl易除去,因此生成的酰氯纯度高,后处理容易。
2、酸酐的形成羧酸在脱水剂(如乙酰氯、乙酸酐)存在下加热,失去一分子水而生成酸酐。
二元酸可以分子内脱水生成二酸酐:3、酯化反应羧酸和醇在催化剂(H2SO4、HCl或苯磺酸等)作用下回流生成酯:酯化反应由多种机理,在大多数情况下,是羧酸中羟基与醇中羟基氢结合生成水,表观上看是一种亲核取代反应,实际上是一个亲核加成-消除反应的机理:决定反应速度的一步是亲核加成,因此羧基中碳的正电性以及羧基所连的基团大小核亲核试剂R'OH中R'体积大小都影响反应的速度,下列羧酸与甲醇酯化反应的相对速度的快慢顺序为:4、形成酰胺的反应羧酸与氨立即反应生成盐,在加热条件下,脱水生成酰胺,生成酰胺的反应是可逆的,如果把生成的水从反应体系中除去,反应可趋于完全。
有机化学第11章 醛和酮

O H3C C CH3
NaCN H2S O4
CH3 CH2=C-COOCH3
(CH3)2CCN OH
H2O
CH3 CH2=C-CN
CH3OH
CH3
H
CH2=C-COOCH3
α-甲基丙烯酸甲酯
2、与格氏试剂的加成反应
δ C
δ O
+ δR δMgX
无水乙醚
OMgX H2O C
R C OH + HOMgX
R
C H (R )
O
+ CH3-CH-CH3 ( i - Pr -O-)3Al
R CH OH
OH
H (R )
+ CH3-C-CH3 O
可逆反应,正反应称为麦尔外因-庞多夫-维尔莱还原反应, 其逆反应称为奥本奥尔氧化反应。 反应的专一性高,只使羰基与醇羟基互变而不影响其它基团, 故为一级醇、二级醇与醛酮对应转变的重要方法。
4-甲基-3-乙基己醛
2-甲基-3-戊酮
2-苯丙醛
例如:
CH3-C=CHCH 2CH2-CH-CH 2CHO
CH3
CH3
3,7 二甲基 6 辛烯醛
H3C O
3 甲基环戊酮
O
O
O
C-CH 2CH3
C-CH 3
2 环己烯酮
1 环己基 1 丙酮
1 苯基 1 乙酮
多元醛酮:称某二醛或酮
当酮羰基和醛羰基共存时,酮羰基称羰基、酰基或氧代;
醛的异构现象是碳链异构。 酮的异构现象是碳链异构和羰基的位置异构。
三、醛酮的命名
1、IUPAC命名法
选择含羰基的最长链为主链;从近羰基的一端开始编号, 醛基总在链端;取代基位次和名称写于母体名称之前。
有机化学 第十一章 醛酮

O CCH3
山东科技大学
王鹏
化学与环境工程学院
11.3 醛酮的制备
丁酮的1H NMR谱图:
单峰
三重峰
四重峰
山东科技大学
王鹏
化学与环境工程学院
11.6 醛和酮的化学性质
醛和酮的反应部位:
氧化还原反应
亲核加成反应
O C C R (H) H
α-氢的反应
山东科技大学
王鹏
化学与环境工程学院
• 碳负离子 • 氧负离子 • 氮负离子 • 硫负离子
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
二、羰基与碳负电中心的加成
1. 与HCN的加成:
反应现象:
• 仅丙酮与氢氰酸混合,长时间加热仅得极少产物
• 加入极少量的碱,反应能迅速完成;而体系存在酸 时反应受到抑制,甚至不反应
δ+ Li
-n-BuH
H
+
_
(C6H5)3P CH2CH3Br
+ (C6H5)3P (C6H5)3P
_
CHCH3 Ylide CHCH3 磷 叶 立 德
• 磷叶立德可与羰基反应生成烯烃:
R1
Ph3P=CHR +
CO
R2
R1 C CHR
R2
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
CH3CH2CH2 C H
CH3
O CH
正丁醛
异戊醛
苯甲醛
酮:以甲酮作母体,“甲”字可省略
O
CH3 C CH2CH3
甲乙酮 甲基乙基(甲)酮
有机化学 第十一章 杂环化合物和生物碱

第十一章杂环化合物和生物碱杂环化合物和生物碱广泛存在于自然界中,在动植物体内起着重要的生理作用。
本章介绍杂环化合物的分类、命名、结构特点、性质及重要的杂环化合物,生物碱的一般性质、提取方法和重要的生物碱。
第一节杂环化合物环状有机化合物中,构成环的原子除碳原子外还含有其它原子,且这种环具有芳香结构,则这种环状化合物叫做杂环化合物。
组成杂环的原子,除碳以外的都叫做杂原子。
常见的杂原子有氧、硫、氮等。
前面学习过的环醚、内酯、内酐和内酰胺等都含有杂原子,但它们容易开环,性质上又与开链化合物相似,所以不把它们放在杂环化合物中讨论。
杂环化合物种类繁多,在自然界中分布很广。
具有生物活性的天然杂环化合物对生物体的生长、发育、遗传和衰亡过程都起着关键性的作用。
例如:在动、植物体内起着重要生理作用的血红素、叶绿素、核酸的碱基、中草药的有效成分——生物碱等都是含氮杂环化合物。
一部分维生素、抗菌素、植物色素、许多人工合成的药物及合成染料也含有杂环。
杂环化合物的应用范围极其广泛,涉及医药、农药、染料、生物膜材料、超导材料、分子器件、贮能材料等,尤其在生物界,杂环化合物几乎随处可见。
一、杂环化合物的分类和命名为了研究方便,根据杂环母体中所含环的数目,将杂环化合物分为单杂环和稠杂环两大类。
最常见的单杂环有五元环和六元环。
稠杂环有芳环并杂环和杂环并杂环两种。
另外,可根据单杂环中杂原子的数目不同分为含一个杂原子的单杂环、含两个杂原子的单杂环等。
杂环化合物的命名在我国有两种方法:一种是译音命名法;另一种是系统命名法。
译音法是根据IUPAC 推荐的通用名,按外文名称的译音来命名,并用带“口”旁的同音汉字来表示环状化合物。
例如:呋喃 咪唑 吡啶 嘌呤furan imidazole pyridine purine杂环上有取代基时,以杂环为母体,将环编号以注明取代基的位次,编号一般从杂原子开始。
含有两个或两个以上相同杂原子的单杂环编号时,把连有氢原子的杂原子编为1,并使其余杂原子的位次尽可能小;如果环上有多个不同杂原子时,按氧、硫、氮的顺序编号。
有机化学-第十一章

第十一章 胺的分类命名和结构本章要点1、分类命名结构2、化性(1)胺:碱性,霍夫曼消除,与H NO 2反应,烃基/酰基化,兴斯堡反应,氧化,苯胺环上亲电取代(2)腈:水解,还原(3)尿素:碱性,水解,与HNO 2反应 ,酰基化,缩二脲反应 (4)重氮/偶氮:取代(放N 2),偶联(不放N 2)(5)硝基化合物:还原,定位效应及对酸性的影响 一、胺的分类主要掌握伯胺、仲胺、叔胺和季铵的判别,掌握什么是胺的盐、季铵盐以及季铵碱:-NH 2 NH 2R NHRR ’ NRR ’R ’’R 4N +Cl - R 4N + OH - R 3HN +Cl -氨基 伯胺 仲胺 叔胺季铵盐 季铵碱 胺的盐二、命名 (一)脂肪胺1、一烃基取代直接称“某胺”;2、相同二烃基取代,称“二某胺”;3、不同二烃基取代,称“某某胺(小前大后)”;4、相同三烃基取代,称“三某胺”;……,以此类推;5、多元胺称“某二胺”、“某三胺”……;6、复杂取代的胺,则将氨(胺)基作取代基命名。
(二)芳胺以胺为母体,氮上有取代时要标注“N-某基”。
(三)季铵盐、季铵碱类似于无机盐和碱的命名。
例题:1、N(CH 3) 32、NH(C 2H 5)23、H 2NCH 2CH 2NH 24、Ph-NH 25、Ph -NH 3+Cl -6、CH 3NHC 2H 57、Ph-N(CH 3)28、Ph-N(CH 3)Et9、CH 2(CH 2)3CHCOOHNH 2NH 210、[NH(CH 3)3] +Cl -11、[(CH 3)2NEt 2]+OH -12、NH 2NH 213、N(CH 3)214、CH 3NH 2解:1、三甲胺 2、二乙胺 3、乙二胺 4、苯胺5、氯化苯铵6、甲乙胺7、N ,N-二甲基苯胺8、N -甲基-N -乙基苯胺9、2,6-二氨基己酸(赖氨酸) 10、氯化三甲铵 11、氢氧化二甲基二乙基铵 12、对苯二胺 13、N ,N-二甲基环己胺 14、5-甲基-2-萘胺 三、胺的结构 (一)脂肪胺1、脂肪胺中的N为sp3不等性杂化,键角大小可变;2、N具有孤对电子,因此胺具有碱性和亲核性。
有机化学 11
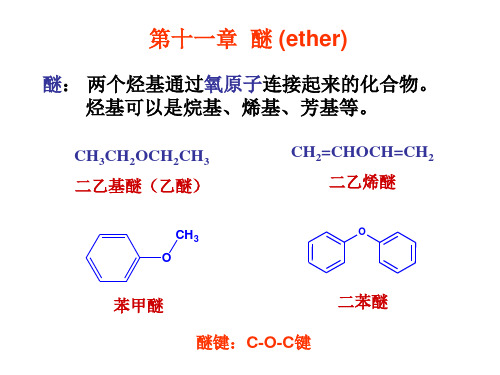
氧与二个1 相连 发生S , 相连, 氧与二个 oC相连,发生 N2, 氧与2 、 相连, 氧与 oC、 3oC相连,发生 N1。 相连 发生S 。
烷基芳基混合醚: 烷基芳基混合醚: 一起加热生成碘代烷和酚 与HI一起加热生成碘代烷和酚,酚不与氢碘酸作用 。 一起加热生成碘代烷和酚,
O
CH3 + HI
O
-
Cl
-Cl-
O
Cl
Cl
+ HOCl
OH
NaOH
O-
分子内S 分子内 N2
O
Cl OH H
NaOH E2
HO
(4) 冠谜的合成
HO-CH2-CH2-OH + 2
O
苯甲醚 醚键: 醚键:C-O-C键 键
二苯醚
醚的结构、 第一节 醚的结构、命名和物理性质 1. 分类
开链醚:没有环的醚。 开链醚:没有环的醚。
CH 3 O
CH2=CHOCH=CH2
O O O
15 16 17 14 18 O 13 O1 2 12 O 11 O 10 9 O 8 7 6 O4 3 5
链增长: 链增长:
• (CH3)2COCH3 + O2
优先形成稳定 的自由基。 的自由基。
(CH3)2COCH3 OO •
(CH3)2COCH3 + (CH3)2CHOCH3 OO • • (CH3)2COCH3 + (CH3)2COCH3 OOH
关键中间体
3. 醚的碳氧键断裂反应
CH3OCH3 + HI (1mol)
RO
- ...
... CH2
X
取代
ROCH2CH2R' + X-
有机化学第十一章 酚和醌

SO3Na
NaOH熔 融
ONa
酸 化
OH
330~340℃
此法是较早的生产方法,苯酚的收率高、质 量好、生产设备简单,但反应流程复杂、且生产 不连续,消耗大量的硫酸和烧碱,不宜大规模生 产,目前,仅用来生产萘酚和间苯二酚。
OH C C OH
用于定性分析
11.4.2 芳环上的亲电取代反应
羟基是强的邻对位定位基,由于羟基与苯环的P-π 共
轭,使苯环上的电子云密度增加,亲电反应容易进行。 1. 卤代 苯酚在室温下与溴水反应,生成2,4,6-三溴苯酚的 白色沉淀,反应定量进行,常用于酚的定量、定性 分析试验。
Br
OH
Br2/H2O
OH +
H
OH (20%)
25℃
OH NO2 + NO2
=
O
= N
O O HO
N
O
HO
=
N O 分子间氢键 (沸点较高)
O
O
分子内氢键 (沸点较低)
故可借助水蒸气蒸馏将二者分开。
浓硝酸的氧化性很强,如用浓硝酸进行硝化, 则易将苯酚氧化,所以多硝基苯酚不能用苯酚直接硝
化的方法制备。如2,4-二硝基苯酚是由2,4-二硝基
• 酚的沸点和熔点较高都比相对分子质量相近的烃高, 这是由于酚分子之间可发生氢键缔合。
酚易溶于醚等有机溶剂,有腐蚀性、毒性、杀菌性。 如苯酚和甲酚。在十七世纪的欧洲,没有发明青霉 素之前,很多人因不小心弄出个小口子,都可能因 感染而死,那时人们用石炭酸(苯酚)消毒,但它 不仅杀死了细菌,连正常的组织也被破坏,有时甚 至不如不用。 •将甲酚(甲基苯酚的混合物)用肥皂水溶解成 40%的溶液,即医院中消毒常用的“来苏水”。
有机化学:第十一章 羧酸及其衍生物
O18
CH3C-OC(CH3)3 + H2O
由于R3C+易与碱性较强的水结合,不易与羧酸结合,故逆向 反应比正向反应易进行。所以3oROH的酯化反应产率很低。
④ 酯化反应的特殊机理:酰基正离子机理
少量空阻大的羧酸按此反应机理进行。
O
O
+
C-OH
C-OH2
CH3
CH3 H2SO4(浓) CH3
CH3
O
+C CH3CH3ຫໍສະໝຸດ +OCCH3
CH3
CH3
CH3
CH3
OH C-O+ CCHH33
-H+ CH3
O
C-OCH3 CH3
CH3
CH3
反应方式:酸脱羟基醇脱氢。
CH3
CH3
O H+
CH3C-OH
+OH CH3C-OH
加成
HOC2H5
OH
CH3-C-OH
HO +
C2H5
四面体正离子
质子转移
OH
+
CH3-C-OH2
OC2H5
-H2O
+OH
-H+
O
消除 CH3C-OC2H5
CH3C-OC2H5
按加成--消除机制进行反应,是羧酸中羧基的C-OH键断 裂,醇中的O-H键断裂。
③ 酯化反应的特殊机理:碳正离子机制
OH
O RC
OH
O RC
O
O RC
O
O RC
O
p-π共轭, 键长完全平均化
键长平均化
C=O比醛酮中C=O键长(0.123nm)要长; C-O比醇的C-O键长(0.143nm)要短。
有机化学第十一章羧酸衍生物

肪 硬脂酸(十八碳酸)Fra bibliotek酸 花生四烯酸(二十碳酸)
棕榈油酸(9-十六碳烯酸)
结构式 CH3(CH2)10COOH CH3(CH2)12COOH CH3(CH2)14COOH CH3(CH2)16COOH CH3(CH2)18COOH
CH3(CH2)5CH=CH(CH2)7COOH
不 油酸(9-十八碳烯酸)
② 酸酐的氨(胺)解 酸酐与胺反应,除产生酰胺外,还有一分子羧 酸,因此反应中经常加入三级胺,以中和反应产生的酸。
③ 酯的氨(胺)解 酯可以与氨或胺反应形成酰胺。氨或胺本身作 为亲核试剂,进攻酯羰基碳。
④ 酰胺的氨(胺)解 酰胺与氨(胺)反应是一个胺的交换反应。
2.异羟肟酸铁盐反应 除酰卤外,酸酐、酯和酰伯胺均能与羟胺反应生成异羟肟酸,异 羟肟酸与三氯化铁作用,得到紫红色的异羟肟酸铁盐,这一反应常用 来鉴别酸酐、酯和酰胺,称为异羟肟酸铁盐反应。
有机化学
第十一章 羧酸衍生物
学习目标
1. 掌握羧酸衍生物的结构特征、分类、命名方法及主要化学性质; 2. 理解不同羧酸衍生物在化学性质上的异同; 3. 了解常见羧酸衍生物的性质和用途; 4. 学会油脂和类脂化合物的鉴别方法。
第十一章 羧酸衍生物
羧酸分子中的羟基被其它原子或基团取代所生成的化合物,主要 有酰卤、酸酐、酯、酰胺,其分子结构中均含有酰基,因而也被称为 酰基化合物。
1.水解反应
在酸、碱或酶的作用下,油脂可发生水解反应。在酸性条件下,
油脂水解生成高级脂肪酸和甘油,该反应为可逆反应。
在碱性条件(如NaOH或KOH)下,油脂水解生成甘油和高级脂肪
酸钠(钾)盐。高级脂肪酸钠盐俗称肥皂。因此,把油脂在碱性溶液
中的水解反应称为皂化反应。
有机化学第十一章酚与醌

氧化反应
酚易被氧化,如苯酚在空气中放置会逐渐氧 化成粉红色。
缩合反应
酚可与醛或酮发生缩合反应,生成酚醛树脂 或酚酮树脂。
醌的反应及应用
加成反应
醌可与亲核试剂发生加成反应,如与氢氰酸加成生成α-羟基腈。
还原反应
醌可被还原成酚,常用的还原剂有金属氢化物、硫化物等。
取代反应
醌环上的氢原子可被卤素、硝基等取代,生成相应的卤代醌或硝基醌。
实验安全注意事项
实验过程中需佩戴防护眼镜和 手套,避免试剂飞溅或接触皮
肤。
1
使用浓硫酸时应特别小心,避 免溅到皮肤或衣物上。若不慎 接触,应立即用大量清水冲洗
并就医。
加热回流过程中应注意控制温 度,避免温度过高引发危险。
实验结束后应妥善处理废液和 废弃物,保护环境。
06
知识拓展与前沿动态
酚和醌在自然界中的存在和作用
实验操作步骤详解
01
在圆底烧瓶中加入适量苯酚和乙醇,加热回流。
02
通过滴液漏斗缓慢滴加浓硫酸,同时观察反应现象。
03
反应完成后,将反应液冷却并用氢氧化钠溶液中和,析
出醌。
实验操作步骤详解
4. 醌的性质实验
将醌溶于少量有机溶剂 (如乙醇)中,观察其溶 解性。
取少量醌晶体,观察其颜 色、状态。
向醌溶液中滴加溴水或氯 化铁溶液,观察颜色变化。
有机化学第十一章 酚与醌
contents
目录
• 酚的概述与性质 • 醌的概述与性质 • 酚与醌的合成方法 • 酚与醌的反应及应用 • 实验操作与注意事项 • 知识拓展与前沿动态
01
酚的概述与性质
酚的定义与分类
定义
羟基直接连在芳香环上的化合物称为 酚。
有机化学:第十一章 羧酸和取代羧酸亲核加成-消除反应

3. 酸酐的生成
脱水剂:乙酰氯、乙酸酐、P2O5
O R—C—OH
O R—C—OH
例如:
P2O5
或强热
酐键
OO R—C C—R
O
+ H2O
2
COOH (CH3CO)2O
O
O
COC
+ 2 CH3COOH
甲酸与脱水剂共热,分解为一氧化碳和水。
HCOOH
H2SO4 60-80℃
CO + H2O
酸酐也可由羧酸盐与酰氯反应加热得到,此方法可以 制备混合酸酐。
羧酸的酸性强弱受整个分子结构的影响:
电子效应 场效应
凡能降低羧基电子云密度的基 团将使酸性增大。反之亦然。
取代基对RCOOH的酸性的影响:
G COOH
G
COO- + H+
酸性增强
G COOH
G COO- + H+
酸性减弱
(1)
CH3COOH < ClCH2COOH< Cl2CHCOOH < Cl3CCOOH
p,p-共轭体系
共平面
R—
O
—
H R—C O·· H
·
羰 基 和 羟 基 通 过 p,p- 共 轭 构 成 一 个 整 体 ,
故羧基不是羰基和羟基的简单加合。
O
R—C
P-π共轭的结果:
··O H ·
❖ 键长平均化; ❖ 羰基的正电性— 降低,亲核加成变难; ❖ 羟基 H 的酸性—增加; ❖ a-H 的活性—— 降低
HOOC-CH—CH-COOH OH OH
2,3-二羟基丁二酸 酒石酸
CH2-COOH HO— C—COOH
有机化学 11第11章_醛和酮
总目录
2. 卤代反应
(1)酸催化卤代,生成一卤代物。
O C CH3
O C CH2Br
+ Br2
CH3
CH3COOH 20℃
CH3
+
HBr
反应易停留在一取代上。
总目录
机理:
O CH3CCH3 + H∶B
+OH
CH3CCH2 H 慢
快
+O H
CH3CCH3 + ∶B
OH CH3 C CH2 + H∶B
总目录
3. 羟醛缩合反应
O 2 CH3C H
慢
稀 OH
CH3CH CHCHO
机理:
O CH3C H
+ -CH2C
O H
O CH3CHCH2CHO
H2O
OH CH3CHCH2CHO
- H2O
CH3CH CH CHO
总目录
交叉的羟醛缩合反应
CH3CH2CHO + CH3CHO 稀 OH ?
CH3CH CHCHO
如果没有保护,醛基也会被氧化!
总目录
5. 与氨及其衍生物的加成
(1)氨
H H C O OH H
+ NH2 H
H H
C
NH
(2)胺
C6H5C O H OH H
+ C6H5NH2
1°胺
C6H5
C N C6H5 H
H C C O
H
OH C NR2 C C
+ HNR2
2°胺
C
NR2
烯胺
烯胺是有机合成重要的中间体。
O
总目录
3. 与金属有机化合物反应
《有机化学》第11章 羧酸及衍生物

二元酸时选择含有两个羧基在内的最长碳链为主链,称为某二酸。例如: HOOC-COOH 乙二酸
2023/6/13
3
2023/6/13
4
二、羧酸的物理性质
常温下,C10以下的饱和一元羧酸为液体,具有较强的刺激性气味或难闻 腥臭味;C10以上的饱和一元羧酸为蜡状固体;二元羧酸和芳香族羧酸都是结 晶固体。
2023/6/13
1
第一节 羧酸
一、羧酸分类和命名 1. 羧酸的分类
⑴ 根据和羧基相连的烃基的不同,可以分为脂肪族羧酸(脂肪酸)、 脂环酸、芳香族羧酸(芳香酸);
⑵ 根据和羧基相连的烃基是否饱和可以分为饱和羧酸、不饱和羧酸; ⑶ 根据分子中羧基的数目,又可以分为一元酸、二元酸、多元酸等。
2. 羧酸的命名 ⑴ 羧酸的俗名
2. 酸酐
酸酐是将羧酸的名称后加“酐”字。例如:
2023/6/13
15
3. 酯
酯是羧酸和醇经酯化反应而得,命名时,酸的名称在前,醇的名称在后, 再加“酯”字。例如:
二、物理性质
最简单的酰氯为乙酰氯,沸点为52℃。甲酰氯在-60℃以上是不稳定的, 立即分解为一氧化碳和氯化氢。苯甲酰氯的沸点为197℃。
2023/6/13
12
5. α-H的卤代
脂肪酸中的羧基和羰基一样能使α-H活化,但羧基的致活作用比羰基小得多,要 在催化剂(常用红磷)作用下逐步卤代。例如:
红磷的作用是生成卤化磷(PCl3和PBr3),它与羧酸作用生成酰卤,酰卤的α-H卤代要比羧酸 容易得多。
2023/6/13
13
第二节 羧酸衍生物
酰氯的沸点比相应的羧酸低,低级酰氯遇水猛烈水解,水解产物能溶于水,
表面上好象是酰氯溶解。酰氯的密度大于1。 乙酐的沸点为140℃,比乙酸高,苯甲酸酐和邻苯二甲酐为固体,熔点为
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
红 red
orange 橙
greenish blue 青蓝
2008-11-19
Bluish green 青
green 绿
7
Table 11-1 Colors of visible light and complementary hue
Wavelength Absorbed/nm 380-420 420-440 440-470 470-500 500-520 520-550 550-580 580-620 620-680 680-780
2008-11-19
λmax
Absorption spectrum of iron(Ⅱ) Ⅱ -o-phenanthroline complex 14
……………… ………………
11-3 The Spectrophotometer
• Major Components Light source tungsten lamp Wavelength Selector
Chapter Eleven
Ultraviolet-Visible
Spectrophotometry
• Spectrophotometry is one of the most widely used methods of analysis in clinical chemistry, hygiene analysis, medicine analysis.
• It is used to measure the absorption capabilities of certain compounds with reference to wavelengths of light on the ultraviolet and visible light ranges.
Absorption spectrum depicts what wavelengths of light are absorbed by a sample. One can readily see what wavelengths of light are absorbed (peaks). The maximum absorption at 508nm was characteristic of the complex solution. When the concentration of complex increased, the absorption spectrum increased.
2008-11-19
20
Solution:
The percent transmittance is 80%, and so T=0.80,a=2.0,b=1.0 , ,
1 1 A = lg = abc log = 2 .0 × 1 .0 × c T 0 . 80
0 . 10 c = = 0 . 05 g / L 2 .0
Lambert–Beer,s law is strictly valid for purely monochromatic radiation; that is, for radiation consisting of only one wavelength.
Monochromatic light
2008-11-19 13
A εbc1 c1 1 = = A2 εbc2 c2
2008-11-19
A1=εbc1 A2=εbc2
Direct comparison method
A2 c2 = ×c1 A 1
16
Ⅱ. Standard Curve Method
A = abc
• c0
c1 c2 c3 c4 c5
Standard curve
2008-11-19
1
• High sensitive, can used microanalysis 10-3~10-6mol/L e.g. There is 10-8g Fe in 10ml solution, if titrate it using KMnO4 standard solution (c=2.0×10-4 mol/L), only consumed 0.02ml × KMnO4 standard solution.
· ·
A0 A1 A2 A3 A4 A5
The graph should be a straight line.
·
Ax ·········· ·
··········· cx
·
2008-11-19
17
• Analytical Procedures
1) Selection of monochromatic light (Choice of Wavelength) 2) Prepare a reagent blank containing all reagents, but with analyte replaced by distilled water. 3) Prepare a series of standards solution and measure their absorbance 4) Establish a calibration curve 5) the unknowns be prepared using the same procedure as for standards solution 6) Calculate the content of unknown
monochromator
Sample cell cuvette
a grating
indicator scale
2008-11-19
Light detector phototube
15
11-4 Typical Analytical Procedures
Methods and Applications of Spectrophotometry Ⅰ. Direct comparison method
Ia
c b
9
Io A = lg = abc Lambert–Beer,s law I
A- absorbance a - absorptivity (L·g-1·cm-1 ) b - path length (cm) c - mass concentration (g/L) c:mass concentration(g/L)→ concentration (mol·L-1) a:absorptivity (L/g·cm ) → ε (L·mol-1·cm-1 ) : ε:the molar absorptivity :
2008-11-19
2
11-1 Properties of Light 11-2 Absorption of Light * 11-3 The Spectrophotometer 11-4 Typical Analysis Procedures
2008-11-19
3
11-1 Properties of Light
8
11-2 Absorption of Light
Lambert – Beer,s law
Io lg = abc I
Absorbance The absorbance (A) of a sample is the logarithm of the ratio of Io / I .
2008-11-19
A=abc = - logT = -log0.80 = 0.0969
• Lambert – Beer,s law, commonly called Beer's law: Absorbance is directly proportional to the concentration of light-absorbing species in the sample and the pathlength of the solution.
• T: range 0 ~ 1 between 0 and 100%. • When no light is absorbed T=1=100% , P=P0 and A=0 I= I0 and A=0
2008-11-19 12
• l00·T : (the percent transmittance) varies
A = ε bc
2008-11-19 10
Transmittance (T) is the ratio of I/Io .
I T= Iο
Io 1 A = lg = lg = −lg T I T
Io 1 A = lg = lg = εbc T I
2008-11-19 11
p0 A = log = − log T = kcb p
2008-11-19
Color Color absorbed observed Violet Green-yellow Yellow Violet-blue Blue Orange Blue-green Red Green Purple Yellow-green Violet Yellow Violet-blue Orange Blue Red Blue-green Purple Green
2008-11-19 18
Choice of λmax Prepare solutions
Analytical
Measure their absorbance
Procedures Establish a calibration curve
Calculate the content of unknown
• Light is electromagnetic wave • The dual nature of particles and waves *Wavelength λ unit: nm *Frequencyν (Hz) unit of frequency is s-1 Hertz: One oscillations per second is called 1Hz 106 s-1 is therefore said to be 106 Hz, or one megahertz (MHz). 1 *Wavenumber v = unit: nm-1, m-1, cm-1
