第九章 专题三 化学反应速率、化学平衡的图像
化学反应速率及平衡图象

平衡状态Ⅰ
V逆
0
t1
t2
t3
t(s)
速率~时间关系图 2
当减小反应物浓度时
移动方向:
V’正< V’逆
逆向
3
温
逆向
度
正向
对
化
学
平
衡 逆向
的
影
正向
响
4
压 强 对 化 学 平 衡 的 影 响
5
思考:对于反应
高温
H2O+CO
H2+CO2
催化剂
如果增大压强,反应速率是否改变,平衡是否移动?
速率-时间:
22
解题方法和技巧:
1、审题:ΔH的正负;有无固体、纯液体;体积变化 2、看图象: 一看面:认清纵、横坐标所代表的意义。 二看线:走向、趋势 三看点:起点、拐点、终点、交点、最高点。
23
3、常见情况总结
1>“v – t”图中,速率突变一般为改变温度或压
强,渐变为浓度
2>速率改变但平衡不动的情况,可能为催化 剂或压强(m+n=p+q)
V(molL-1S-1)
V正= V逆
V’正= V’逆 V”正= V”逆
0
t2
增大压强,正逆反应速 率均增大,但增大倍 数一样, V’正= V’逆, 平衡不移动。
T(s)
6
催化剂对化学平衡的影响
催化剂同等程度改变化学反应速率, 即V’正= V’逆,只改变反应到达平衡所需要的时 间,而不影响化学平衡的移动。
示。据此分析 X、Y、W、Z的聚集
状态是
(B ) v
A. Z、W均为气态,X、Y中有一种为气体
B. Z、W中有一种为气体,X、Y均为气体
化学反应速率与化学平衡图象

0
t1
t2 时间
二、化学平衡图象 mA(g)+nB(g) pC(g)+qD(g) A%
问题: 1、P1与P2的相对大小 2、m+n 与 p+q 的大小
P2 P1
答 案
P1 > P2 m+n > p+q
0
时间
二、化学平衡图象
4.转化率——时间曲线 mA(g)+nB(g) pC(g)+qD(g)
A的 转 化 率
V
V逆 V正
V'正 V'逆 突变
答:从逆反应开 始。
降温或减压。
平衡向正反 应方向移动。
t
练 习
看图:说出反应起始时是从正反应;还是从 逆反应开始?然后是改变什么条件?化学平衡向 什么方向移动?
V
V正 V逆
V'正 = V'逆 突变
答:正、逆反应 同时开始。
加催化剂或加 压(反应前后气体 体积不变)时,平 衡不移动。
t
2.速度-时间图:
对于mA(g)+nB(g) pC(g)+qD(g),改变压强时 有如下图变化,则压强变化是 增大 (增大或 减小),平衡向 逆 反应方向移动,m+n < (>、<、=)p+q。
v
v逆
v正
v v逆 v正
t t t1 t2 t1 t2 •若对以上反应已知m+n>p+q,平衡后降低压强时, 画出相关的 V –t 图。
等压线
m+n < p+q Q < 0
0
P
压强
二、化学平衡图象
3.物质百分含量——时间曲线
化学反应速率和化学平衡图像

化学反应速率和化学平衡图像图像分析要领2SO2(g)+O2(g)2SO3(g) t随后逐渐增加,说明改变的条件是增加反应物的浓度。
CH4(g)+H2O(g)CO(g)+3H2(g)ΔH>0tmA(g)+nB(g)qC(g)+pD(g) “定一议二”。
m+n>q+p时2NO(g) + 2CO(g)N2(g)+2CO2(g) 先拐先平,先平者高。
T投料比图2SO2(g)+O2(g)2SO3(g) △H<01.b应对应物质的化学计量数之n2.T3.平衡向右移动,分数先增大后减小定位题组1.对于可逆反应:2SO 2(g)+O 2(g)2SO 3(g)△H<0,下列研究目的和示意图相符的是2.工业上可利用CH 4(g)+H 2O(g)CO(g)+3H 2(g)反应生产合成氨原料气H 2。
已知温度、压强和水碳比[)()(42CH n O H n ]对甲烷蒸汽转化反应的影响如下图:图1(水碳比为3) 图2(水碳比为3) 图3(800℃)(1)降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);升高温度,平衡向____________方向移动(选正反应或逆反应)。
(2)图2中,两条曲线所示温度的关系是:t 1_____t 2(选填>、=或<);图1中,在800℃、2MPa 比1MPa 时的甲烷含量_______(选填高、低或不变),3.甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH 4和H 2O 为原料来制备甲醇。
(1)将1.0 mol CH 4和2.0 mol H 2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH 4(g)+H 2O(g) CO(g)+3H 2(g)……Ⅰ,CH 4的转化率与温度、压强的关系如图。
①已知100 ℃时达到平衡所需的时间为5 min 。
则用H 2表示的平均反应速率为________。
化学反应速率与化学平衡——图像专题(共52张PPT)
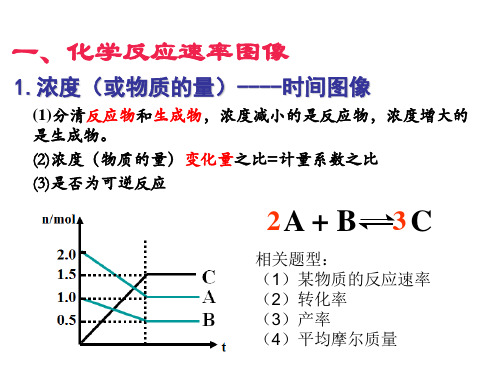
v
v正 v逆 t
v
t1
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
2.速率----时间图像
原因分类: (1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1 t2
t
v逆 v正
t1 t2
t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g) pC(g)+qD(g),条件改变时有 右图变化,改变的条件可能 加正催化剂 ; 为:a.____________ 加压 ,m+n___p+q b.________ ;平 = 正 反应方向移动。 衡向____
mA(g)+nB(g)
A 的 转 化 率
pC(g)+qD(g) ΔH
T2C T1C
答 问 案 题
1、T1>T 与T 2 2的高低 2、是放热反应 ΔH<0 、放热反应还是吸热反应
看图技巧:
0
t1
t2
时间
(1)看清横纵坐标含义 (2)先拐先平衡数值大 (3)平衡移动
二、化学平衡图像
1.含量——时间图像
看图技巧:
(1)看清横纵坐标含义 (2)先拐先平衡数值大 (3)平衡移动
课堂练习
mA(g)+nB(g)
A 的 转 化 率
pC(g)+qD(g) ΔH
高中化学【化学反应速率和化学平衡图像】

平衡
100%
CH3OH的平衡产率=
n CH3OH平衡 n CO2 初始
100%
其中纵坐标表示CO2平衡转化率的是图___________(填“甲”或“乙”);压强p1、p2、
p3由大到小的顺序为___________;图乙中T1温度时,三条曲线几乎交于一点的
原因是___________。
答案:(3). 乙 p1、p2、p3 等,压强改变对平衡没有影响
D.t3~t4
E.t4~t5
F.t5~t6
(2)判断 t1、t3、t4 时刻分别改变的一个条件。
A.增大压强
B.减小压强 C.升高温度
D.降低温度
E.加催化剂 F.充入氮气
t1 时刻________;t3 时刻________;t4 时刻________。 (3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 ________。
率与nn( (C HO 2OS) )的关系如图 2 所示。
ቤተ መጻሕፍቲ ባይዱ
①由图 1 可知,催化剂活性最大时对应的温度约为
____________,COS 的转化率在后期下降的原因是_______。
②由图 2 可知,P 点时平衡常数 K=________(保留 2 位有效数
先拐先平数值大
2.转化率(或质量分数)与压强—温度图像 (1)恒压线图像
(2)恒温线图像
定一议二
3.化学平衡中的其他图像 (1)对于化学反应:mA(g)+nB(g) pC(g)+qD(g),M 点前,
表示从反应开始,v(正) >v(逆);M 点为刚达到平衡点;M 点后为平衡受温度的影响情况,即升温,A 的百分含量增加 或 C 的百分含量减少,平衡左移,故 ΔH<0。
化学平衡和速率图像

3.“平台”类 v-t 图——催化剂(或压强)对化学反应 速率的影响
图像中 v′(正)、v′(逆)都是突然增大,且增大的程度 相同,t1 时刻,图像中出现了“平台”,化学平衡不发生移 动,改变的条件可能是使用了催化剂也可能是对反应前后气 体总体积不发生变化的反应增大了压强。
(2)解题原则——“先拐先平数值大”。 在化学平衡图像中,先出现拐点的反应则先达到平衡,先出 现拐点的曲线表示的温度较高(如图Ⅰ中 T2>T1)、压强较大(如图 Ⅱ中 p2>p1)或使用了催化剂(如图Ⅲ中 a 使用了催化剂)。
Ⅰ.表示 T2>T1,生成物的百分含量降低,说明正反应是放热 反应,温度升高,平衡逆向移动。
图像Ⅱ中,v′(正)渐变,v′(逆)突变,t1 时刻图像中有一条线是 连续的,且 v′(正)>v′(逆),说明 t1 时刻改变的条件是减小了生成 物的浓度,使 v′(逆)突变,平衡正向移动。
2.“断点”类 v-t 图——温度(或压强)对化学反应速率的影响
图像Ⅰ中,v′(正)、v′(逆)都 是突然增大的,t1 时刻,图像中出现 了“断点”,且 v′(正)>v′(逆), 平衡正向移动,说明该反应的正反 应可能是吸热反应(或气体总体积减 小的反应),改变的外界条件B(g) pC(s)+qD(g)反应过程中,
其他条件不变时,产物 D 的质量分数 D%与温度 T 或压强 p
的关系如图所示,请判断下列说法正确的是
A( )
A.降温,化学平衡向正反应方向移动
化学反应速率和化学平衡的图像

化学反应速率和化学平衡的图像
1.速率-时间图此类图像定性揭示了V正、V逆随时间(含条件改变对化学反应速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
2.含量―时间―温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。
3.恒压(温)线该类图像的纵坐标为物质的平衡浓度(c)或反应物的转化率( ),横坐标为温度(T)或压强(p),常见类型如下图:
小结
1.图像分析应注意“三看”
(1)看两轴:认清两坐标轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定一议二”的方式进行分析。
反应速率、化学平衡图像

C%
问 答 题 案
看图技巧:
先拐先平,速率快
0
t1
t2 时间
3.物质百分含量—压强/温度(ɑ%-p/T)曲线
mA(g)+nB(g) pC(g)+qD(g) ΔH=QKJ/mol
A%
等压线
300C 200C 100C 练习:比较大小
m+n < p+q Q<0
看图技巧: 定一议二
0
P
压强
巩固练习:
练习1:右图表示800℃时,A、B、C三种气体物质的浓 度随时间的变化情况,t1是到达平衡状态的时间。试回 答: (1)该反应的反应物是: A ; (2)反应物的转化率是: ; 40% (3)该反应的化学方程式为
2A=B+3C
。
练习2、图中a曲线表示一定条件下的可逆反应: X(g)+Y(g) 2Z(g)+W(g); △H =QkJ/mol 的反应过程。若使a曲线变为b曲线,可采取的措施 是( A ) A、加入催化剂 B、增大Y的浓度 C、降低温度 D、增大体系压强
练习4:温度一定,压强分别为P1和P2 时,反应体系
X(s)+2Y(g)
nZ(g)中反应物Y的转化率与时间的关系
如图2-27所示,由此可知(
A
)。
A、P1>P2阿 ,n>2
C、P1<P2,n<2
B、P1>P2,n<2
D、P1<P2,n>3
练习4.如图所示,反应:X(气)+3Y(气) 2Z(气);△H<0 。 在不同温度、不同压强(P1>P2)下达到平衡时,混合气 体中Z的百分含量随温度变化的曲线应为( C )
化学反应速率图像课件

v
逆
C
6000C 正
4000C
0
P
0
t
正反应气体体积数增大
△H<0
化学反应速率图像
(图A上逆下正、图B上正下逆、图D为跳跃型,上逆下正)
1、加催化剂对速率影响的图象是( )。 2、增大O2的浓度对速率影响的图象是( ) 3、 减小反应容器体积对速率影响的图象是( )。 4、升温对速率影响的图象是( )
化学反应速率图像
例:合成氨反应:N2+3H2
2NH3 △H < 0 。如图只改变某一
A.若a+b=c,则t0时只能是增大了容器的压强 B.若a+b=c,则t0时只能是加入了催化剂 C.若a+b≠c,则t0时只能是增大了容器的压强 D.若a+b≠c,则t0时只能是加入了催化剂
化学反应速率图像
化学反应速率图像的分析技巧 分析图像问题时,应从以下几个方面着手: (1)看起点,分清反应物和生成物,浓度减小的是反应物, 浓度增大的是生成物,生成物多数以原点为起点。 (2)看变化趋势,分清正反应和逆反应,分清放热反应和吸 热反应。 (3)看终点,分清消耗浓度和增加浓度,反应物的消耗浓度 和生成物的增加浓度(或物质的量)之比等于反应方程式中各物 质化学计量数之比。 (4)时间—速率图像,看清曲线是连续的还是跳跃的,分清 “渐变”和“突变”、“大变”和“小变”。
化学反应速率图像
【典例 1】一定温度下,在 2 L 的密闭容器中,X、Y、Z 三种 气体的物质的量随时间变化的曲线如图 所示:
(1)写出反应的化学方程式; (2)反应开始到 10 s ,用 Z 表示的平均反应速率; (3)反应开始到 10 s 时,求出 Y 的转化率为。
化学反应速率图像
类型2.速率—时间图像及其应用
化学平衡图像及等效平衡

练习3
右图表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时 ,由于条件改变而引起反应 速度和化学平衡的变化情况,ab过程中改变 的条件可能是 ;bc过程中改变的条件可能 是 ; 若增大压强时,反应速度变化情况 画在c—d处.
V正
V逆
升温
减小[SO3]
三、x% – t 图
x% (或用φ(C) 表示) 可以表 示反应物、生成物在反应体系中的 物质的量百分数(体积分数)、或 表示反应物的转化率等; t表示时间;
V
V正 V逆
A t
V正
V逆 D t
V正
B t
V正
C t
说明
上述图象的特点是有一速 率改变,随后正逆反应速率再 发生变化,直至两者相等建立 新的平衡。是改变某一物质浓 度而引起化学平衡移动的特征。
二、v – t 图
练习2
练习2
在密闭容器,一定条件下进行反应, mA(g)+nB(g) pC(g)+qD(g) 若增大压强或升高温度,重新达到平衡,变化过 程均如图所示,则对该反应叙述正确的是(BD ) A.正反应是吸热反应 B.逆反应是吸热反应 C.m+n>p+q D.m+n<p+q
例3:下列图线分别有哪些含义?
V V V V
V正 V逆 A
t
V正 V逆
V逆 V正
V逆 V正
t
B
t
C
D
t
A.升温时,正、逆反应速率均增大,但吸热反应方 向的速率增得更多,正反应为吸热反应; 或气体反应时增压,正逆反应速率均增大,但气体 体积大的增大得更多,正反应为气体缩小的反应。 C与A 正、逆相反。
化学反应速率与化学平衡——图像专题(共52张)
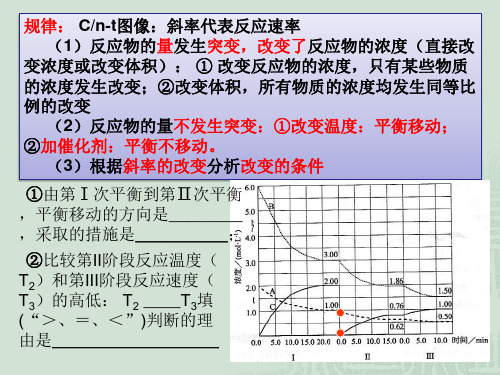
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
化学平衡图像专题(超详细版)

一、浓度 - 时间图:
例:
c
0.9 0.6 0.3
可用于:
1)写出化学反应方程式:
C A B
t
A+2B 3C A的转化率=33.3% B的转化率=66.7%
2)求反应物的转化率:
使用催化剂
练习:反应N2(g)+3H2(g)
2NH3(g) △H<0 在某一时间段中
反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的
时间段是( A.t0-t1 C.t3-t4
) ,氨DB的..Att百25--分tt含63 量最高的时间D段是( )
mA(g)+nB(g)
C% C2% C1%
t2
引起平衡移动的因素是 __增__大__反__应__物__浓__度__,平衡将
t 向_____方向正移动。vΒιβλιοθήκη v正v逆t1
t2
引起平衡移动的因素是 _减__小__生__成__物__浓__度___,平衡将
t 向_____方正向移动。
已知对某一平衡改变温度时有如下图变化, 则温度的变化是________(升高或降升低高),平衡向 ______反应方向移动,正正反应是______热反应。
pC(g)+qD(g)
A%
200℃ 300℃
正反应吸热 m+n=p+q
P
判断m+n与p+q的关系?正反应是放热还是吸热?
对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有 如下图所示的变化,图中Y轴可能表示:
《化学反应速率和化学平衡的图像》

增大压强
v(正)、v(逆)均增大; 若Δ Vg<0,则v(正)强变, υ (逆)弱变;v(正)>v(逆),平衡 向右移动
减小压强
v(正)、v(逆)均减小; 若Δ Vg<0,则v(正)强变, υ (逆)弱变;v(正) <v(逆),平 衡向左移动
改变压强
v(正)、v(逆)均增大(或减 小); 若Δ Vg=0, 则v(正) =v(逆), 平衡不移动
[例3]
可逆反应aA(g)+bB(g) cC(g)+dD(g) △H<0 在相同温度、不同压强时,A的转化率跟反应时间 的关系如图,则P1 < P2, a+b < c+d (填>、<或=)
先拐先平, P2>P1
P1 →P2 增大压强,A的转化率减小,
则平衡逆向移动,逆向为气体系数减小的反应
[小结]
看图,分析图像特点→依据图像的拐点→比较
温度或压强的的大小→分析改变条件后,y轴的变
化情况→结合平衡移动原理 →得到相关结论
[练习3]
在密闭的容器中进行如下的反应: H2(g)+I2(g) 2HI(g),在温度T1和T2时,产物的 量与时间的关系如下图所示,符合图象的正确的判 断是( D) A.T1>T2,△H>0 B.T1>T2,△H<0 C.T1<T2,△H>0 D.T1<T2,△H<0
化学反应速率和化学 平衡的图像
考试说明要求
理解外界条件(浓度、温度、压强、催化剂等) 对反应速率及化学平衡的影响,认识其一般规 律。
1.反应速率—时间图象 2.反应速率—温度(压强)图象 3. 含量—时间-温度(压强)图象 4. 转化率—温度、压强图象
1、浓度对化学反应速率影响及平衡移动的图像
条件变化 速率变化和平衡移动方向 V—t图像
化学反应速率、化学平衡的图像分析

B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
化学
首页
上一页
下一页
末页
热点专题课 化学反应速率、化学平衡的图像分析 结束
[解析] 解答该题要综合运用“定一议二”和“先拐先
平”。由(T1,p1)和(T1,p2)两条曲线可以看出:①温度(T1)相 同,但压强为p2时先出现“拐点”,达到平衡所需的时间短,即 反应速率大,所以p2>p1;②压强较大(即压强为p2)时对应的w(B) 较大,说明增大压强平衡逆向移动,则a+b<c。由(T1,p2)和 (T2,p2)两条曲线可以看出:①压强(p2)相同,但温度为T1时先出 现“拐点”,达到平衡所需的时间短,即反应速率大,所以
入一体积为 1 L 的恒温密闭容器中,反应物浓度随时间变化
关系如图所示,回答下列问题:
化学
首页
上一页
下一页
末页
热点专题课 化学反应速率、化学平衡的图像分析 结束
题组一 1 题组二 2 题组三 3 题组四 4 5 题组五 6 7
(1)图中共有两条曲线 X 和 Y,其中曲线______表示 NO2 浓度 随时间的变化;a、b、c、d 四个点中,表示化学反应处于平衡
热点专题课 化学反应速率、化学平衡的图像分析 结束
热点专题课
化学反应速率、化学平衡的图像分析
一、解答化学反应速率、化学平衡图像题的一般原则方法
(1)看图像:一看轴,即纵、横坐标的意义;二即线的走向和变 化趋势;三看线,看点:即起点、拐点、交点、终点;四看辅助线, 即等温线、等压线、平衡线等;五看量的变化,如浓度变化、温度 变化、转化率变化、物质的量的变化等。
化学反应速率和平衡图像

化学反应速率和平衡图像一、回顾1.影响化学反应速率的外界因素2.影响化学平衡的外界因素二、内容1.速率—时间图解法识记:1.增加反应物浓度,v正跳上得更大;减小反应物浓度,v正跳下得更大2.增加生成物浓度,v逆跳上得更大;减小生成物浓度,v逆跳下得更大3.升高温度,吸热方向跳上得更大;降底温度,吸热方向跳下得更大4.增大压强,计量数减小方向跳上得更大;减小压强,计量数减小方向跳下得更大若v正在v逆的上方,即平衡向正反应方向移动;若v逆在v正的上方,即平衡向逆反应方向移动。
2.浓度(或物质的量)—时间图1.可逆反应a X(g)+b Y(g) c Z(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)—时间(t)图象如图,则下列说法中正确的是()A.若a+b=c,则t0时只能是增大了容器的压强B.若a+b=c,则t0时只能是加入了催化剂C.若a+b≠c,则t0时只能是增大了容器的压强D.若a+b≠c,则t0时只能是加入了催化剂【典例2】(2013·成都模拟)可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
1)根据图1请写出合成氨的热化学方程式______________________________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的___________条件,该条件的改变与图2中哪一时刻条件的改变相同_________(用“t1…t6”表示)。
(3)图2中t3时刻改变的条件是_______________,t5时刻改变的条件是___________。
答案:(1)N2(g)+3H2(g) 2NH3(g)ΔH=-2(E3-E1)kJ·mol-1(2)催化剂t2…t3 (3)减小压强升高温度8、这个世界并不是掌握在那些嘲笑者的手中,而恰恰掌握在能够经受得住嘲笑与批忍不断往前走的人手中。
9、障碍与失败,是通往成功最稳靠的踏脚石,肯研究、利用它们,便能从失败中培养出成功。
2024届高考一轮复习化学课件:化学反应速率和平衡图像及分析

图像
温 升高
降低
t1时刻 度 正反应为放热的反应
所改变
增大
减小
压
的条件
正反应为气体物质的量增大的反
强
应
升高
降低
正反应为吸热的反应
增大
减小
正反应为气体物质的量减小
的反应
3.“平台”类v-t图像及分析
图像
分析
结论
其他条件不变,t1时使用
t1时v'(正)、v'(逆)均突然 催化剂
增大且v'(正)=v'(逆),平衡 其他条件不变,t1时增大
增大X或Y的浓度,平衡正向移动,则Z的浓度增大,D错误。
考点二
化学平衡图像
必备知识 自主预诊
1.浓度(转化率、百分含量)—时间图像及分析
C%指生成物的百分含量,B%指反应物的百分含量。
(a 用催化剂,b 不用)
(T2>T1,正反应为吸热反应)
(T2>T1,正反应为放热反应)
(p1>p2,正反应为体积减小的反应)
D.反应进行至25 min时,曲线发生变化的原因是增加Y的浓度
思路导引(1)分析体系及反应特点:①恒温恒容体系;②正反应是气体体积
减小的放热反应。
(2)分析图像:横坐标是时间,纵坐标是浓度
的大小;25 min 时 c(Y)逐渐增大,c(X)瞬间增大
图中曲线的斜率表示反应速率
外界条件的变化。
答案 D
mol
(1- + 3-3 + + )mol
×100%=30%,解得x=0.75,则CO2的转化率为75%,B正确;随着温度的升高,
甲醇的体积分数减小,平衡向逆反应方向移动,正反应为放热反应,压强越
化学反应速率与化学平衡 图像专题-化学反应速率与化学平衡

2
4
6
8
二. c(n)-t [浓度(物质的量)—时间] 图像
题型2.以浓度-时间图像描述等效平衡过程 例2. 在425℃时,1L密闭容器中进行反应: H2(g)+I2(g) 2HI(g),以不同的方式加入反应物 或生成物均达到平衡(下图)
2.00 2.00 C/(mol· L-1) HI H 2 或 I2 2.00 C/(mol· L-1) HI
C/(mol· L-1)
1.58
1.00 0.21 HI
1.58
1.00 0.21 t1 t/s
1.58
1.00 0.21 t1 t/s
0
H 2 或 I2
A
0
B
0
H 2 或 I2
C
t1 t/s
化学反应速率与化学平衡图像专题
图像问题解题步骤 (1) 看懂图像: ①看面(即弄清纵坐标与横坐标的意义); ②看线(即弄清线的走向和变化趋势); ③看点(即弄清起点、拐点、交点、终点的意义); ④看是否要作辅助线(如等温线、等压线); ⑤看定量图像中有关量的多少。
(2) 联想规律:联想外界条件的改变对化学反应速率和化学平衡
【练习】2. 最新“人工固氮”的研究报道:常温常压、 光照条件下,N2在催化剂表面与水发生反应: 2N2(g)+6H2O(l) 4NH3(g)+ 3O2(g) 常温下,在恒压密闭容器中上述反应达到平衡后, 在其他条件不变时,通入2molN2,请在右图中画出 正(v正)、逆(v逆)反应速率随时间 t 变化的示意图。
v
t
一. v-t (速率—时间) 图像
高中化学课程课件 化学反应速率、平衡图像

2.如图是温度和压强对反应X+Y 2Z影响的示意图。图中横坐标表示 温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是 A.上述可逆反应的正反应为放热反应 B.X、Y、Z均为气态
√C.X和Y中最多只有一种为气态,Z为气态
D.上述反应的逆反应的ΔH>0
图像
温度 t1时刻 所改变
升高
降低
正反应为放热的反应
增大
减小
的条件 压强 正反应为气体物质的量增
大的反应
升高
降低
正反应为吸热的反应
增大
减小
正反应为气体物质的量减
小的反应
应用体验
在一密闭容器中发生反应N2+3H2 2NH3 ΔH<0,达到平衡后,只改 变某一个条件时,反应速率与反应时间的关系如图所示。
由图可得出的正确结论是 A.反应在c点达到平衡状态 B.反应物浓度:a点小于b点 C.反应物的总能量低于生成物的总能量
√D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
3.物质的量(或浓度)—时间图像 例如:某温度时,在定容(V L)容器中,X、Y、Z三种物质的物质的量随 时间的变化曲线如图所示。 (1)由图像得出的信息 ①_X__、__Y_是反应物,_Z__是产物。 ②t3 s时反应达到_平__衡__状态,X、Y并没有全部 反应,该反应是_可__逆__反应。 ③0~t3 s时间段:Δn(X)=_n_1_-__n_3_mol,Δn(Y)=_n_2_-__n_3_mol,Δn(Z)= _n_2_mol。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__A__。
A.t0~t1
B.t2~t3
C.t3~t4 D.t5~t6
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.对于可逆反应:A(g)+2B(?) 2C(g),在不同温
度及压强(p1, 2)条件下, p 反应物 A 的转化率如图所示, 下列判断中正确的是 ( )
A.ΔH>0,B为非气态
B.ΔH>0,B为气态
C.ΔH<0,B为气态
ΔnX 0.79 mol - B 项:Δc(X)= V = =0.395 mol· 1; L 2L n转 0.79 mol C 项:Y 的转化率为= = =79.0%; n总 1.00 mol D 项:化学方程式系数之比等于转化的各物质的物质的量 之比并等于各物质的反应速率之比, 所以化学方程式为 X(g)
A.反应的化学方程式为 5Y X
B.t1 时,Y 的浓度是 X 浓度的 1.5 倍 C.t2 时,正、逆反应速率相等 D.t3 时,逆反应速率大于正反应速率
解析:t1 min 内 ΔY∶ΔX=(10-6) mol∶(4-2.5) mol=
8∶3, 因此反应的方程式为 8Y
(3)物质的含量—时间图,即X%t图 [图像特点] 该图像的纵坐标是反应物或生成物中一种物质的含 量,横坐标是时间,图像表示的是在不同的压强或温度下, 反应达到平衡时所需的时间与平衡时物质含量的关系.
[分析方法]
一、用斜率绝对值大小判断压强大小或温度高低, 即斜率绝对值越大,表示反应速率越大,所以对应的压 强越大或温度越高(如图中p1<p2或T1<T2). 二、利用两平衡线高低判断正反应是吸热反应还是
方程式为 3X(g)+Y(g) 2Z(g), 正确; 3 min 内, A 前
X 物质的量变化了 0.6 mol,则 Δc(X)=0.6 mol/2 L=0.3 mol/L,所以 v(X)=Δc(X)/Δt=0.1 mol/(L· min),B 错;从 图Ⅱ可以看出 T2>T1,随着温度的升高,Y 的含量降低, 意味着该反应的正反应吸热,所以升高温度,平衡向正反
+Y(g) 2Z(g).
[答案] C
(2)速率——时间图(如图2所示) 如Zn与足量盐酸的反应,反应
速率随时间的变化出现如图所示的
情况,解释原因:AB段(v渐增),因 反应为放热反应,随反应的进行, 温度渐高,导致反应速率增大;BC 段(v渐小),则主要原因是随反应的
进行,溶液中c(H+)渐小,导致反应速率减小.故分析时要
[分析方法]
一、看v(正)、v(逆)的大小判断移动的方向,若v(正)
>v(逆),平衡向正反应方向移动;若v(正)<v(逆),平衡 向逆反应方向移动. 二、看v(正)、v(逆)的连续或跳跃,判断影响平衡的 条件,如果v(正)、v(逆)有一个连续,有一个突变,那么
一般是因改变浓度条件引起的;如果v(正)、v(逆)同时有
[解析] 升高温度或增大压强时,反应速率大,到达平衡 的时间短,平衡逆向移动,NO含量降低,故A、B项正确,
C项错误;使用催化剂,反应速率大,但平衡不移动、NO
含量不变.
[答案] C
1.(2011· 蚌埠模拟)一定温度下在密闭容器内进行着某一 反应,X气体、Y气体的物质的量随反应时间变化的曲 线如下图.下列叙述中正确的是 ( )
物质的含量的变化.
[分析方法] “定一议二”,当有多条曲线及两个以上条件时,要
固定其中一个条件,分析其他条件之间的关系,必要时,
作辅助线分析.
[例 4]
(2011· 河西模拟)在一定条件下某体积一定的密闭
容器中发生的反应 aA(g)+bB(g)
xC(g)符合下图甲
所示关系(c%表示平衡混合气体中 C 的百分含量,T 表示 温度,p 表示压强).则图乙中纵轴 y 是指 ( )
放热反应,或者是化学方程式中气体物质反应前后计量
数的大小.
[ 例 5]
(2011· 庆 八 中 ) 已 知 : 4NH3(g) + 5O2(g) 重
4NO(g)+6H2O(g);ΔH=-1025 kJ/mol 该反应是一
个可逆反应.若反应物起始物质的量相同,下列关于该反 应的示意图不正确的是 . ( )
抓住各阶段的主要矛盾,认真分析.
[例 2] KClO3 与 NaHSO3 发生氧化还原 反应生成 Cl 和 SO2 的速率如图所示, 4 已知这个反应速率随着溶液中 c(H+)的 增大而加快. (1)反应开始时,反应速率加快的原因是________. (2)反应后期时,反应速率下降的原因是________.
A.平衡混合气的密度
B.平衡混合气中B的百分含量
C.平衡混合气的总物质的量 D.平衡混合气的平均相对分子质量
[解析] 本题考查化学反应速率、化学平衡知识及图像分 析能力,中等难度.首先根据图像甲可以分析出题目中正 反应
是体积减小的放热反应;因为反应容器的容积不变,根据
质量守恒,反应混合气体的密度不变,A选项错误.分析 图像乙:在相同的压强下,随着温度的升高,反应逆向进 行,反应物B的含量应该增加,反应物的总的物质的量应 该增加,故B、C两选项错误. [答案] D
应方向移动,C错;对比图Ⅰ和图Ⅲ,图Ⅲ达到化学平衡 的时间缩短了,各物质浓度没有发生变化,所以条件是使 用了催化剂. 答案:A
5.(2011· 柳州高中检测)某密闭容器中充入等物质的量的 气 体 A 和 B ,一定温 度下发 生反应 A(g)+ xB(g)
2C(g),达到平衡后,只改变反应的一个条件,
,用 X 表示的反应速率 v(X)= 0.3 mol/(L· min) C.保持其他条件不变,升高温度,化学平衡向逆反应方向 移动 D.若改变反应条件,使反应进程如图Ⅲ所示,则改变的条 件是增大压强
解析:本题考查了化学反应速率和化学平衡等考点,中档 题 . 在 同 一 条 件 下 , v(X)∶v(Y)∶v(Z) = Δn(X)∶Δn(Y)∶Δn(Z)=0.6∶0.2∶0.4=3∶1∶2, 所以化学
A.t1时升高了温度 B.t3时加入了催化剂 C.t4时降低了压强 D.在t3~t4时间内,X的转化率最低
[解析]
A项,T升高,v(正)、v(逆)都增大,平衡逆向移动,
即v(逆)>v(正),正确;B项,对于前后气体体积不相等的 反应,v(正)、v(逆)同时增大相同倍数,只能是加催化剂, 正确;C项,v(正)、v(逆)同时减小,且平衡逆向移动,降
题意. 答案:C
4.(2011· 南通模拟)T℃时在2 L密闭容器中使X(g)与Y(g)发 生反应生成Z(g).反应过程中X、Y、Z的浓度变化如
图Ⅰ所示;若保持其他条件不变,温度分别为T1和T2
时,Y的体积分数与时间的关系如图Ⅱ所示.则下列 结论正确的是 ( )
A.容器中发生的反应可表示为:3X(g)+Y(g)
测得容器中物质的浓度、反应速率随时间的变化情况 如图所示.下列说法中正确的是 ( )
A.30 min时降低温度,40 min时升高温度 B.8 min前A的平均反应速率为0.08 mol/(L· s)
C.反应方程式中的x=1,正反应为吸热反应
D.20 min A、B的转化率为50%
像题要注意各物质曲线出现折点(达到平衡)的时刻相同,各 物质浓度变化的内在联系及比例符合化学方程式中的化学 计量数关系.
[例1] 一定温度下,在2 L的密闭容器中,X、Y、Z三种 气体的物质的量随时间变化的曲线如图所示.下列描述
正确的是
(
)
A.反应开始到 10 s,用 Z 表示的反应速率为 0.158 mol· -1·-1 L s B.反应开始到 10 s,X 的物质的量浓度减少了 0.79 mol· L
即联想外界条件对化学反应速率和化学平衡的影响规
律,且熟练、准确应用. 3.最后是能正确判断 即依题意仔细分析进行正确判断.
二、图像类型及分析方法 1.化学反应浓度速率图像 (1)浓度——时间图 此类图像能说明平衡体系中各组分在反应过程中的变
化情况.如 A+B
AB 反应情况如图 1 所示,解该类图
专题三
化学反应速率、化学平衡的图像
一、解答速率、平衡图像题的一般思路
1.首先要看清并读懂图像
一要看清楚横坐标和纵坐标; 二要看懂线的走向、变化趋势; 三要注意变化点,如线是否通过原点,两条线的交点 及线的拐点; 四要善于借助辅助线(如等温线、等压线); 五要看清楚定量图像中有关量的多少.
2.其次要学会联想规律
-1
C.反应开始到 10 s 时,Y 的转化率为 79.0%
D.反应的化学方程式为 X(g)+Y(g) Z(g)
[解析] 由图像可知:X、Y 的物质的量逐渐减少,为反应 物;Z 的物质的量逐渐增多,为生成物.它们物质的量的 变化 分别为 X:1.20 mol-0.41 mol=0.79 mol, Y:1.00 mol-0.21 mol=0.79 mol, Z:1.58 mol-0 mol=1.58 mol. 故 A 项: ΔcZ 1.58 mol v(Z)= = =0.079 mol· -1·-1; L s Δt 2 L×10 s
D.ΔH<0,B为非气态
解析:由图(2)分析可知:升高温度,A的转化率降低,平 衡向逆反应方向移动,正反应为放热反应,ΔH<0,故A、 B两项均错误;由图(1)分析可知:达到平衡的时间越短, 压强越大,即p1>p2,压强越大,A的转化率越高,可知
正反应方向为气体体积减小的反应,则B为气体,C项符合
压,正确;D 项,在t4~t5时刻,平衡逆向移动,X的转化
率比t3~t4时间段还要低,D项错误. [答案] D
(2)压强(温度)—温度(压强)—物质的含量图,即p- X%或 TT- X%图 p[图像特点] 该图像的横坐标是压强或温度,纵 坐标是反应物或生成物中一种物质的含
量,图像表示的是随压强或温度变化时,
