材料学基础I课件
合集下载
《材料科学基础》课件

THANKS
感谢观看
稳定性
材料在化学环境中保持其组成和结构的能力。
腐蚀性
材料与化学物质反应的能力,一些材料容易受到腐蚀。
活性
材料参与化学反应的能力和程度。
耐候性
材料在各种气候条件下的稳定性,如耐紫外线、耐风雨等。
材料的力学性质
弹性模量
描述材料抵抗弹性变形的能力。
硬度
材料表面抵抗被压入或划痕的能力。
韧性
材料吸收能量并抵抗断裂的能力。
材料科学的发展历程
总结词
概述材料科学的发展历程,包括重要的里程碑和代表 性人物。
详细描述
材料科学的发展历程可以追溯到古代,如中国的陶瓷和 青铜器制作,古埃及的石材加工等。然而,材料科学作 为一门独立的学科是在20世纪中期才开始形成的。在 这个时期,一些重要的里程碑包括开发出高温超导材料 、纳米材料和光电子材料等新型材料,这些材料的出现 极大地推动了科技的发展。同时,一些杰出的科学家如 诺贝尔奖得主也在这个领域做出了卓越的贡献。随着科 技的不断进步,材料科学的发展前景将更加广阔。
。
绿色材料与可持续发展
绿色材料
采用环保的生产方式,开发具有环保性能的新型材料,如可降解 塑料、绿色建材等。
节能减排
通过采用新型材料和技术,降低能源消耗和减少污染物排放,实现 节能减排的目标。
可持续发展
推动材料科学的发展,实现经济、社会和环境的协调发展,促进可 持续发展。
非晶体结构与性质
非晶体的结构特征
非晶体中的原子或分子的排列是无序的,不遵循长程有序的晶体 结构。
非晶体的物理和化学性质
非晶体的物理和化学性质与晶体不同,如玻璃态物质具有较好的化 学稳定性和机械强度。
第二章-材料化学的理论基础1
周期:任一方向排在一直线上的相 邻两质点之间的距离。
晶格(lattice):把晶体中质点的中心用直线联起来构成的 空间格架。
结点(lattice points):质点的中心位置。 空间点阵(space lattice):由这些结点构成的空间总体。 晶胞(unit cell):构成晶格的最基本的几何单元。
在晶体的宏观对称中,n 的数值不能是任意的。晶体对称定律 证明:在晶体中只可能出现1次、2次、3次、4次和6次旋转轴。 不可能出现5次以及高于6次的旋转轴。
❖晶体中如果存在旋 转轴,则其必定通过 晶体的几何中心。
立方晶体有6个2次轴,4 个3次轴,3个4次轴。
Chapter2, Chemistry of Materials 2005, ceszzh@
晶体的对称性
2. 晶体的宏观对称性
❖ 上世纪末有人宣称在晶体中发现5次等 旋转对称性,对晶体对称性这一经典理 论提出了挑战。但是,这一发现并未得 到学术界的完全认同。
关于晶体宏观对称性的详细讨论以及微观对称性不属于本课 程的范围,有兴趣的可以阅读已经出版的大量的结晶学方 面的专门著作。
Chapter2, Chemistry of Materials 2005, ceszzh@
晶体的对称性
2. 晶体的宏观对称性
因此,晶体中只存在有 8 种独立的对称要素, 分别为:
i, m, 1, 2, 3, 4, 6, 4
任何宏观晶体所具有的对称性都是这 8 种基本对 称要素的组合。可以得到32种宏观对称类型。
Chapter2, Chemistry of Materials 2005, ceszzh@
Chapter2, Chemistry of Materials 2005, ceszzh@
晶格(lattice):把晶体中质点的中心用直线联起来构成的 空间格架。
结点(lattice points):质点的中心位置。 空间点阵(space lattice):由这些结点构成的空间总体。 晶胞(unit cell):构成晶格的最基本的几何单元。
在晶体的宏观对称中,n 的数值不能是任意的。晶体对称定律 证明:在晶体中只可能出现1次、2次、3次、4次和6次旋转轴。 不可能出现5次以及高于6次的旋转轴。
❖晶体中如果存在旋 转轴,则其必定通过 晶体的几何中心。
立方晶体有6个2次轴,4 个3次轴,3个4次轴。
Chapter2, Chemistry of Materials 2005, ceszzh@
晶体的对称性
2. 晶体的宏观对称性
❖ 上世纪末有人宣称在晶体中发现5次等 旋转对称性,对晶体对称性这一经典理 论提出了挑战。但是,这一发现并未得 到学术界的完全认同。
关于晶体宏观对称性的详细讨论以及微观对称性不属于本课 程的范围,有兴趣的可以阅读已经出版的大量的结晶学方 面的专门著作。
Chapter2, Chemistry of Materials 2005, ceszzh@
晶体的对称性
2. 晶体的宏观对称性
因此,晶体中只存在有 8 种独立的对称要素, 分别为:
i, m, 1, 2, 3, 4, 6, 4
任何宏观晶体所具有的对称性都是这 8 种基本对 称要素的组合。可以得到32种宏观对称类型。
Chapter2, Chemistry of Materials 2005, ceszzh@
Chapter2, Chemistry of Materials 2005, ceszzh@
材料科学基础I 回复与再结晶

§9-7 回复
一、回复过程的特征
1、回复过程中组织不发生变化; 2、宏观一类应力全部消除,微观二类应力部分消除; 3、力学性能变化很小,电阻率显著降低,密度增加; 4、变形储存的能量部分释放。
二、回复过程机制
低温回复 (0.1~0.3)Tm 低温回复阶段主要是空位浓度明显降低。原因: 1、空位迁移到金属表面或晶界而消失; 2、空位与间隙原子结合而消失; 3、空位与位错交互作用而消失; 4、空位聚集成片,晶体崩塌而转变成位错环。
经常需要将冷变形金属加热退火,以使其性能恢复到变形前。
冷变形金属与合金随 着被加热温度升高,依 次发生回复、再结晶和 晶粒长大。
右图为冷变形黄铜随 温度身高组织与性能的 变化情况。可以分为三 个阶段:回复、再结晶 和晶粒长大。其中,再 结晶阶段性能变化最大: 强度迅速下降,塑性迅 速升高。
冷变形金属在加热过程中性能随温度升高而变化,在再结晶 阶段发生突变。
注意:图中纵坐标,向上表示晶粒数少,尺寸大。
§9-9 再结晶后的晶粒长大
冷变形金属完成再结晶后,继续加热时会发生晶粒长大。 晶粒长大又可分为正常长大和异常长大(二次再结晶)。
一、晶粒的正常长大
再结晶刚完成时得到的是细小的、无畸变和内应力的等轴晶 粒。温度继续升高或延长保温时间,晶粒仍可以继续长大,若 是均匀地连续生长,就称为正常长大。
三、再结晶图
把再结晶退火后的晶粒大小、冷变形程度及退火温度间的关 系绘制成三维图形,称为再结晶图。
四、退火孪晶
一些面心立方结构的金属或合金,如铜、铜合金、奥氏体不 锈钢等,经再结晶退火后,其晶粒中出现孪晶组织,称为退火 孪晶。
一般认为退火孪晶 是在晶粒生长过程中 形成的。当晶粒通过 晶界移动而生长时, (111)晶面发生堆垛层 错而产生孪晶。
材料科学基础I 第四章 (凝固与结晶)

本章应掌握以下内容: 本章应掌握以下内容: 1. 金属凝固的过程和现象 2. 凝固和结晶的热力学条件 3. 几个重要概念:过冷度,临界晶核半径,临界形核功, 几个重要概念:过冷度,临界晶核半径,临界形核功, 形核率,均匀形核,非均匀形核, 形核率,均匀形核,非均匀形核,成分过冷 4. 冷却速度、过冷度对凝固过程和凝固组织的影响 冷却速度、 5. 液—固界面的结构及晶体生长形态 固界面的结构及晶体生长形态 6. 成分过冷对晶体生长形态的影响 7. 单相固溶体的长大 8. 两相共晶体的长大
三、近程有序(Short range order) 近程有序
由于有序原子集团的尺寸很小, 由于有序原子集团的尺寸很小,所以把液态金属结构的特点 概括为近程有序 温度降低,这些近程有序的原子集团( 近程有序。 概括为近程有序。温度降低,这些近程有序的原子集团(又称 晶胚Embryo)尺寸会增大;当具备结晶条件时,大于一定尺 为晶胚 )尺寸会增大;当具备结晶条件时, 寸的晶胚就会成为晶核 晶核(Nucleus)。晶核的出现就意味着结晶开 寸的晶胚就会成为晶核 。 始了。 始了。 综上所述,接近熔点的液态金属是由许多“原子集团”组成, 综上所述,接近熔点的液态金属是由许多“原子集团”组成, 其中原子呈规律排列,结构与原固体相似(近程有序);但是 其中原子呈规律排列,结构与原固体相似(近程有序);但是 ); 金属液体中存在很大的能量起伏,热运动激烈。 金属液体中存在很大的能量起伏,热运动激烈。原子集团的大 小不等,存在时间很短,时聚时散,空位较多。 小不等,存在时间很短,时聚时散,空位较多。原子集团之间 存在“空穴”和一些排列无序的原子。 存在“空穴”和一些排列无序的原子。
三、结晶的驱动力
∆G=GS‒GL<0,符合热力学第二定律。 ,符合热力学第二定律。 单位体积金属结晶时自由能的变化: 单位体积金属结晶时自由能的变化: ∆Gv=GS‒GL=(HS‒TSS) ‒(HL‒ TSL)= (HS‒ HL) ‒T (SS ‒ SL) = ‒∆Hm+ T∆S = ‒∆Hm+T(∆Hm/Tm) = ‒∆Hm(Tm‒T)/Tm =(‒∆Hm/Tm) ∆T ‒ ∆T=Tm‒T,称为过冷度 ,称为过冷度 ∆Hm,即结晶潜热 m 即结晶潜热L ∆Gv(<0)就是结晶的驱动力,∆T越大,结晶的驱动力越大。 就是结晶的驱动力, 越大 结晶的驱动力越大。 越大, 就是结晶的驱动力
材料科学基础第一章材料结构的基本知识ppt课件

整理版课件
14
3、金属键 • 通过正离子与自由电子之间相互吸引力使原子结
合的结合键。 • 价电子脱离原子成为“电子气”,正离子整齐地
排列在 “电子气”的海洋中. • 金属具有高的密度,良好的塑性,导电,导热,
固态溶解
整理版课件
15
二、二次键 1、范德瓦耳斯键 • 具有稳定电子结构的原子或分子通过电偶极矩相
Cu : …3p63d104s1
K:…3p64s1
整理版课件
7
5、电负性呈周期性变化:同周期自左至右逐渐增强, 同族自上而下逐渐减弱
整理版课件
8
第二节 原子的结合键
• 一次键 • 二次键 • 混合键 • 结合键的本质及原子间距 • 结合键与性能
整理版课件
9
按结合力强弱分:
• 一次键:通过电子的转移或共享使原子结合的结 合键.包括离子键、共价键、金属键,结合力较 强.
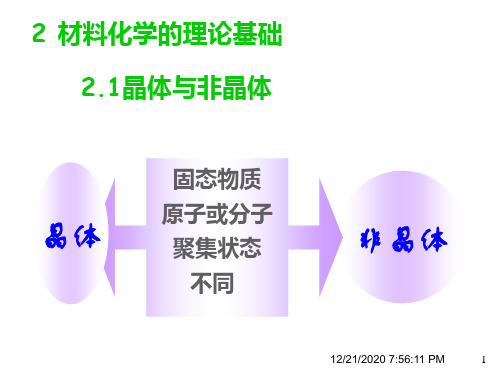
晶体: 有确定熔点 单晶体各向异性 多晶体各向同性
非晶体: 无确定熔点 各向同性
整理版课件
30
二、 原子排列的研究方法
• X射线或电子束 • 衍射原理 布拉格定律:
2dsinn
根据衍射分布图,可 分析晶体中原子排列 的特征(排列方式、 原子面间距等)
整理版课件
31
第四节 晶体材料的组织
1、结晶过程及多晶组织
整理版课件
39
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
整理版课件
20
由表可见,A、B原子间的电负性差越大,所 形成的 AB 化合物中离子键结合的比例越高
整理版课件
21
2、一次键与二次键混合 例如: • 石墨: 片层中为共价键,片层间
材料科学基础I 第一章(晶体学基础)

立方正方斜方cba???90??????cba??????90???cba??????90???菱方六方单斜三斜cba??????90???cba?????90????120?cba?????????90cba??????90???7大晶系包含14种空间点阵布拉布拉菲abravais点阵3
第一章 晶体学基础
1、晶面指数 、
方法和步骤与三指数时相同, 方法和步骤与三指数时相同, 只是要找出晶面 在四个坐标 轴上的截距。 轴上的截距。 例如: 例如: a3 o a1 a2
(1010) (0110) (1100)
(1010)
2、晶向指数: 、晶向指数:
四坐标晶向指数的确定方法有行走法和解析法。 四坐标晶向指数的确定方法有行走法和解析法。由于行走法 确定的晶向指数不是唯一的,所以这里仅介绍解析法 解析法。 确定的晶向指数不是唯一的,所以这里仅介绍解析法。 步骤: 步骤: 1)求出待定晶向在 1,a2,c三个坐标轴下的指数:U, V, W 求出待定晶向在a 三个坐标轴下的指数: 求出待定晶向在 三个坐标轴下的指数 2)按以下公式算出在四坐标轴下的指数:u, v, t, w 按以下公式算出在四坐标轴下的指数: 按以下公式算出在四坐标轴下的指数
多数金属和非金属材料都是晶体。因此, 多数金属和非金属材料都是晶体。因此,首先 要掌握晶体的特征及其描述方法。 要掌握晶体的特征及其描述方法。 晶体——组成晶体的质点在三维空间作周期性地、 组成晶体的质点在三维空间作周期性地、 晶体 组成晶体的质点在三维空间作周期性地 规则地排列。 规则地排列。 晶体的特点: 晶体的特点: 质点排列具有规则性、 质点排列具有规则性、周期性 有固定熔点(结晶温度) 非晶体没有固定的熔点 非晶体没有固定的熔点] 有固定熔点(结晶温度)[非晶体没有固定的熔点 各向异性(包含多种性能) 各向异性(包含多种性能)
第一章 晶体学基础
1、晶面指数 、
方法和步骤与三指数时相同, 方法和步骤与三指数时相同, 只是要找出晶面 在四个坐标 轴上的截距。 轴上的截距。 例如: 例如: a3 o a1 a2
(1010) (0110) (1100)
(1010)
2、晶向指数: 、晶向指数:
四坐标晶向指数的确定方法有行走法和解析法。 四坐标晶向指数的确定方法有行走法和解析法。由于行走法 确定的晶向指数不是唯一的,所以这里仅介绍解析法 解析法。 确定的晶向指数不是唯一的,所以这里仅介绍解析法。 步骤: 步骤: 1)求出待定晶向在 1,a2,c三个坐标轴下的指数:U, V, W 求出待定晶向在a 三个坐标轴下的指数: 求出待定晶向在 三个坐标轴下的指数 2)按以下公式算出在四坐标轴下的指数:u, v, t, w 按以下公式算出在四坐标轴下的指数: 按以下公式算出在四坐标轴下的指数
多数金属和非金属材料都是晶体。因此, 多数金属和非金属材料都是晶体。因此,首先 要掌握晶体的特征及其描述方法。 要掌握晶体的特征及其描述方法。 晶体——组成晶体的质点在三维空间作周期性地、 组成晶体的质点在三维空间作周期性地、 晶体 组成晶体的质点在三维空间作周期性地 规则地排列。 规则地排列。 晶体的特点: 晶体的特点: 质点排列具有规则性、 质点排列具有规则性、周期性 有固定熔点(结晶温度) 非晶体没有固定的熔点 非晶体没有固定的熔点] 有固定熔点(结晶温度)[非晶体没有固定的熔点 各向异性(包含多种性能) 各向异性(包含多种性能)
材料科学基础I-二元共晶合金相图

亚共晶合金室温下的组织为:先共晶固溶体α和共晶组织 (α+β)。由于α固溶体的溶解度随温度变化较大,所以先共晶固 溶体α中有点状βII析出。下左图是实际亚共晶合金组织的金相 照片。
例题 含Sn量为40%的Pb-Sn合金中,共晶组织的相对量是多少?
分析:共晶组织是由成分为E点的液相转变而来的,计算出共晶 转变开始时液相的相对量即可。因此,选择L+α两相区和共晶温 度作为计算条件。
纯Pb的熔点(327.5 ˚C) 纯Sn的熔点(231.9 ˚C) 共晶点(61.9%Sn, 183˚C) Sn在Pb中的最大溶解度(19.2%Sn, 183˚C) Pb在Sn中的最大溶解度(2.5%Pb, 183˚C)
2、线
TPb E TSn TPb C E D TSn C ED CF DG
液相线 固相线 共晶线(水平线) Sn在Pb(α)中的溶解度曲线,随温度变化 Pb在Sn(β)中的溶解度曲线,随温度变化
3、区
单相区
L 液相区 α α固溶体区 β β固溶体区
两相区
L +α 液、固二相区,与匀晶相图的二相区相同,可以将 L +β 它们看作匀晶相图的一部分。
α+β 固态二相区
三相区 L+α+β
Hale Waihona Puke C E D水平线 (一个特殊的相区)
三、典型合金的冷却过程分析
共晶系合金一般以共晶点为界进行分类,可以分为: ❖共晶合金: 61.9 %Sn(图5.3-4中合金I) ❖亚共晶合金: 19.2% ~ 61.9 %Sn (如合金II) ❖过共晶合金: 61.9% ~ 97.5 %Sn (如合金III) Sn < 19.2 %和Sn > 97.5 %的合金可以看作是匀晶合金
例题 含Sn量为40%的Pb-Sn合金中,共晶组织的相对量是多少?
分析:共晶组织是由成分为E点的液相转变而来的,计算出共晶 转变开始时液相的相对量即可。因此,选择L+α两相区和共晶温 度作为计算条件。
纯Pb的熔点(327.5 ˚C) 纯Sn的熔点(231.9 ˚C) 共晶点(61.9%Sn, 183˚C) Sn在Pb中的最大溶解度(19.2%Sn, 183˚C) Pb在Sn中的最大溶解度(2.5%Pb, 183˚C)
2、线
TPb E TSn TPb C E D TSn C ED CF DG
液相线 固相线 共晶线(水平线) Sn在Pb(α)中的溶解度曲线,随温度变化 Pb在Sn(β)中的溶解度曲线,随温度变化
3、区
单相区
L 液相区 α α固溶体区 β β固溶体区
两相区
L +α 液、固二相区,与匀晶相图的二相区相同,可以将 L +β 它们看作匀晶相图的一部分。
α+β 固态二相区
三相区 L+α+β
Hale Waihona Puke C E D水平线 (一个特殊的相区)
三、典型合金的冷却过程分析
共晶系合金一般以共晶点为界进行分类,可以分为: ❖共晶合金: 61.9 %Sn(图5.3-4中合金I) ❖亚共晶合金: 19.2% ~ 61.9 %Sn (如合金II) ❖过共晶合金: 61.9% ~ 97.5 %Sn (如合金III) Sn < 19.2 %和Sn > 97.5 %的合金可以看作是匀晶合金
《材料科学基础》课件第1章 材料的结构

◆ 晶体与非晶体区别:
(a)是否具有周期性、对称性; (b)是否有确定的熔点; (c)是否各向异性; 单晶体的各向异性
25
1.2 晶体学基础 1.2.2 空间点阵和晶胞
为了便于分析研究晶体中原子或分子的排 列情况,可把它们抽象为规则排列于空间的无 数个几何点,这些点子可以是原子或分子的中 心,也可以是彼此等同的原子群或分子群的中 心,但各个点子的周围环境必须相同,这种点 的空间排列称为空间点阵。
3. 晶胞
空间点阵
27
晶胞
1.2 晶体学基础
1.2.2 空间点阵和晶胞
28
1.2 晶体学基础
◆选取晶胞的原则:
1.2.2 空间点阵和晶胞
① 应反映出点阵的高度对称性; ② 棱和角相等的数目最多; ③ 棱边夹角为直角时,直角数目最多; ④ 晶胞体积最小。
29
1.2 晶体学基础 4. 晶格(点阵)参数
1.2.2 空间点阵和晶胞
⑷ 简单正交
⑸ 底心正交
⑹ 体心正交
34
⑺ 面心正交
1.2 晶体学基础
1.2.2 空间点阵和晶胞
(四)四方 a=b≠c =β=γ=90°
⑻ 简单四方
⑼ 体心四方
(五)菱方 a=b=c =β=γ≠90°
⑽ 简单菱方
35
1.2 晶体学基础 (六 )六方 a=b≠c =β=90°,γ=120°
共价键 相邻原子价电子各处于 相反的自旋状态,原子 核间的库仑引力 离子键 原子得、失电子后形成 负、正离子,正负离子 间的库仑引力 金属键 自由电子气与正离子实 之间的库仑引力 分子键 原子间瞬时电偶极矩的 感应作用
18
强
较强
最弱
1.1 材料的结合方式 1.1.2工程材料的键性 实际上使用的工程材料,有的是单纯的一种键,更多
(a)是否具有周期性、对称性; (b)是否有确定的熔点; (c)是否各向异性; 单晶体的各向异性
25
1.2 晶体学基础 1.2.2 空间点阵和晶胞
为了便于分析研究晶体中原子或分子的排 列情况,可把它们抽象为规则排列于空间的无 数个几何点,这些点子可以是原子或分子的中 心,也可以是彼此等同的原子群或分子群的中 心,但各个点子的周围环境必须相同,这种点 的空间排列称为空间点阵。
3. 晶胞
空间点阵
27
晶胞
1.2 晶体学基础
1.2.2 空间点阵和晶胞
28
1.2 晶体学基础
◆选取晶胞的原则:
1.2.2 空间点阵和晶胞
① 应反映出点阵的高度对称性; ② 棱和角相等的数目最多; ③ 棱边夹角为直角时,直角数目最多; ④ 晶胞体积最小。
29
1.2 晶体学基础 4. 晶格(点阵)参数
1.2.2 空间点阵和晶胞
⑷ 简单正交
⑸ 底心正交
⑹ 体心正交
34
⑺ 面心正交
1.2 晶体学基础
1.2.2 空间点阵和晶胞
(四)四方 a=b≠c =β=γ=90°
⑻ 简单四方
⑼ 体心四方
(五)菱方 a=b=c =β=γ≠90°
⑽ 简单菱方
35
1.2 晶体学基础 (六 )六方 a=b≠c =β=90°,γ=120°
共价键 相邻原子价电子各处于 相反的自旋状态,原子 核间的库仑引力 离子键 原子得、失电子后形成 负、正离子,正负离子 间的库仑引力 金属键 自由电子气与正离子实 之间的库仑引力 分子键 原子间瞬时电偶极矩的 感应作用
18
强
较强
最弱
1.1 材料的结合方式 1.1.2工程材料的键性 实际上使用的工程材料,有的是单纯的一种键,更多
材料科学基础I 课件5相图2019

应该注意:杠杆规则是由物质守恒原理导出的,和体系是否平衡
无关。例如,一个成分为xB的体系,分成不同成分的两部分,不论 这两部分是否处于平衡,它们的相对摩尔量(或相对质量)都可
以采用杠杆规则来计算。
12
由一对共轭的温度成分曲线围成的两相区一般呈”透镜”
状。在某些二元系中,两相区会出现最高点或最低点。 固相线和液相线出现最低点的例子Fe-Ni系。 固相线和液相线出现最高点的例子Ag-Mg系。
5.1 吉布斯相律
F C 2
对凝聚态系统中的相平衡,通常每改变105Pa压力,其平衡温度改变 约为10-2Κ的数量级,因此,当压力变化不大的情况下,压力的影响
可忽略。此时相律为: F C 1
相区邻接法则: 相图中相邻相区中相的数目的差值一定是1。
R R D D
R’两个相区边界的维数;R相图的维数;D和D+分别是从一个相 区越过边界进入邻接的另一相区后消失和出现的相的数目。
相图的局限性: 描述体系的平衡状态 ,不能说明达到平衡过程的动力学,不能知 道转变后的组织,也不能判断体系中可能出现的亚稳相 。由于固 态材料往往难达到整体稳定的平衡 ,实际测得的相图多数都或多 或少地偏离真正平衡,甚至有些相实际上是亚稳相。
本章先讨论相图的几何结构;再讨论相图的热力学。
3
相图遵循的一般规律
式中M是原子(或分子)质量。
10
5.3.1 单相平衡和两相平衡
图例:Bi-Sb二元相图。
单相平衡和两相平衡 单相平衡(=1,F=2-+1=2),在相图上单相平衡相区表现为一块面 积。 两相平衡(=2,F=1),即平衡相的T(或w)中有一个确定时,另一 个也确定,平衡态也被确定。即每一个参与两相平衡的相的成分 是温度的函数。它们是一
无关。例如,一个成分为xB的体系,分成不同成分的两部分,不论 这两部分是否处于平衡,它们的相对摩尔量(或相对质量)都可
以采用杠杆规则来计算。
12
由一对共轭的温度成分曲线围成的两相区一般呈”透镜”
状。在某些二元系中,两相区会出现最高点或最低点。 固相线和液相线出现最低点的例子Fe-Ni系。 固相线和液相线出现最高点的例子Ag-Mg系。
5.1 吉布斯相律
F C 2
对凝聚态系统中的相平衡,通常每改变105Pa压力,其平衡温度改变 约为10-2Κ的数量级,因此,当压力变化不大的情况下,压力的影响
可忽略。此时相律为: F C 1
相区邻接法则: 相图中相邻相区中相的数目的差值一定是1。
R R D D
R’两个相区边界的维数;R相图的维数;D和D+分别是从一个相 区越过边界进入邻接的另一相区后消失和出现的相的数目。
相图的局限性: 描述体系的平衡状态 ,不能说明达到平衡过程的动力学,不能知 道转变后的组织,也不能判断体系中可能出现的亚稳相 。由于固 态材料往往难达到整体稳定的平衡 ,实际测得的相图多数都或多 或少地偏离真正平衡,甚至有些相实际上是亚稳相。
本章先讨论相图的几何结构;再讨论相图的热力学。
3
相图遵循的一般规律
式中M是原子(或分子)质量。
10
5.3.1 单相平衡和两相平衡
图例:Bi-Sb二元相图。
单相平衡和两相平衡 单相平衡(=1,F=2-+1=2),在相图上单相平衡相区表现为一块面 积。 两相平衡(=2,F=1),即平衡相的T(或w)中有一个确定时,另一 个也确定,平衡态也被确定。即每一个参与两相平衡的相的成分 是温度的函数。它们是一
[大连理工大学]材料科学基础课件1第一章
![[大连理工大学]材料科学基础课件1第一章](https://img.taocdn.com/s3/m/5c2ed707f78a6529647d53e4.png)
子原置位心面 子原 角顶
a
2
4
4�数子原的中胞晶
�r
半之离距短最间子原�径半子原
sdilos enillatsyrc fo erutcurts ehT 1 retpahC
�CCF�构结方立心面
a : 数常阵点
�2A �CCB �erutcurts latsyrc cibuc deretnec-ydob eht�构结方立心体
sdilos enillatsyrc fo erutcurts ehT 1 retpahC
�角直的多能可尽 2
γ βα :角夹间之轴 c,b,a�度长边棱
,类分阵点间空对角夹间之轴晶和系关的间之度长边棱胞晶据根
阵点种41,系晶个7为归可体晶有所
阵点菲拉布和系晶 3
阵点种41�系晶个7
]011[=AP=BO
sdilos enillatsyrc fo erutcurts ehT 1 retpahC
�yportolla dna msihpromylop�构异素同和性型晶多
相间中 相金合 体溶固
金合的成组相的同不种几由�金合相多 金合的成组相种一由�金合相单 。分部成组匀均的开隔互相面界以并质性和
构结体晶一同、态状集聚一同有具中金合��esahp�相 �质物的立独的本基的金合成组��tnenopmoc�元组 属金非与属金或属金的上以种两或种两��yolla�金合 构结相金合4.1§ 。质物的性特属金有具的成制法方它其或炼熔经 物合化或、素元属金非、属金纯是以可元组
1
�
lk h
d
� soc
c
l
� � soc
b
k
� � soc
h
a
�
材料学基础I-11

面心正交 oF 4
六方 Hexagonal a1=a2=a3≠c,α=β=90º γ=120º ,
a3 a2 a1 简单六方 hP
菱方 Rhombohedral a=b=c, α=β=γ≠90º
简单菱方 hR 1
四方(正方)Tetragonal a=b≠c, α=β=γ=90º
简单四方 tP 1
金属原子 四面体间隙 (b)
(a) 八面体间隙
(b) 四面体间隙
面心立方晶格中也有八面体间隙与四面体间隙两种,如图 所示,它们分别是正八面体间隙和正四面体间隙
金属原子 八面体间隙
金属原子 四面体间隙
(a)
面心立方结构中的间隙 (a) 八面体间隙
(b)
(b) 四面体间隙
原子的堆垛方式 前面已指出,面心立方晶格和密排六方晶格的致密度与配位数 完全一致,均属于最密排列晶格,但是晶格类型却不同,为了 搞清这个问题,就需要了解结构
有几百种化合物属于NaCl型结构,它可 以看成是由两个面 心立方点阵穿插而 成的超点阵。如果 把一个钠离子和一 个氯离子共同看成 一个基元,则点阵 为面心立方。 Na+(Mg2+) Cl-(O2-)
ZrO2(CaF2)型结构
在ZrO2结构中, Zr4+占据面心 立方结构的结 点位置,而O2+ 处于四面体间 隙中 (1/4,1/4,1/4)。
部分参考书(I):
1. 2. 3. 4. 5. 杰罗得,《固体结构》(科学版)(中译本) 俞文海,《晶体物理学》(科大) 陈纲,《晶体物理学基础》(科学版) 张克从,《近代晶体学基础》(科学版) 冯端,《金属物理学》第一卷 (科学版)
第三节 金属及合金的结构特点
Structure Characteristic of Metal & Alloy
材料学基础ppt课件

根据用途不同,特种玻璃分为防辐射玻璃、激光
玻璃、生物玻璃、多孔玻璃、非线性光学玻璃和光纤玻
璃等。
最新课件
30
传统的无机非金属材料 之三:水泥
水泥是指加入适量水 后可成塑性浆体,既能在 空气中硬化又能在水中硬 化,并能够将砂、石等材 料牢固地胶结在一起的细 粉状水硬性材料。
最新课件
31
水泥的种类很多,按其用途和性能可分为: 通用水泥、专用水泥和特性水泥三大类;按其所 含的主要水硬性矿物,水泥又可分为硅酸盐水泥、 铝酸盐水泥、硫铝酸盐水泥、氟铝酸盐水泥以及 以工业废渣和地方材料为主要组分的水泥。目前 水泥品种已达一百多种。
最新课件
32
• 通用水泥为大量土木工程所使用的一般用途的水 泥,如硅酸盐水泥、普通硅酸盐水泥、矿渣硅酸 盐水泥、火山灰质硅酸盐水泥、粉煤灰硅酸盐水 泥和复合硅酸盐水泥等。
• 专用水泥指有专门用途的水泥,如油井水泥、砌 筑水泥等。
• 特性水泥则是某种性能比较突出的一类水泥,如
快硬硅酸盐水泥、抗硫酸盐硅酸盐水泥、中热硅
最新课件
18
2. 无机非金属材料
无机非金属材料是由硅酸盐、铝酸盐、硼酸盐、
磷酸盐、锗酸盐等原料和(或)氧化物、氮化物、碳
化物、硼化物、硫化物、硅化物、卤化物等原料经一
定的工艺制备而成的材料。是除金属材料、高分子材
料以外所有材料的总称。它与广义的陶瓷材料有等同
的含义。无机非金属材料种类繁多,用途各异,目前
《材料学基础》
主讲: 叶原丰
金陵科技学院材料工程学院
最新课件
1
材料引言
• 什么是材料? • 1.1 材料分类 • 1.2 组成-结构-性质-工艺过程之间的关系
• 1.3材料的选择
相关主题
