化工分离过程课件陈洪钫,刘家祺编第2章单级平衡过程
化工分离工程第2章 单级平衡过程

FLGC
• 活度系数法通式
fˆi L
i
xi
fiL
i
xi
is
Pi s
expVi L
(P RT
Pi s
)
yiˆiv
P
i
xiis Pi s
expVi L
(P RT
Pi s
)
i 1,2,, N
低压至中压
expVi
L
(P RT
Pi
s
)
1
yiˆiv P
xi
s
ii
Pi
s
i 1,2,, N
(2-7)
11
FLGC
两种常用的汽液相平衡关系表达式:
(2-5)式和(2-6)式代入(2-4),得 ˆiV yi p ˆiL xi p (2-5)式和(2-7)式代入(2-4),得 ˆiV yi p i xi fiOL
12
FLGC
二、相平衡关系的表示方法:
1. 相图 yi
主要用来表示二元组分体系的相 平衡关系,包括恒压下的t-x图和 y-x图,以及恒温下的p-x图。
i
④判定 | 1 S y | 是否接近0,是,得到Tb=T和Ki;否,按以下方式调整
T。
⑤ S y 1,T偏大,调小; S y 1,T偏小,调大;调整后返回②。
FLGC
一、泡点温度的计算
1. Ki与组成无关: Ki f (T, P)
泡点方程:
f
T
C
Ki xi
1
0
i 1
假定T
已知P 得到Ki 调整T
3
FLGC
• 相平衡,是研究多相平衡体系的状态如何随温度、 压力、组成的变化的科学。
化工分离过程ppt

自由度数与
相律:f c 2 c 2 2 c
组分数相当
计算类型 泡点温度 泡点压力 露点温度 露点压力
规定量(c个)
P, x1, x2 ,xc1 T , x1, x2 ,xc1 P, y1, y2 ,yc1 T , y1, y2 ,yc1
求解量 T , y1, y2,yc P, y1, y2,yc T , x1, x2 ,xc P, x1, x2 ,xc
2. lnPiS=Ai-Bi/(t+Ci)
3. 常压操作 解法1:用试差法计算
Ki Pi S
c
P ; Ki xi 1 i 1
T(设) ∑Kixi
70℃ 0.379
110℃ 1.344
98℃ 0.951
100℃ 1.00
15
2.2.1 泡点温度和压力的计算
解法2:用αiK计算(不试差,适用于完全理想系)
露点温度是在一定压力下降低温度,当出现第一个液滴 时的温度,露点压力是在一定温度下增加压力,当出现 第一个液滴时的压力。
5
泡点和露点的意义
泡点温度:一定组成的液体,在恒压下加热的过程中,出现第一个气泡时的温 度,也就是一定组成的液体在一定压力下与蒸汽达到汽液平衡时的温度。
露点温度:一定组成的汽体,在恒压下冷凝的过程中,出现第一个液滴时的温 度,也就是一定组成的蒸汽在一定压力下与液相达到汽液平衡时的温度。
c
f P Ki xi 1 0 i 1
11
2.2.1 泡点温度和压力的计算
1. 平衡常数与组成无关的泡点温度计算
Ki f (T , P)
泡点方程:
c
f T Ki xi 1 0 i 1
最新文档-化工分离过程2单级平衡过程第2讲-PPT精品文档

L s v ( P P P s i i ) ln ln s i RT P i
化工分离过程
Chemical Separation Processes
第二章 单级平衡过程
第二章 单级平衡过程
2
第二章 单级平衡过程
主要内容及要求: 1. 相平衡常数计算:状态方程法,活度系数法 2. 泡点、露点计算 (1)泡点计算:在一定 P(或T)下,已知xi, 确定Tb(或Pb)和yi。 (2)露点计算 3. 等温闪蒸计算:给定物料的量与组成,计算在 一定P和 T下闪蒸得到的汽相量与组成,以及剩 余的液相量与组成。
7
2.1.1 相平衡关系
相平衡关系的表示方法:
yi 1. 相图
0 2. 相平衡常数
xi
K i y i /x i
8
2.1.1 相平衡关系
分离因子
y K y i /y j i i /x i ij K y x j j /x j i /x j
分离因子评价体系分离难易程度,与1的偏离程度表示 组分之间分离的难易程度。
ˆL x f OL 液相: f i i i i
OL
相平衡常数:
yi i fi Ki V ˆ P xi i
如何求取基准态逸度、液相活度系数和汽相逸度系数
是计算相平衡常数的关键。
14
2.1.2 相平衡常数的计算
1、基准态逸度 fiOL:
(1)可凝组分基准态逸度: 基准态:xi 1时,i 1。
其中:
ai
27 R 2Tc2 ,i 64 Pc ,i
bi
RT c , i 8 Pc , i
a y m i a i
2
b y m ib i
化工分离过程

化工分离
教学内容
chap1 绪论
过程
chap2 单级平衡过程
Separation chap3 多 离 简组 过捷分程计多分算级析分与
Processes chap4 多 离组的分严多格级计分算
in Chemical
chap6 分离过程的节能 chap7 膜分离和反应精馏
Engineering
第一章 绪论
设 pA*和 pB*分别为液体A和B在指定温度时的饱和蒸 气压,p为体系的总蒸气压
pA
p* A
xA
pB pB* xB pB* (1 xA )
p pA pB p*AxA pB* (1 xA )
§2.2 多组分物系的 泡、露点计算
§2.3 闪蒸过程的 计算
§2.1 相平衡
一、相平衡条件
相平衡:指混合物或溶液形成若干相,这些相保持着物 理平衡而共存的状态。
热力学角度:整个体系的熵 达到最大值,自由焓达到最小值 动力学角度:相间表观传递速率为零
相平衡条件: 1、各相的 温度T、压力 p及每一组分 i 的化学位
乙
醛
水
93% 产品
8 9 10
废水
废水
1-固定床催化反应器;2-分凝器;3、5、9-吸收塔;4-闪蒸塔;6-粗馏塔; 7-催化加氢反应器;8-脱轻组分塔;10-产品塔
涉及分离过程:吸收:3、5、9; 精馏:6、8、10;闪蒸:4;分凝器:2
化工厂中分离设备投资约占 总投资的50~90% !!!
鲁西化工集团
为惰性组分)
若 B 不溶于 S 中,xB=0, AB
最理想情况
3. 萃取
AB
kA kB
(xA (xA
xB )E xB )R
化工分离过程第二章

yi yj
2.1.2 相平衡常数的计算
ˆ 计算K——状态方程法 一、根据逸度系数
ˆ V V y P 汽相: f i i i
ˆ L L x P 液相: f i i i
yi iL 相平衡常数: Ki V xi i
(2-14)
关键: 选择一 个既适用于汽 相、又适用于 液相的状态方 程。
式中:fi0V 在系统温度和压力下纯组分i的气相逸度 γiV 组分i的气相活度系数 φi0V在系统温度和压力下,纯组分i的气相逸度系数 φiV 在系统温度和压力下,组分i的气相分逸度系数且
V 0V V ˆ i i i
9
同样,液相逸度与液相组成的关系为:
ˆ L f 0L L x P 0L L x P ˆL x f i i i i i i i i i
式中的逸度系数可从该物质的p-V-T(状态方程)关系或 实测数据计算。逸度系数通过状态方程计算: 此法适用于中压下,液相非理想性不是很强的烃类系统。
19
由热力学原理可以推导出以下表达式:
以V为自变量பைடு நூலகம்
RT 1 P ˆ lni dVt lnZ m v RT ni T ,V ,n Vt j
应用:已知 T,P,xi , yi ( i 1, 2, 求
V i
c)
26
L i
步骤:
输入:T、P、Tc、i、Pc、i,xi、yi
i=1
i) (1)式求V( t (i) (2)式求Z M ˆ(i) (3)式求 i
i=i+1
i=1
Yes No
V L ˆ ˆ 输出 i 或 i
注意:
● i=1时求汽相逸度系数;i=2时求液相逸度系数。
《化工分离工程》PPT课件-第4讲分离过程
(k )
f T (k ) − f ′ T (k )
( ) ( )
f (T ) = ∑ K i xi − 1
2. Ki与组成有关: 与组成有关:
已知: 已知: x 、p 计算: 计算: y 、T 已知: 已知: x 、T 计算: y 、p 计算: 泡点方程: 泡点方程:
f (T ) =
பைடு நூலகம்泡点温度计算 泡点压力计算
pb = ∑ pis xi
y i = K i xi
C
i = 1,2,..., C
C
(2)摩尔分率加和方程: 2个 摩尔分率加和方程:
∑x
i =1
i
= 1 .0
∑y
i =1
i
= 1.0
2C+ 2C+2 C个
(3)汽液平衡常数关联式: 汽液平衡常数关联式:
Ki = f (T , P, x, y)
i = 1,2,...,C
变量数: 变量数:
∑K
i =1
C
i
xi − 1 = 0
K i = f T , P , x, y
(
)
由状态方程法或活度系数法求取K 由状态方程法或活度系数法求取 i :
K
i
φˆ i L = φˆ iV
K
i
yi γ i Pi sφ = = xi φˆ iV P
s i
v iL ( P − P i s ) exp RT
已知条件
开始
输入p 及有关参数 输入 ,x及有关参数
活 度 系 数 法 计 算 泡 点 温 度 的 框 图
设T并令φiV=1,作第一次迭代 并令 ,
L Vm,i p − pis pisϕis Ki = )V exp RT ϕi p
化工分离过程第二章

(2) 逸度与组成的关系 气相逸度与气相组成yi的关系为:
fˆiV
fi0V
V i
yi
Pi0V
V i
yi
PˆiV yi
式中:fi0V 在系统温度和压力下纯组分i的气相逸度 γiV 组分i的气相活度系数 φi0V在系统温度和压力下,纯组分i的气相逸度系数 φiV 在系统温度和压力下,组分i的气相分逸度系数且
ˆiL
i0L
L i
平衡时,汽液两相逸度相等,通过平衡常数Ki的定义式可求 出相平衡常数。
10
1. 汽液平衡关系(Vapor-liquid phase equilibrium)
fˆiV fˆi L
(2-4)
引入逸度系数 :
ˆ i
,汽相中组分i的逸度系数 ˆ Vi 定义为
ˆ iV fˆiV / yiP
ZM
PVt RT
RT (Vt b
a Vt2
)Vt
RT
Vt Vt
b
a RTVt
2
④计算汽相逸度系数
将(2—15)积分后代入以上结果:
ln
) i
bi Vt b
ln[ZM
(1
b Vt
)]
2 aai RTVt
3
25
⑤用xi代替yi,按照②~④步骤求各组分的液相逸度 系数
⑥由式(2-14)求Ki值。
fi L
Pi S iS
exp[ViL (P PiS )] RT
(2-21)
33
由式(2—21)可知,纯液体i在T、P下的逸度等于饱和 蒸汽压乘以两个校正系数。
S i
为校正处于饱和蒸汽压下的蒸汽对理想气体的偏离,
而指数校正项也称普瓦廷(Poynting)因子,是校正压
分离过程-第2章单级平衡过程
⎟⎞dP ⎠
(2-20)
对气、液、固组分均适用。
纯液体组分i的逸度:
∫ ∫ ln fiL P
=
1 RT
⎡ ⎢⎣
Pis 0
⎜⎛ ⎝
vi
−
RT P
⎟⎞dP ⎠
+
P pis
⎜⎛ ⎝
vi
−
RT P
⎟⎠⎞dP⎥⎦⎤
=
ln φis
+
viL (P − RT
Pis )
−
ln
P Pi s
纯组分i在一定温度的饱 纯液体组分i在系统温度下
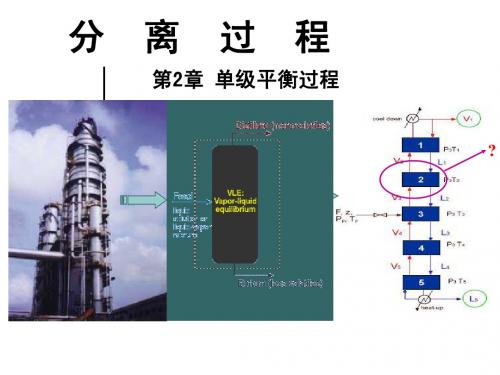
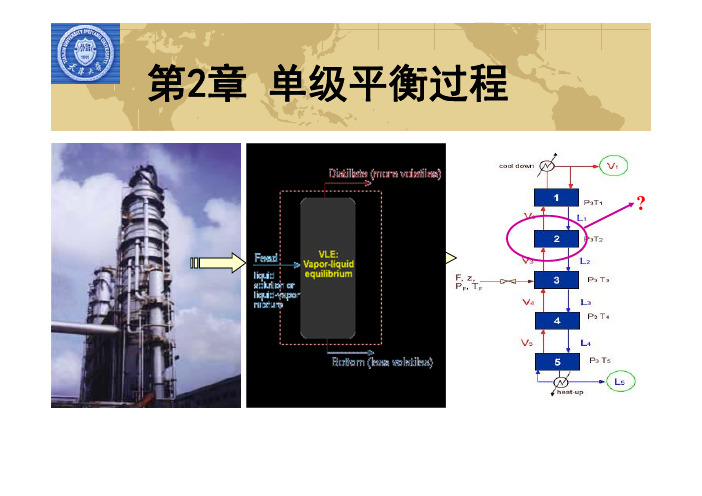
第2章 单级平衡过程
?
2.1 相平衡
所谓相平衡指的是混合物或溶液形成若干相,这 些相之间保持着物理平衡而共存的状态。 从热力学上看,整个物系的自由焓处于最小状态。 从动力学来看,相间表观传递速率为零。
2.1.1 相平衡关系
一、相平衡条件(准则): 各相的温度、压力相同,各相组分的逸度也相等。
T ′ = T ′′ = T ′′′ = ...... P′ = P′′ = P′′′ = ......
泡点方程:
C
f (T ) = ∑ Ki xi
−1= 0
i =1
假定T 已知P 得到Ki 调整T
ΣKixi
f(T)=|ΣKixi-1 |<ε
no yes
T,yi
(1)温度T初值的选定
取纯物质的沸点作为温度的迭代初值。
(2) Ki值的获得
1)p-T-K图(烃类物系) 2)简化表达式: K i = Pis / P 3)经验关系式
⎣
viL
(
P− RT
Pi
s
)
⎤ ⎥ ⎦
第2章 单级平衡过程 化学分离工程讲解

yi
ij
yj xj
xi
Ki Kj
(2-13)
8
END
2.1.2 汽液平衡常数的计算
一、状态方程法
由2-8式得方法模型:k i 其中:
yi
xi
ˆL i
ˆ V (2-14) i
L ˆ i
和
V ˆ i
由状态方程计算。
ˆL 和 ˆV 表达式: 由P-V-T关系计算 i i
i i
f ioI iII xiII f ioII
(2-12)
2、相平衡常数法 相平衡常数的定义式:
Ki yi x i
对精馏、吸收而言, Ki 称为汽液平衡常数; 对萃取而言, Ki 称为液液平衡常数(分配系数)。 3、分离因子法
定义:
s ij
xi 1 x j 1 xi 2 x j 2
26
2.2 Calculation about Bubble-point and
(2-15) 计算 逸度 系数 的普 遍化 公式
9
(2-16)
2.1.2 汽液平衡常数的计算
只要知道状态方程,代入(2-15、2-16)就可以 ˆ 求逸度系数 i 不同的状态方程或同一状态方程采用不同的混合规
则,逸度系数的表达式不同!
状态方程选择原则:
选择既适用于汽相又适用于液相的状态方程。 常用方程:RK、SRK、PR、BWRS等方程。 适用条件:中压、液相非理想性不是很强的烃类系统。
(2-35)
(1)汽相为理想气体,液相为理想溶液(完全理想系) 活度系数、逸度系数为1,指数因子近似为1,所以 Ki = PiS/P (2-36) Ki=f(T,P) 适用物系:P<200kPa、分子结构相似的物系 (苯-甲苯) (2)汽相为理想气体,液相为非理想溶液 逸度系数为1,指数因子近似为1,所以 Ki=γi PiS/P (2-38) Ki=f(T,P,xi) 适用物系:低压下,分子结构相差不大组分溶液(醇、醛、 22
化工分离过程(2单级平衡过程)(第4讲)

2.3.1等温闪蒸和部分冷凝过程
④ 计算汽、液相产量V和L: V=ΨF=202.5kmol/h,L=(1-Ψ)F=297.5kmol/h ⑤ 利用下式计算汽、液相组成y和x:
yi
成分 汽相组成yi 液相组成xi
K i zi ( K i 1) 1
乙烷(1) 0.1512 0.0315
c个 2c+3
i 1, 2 ,... c
(3)摩尔分率加和式—S方程: 2个
c
xi 1
i 1
c
yi 1
i 1
(4)热量平衡式— H方程: 1个
FH
F
Q VH
V
LH
L
10
2.3 闪蒸过程的计算
闪蒸过程的设计变量
变量数: 3c+8个 (F,TF ,PF ,T,P,V,L,Q,zi ,yi ,xi)
z 1 0 . 08
z 2 0 . 22
z 3 0 . 53
z 4 0 . 17
试计算汽、液相产品的流率和组成。
26
2.3.1等温闪蒸和部分冷凝过程
① 利用P-T-K图查得: K1=4.80,K2=1.96,K3=0.80,K4=0.33
② 验证料液的泡点和露点: 泡点验证:
K
i 1
约束方程总数:
2c+3个
需规定变量数(设计变量):c+5个
其中进料变量数 (固定设计变量):
(可调设计变量):
c+3个 2个
(F,TF ,PF ,zi )
11
2.3 闪蒸过程的计算
根据2个可调设计变量的规定方法可将闪蒸计算 分为如下五类: 规定变量
P,T P,Q=0 P,Q≠0 P,L(或ψ)
化工分离过程(陈洪钫刘家祺著)课后习题答案下载

化工别离过程(陈洪钫刘家祺著)课后习题答案下载化工别离过程这本书为高等学校化学工程与工艺专业教学指导委员会根据化学工程与工艺专业的教学方案,组织编写的专业根底课教材。
以下是由关于化工别离过程(陈洪钫刘家祺著)课后习题答案下载地址,希望大家喜欢!第一章绪论第一节别离操作在化工生产中的重要性第二节传质别离过程的分类和特征1.2.1平衡别离过程1.2.2速率别离过程第三节本课程的任务和内容参考文献第二章单级平衡过程第一节相平衡2.1.1相平衡关系2.1.2相平衡常数的计算第二节多组分物系的泡点和露点计算2.2.1泡点温度和压力的计算2.2.2露点温度和压力的计算第三节闪蒸过程的计算2.3.1等温闪蒸和局部冷凝过程2.3.2绝热闪蒸过程本章符号说明参考文献习题第三章多组分多级别离过程分析与简捷计算第一节设计变量3.1.1单元的设计变量3.1.2装置的设计变量第二节多组分精馏过程3.2.1多组分精馏过程分析3.2.2最小回流比3.2.3最少理论塔板数和组分分配3.2.4实际回流比和理论板数第三节萃取精馏和共沸精馏3.3.1萃取精馏3.3.2共沸精馏第四节吸收和蒸出过程3.4.1吸收和蒸出过程流程3.4.2多组分吸收和蒸出过程分析3.4.3多组分吸收和蒸出的简捷计算法3.4.4化学吸收第五节萃取过程3.5.1萃取流程3.5.2逆流萃取计算的集团法本章符号说明参考文献习题第四章多组分多级别离的严格计算第一节平衡级的理论模型第二节逐级计算法第三节三对角线矩阵法4.3.1方程的解离方法和三对角线矩阵方程的托玛斯解法4.3.2泡点法(BP法)4.3.3流率加和法(SR法)4.3.4等温流率加和法本章符号说明参考文献习题第五章别离设备的处理能力和效率第一节气液传质设备的处理能力和效率5.1.1气液传质设备处理能力的影响因素5.1.2气液传质设备的效率及其影响因素5.1.3气液传质设备效率的估计方法第二节萃取设备的处理能力和效率5.2.1萃取设备的处理能力和塔径5.2.2影响萃取塔效率的因素5.2.3萃取塔效率第三节传质设备的选择5.3.1气液传质设备的选择5.3.2萃取设备的选择本章符号说明参考文献习题第六章别离过程的节能第一节别离的最小功和热力学效率6.1.1等温别离的最小功6.1.2非等温别离和有效能6.1.3净功消耗和热力学效率第二节精馏的节能技术6.2.1精馏过程的热力学不可逆性分析6.2.2多效精馏6.2.3低温精馏的热泵6.2.4设置中间冷凝器和中间再沸器的精馏第三节别离顺序的选择6.3.1简单别离顺序的合成6.3.2复杂塔的别离顺序本章符号说明参考文献习题第七章其它别离技术和别离过程的选择第一节膜别离技术7.1.1别离用膜和膜别离设备7.1.2反渗透7.1.3超滤7.1.4电渗析7.1.5气体膜别离7.1.6液膜别离第二节吸附别离7.2.1吸附原理和吸附剂7.2.2吸附平衡7.2.3吸附速率7.2.4吸附别离工艺简介第三节反响精馏7.3.1反响精馏过程分析7.3.2反响精馏过程的数学模拟第四节别离过程的选择7.4.1可行性7.4.2别离过程的类型7.4.3生产规模7.4.4设计的可靠性7.4.5别离过程的独立操作性能本章符号说明参考文献附录一、多组分闪蒸过程计算源程序二、多组分精馏塔的简捷计算源程序三、多组分精馏塔的泡点法计算源程序四、吸收和蒸出计算的流率加和法源程序看过“化工别离过程(陈洪钫刘家祺著)课后习题答案下载”的人还看了:1.2.3.4.5.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
步骤: 输入:T、P、Tc、i、Pc、i,xi、yi
i=1
(1)式求V( t i)
(
2)式求Z
(i) M
(3)式求fˆ( i i)
Yes i=1
No
输出fˆiV 或fˆiL
i=i+1
注意:
● i=1时求汽相逸度系数;i=2时求液相逸度系数。 汽相:用y求a、b 液相:用x求a、b
●(1)式有三个根
★1964年:化学热力学的发展
由
G
E
提出
Q
GE RT
,Wohl对历年公式加以总结,并推
广到多元。
★1964年:Wilson提出局部组成新概念,并得到发展。
出现了Wilson方程、NRTL方程、UNQAC方程…。
1>.Wohl型经验关系式
Margules方程 Van Laar方程 S—H方程 特点:简便,由于缺乏多元数据,因
2.由(2—31)求 lnfˆi
维里方程的适宜范围:
c
注 意:
P
T 2
yi pc,i
i 1
c
yiTc,i
或
0.5 c
i 1
3.采用R—K方程计算
特点: 1.比多参数状态方程简单 2.适宜于气、液态
R—K方程:
P
RT
VM bM
T
V 0.5 M
aM (VM
bM )
一、状态方程法 二、活度系数法
一、状态方程法
由(2—8):
Ki
yi xi
fˆ L
i
fˆiV
(2 14)
由P—V—T关系计算 f V , f L
i
i
以V为自变量:
lnfˆi
1 RT
V [(nPi
)T
,
P,n
j
(
RT Vt
)]dVt
ln
ZM
(2 15) 推导略
以P为自变量:
与T、P、n j无关
Bij 的计算:
Bij
( RTc,ij pc ,ij
)(
B(0) ij
ij Bij(1) )
ij 0.5(i j ) 偏心因子
Tc,ij (1 kij )(Tc,iTc, j ) 临界温度
Pc,ij 0.5( ZC ,i ZC , j )RTc,ij
过剩自由焓G E与活度系数g i关系:
nG E
C
(ni RT
lng i )
i 1
G E —1摩尔混合物的
过剩自由焓
(nG E ) ( ni )T ,P ,n j
RT lng i
(2 27)
(nGE )
lng i (
RT ni
)T ,P ,n j
Q GE RT
G E与T、P、xi、yi关系?
注意:
求汽相逸度时组成用 yi
求液相逸度时组成用
xi
作业:
P51:3题(只求fiV)
3题改错: 去掉“%”
二、活度系数法
由(2—9):
Ki
yi xi
g
i
f
0 i
L
fˆiV p
(2 17)
f
V i
已解决
对
f
OL ,
i
g
i
分别讨论
恢复
1.基准态逸度
f
OL i
液相活度系数:
gi
fˆiL
ZM
PVt RT
(VRt Tb
a Vt2
)Vt
RT
Vt Vt b
a RTVt
将(2—15)积分后代入以上结果:
2
lnfˆi
bi Vt
b
ln[ Z M
(1
b Vt
)]
2 aai RTVt
3
应用:已知T,P,xi , yi ( i 1,2,c)
求 fˆiV fˆiL
推出:lnfˆi
(ZM
1) Bi BM
ln( Z M
BM P)
AM2 [2 Ai Bi ]ln(1 BM P ) 7
BM AM BM
ZM
计算方法:
1.由〈6〉计算ZM
三个根:求气体(fˆiV )取(ZM )max
求液体(fˆiL)取(ZM )min
2.由〈7〉求fˆi
0.097Tr3 0.0073Tr8
● kij 为二元相互作用参数,计算:
kij 1 8
Vc,iVc, j
(Vc1,i3
Vc1,
3 j
)3
——用于烷烃相当成功
二元常数k ij的平均值
i水
醇
醚
酮
烃
j
烃
0.4 0.15 0.10 0.13
0
酮 0.15 0.05 0.13 0
醚 0.35 0.13 0
第二章 单级平衡过程
简单精馏塔
N M+2
F M+1
M
2
D W=L1
内容:
内容:
各组分物系汽液平衡 单级平衡过程的计算
第二章 单级平衡过程
第一节 相平衡 第二节 多组分物系的泡点和露点计算 第三节 闪蒸过程的计算
第一节 相平衡
2.1.1相平衡条件 2.1.2 相平衡常数的计算
返返回回
2.1.1 相平衡条件 一、相平衡条件
AM2 BM
BM
P
1)ZM
AM2 BM
(BM
P)2
0
6
式中: AM
BM
c
Ai
i 1
c
Bi
i 1
yi yi
Ai
(
R
ai 2T
2.5
)1
2
(
0.42748 Pc ,i Tr2,i.5
)1
2
Bi
bi RT
0.08664 Pc,iTr ,i
相平衡:由混合物或溶液形成若干相,这些相保 持物理 平衡而共存状态。
热力学上看—物系的自由焓最小 动力学上看—相间表观传递速率为零
相平衡条件:
T T T P P P fˆ fˆ fˆ
1.汽液平衡
fˆiV fˆi L
(2—7):
gi
fˆi L
xi
f
OL i
fiOL
fˆi L xi
Hi
Hi —为亨利常数,与T、P、溶质、溶剂有关。
H—化工计算解决
(3)溶液基准态
取基准态: 溶质:属不凝性组分,定义基准态 溶液:属可凝性组分,定义基准态 ————不对称性标准化方法
2.液相活度系数 g i 化工热力学提出:
用K 表示: i
y K x K x 1
i ii
ii
用 ij表示:
yi
Ki xi Ki xi
(Ki (Ki
K j )xi K j )xi
ij xi ij xi
返回
xi
yi y
i
Ki K
i
yi [ y
i
(Ki (K
i
Kj K
)
)]
j
yi y
i
ij
ij
2.1.2 相平衡常数的计算
P PiS
f
L i
PiSfiS
exp[ViL
(
P RT
PiS
) ]
(2 21)
(2—21)有二个校正系数:
1.
f
S i
校正在PiS
下蒸汽对理想气体的偏离。
2.
exp[ViL
(
P
PiS
) ]
称Poynting因子,
RT
校正压力偏离饱和蒸气压的影响。
(2)不凝性组分基准态
取基准态:
当xi 0时,g i 1
此不能应用于多元。
2>.由局部组成概念建立的半经验方程
Wilson方程:
三个优点:1.推算精度高。 2.对理想系偏离很大的物系也适宜。 3.无须多元实验值。
二个主要缺点; 1.不适用于部分互溶系与液液平衡系。 ——修正后可用
2. lng i xi 曲线呈极值点时不适用。
NRTL方程: 适用于部分互溶体系,液液平衡体系 。
xi
f
OL i
(2 7)
讨论:◆可凝性组分基准态
◆不凝性组分基准态 ◆溶液基准态
(1)可凝性组分基准态
取基准态:
当xi 1时,g i 1
这时
f
OL i
fˆi
fiL
fiOL为在系统T、P下液相中纯i 组分逸度
(2 —
7)为:g i
fˆiL xi fiL
(2 19)
fˆiL fˆiL Pyi前已解决,
i
i
将左式代入:
d lnfˆi
d ln fˆ i
1 RT
(Vnt t
)T
,
P
,
n
j
dP
1 RT
(Vnit
)T
,
P
,n
j
dp
dp p
