Validation04过程能力确认04
过程确认控制程序

过程确认控制程序编制人/日期:审核人/日期:批准人/日期:修订页目录1. 目的 (5)2. 适用范围 (5)3. 依据标准 (5)4. 术语 (5)5. 职责 (5)6. 确认程序 (6)7. 相关文件 (11)1.目的本程序的制定旨在确保我司确认工作符合国内、国际现行法规以及确认指南的要求,确保产品制造所涉及的厂房设施与设备、工艺过程等经过了科学的确认,确保我司确认工作的有效性、时效性,为我司的确认活动提供指导原则与实施依据。
2.适用范围本文件适用于我司确认工作的管理;适用于执行确认任务的各个工作阶段;适用于各种确认对象,包括公用系统、工艺设备、检验设备、工艺过程等。
3.依据标准《药品生产确认指南》2003版4.术语4.1确认(Validation):通过提供客观证据对特定的预期用途或应用要求已得到满足的认定。
4.2验证(Verification):通过提供客观证据对规定要求已得到满足的认定。
4.3关键过程:对形成产品的质量起决定作用的工序。
一般包括:形成关键、重要特性的工序,加工难度大、质量不稳定、易造成重大损失的工序。
4.4特殊过程:产品质量不能通过后续测量和监控加以确认的工序。
该工序的产品仅在使用或服务交付之后,其不合格特性才能暴露出来。
4.5安装确认IQ(Installation Qualification):通过对设备的机械、电气安全性及软件等各方面确认,确保设备的各项运转功能及运转参数范围正常,符合产品生产的基本需要及质量要求及设备的设计规格。
4.6运行确认OQ(Operation Qualification):用客观证据支持,使产品符合所有预定要求的过程控制范围和作用程度。
4.7性能确认PQ(Performance Qualification):用客观证据支持,在预期条件下,过程能连续稳定地产出符合所有预定要求的产品。
4.8确认主计划VMP(Validation Master Plan): 确认主计划用来提供确认的策略和方法的要求。
过程确认
也称作安装鉴定( IQ);
— 证明过程将生产出可接受的结果及所建立的
�
过程参数的限度(最不利的情况) —也称作 操作鉴定( OQ),和 — 过程长期稳定性的建立 —也称作性能鉴定 (PQ)。
�
过程能力的评价
TU
过程能力的评价
σ 2σ 3
TU T
TL
μσ σ 6
T
μσ
σ -2σ -σ -3
f(x) 频数
9
FDA的21 CFR Part 820 对过程确认的要求
21 CFR820.75 过程确认 (a ) 当过程结果不能为其后的检验或试验充分验证 时,过程应以高度的把握予以确认,并按已确定的 程序批准。确认活动和结果,包括批准日期和批准 人签字,以及(适当时)被确认的主要装置,应形 成文件。
10
FDA的21 CFR Part 820 对过程确认的要求
19
YY/T0287(ISO13485)对过程确认的要求
7.5.2.1 总要求 e)再确认 关于再确认,应规定何时再确认,再确认的程序和方法等要求。
通常,下列情况下应评审是否需要再确认,并将评价结果形成文件:
—
发生会影响到品质或确认状态的过程变更时,如产品设计变更、 工艺参数拟变化、地址搬迁等; 产品质量不好时:如,顾客反馈、质检趋势不好时 …
21 CFR820.75 过程确认 (b)每个制造商应为已经确认的过程的参数进行监视和控 制建立和保持程序,以确保规定的要求持续得到满足。 (1)每个制造商应确保,经确认的过程由有资格的人员 操作。 (2)对经确认的过程,监视和控制的方法和信息、监控 日期,以及(适当时)过程的操作人员或使用的主要装置应 形成文件。 (c)当发生更改或过程偏离是,制造商应对过程进行评审 和评价,适当时,进行再确认。搜有这些活动应形成文件。
过程确认及方法概述

Wally Wang Paragon Medical Device Changzhou 王新化 派瑞格医疗器械(常州)有限公司
Agenda/Topics 日程 / 主题
• • • • • • • • • • • What is Process Validation? 什么是过程确认? Brief history of validation 确认的简要历史 Who concerns about validation? 谁关心确认? Expectations 期望 Definitions/Compliance 定义 / 符合性 Validation Economics 确认的经济意义 Examples of Warning Letters 警告信的案例 Elements of Process Validation 过程确认的要素 When to Validate 何时确认 Validation Master Plans 确认主计划 What is Required to Be Outstanding in Process Validation? 确认中需要强调什么? • Steps to Validation of a Process 过程确认的步骤
Does Your Company Need to Do Process Validation? 你们公司需要做过程确认吗?
• Are any classes of medical devices exempt? 哪个类别的医疗器械不需要做过程确认? – No! Unless specifically stated in Medical Device Exemptions 510(k) and GMP Requirements 没有!除非医疗器械豁免510(k) 和GMP要求中有特 别声明。
Validation01过程能力确认解读

Module 1, Part 1: Introduction and The VMP
Slide 15 of 22
© WHO – EDM
Validation
VMP should state who is responsible for:
Preparing the VMP
The protocols and SOPs Validation work Report and document preparation and control Approval/authorisation of validation protocols and reports in all stages of validation process Tracking system Training needs in support of validation
by whom?
how? when?
Slide 9 of 22
© WHO – EDM
Module 1, Part 1: Introduction and The VMP
Validation
Validation Master Plan
Prospective validation Concurrent validation Retrospective validation Revalidation
Qualification versus validation, e.g. you qualify an autoclave, whereas you validate a sterilization process
Slide 6 of 22
质量管理体系五大工具介绍及应用

检测:
检查并剔除不符合规范的产品。
预防:
在第一步就可以避免生产无用 的输出,从而避免浪费。 过程控制系统
特殊原因
UCL CL LCL
SPC的定义
Statistical :统计数据和分析技术 Process :对生产过程能力的分析 Control :通过PDCA循环的可持续管理
变差
随机原因
apqpcpfmeamsaspcppap程序作业指导书其它文件第二层确定谁做什么何时做第三层回答如何做第四层及时记录的信息如表格标记标签一旦记录第四层的项目就可以成为质量记录五大工具介绍及应用质量管理体系的五大技术手册概况产品质量先期策划apqp潜在失效模式和后果分析fmea测量系统分析msa第三版2001年7月第三版2002年3月统计过程控制spc第二版2005年7月生产件批准程序ppap第四版2006年3月第一版1994年6月五大技术手册五大工具介绍及应用五大工具乊apqpcp概念产品质量先期策划和控制计划产品质量先期策划和控制计划advancedproductqualityplanningcontrolplan反馈评定和纠正措施五大工具介绍及应用产品质量策划进度图表productqualityplanningtimingchartplnning策划plnning产品设计和开发productdesigndevelopment过程设计和开发prcessdesigndevelopment产品与过程确认productprcessvalidation生产生产production反馈评定和纠正措施反馈评定和纠正措施feedbackassessmentcorrectiveaction策划plnning概念提出批准conceptinitiationapproval项目批准programapproval样件prototype试生产pilot投产launch计划和确定项目plandefineprogram产品设计开发和验证productdesigndevelopmentverification过程设计开发和验证processdesigndevelopmentverification产品和过程确认productprocessvalidation反馈评定和纠正措施feedbackassessmentcorrectiveaction五大工具介绍及应用计划和定义产品设计和开发过程设计和开发产品和过程确认dfmeapfmeamsaspcppapapqp反馈评定和纠正措施五大工具介绍及应用fmea
软件开发过程_验证和确认过程

验证和确认过程Verification & Validation Process【目录】1概述 (3)1.1 编写目的 (3)1.2 适用范围 (3)1.3 术语和缩写 (3)1.4 参考资料 (3)2输入 (3)3输出 (4)4角色和职责 (4)5验证和确认概述 (5)6过程定义 (5)6.1 入口条件 (5)6.2 出口条件 (5)6.3 过程流程图 (5)6.4 过程活动描述 (5)6.4.1建立验证和确认计划 (5)6.4.2建立验证和确认环境 (6)6.4.3建立详细的验证和确认计划 (7)6.4.4执行同行评审 (7)6.4.5进行验证和确认 (7)6.4.6分析验证和确认的结果 (8)7验证和确认的工作产品 (9)8过程度量 (14)9过程剪裁准则 (14)1概述1.1 编写目的定义和建立公司对项目验证和确认的规范和责任。
定义及规范软件产品的验证和确认过程,以保证工作产品在软件开发的整个生命周期中能满足其规定的要求,同时证明,产品或产品构件当被置于其预定环境中时,适合于其预定用途。
通过该规范来提高公司的验证和确认的能力。
1.2 适用范围本过程适用于公司内所有软件开发项目的验证和确认活动。
1.3 术语和缩写1.4 参考资料2输入3输出(具体输出制品请参阅7.验证和确认的工作产品的验证和确认记录)4角色和职责5验证和确认概述验证的目的是为了确保产品符合其指定的需求,包括指定用户需求、产品需求、工作产品组件的需求。
从需求开始验证直到最终产品完成的验证,该过程贯穿于整个软件生产过程中,是渐进式的过程;确认的目的是为了确保产品和产品组件在预期的使用环境中能够满足产品的使用需求。
确认和验证经常同时执行,确认一般会包括使用者。
“验证”过程方面与“确认”过程方面看起来类似,但是它们处理的问题不同。
“确认”是要证明所提供的(或将要提供的)产品适合其预计的用途,而“验证”则是要查明工作产品是否恰当地反映了规定的要求。
APQP标准

17 包装规范
18 产品试生产
19 生产控制计划
20 初始过程能力研究
21 生产确认试验 22 生产件批准
第5页,共75页。
检查清单中的重要要素
▪ 设计FMEA ▪ 设计验证计划和报告
▪ 样件制造控制计划
▪ 制造过程流程图 ▪ 过程FMEA ▪ 试生产控制计划
▪ 作业指导书
▪ 生产控制计划
图纸和规范
过程与产品
特性联结
初始过程 能力研究 计划
设计验证和批准报告 平面布置图
特性矩阵表
PFMEA
MSA
试生产
控制计划
包装规范
包装标准
产品/过
程质量
系统评
审
特殊产品/
过程特性
作业指导书
管理层评审
产品和过程验证
试生产
生产控 制计划
质量计划
批准和管 理层支持
初始过程能力研究 生产验证
包装评估
生产件
批准 (PSW)
产生生产控制计划的样件制造和试生产之间的步骤
识别和调整产品特性及其指标的过程步骤
第38页,共17-54页2。
PBCP 总的期望
评审产品特性
确定 PBCP 所要求的特性。
必须包括 DFMEA 输出的所有潜在重要和关键特性。
过程参数条件必须被文件化。
包括所有特殊工具、制造和装配条件。
第39页,共17-54页3。
Definition APQP是一种结构化的方法,用来确定 和制定确保某产品使顾客满意所需的 步骤
第1页,共75页。
Goal APQP的目的是使所有参加该项目的人 员和行为便于沟通,确保所有开发阶 段按时,以可接受的成本和质量水准 完成.
五大手册

1.APQP 2.PPAP 3.SPC 4.FMEA 5.MSA
PPAP
PPAP:Production Part Approval
Process 生产性零组件承认程序 目的: (1)确认供应商,是否充分了解客户工程设 计与规格需求; (2)平谷供应商,是否有符合客户规格去 求之生产能力。
生产性零组件承认程序
减少变差 顾客满意 交付和服务
APQP阶段5:反馈、评定和纠正措施 FEEDBACK ASSESSMENT AND CORRECTIVE ACTION
减少变差
关键术语和基本概念
使用控制图和其他统计技术来减少变差 应用分析和纠正措施来减少变差 持续改进,注意产生变差的特殊原因和普通原因 持续改进,减少产生变差的特殊原因和普通原因
设计责任部门的输出
PRODUCT DESIGN AND DEVELOPMENT VERIFICATION
产品质量策划小组的输出
DFMEA 可制造性和装配的设计 设计验证 设计评审 样件制造 工程图样 材料规范 图样和规范更改
新设备、工装和设施要求 特殊产品和过程特性 样件控制计划 量具/试验装置的要求 DFMEA的更新
APQP阶段4: 产品和过程确认 PRODUCT AND PROCESS VALIDATION
PPAP 范围
关键术语和基本概念
生产件—通常300件 包括内部和外部的信息来源 第一次产品转运前的批准要求
APQP阶段4: 产品和过程确认 PRODUCT AND PROCESS VALIDATION
生产性零组件承认程序
送件等级区分:
Validation(有效性鉴定

Process Validation有效性鉴定P rocess V alidation 有效性鉴定About The Course关于该培训•Background for the training背景–P&G QAKE KE6•Not a Training but a forum讨论•Raise question any time欢迎提问•Time:2-3hrsObjective学习本课程要求达到的目标1.有效性鉴定的基本概念和其重要性2.有效性鉴定的种类和方法。
3.有效性鉴定系统和主计划4.编写与执行有效性鉴定协议草案与报告What is Validation?什么是有效性签定什么是有效性签定??•Validation is establishing documented evidence that a specific process will consistently produce a product meeting its pre-determined specifications and quality attributes.有效性签定是文件化地证实一个工艺过程能够持续地生产符合既定规格或质量要求的产品.ProcessMaterial Machine MethodProductEquipmentdesign features(e.g.ProcessConditions(e.g,temp,Physical property orfunction of material(e.g.,thickness,Actions criticalfor quality(e.g.,positioning,Skillsrelated toQ-TasksMachine Material Methods huMan What is Process?什么是工艺过程Why Important为什么有效性鉴定重要Cost(minimize re-work,reduce scrap)by process control成本(减少返工,报废)Those not be able to be verified by inspection某些不能事后检验Quality(guarantee quality product to the consumer–same quality every time)保证向用户提供优质稳定产品Speed to the market(do it right1st time)加速进入市场(一次做好)Regulatory Basis(the law)法规的需要»Food and Drug Requirement(Drugs&Devices)药品和医疗器械要求»Required by P&G(via the Key Elements)Any system that is designed to deliver specific conditions for the production of a specified product.任何设计用于为一个专门产品的生产提供专门条件的系统。
方法验证和确认相关的36个概念

方法验证和确认相关的36个概念01定义验证verification:提供客观证据,证明给定项目满足规定要求。
(CNAS CL01:2018)方法验证method verification:实验室通过核查,提供客观有效证据证明满足检测方法规定的要求。
(GB/T 27417-2017)方法验证是指标准方法在引入实验室使用前,对实验室从人、机、料、法、环、测等方面评定其是否有能力在满足方法要求的情况下开展检测校准活动的过程。
确认validation:对规定要求满足预期用途的验证。
(CNASCL01:2018)方法确认method validation:实验室通过试验,提供客观有效证据证明特定检测方法满足预期的用途。
(GB/T 27417-2017)方法确认是对非标准方法,实验室制定的方法,超出预定范围使用的标准方法或其它修改的标准方法确认能否合理、合法使用的过程。
02目的方法验证的目的是证明检测实验室有能力依据所选择的标准方法开展检测活动并能够得到满意的检测结果, 以确保实验室可以按照方法开展检测。
方法确认的目的是证明非标准方法的合理性、合法性, 各质量参数可以满足特定预期用途的特定要求, 以确保实验室能够使用合规方法进行检测。
03对象方法验证的对象是标准方法。
标准方法是指由公认机构经过评价确认后向社会公开发布的技术规范文件。
如国际标准方法、国家标准方法、行业标准方法或地方标准方法等。
方法确认的对象是非标准方法。
从广义的理解来看,除了国际、区域、国家、行业、地方标准所规定方法以外的检测方法都属于非标准方法,如实验室制定的方法,超出预定范围使用的标准方法或其它修改的标准方法。
04内容方法验证标准方法使用前,实验室应评估人、机、料、法、环等资源是否满足标准要求,对实验室的实施能力进行验证。
人员检测/校准人员的资历,数量是否满足要求。
人员是否经过方法培训、考核、授权。
是否能够熟练操作。
提供人员相应的履历证明,提供培训考核记录,包括实际进行检测或校准的记录。
CMMI之过程域验证(Ver)与确认(Var)的比较

CMMI之过程域验证(Ver)与确认(Var)的比较CMMI全称是Capability Maturity Model Integration,即软件能力成熟度模型集成,这里华迪教育就CMMI中的过程域验证(Ver)与确认(Var)进行一番比较。
1、概念识别验证verification:通过提供客观证据对规定要求已得到满足的认定;确认validation:通过提供客观证据对特定的预期用途或应用要求已得到满足的认定。
2、相近之处CMMI不同的两个PA,均用于表示相应的认定状态。
确认与验证活动经常同时执行,且可能使用部分相同的环境。
3、认定的准则不同验证重点强调的是,验证的准则是规定的要求。
规定要求的表现的工作产品很多,如单元测试验证产品每一模块是否符合详细设计说明书要求;集成测试验证接口是否符合概要设计说明书要求;系统测试验证产品是否符合需求规格说明书要求;验证这个PA其目的是希望软件企业在软件开发整个过程中,做好相应的检查工作,把尽量问题发现前面,保证了项目的可控性,降低开发的成本。
确认重点强调的是,确认的准则是预期用途或应用要求。
确认考虑的是产品或系统最终的用途或应用要求是否可以实现,确认过程所使用的条件(如环境条件)要是实际的或是模拟的,如汽车要求预期用途是在高温的沙漠里行驶,确认过程可以实际或模拟高温和沙尘的环境,把新开发的汽车放在次环境中路试;开发环境与真实环境是不可避免存在差异的,为了有效地避免在开发环境中没有问题,但一到真实环境就出现问题的情况,确认的工作是非常重要的。
通常,确认活动包含了最终使用者及其它相关干系人。
一般来说,实际环境或客户环境中调试、试用、验收测试等都是确认的工作。
4、认定的方法验证认定的办法一般是同行评审、软件测试、试验、演示等。
确认认定的方法:可以是分析、评审、模拟、原型、示范、试验、测试等。
工艺验证的类型

工艺验证的类型工艺验证是指通过实验、测试或其他方法,确认工艺过程能够生产出符合设计要求的产品,并满足特定的质量标准和要求。
根据验证的目的和内容,工艺验证可以分为以下几种类型:1. 工艺能力验证(Process Capability Validation):验证工艺过程的能力,即确定工艺过程能否稳定、可靠地生产出合格产品,并满足特定的质量指标。
通常采用统计方法分析工艺过程的变化范围、偏移程度等指标,如Cp、Cpk指数等。
2. 工艺参数验证(Process Parameter Validation):验证工艺过程中涉及的各种参数设置是否正确,以及参数值的稳定性和准确性。
通过试验、记录和统计等方法,检查和确认工艺参数的设定是否能够满足产品的设计要求。
3. 设备验证(Equipment Validation):验证工艺过程中使用的设备是否满足产品生产的要求,设备的性能参数是否符合规定的标准和要求。
包括设备的安装调试、性能测试、校准验证等环节。
4. 工艺流程验证(Process Flow Validation):验证整个工艺流程的可行性和一致性,以确保产品生产能够按照规定的程序流程进行。
通过对各个工艺步骤的执行情况进行验证和评估,确认工艺流程的合理性和有效性。
5. 工艺风险评估(Process Risk Assessment):对工艺过程中可能存在的风险进行评估和分析,确定相应的控制措施和纠正预防措施。
通过风险评估,可以帮助确定工艺改进的重点和方向,提高工艺过程的可靠性和稳定性。
6. 工艺验证计划(Process Validation Plan):针对具体的产品和工艺过程,制定详细的验证计划,包括验证的目标、方法、标准、流程和工具等。
工艺验证计划是指导和管理工艺验证活动的重要依据,确保验证工作的顺利进行。
过程检验控制程序

过程检验控制程序过程检验控制程序(Process Validation Control Procedure)是指通过一系列可重复的操作,来验证并确认制造过程能够按照既定的规范进行,以确保产品的质量符合要求。
下面将详细介绍过程检验控制程序的主要步骤和要点。
1.制定过程检验计划制定过程检验计划的目的是明确制造过程中需要检验的关键环节和检验方法,以确保产品可以符合质量要求。
检验计划应该根据产品要求和制造过程的特点来制定,包括需要测试的项目、测试方法、测试频率、检验人员及其培训要求等内容。
2.制定检验标准在制定过程检验标准时,应参考国家标准、行业标准、公司内部标准和客户要求等,并结合实际情况进行制定。
检验标准应包括产品的外观质量、物理性能、化学成分、尺寸精度、功能性能等项目,并明确每个项目的可接受标准和测试方法。
3.制定检验流程制定检验流程的目的是明确每个环节的操作方法和要求,确保检验过程的一致性和可追溯性。
检验流程应包括样品的采集、实验室测试、数据记录和结果分析等环节,并详细说明每个环节的操作要点和注意事项。
4.建立检验记录和报告在执行过程检验过程中,应及时记录检验数据和结果,并生成相应的检验报告。
检验记录和报告应包括样品编号、检验时间、检验人员、测试项目、测试结果和评定结论等内容,并有专门的存档和管理措施,以备后续的质量追溯和证明。
5.进行过程能力分析过程能力分析是对制造过程进行统计分析的一种手段,旨在评估制造过程是否具备稳定性和能够满足产品质量要求。
常用的过程能力指标有过程能力指数(Cp)、过程能力指数(Cpk)和过程能力比(CR)等。
通过过程能力分析,可以确定制造过程的容量以及需要改进的问题,以保证产品的稳定性和一致性。
6.建立纠正和预防措施当发现过程检验结果不合格时,应立即采取纠正措施,如调整工艺参数、更换设备等,以消除不合格因素,保证产品质量。
同时,还应进行原因分析,确定问题根源,并制定相应的预防措施,以防止不合格再次发生。
validation用法

validation用法Validation是指在数据输入、处理或输出过程中,对数据的合法性进行检查和验证的过程。
在软件开发中,数据的合法性非常重要,因此需要使用Validation来确保数据的正确性和完整性。
本文将介绍Validation的基本概念、原则、方法和实现。
一、概念1.1 Validation定义Validation是指对数据进行检查和验证的过程,确保数据符合规定的条件、要求和标准。
1.2 Validation目的Validation的目的是确保输入、处理或输出的数据符合系统设计要求,并且能够满足用户需求。
1.3 Validation原则Validation应该遵循以下原则:(1)有效性:验证结果应该能够正确地反映出数据是否符合规定条件。
(2)可靠性:验证结果应该具有可重复性,即同样的输入应该得到同样的输出。
(3)完整性:所有必要信息都应该被验证,并且不会漏掉任何一个必要信息。
(4)及时性:验证应该在最早可能时间进行,以便及时发现错误并纠正。
二、方法2.1 数据类型验证数据类型验证是指对输入数据类型进行检查和确认。
例如,在一个数字型字段中输入了非数字字符,则会提示错误信息并拒绝保存。
这种方法可以有效地防止非法字符输入,从而提高系统安全性。
2.2 数据格式验证数据格式验证是指对输入数据格式进行检查和确认。
例如,在一个邮件地址字段中输入了错误的邮件地址,系统会提示错误信息并拒绝保存。
这种方法可以有效地防止错误格式输入,从而提高系统可靠性。
2.3 数据范围验证数据范围验证是指对输入数据范围进行检查和确认。
例如,在一个年龄字段中输入了负数或超过规定范围的数字,则会提示错误信息并拒绝保存。
这种方法可以有效地防止非法数据输入,从而提高系统完整性。
2.4 数据逻辑验证数据逻辑验证是指对输入数据逻辑关系进行检查和确认。
例如,在一个订单表中,订单数量不能大于库存数量,则会提示错误信息并拒绝保存。
这种方法可以有效地防止逻辑错误输入,从而提高系统精确度。
valid和validated的工作原理

valid和validated的工作原理哎呀,今天咱们聊聊valid和validated这两个词儿,它们在日常生活中可重要了。
你知道吗,有时候我们在网上填写问卷,就需要用到这两个词儿。
它们到底是怎么工作的呢?别着急,听我慢慢道来。
咱们来说说valid。
valid这个词儿,它的意思是“有效的”,“正确的”。
咱们在填写问卷的时候,如果某个问题回答得不对,那么这个答案就是invalid的。
而一个正确的答案,就是valid的。
valid这个词儿,就像是一个指南针,告诉我们哪些答案是对的,哪些是错的。
接下来说说validated。
validated这个词儿,它的意思是“验证过的”,“核实过的”。
在咱们填写问卷的时候,如果某个问题需要我们提供一些个人信息,比如姓名、电话号码等等。
这时候,我们需要先把这些信息填写好,然后再提交给相关部门进行validated。
这个过程就像是给我们的信息做一个认证,确保它是真实可靠的。
现在咱们已经知道了valid和validated的基本意思。
它们是怎么在实际生活中应用的呢?咱们来看个例子。
有一天,小明在网上参加了一个关于环保的问卷调查。
这个问卷里有很多问题,比如你每天会骑自行车上班吗?你会定期参加社区的环保活动吗?你家里有没有安装节能电器?等等。
小明觉得这些问题都挺有意义的,于是他认真地回答了每一个问题。
可是,当他写到最后一个问题时,突然发现自己不知道该怎么回答。
这个问题是:“你认为政府在环保方面做得怎么样?”小明觉得这个问题很重要,但是他又不确定自己的看法是否正确。
于是,他决定先把自己的观点写上去,然后再去查资料,看看别人都是怎么看待这个问题的。
过了几天,小明终于完成了问卷。
他觉得自己做得非常好,因为每个问题都回答得非常仔细。
于是,他把自己的问卷提交给了相关部门。
不久之后,他收到了一个回复,说他的问卷已经被validated了。
这让小明非常高兴,因为他觉得自己的观点得到了认可。
过程确认--原理

Design Qualification(DQ)设计确认 Specification Qualification(SQ)规范确认 Design of Experiments (DOE)试验设计
定义: Installation Qualification 安装确认
过程确认:通过客观证据的建立,证明过程能持 续地生产出一个结果或产品符合预定的要求
例如: 在正常生产条件下连续成功地至少生产3 批合格产品。
时间排列:确认,作为一种良好的业务实践
研究和开发 概念和设计
确认输入
设计 开发
总计划
详细 计划
工程 启动
合格性鉴定 /确认
保证我们满足规章要求
运行
规章管理 工程设计
通过检查及客观证据的提供确保已经达到具体的要求 (21CFR Part 820 FDA )
通过提供客观证据对规定要求已经得到满足的认定(ISO 13485:2003)
为什么要确认?
大多数的过程不能被 100%核实、查证 大多数的过程不能被 100%检验 确保系统、设备、方法和产品的表现如期望的一 样具有可靠性、重复性和持续性 确保产品质量、减少不合格 当过程中的问题产生时能够提高解决问题的能力
Basic Framework for Specification, Design and Testing 关于标准,设计和测试的基本框架
V
User Requirements Specification
用户要求
Functional Specification
功能要求
Design Specification
通过提供客观证据对特定的预期用途或应用要求已得 到满足的认定.(ISO13485:2003)
过程能力的确认方法

99.5 99.73
从表一可以看出,只有当测量次数 n →∞ 时,对应 KPt =3时的置信概率 p 才为 99.73%也就是说,只有这时 t- 分布才趋于正态分布。这说明,当 t- 分布 时,对应置信系数 KPt=3(即 ± 3 为极限误差),其置信概率并不永远是 99.73%,而是随测量次数的减少而降低。
1
μ= n
n
∑ X i ,(n→∞ )
i=1
n
√ δ=
1 ∑ (Xi - μ) 2
n
i=1
,(n→∞ )
在进行有限次测量时,上述参数的估计值分别为:
n
?= = 1 Xn
∑ X i ,(n 为有限
次) i=1
n
√ e=
1
____
∑
n-1 ( X i -
X )2
i=1
,(n 为有限次 )
上述估计值 ?、e可以作为 t- 分布的参数值。 2.t- 分布时,置信概率与测量次数的关系。 对于正态分布,当置信系数 KPt =3 时,对应置信区间(- 3δ 、+ 3δ )
表三 过程能力指数C P(或C Pt ) 评价表
一、过程确认与过程能力 7.5.2 条款要求对特殊过程实施确认,并明确提出:“确认应证实这些过程 实现所策划的结果的能力。”所谓过程能力,就是在受控条件下,保证过程能够 生产合格产品的能力。 任何过程的运行都会受到许多因素的影响,这些影响因素大致可分为两大 类:一是系统性影响因素,二是随机性影响因素。 系统性影响因素能使过程产生系统性波动, 这类波动的数值较大或具有一定 的规律性,这是我们所不期望的, 应该力加避免。 所谓使过程在受控条件下运行, 就是要对系统性因素实施有效控制,不允许过程在系统性因素的影响下运行。 随机性影响因素能使过程产生随机性波动, 这种波动的数值比较小, 从微观 上说波动没有规律, 是很多微弱影响因素综合作用的结果。 这类波动无法 (或不 值得)从技术的角度加以克服, 只能利用统计学的规律对其进行研究。 大多数随 机波动服从统计学的正态分布规律。 综上所述, 当过程受控并消除了系统性波动, 在随机状态下运行, 就可以用 随机状态的正态分布规律讨论过程的能力。
医疗器械过程验证和确认

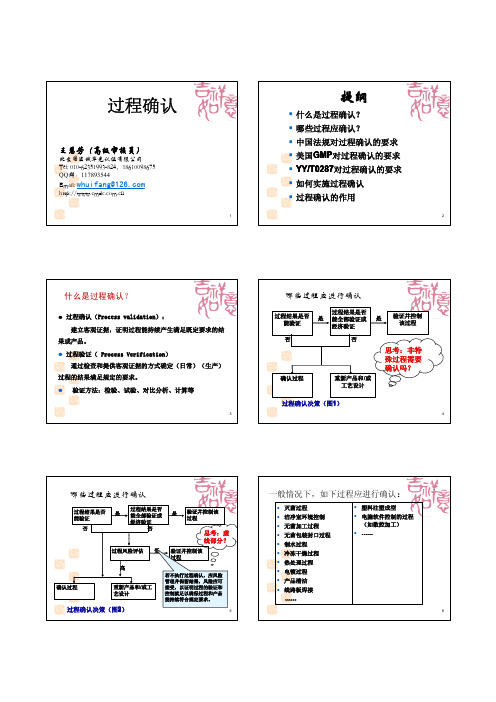
一、什么是过程确认(process validation)?过程确认基本上就是日常我们所说的工艺验证(process validation)。
在GHTF/SG3/N99-10:2004(第2版)中,对过程确认给出如下定义:提供客观证据,证明过程(或工艺)将能连续地生产出符合预定要求的结果或产品。
换句话说,过程确认就是在一个过程或工艺被交付用于正式或批量生产销售的产品之前,通过提供相应证据如试验结果、计算结果、对比分析等,证明该过程或工艺具备持续地生产符合要求的结果或生产合格产品能力;一般情况下,正式交付用于生产以后,还需要根据情况考虑再确认。
二、什么样的过程需要确认?关于什么样的过程需要确认,ISO13485的7.5.2.1是这样描述的:“当生产和服务提供过程的输出不能由后续的监视或测量加以验证时,组织应对任何这样的过程实施确认。
这包括仅在产品使用或服务已交付之后问题才显现的过程。
”换种方式,可以用下图判断什么样的过程需要确认(见GHTF/SG3/N99-10:2004(第2版):此处所指的“验证”,是指通过检验、试验、计算、对比分析等方法判定某过程(或工艺)的结果或产品是否合格。
其实很多过程在日常生产过程中,企业通过对其结果或产品进行全部验证然后才放行产品是不可行的,原因如下:—检验时,对产品是破坏性的;—检验活动很耗时;—检验的成本很高。
对这样的过程,因此企业应在该过程(或工艺)被交付用于正式或批量生产销售的产品之前,通过提供相应证据如试验结果、计算结果、对比分析等,证明该过程(或工艺)具备持续地生产符合要求的结果或生产合格产品能力,从此日常生产时即使不全部验证,也能判定该过程生产合格产品的能力是符合要求的。
企业如果对这样的过程不进行确认,此时应提供对该过程风险分析和风险评估的证据,且评估结果时该过程有关的风险很低,低至可以接受。
具体判定哪些过程需要确认时,可以采纳下面的流程方法:a)首先,确定生产流程,画出流程图,注意确保和实际生产流程是一致的。
validation的用法

Validation的用法简介Validation(验证)是指通过对数据、过程或系统进行检查,以确保其符合特定的要求、标准或规范。
在计算机科学和软件工程领域,验证是确保软件系统或组件的正确性和可靠性的重要步骤。
通过验证,我们可以发现和纠正错误,提高软件系统的质量和可靠性。
数据验证数据验证是指对输入的数据进行检查,以确保其符合预期的格式、范围或规则。
数据验证的目的是防止无效或恶意数据的输入,从而保证数据的完整性和安全性。
常见的数据验证技术包括:•格式验证:检查数据是否符合指定的格式要求,例如日期、时间、邮箱地址等。
•范围验证:检查数据是否在指定的范围内,例如年龄、成绩等。
•唯一性验证:检查数据是否唯一,例如用户名、身份证号码等。
•逻辑验证:检查数据之间的逻辑关系是否正确,例如起始日期不能晚于结束日期。
•安全验证:检查数据是否包含潜在的安全风险,例如SQL注入、跨站脚本攻击等。
数据验证通常在用户输入数据之后、数据存储之前进行,以确保无效或恶意数据不会进入系统。
表单验证表单验证是指对用户提交的表单数据进行检查,以确保其符合预期的格式、范围或规则。
表单验证通常用于Web应用程序和移动应用程序中,以确保用户输入的数据的有效性和一致性。
常见的表单验证技术包括:•必填字段验证:检查必填字段是否为空,例如姓名、邮箱等。
•长度验证:检查字段的长度是否在指定范围内,例如密码长度、用户名长度等。
•格式验证:检查字段是否符合指定的格式要求,例如邮箱地址、电话号码等。
•密码验证:检查密码是否符合安全要求,例如包含特殊字符、大写字母等。
•一致性验证:检查两个或多个字段的值是否一致,例如确认密码、验证码等。
表单验证可以通过前端技术(如JavaScript)或后端技术(如服务器端验证)来实现。
前端验证可以提高用户体验,减少不必要的服务器请求,但后端验证是必不可少的,以确保数据的完整性和安全性。
软件验证软件验证是指对软件系统或组件进行检查,以确保其符合预期的功能、性能、安全和可靠性要求。
流程性材料检验

流程性材料的检验[折叠]1.流程性材料产品的特点在社会生产、服务和生活的各项活动中随时、随处可以看到、遇到、用到流程性材料,它和我们日常生活、工作、学习及衣、食、住、行的关系极为密切。
流程性材料诸如:固态:纸张、纺织品、电线电缆、金属、非金属的板材、线材、冰、面粉、糖、盐等等;液态:涂料、蒸馏水、成品燃料油等;气态:氮、氧、天然气等气体。
流程性材料有以下特点:(1)流程性材料可以是固态,也可以是液态和气态。
在一定条件下(如温度、压力、时间)三种形态可相互转化。
固态可转换为液态、气态,反之亦然。
(2)流程性材料通常为有形产品(与软件、服务相比较),但是许多流程性材料(常温时为气态、液态和颗粒状的固态)形态有不确定性和随遇性,随其存放、盛纳的容器和包装物及堆放场所(散状固态)而定。
(3)流程性材料具有整体的均匀性,其整体中任一微小单元或整体分割后各单元仍是相同的物质,并且其性质不变。
(4)流程性材料具有自然的连续性,无法进行计数,只能进行计量。
(5)流程性材料其产品形成过程一般也是连续实现的,在一定批量投料完成之前,一般不能或不易中途停顿中止生产。
产品形成后一旦出现性能不合格很难纠正(返工、返修)。
2.流程性材料产品的主要性能(1)外观:色泽、形态。
(2)物理性能:密度(体密度、面密度、线密度)、粘度(粘度系数)、粒度、熔点、沸点、凝固点、燃点、闪点、热传导性能(比热、热导率、线胀系数)、电传导性能(电阻率、电导率、电阻温度系数)、磁性能(磁感应强度、磁场强度、矫顽力、铁损)。
(3)化学性能:耐腐蚀性、抗氧化性、化学稳定性。
(4)力学性能:强度、弹性、塑性、韧性、硬度、疲劳、耐磨性等。
3.流程性材料的检验方法(1)流程性材料检验的特点由于流程性材料的多样性,其产品各自性能要求千差万别,因此它们的检验方法和检测使用的仪器、设备也各不相同,无法笼统地回答什么是流程性材料的检验方法。
但与机械及电工产品相比较又有其特点:①流程性材料整体均匀性的特点决定了流程性材料可通过对其微小单元(部分)实行检验得到整体的性能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Module 1,, Part 4: QC-related validation
Slide 16 of 28
© WHO – EDM – 1/2002
Calculated analyte in mg/mL
Linearity of an analyte in a material
Table of values (x,y)
x #
Reference material mg/ml
y
Calculated mg/ml
1
2
Reference material mg/ml 0.02 0.025 0.03 0.035 0.04
Validation
Analytical method transfer
Method transfer protocol and procedure
precision accuracy ruggedness
Written and approved specific test method Proficiency check Formal acceptance by new laboratory
Slide 17 of 28
© WHO – EDM – 1/2002
Module 1,, Part 4: QC-related validation
Validation
Chemical laboratory validation requirements (1)
Balances
Chromatography HPLC, HPTLC, GC, TLC Dissolution or disintegration apparatus Karl Fischer moisture determination Melting, softening or freezing point apparatus
Supplementary Training Modules on Good Manufacturing Practice
Validation Part 4:
QC-related validation
Module 1,, Part 4: QC-related validation
Slide 1 of 28
Slide 2 of 28
© WHO – EDM – 1/2002
Validation
Objectives
To introduce the concepts of :
Protocol development Instrument qualification Analytical procedure Extent of validation
Validation
Linearity Statistics
Intercept Slope Correlation coefficient
Pearson Olkin and Pratt
-0.0002 1.0237
0.9978 0.9985
Limit of Linearity and Range 0.005 – 0.040 mg/mL
D X* X
Robustness
Linearity and range Specificity Limit of detection Limit of quantitation
Module 1,, Part 4: QC-related validation
X
X
X
X X X
X
X X
X
X X
X
X X
* A degree of bias may be allowed
Module 1,, Part 4: QC-related validation
Slide 6 of 28
© WHO – EDM – 1/2002
Validation
Characteristics of analytical procedures (1)
Accuracy Precision Repeatability
© WHO – EDM – 1/2002
Validation
Introduction
Why is analytical monitoring necessary? What is the purpose of analytical validation?
Module 1,, Part 4: QC-related validation
Class A: To establish identity Class B: To detect and quantitate impurities
Class C: To determine quantitatively the concentration
Class D: To assess the characteristics
Module 1,, Part 4: QC-related validation
Slide 5 of 28
© WHO – EDM – 1/2002
Validation
Qualification of the instrument
Make, model and maker’s manual Modifications Installation and operational qualification Calibration programs Maintenance schedules
Responsibilities Documented test method
List of materials and equipment
Procedure for the experiments for each parameter Statistical analysis Acceptance criteria for each performance parameter
Slide 15 of 28
© WHO – EDM – 1/2002
Validation
Extent of validation
New methods require complete validation Pharmacopoeial methods require partial validation (or verification) Significant changes mean partial revalidation
Reproducibility
Module 1,, Part 4: QC-related validation
Slide 7 of 28
© WHO – EDM – 1/2002
Validation
Relationship between accuracy and precision
Inaccurate & imprecise
Validation
Validation of analytical procedures requires:
Qualified and calibrated instruments
Documented methods
Reliable reference standards
Qualified analysts
0.0100
0.0150 0.0200 0.0250 0.0300 0.0400
0.0101
0.0145 0.0210 0.0260 0.0294 0.0410
3 4 5 6
0.015
Module 1,, Part 4: QC-related validation
Slide 11 of 28
© WHO – EDM – 1/2002
Relative procedure standard deviation
Slide 12 of 28
3.4%
© WHO – EDM – 1/2002
Module 1,, Part 4: QC-related validation
Validation
LOQ, LOD and SNR
Limit of Quantitation Limit of Detection Signal to Noise Ratio
Sensitivity
Limit of detection Limit of quantitation
Module 1,, Part 4: QC-related validation
Slide 10 of 28
© WHO – EDM – 1/2002
Validation
0.040 0.035 0.030 0.025 0.020 0.015 0.010 0.01
Module 1,, Part 4: QC-related validation
Slide 14 of 28
© WHO – EDM – 1/2002
Validation
Characteristic
Accuracy Precision A B quant. X X B
Limit test
C X X
Sample integrity
Slide 4 of 28
© WHO – EDM – 1/2002
