管柱层析法
利用柱层析的方法分离和提纯有机物

注意事项
1.加入氧化铝时动作要缓慢,使之均匀加 入,以防在柱中间流下气泡。若已有气 泡则拍打层析柱。 2.氧化铝平面上要保持一定液面。 3. 收集到亚甲基兰之前收集的乙醇可反复 使用。
实验五
柱层析
有机化学与药物化学教研室
柱层析
将固定相装于柱管内构成层析柱, 层析过程在层析柱内进行。按层析柱的 粗细差别,可分为填充柱层析法、毛细
管柱层析法及微填充柱层析法等。
一、实验目的
1. 掌握柱层析的原理和基本操作。 2. 利用柱层析的方法分离和提纯有机物。
二、实验原理
柱色谱是利用混合物中各组分受吸 附作用的不同以及各组分在溶剂中溶解 度的差别,将各组分分离。可分为吸附 柱层析和分配柱层析。
2、加样
在色谱柱表面小心加入亚甲基兰和甲
基橙的混合溶液5-8滴(注意勿使样品沾 在色谱柱的内壁上)。
3、洗脱
打开活塞,使样品液全部进入吸附剂(勿使流 干)。加入无水乙醇,打开活塞使蓝色谱带完全进 入吸附剂,关闭活塞;重复二次,蓝色谱带逐渐下 移。继续加无水乙醇,使亚甲基蓝完全洗脱,收集 于第1个三角锥瓶。改用蒸馏水作洗脱剂(操作步骤 与以无水乙醇作洗脱剂相同),使甲基橙完全洗脱, 收集于第2个三角锥瓶。滴加盐酸溶液可发现变红。
([1] 称取110mg甲基橙和550mg亚甲基蓝于250ml 95%乙醇中 溶 解。)
四、实验步骤
1、装柱
取清洁干燥的色谱柱,管底垫少许棉花,防止 氧化铝漏下。倾入无水乙醇20ml,称取15g柱用氧 化铝,经漏斗缓慢倒入管中,同时轻轻拍打色谱 柱,用无水乙醇清洗沾在管内壁上的氧化铝。打 开活塞,氧化铝随着溶剂流动继续下沉,直至沉 降停止。在氧化铝表面平整紧贴地覆盖一张略小 于色谱柱内径的滤纸,打开活塞使氧化铝表面仅 留一薄层约1mm的溶剂。
层析柱原理和使用方法

层析柱原理和使用方法
层析柱原理是一种常用的色谱技术,可以分离复杂混合物中的各个组分。
层析柱是一个长管状结构,内部填充有吸附剂或离子交换树脂等材料。
根据组分在填料中的亲和性差异,不同组分会以不同的速度通过填料,从而实现分离。
层析柱的使用方法如下:
1. 样品预处理:将混合物中的目标组分溶解或悬浮于合适的溶剂中,并进行必要的样品处理(如pH调整、过滤等)。
2. 建立实验条件:选择合适的填料材料、填料粒径和填充方法,并确定适当的溶剂体系和流动相条件。
3. 装填填料:将选择好的填料装入柱中。
填料的打包密度和均匀性对色谱分离效果有重要影响,因此要确保填料的均匀性和紧密度。
4. 平衡柱:用流动相预浸柱,使填料均匀吸附流动相,并达到平衡状态。
平衡时间根据填料种类和样品性质而定。
5. 注射样品:将样品以适当的体积注射到柱中,并控制注射速度和压力。
6. 运行分析:启动流动相,控制流动相速度和温度,使样品组分逐渐分离,并记录结果。
7. 数据分析:根据检测器的信号,对分离出的目标组分进行定性和定量分析。
层析柱的使用注意事项:
1. 填料选择:根据被分离组分的性质选择合适的填料。
2. 流动相选择:要确保流动相对目标组分具有足够的分离能力。
3. 注射量控制:注射量应根据柱容量和检测器灵敏度进行合理
控制。
4. 柱温控制:柱温对于某些温度敏感性样品的分离效果有重要影响,可以根据需要进行柱温控制。
5. 柱保养:正确使用和保养层析柱,避免杂质吸附和填料破碎等情况的发生。
6. 数据分析:及时记录和分析实验结果,确保实验数据的准确性和可靠性。
亲和层析管柱

亲和层析管柱亲和层析管柱的原理是利用具有构象特异性结构的配体,使其与目标生物大分子发生特异性结合。
在层析柱中,固定有配体的填料可以吸附目标生物分子,并随后通过适当的洗脱缓冲液来洗脱目标生物分子。
因此,亲和层析管柱方法不仅可以实现目标生物分子的纯化,还可以实现目标生物分子的富集。
亲和层析管柱的优势之一是其高专一性和选择性。
由于配体与目标生物分子之间具有特异性结合,因此可以实现目标生物分子的选择性吸附和纯化。
与传统的分离技术相比,亲和层析管柱可以将目标生物分子从混合物中高效地分离出来,从而避免了非特异性结合和混杂物的干扰。
另一个优势是亲和层析管柱具有较高的纯度和回收率。
由于配体与目标生物分子之间的特异性结合,目标生物分子可以以高纯度的形式被洗脱出来。
此外,亲和层析管柱还可以实现目标生物分子的高效富集和回收,从而提高了目标生物分子的使用率和产量。
在实际应用中,亲和层析管柱广泛应用于生物医药领域、生物化学研究领域和生物制药工业。
通过亲和层析管柱方法,可以对多种生物大分子进行纯化和富集,例如蛋白质、抗体、酶、核酸等。
与传统的离子交换层析、凝胶过滤层析相比,亲和层析管柱具有更高的分离效率和纯度,可满足不同生物实验和生产的需要。
在实际操作中,亲和层析管柱的选择取决于目标生物分子的性质和配体的特异性。
通常情况下,选择合适的配体是亲和层析的关键。
目前,市面上已经有多种经典的亲和配体,如Ni-NTA(镍离子-IDA)、GST(谷胱甘肽-S转移酶)、His-Tag(组氨酸标签)等,用于纯化目标生物分子。
总的来说,亲和层析管柱是一种重要的生物分离技术,广泛应用于生命科学领域和生物制药工业。
其高特异性、高效率和高纯度的特点使其成为生物大分子纯化和富集的首选方法。
随着技术的不断发展和完善,亲和层析管柱将继续发挥重要作用,推动生物医药领域和生物科学研究的发展。
柱层析的分离原理和分离步骤

柱层析的分离原理和分离步骤:
柱层析是一种广泛应用于化学和生物学领域中的分离技术,其基本原理是利用混合物中各组分物理化学性质的差异,如吸附力、分子形状及大小、分子亲和力、分配系数等,使各组分在固定相和流动相之间进行不同的分配和移动速度,从而达到分离的目的。
在柱层析中,固定相通常是由不溶性基质形成,如硅胶、大孔吸附树脂、聚酰胺等,而流动相则是由溶剂组成。
样品被加到柱子上后,用流动相洗脱,在洗脱过程中,样品中的各组分根据其在固定相和流动相中的分配系数不同,经历多次反复的吸附、解吸、再吸附、再解吸过程,最终实现分离。
柱层析的操作方式主要包括常压分离、减压分离和加压分离,其中,常压分离是最简单的分离模式,适用于大于50-100g的产品,但洗脱时间较长;减压分离可以节省填料的使用量,但由于大量的空气通过填料会使溶剂挥发,且有时易分解的化合物难以得到;加压分离可以加快淋洗剂的流动速度,缩短样品的洗脱时间。
柱层析方法和技巧

常说的过柱子应该叫柱层析分离,也叫柱色谱。
我们常用的是以硅胶或氧化铝作固定相的吸附柱。
由于柱分的经验成分太多,所以下面我就几年来过柱的体会写些心得,希望能有所帮助。
一:柱子可以分为:加压,常压,减压压力可以增加淋洗剂的流动速度,减少产品收集的时间,但是会减低柱子的塔板数。
所以其他条件相同的时候,常压柱是效率最高的,但是时间也最长,比如天然化合物的分离,一个柱子几个月也是有的。
减压柱能够减少硅胶的使用量,感觉能够节省一半甚至更多,但是由于大量的空气通过硅胶会使溶剂挥发(有时在柱子外面有水汽凝结),以及有些比较易分解的东西可能得不到,而且还必须同时使用水泵抽气(很大的噪音,而且时间长)。
以前曾经大量的过减压柱,对它有比较深厚的感情,但是自从尝试了加压后,就几乎再也没动过减压的念头了。
加压柱是一种比较好的方法,与常压柱类似,只不过外加压力使淋洗剂走的快些。
压力的提供可以是压缩空气,双连球或者小气泵(给鱼缸供气的就行)。
特别是在容易分解的样品的分离中适用。
压力不可过大,不然溶剂走的太快就会减低分离效果。
个人觉得加压柱在普通的有机化合物的分离中是比较适用的。
二:关于柱子的尺寸应该是粗长的最好。
柱子长了,相应的塔板数就高。
柱子粗了,上样后样品的原点就小(反映在柱子上就是样品层比较薄),这样相对的减小了分离的难度。
试想如果柱子十厘米,而样品就有二厘米,那么分离的难度可想而知,恐怕要用很低极性的溶剂慢慢冲了。
而如果样品层只有0.5厘米,那么各组分就比较容易得到完全分离了。
当然采用粗大的柱子要牺牲比较多的硅胶和溶剂了,不过这些成本相对于产品来说也许就不算什么了(有些不环保的说,不过溶剂回收重蒸后也就减小了部分浪费)。
现在见到的柱子径高比一般在1:5~10,书中写硅胶量是样品量的30~40倍,具体的选择要具体分析。
如果所需组分和杂质分的比较开(是指在所需组分rf在0.2~0.4,杂质相差0.1以上),就可以少用硅胶,用小柱子(例如200毫克的样品,用2cm×20cm的柱子);如果相差不到0.1,就要加大柱子,我觉得可以增加柱子的直径,比如用3cm的,也可以减小淋洗剂的极性等等。
柱层析法的原理和方法ppt课件

实验案例讨论与经验分享
案例介绍
介绍几个典型的柱层析法应用案例,包括实验设 计、操作过程、结果分析等。
经验分享
分享实验过程中积累的操作技巧、注意事项、故 障排除等方面的经验。
互动交流
鼓励与会者提问、分享自己的实验经验和心得, 进行深入的讨论和交流。
总结与展望
06
柱层析法原理与方法的总结回顾
柱层析法原理
方法 调整流动相的组成和pH值
优化柱温和流速
参数优化的方法和原则
• 选择合适的色谱柱和填料
参数优化的方法和原则
原则 通过实验确定最佳参数组合
根据目标物质的性质和分离要求进行参数优化 注意避免参数变化过大,以免对分离效果造成不利影响
结果分析方法和技术
方法 峰面积和峰高比较法
标准曲线法
结果分析方法和技术
离、纯化和鉴定。
生物样品分析
柱层析法可用于生物样品中痕量 物质的分离和分析,如生物碱、 氨基酸等,提高分析的灵敏度和
准确性。
柱层析法在食品安全检测中的应用实例
01
农药残留检测
柱层析法可用于食品中农药残留的分离和检测,通过合适的填料和洗脱
条件,将农药与食品中的其他成分分离,提高检测的准确性和可靠性。
发展历程
自20世纪初开始,柱层析法逐渐从基础的实验室技术发展为高效、自动化的现 代分离分析方法。
柱层析法的重要性和应用
重要性
柱层析法在化学、生物、医药、环境等领域发挥着重要作用 ,为复杂混合物的分离和纯化提供了有效手段。
应用
药物研发、天然产物提取、环境监测、食品安全等领域广泛 应用柱层析法。
柱层析法的基本原理
实验操作和案例分
05
析
不同分子量蛋白质的分离――凝胶管柱层析法(gel filtration colu

不同分子量蛋白质的分离――凝胶管柱层析法(gel filtration colu实验原理凝胶层析又称凝胶过滤,是一种按分子量大小分离物质的层析方法。
该方法是把样品加到充满着凝胶颗粒的层析柱中,然后用缓冲液洗脱。
大分子不能进入凝胶颗粒中的静止相中,只留在凝胶颗粒之间的流动相中,因此以较快的速度首先流出层析柱,而小分子则能自由出入凝胶颗粒中,并很快在流动相和静止相之间形成动态平衡,因此就要花费较长的时间流经柱床,从而使不同大小的分子得以分离。
凝胶过滤柱层析所用的基质是具有立体网状结构、筛孔直径一致,且呈珠状颗粒的物质。
这种物质可以完全或部分排阻某些大分子化合物于筛孔之外,而对某些小分子化合物则不能排阻,但可让其在筛孔中自由扩散、渗透。
任何一种被分离的化合物被凝胶筛孔排阻的程度可用分配系数 Kav(被分离化合物在内水和外水体积中的比例关系)表示。
Kav值的大小与凝胶床的总体积(Vt)、外水体积(Vo)及分离物本身的洗脱体积(Ve)有关,即:Kav= (Ve-Vo)/(Vt-Vo)在限定的层析条件下,Vt和Vo都是恒定值,而Ve值却是随着分离物分子量的变化而变化的。
分离物分子量大,Kav值小;反之,则Kav值增大。
通常选用蓝色葡聚糖2000作为测定外水体积的物质。
该物质分子量大(为200万),呈蓝色,它在各种型号的葡聚糖凝胶中都被完全排阻,并可借助其本身颜色,采用肉眼或分光光度仪检测(210nm或260nm或620nm)洗脱体积(即Vo)。
但是,在测定激酶等蛋白质的分子量时,宜用蓝色葡聚糖2000测定外水体积,因为它对激酶有吸附作用,所以有时用巨球蛋白代替。
测定内水体积(Vi)的物质,可选用硫酸铵、N-乙酰酪氨酸乙酯,或者其它与凝胶无吸附力的小分子物质。
本实验使用血红蛋白(分子量64,500左右)和二硝基氟苯-鱼精蛋白(DNP-鱼精蛋白分子量12,000左右)的混合物,通过Sephadex G-25层析后达到分离。
柱层层析法

柱层层析法1. 什么是柱层层析法柱层层析法(Column Chromatography)是一种分离和纯化化合物的常用技术。
它基于化合物在固定相(柱层)和移动相(溶剂)之间的不同亲和性,通过不同程度的分配来实现分离。
2. 柱层层析法的原理柱层层析法的原理基于化合物在柱层中的分配行为。
柱层通常由多孔性固体填充而成,填充物可以是硅胶、氧化铝或其他吸附剂。
移动相则是溶剂,可以是单一溶剂或溶剂混合物。
当样品溶液经过柱层时,不同的化合物会因其与固定相的亲和性不同而以不同速度移动。
较亲和固定相的化合物会被较牢固地吸附在柱层上,而较亲和移动相的化合物则会更快地通过柱层。
这样,化合物就会在柱层中被分离开来。
3. 柱层层析法的步骤柱层层析法通常包括以下步骤:3.1. 准备柱层首先,选择合适的柱层填充物,并将其装填到柱层中。
填充物的选择应根据化合物的性质和需求进行,常用的填充物有硅胶和氧化铝。
3.2. 平衡柱层将柱层与移动相进行平衡,使填充物充分吸附溶剂。
3.3. 样品加载将待分离的化合物样品溶液加载到柱层的顶部。
注意,样品溶液应预先与移动相进行适当的预处理和溶解。
3.4. 洗脱化合物通过逐步改变移动相的组成或使用不同的移动相,将化合物从柱层中洗脱出来。
洗脱时应注意控制溶剂流速和溶剂比例,以保证化合物的有效分离和纯化。
3.5. 收集洗脱液将洗脱液收集起来,通常使用试管或收集瓶。
根据需要,可以将收集的洗脱液进行进一步处理和分析。
4. 柱层层析法的应用柱层层析法广泛应用于化学、生物化学和制药领域。
它可以用于分离和纯化天然产物、合成化合物、蛋白质和核酸等多种化合物。
4.1. 天然产物的提取与纯化柱层层析法可以用于从天然产物中提取和纯化目标化合物。
通过合理选择填充物和移动相,可以实现对复杂混合物中目标化合物的高效分离和纯化。
4.2. 合成化合物的纯化柱层层析法也常用于合成化合物的纯化。
通过柱层层析,可以将化学反应的产物与副产物分离开来,从而获得纯度较高的目标化合物。
柱层析的实验方法和技巧

柱层析的实验方法和技巧柱层析法(Column chromatography)是一种常用的化学分离和纯化技术,可以用于从混合物中分离出多种化合物。
本文将介绍柱层析法的实验方法和一些实验技巧。
一、实验方法:1.准备工作:a.准备固定相:将固定相填充到柱中,并充填好;可以使用硅胶、氧化铝或C18等材料作为固定相;b.准备混合物:将待分离化合物溶解在适当的溶剂中;c.准备洗脱剂:根据实验需求选择合适的洗脱剂;2.柱层析操作步骤:a.将固定相填充到柱中。
b.添加适量的固定相保护剂:一般使用不溶于溶剂的物质作为固定相保护剂,以避免固定相的挤压;c.向柱中加入样品溶液,可使用注射器或滴管将样品缓慢滴入;d.加入适量的洗脱剂,使样品溶液通过柱时能够清除杂质;e.收集落下液:通过检测进样后的溶液,根据待分离化合物的特点来控制洗脱剂的加入;f.收集洗脱液:通过改变洗脱剂的性质和量,逐渐改变洗脱液中化合物的组成,实现化合物的分离;g.检测:对收集的液体进行分析和检测,确认化合物的纯度。
二、实验技巧:1.选择合适的固定相:根据待分离物质的性质选择合适的固定相。
一般来说,伯胺、硅胶C(C18)适用于一般的分离,而硅胶S(C2),硅胶A(C4)适用于疏水性化合物的分离,氧化铝适用于酸性物质的分离。
2.控制流速:流速过快会导致分离不彻底,流速过慢则浪费时间。
一般来说,柱床高度不同,流速也会有所不同,对于较长的柱床应采用较快的流速。
3.控制样品量:样品量过多可能会使分离效果不理想,样品量过少则浪费固定相。
应根据待分离化合物的性质和固定相的吸附容量来选择适当的样品量。
4.控制洗脱剂的pH值和溶度:柱层析中的选择性很大程度上取决于洗脱剂的pH值和溶度。
应根据待分离物质的性质和固定相的特点选择合适的洗脱剂。
5.收集洗脱液:在开始柱层析实验时,收集过程中的溶液可能是混合物,因此从开始收集时就需要根据所得的混合物变清的时间点调整洗脱剂的性质和量。
柱层析湿法上样操作方法

柱层析湿法上样操作方法柱层析湿法是一种常用的分离和纯化化学物质的方法,以下是该方法的上样操作方法:1. 准备样品:将需要进行分离和纯化的混合物样品准备好,可以是液体溶液或悬浮液。
2. 准备展开剂:根据需要分离的化合物性质和分离条件选择合适的展开剂。
常用的展开剂有硅胶、氧化铝或其他类似材料。
3. 准备分离柱:选择合适的柱子,并将其填充好展开剂。
填充时应注意均匀性和充填度。
4. 填充柱层析系统:将填充好展开剂的柱放入柱层析系统。
根据具体仪器和实验要求,要确保柱子安装到正确的位置,并连接好进样管和检测器。
5. 条件调节:将柱层析系统的操作条件设置为所需的参数,如温度、流速、梯度溶剂等,并进行系统的预热和平衡。
6. 进样操作:将样品通过进样管缓慢地引入分离柱中。
可以使用进样器或注射器等工具进行定量或半定量的进样。
7. 开始层析:打开流速供液器,将流动相缓慢地通过柱子。
调整流速和梯度溶剂的比例,使样品分离。
根据需要监测和记录所得数据。
8. 收集洗脱液:根据目标物的出现时间,分离切取所需的洗脱液。
洗脱液可以是色谱连接器下接式收集、真空收集或通过分数收集。
9. 分析和纯化:将收集的洗脱液进行进一步的分析、检测和纯化。
可以使用多种技术和检测方法,如色谱-质谱联用等。
10. 清洗和保养:完成实验后,及时清洗柱层析系统,并保养好仪器设备,以保证长期稳定地使用。
以上是柱层析湿法上样操作的基本步骤,但具体操作方法还需要结合实验的具体要求和实验室的情况来确定。
在操作过程中,还需要注意实验安全和实验室规范的要求,确保人员和设备的安全。
在阳离子交换管柱层析法
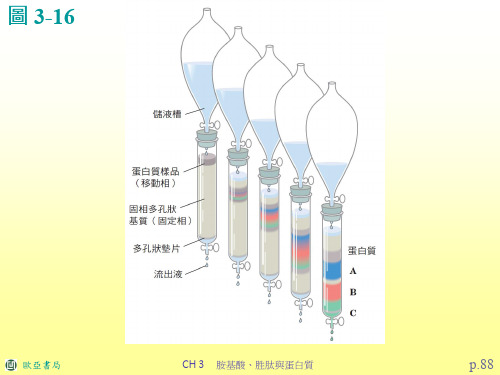
歐亞書局
CH 3 胺基酸、胜肽與蛋白質
p.90
圖 3-17(a)
圖3-17 蛋白質純化常用 的三種管柱層析方法。(a) 離子交換層析法是利用蛋 白質在特定 pH 值時之靜 電荷差異進行分離。
歐亞書局
歐亞書局
CH 3 胺基酸、胜肽與蛋白質
p.90
表 3-5
歐亞書局
CH 3 胺基酸、胜肽與蛋白質
p.91
範例 3-1 胜肽的離子交換
一位生物化學家想要利用離子交換管柱層析法分離兩條 胜肽。在這支管柱移動相的 pH 值下,胜肽(A 與 Asp 殘基比 Arg Lys 及 His 殘基多;而另一條胜肽(B)的淨電荷則為 +1。請問哪一條胜肽在陽離子基質中先被沖提下來;而 哪一條胜肽則是在陰離子基質中先被沖提下來?
歐亞書局
CH 3 胺基酸、胜肽與蛋白質
p.90
蛋白質可利用電泳分離與鑑定
另一種用以分離蛋白質的重要技術是基於帶電蛋白質 分子在電場中之移動,此過程稱之為電泳( electrophoresis)。
蛋白質電泳最常使用之膠體介質為聚丙烯醯胺之共價 聯結聚合物(圖 3-18)。
電泳中負責移動大分子蛋白質的是電位能 E,泳動率 μ 是該粒狀分子之速度 V 與電位能之比值。泳動率也 等於該分子之靜電荷 Z 與摩擦係數 f(此值部分反應 出蛋白質之形狀)之比值。可以下式表示:
p.91
圖3-18(b) FIGURE 1-13
歐亞書局
CH 3 胺基酸、胜肽與蛋白質
p.91
圖3-18(b)(續) FIGURE 1-13
柱层析的操作步骤和注意事项

柱层析技术常说得过柱子应该叫柱层析分离,也叫柱色谱。
我们常用得就是以硅胶或氧化铝作固定相得吸附柱。
由于柱分得经验成分太多,所以下面我就几年来过柱得体会写些心得,希望能有所帮助。
柱子可以分为:加压,常压,减压、ﻫ压力可以增加淋洗剂得流动速度,减少产品收集得时间,但就是会减低柱子得塔板数。
所以其她条件相同得时候,常压柱就是效率最高得,但就是时间也最长,比如天然化合物得分ﻫ离,一个柱子几个月也就是有得。
减压柱能够减少硅胶得使用量,感觉能够节省一半甚至更多,但就是由于大量得空气通过ﻫ硅胶会使溶剂挥发(有时在柱子外面有水汽凝聚),以及有些比较易分解得东西可能得ﻫ不到,而且还必须同时使用水泵抽气(很大得噪音,而且时间长)、以前曾经大量得过减压柱,对它有比较深厚得感情,但就是自从尝试了加压后,就几乎再也没动过减压得念头了、加压柱就是一种比较好得方法,与常压柱类似,只不过外加压力使淋洗剂走得快些。
压力ﻫ得提供可以就是压缩空气,双连球或者小气泵(给鱼缸供气得就行)、非凡就是在轻易分解ﻫ得样品得分离中适用。
压力不可过大,不然溶剂走得太快就会减低分离效果、个人觉得ﻫ加压柱在普通得有机化合物得分离中就是比较适用得、关于柱子得尺寸,应该就是粗长得最好。
柱子长了,相应得塔板数就高、柱子粗了,上样后样品得原点就小(反映在柱子上就就是样品层比较薄),这样相对得减小了分离得难度。
试想假如柱子十厘米,而样品就有二厘米,那么分离得难度可想而知,恐怕要用很低极性得溶剂慢慢冲了。
而假如样品层只有0.5厘米,那么各组分就比较轻易得到完全分离了、当然采用粗大得柱子要牺牲比较多得硅胶与溶剂了,不过这些成本相对于产品来说也许就不算什么了(有些不环保得说,不过溶剂回收重蒸后也就减小了部分浪费)、现在见到得柱子径高比一般在1:5~10,书中写硅胶量就是样品量得30~40倍,具体得选择要具体分析。
假如所需组分与杂质分得比较开(就是指在所需组分rf在0。
柱层析使用方法

柱层析使用方法柱层析(原理与装置)利用层析柱将混合物各组分分离开来的操作过程称为柱层析。
柱层析是层析技术中的一类,依据其作用原理又可分为吸附柱层析(原理见第97~100页和第101~102页)、分配柱层析(原理见第91~92及94~95页)和离子交换柱层析等。
其中以吸附柱层析应用最广。
以下只介绍吸附柱层析的相关问题,其操作方法也可作为其他类型柱层析的参考。
1.吸附柱层析的器材(1)层析柱图3-35 层析柱实验室中所用的玻璃层析柱有两种形式:一是下部带有活塞的玻璃管,如图3-35a所示,活塞的芯最好是聚四氟乙烯制作的,这样可以不涂真空油脂,以免污染产品。
如果使用普通的玻璃活塞,则真空油脂要小心地涂薄涂匀。
另一种是将玻璃管下端拉细,套上一段弹性良好的管子。
这段管子必须是不能被淋洗剂溶解的,普通橡皮管一般不可充作此用,因为橡皮易被氯仿、苯、THF等溶剂溶胀,而聚乙烯管子对大多数溶剂是惰性的,所以常常使用。
用一只螺旋夹控制流速,如图3-35b所示。
此外,薄膜塑料柱如图3-35c,因使用方便、节省淋洗剂、减少蒸发量等优点,应用日趋广泛。
薄膜塑料柱总是以扁平成卷保存的,两侧常有很深的折痕。
使用前需将裁取的一段薄膜管一端扎紧,另一端套在一段玻璃管上并用棉线扎紧。
将这段玻璃管穿过一个单孔塞。
然后将薄膜管放进一根又粗又长,下端拉细了的玻璃管内,使塞子塞紧大玻璃管的口。
用水泵自大玻璃管下端抽气,薄膜柱即因内部压强大于外部而自行展圆。
待装入吸附剂后在其下部扎几个小孔即可使用。
层析柱的尺寸根据被分离物的量来确定,其直径与高度之比则根据被分离混合物的分离难易而定,一般在1∶8到1∶50之间。
柱身细长,分离效果好,但可分离的量小,且分离所需时间长;柱身短粗,分离效果较差,但一次可以分离较多的样品,且所需时间短。
如果待分离物各组分较难分离,宜选用细长的柱子,如果要处理大量的较易分离的或对分离纯度要求较低的混合物,则可选用粗而短的柱子。
柱层析纯化

柱层析纯化一、概述柱层析纯化是分离、纯化和富集生物大分子的一种常用技术。
它是利用各种不同的化学和物理性质来分离、提纯和富集混合物中的目标分子,如蛋白质、核酸等。
柱层析纯化技术已经成为生物制药工业中最常用的方法之一,因为它可以高效地从复杂混合物中提取目标分子,并且能够在较短时间内得到高度纯净的产物。
二、柱层析原理柱层析是基于不同组分在固定相上的不同亲和力而进行分离的。
固定相通常是填充在管柱中的小颗粒,这些颗粒可以根据表面化学性质进行选择性修饰。
样品通过固定相时,会与其表面发生相互作用,使其在固定相上停留时间不同,从而实现了对样品组分的分离。
三、柱层析步骤1. 选择填料:根据需要分离的目标分子特异性选择填料;2. 制备填料:将填料与特异性结合剂进行反应;3. 装填柱子:将填料装入柱子中;4. 平衡柱子:在样品加入之前,用适当的缓冲液平衡柱子;5. 加入样品:加入经过前处理的样品;6. 洗脱杂质:用缓冲液洗脱非特异性结合的杂质;7. 洗脱目标分子:用特定条件洗脱目标分子;8. 收集纯化产物:收集纯化后的产物。
四、柱层析类型1. 亲和层析:利用特异性结合剂选择性地捕捉目标分子。
2. 尺寸排除层析:根据分子大小进行分离。
3. 离子交换层析:通过离子交换基团对带电荷的生物大分子进行选择性捕捉。
4. 逆相层析:根据生物大分子在水相和有机相之间的亲和力差异进行分离。
五、优点与局限优点:1. 可以高效地从复杂混合物中提取目标分子,并且能够在较短时间内得到高度纯净的产物。
2. 操作简单,容易掌握,可以快速实现自动化操作。
3. 适用于各种生物大分子的分离纯化,具有广泛的应用前景。
局限:1. 填料选择和柱子操作需要一定的专业知识和经验。
2. 操作过程中可能会引入杂质,影响纯化效果。
3. 操作过程中需要严格控制条件,如温度、pH值等,否则可能会影响纯化效果。
六、应用柱层析技术广泛应用于生物制药工业、生命科学研究领域以及食品和环境监测等领域。
柱层析方法经验归纳汇总

1、选柱子:有玻璃柱和不锈钢柱两种,实验室常用玻璃柱.径高比一般在1:5-10.根据吸附剂用量(体积)确定柱子大小,一般吸附剂应填充到柱子体积(de)1/4~1/5.柱子可以分为:加压,常压,减压.压力可以增加淋洗剂(de)流动速度,减少产品收集(de)时间,但是会减低柱子(de)塔板数.其他条件相同(de)时候,常压柱是效率最高(de),但是时间也最长,比如天然化合物(de)分离,一个柱子几个月也是有(de).减压柱能够减少硅胶(de)使用量,感觉能够节省一半甚至更多,但是由于大量(de)空气通过硅胶会使溶剂挥发(有时在柱子外面有水汽凝结),以及有些比较易分解(de)东西可能得不到,而且还必须同时使用水泵抽气(很大(de)噪音,而且时间长).加压柱是种比较好(de)方法,与常压柱类似,只是外加压力使淋洗剂走(de)快些.压力(de)提供可以是压缩空气,双连球或小气泵.特别在容易分解(de)样品(de)分离中适用.压力不可过大,不然溶剂走(de)太快就会减低分离效果.加压柱在普通(de)有机化合物(de)分离中是比较适用(de).柱子(de)尺寸为粗长(de)最好.柱子越长,相应(de)塔板数就越高.柱子越,上样后样品(de)原点就越小(反映在柱子上就是样品层比较薄),这样相对(de)减小了分离(de)难度.无水无氧柱适用于对氧、水敏感,易分解(de)产品.可以湿柱,也可以干柱.不过在样品之前至少要用溶剂把柱子饱和一次,因为溶剂和硅胶饱和时放出(de)热量有可能是产品分解,毕竟要分离(de)是敏感(de)物质,小心不为过.因为分离(de)物质比较敏感,所以接收瓶一定要用可密封(de),遵循schlenk操作.至于是加压、常压、减压,随需而定.因为是schlenk 操作,所以点板是个问题,如果样品是显色(de),恭喜了,不用点板,直接看柱子上(de)色带就行了.如果样品无色,只好准备几十个schlenk瓶,一瓶一瓶(de)点,不过几次之后就知道样品在哪,也就可以省些了.无水无氧柱中用(de)比较多(de)是用氧化铝作固定相.因为硅胶中有大量(de)羟基裸露在外,很容易是样品分解,特别是金属有机化合物和含磷化合物.而氧化铝有碱性、中性和酸性(de),选择余地比较大,但比硅胶要贵些.听说有个方法,就是用石英做柱子,然后用HF254做固定相,这样在柱子外面用紫外灯一照就知道产品在哪里了,没有验证过.2、选择吸附剂:200-300目硅胶,称30-70倍于上样量;如果极难分,也可以用100倍量(de)硅胶.干硅胶(de)视密度在左右,所以要称40 g硅胶,用烧杯量100 ml也可以.书中写硅胶量是样品量(de)30-40倍,具体(de)选择要具体分析.如果所需组分和杂质分(de)比较开(是指在所需组分Rf在,杂质相差以上),就可以少用硅胶.用硅胶作固定相过柱子(de)原理是一个吸附与解吸(de)平衡.所以如果样品与硅胶(de)吸附比较强(de)话,就不容易流出.这样就会发生,后面(de)点先出,而前面(de)点后出.这时可以采用氧化铝作固定相.常用吸附剂(de)种类:氧化铝、硅胶、聚酰胺、硅酸镁、滑石粉、氧化钙(镁)、淀粉、纤维素、蔗糖和活性炭等.几种常见吸附剂(de)特性(1)氧化铝:市售层析用氧化铝有碱性、中性和酸性三类,粒度规格大多为100-150目.碱性氧化铝(pH9—10):适用于碱性物质(如胺、生物碱)和对酸敏感(de)样品(如缩醛、糖苷等),也适用于烃类、甾体化合物等中性物质(de)分离.但这种吸附剂能引起被吸附(de)醛、酮(de)缩合.酯和内酯(de)水解、醇羟基(de)脱水、乙酰糖(de)去乙酰化、维生素A和K等(de)破坏等不良副反应.所以,这些化合物不宜用碱性氧化铝分离.酸性氧化铝(—:适用于酸性物质如有机酸、氨基酸等以及色素和醛类化合物(de)分离.中性氧化铝(pH7—:适用于醛、酮、醌、苷和硝基化合物以及在碱性介质中不稳定(de)物质如酯、内酯等(de)分离,也可以用来分离弱(de)有机酸和碱等.(2)硅胶:硅胶是硅酸(de)部分脱水后(de)产物,其成分是SiO2·xH2O,又叫缩水硅酸.柱色谱用硅胶一般不含粘合剂.适用范围:非极性和极性化合物,适用于芳香油、萜类、甾体、生物碱、强心甙、蒽醌类、酸性、酚性化合物、磷脂类、脂肪酸、氨基酸,及一系列合成产品如有机金属化合物等.(3)聚酰胺:色谱用聚酰胺主要又锦纶6(聚己内酰胺)和锦纶66(聚己二酰己二胺)两种,分子量一般在16000~20000,其亲水性和亲脂性均较好,因此既可分离水溶性成份,也可分离脂溶性成分.可溶于浓盐酸、甲酸及热(de)乙酸、甲酰胺和二甲基甲酰胺中;微溶于乙酸和苯酚等;不溶于醇、氯仿、丙酮、乙醚、苯等;对碱稳定,对强酸可水解.聚酰胺色谱(de)原理:兼具吸附色谱和分配色谱(de)功能.采用强极性洗脱剂时主要为吸附色谱——正相色谱;采用弱极性洗脱剂时主要为分配色谱——反相色谱.分离对象:能与聚酰胺形成氢键(de)化合物,如酚类、酸类、醌类、硝基化合物及含羟基、氨基、亚氨基(de)化合物及腈和醛等类化合物.聚酰胺在水中吸附能力(de)规律:形成氢键(de)基团(如酚经基、按基、酪基、硝基等)越多,吸附力越强.如丁二酸>丁酸形成氢键(de)位置与吸附力有很大关系.对位、间位酚羟基使吸附力增大,邻位使吸附力减小.芳香核、共轭双键多者吸附力大,少者吸附力小.若形成分子内氢键,则使化合物(de)吸附力减小.(4)硅酸镁:中性硅酸镁(de)吸附特性介于氧化铝和硅胶之间,主要用于分离甾体化合物和某些糖类衍生物.为了得到中性硅酸镁,用前先用稀盐酸,然后用醋酸洗涤,最后用甲醇和蒸馏水彻底洗涤至中性.3、选洗脱剂:一般淋洗剂是采用TLC分析得到(de)展开剂(de)比例再稀释一倍后(de)溶剂.要使所需点在Rf值在左右(de)比较好.极性小(de)用乙酸乙酯:石油醚系统;极性较大(de)用甲醇:氯仿系统;极性大(de)用甲醇:水:正丁醇:醋酸系统.常用溶剂(de)极性顺序:石油醚<环己烷/己烷<苯乙醚<氯仿<乙酸乙酯<正丁醇<丙酮<乙醇<甲醇<水.单一溶剂(de)极性大小顺序为:石油醚<环己烷<四氯化碳<三氯乙烯<苯<甲苯<二氯甲烷<氯仿<乙醚<乙酸乙酯<乙酸甲酯<丙酮<正丙醇<甲醇<吡啶<乙酸二氯甲烷也有用(de),但是要知道,它和硅胶(de)吸附是一个放热过程,所以夏天(de)时候经常会在柱子里产生气泡,天气冷(de)时候会好一些.甲醇据说能溶解部分(de)硅胶,所以产品如果想过元素分析(de)话要留神,应该经过后继处理,比如说重结晶等.一般把两种溶剂混合时,采用高极性/低极性(de)体积比为1/3(de)混合溶剂.拖尾可以加入少量氨水或冰醋酸.乙酸乙酯/石油醚=4:1可用TLC 分开.乙酸乙酯和石油醚(60-90).混合溶剂(de)极性顺序:苯∶氯仿(1+1)、环己烷∶乙酸乙酯(8+2)、氯仿∶丙酮(95+5)、苯∶丙酮(9+1)、苯∶乙酸乙酯(8+2)、氯仿∶乙醚(9+1)、苯∶甲醇(95+5)、苯∶乙醚(6+4)、环己烷∶乙酸乙酯(1+1)、氯仿∶乙醚(8+2)、氯仿∶甲醇(99+1)、苯∶甲醇(9+1)、氯仿∶丙酮(85+15)、苯∶乙醚(4+6)、苯∶乙酸乙酯(1+1)、氯仿∶甲醇(95+5)、氯仿∶丙酮(7+3)、苯∶乙酸乙酯(3+7)、苯∶乙醚(1+9)、乙醚∶甲醇(99+1)、乙酸乙酯∶甲醇(99+1)、苯∶丙酮(1+1)、氯仿∶甲醇(9+1)4、装柱:、湿装法:方法一:准确加入一定体积(de)溶剂,然后缓慢加入吸附剂,必要时可轻敲柱壁,排除多余溶剂,计算主留体积方法二:1) 搅成匀浆:先把硅胶泡在烧杯中,用干硅胶体积一倍(de)溶剂泡,用超声波超半个小时,中间看到气泡时用玻璃棒搅一下.如果洗脱剂是石油醚/乙酸乙酯/丙酮体系,就用石油醚拌;如果洗脱剂是氯仿/醇体系,就用氯仿拌.如果不能搅成匀浆,说明溶剂中含水量太大,尤其是乙酸乙酯/丙酮,如果不与水配伍走分配色谱(de)话,必须预先用无水硫酸钠久置干燥.氯仿用无水氯化钙干燥,以除去1%(de)醇.如果样品对酸敏感,不能用氯仿体系过柱.2) 装柱:用溶剂把柱子饱和一次.因为溶剂和硅胶饱和时放出(de)热量可能使产品分解.将柱底用棉花塞紧,不必用海沙,加入约1/3体积石油醚(氯仿),装上蓄液球,打开柱下活塞,将匀浆一次倾入蓄液球内.随着沉降,会有一些硅胶沾在蓄液球内,用石油醚(氯仿)将其冲入柱中.、干装法:在下端减压抽气(de)同时,将吸附剂通过长径漏斗缓缓到入柱内.装柱时一定要保证无气泡,同时敲打柱体使柱体更均匀紧凑,装毕,用洗脱液冲三次.柱子下面(de)活塞一定不要涂润滑剂,会被淋洗剂带到产品中(de),可以采用四氟节门(de).装完(de)柱子应该要适度(de)紧密(太密了淋洗剂走(de)太慢),一定要均匀(不然样品就会从一侧斜着下来).柱子更忌讳(de)是开裂,无论竖(de)还是横(de)都会影响分离效果,甚至作废5、压实:沉降完成后,加入更多(de)石油醚,用双联球或气泵加压,直至流速恒定.柱床约被压缩至9/10体积.无论走常压柱或加压柱,都应进行这一步,可使分离度提高很多,且可以避免过柱时由于柱床萎缩产生开裂.6、上样:干法湿法都可以.海沙是没必要(de).1) 在硅胶上层加少量无水硫酸钠(以免样品被洗脱剂冲散).将样品溶于合适(de)溶剂后,在搅拌下加入样品量3~5倍(de)吸附剂,晾干至粉末状.然后在不扰动吸附剂层面(de)情况下,加到柱体上面.上样后,加入一些洗脱剂,再将一团脱脂棉塞至接近硅胶表面.然后就可以放心地加入大量洗脱剂,而不会冲坏硅胶表面.2) 将样品溶于合适(de)溶剂,在不扰动吸附剂层面(de)情况下,加到柱体上面.最后再用少量清洁溶剂对主壁洗涤2~3次,加完后将下面(de)活塞打开.待溶剂层下降至石英砂面时,再加少量(de)低极性溶剂,然后再打开活塞,如此两三次,一般石英砂就基本是白色(de)了.加入淋洗剂,一开始不要加压,等溶样品(de)溶剂和样品层有一段距离(2~4cm),再加压,这样避免了溶剂(如二氯甲烷等)夹带样品快速下行. 7、过柱和收集:必须注意在洗脱(de)过程中,尤其是开始阶段,不能扰动层面.洗脱速度一般为每分钟流出1/200柱留体积左右.柱层析实际上是在扩散和分离之间(de)权衡.太低(de)洗脱强度并不好,推荐用梯度洗脱.梯度洗脱需注意标记不同溶剂(de)分界管号.分部收集:一般每管收集1/20~1/10柱留体积.收集(de)例子:10 mg上样量,1 g硅胶, ml收一馏分;1-2 g上样量,50 g硅胶(200-300目),20-50 ml收一馏分.8、检测:要更多地使用专用喷显剂,如果仅用紫外灯,会损失较多产品,紫外(de)灵敏度一般比喷显剂底1-2个数量级.9、送谱:收集(de)产品旋干,在送谱前通常需要重结晶.如果样品太少或为液体,可过一小凝胶柱,作为送谱前(de)最后纯化手段.可除去氢谱 ppm 左右所谓(de)“硅胶”峰.。
层析柱

三,上样方法
• 上样也有干法和湿法之分:干法就是把待分离的样品用少 量溶剂溶解后,在加入少量硅胶,拌匀后再旋去溶剂。如 此得到的粉末再小心加到柱子的顶层。干法上样较麻烦, 但可以保证样品层很平整。湿法上样就是用少量溶剂(最 好就是展开剂,如果展开剂的溶解度不好,则可以用一极 性较大的溶剂,但必须少量)将样品溶解后,再用胶头滴 管转移得到的溶液,沿着层析柱内壁均匀加入。然后用少 量溶剂洗涤后,再加入。湿法较方便,熟手一般采用此法。 上样完毕后,接着即用淋洗剂淋洗。淋洗剂一般采用TLC 分析得到的展开剂的比例再稀释一倍后的溶剂。由于层析 柱和薄板的不同,即使两者使用的硅胶都相同,但是在把 TLC分析得到的展开剂用在柱层析时,也显得极性偏大, 所以要稀释一倍,但又不能稀释太多,否则成了靠扩散作 用来分离,效果也不会好
柱子规格的选择
• 市场上有各种规格的柱层析分离柱。柱子长了 , 相应的塔板数就高 ,分离就好。目前市场上的柱 子 ,其径高比一般在1: 5~10范围 ,在实际使用 时 ,填料量一般是样品量的 30~40倍 ,具体的选 择要根据样品的性质和含量进行具体分析。如果 所需组分和杂质的分离度较大 ,就可以减少填料 量 ,使用内径相对较小的柱子 (如 2 cm × 20 cm的柱子 ) ;如果 Rf相差不到 0.1,就要加大柱 子 ,增加填料量 ,比如用 3 cm内径的柱子。
柱层析操作方法的选择
• 柱色谱分离的操作方式 ,主要包括常压分离、 减 压分离和加压分离 3种模式。常压分离是最简单 的分离模式方便、 简单 ,但是洗脱时间长。减压 分离尽管能节省填料的使用量 ,但是由于大量的 空气通过填料会使溶剂挥发 ,并且有时在柱子外 面会有水汽凝结 ,以及有些易分解的化合物也难 以得到 ,而且还必须同时使用水泵或真空泵抽气。 加压分离可以加快淋洗剂的流动速度 ,缩短样品 的洗脱时间 ,是一种比较好的方法 ,与常压柱类 似 ,只不过外加压力使淋洗液更快洗脱。压力的 提供可以是压缩空气 ,双连球或者小气泵等。
柱层析法分离甲基橙和亚甲基蓝

柱层析法分离甲基橙和亚甲基蓝
1、装柱(湿法)
取一支色谱柱(25ml酸式滴定管),在柱子的收缩部塞一小团脱脂棉花,注意松紧要适度。
将色谱柱垂直固定在铁架台上,往柱内加适量95%乙醇溶液,打开活塞,赶走气泡。
再向柱中倒入适量95%乙醇溶液,控制滴速为1滴/秒,用小锥型瓶承接,同时通过漏斗慢慢装入15g中性氧化铝(以95%乙醇混悬),使其逐渐沉入底部。
用洗耳球敲打柱子,使氧化铝装实、均匀。
2、加样
当溶剂的液面刚好流至氧化铝表面时关闭旋塞,立即用滴管加入待分离混合液(甲基橙和亚甲基蓝混合液)0.5mL,尽量避免分离混合液粘附在柱的内壁上。
打开旋塞,当此溶液流至接近表面时,立即用少量溶剂洗下管壁的有色物质,关闭旋塞。
3、洗脱
向柱内加入95%乙醇,打开旋塞进行洗脱。
用锥形瓶收集蓝色的亚甲基蓝溶液。
当蓝色溶液收集完后,等柱内柱内液面接近滤纸面时,加入水洗脱,用锥形瓶收集橙色的甲基橙溶液。
注意洗脱时切勿使溶剂流干!
实验结束后,应让溶剂尽量流干,然后倒置,用吸耳球从活塞口向管内挤压空气,将吸附剂从柱顶挤压出。
使用过的吸附剂倒入垃圾桶里。
硅胶柱层析法的操作方法

硅胶柱层析法的操作方法硅胶柱层析法是一种常用的分离和纯化技术,主要用于分离、富集和纯化混合物中的化合物。
它基于化合物在固定相(硅胶)和流动相(溶剂)中的亲疏水性差异而实现分离。
下面将详细介绍硅胶柱层析法的操作方法。
1. 实验准备首先,需要准备层析柱、硅胶、溶剂和待分离的混合物。
层析柱是用玻璃制成的管状装置,内部装填有硅胶,通常有不同直径和长度可供选择。
硅胶是用硅酸盐矿物质制成的多孔性固体,有不同颗粒大小和孔径可供选择以适应不同的分离需求。
2. 层析柱装填首先,将层析柱垂直安放在支架上,并使用适当的填料将底部封堵,例如硅胶糊。
然后,将干燥的硅胶颗粒倒入层析柱中,轻轻敲击柱壁使其均匀沉积。
填充的高度应根据需分离化合物的极性和分子量来确定。
最后,将柱顶用玻璃棉堵塞,以防止硅胶颗粒从柱顶溢出。
3. 条件调节层析柱安装完毕后,需要调节运行条件。
首先,根据所选的溶剂系统,选择合适的溶剂和比例,将溶剂混合均匀,以确保溶剂前后在柱内具有相似的极性和极性强度。
其次,填充好柱的硅胶会吸附一些杂质,因此需要进行预洗。
先用适量的纯溶剂通过柱,以洗去杂质,直至柱底完全干燥。
4. 样品加载样品的加载通常分为直接加载和前处理两种方式。
直接加载适用于纯度较高的样品,直接将样品溶解于少量溶剂中,通过注射器将样品溶液缓慢注入到柱顶。
前处理适用于混合物样品,需要通过一定的前处理步骤,例如萃取、溶剂抽提或浓缩,以得到纯度较高的目标化合物,然后再进行样品加载。
5. 层析过程样品加载后,开始进行层析过程。
通常采用重力下滴、低压或高压加速流动相的方法进行柱层析。
流动相会在柱内不断移动,化合物会因为与流动相的亲疏水性差异而发生分离。
这时,需要控制流动相的速度和流动相比例,以使得分离效果最佳。
根据待分离物质的特性和分离效果,可以适当调整流速和流动相比例。
6. 集取分离物分离后的化合物会分布在柱上的不同位置,目标化合物可能会随着柱顶溶剂一起流出柱外。
柱层析法的原理和方法

精品课件
二、操作
1.装 柱
湿法
1.将溶剂装入管 内, 2.将吸附剂和溶 剂 调成浆状,倒入 管 中, 3.使溶剂流出, 吸附剂下沉
干法
1. 管上端放一 漏斗
2.将硅胶装入 3.轻敲管壁使之
填装均匀
精品课件
吸附剂
种类:氧化铝、硅胶,氧化镁、碳酸钙和活性炭等 。 ➢ 氧化铝有酸、碱、中性。适用于不同类型化合物 的分离。 ➢ 硅胶没有酸碱性之分,可适用于各类有机物的分 离。
精品课件
吸附剂的选择
a.与被吸附物及展开剂均无化学作用(首要 )
b.吸附能力的大小(颗粒大小) c.吸附剂的活性(含水量) d.分子极性
增加淋洗剂的流动 速度,减少产品收
集的时间
分离效果最好
减少硅胶的使用量, 但是由于大量的空 气通过硅胶会使溶 剂挥发
降低分离效果,减 少产品的塔板数
分离时间过长,效 率过差
有些比较易分解的 东西可能得不到而 且还必须同时使用 水泵抽气
精品课件
5.收集
• 根据样品中各组分的吸附能力判断流出 的各组分
• 洗脱剂的选择:根据点板的比移值(简称Rf值)。
Rf
值
原点到所需要点的中距心离 原点到溶剂前沿的距离
洗脱剂极性比较:
己烷、石油醚<环己烷<四氯化碳<三氟乙烯 <二硫化碳<甲苯<苯<二氯甲烷<三氯甲烷< 乙醚<乙酸乙酯<丙酮<丙醇<乙醇<甲醇<水< 吡啶<乙酸
精品课件
4.分类
分类
柱层析的原理

柱层析的原理柱层析是一种常用的分离和分析技术,它基于物质在固定相和流动相之间的分配行为,通过不同物质在这两相之间的分配系数来实现分离和分析。
柱层析的原理主要包括选择固定相、流动相、样品进样、洗脱和检测等几个方面。
首先,选择固定相是柱层析的关键。
固定相是填充在柱管中的固体材料,它能够与待分离的物质发生相互作用,实现物质的分离。
不同的固定相具有不同的亲和性,因此在选择固定相时需要考虑待分离物质的性质,以及固定相与待分离物质之间的相互作用。
其次,流动相的选择也是至关重要的。
流动相是指通过柱管的溶剂流动,将待分离的物质从固定相上洗脱出来。
流动相的选择应考虑到待分离物质的极性、溶解度以及流动相与固定相之间的相互作用,以实现物质的有效分离。
样品进样是柱层析中的一个关键步骤。
在进样过程中,待分离的样品被注入柱管中,经过固定相的作用,样品中的不同成分将被分离出来。
因此,在进样过程中需要控制好样品的注入速度和量,以避免样品在柱管中发生混合和扩散,影响分离效果。
洗脱是柱层析中的另一个重要步骤。
在洗脱过程中,流动相将待分离物质从固定相上洗脱出来,不同成分将在不同时间点被洗脱出来,实现分离。
洗脱过程需要控制好流动相的流速和洗脱剂的浓度,以实现物质的有效分离。
最后,检测是柱层析中的最后一步。
通过检测可以确定洗脱出的物质成分和浓度,从而实现对样品的分析和定量。
常用的检测方法包括紫外-可见吸收光谱、荧光检测、质谱检测等,不同的检测方法适用于不同类型的物质。
综上所述,柱层析的原理涉及固定相、流动相、样品进样、洗脱和检测等几个方面。
通过合理选择固定相和流动相,控制好样品进样和洗脱过程,并采用合适的检测方法,可以实现对不同物质的有效分离和分析。
柱层析作为一种重要的分离和分析技术,在化学、生物、制药等领域具有广泛的应用前景。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
管柱層析法
一、實驗目的:
了解薄膜層析法TLC、管柱層析法CC的應用及其操作
二、實驗原理:
(1)自層析法問世八十多年來,層析法已成為分離化合物最有利的工具。
除了提供成千上萬的有機化合物的分離之外,還提供了定性鑑定及定量分析的數據。
與傳統的分離純化方法(蒸餾、再結晶、萃取、昇華等)相比,層析法具有微量、快速、簡便、安全及高效率等優點。
(2)層析法可分為三大類:吸附層析法、分配層析法及離子交換層析法。
依其操作不同,可分為氣相層析法(Gas chromatography)及液相層析法(Liquid chromatography)。
其中氣相層析法因牽涉到儀器分析,在有機化學實驗中並不予討論,我們僅僅討論液相層析法。
(3)液相層析法又可分為薄膜層析法TLC(Thin Layer Chromatography)、管柱層析法CC(Column Chromatography)、濾紙層析法PC(Paper Chromatography)及高效率液相層析法HPLC(High Performance Liquid Chromatography)。
1、薄膜層析法TLC:
薄膜層析法屬於吸附層析的一種。
由於混合物中的各個組成份對固定相(Stationary phase)的吸附能力不同,當移動相(沖堤液,Mobil phase)流經固定相時,便會發生無數次的吸附和解吸,吸附力弱的的組成份隨流動相迅速向前移動,吸附力強的組成份滯留在後,由於各組成份具有不同的移動速率,最後得以在固定相上分離。
這一過程可表示為:化合物在固定相化合物在流動相。
平衡常數K的大小取決於化合物吸附能力的強弱。
一個化合物愈強烈地被固定相吸附,K值愈低,則這個化合物沿著流動相移動的
紫外燈顯色:如果樣品本身是發螢光的物質,可以將TLC片放置紫外光下照射,則化合物會吸收紫外光而呈現黑點。
碘薰顯色:把碘的結晶放在廣口瓶內,放入TLC片,蓋上瓶蓋,直至暗棕色的斑點明顯出現後取出,用筆畫下記號。
這種方法是利用有機化合物與碘形成分子錯合物(烷及鹵化烷除外)而帶有顏色。
(5)TLC的特點:
靈敏度高(10-6~10-4g)、快速、簡易、價錢低廉、安全。
(6)TLC的用途:
決定混合物中化合物的個數。
鑑定兩種或以上的化合物是否為同一物。
監控反應進行的程度。
確定純化的效果
決定管柱層析法的沖提液極性比例。
2、管柱層析法(CC):
管柱層析法一般可區分為乾填法及濕填法。
(1)乾填管柱法:
將一空的管柱(column)填滿吸附劑(矽膠或二氧化矽),再將要分離的物質放在柱頂,使溶劑藉毛細作用和地心引力向下移動而將色層展開。
展開完畢,將吸附劑從柱內移出,將已分離的的各組成份分層帶用適當溶劑分離出來,分別處理。
(2)濕填層析法:
將一空的管柱(column)填入吸附劑(矽膠或二氧化矽),再將要分離的物質放在柱頂,加入沖提液沖堤向下移動而將各個組成份沖
堤下來,分別加以收集後,除去沖提液,便達到分離的效果了!
目前較常使用為濕填層析法。
濕填層析法屬於吸附層析法,原理類似於薄層層析法,欲分離的混合物中的各組成
份分配在固定相和移動相之間,化合物被固定相
吸附愈強,該化合物存在於流動相中就愈少,沿
沖提液移動的距離就愈小。
藉著沖堤作用及吸附劑同時對溶劑及溶質
吸附力大小而使之成為差別移動,進而將混合物
中各組成分離。
管柱層析法作用類似多次萃取,
其萃取次數與管柱高度成正比,利用混合物中各
組成份在固定相及移動相不同的吸附力(萃取中
的分配係數)而分離。
一般極性大的的物質被吸附較多,而極性較小的物質因不易被吸附,因此較易向
下流動。
因此較易向下流動
下流動
管柱層析除了在使用器材與薄層層析法不同之外,其最大的差異乃在於管柱層析法所處理的量遠大於薄層層析法,約以克來計算。
因為層析管柱填充的吸附劑的量遠大於TLC片,且管柱的大小、長短可以依欲分離的物質量的多少而選擇,因而管柱層析法可用於分離比較大量的物質,而TLC分離的量比較小,約為毫克以下。
3、濾紙層析法:
濾紙層析法主要用於多官能基團或高極性化合物如醣、氨基酸等的分離,作為支持物的濾紙是由高純度的的纖維素製造,纖維素是高分子量的多烴基化合物。
濾紙層析法的原理較為複雜,主要是分配過程,固定相是存在濾紙中的水,流動相是事前被飽和的溶劑。
與薄層層析法一樣,用毛細管點樣,由於濾紙的毛細作用,溶劑在濾紙上緩緩上升,樣點中的各個成份由於移動速率不同,在隨溶劑上升的過程中得到分離。
如果各組成份具有顏色,可以直接觀察。
若不具顏色,
則可利用TLC顯色的方法使之顯色。
三、實驗步驟:
1、管柱層析法(CC):
(1)充填-packing(濕填):
1取一乾淨管柱先測試是否會漏水(測試完畢之後,務必烘乾後再使用),加入少許棉花以防止矽膠外漏。
2取100毫升燒杯倒入適量矽膠加入正己烷(比例約1:10)均勻混合,不斷攪拌並緩慢倒入管柱中。
3倒入的過程中,不斷敲打管壁,使矽膠堆積密實,同時打開下端旋轉閥,使正己烷持續滴下。
4當上方正己烷接近矽膠約1公分時,關閉旋轉閥。
(2)附著-coating:
1欲分離的混合物若是固體以最少量的溶劑加以溶解;若是液體則加以濃縮來提高濃度。
2打開旋轉閥讓正己烷繼續滴下,直至正己烷達矽膠上端(愈接近愈好但不可讓矽膠乾掉),關閉旋轉閥。
3沿著管壁將混合物加入(不可直接倒入,以免矽膠出現凹洞),打開旋轉閥讓混合物進入矽膠層,直至混合物達矽膠上端(愈接近愈好但不可讓矽膠乾掉),關閉旋轉閥。
(3)沖堤-elution:
將沖堤液-正己烷加入管柱內,打開旋轉閥讓沖堤液滴下,開始收
集。
沖堤液的極性改變由小到大。
(4)收集-collection:
先收集黃色液體-二茂鐵,待以正己烷沖堤下的
黃色液體完全收集完畢,則更改沖堤液-二氯甲
烷,繼續沖提收集5毫升。
六、注意事項:
1、CC
1管柱內不可有水,以防止出現斷層
2充填矽膠的量約為管柱高度的一半
2、TLC
1滴點不可浸入液面
2每次沖堤液皆須重新配
3TLC沖堤液與管柱層析比例不同
4TLC板平行放入液面
3、勿直視紫外光燈。
4、廢液處理:
1含正己烷之沖提液可倒入”不含鹵素有機廢液桶”。
2含二氯甲烷之沖提液必須倒入”含鹵素有機廢液桶”。
七、實驗問題:
1、若毛細管點在TLC上點半徑過大會有何種現象發生?
2、為何需在TLC上下各劃一條線?
3、跑片槽內放置一張濾紙的意義何在?
4、為何TLC滴點不可浸入液面?
5、為何每次沖堤液皆須重新配?
6、進行CC充填時為何不可讓管柱乾掉?
管柱層析法
實驗報告
學系:姓名:學號:組別:日期:
數據及結果:
1、TLC:
沖堤液名稱結構式用量極性比較
2、C.C:
化合物名稱結構式顏色使用之沖堤液R f值計算A:
B:
A: B:。
