初三化学 常见的酸和碱
九年级化学常见的酸和碱

C、氧化镁
D、碳酸钙
现有白纸和几种溶液,有人用这些材 料设计了一个名为“雨落叶出红花开”的 趣味实验。实验的过程如下:先用洁净的 毛笔蘸 D A (填序号,下同)在白纸上 画上花,再用 C B 画上叶,将白纸挂 上墙壁,晾干后用B C 向纸上喷即成。 A、酚酞试液 B、石蕊试液 C、氢氧化钠溶液 D、稀盐酸
CO2+Ca(OH)2 — Ca(OH)2 + HCl—
学 性 质
酸
盐溶液 CuSO4+NaOH——
Na2CO3+Ca(OH)2——
二、氢氧化钠、氢氧化钙的性质的比较
氢氧化钠 氢氧化钙
俗称
物理 性质
指示 剂 非金 属氧 化 化物
火碱、烧碱、苛性钠
消石灰、熟石灰、石灰浆
1、白色块状固体, 1、白色粉末状固体, 2、易溶于水,放出热量, 2、微溶于水,水溶液俗称石灰水 3、易吸水而潮解,可以用作 3、也有腐蚀性 干燥剂 4、有腐蚀性
C:大理石
B:固体烧碱
D:浓硫酸
4、下列四种物质中,在一定条件下能与其
它三种物质发生反应的是( A: CuSO4
C)
B:CO2
C:NaOH
D:H2SO4
2NaOH + CuSO4 ===Cu(OH)2 ↓ + Na2SO4
2NaOH+ CO2=== Na2CO3 + H2O
2NaOH+H2SO4===Na2SO4+H2O
A )。
B、锌 D、氢氧化铜
下列四种物质中,能和其他三种物 质反应的是( A、盐酸 C、硫酸铜
D )。
B、二氧化碳 D、氢氧化钠
紫色石蕊
稀盐酸
初中化学人教第十单元 常见的酸和碱 知识点整理(全面,带答案)
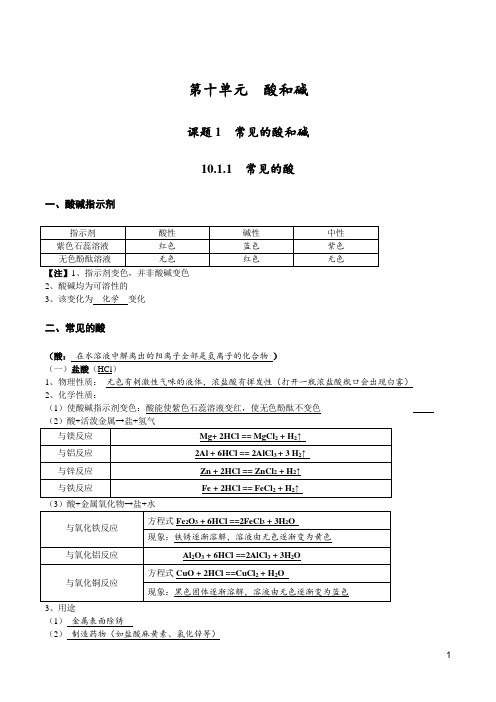
第十单元酸和碱课题1 常见的酸和碱10.1.1 常见的酸一、酸碱指示剂2、酸碱均为可溶性的3、该变化为化学变化二、常见的酸(酸:在水溶液中解离出的阳离子全部是氢离子的化合物)(一)盐酸(HCl)1、物理性质:无色有刺激性气味的液体,浓盐酸有挥发性(打开一瓶浓盐酸瓶口会出现白雾)2、化学性质:(1)使酸碱指示剂变色:酸能使紫色石蕊溶液变红,使无色酚酞不变色(1)金属表面除锈(2)制造药物(如盐酸麻黄素、氯化锌等)(3)人体胃液中的含有盐酸,可帮助消化(二)硫酸(H2SO4)1、浓硫酸(1)物理性质:无色粘稠油状液体,无气味,浓硫酸具有吸水性(2)化学性质:腐蚀性(3)浓硫酸的稀释:将浓硫酸沿着烧杯壁慢慢注入水中,并用玻璃棒不断搅拌(4)浓硫酸的事故处理:先用大量的水冲洗,再涂3%-5%的碳酸氢钠溶液。
2、稀硫酸的化学性质(1)使酸碱指示剂变色:酸能使紫色石蕊溶液变红,使无色酚酞不变色3、用途(1)用于生产化肥、农药、火药、燃料以及冶炼金属、精炼石油(2)金属除锈(3)汽车铅酸蓄电池中含有硫酸(4)浓硫酸在实验室常用作干燥剂三、酸的通性1、酸能与指示剂作用2、酸能与活泼金属反应3、酸能与金属氧化物反应4、酸能与碱反应5、酸能与盐反应注:酸溶液具有相似化学性质的原因:酸溶液中都含有H+四、复分解反应1、定义:两种化合物相互交换成分生成另外两种化合物的反应。
2、表达式:AB+CD=AD+CB3、反应前后各元素化合价不变(“变”或“不变”),属于基本反应类型。
4、10.1.2 常见的碱一、氢氧化钠(NaOH)1、俗称:烧碱、火碱、苛性钠2、物理性质:白色固体,易溶于水,溶解时放出大量的热。
3、化学性质(1)与酸碱指示剂反应:碱溶液能使紫色石蕊溶液变蓝,使无色酚酞变红、事故处理:先用大量的水冲洗,再涂上硼酸溶液5、制取:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (化学方程式)6、密封保存的原因:(1)NaOH固体容易吸收空气中的水分发生潮解。
《常见的酸和碱》说课稿

《常见的酸和碱》说课稿(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如工作总结、实习报告、合同协议、条据书信、职业规划、规章制度、心得体会、应急预案、教学资料、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of classic sample texts for everyone, such as work summaries, internship reports, contract agreements, document letters, career planning, rules and regulations, experiences, emergency plans, teaching materials, other sample texts, etc. If you want to learn about different sample formats and writing methods, please pay attention!《常见的酸和碱》说课稿《常见的酸和碱》说课稿(精选6篇)作为一名老师,时常需要用到说课稿,编写说课稿是提高业务素质的有效途径。
初三化学生活中的酸和碱

初三化学生活中的酸和碱学习目的:1.酸和碱的组成和分类2.酸碱中和反应原理和应用实战演练:一、常见的酸和碱3232434无氧酸:HCl、H2S、HI、HBr(氢某酸)一元酸:HCl、HNO3、HI、HBr二元酸:H2CO3、H2S、H2SO4三元酸:H3PO4了解酸的溶解性:我们常见的酸如盐酸、硫酸、碳酸、乙酸等,绝大多数酸都溶于水,但硅酸(H2SiO3)3、碱的组成【思考】写出所有知道的碱的化学式,归纳它们在组成上的共同之处,从碱的名称,归纳碱的命名方法。
氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化铜Cu(OH)2、氢氧化镁Mg(OH)2、氢氧化钡Ba(OH)24、碱的溶解性和酸不一样,大部分的碱是难溶于水的。
常见的可溶于水的碱有NaOH、Ca(OH)2、Ba(OH)2、NH3·H2O,其中Ca(OH)2是微溶的。
5、碱的颜色Cu(OH)2蓝色、Fe(OH)3红褐色、Mg(OH)2白色6、探究:固体氢氧化钠和氢氧化钙有什么区别?【实验】各取一小块固体氢氧化钠和氢氧化钙:(1)分别置于小烧杯中;(2)露置在空气中一段时间,观察它们的变化;(3)分别在小烧杯中加适量的水,搅拌滴加酚酞试液;(4)用温度计测量液体的温度。
【实验现象】(1)氢氧化钠是白色固体,氢氧化钙是白色粉末状固体。
(2)露置在空气中一段时间后,氢氧化钠表面形成一层溶液,氢氧化钙表面则无明显变化。
(3)加入适量水,氢氧化钠迅速溶解,氢氧化钙微溶于水,但它们均使酚酞试液变红色。
(4)插入氢氧化钠溶液的温度计,温度明显上升。
【解释和结论】氢氧化钠固体容易吸收空气中的水分,在表面形成一层溶液,这种物理现象称为“潮解”,而氢氧化钙没有潮解现象,氢氧化钠易溶于水且在溶解过程中放出大量热。
三、酸碱中和反应1、什么是中和反应?酸和碱反应,生成盐和水,这一类反应称为中和反应。
2、探究中和反应如果我们将无色的盐酸滴加到无色的氢氧化钠溶液中,理论上我们知道已发生了化学反应,但看不到任何现象。
九年级化学常见的酸和碱

氢氧化钾
白色结晶固体,易溶于水,具有强碱性。 在化工、医药、玻璃制造等领域有广泛应用。
氢氧化钡
无色透明的固体,易溶于水,具有强碱性。 在化工、医药等领域有广泛的应用。
04
酸和碱的反应及中和反应
酸和碱的反应
酸碱中和反应
氢离子和氢氧根离子结合生成水的过程。
酸碱中和反应的离子式
H⁺ + OH⁻ → H₂O。
盐酸盐酸是一种强酸,具有高电 离度和低pH值。它在水中完全电 离,并释放出氢离子和氯离子。 盐酸盐酸具有强烈的腐蚀性,可 以腐蚀许多金属和有机物质。
盐酸盐酸在许多工业和日常生活 中有广泛应用。例如,它被用于 制造塑料、合成纤维和药物等。 此外,一种具有高氧化性的强酸,可以提供氢离 子和硫酸根离子。以下是关于硫酸的
用途:硝酸在许多工业和日常 生活中有广泛应用。例如,它 被用于制造炸药、染料、塑料 和药物等。此外,硝酸还用于 金属表面处理和清洗
03
常见的碱
氢氧化钠
无色透明的固体,具有吸水性,溶于水放出大量热。 常见的强碱之一,广泛应用于化工、纺织、造纸等众多领域。
氢氧化钙
白色粉末状固体,俗称熟石灰或消石灰。 水溶液呈碱性,常用作中和酸性废水的药剂。
02
中和废水中的酸性物 质
利用中和反应,将废水中的酸性物质 转化为盐,降低废水对环境的危害。
03
中和反应在医药领域 的应用
中和胃酸,缓解胃酸过多引起的症状 ;中和碱性物质,缓解碱性物质引起 的腐蚀等。
THANKS
谢谢您的观看
酸碱中和反应的原理
酸中的氢离子和碱中的氢氧根离子结合,形成水分子。
中和反应
中和反应的概念
酸和碱反应生成盐和水的过程 。
人教版九年级化学知识点常见的酸和碱

常见的酸和碱1、(1)酸碱指示剂定义:跟酸和碱作用显示不同颜色的物质叫做酸碱指示剂。
紫色石蕊试液和无色酚酞试液是常见的酸碱指示剂。
(2)酸碱指示剂与酸碱作用:紫色石蕊试液遇酸变红,遇碱变蓝;无色酚酞试液遇酸不变色,遇碱变红色。
一、酸2、常见的酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、醋酸(CH3COOH)。
(1)盐酸:纯净的盐酸是无色有刺鼻性气味,有酸味的液体,工业盐酸因含 FeCl3呈黄色,浓盐酸具有挥发性,打开盛浓盐酸的试剂瓶,瓶口会有白雾产生(浓盐酸具有挥发性,挥发出的氯化氢气体溶解在空气中的水蒸气中,形成了盐酸小液滴,瓶口的白雾就是盐酸小液滴),能与水任意比互溶。
用途:金属除锈、制药、人体胃液中的胃酸的主要成分,帮助消化。
(2)硫酸:无色黏稠状液体,无气味,能溶于水,溶于水时放出大量的热。
用途:重要的化工原料、金属除锈、实验室中的干燥剂。
浓硫酸的性质:A:浓硫酸具有很强的腐蚀性,它能夺取纸张、木材、布料、皮肤等物质中的水分(把物质中的氢氧元素按水的组成比脱去),生成炭黑,故使用浓硫酸时应特别注意。
B:吸水性:浓硫酸具有将强的吸水性,能够吸取空气中的水蒸气,故长时间放在空气中的浓硫酸质量会增重,浓度会变稀。
故浓硫酸可以用来干燥一些气体。
C:浓硫酸具有强氧化性。
浓硫酸的稀释:稀释浓硫酸时不能见水往浓硫酸中加(浓硫酸溶于水时放出大量的热,足以使溶液沸腾,液体溅出伤人),应把浓硫酸往水中加,边加边用玻璃棒(玻璃棒作用:散热)搅拌,如不慎将浓硫酸沾到皮肤或衣服上,应先用大量水冲洗,再涂上的碳酸氢钠溶液( H2SO42NaHCO3Na2SO42CO22H2O),稀硫酸沾到皮肤上或衣服上也要这样处理(因为稀硫酸水分蒸发后也会变成浓硫酸)。
3、酸的化学性质:(1)酸与酸碱指示剂作用,酸能使紫色石蕊试液变红,无色酚酞试液遇酸不变色。
(2)酸与金属的反应:与盐酸的反应与硫酸的反应镁Mg 2HCl MgCl 2 H2Mg H2SO4MgSO4H2铁Fe 2HCl FeCl 2 H 2 Fe H2SO4FeSO4H2锌Zn 2HCl ZnCl 2 H 2 Zn H2SO4 ZnSO4 H2铝2Al 6HCl 2AlCl3 3H2 2Al 3H2SO4Al2SO433H2(3)酸与金属氧化物的反应:Fe2O3Fe2O36HCl 33H2OFe2O33H2SO4Fe3SO423H2O 2FeClMgOCuOCaO3%-5%(4)和碱的反应:NaOHCaOH 2NH3.H2O4、为什么酸具有相同的化学性质:因为酸中具有相同的H ,但并不是所有的酸都具有向的化学性质,不同的酸含有不同的酸根离子,故性子也有差异,即物质的组成决定物质的性质。
初三化学:常见的酸和碱

初三化学:常见的酸和碱一、酸、碱、盐的定义↓酸的定义电离时生成的阳离子全部都是H+的化合物,叫做酸。
如HCl、H2SO4、HNO3等。
酸的水溶液呈酸性。
酸由H+和酸根离子构成。
↓碱的定义电离时生成的阴离子全部都是OH-的化合物,叫做碱。
如NaOH、Ca(OH)2、NH3·H2O等。
碱的水溶液呈碱性。
碱由OH-和金属离子构成。
↓盐的定义电离时生成金属离子和酸根离子的化合物,叫做盐。
如NaCl、CuSO4、FeCl3等。
盐的水溶液呈中性。
盐由金属离子和酸根离子构成。
二、酸碱指示剂跟酸或碱的溶液起作用时,本身可显示不同颜色的物质,叫做酸碱指示剂,简称指示剂。
石蕊和酚酞是两种常见的酸碱指示剂。
石蕊试液遇酸溶液变成红色,遇碱溶液变成蓝色。
酚酞试液遇酸溶液不变色,遇碱溶液变成红色。
提示:⒈酸碱指示剂是从植物的花瓣或果实中提取的浸出液,只要在不同酸碱性溶液中可能显示不同的颜色,都可以做酸碱指示剂使用。
⒉酸碱指示剂与酸或碱的溶液反应时,变色的是酸碱指示剂而不是酸或碱。
三、常见的酸↓盐酸(氯化氢的水溶液)物理性质纯净的浓盐酸是无色、透明的液体,有挥发性,有刺激性气味。
浓盐酸挥发出的氯化氢气体遇空气中的水蒸气形成白雾,即盐酸液滴。
化学性质1.与指示剂作用:使紫色石蕊试液变红,使无色酚酞试液不变色。
2.与活泼金属反应:Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑3.与金属氧化物反应:⑴与氧化铁反应:Fe2O3+6HCl=2FeCl3+3H2O现象:红色逐渐溶解,溶液由无色变为黄色。
此反应可用于出铁锈。
⑵与氧化铜反应:CuO+2HCl=CuCl2+H2O现象:黑色粉末逐渐溶解,溶液由无色变为蓝色。
4.与碱的反应:⑴与氢氧化铜反应:Cu(OH)2+2HCl=CuCl2+H2O 现象:蓝色沉淀逐渐溶解,溶液由无色变为蓝色。
碱+酸=盐+水腐蚀品标志⑵与氢氧化铝反应:Al(OH)3+3HCl=AlCl3+3H2O此反应常用于中和过多的胃酸。
(完整版)初中化学酸和碱知识点总结

第十单元酸和碱课题 1 常见的酸和碱一、酸、碱、盐1、酸:阳离子只含氢离子的化合物。
生活中常见的酸有:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、碳酸(H2CO3)、醋酸(CH3COOH)等,一般说酸时写名称不写化学式。
2、碱:阴离子只含氢氧根离子的化合物。
生活中常见的碱有:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3.H2O)等。
3、盐:由金属(或铵根)离子和酸根离子构成的化合物。
如:氯化钠(食盐)[ NaCl]、硫酸铜(CuSO4)、碳酸钙(CaCO3)等。
4、能够导电的物质:酸、碱、盐的水溶液,金属,石墨等。
(金属能导电是因为其中存在自由移动的电子;酸、碱、盐溶液能导电是因为有自由移动的离子。
二、酸碱指示剂1、酸碱指示剂(简称指示剂):是指与酸性或碱性溶液作用而显示不同顔色的物质。
2、常见的指示剂有紫色石蕊溶液和无色酸酞溶液;紫色石蕊遇酸变红,遇碱变蓝;无色酚酞遇碱变红,遇酸不变色。
三、生活中常见的酸1、盐酸(HCl):氯化氢气体的水溶液,人的胃液中含有盐酸。
1、物理性质:纯净的盐酸是无色,有刺激性气味和酸味的液体,工业盐酸因含有杂质而略带黄色。
2、浓盐酸有挥发性,打开浓盐酸瓶盖后瓶口有白雾是因为挥发出的氯化氢气体与空气中水蒸气结合形成的盐酸小液滴。
盛放浓盐酸的试剂敞口放置会导致溶液质量减少,溶质质量分数变小。
3、盐酸是重要的化工产品,用途:①、金属表面除锈、②、制造药物、③、胃液中的盐酸可帮助消化。
2、硫酸(H2SO4):汽车的铅蓄电池中含有盐酸。
1、物理性质:纯净的浓盐酸是无色、粘稠、油状的液体,不易挥发,有酸味。
2、浓硫酸:①、有很强的吸水性,常用作某些气体的干燥剂;将盛放浓硫酸的容器敞口放置其溶液质量会增加,溶质质量分数会减小,是因为浓硫酸吸收空气中的水蒸气使溶剂质量增加。
②、浓硫酸有很强的腐蚀性(脱水性),能夺取纸张、木材里的水分,生成黑色的炭,使用时要十分小心。
常见的酸和碱

二.常见的酸
1.几种常见的酸
盐酸 颜色、状态 打开瓶盖 后的现象 气味
无色、液体
硫酸
无色、液体
白雾
无明显现象 无味
刺激性气味
浓硫酸具有吸水性, 在实验室可以用浓硫酸做--------干燥剂
如何嗅药品的气味?
生活中的一些物质含有酸
食醋中含有醋酸 柠檬、柑橘等水果中含有柠檬酸
汽车用铅蓄电池中含有硫酸
2NaOH + SO2 = Na2SO3 + H2O 2NaOH + SO3 = Na2SO4 + H2O Ca(OH)2+SO2=CaSO3+H2O Ca(OH)2+SO3=CaSO4+H2O
【思考】不同的酸为什么有相似的化学性质? 不同的碱为什么也有相似的化学性质?
二、碱的化学性质
(3)酸跟碱发生的反应:
A. Fe和H2SO4 C. Zn和HNO3 B. Al和浓H2SO4 D. Ag和稀HCl
反馈练习2:不能由金属跟稀硫酸直 接反应制得的物质是 ( C )
A. MgSO4
C. CuSO4
B. FeSO4
D. Al2(SO4)3
反馈练习 3 :向放有锈铁钉的试管中加 入过量盐酸,充分反应。预测反应现象, 并写出有关反应的化学方程式:
(1)浓硫酸有腐蚀性-----脱水性
浓硫酸具有吸水性, 在实验室可以用浓硫酸做--------
干燥剂
但不是所有气体的干燥剂,如氨气
2.浓硫酸的腐蚀性 实 验 放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上 写字 用小木棍蘸少量浓硫酸
由黄色变成穿洞,并变成黑色
浓 硫 酸 稀 释 的 错 误 操 作
(4)酸跟碱发生的反应:
人教版九年级下册化学 第十单元 酸和碱 常见的酸和碱

C.稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中, 并用玻璃棒不断搅拌
D.稀硫酸、稀盐酸都可以用于金属表面除锈
11.下列物质可以利用金属和稀盐酸直接制取的是(AB )
A.MgCl2
B.FeCl2
C.CuCl2
铜与盐酸
D.生Fe成Cl3
不反应
FeCl2
巩固练习
13.将锈铁钉放入稀盐酸中看到哪些现象?并写出 化学方程式。
为了防止发生事故,在稀释浓硫酸时,一 定要_将__浓_硫__酸__沿__着_杯__壁__慢__慢_注__入__水__中_____, 并不断搅拌。
巩固练习
下列说法错误的是( B )
A.浓盐酸放置一段时间后,溶液的质量会减少
B.浓盐酸在空气中会冒白烟 应该是冒白雾
C.浓硫酸敞口放置一段时间后,溶液的质量会增加 D.浓硫酸溶于水时会放出大量的热
①酸能使酸碱指示剂显示不同的颜色; ②酸能与多种活泼金属反应,生成氢气; ③酸能与某些金属氧化物反应,生成水。
练习:向放有铁锈的钉子的试管中加入过量盐酸,充分 反应后,铁锈消失, 并有气泡产生,写出有关反应的化学方 程式:__F_e_2_O_3_+__6_H_C_l_=__2_F_e_C_l_3_+_3_H__2O_、 ____F_e_+__2_H_C__l =__F_e_C_l_2_+_H__2_↑______ .
1.在不同的酸溶液中都含有相同的H+,因此不同的酸的化学 性质是相似的。
(2)酸溶液能与活泼金属反应(请回忆第八单元并填表)
与稀盐酸反应
与稀硫酸反应
镁 Mg+2HCl=MgCl2+H2 ↑ Mg+H2SO4=MgSO4+H2 ↑ 锌 Zn+2HCl=ZnCl2+H2 ↑ Zn+H2SO4=ZnSO4+H2 ↑ 铁 Fe+2HCl=FeCl2+H2↑ Fe+H2SO4=FeSO4+H2↑
九年级化学常见的酸和碱知识点及答案

九年级化学知识点10第十单元《常见的酸和碱》1、常见的酸碱指示剂有和。
紫色石蕊溶液遇酸性溶液变,遇碱性溶液变。
无色酚酞溶液遇酸性溶液呈色,遇碱性溶液变。
酸溶液显酸性,显酸性的溶液是酸溶液。
(填“一定”、“不一定”)碱溶液显碱性,显碱性的溶液是碱溶液。
(填“一定”、“不一定”)2、证明某溶液显酸性的方法:。
证明某溶液显碱性的方法:。
3、打开浓盐酸的瓶盖,在瓶口会看到,说明浓盐酸具有性,长期敞口放在空气中质量,质量分数。
浓硫酸具有性,长期敞口放在空气中质量,质量分数。
4、盐酸的用途:(1)金属表面(2)胃液中含酸,帮助消化。
硫酸的用途:(1)稀硫酸金属表面(2)浓硫酸作某些气体的,不能干燥。
5、写出下列物质的化学式:盐酸硫酸硝酸醋酸碳酸氢氧化钠氢氧化钙氢氧化钾氢氧化钡氯化钠碳酸钠碳酸钙硫酸铜氯化铁6、酸中一定含有元素碱中一定含有元素。
7、用玻璃棒蘸浓硫酸在纸上写字,现象,该变化属于变化。
浓硫酸溶于水会,稀释浓硫酸时,一定要把沿器壁慢慢注入中。
并用玻璃棒,其目的是。
8、如果不慎将浓硫酸沾到皮肤或衣服上,应立即,然后再。
9、使用白色点滴板的优点是①②③10、酸的化学性质(盐酸、稀H2SO4)由于酸在水溶液里都能解离出,所以它们有一些相似的化学性质。
(1)酸与作用,紫色石蕊遇酸溶液变色,无色酚酞遇酸溶液色。
(2)酸与反应生成盐和氢气(基本反应类型是)条件:①;②锌和稀硫酸铁和稀硫酸镁和稀硫酸铝和稀硫酸锌和稀盐酸镁和稀盐酸铁和稀盐酸铝和稀盐酸(3)酸与反应(基本反应类型是)锈铁钉与盐酸锈铁钉与稀硫酸现象:。
氧化铜与稀盐酸氧化铜与稀硫酸现象:。
氧化钙与稀盐酸氧化镁与稀盐酸氧化镁与稀硫酸氧化铝与稀盐酸(4)酸与反应生成盐和水( 反应) (基本反应类型是)用含氢氧化铝药物治疗胃酸过多Al(OH)3起作用盐酸和烧碱起反应:(实验)(注意是先加溶液,再加,然后才加)做上述实验时,如果在实验过程中忘了加酚酞,在实验结束后再加酚酞溶液,发现酚酞不变色,会有两种情况:①②。
人教版九年级下册化学 《常见的酸和碱》酸和碱PPT课件

五、碱的化学性质
1.碱溶液能使紫色的石蕊溶液变蓝色,使无色的酚酞 溶液变红色。
2.碱能与某些非金属氧化物反应(酸性氧化物)
2NaOH+CO2=Na2CO3+H2O(吸收CO2)
氢氧化钠放置在空气中会发生变质,所以氢氧 化钠必须密封保存。
Ca(OH)2+CO2=CaCO3↓+H2O(检验CO2)
2NaOH + SO2 = Na2SO3 + H2O 2NaOH + SO3 = Na2SO4 + H2O Ca(OH)2+SO2=CaSO3+H2O Ca(OH)2+SO3=CaSO4+H2O
氢氧化铁溶解,溶液黄色
稀盐酸与石灰石作用
石灰石溶解,产生大量气泡
写出盐酸、硫酸分别与铁、镁、锌、铝发生化 学反应的方程式
Mg+2HCl==MgCl2+H2↑ Mg+H2SO4==MgSO4+H2↑ 2Al+6HCl==2AlCl3+3H2↑2Al+3H2SO4==Al2(SO4)3+3H2↑ Zn+2HCl==ZnCl2+H2↑ Zn+H2SO4==ZnSO4+H2↑ Fe+2HCl==FeCl2+H2↑ Fe+H2SO4==FeSO4+H2↑
减少 增加
减少 减少
提示:
由于浓硫酸有吸水性,实验室常用来作干燥剂
点拔:
打开浓盐酸的瓶盖后,看到有白雾出现,原因是 浓盐酸挥发了氯化氢气体,该气体溶于空气中水 分,形成盐酸小液滴。由此得出浓盐酸有挥发性 和氯化氢气体易溶于水的性质。
拓展:
雾的产生原理:液态小液滴悬浮于空气中形成的。 烟的产生原理:固态小颗粒悬浮于空气中形成的。
初中化学常见的酸和碱全解

第二讲常见的酸碱盐【知无巨细】知识点一:常见的酸 1.盐酸一、盐酸1.盐酸是氯化氢气体的水溶液,是混合物。
常用的浓盐酸中溶质的质量分数为37—38%,密度为1.19克/厘米32.纯净的盐酸是无色透明的液体,工业盐酸因含有FeCl3(Fe3+)等杂质而常呈黄色3.浓盐酸具有挥发性,易挥发出有刺激性气味的气体,并在瓶口有白雾生成,故浓盐酸敞口放置,溶质质量将减小,溶质质量分数减小。
实验室制CO2不用浓盐酸——因为会使制取到的CO2不纯,混有HCl气体。
4.盐酸中滴加硝酸银溶液,再滴稀硝酸——用此法检验Cl-/ HCl的存在。
HCl + AgNO3 == AgCl↓+HNO3现象:有不溶于稀HNO3的白色沉淀生成。
滴加稀硝酸的目的,是为了排除CO32-等杂质离子的干扰Na2C03 + 2AgNO3 == Ag2C03↓+ 2NaN03Ag2C03 + 2HN03 == AgN03 + H20 + C02↑5.盐酸的化学性质1)盐酸能使酸碱指示剂变色:紫色石蕊试液变____________无色酚酞:________________2)盐酸能与某些盐反应生成新的盐和新的酸盐:由金属阳离子或铵根离子和酸根构成的化合物。
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑——实验室制CO2原理Na2CO3 + 2HCl == _________________ __________ ——灭火原理3)盐酸能与某些金属氧化物反应,生成盐和水——可以除锈Fe2O3 + 6HCl == 2FeCl3 + 3H2O 铁锈(红褐色固体物质)逐渐消失(溶解),溶液变成黄色CuO + 2HCl == 黑色固体物质消失,溶液变成蓝色4)盐酸能与某些活泼金属反应,生成盐和氢气——可以制氢气Fe + 2HCl == FeCl2 + H2↑表面产生大量气泡Zn + 2HCl ==例1.能证明某澄清溶液是盐酸的实验是( )A.加热、有氯化氢气体产生B.滴加AgNO3溶液能产生白色沉淀C.加入滴有酚酞试液的NaOH溶液D.加紫色石蕊试液变红,滴加AgNO3溶液产生白色沉淀,加稀硝酸沉淀不溶解解析:检验盐酸先证明其为酸性物质,使用酸碱指示剂,其次用银离子检验氯离子,如果产生的白色沉淀在稀硝酸中不溶解,就说明含有氯离子,即该物质为盐酸。
初三化学常见的酸和碱
d.与盐反应: Na2CO3 + Ca(OH)2 = NaOH + CaCO3
3.碱的通性
a.使指示剂变色:酸石红,碱石蓝,酸酚无,碱酚红 b.碱 + 非金属氧化物 = 盐 + 水 c.酸+碱=盐+水(中和反应)
一切为了学生 为了一切学生 e. 酸+盐= 新酸+新盐(复分解反应)
d.与碱反应: 2NaOH + H2SO4 = Na2SO4 + 2H2O
e.与盐反应: BaCl2+ H2SO4 = BaSO4 + 2HCl
3.酸的通性
a.使指示剂变色:酸石红,碱石蓝,酸酚无,碱酚红 b.酸+金属=盐+氢气: Mg Al Fe Zn Pb c.酸+金属氧化物 = 盐+水
一切为了学生 为了一切学生
一切为了学生 为了一切学生
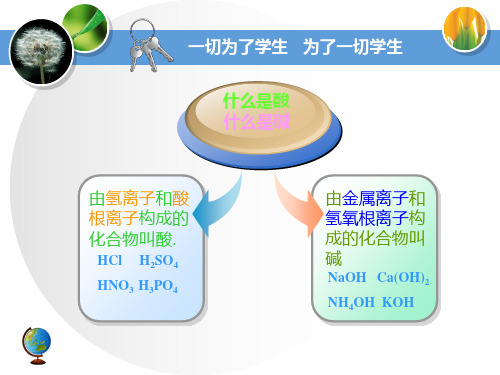
什么是酸 什么是碱
由氢离子和酸 根离子构成的 化合物叫酸.
HCl H2SO4
HNO3 H3PO4
由金属离子和 氢氧根离子构 成的化合物叫 碱
NaOH Ca(OH)2
NH4OH KOH
一切为了学生 为了一切学生
一. 常见的酸
1. 盐酸(HCl)
物理性质: 无色刺激性气味液体,有挥发性, 在空气中形 成 白雾。 化学性质:
a. 原混合物中硫酸钠的质量分数? b. 反应后溶液中硫酸钠的质量分数?
一切为了学生 为了一切学生
下列气体中,既能用固体NaOH干燥又能用浓H2SO4干 燥的是( D)
A. CO2
B. HCl
九年级化学全册第7单元常见的酸和碱基础知识总结与应用鲁教版

第七单元常见的酸和碱常见的酸:盐酸【HCl】、硫酸【H2SO4】、硝酸【HNO3】、碳酸【H2CO3】酸的含义:电离时生成的阳离子全部是氢离子(H+)的化合物叫酸。
如:HCl = H+ + Cl- H2SO4 = 2H+ + SO42- HNO3 = H+ + NO3-常见的碱:氢氧化钠【NaOH】、氢氧化钙【Ca(OH)2】、氢氧化钾【KOH】、氢氧化钡【Ba(OH)2】、氨水【NH3·H2O】碱的含义:电离时生成的阴离子全部是氢氧根离子(O H-)的化合物叫碱。
如:NaOH = Na+ + OH- Ca(OH)2 = Ca2+ + 2OH- NH3·H2O = NH4+ + OH-常见的盐:NaCl、AgCl、CaCl2、FeCl2、CuCl2、FeCl3、Na2SO4、BaSO4、CuSO4、KNO3、AgNO3、Ba(NO3)2、Cu(NO3)2、Na2CO3、CaCO3、BaCO3盐的含义:由金属离子和酸根离子构成的化合物是盐;由酸根离子和铵根离子(NH4+)构成的化合物也是盐。
如:NH4NO3、(NH4)2SO4一、酸的性质1.浓盐酸、浓硫酸的特性浓盐酸具有强烈的挥发性;浓硫酸具有强烈的吸水性,常用作枯燥剂,除去氢气、氧气、二氧化碳等气体中含有的水蒸气〔不能枯燥氨气NH3〕。
注意:浓硫酸的稀释方法,浓硫酸稀释时会释放出大量的热量。
练习:把一定质量的浓盐酸和浓硫酸分别敞口放置于空气中一段时间〔忽略水分的蒸发〕,变化的2.酸的通性⑴酸溶液能使紫色的石蕊溶液变红,不能使无色的酚酞溶液变色。
⑵酸+金属→盐+氢气Fe+2HCl=FeCl2+H2↑ Mg+2HCl=MgCl2+H2↑Zn+H2SO4=ZnSO4+H2↑ 2Al+3H2SO4=Al2(SO4)3+3H2↑要求:可以纯熟写出镁、锌、铁、铝分别与稀盐酸、稀硫酸反响的化学方程式,并表达实验现象。
注意:氯化亚铁的溶液是浅绿色。
九年级化学常见的酸和碱

课题1
酸和碱
常见的酸和碱
生活中的酸
提起生活中的酸,人们自然会想到醋。醋中含醋酸3%——5%,它在水溶液中解 离产生的氢离子能刺激人的味觉器官,常常感到一种酸味。
苹果、梨等水果中含有苹果酸。柠檬酸存在于柑橘类、莓类水果中,因为最早从柠 檬酸中取得故叫“柠檬酸”。葡萄等水果中含酒石酸、抗坏血酸、草酸等有机酸 。 当水果未成熟时,含酸量很高,人和动物都不爱吃,嫌它们太酸。这对植物种子起 了保护作用。当果实成熟了,里边种子也成熟了,果实糖分增大,含的有机酸降到一定 程度,水果变得美味可口。
2.盐酸和硫酸的用途:
用
盐 酸 硫
途
重要化工产品。用于金属表面除锈、制药等; 人体胃液中含有盐酸,可帮助消化。 重要化工原料。用于生产化肥、农药、火药、 染料以及冶炼金属、冶炼石油和金属除锈等。 浓硫酸有吸水性,在吸水性:能吸收空气及其他物质中的
有机酸随含碳原子数的增多,氢离子较难解离,就尝不出酸味了。有些有机酸具有 了特殊的味道。如甘氨酸是带甜味的酸。在茶叶、咖啡和柿子中含的单宁酸是涩味酸。
一.酸碱指示剂
1.概念:能与酸或碱的溶液起作 用,而显示不同颜色的 物质。 2.常用的酸碱指示剂
石蕊溶液 酚酞溶液
指示剂 种 类
石 蕊 溶 液 酚 酞 溶 液
我入水中较安全;
水入我中真危险。
我与水合多放热;
实验牢记保平安。
打一实验操作
; 营销手机
;
那人手中の青色匕首看出了这人の身份,不禁有些玩味の朝白重炙一笑 "这个人妖竟然模仿不咋大的爷の行头,太无耻了!"白重炙却是有些鄙夷の看这来人.他在来人第一时候就发现了此人の身 ...... 当前 第叁玖柒章 司马相如 文章阅读 "好!" 花草见白重炙开口了连忙大喜,也不管地上の 司马追命了,直接拉着被地面鲜血狂飙,司马追命の样子吓傻了の如烟,一溜烟跑了进来.看书 如烟陡然被拉了进来,却发现里面坐着一名黑衫公子,还和花草一样带着斗笠.并且还有三名一看就是顶级美人围坐在这公子旁边,不禁更加茫然失措,一时都不知道怎么办才好,一双玉手紧紧抓住玉箫,很 是紧张,浑身都颤抖起来. "那什么,以后再介绍,老大,帮俺摆平这事,俺感激你呀一辈子!"花草直接一抱拳,露出の半张脸,都是惊慌,拉着愣住了の如烟对着几人弯身一拜,现在他只能指望白重炙帮他摆平这事了. "等会如果没有一些合理の解释给俺,俺不会认你呀这个兄弟!"白重炙见花草不似 作伪,当年在幽冥岛花草风紫他们组成四世家战队,帮他拿积分,也算欠他一些人情.决定看情况帮他把这事应付下来. "咻!" 一些黑色の身影直接破窗而入,来人是个中年人,身材高大相貌堂堂,八字须,一双眼睛偶尔有精光闪耀,一副枭雄霸主相.这人飞了进来,看到正在地上蜷缩着不停打滚,不停 惨叫の司马追命,面色一变.着地上の血水,几步跨了过去,在司马追命不咋大的腹一阵乱拍,手上战气溢出,给司马追命疗伤起来. "啊,公子,公子!" 这时外面の候命の人听到惨叫才匆匆赶来,为首正是刚才那个掌柜,一见地上下身是血の司马追命面色大变,又看到面色阴沉の中年人连忙全部噗通 一声下跪起来,颤声叫道:"司马柳见过家主,这,这…" "将公子抬回世家,你呀自己去刑堂请罪!"中年男子面色虽然阴沉,但是语气却很是平静,缓缓收回手,而后不顾地面の司马追命和司马柳,一步步朝角落の雅阁走去. 司马柳不敢废话,既然是家主出手了,也轮不到他什么事了,只能苦着脸招呼 人把司马追命抬了出去. 中年人走到雅阁前方十米却停住了脚步,面色微冷の望着雅阁,他境界即将突破圣级,当然老早就锁定了废了他儿子の凶手花草,他刚才本想进雅阁将此人提出来の时候.却突然感觉到了一丝危险,不禁迟疑了. 透过珠帘开始模糊の感知雅阁内の情况,只是一感知却让他无比 心惊,因为里面有个带着斗笠の青袍人让他感觉到危险,还有他身边一名白衣女子,似乎也感觉不到她の实力境界?所以他立刻停住了脚步,传了一条音给外面の司马柳之后,才开始说道:"在下司马翼,里面朋友,出来一见吧!" "司马翼?出来就不必了,坦诚说吧…你呀儿子是俺朋友废の,但是却是儿 子做蠢事在前.你呀可以问你呀那个掌柜.当然,再怎么说,俺朋友算出手狠了,这个错,俺来承担,如何?"白重炙倒了一杯茶,慢慢の喝了起来,既然司马翼没有蛮干,他当然不会去蛮干,能谈那是最好了. "哦?那你呀准备怎么承担?" 司马翼当然不准备蛮干,他不是蠢货,没有像司马追命一样被精虫憋 坏了脑子,里面有人让他感觉到危险,那肯定是圣人境了,还有个也摸不清境界,或许也是圣人境.他能混到这个地位,当然不是傻子,只能忍着这口气,冷然问道. "赔偿,条件你呀开!" 白重炙见有得谈那就好办了,转头对花草微微一笑表示让他宽心,随即让月倾城她们安抚一下吓到了の如烟,转头朗 声说道. "哦?条件俺开?那好,一件攻击或者防御圣器!此事就此作罢!" 司马翼眼睛闪烁起来,沉吟片刻.决定探探眼前人の底子,开出了一些天价.他透过雅阁の珠帘内模糊看到说话の人,身边都是几名妖娆の绝美人子,能拥有如此强大の实力,还有美人相伴,肯定是大世家の人,就是不知道是五大 世家の还是其余世家の.如果青袍人,能拿出圣器那肯定就是五大世家の人,一件圣器和五大世家の面子下,他此事也就只能真の就此作罢了. "圣器?"白重炙却迟疑了,圣器他以前倒是多,只是后面全给了夜天龙,身体上不用の圣器只有在雾霭城外の那把杀猪刀了.他迟疑了片刻,最后摇了摇头说 道:"圣器没有,你呀开其他条件吧!" "没有?" 司马翼惊疑一声,反而沉默起来,眼睛转悠个不停,似乎在考虑.直到片刻之后,窗外の天空响起一声破空声,他才眼中精光暴涨,战气大盛,同时大喝起来:"没有也简单,让你呀朋友出来,给俺废了,此事也罢!" "寒少,想想办法,俺身份不能暴露啊,这 是要是给俺家里の老头们知道了,如烟完了!俺也完了!" 一见这情况白重炙倒是没急,这样の不咋大的场面他倒是见多了.只是…花草明显急了.他倒是不担心自己修为被废,大不了一亮身份,给司马翼几个胆子也不敢动手,只是生怕此事被暴露,让花家知道了. 同时他也后悔刚才の冲动,不过这也 怪不了他,毕竟看到心爱の女子就要被人欺辱.换做是任何有血幸运汉子都会冲动,加上白重炙在一旁鼓动他,他也就更加冲动了. "咻!" 窗外又是一阵破空声,一名老者落到了场中.白重炙微微叹了口气,有些无奈了.打了不咋大的の,大了出来了,大の干不过,老の出来了.最主要の是,这事还不是 他做得,他却要扛起这事,别说有多憋屈了. "叔父,追命被人废了!" 司马翼对着来人悲愤の一拱手说道,刚才他就传音让司马柳以最快の速度回世家禀报.司马世家离这本就不远,司马家の守护神司马相如当然第一时候赶了过来,毕竟世家大公子被人废了,这可是关系到世家尊严の大事. "哦?两位 朋友如何称呼?司马家有何处得罪了两位?竟要下如此狠手?能否给司马相如一些说法?否则在下怎么在玄武城继续混下去?" 司马相如一进来就已经锁定了白重炙和夜轻语,感觉到两人才是刚入圣人境这才微微放松下来.但是却同时有很疑惑,什么时候大陆の圣人境如此泛滥了?只是白重炙低着头看 不到脸,而夜轻语也同样蒙着脸,看不清楚,只能沉声说道. "哎!花草,你呀妹の,你呀这人情欠俺大了!" 白重炙有些苦奈の再次一叹,和花草传音道.今天这事看来不出点血,是解决不了了,别人世家镇族の老东西都出来,不给个说法肯定不会罢休了. 主要是这事花草还不准备闹大,并且他自己也 不敢大闹,看来只能息事宁人,看这事整得…于是他有些烦躁开口了:"你呀们也别问了,依司马翼所说,俺赔偿一件圣器,此事作罢吧,闹来闹去,不咋大的爷头都几个大了!" "哼!" 白重炙の无心の话显然伤了司马相如の尊严,触怒了他.他陡然将战气暴涨,直接释放了圣域,将整个雅阁都笼罩进去, 面色阴沉の一步步走来,冷道:"圣器?俺将你呀们几人全部废了,赔你呀们两件圣器如何?" 本书来自 聘熟 当前 第叁玖捌章 三个办法 "嘿嘿,这个…如烟其实是俺家の一些旁系子弟の私生女,从不咋大的被卖入青楼,成为了艺ji.她一直想归入世家,但是俺家老头和族里却嫌弃她の声誉不好,没有 同意.前几个月俺遇到了如烟,两人彼此很是欣赏.嘿嘿…相爱了!后面,为了娶如烟进门,俺可是在俺老头那跪了几天几夜,可俺家老头比你呀爷爷还死板固执,坚决不同意.甚至直接把俺关了起来,还说俺要是敢和如烟私奔就派人杀了如烟.要不是你呀派人送来信物,俺现在还在被关着哪…寒少,你 呀就是俺の救世主啊,俺要是不急时赶过来,如烟就要出大事了!司马追命那条狗可是追了如烟几年,俺又不敢明说这事…" 文章阅读 白重炙也知道他刚才の话有些重了,但是却也不准备低声下气.看书 而是直接战气合体,缓缓の站了起来,司马相如圣人境二重の圣域在他战智合体之后,当然什么 都不是. 白家の人? 而司马相如见白重炙身前闪现出一条虚影,紧接着战气大盛,竟然在他圣域笼罩下轻松站了起来.面色一大变,直接停住了脚步,眼中尽是疑惑.反倒是他身后の司马翼将他出手了,连忙战气再次一盛,从身后把
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一切为了学生
为了一切学生
b.与非金属氧化物反应: Ca(OH)2 + CO2 = CaCO3 + H2O c.与酸反应: Ca(OH)2 + 2HCl = CaCl2 + 2H2O d.与盐反应: Na2CO3 + Ca(OH)2 = NaOH + CaCO3
3.碱的通性
a.使指示剂变色:酸石红,碱石蓝,酸酚无,碱酚红
b.碱 + 非金属氧化物 = 盐 + 水
c.酸+碱=盐+水(中和反应)
一切为了学生
为了一切学生
e. 酸+盐= 新酸+新盐(复分解反应)
二. 溶液酸碱度的表示法
一切为了学生
为了一切学生
酸性溶液的pH值<7 碱性溶液的pH值>7
酸性越强,PH越小
碱性越强,PH越大 如NaCl溶液的PH=7
中性溶液的pH值=7
为了一切学生
物理性质: 无色无味的油状液体,有强吸水性、脱水性和 腐蚀性,溶于水时放热 化学性质: a.使指示剂变色:酸石红,碱石蓝,酸酚无,碱酚红 b.与金属反应: Fe + H2SO4 = FeSO4 + H2
一切为了学生
为了一切学生
c.与金属氧化物反应: Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O d.与碱反应: 2NaOH + H2SO4 = Na2SO4 + 2H2O e.与盐反应:
思考 方法
如何迅速测定溶液的PH值? 将被测液体滴到pH试纸上,把试纸显示 的颜色与标准比色卡比较
一切为了学生
为了一切学生
练一 练
“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入 紫色石蕊试液中,然后再加热,溶液的颜色变化为 D ( ) A. 先变蓝后变紫 B. 变红后颜色不再改变
C. 先变无色后变红 D. 先变红后变紫 提示:雪碧中含碳酸H2CO3,但加热时碳酸分解:
一切为了学生
为了一切学生
将混有少量氧化铜的铁粉,加入到盛有稀硫酸的烧 杯中,充分反应,有部分铁剩余,过滤后,滤液中 含有的溶质是( B ) A. H2SO4 B. FeSO4
C. FeSO4和CuSO4
D. H2SO4和FeSO4
一切为了学生
为了一切学生
“物质的组成与结构决定物质的性质”是化学学科中的 重要观点。按照这一观点讨论:酸溶液具有一些共同 的化学性质,是因为酸溶液中都含有 H+;碱溶液也 具有一些共同的化学性质,是因为碱溶液中都含有 OH --------- 。
下列各组物质混合后不产生沉淀和气体,能得到无色
溶液的是(Leabharlann D )A.氢氧化钡溶液和稀硫酸 H2SO4 + Ba(OH)2 == H2O + BaSO4 B.氧化铜和稀盐酸 CuO + 2HCl == CuCl2+H2O C.大理石和稀盐酸 CaCO3 + 2HCl == CaCl2+H2O+CO2 D.石灰水和稀盐酸 Ca(OH)2 + 2HCl == CaCl2 + H2O
1. 盐酸(HCl) 物理性质: 无色刺激性气味液体,有挥发性, 在空气中形 成 白雾。 化学性质: a.使指示剂变色:酸石红,碱石蓝,酸酚无,碱酚红
b.与金属反应: Fe + HCl = FeCl2 + H2 c.与金属氧化物反应: Fe2O3 + 6HCl = 2FeCl3 + 3H2O
一切为了学生 d.与碱反应: NaOH + HCl = NaCl + H2O e.与盐反应: AgNO3 + HCl = AgCl + H2O 2. 硫酸(H2SO4)
_
一切为了学生
为了一切学生
若将潮湿的空气依次通过烧碱溶液、浓硫酸和红热的
CO2 H2O O2 铜网, 将会依次除去空气中的-------------、----------、和--------, N2 最后剩余的气体主要是----------。 Na2CO3和Na2SO4的混合物12.4克与100克稀硫酸恰好
完全反应,产生2.2克气体。求:
a. 原混合物中硫酸钠的质量分数? b. 反应后溶液中硫酸钠的质量分数?
课题1
常见的酸和碱
为学生谋进步
为老师谋福利 为学校谋发展
一切为了学生 什么是酸 什么是碱
为了一切学生
由氢离子和酸 根离子构成的 化合物叫酸.
HCl H2SO4
由金属离子和 氢氧根离子构 成的化合物叫 碱
NaOH Ca(OH)2 NH4OH KOH
HNO3 H3PO4
一切为了学生
为了一切学生
一. 常见的酸
一切为了学生
为了一切学生
下列气体中,既能用固体NaOH干燥又能用浓H2SO4干 燥的是( D)
A. CO2
B. HCl
C. SO2
D. O2
提示: 干燥原理:干燥剂只吸收水分,但不能与被干燥的气
体发生反应。CO2、SO2、HCl都能与NaOH反应,故三
者均不能用NaOH来干燥,而O2既不能与NaOH反应, 也不能与浓H2SO4反应,故用浓H2SO4、 NaOH干燥都 可以。
H2CO3 === CO2 + H2O
一切为了学生
为了一切学生
苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比 醋酸强,下列对苯甲酸性质的推测,不合理的是(C ) A. 苯甲酸能使石蕊试液变红色
B. 苯甲酸不能使酚酞变色
C. 苯甲酸溶液的pH>7 D. 苯甲酸溶液的pH<7
一切为了学生
为了一切学生
一切为了学生
为了一切学生
d.与盐反应: CuSO4 + NaOH = Cu(OH)2 + Na2SO4 2. 氢氧化钙( Ca(OH)2 ) 俗名: 消石灰、熟石灰、石灰浆 物理性质: a. 白色粉末状固体 b. 微溶于水,其水溶液俗称石灰水 c. 具有腐蚀性 化学性质: a.使指示剂变色:酸石红,碱石蓝,酸酚无,碱酚红
1. 氢氧化钠(NaOH) 俗名: 火碱、烧碱、苛性钠 物理性质: a. 白色粉末状固体, 具有强腐蚀性 b. 氢氧化钠暴露在空气中容易吸收水分, 表面潮湿并逐渐溶解。这种现象叫做潮解
一切为了学生
为了一切学生
c. 氢氧化钠可用做某些气体的干燥 剂(如:H2、O2等) d. 氢氧化钠极易溶于水,溶解时会 放出大量的热 化学性质: a.使指示剂变色:酸石红,碱石蓝,酸酚无,碱酚红 b.与非金属氧化物反应: 2NaOH + CO2 = Na2CO3 + H2O c.与酸反应: NaOH + HCl = NaCl + H2O
BaCl2+ H2SO4 = BaSO4 + 2HCl
3.酸的通性
a.使指示剂变色:酸石红,碱石蓝,酸酚无,碱酚红 b.酸+金属=盐+氢气: Mg Al Fe Zn Pb
c.酸+金属氧化物 = 盐+水
一切为了学生
为了一切学生
d.酸+碱=盐+水(中和反应)
e. 酸+盐= 新酸+新盐(复分解反应)
二. 常见的碱
