第5章_酸碱滴定法答案
第5章 酸碱滴定法

当离子强度(I=1/2∑ciZi2)较小时, -lgγi=0.5Zi2 I 1/2 ci↑ I↑ γi↓ Zi↑ I↑ γi↓ Zi↑γi↓ I相同,对高价离子的影响要大得多。 中价分子的活度系数近似等于1。
二、酸碱质子理论
酸(acid):给予质子(proton) 碱(base) :接受质子 某酸丢掉一个质子,成为该酸的共轭碱; 某碱得到一个质子,成为该碱的共轭酸。
(2)弱酸弱碱盐(考研)
5.4 对数图解法(了解)
5.5 酸碱缓冲溶液(重点)
缓冲溶液(buffer solution)的种类 (1) 弱酸及其共轭碱,例如 HAc-Ac- , NH4+-NH3 等。不仅具有抗外加强酸、 强碱的作用,还有抗稀释的作用。 (2) 强酸(pH<2)、强碱(pH>12)溶液。 具有抗外加强酸、强碱的作用,但不 具有抗稀释的作用。
HIn 甲色
+ H +In
乙 色
Ka=[H+][In-]/[HIn] [In-]/[HIn]=Ka/[H+] 比值[In-]/[HIn]是[H+]的函数。一般 说来,如果 [In-]/[HIn]≥10 ,看到的 是乙色;[In-]/[HIn]≤0.1,看到的是 甲色。
常用的酸碱指示剂: (1)甲基橙(MO) methyl orange (2)甲基红(MR) methyl red (3) 酚酞(PP) phenolphthalein (4) 百里酚酞 (THPP) thymolphthalein
指示剂 变色范 围 pH
颜色 酸 色 红 碱 色 黄
浓度
甲基橙 3.1~4.4 (MO) 8~10 酚酞 (PP)
无
0.05%水 溶液 红 0.1%(90 %乙醇溶 液)
第5章 酸碱滴定法

一. 物料平衡 在一个化学平衡体系中,某一给定物质的
总浓度,必然等于各有关型体平衡浓度之和,
这种等衡关系称为物料平衡,其数学表达式
称为物料平衡方程,用MBE表示。
(Material Balance Equation)
例1:写出cmol· -1下列溶液的MBE L
(1)HAc (2)Na2CO3 (3)NaNH4HPO4
(1)Cl-的浓度
(2)Al3+的电荷
结 论
当离子强度相同时,离子的价态越高, 则γ越小。
6
(2)德拜-休克尔极限公式
lg i 0.512Zi
2
I
通常运用该式对活度系数随离子强度的 改变进行定性描述
(3)戴维斯(Davies)经验公式
I lg i 0.50 Z i 0.30 I 1 I
I lg i 0.512 Z i 1 Ba I
2
Z i — i 离子所带电荷
B —常数,25℃时为0.00328 I —离子强度
a —离子体积系数
1 2 I ci Z iห้องสมุดไป่ตู้2
ci 、Zi — 溶液中i 种离子的浓度和电荷
4
例1: 计算0.10mol· -1HCl溶液中H+的活度 L (武大本P111例1)
27
4、CBE的书写步骤
(1)首先写出溶液中存在的所有平衡(特别注意: 不要漏掉水的解离作用); (2)写出溶液中所有的阳离子和阴离子; (3)将离子的电荷浓度正确表示出来; (4)将阳离子和阴离子分列等式两边,写出CBE。 例2:写出c mol· -1下列溶液的CBE L (1)NaCl (2)BaCl2 (3)Na2CO3
分析化学 第05章 酸碱滴定法3

4) 化学计量点(SP)后: NaOH + NaAc 由于过量NaOH存在,抑制Ac-的离解,因此溶液的pH由 过量的NaOH决定。也就是说化学计量点后的溶液pH和 强碱滴定强酸的情况一样。 pH决定于过量的NaOH. 设滴入20.02mL NaOH。 (相对误差+0.1%)
[OH ] 0.1000 (20.02 20.00) 5.00 105 (mol / L) 20.00 20.02
.3.
(1) 滴定过程中pH值的变化 例: 0.1000mol· L-1 NaOH溶液滴定 20.00mL 0.1000mol· L-1 HCl 溶液 1) 滴定开始前: HCl 溶液的pH值等于HCl的原始浓度的pH。 [H+]=c(HCl)=0.1000mol· L-1 pH=1.00 2) 滴定开始至等SP前: HCl +NaCl VHCl VNaOH H 0.1000 如滴入18.00mLNaOH VHCl VNaOH 0.1000 (20.00 18.00) pH 2.28 [H ] 5.26 103 (mol / L) 20.00 18.00
HAc
Ac-
Ac-+OH-
pH
a
.19.
(3) 影响滴定突跃的因素和指示剂的选择 影响因素:被滴定酸的性质,浓度.
滴定突跃:pKa+3 ~-lg[Kw/cNaOH(剩余)] 浓度: 增大10倍,突跃增加1个pH单位(上限) Ka:增大10倍,突跃增加1个pH单位(下限) 指示剂的选择: ⊿pH =7.74~9.7,选碱性范围变色的酚酞,百里酚酞 (4) 弱酸能被准确滴定的判别式:(终点误差± 0.1%以内)。 ca •Ka≥ 10-8
大学分析化学第5章-1

Ac- + H2O
共轭酸碱对
醋酸与氨在水溶液中的中和反应 HAc + NH3 NH4+ + Ac-
共轭酸碱对
结论(conclusion)!
酸碱半反应不可能单独发生 酸碱反应是两对共轭酸碱对共同作用的结果 酸碱反应的实质是质子的转移 质子的转移是通过溶剂合质子来实现的
二、 酸碱反应的平衡常数
二、酸度对弱酸(碱)各形体分布的影响
• 分布分数(distribution fraction): • 溶液中某酸或碱组分的平衡浓度占其总浓度 的分数, 以表示. c
i
c
• 分布曲线——不同pH值溶液中酸碱存在形式 的分布
作用:
(1)深入了解酸碱滴定过程; (2)判断多元酸碱分步滴定的可能性。 滴定是溶液pH与溶液中各物种的量、比例 不断变化的过程。
• 则 [H2C2O4] = 0c, [HC2O4-] = 1c, [C2O42-] = 2c •
2
0+1+ 2=1
多 元 酸 溶 液
[ H 2C2O4 ] [ H 2C2O4 ] 0 2 c [ H 2C2O4 ] [ HC2O4 ] [C2O4 ] 1 1 2 K a1 K a1 k a2 [ HC2O4 ] [C2O4 ] 1 2 1 [H ] [H ] [ H 2C2O4 ] [ H 2C2O4 ] [ H ]2 2 [ H ] K a1 [ H ] K a1 k a2
+
展开得一元三次方程
[H+]3 + Ka[H+]2- (Kaca+Kw)[H+] - KaKw= 0
第5章_酸碱平衡及酸碱滴定法-1

[HAc] [HAc]Ka [HAc]+ [H+]
cHAc
Ka [Ac-] = -] [H+] + Ka [HAc]+[Ac
分布分数的一些特征
δHA
[H+] = [H+] + Ka
δA-
Ka = [H+] + Ka
δ 仅是pH和pKa 的函数,与酸的分析浓度c无关 对于给定弱酸, δ 仅与pH有关 δHA+ δA -=1
Kbi =
Kw Ka(n-i+1)
例题:从手册中查出下列各酸的酸度常数pKa,计算各
酸的Ka与相应共轭碱的Kb值。(1)H3PO4;(2)H2C2O4;
(3)苯甲酸;(4)NH4+;
(2)溶剂分子的质子自递反应 H2O + H2O H3O+ + OH(25°C)
Kw= aH + aOH - =1.0×10-14
[HA]= δHA c HA , [A-]= δA- c HA
一元弱酸溶液
多元弱酸溶液
分布分数-一元弱酸
HAc H++ Ac-
cHAc=[HAc]+[Ac-]
def [HAc] [HAc] δHAc== c = [HAc]+[Ac-] = HAc
[H+] = [H+] + Ka def [Ac-] δAc == =
配位平衡
氧化还原平衡 沉淀平衡
配位滴定法
氧化还原滴定法 沉淀滴定法
1 酸碱平衡
酸 共轭碱 + 质子
HF
H2PO4-
FHPO42-
+
(完整版)分析化学第五版第五章课后习题答案(武大版)

第五章酸碱滴定法习题详解51写出下列溶液的臆子条件式.a.q(mol , L-^NH^c/mol -b.臼《med , L-^NaOH + fiCmol •c.幻(mol , L-^HiPO^c^mol - L-^HCOOHjd.0, 010 mol - L^1 FeCl,.W¥】s [NH:] + CH*] = [C「]一[OH「]或[NHT ] + [H+ ]=q + [OH 'Jb N*] + [H*]=[H£BOr] + [OH-]或E+[H+]=[压BOn+[Q]ire.[H+]=[HwPO「]+2[HFO:-]+3[PO「]+[HCO0—] + [QHrd. [H"] = EFUOH产]+2[FHOH律:]+[。
十]5-2计算下列各溶液的pH缱'岳0. LC mol * b. 0. 10 mol ■ L'^HiSOuc.0, 10 mol,L i三乙薜胺彳d, 5.0X10^mol • L7HC"孔 0. 20 mol - L』1H,FQ‘,【解I a, □由H R。
:.乾凡・ = 5・8X10T,£K.=0. It)X5. 8 X 10-ls^5. 8X 10'll> 1。
章.#=匚二氏项>Jg.所以可用最简式进行计碧, 、内a* o A[FT] =77^ = ( 70, 10X 5. 8X10-lc)niol •[广】=7, GX ICT'mol ・L-1pH= 5* 12上已知H3SO X的K,= 1.QX1G、一级离料完全,涪凌的质子条件式为[H+] = rSOf -J + [OH-]+^[S()i-l+r-f F凫铲f+r整理后得[H+T + KjH+]r[H+] — 2cK.2 =。
解方程得田+ ] = (c- K% ),+ 8瓦=『0. 10—0.01+ /(0. 10—0.0]>2+8><0.10X0.0i]mol ■ L~i L 2J=0.11 mol • L 1pH=0. 96c.已知三乙孵胺的Kb = 5. 8X 10-',cKb = 0. 10 X 5. 8 X 10-T = 5. 8 X 10_,>10K w, 100,所以可用最筒式进行计算.[OH-]= >/cK^=( ✓O. 10X5. 8X10~7)mol ・ L*!-2. 4 X 10-*mol • L~lpH =10. 38d.由于HCl浓度过低,因此不能忽略水解产生的H♦,溶液的质子条件为[H+]=c + [OHr整理后得= O解方程得= [5.0X10-'+ /〈5.0X107)2 士4X10-*=1. 3X 10~f mol • L~lpH = 6. 89e・ H3PO4的K、= 7. 6X1O-',K% = 6. 3X10-',K、= 4. 4Xl<r” ・因为cK.= 0.20X7.6 X10T>10K = 2X6.3X102^<Q05 •</0.20X7.6X10_, K 7.6X10 100,所以可用F式计算.[H・]2+K,[H+]—cK 气=0[H,A奇+序云="藉虹+把毛*+ 0 20X7. 6万3卜。
武汉大学《分析化学》第5版上册章节题库(酸碱滴定法)【圣才出品】

,pH 与浓
圣才电子书
度无关。
十万种考研考证电子书、题库视频学习平台
11.下列说法中错误的是( )。 A.硬酸倾向于结合硬碱 B.硬酸是强酸,而软酸是弱酸 C.质子是强酸 D.H-是软碱 【答案】B
12.在水溶液中,HClO4 和 HCl 均显示强酸性质而无法区别其强度,是由于( )。 A.两种酸本身性质相同 B.两种酸均具有 Cl 元素 C.对两种酸而言,水是较强的碱 D.水易形成氢键 【答案】C
圣才电子书 十万种考研考证电子书、题库视频学习平台
武汉大学《分析化学》第 5 版上册章节题库 第 5 章 酸碱滴定法
一、选择题
1.已知 H3PO4 的 A.11.88
分别是 2.12、7.21、12.36,则 的 pKb 为( )。
B.6.80
C.1.64
D.2.12
13.下列溶剂中,能使 HNO3、HCl 和 HAc 等酸显相同强度的是( )。 A.纯水 B.甲酸 C.液氨 D.甲醇 【答案】C
5 / 66
圣才电子书 十万种考研考证电子书、题库视频学习平台
14.c(NaCl)=0.1mol/L 的 NaCl 水溶液的质子平衡式是( )。 A.[Na+]=[Cl-]=0.1mol/L B.[Na+]+[Cl-]=0.1mol/L C.[H+]=[OH-] D.[H+]+[Na+]=[OH-]+[Cl-] 【答案】C
17.已知 0.10mol/L 一元弱酸 HB 溶液的 pH=3.5,则 0.10mol/L 共轭碱 NaB 溶液 的 pH 是( )。
A.10.5 B.10.0 C.9.0 D.9.5 【答案】D
18.等浓度 NaOH 滴定一元弱酸时,当中和一半时,pH=5.0,弱酸的 Ka 为( )。 A.5.00 B.1.0×10-5 C.9.00 D.1.0×10-9 【答案】B
第五章酸碱滴定法(一)

如HCl、HAc、NH4+、 H2O +等; • 凡能接受质子的物质叫碱
如Cl-、Ac-、NH3、PO43-等; • 既可以给出质子又可以接受质子的物质,称为
两性物质
如H2O,HCO3- ,HPO42-
2019/10/10
5
酸失去质子后变成该酸的共轭碱: 酸Ⅰ → H+ + 碱Ⅰ (共轭碱)
碱得到质子后变成该碱的共轭酸: 碱Ⅱ + H+ → 酸Ⅱ (共轭酸)
2019/10/10
25
三、质子平衡
溶液中酸失去质子数目等于碱得到质子数目。
质子条件表达式称为质子等衡式 PBE(proton balance equation)
(1) 先选零水准 (大量存在,参与质子转移的物质), 一般选取投料组分及H2O
(2) 将零水准得质子产物写在等式一边,失质子产物 写在等式另一边
此 反应平衡常数称为溶剂的质子自递常 数(KS )
2019/10/10
12
水的质子自递常数又称为水的活 度积Kw,
水的质子自递常数Kw
Kw
a(H3O )
a (OH
)
1.01014(25C)
2019/10/10
13
分析化学中的反应常在稀溶液中进行, 所以常忽略离子强度的影响,即
H2O: KS = [H3O+][ OH-] =KW =1.0 10-14 (25℃)
pKW =14.00
2019/10/10
14
水的质子自递常数Kw
t 0C 0
10 20 25 30 40 50 60
pKw 14.96 14.53 14.16 14.00 13.83 13.53 13.26 13.02
第5章_酸碱滴定法答案

第5章_酸碱滴定法答案1.写出下列溶液的质⼦条件式。
a.c1mol·L-l NH3 + c2mol·L-l NH4Cl;c.c1mol·L-l)H3PO4 + c2mol·L-l HCOOH;解:a. 对于共轭体系,由于构成了缓冲溶液,所以可以将其视为由强酸(HCl和弱碱(NH3)反应⽽来,所以参考⽔准选为HCl, NH3和H2O质⼦条件式为:[ H+ ] + [NH4+] = [Cl-] + [OH-]或[ H+ ] + [NH4+] = c2 + [OH-]c. 直接取参考⽔平:H3PO4 , HCOOH , H2O质⼦条件式:[H+] = [H2PO4-] + 2[HPO42-] + 3[PO43-] + [HCOO-]+[OH-] 2.计算下列各溶液的pH3.计算下列各溶液的pHi.mol·L-l HCI和mol·L-l氯⼄酸钠(ClCH2COONa)混合溶液。
解: a NaAc为⼀元弱碱, 其K b=K w/K HAc=×10-10i. 由于ClCH2COONa + HCl = ClCH2COOH + NaCl所以原溶液可以看成L的ClCH2COOH和LHCl的混合溶液设有x mol/L的ClCH2COOH发⽣离解,则ClCH2COOH ?ClCH2COO- + H+x + x所以有(0.01)0.05x xx+-= Ka= ?10-3解得x = ?10-3mol/L那么[H+] = L pH = -log [H+] =4.⼈体⾎液的PH为,H2CO3,HCO3-和CO2-在其中的分布分数各为多少H2CO3 Ka1=×10^-7 Ka2=×10^-11(引⾃张祖德⽆机化学) H2CO3的分布分数=[H+]^2 / { [H+]^2 + [H+]×Ka1 + Ka1×Ka2} =[10^]^2 / {[10^]^2+ [10^]××10^-7 + ×10^-7 ) ××10^-11}=HCO3-的分布分数= [H+]×Ka1 / { [H+]^2 + [H+]×Ka1 + Ka1×Ka2}= {10^××10^-7}/ {[10^]^2+ 10^××10^-7 + ×10^-7 ××10^-11}=CO32-的分布分数= Ka1×Ka2/ { [H+]^2 + [H+]×Ka1 + Ka1×Ka2}= {×10^-7 ××10^-11}/ {[10^]^2+ 10^××10^-7 + ×10^-7 ××10^-11}=5.某混合溶液含有 mol·L -l HCl 、×10-4 mol·L -l NaHSO 4和×10-6 mol·L -l HAc 。
分析化学 第五章 酸碱滴定法(习题)

第五章 酸碱滴定法一、选择题1、 浓度为c(HAc)(mol .L -1)的HAc 溶液中加入c(HCl)(mol .L -1) HCl 和c(NaOH)(mol .L -1)NaOH 后的质子平衡方程是 A. [H +]+ c(HCl)=[Ac -]+ c(NaOH)+[OH -] B. [H +]=[Ac -]+ c(NaOH)+[OH -] + c(HCl) C. [H +]+ c(HCl) + c(NaOH)=[Ac -]+[OH -] D. [H +]+ c(NaOH) =[Ac -]+ c(HCl)+[OH -] 答案:D2、 下列各组酸碱对中,属于共轭酸碱对的是A. H 2CO 3—CO 32-B. H 3O +—OH -C. HPO 42-—PO 43-D. NH 3+CH 2COOH —NH 2CH 2COO - 答案:C3、 用0.10 mol .L -1 NaOH 溶液分别滴定25mL 某一H 2SO 4和HCOOH 溶液,若消耗的NaOH 体积相同,则这两种溶液中H 2SO 4和HCOOH 浓度之间的关系是 A. c(HCOOH)=c(H 2SO 4) B. 4c(HCOOH)=c(H 2SO 4)C. c(HCOOH)=2c(H 2SO 4)D. 2c(HCOOH)=c(H 2SO 4) 答案:C解: 2NaOH~1H 2SO 4,1NaOH~1HCOOH ,消耗的NaOH 体积相同,HCOOH SO H c c 2142=。
4、 今有0.20 mol .L -1二元弱酸H 2B 溶液30mL ,加入0.20 mol .L -1 NaOH 溶液15mL时的pH= 4.70;当加入30mLNaOH 时,达到第一化学计量点的pH= 7.20。
则H 2B 的2a pK 是 A. 9.70 B. 9.30 C. 9.40 D. 9.00 答案:A解:中和到pH= 4.70时,溶液成为1:1:2=NaHB B H c c 的缓冲溶液,70.411lg 70.4lglg2121=-=-=⇒+=--BH HB a BH HB a c c pH pK c c pK pH达到第一化学计量点时,溶液成为0.10 mol .L -1 NaHB 溶液][)][(][121--+++=HB K K HB K K H a W a a当 c HB ≈-][,W a K c K 202>,120a K c >21][a a K K H =∴+,即 )(2121a a pK pK pH +=70.970.420.72212=-⨯=-=a a pK pH pK5、 用标准NaOH 溶液滴定同浓度的HAc ,若两者的浓度均增大10倍,以下叙述滴定曲线pH 突跃大小,正确的是 A. 化学计量点前后0.1%的pH 均增大B. 化学计量点前0.1%的pH 不变,后0.1%的pH 增大C. 化学计量点前0.1%的pH 减小,后0.1%的pH 增大D. 化学计量点前后0.1%的pH 均减小 答案:B解:化学计量点前0.1%形成的是NaAc —HAc 缓冲溶液HAcAc HAc a c c pK pH -+=lg)(,)前()前(21pH pH =∴化学计量点后0.1%形成的是NaAc —NaOH 溶液,)(lg 14过量NaOH c pH -= NaOH 的浓度增大,pH 也增大。
第5章 酸碱滴定法4
酚酞
Na2HPO4 HCl NaCl
(无色,V1mL) 无色, 无色
甲基橙
NaH2PO4
(红色,V2mL) 红色, 红色
C Na 3PO 4
C(V1 − V2 ) HCl (CV2 ) HCl −1 C NaOH = mol ⋅ L−1 = mol ⋅ L V试液 V试液
2
5、NaAc: kb=5.6×10-10 不能滴定 、 × HCl+NaAc=HAc+NaCl ka=1.8×10-5 × HCl,HAc , 若能滴定必须 ∴不合理 6、pH=10.5 、 cHCl cHAc >10-2mol.L-1
c HCl 且 > 5, E r > 1%, 也较大 c HAc
Na2CO3+HAc=NaAc+NaHCO3 2NaOH→HAc
C HAc (CV ) NaOH = V试样
多用了NaOH,结果偏高 , 多用了 Na2CO3+2HCl=2NaCl+H2O+CO2 故无影响
11
②2NaOH+CO2= Na2CO3 NaOH+HCl=NaCl+H2O 2NaOH→ Na2CO3→2HCl
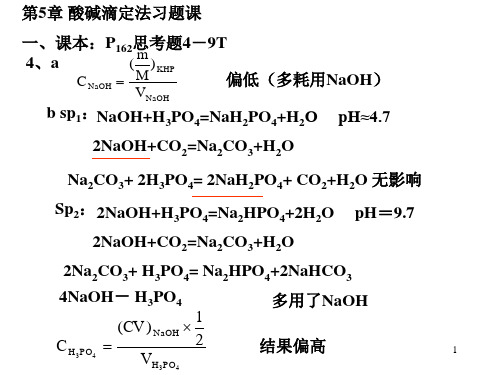
第5章 酸碱滴定法习题课 章 思考题4- 一、课本:P162思考题 -9T 课本: m 4、a ( ) KHP 、 偏低(多耗用NaOH) 偏低(多耗用 ) C NaOH = M
VNaOH
b sp1:NaOH+H3PO4=NaH2PO4+H2O 2NaOH+CO2=Na2CO3+H2O
pH≈4.7
Na2CO3+ 2H3PO4= 2NaH2PO4+ CO2+H2O 无影响 Sp2: 2NaOH+H3PO4=Na2HPO4+2H2O 2NaOH+CO2=Na2CO3+H2O 2Na2CO3+ H3PO4= Na2HPO4+2NaHCO3 4NaOH- H3PO4 -
8第五章酸碱滴定法原理,终点误差

ep HCl
sp
设ΔpH = pHep-pHsp 则 pH log[H ]ep ( log[H ]sp )
[ H ]sp pH log[H ]sp log[H ]ep log [ H ]ep 则 10pH [ H ]sp [ H ]ep
Ka 2 Ka1 (10pH 10 pH ) Cep1 Cep1
说明:① ΔpH = pHep-pHsp;pHep= pKHIn;pHsp根据化学 计量点溶液组成计算 ②Et只取决于ΔpH、Ka1和Ka2,与Kt和Cep没有关系。 ③多元酸第二个sp公式类似,不过要多除以2,并注意ka下标。 因为滴定2个H+,化学计量关系为1:2,公式如下
5.8 终点误差
1.强酸碱的滴定 2.一元弱酸碱的滴定 3.强碱滴定多元弱酸、混合酸
① 写出滴定终点ep时溶液的质子条件。根据质子条件 导出误差浓度的表达式。 ② 根据终点误差的定义,应用上面的表达式,逐步推 导整理得到终点误差计算公式。 n(过量或不足的滴定剂 )
Et n(应加入的滴定剂 )
书写终点误差计算公式的简单方法
① 写出sp时溶液的质子条件。明确得质子产物和失质 子产物。 ② 根据下面公式写出终点误差计算通式。 碱滴酸: 酸滴碱:
Et 失质子产物浓度和-得 质子产物浓度和 ep C酸 得质子产物浓度和-失 质子产物浓度和 ep C碱
Et
注意:这是化学计量关系为1:1时的情况,如果不是1:1 还要在分母中乘以一个系数。
10 Et
第五章 酸碱滴定法

第五章 酸碱滴定法一、内容提要本章讨论了水溶液中的酸碱滴定,它是以水溶液中的质子转移反应为基础的滴定分析法,其理论基础是酸碱平衡理论。
根据质子理论,凡能给出质子(H +)的物质是酸;凡能接受质子(H +)的物质是碱。
HA === A - + H +酸 碱 质子在溶剂水中酸碱的离解、盐水解、酸碱中和反应等都是通过水合质子实现质子转移过程,是由两个共轭酸碱对相互作用而达到平衡,该平衡反应总是由较强酸碱向生成较弱酸碱的方向进行。
在酸碱滴定法中,常借助酸碱指示剂来指示终点。
当酸碱滴定至化学计量点前后,其pH 值急剧变化,从而产生滴定突跃。
凡是变色点的pH 值处于滴定突跃范围内的指示剂均可用来指示终点。
由化学计量点与滴定终点不符合所引起的误差称为滴定误差,其大小由被滴定溶液中剩余酸(或碱)或多加碱(或酸)滴定剂的量决定。
一元酸碱滴定的可行性判据是C ·K a (b )≥10-8,多元酸碱的分步滴定及混合酸碱分别滴定的判据是C ×K (a )b ≥10-8和 >104。
本章重点是酸碱指示剂及强酸(强碱)的滴定,酸碱滴定可行性判据。
本章难点是酸碱滴定曲线。
二、 习题(一)判断题( )1.pH 值小于7的溶液一定是酸。
( )2.在酸碱滴定法中,为保证化学计量点附近相差0.1%,有0.2pH 单位的变化是指示剂法进行准确滴定的最低要求,因此,通常以C·K a ≥10-8作为判断弱酸能否被准确滴定的界限。
( )3.在酸碱滴定法中,用强碱滴定强酸时,滴定突跃范围越小,则滴定误差越小,准确度越高。
21b b K K()4.对于多元酸,应首先看相邻两级K a的比值是否大于104,如果大于104,则能够准确地分步滴定。
()5.酸碱指示剂为有机弱酸或弱碱,且其酸式和碱式结构具有不同的颜色。
()6.用已知浓度的NaOH标准溶液,滴定相同浓度的不同种弱酸时,若弱酸的K a 愈大,则滴定突跃范围愈大。
中国药科大学 分析第5章_酸碱滴定法

pH = 9.70
2021年1月
22
2.滴定曲线的形状
pH
❖ 滴定开始至滴入
14
19.98mlNaOH,⊿pH微小
12
⊿pH=3.3 曲线平坦
10
❖ SP前后0.1%,⊿pH ↑↑ ,
8
⊿pH=5.4 曲线几乎直线上升6Fra bibliotek计量点4
❖ SP后继续滴NaOH,强碱
2
缓冲区,⊿pH↓ 曲线平坦
10
20
30 40 VNaOH
❖ 1.指示剂的用量 ❖ 2.温度的影响 ❖ 3.溶剂的影响 ❖ 4.滴定程序
2021年1月
11
1.指示剂的用量
❖ 尽量少加,但不能太少,否则终点 不敏锐 指示剂本身为弱酸碱,多加增大滴 定误差
例:50~100mL溶液中
加入酚酞 2~3滴,pH=9变色 加入酚酞15~20滴,pH=8变色
2021年1月
2
一、 指示剂的变色原理
❖指示剂的特点
a.弱的有机酸、碱
b.酸式色和碱式色颜色明显不同→ 指示终点
c.溶液pH变化→指示剂结构改变→ 指示终点变化
2021年1月
3
一、 指示剂的变色原理
酚酞 HIn + H2O
H3O+ + In-
酸式
碱式
酚酞(pp)
HO
OH
O-
O
OH-
OH C O O-
H+
羟式(无色)
碱滴定酸 → 选酚酞
2021年1月
14
四、 混合指示剂
❖组成
1.指示剂+惰性染料
❖例:甲基橙+靛蓝(紫色→绿色)
第5章 酸碱滴定法1

5.2 酸碱组分的平衡浓度与分布分数δ
5.2.1一元酸(碱)溶液各型体分布分数:
什么分布分数δ: 溶质某种型体的平衡浓度在其分析 浓度中所占的分数称为分布分数。
㈠、一元弱酸碱各型体的分布分数:
1、计算公式:
HA
HA
c HA
HA 1 H HA A 1 K a /H H K a
a、0.10mol/LNa2CO3溶液的MBE为 [H2CO3]+[HCO3-]+[CO32-]==0.1mol/L [Na+]==2C b、0.10mol/LNa2CO3溶液的CBE为 [Na+]+ [H+]==[HCO3-]+2[CO32-]+[OH-] c、合并2[H2CO3]+2[HCO3-]+2[CO32-] +[H+]==[HCO3-]+2[CO32-]+[OH-] 得PBE:2[H2CO3]+[HCO3-]+[H+]=[OH-]
注意:在正确PBE中应不包括质子参考 水准本身的有关项,也不含有与质子 转移无关的项。对于多元酸碱组分一 定要注意其平衡浓度前面的系数,它 等于与零水准相比较时该型体得失质 子的量。
例1、写出Na2CO3溶液的PBE
第一步:选取零水准——H2O, 2CO3 第二步:绘出得失质子示意图 第三步:写出PBE
例:已知HAc的Ka==1.75×10-5, 求Ac-的Ka
已知NH3的Kb 求NH4+的Ka
-5 =1.8×10 ,
5.1.3溶液中的其他相关平衡—物料 平衡、电荷平衡和质子条件
第5章 酸碱滴定法

第五章酸碱滴定法一、判断题(对的打√, 错的打×)1、NaOH滴定HCl,酚酞作指示剂优于甲基橙,而HCl滴定NaOH,则相反。
()2、酸碱滴定分析中,滴定至溶液中指示剂恰好发生颜色变化时即为化学计量点。
()3、强酸滴定强碱的pH滴定突跃与所选指示剂的变色范围有关。
()4、强碱滴定弱酸,pH滴定突跃随滴定剂的浓度增大而增大,随弱酸的强度减小而减小。
()5、滴定反应都必须有明确的计量关系。
()6、在酸碱滴定中,选择强酸强碱作为滴定剂的理由是强酸强碱可以直接配制标准溶液。
()二、选择题1.质子理论认为,下列物质中全部是碱的是()A.HAc、H3PO4、H2O B.Ac-、PO43-、H2OC.HAc、H2PO4-、OH-D.Ac-、PO43-、NH4+2.用质子理论比较下列物质的碱性由强到弱顺序为()A.CN->CO32->Ac->NO3-B.CO32->CN->Ac->NO3-C.Ac->NO3->CN->CO32-D.NO3->Ac->CO32->CN-3.在下列化合物中,其水溶液的pH值最高的是()A.NaCl B.NaHCO3C.NH4Cl D.Na2CO34.在pH=6.0的溶液中,下列物质浓度最大的为()A.H3PO4B.H2PO4-C.HPO42-D.PO43-5.在110ml浓度为0.1mol·l-1的HAc中,加入10ml浓度为0.1 mol·l-1的NaOH溶液,则混合溶液的pH值为(已知HAc的pKa=4.75)()A.4.75 B.3.75 C.2.75 D.5.756.欲配制pH=9.0的缓冲溶液,应选用()A.甲酸(pK a4.0)及其盐B.HAc-NaAc C.NH3—NH4+D.六亚甲基四胺7.下列混合物溶液中,缓冲容量最大的是()A.0.02 mol·l-1NH3—0.18 mol·l-1NH4Cl B.0.17 mol·l-1NH3—0.03 mol·l-1NH4ClC .0.15 mol·l -1NH 3—0.05 mol·l -1NH 4ClD .0.10 mol·l -1NH 3—0.10 mol·l -1NH 4Cl8.在0.06mol·l -1HAc 溶液中,加入NaAc ,并使c(NaAc)=0.2 mol·l -1。
第5章--酸碱滴定法习题解答

第5章酸碱滴定法思考题与习题1.下列各组酸碱物质中,哪些是共轭酸碱对?(1) OH--H3O+(2) H2SO4-SO42-(3) C2H5OH-C2H5OH2+(4) NH3-NH4+(5) H2C2O4-C2O42-(6) Na2CO3-CO32-(7) HS--S2-(8) H2PO4--H3PO4(9) (CH2)6N4H+-(CH2)6N4(10) HAc-Ac-答:(3)、(4)、(7)、(8)、(9)、(10)是共轭酸碱对。
2. 写出下列溶液的质子条件式。
(1) 0.1 mol/L NH3·H2O (2) 0.1mol/L H2C2O4 (3) 0.1mol/L (NH4)2HPO4(4) 0.1 mol/L Na2S (5) 0.1mol/L (NH4)2CO3 (6) 0.1mol/L NaOH(7) 0.1mol/L H2SO4 (8) 0.1mol/L H3BO3答:(1)[H+]+[ NH4]= [OH-](2)[H+]= [OH-]+[H C2O4-]+2[ C2O42-](3)[H+]+[H2PO4-]+2[ H3PO4]=[NH3]+[PO43-]+[OH-](4)[H+]+[ HS-]+2[ H2S]= [OH-](5)[H+]+[H CO3 -]+2[H2 CO3] = [OH-]+[ NH3](6)[H+]+0.1= [OH-](7)[H+]= [OH-]+[H SO4 -]+2[SO4 2-]或[H+]= [OH-]+0.1+2[SO4 2-](8)[H+]= [ H2BO3-]+[OH-]3. 欲配制pH为5的缓冲溶液,应选下列何种酸及其共轭碱体系?(1) 一氯乙酸(p K a=2.86) (2) 邻苯二甲酸氢钾KHP (p K a2=5.41)(3) 甲酸(p K a=3.74) (4) HAc(p K a=4.74)(5) 苯甲酸(p K a=4.21) (6) HF (p K a=3.14)答:由pH≈pK a可知,应选HAc-NaAc配制pH为5左右的缓冲溶液。
第5章酸碱滴定法5

Kbc 20Kw [OH] Kbc 5.29106
c 500 Kb
pHsp 14 6 0.72 8.72
pH pHep pHsp 8.00 8.72 0.72
TE % 100.72 100.72 100
Ka Kw
c ep HB
0.19 5.25 100 0.05 1.8108 0.05
CB,ep
]ep
B,ep
100
%
其中
B,ep
[OH ]ep [OH ]ep Kb
Ka
[H ]ep Ka
举例:P164 19.
1、用0.1mol/lNaOH滴定0.1mol/lHAc至
pH=8.00。计算终点误差。
解:sp时
cNaOH 0.05mol
L1
Kb
Kw Ka
5.6 1010
终点误差 (end point error,titration errror)
1 强碱滴定强酸 2 强碱滴定一元弱酸 3 强碱滴定多元弱酸
1、强碱(酸)滴定强酸(碱):
以浓度为c(mol/L)强碱NaOH滴定浓度为c0 (mol/L)、体积为V0(mL)的HCl为例:
设滴定到终点时消耗NaOH的体积V(mL),则
滴定至第二化学计量点: 体系: Ac-,为弱碱性物质
[OH ]sp2 Kb,Ac Csp2,Ac
总之:弱酸的强度越弱,越有利于 滴定强酸,弱酸的酸度愈强,越
有利于滴定总酸度。此外,强酸 和弱酸的混合浓度 c1/c2 比例,对 混合酸能否分别滴定也有影响。一 般来说,强酸的浓度愈大,分别滴 定的可能性就愈大,反之愈小。
[H]
K
NH2OH
1.1106 5.61010 0.0500/ 0.050 2.5 108 (mol / L)
第5章酸碱滴定法习题解答

第5章酸碱滴定法思考题与习题1.下列各组酸碱物质中,哪些是共轭酸碱对(1) OH--H3O+ (2) H2SO4-SO42- (3) C2H5OH-C2H5OH2+(4) NH3-NH4+ (5) H2C2O4-C2O42- (6) Na2CO3-CO32-(7) HS--S2- (8) H2PO4--H3PO4 (9) (CH2)6N4H+-(CH2)6N4(10) HAc-Ac-答:(3)、(4)、(7)、(8)、(9)、(10)是共轭酸碱对。
2. 写出下列溶液的质子条件式。
(1) mol/L NH3·H2O (2) L H2C2O4 (3) L (NH4)2HPO4(4) mol/L Na2S (5) L (NH4)2CO3 (6) L NaOH(7) L H2SO4 (8) L H3BO3答:(1)[H+]+[ NH4]= [OH-](2)[H+]= [OH-]+[H C2O4-]+2[ C2O42-](3)[H+]+[H2PO4-]+2[ H3PO4]=[NH3]+[PO43-]+[OH-](4)[H+]+[ HS-]+2[ H2S]= [OH-](5)[H+]+[H CO3 -]+2[H2 CO3] = [OH-]+[ NH3](6)[H+]+= [OH-](7)[H+]= [OH-]+[H SO4 -]+2[SO4 2-]或[H+]= [OH-]++2[SO4 2-](8)[H+]= [ H2BO3-]+[OH-]3. 欲配制pH为5的缓冲溶液,应选下列何种酸及其共轭碱体系(1) 一氯乙酸(p K a= (2) 邻苯二甲酸氢钾KHP (p K a2=(3) 甲酸(p K a= (4) HAc(p K a=(5) 苯甲酸(p K a= (6) HF (p K a=答:由pH≈pK a可知,应选HAc-NaAc配制pH为5左右的缓冲溶液。
4.以NaOH或HCl溶液滴定下列溶液时,在滴定曲线上出现几个滴定突战跃分别采用何种指示剂确定终点(1) H2SO4 (2) HCl+NH4Cl (3) NH3·H2O+NaOH(4) H2C2O4 (5) HF+HAc (6) Na2HPO4+NaOH(7) H3PO4 (8) Na2CO3+Na3PO4 (9) HCl+H3PO4答:5. 下列各物质的浓度均为 mol/L,能否用等浓度的强酸强碱标准溶液滴定如果能够,应选用哪种指示剂确定终点(1) 苯酚(p K a= (2) NaHS(p K a2=, p K b2=(3) 吡啶(p K b= (4) NaF (HF的p K a=(5) 苯甲酸(p K a= (6) HAc(p K a=答:(2)NaHS(p K a2=, p K b2=,可用HCl标准溶液滴定,甲基橙为指示剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.写出下列溶液的质子条件式。
a.c1mol·L-l NH3 + c2mol·L-l NH4Cl;c.c1mol·L-l)H3PO4 + c2mol·L-l HCOOH;解:a. 对于共轭体系,由于构成了缓冲溶液,所以可以将其视为由强酸(HCl和弱碱(NH3)反应而来,所以参考水准选为HCl, NH3和H2O质子条件式为:[ H+ ] + [NH4+] = [Cl-] + [OH-]或[ H+ ] + [NH4+] = c2 + [OH-]c. 直接取参考水平:H3PO4 , HCOOH , H2O质子条件式:[H+] = [H2PO4-] + 2[HPO42-] + 3[PO43-] + [HCOO-]+[OH-] 2.计算下列各溶液的pH3.计算下列各溶液的pHi.0.060 mol·L-l HCI和0.050 mol·L-l氯乙酸钠(ClCH2COONa)混合溶液。
解: a NaAc为一元弱碱, 其K b=K w/K HAc=5.6×10-10i. 由于ClCH2COONa + HCl = ClCH2COOH + NaCl所以原溶液可以看成0.050mol/L的ClCH2COOH和0.010mo/LHCl的混合溶液设有x mol/L的ClCH2COOH发生离解,则ClCH2COOH ClCH2COO- + H+0.05-x x0.01+x所以有(0.01)0.05x xx+-= Ka= 1.4 ⨯10-3解得x = 4.4 ⨯10-3mol/L那么[H+] = 0.0144mol/L pH = -log [H+] = 1.844.人体血液的PH为7.40,H2CO3,HCO3-和CO2-在其中的分布分数各为多少?H2CO3 Ka1=4.30×10^-7 Ka2=5.61×10^-11(引自张祖德无机化学)H2CO3的分布分数=[H+]^2 / { [H+]^2 + [H+]×Ka1 + Ka1×Ka2} =[10^(-7.4)]^2 / {[10^(-7.4)]^2+ [10^(-7.4)]×4.30×10^-7 + (4.30×10^-7 ) ×5.61×10^-11} =0.085HCO3-的分布分数= [H+]×Ka1 / { [H+]^2 + [H+]×Ka1 + Ka1×Ka2}= {10^(-7.4)×4.30×10^-7}/ {[10^(-7.4)]^2+ 10^(-7.4)×4.30×10^-7 + 4.30×10^-7 ×5.61×10^-11}=0.914CO32-的分布分数= Ka1×Ka2/ { [H+]^2 + [H+]×Ka1 + Ka1×Ka2} = {4.30×10^-7 ×5.61×10^-11}/ {[10^(-7.4)]^2+ 10^(-7.4)×4.30×10^-7 + 4.30×10^-7 ×5.61×10^-11}=0.0015.某混合溶液含有0.10 mol·L -l HCl 、2.0×10-4 mol·L -l NaHSO 4和2.0×10-6 mol·L -l HAc 。
a .计算此混合溶液的pH 。
b .加入等体积0.10 mol·L -l NaOH 溶液后,溶液的pH 。
解:a. HSO 4- K a2=1.0×10-2 HAc K a =1.8×10-5均为弱酸,且浓度远低于HCl 的浓度,所以此体系中的HSO 4-和HAc 在计算pH 值时刻忽略。
故pH=1.00。
b.加入等体积0.1mol/LNaOH 溶液,HCl 被中和,体系变为HSO 4-和HAc 的混酸体系,H +⎡⎤=⎣⎦忽略K W 及K HA [HA], [H + ]2=4HSO K -(C HSO4--[H + ])解得[H + ]=9.90×10-5 故pH=4.006. 将H 2C 2O 4加入到0.10 mol ·L -1Na 2CO 3溶液中,使其浓度为0.020 mol ·L -1,求该溶液的pH ?(H 2C 2O 4:pKa 1=1.20,pKa 2=4.20;H 2CO 3:pKa 1=6.40;pKa 2=10.20)7.已知Cr 3+的一级水解反应常数为10-3.8,若只考虑一级水解,则0.010 mol·L -l Cr(ClO 4)3 的pH 为多少? 此时溶液中Cr(OH)2+的分布分数是多大?解:1)3.82 5.8a K 10101010Wc K ---⋅=⨯=1.8a 10100K c=<2a a a 3K K 4K 1.18210cH +--++⎡⎤==⨯⎣⎦ mol/L故pH=2.932)2 3.8a 3.8 2.93()a K 100.121010K Cr OH H δ+---+===+⎡⎤+⎣⎦8.欲使100 ml 0.10 mol ·L -1HCl 溶液的pH 从1.00增加至4.44,需加入固体NaAc 多少克(忽略溶液体积的变化)?9.今用某弱酸HB 及其盐配制缓冲溶液,其中HB 的浓度为0.25 mol·L -l 。
于100mL 该缓冲溶液中加入200 mg NaOH(忽略溶液体积的变化),所得溶液的pH 为5.60。
问原来所配制的缓冲溶液的pH 为多少? (已知HB 的6a 5.010K -=⨯)解:2000.0540100NaOH C ==⨯(mol/L )已知p K a =5.30,pH=5.60设原缓冲溶液中盐的浓度为x mol/L ,故0.055.60 5.30lg0.25x x +=+-得x=0.35 则原缓冲溶液pH=0.355.30lg5.440.25+=10. 欲配制pH 为3.0和4.0的HCOOH-HCOONa 缓冲溶液,应分别往200ml 0.20 mol ·L -1HCOOH 溶液中加入多少毫升1.0 mol ·L -1 NaOH 溶液。
解x=25.7ml11.配制氨基乙酸总浓度为0.10 mol·L-l的缓冲溶液(pH=2.0)100mL,需氨基乙酸多少克?还需加多少毫升1 mol·L-l酸或碱,所得溶液的缓冲容量为多大?解:设酸以HA表示,p K a1=2.35 p K a2=9.601)需HA质量m=0.10×100×75.0×310-=0.75(g)2)因为氨基乙酸及质子化氨基乙酸构成缓冲溶液,设pH=2时,质子化氨基乙酸浓度为xmol/L,则1lg HAaHAc HpH pKc H-++⎡⎤+⎣⎦=+⎡⎤-⎣⎦即0.12.00 2.35lgx Hx H++⎡⎤-+⎣⎦=-⎡⎤-⎣⎦,解得x=0.079生成0.079mol/L的质子化氨基乙酸,需加酸为0.079×100=7.9ml12. 称取20 g六亚甲基四胺,加浓HCl(按12mol·L-1计)4.0ml,稀释至100ml ,溶液的pH 是多少?此溶液是否是缓冲溶液?13.计算下列标准缓冲溶液的pH(考虑离子强度的影响),并与标准值相比较。
a .饱和酒石酸氢钾(0.034 0 mol·L -l ); c .0.010 0 mol·L -l 硼砂。
解:a. p K a1=3.04,p K a2=4.37I= 1(10.03410.034)0.0342⨯+⨯=(mol/L ),查表得,900H a +=,400HB a -=,2500B a -=故lg 0.51210.0610.003289000.034H γ+=⨯=-+⨯⨯,得0.871H γ+=同理可得0.84HB γ-=,20.51B γ-=又a2K 20W c K ⋅> a120K c>最简式200121221a a a a HBH K K K K γγ+-+⎡⎤=⋅=⋅⎣⎦200454129.110 4.310 2.76100.514a a H H BK K a H γγ++---+-⋅⨯⨯⨯⎡⎤====⨯⎣⎦pH=3.56c. c=0.0100 mol/L ,p K a1=4,p K a2=91(0.020010.02001)0.022I =⨯+⨯=24723323522B O H O H BO H BO --+→+查表23400H BO a -=230.02lg 0.512110.003284000.02H BO γ-=⨯⨯+⨯⨯ 故230.869H BO γ-=3323H BO H H BO +-+ K=5.8×10-1023231010105.810 5.810 6.67100.020.869H H BO H BO a c γ+-----⨯⨯===⨯⋅⨯故pH=9.1814. 用0.200 mol ·L -1Ba(OH)2滴定0.1000 mol ·L -1HAc 至化学计量点时,溶液的pH 等于多少?pOH=5.18 pH=8.8215. 二元弱酸H 2B ,已知pH=1.92时,δH 2B=δHB-;pH=6.22时,δHB-=δB 2-。
计算:a. H 2B 的Ka 1和Ka 2;b. 若用0.100 mol ·L -1NaOH 溶液滴定0.100 mol ·L -1 H 2B ,滴定至第一和第二化学计量点时,溶液的pH 各为多少?各选用何种指示剂?b. sp1时组成为HB -, c HB =0.0500 mol/L16. 解: 已知10.1mol L -⋅一元弱酸HB 的 3.0pH =,问其等浓度的共轭碱NaB 的pH 为多少?(已知:10a w K c K >,且/100a c K >)解:据题意:[]a H K c+=325(10)/10a K c --==910wb aK K K -== 10a w K c K > /100a c K >915101010b OH K c ----==⨯=14.0 5.09.0pH =-=17. 将H 2C 2O 4加入到0.10 mol ·L -1Na 2CO 3溶液中,使其浓度为0.020 mol ·L -1,求该溶液的pH ?(H 2C 2O 4:pKa 1=1.20,pKa 2=4.20;H 2CO 3:pKa 1=6.40;pKa 2=10.20)18. 称取纯一元弱酸HB 0.8150 g ,溶于适量的水中,以酚酞为指示剂,用0.1100 mol ·L -1 NaOH 溶液滴定至终点时,消耗24.60ml 。
