5-2官能团的转化
有机化学官能团相互转化

有机化学官能团相互转化5-fH 3O +Hg 2+ / CH 3CN (aq)C=C-OR C=C-SROCH 3OH 3O+SCH 3OHg 2+3OH 3O Hg 2+3H 3O +OO O SSS SSRSR O O OR OR 5-gHg 2+ / H 3O +H 3O + / solv (aq)H 3O + / solv (aq)Hg 2+ / H 3O +OR OROH OHH 3O + / solv (aq)a very common protecting group, deprotect back to ketoneHC OEt OEt OEtRMgX / H 3O +HC OEt OEt OEtRMgXRCHON H+2Cr 2O 7-2N HCl.CrO 3Ag 2O:1. a mild oxidizing agent2. must be freshly prepared: NaOH into AgNO 3 (aq)3. may involve surface change, react with CO 2, lightSwern oxidation: (DMSO, oxalyl chloride, Et 3N)drawback: react at low T Collins reagent: (CrO 3 - 2 Py)1. drawback: use 6 equivalent, a messy reaction 2. must be very dry, fire easily; purify by CaH 23. an old oxidizing material, isolated by Collin.i. PCCii. PDCix. K 2R C OHO aldehyde1st alcohol2nd alcohol1st alcoholR C OHOR C ROR C HO 5-h i. PCC ii. PDCJOC, 1985, 50, 1332.N OCH 3OHPDC (pyridinium dichormate)(H 2Cr 2O 7 + 2 Py)PCC (pyridinium chlorochromate) (Py-HCl-CrO 3)most widely used use 1 - 1.2 eq.Pfitzner-Moffatt oxidationOO BrDMSOO OOH360 %Synth. Commun., 1986, 16, 1343.JOC, 1977, 42, 1991.Synthesis, 1981, 165.O I OOAcAcOpH 6: weak acid buffer, avoid interfere with ketal groupMcMurray reactioni. Corey approach: subtituted-quinone // H 3O +ii. Watt approacha. PhCHO // MCPBA // H 3O +b. ArPhO // MCPBA // H 3O +c. NBS // KOH // H 3O +PhOPh PhOPhNH 2Ph PhNH 2NC O H // H 3O +O O5-i.15-i.2i. Et 3N // H 3O +Nef reactionii. TiCl 3 / pH 1 or 6iii. SiO 2 / NaOH // H 3O + JACS, 1977, 99, 3861.iv. LDA / MoO 5-Py -v. NaOH // CH 3O OH 3O +vi. KMnO 4 / KOHChem. Rev. 1955, 55, 137.5-k IOOOH O(3 eq.)JACS, 2001, 123, 3183.CH 3CHO2. DDQ / TFA.Synthesis, 1979, 537.JCS, 1932, 1875.Ph-F / DMSO 3.1. SeO 2a select oxidantindrect: change to RC-OH followed by oxidation direct:1. DMAPO / DBU / CH 3CN i. DMSO / AgBF 4RBr DMSO / AgBF 4- Me 2SBull Soc. Jpn., 1981, 54, 2221.THL, 1974, 917.2. NaIO 4 / DMFO Br84 %oNaIO 4 / DMF a new method 3. DMSO reagents:ii. DMSO / ZnSRCHBrMeRC(O)MeDMSO BrOH OOH JACS, 2003, 68, 2480.ROAgBFTHL, 1975, 4467.C C R CHOHRR C C HC C R R'R C C HR C C ArR C C HC C R PhR C C Hsteric base, prevent Nu attack n -BuLi: not MeLi, or t -BuLi,fire easily RX: R-Br, R-TOS, RCHO, RC(O)Rn -BuLi / R'CHO // Ac 2O // KO t BuClOMeN Liiii.ii. (Ph 3P)2PdCl 2, CuI, Et 2NH / PhIi. n-BuLi / RX6-b6-a b c d e g 6-aC CC CC Csulfonic acid: PhSO 3H; sulfinic acid: PhSO 2H; sulfenic acid: PhSOHiv. CuI, NaI, Na 2CO 3, RC C CH 2ClR C C HCl CH 2CC R'RCCCH 2CCR'Synthesis, 2000, 691.RCH 2-SO 2Ph RC CHh f iRCH(CO 2H)-CH 3-C(O)-CH 3O OOXCRR'=CHXin fact: convert to C=C firstlyii. protect - deprotecti. move to terminal 6-cNH 2NHKuse: KAPAuse: Co (CO)8 // Fe(NO 3)3, EtOHJACS, 1975, 97, 891.6-duse: i. Br 2 / CCl 4 // KO t Bu6-euse: Pb(OAc)4, LiCl // KO t Bu // Br 2/CCl 4 // KO t Fe(NO 3)3: weak oxidizing agentii. Br 2 // KOHJA CS, 1941, 63, 1180.PhPhPhPh6-fi. NaBH 4, H 3O +, Br 2, KOtBuii. NH 2OH, NaNO 2 / H 2SO 4 // Ac 2O / DMAPiii. LDA, ClPO(OEt)2ON NODMAP:4-N,N-D i m ethyl a minop y ridinemixture ofAc 2O / DMAP:N NC CH 3O6-guse: TsNHNH 2 / EtOH, heatTHL, 1967, 3943.OHO3(l)O(MVK)CH 3CH CH 2Robinson Annulation German invention, as acylating agent LDA: Li N(iPr)2, ignored a long time, re-introduced by Michigan State U. became famous, appeared every week HORLiNH 2 / NH 3 (l)RXuse: LiNH 2 / NH 3 (l) / R-XO Cl6-h6-i.JA CS, 1958, 80, 4599.JA CS, 1955, 77, 3293.Me PhHOSO 2CF 3Me C C PhMe CPhJOC, 1978, 43, 364.ArAr'H Br Ar C C Ar'NaOEtvia:Ar Ar'Br i. NaOEt (when X = Br)ii. BuLi (when X = -OSO 2CF 3)heatRCH=CH 2:PBu RCH 2CH 2-O-PBu 3RCH 2CH 2-OHPh-Se-PBu 3Ph-Se-CNmechanism:MCPBA OAc CO 2MeOAcMeO MeO 2CNO 2SeNOAcCO 2MeOAc MeOMeO 2Cminorapplied for reactions: without rearrangement; no regiosiomerC (CO 2H)2 / benzeneOH PhPhOO Cl ClClClOCl Cl NC NCO iii. Pd-C; or Ni; Pt, Rhii. chloronaili. DDQ use base: DBNi. CH 3I / Ag 2ii. HCHO / HCO 222use: heatuse: heatb 7-i. p-TSOH.H 2O or CSA ii. weak acid: HOAc; HCO 2H; H 2C 2O 4use:C C HIC C H NH 2C C H OC(S)SMe C C H OAc C C H OMs C C H OH a7-i h gCCX C C C CC CHC O C Cf e dc b a 7--C(O)-CH 3CH-CH CH-CX C-OHjCX-CYNaI / Zn (Cu)i. Zn / acetonei. CSCl 2/C COMs OMs C C BrBrCCOH OHc7-CCOH Iii. CSCl 2 / P(OMe)3P NNPhPOCl 3 / py // Snvia:C C IIapplication: i. protect alkene: via Br 2 // Zn CCCCC 36 o C CCCC=C 31 o C CCCC C Cl Cl 148 o CS OR ORC C BrOAcZn / HOAcOAcO AcOAcOBrOAcZn OOAc OAcOAcJOC, 1978, 43, 364.HOAc/doc/e915102442.html,, 1998, 2113.ii. In / MeOH ii. purify compoundd7-e7-i. WCl 6 / RLi ii. LiPPh 2 / CH 3I product retention product inversionNa R C HC HCH 2CH 2CH 2OH OClRiii. Na(special structure):7-d.7-d.S R 1R 2R 1R 2(EtO)3Puse: (EtO)3PSynthesis , 1977, 1134.via : betaine, oxaphosphetane (NMR)Onot good for Ph 3P=CH 2function as base:expensivedifficult to prepareOEtCNPPh 3CNPPh 3H OPPh 3O CO 2Me+notPh 3P CH EtH C OCO 2Me notPh 3P CH CO 2MeEtH O++++stable ylid gives trans (E)unstable ylid gives cis (Z)water soluble, removed by extraction(comparison: O=PPh 3 highly soluble in organic solvent)use:LiPh SON MeCH 2// Al (Hg)Me 3SiCHR -Li +Ph 3SiCH 2-Li + === Ph 3SiCH 2Br + n-BuLi (exchange)Me 3SiC -H-MgBr === Me 3SiCH 2Cl + Mg (metal reduction) Ph 3SiC -HCH 2Ph === Ph 3SiCH=CH 2 + PhLi (addition to vinylsilane)Me 3SiC -HCO 2Et === Me 3SiCH 2CO 2Et + Li (metalation)Me 3SiCH=PPh 3 === Me 3SiCH 2PPh 3+ X - + KH RO = MeO-, EtO-use: (RO)2PO-CHR'use: Ph 3P-CHR'vi. Sulfoximide (Johnson C.)iii. Silyl Wittig Reaction (Peterson Reaction)ii. Phosphonate Wittig Reaction (Horner-Emmons Modification)i. Wittig Reaction 7-f7-f.Synthesis, 1984, 384.THL, 1981, 2751.JOC, 1968, 33, 780.iv. CH 2(ZnI)2Chem. Lett, 1995, 259.Synlett, 1988, 12, 1369.2CH 2(ZnI)2v. CH 2CHBr 2, Sm, SnI 2 / CrCl 3, THFRO Rvii. Grignard reagent:1. TMSCH MgCluse: TMSCH 2MgClTHL, 1973, 3497.THL, 1988, 4339. 2. NaOAc, AcOHmethylenationOC RR'H advantages over the Wittig:1. by-products are more easily removed,2. reaction suffers less from steric effects.via:(olefination reaction)1953 discover7-f.2not for Wittig, ylid unstableJOC, 1978, 43, 3253.JACS, 1974, 96, 4706.Chem. Lett, 1973, 1041.TiCl 3-LiAlH 4 / THF TiCl 3 / Mg TiCl4 / Zn TiCl 4 / K ii. McMurry Couplingi. use: N 2H 4 / H 2S / Pb(OAc)4BASF, 1973, 2147.via:Zn-CuP(OEt)1. H 2S2. Pb(OAc)431. H 2S2. Pb(OAc)4OON SN N N OSN NSON ON NNN NON NO OSO ON NOO OO OTiCl 3N 2H 4。
2023届高三化学高考备考二轮复习题型突破五 有机合成及合成路线课件

和H2O。
(7)已知
+CO2,则以 为原料合成
的条件下发生取代反应生成
,
再与CH3COCl发生取代反应生成
再与AlCl3反应可得到
再依次与NaOH熔融、HCl反应生成
,
。
时,可先将 与浓硫酸在加热
氧化可得到
,
,
4.[2022·广东化学]基于生物质资源开发常见的化工原料,是绿色化学的重要研究方
回答问题:
(1)A→B的反应类型为
。
答案:(1)取代反应或磺化反应
(2)已知B为一元强酸,室温下B与NaOH溶液反应的化学方程式为
。
答案:(2)
(3)C的化学名称为
,D的结构简式为
答案:(3)苯酚
(4)E和F可用
(写出试剂)鉴别。
答案:(4)FeCl3溶液(或其他合理答案)
。
(5)X是F的同分异构体,符合下列条件。X可能的结构简式为
得苯环上的取代基中含1个羟基;分子中苯环上只含有1个取代基,则该取代基的结
构为
、
、
、
(1、2、3、4均表示羟基的连接位置),即满足条
件的化合物I的同分异构体共有12种。其中,苯环侧链上有3种不同化学环境的氢原
子,且个数比为6∶2∶1的同分异构体应含有两个等效的甲基,则其结构简式为
或
。
2.[2022·湖北化学]化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:
合物a反应得到2 mol Ⅴ,则化合物a为
。
答案:(4)乙烯
解析:(4)化合物Ⅳ到化合物Ⅴ的反应是原子利用率100%的反应,且1 mol Ⅳ与1
新教材人教版高中化学选择性必修三 3-5 有机合成 知识点梳理

第五节有机合成一、有机合成的主要任务(一)构建碳骨架:1、碳链的增长:(1)炔烃与氢氰酸的加成反应(2)醛与氢氰酸的加成反应(3)酮与氢氰酸的加成反应(4)羟醛缩合反应:醛分子中在醛基邻位碳原子上的氢原子(α-H)受羰基吸电子作用的影响,具有一定的活泼性。
分子内含有α-H的醛在一定条件下可发生加成反应,生成β-羟基醛,该产物易失水,得到α,β-不饱和醛。
这类反应被称为羟醛缩合反应。
(5)加聚反应2、碳链的缩短:(1)烷烃的分解反应:(2)烯烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮(3)炔烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮举例:(4)芳香烃的侧链被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸OHOHBrBrBr3、成环反应:(1)第尔斯-阿尔德反应:共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃,如1,3-丁二烯)与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德反应( Diels-Alder- reaction),得到环加成产物,构建了环状碳骨架。
例如:(2)形成环酯:(二)引入官能团1、引入碳碳双键:(1)醇或卤代烃的消去反应:CH 3CH 2OH浓硫酸 170℃CH 2=CH 2↑+H 2OCH 3CH 2Br +NaOH ――→乙醇△CH 2===CH 2↑+NaBr +H 2O (2)炔烃与氢气、卤化氢、卤素单质的不完全加成反应:CH≡CH+HCl催化剂 △CH 2=CHCl2、引入碳卤键:(1)烷烃或苯及其同系物的取代反应:CH 3CH 3+Cl 2−−→−光照CH 3CH 2Cl+HCl(2)醇或酚与氢卤酸的取代反应:CH 3CH 2OH +HBr ∆−−→ CH 3CH 2Br +H 2O +3Br 2→3HBr+ ↓C OCH 3CH3C CH 3OHHCH 3还原(3)烯烃或炔烃与卤素单质或卤化氢的加成反应:CH 2=CH 2+Br 2→CH 2BrCH 2BrCH≡CH+HCl催化剂 △CH 2=CHCl3、引入羟基:(1)烯烃与水加成:CH 2=CH 2+H 2O ∆−−−−→催化剂,加压CH 3CH 2OH (2)醛或酮与H 2加成:CH 3CHO +H 2催化剂 △CH 3CH 2OH+H 2催化剂△(3)卤代烃的水解反应:CH 3CH 2Br +NaOH ――→水△CH 3CH 2OH +NaBr (4)酯的水解反应:CH 3COOC 2H 5+H 2O 24H SO ∆稀CH 3COOH+C 2H 5OH(5)酚盐溶液与CO 2、HCl 等反应:4、引入醛基(或酮羰基):(1)醇的催化氧化:2CH 3CH 2OH+O 2gCu A ∆−−−→或 2CH 3CHO+2H 2O(2)某些烯烃被酸性高锰酸钾溶液氧化的反应:5、引入羧基:(1)醛的氧化反应:2CH 3CHO+O 2Cu∆−−→2CH 3COOH (2)酯的水解反应:CH 3COOC 2H 5+H 2O24H SO ∆稀 CH 3COOH+C 2H 5OH(3)某些烯烃、苯的同系物被酸性高锰酸钾溶液氧化的反应:4()KMnO H +−−−−−−→被氧化COOH(4)伯醇被酸性高锰酸钾溶液氧化的反应:(三)官能团的转化1、利用衍变关系进行转化:醇−−→−氧化醛−−→−氧化羧酸R CHCH2X X R CH CH 2OHOHC H3CH CH 3OH2、增加官能团个数:R-CH 2-CH 2OH −−→−消去R-CH=CH 2−−−→−加成与2X −−→−水解3、改变官能团位置:CH 3CH 2CH 2OH −−→−消去CH 3CH=CH 2−−→−加成 (四)官能团的消除1、加成−−→−消除不饱和键 2、取代、消去、酯化、氧化−−→−消除羟基 3、加成、氧化−−→−消除醛基 4、消去、水解−−→−消除卤原子 5、水解−−→−消除酯基 (五)官能团的衍变(六)官能团的保护——羟基的保护二、有机合成路线的设计与实施(一)分析方法1、正合成法:原料→中间产物→产品2、逆合成法:产品→中间产物→原料3、综合比较法:原料→中间产物←目标产物(二)原则1、原料溶剂和催化剂尽可能价廉易得、低毒性、低污染2、尽量选择步骤最少的合成路线,步骤越少,产率越高。
高中化学选修五-第三章第四节-有机合成
③2mol-OH或2mol-COOH与活泼金属反应放出1molH2。
④1mol-COOH与碳酸氢钠溶液反应放出1molCO2
⑤1mol一元醇与足量乙酸反应生成1mol酯时,其相对分子 质量将增加42,1mol二元醇与足量乙酸反应生成酯时,其相 对分子质量将增加84。
解析:由题意可知,C不是甲酸,E为酮(分子中含碳原子数≥3),
故A可能为
或
。
• 答案:B
25
解有机物综合推断类试题的常用方法 (1)逆推法。由产物推断未知反应物或中间产物时叫逆推法。 (2)根据反应条件推断。在有机合成中,可以根据一些特定反应的 条件,推出未知有机物的结构简式。如“N―aO― △H→/醇”是卤代烃消去的条 件;“ N―aO△―H→/水 ”是卤代烃水解的条件,“ 浓― 17―硫0 →℃酸 ”是乙醇消去的条 件,“浓硫酸,△”是羧酸和醇发生酯化反应的条件。
(1).碳骨架构建:构建方法会以信息形式给出。 包括碳链增长和缩短 、成环和开环等。
(2.官能团的引入和转化: (1)官能团的引入:
思考与交流
1、引入碳碳双键的三种方法: 卤代烃的消去;醇的消去;炔烃的不完全加成。
2、引入卤原子的三种方法:
醇(或酚)的取代;烯烃(或炔烃)的加成;
烷烃(或苯及苯的同系物)的取代。
•2020/2/14 ⑩遇浓硝酸变黄的有机物为: 蛋白质
1717
寻找题眼.确定范围---【有机物·条件】
①当反应条件为NaOH醇溶液并加热时,必定为 卤代烃的消去反应。 ②当反应条件为NaOH水溶液并加热时,通常为 卤代烃或酯的水解反应。
③当反应条件为浓H2SO4并加热时,通常为
高中化学学习细节(人教版)之有机合成及糖类、油脂、蛋白质:官能团的变化Word版含解析

高中化学学习细节(人教版)之有机合成及糖类、油脂、蛋白质:官能团的变化Word版含解析有机合成是高考中不可缺少的题型,其命题方式如下:? 以烃及烃的衍生物的转化关系为内容的考查方式。
? 有机合成推断中渗透有机实验、有机物的相关信息处理等有机综合性问题。
有机合成的实质和相关知识:有机合成的实质是利用有机基本反应原理,进行必要的官能团反应,合成目标产物。
而有机推断的实质是具体物质的合成流程中的某个环节、物质、反应条件缺省,或通过已知的信息推断出未知物的各种信息。
在推断和合成过程中都常涉及到下列情况:官能团的引入、官能团的消除、官能团的衍变、碳骨架即碳链的增减等。
在解有机合成试题时首先要注意:1(合成方法:识别有机物的类别,含何官能团,以及与之有关的信息。
据现有原料,信息及反应原理,尽可能合理把目标分子分成若干片断,或寻求官能团的引入、转换,保护方法或设法将各片断拼接衍变。
正逆推,综合比较选择最佳方案。
一定要注意有机合成中断的什么线(化学键),连的什么点(原子)。
2(合成原则:原料价廉,原理正确路线简捷,便于操作,条件适宜易于分离,产率高3(解题思路:剖析要合成的物质(目标分子),选择原料,路线(正向、逆向思维,结合题给信息)。
合理的合成路线进行什么基本反应,目标分子骨架。
目标分子中官能团引入。
?原料分子(官能团有何不同)过渡中间产物(碎片分子中的官能团如何转化来的)碎片分子切割(断键部位要合理)目标分子【学习目标】认识有机合成中官能团之间的转化。
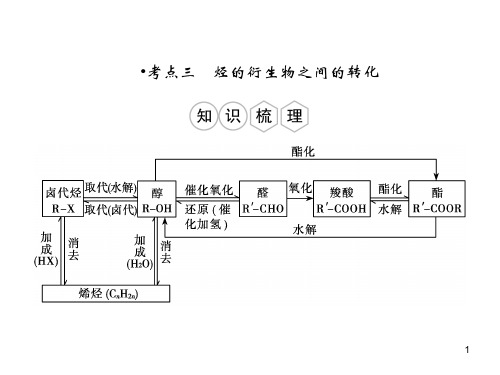
细节诠释一. 官能团的引入引入官能团有关反应烯烃与水加成,醛/酮加氢,卤代烃水解,酯的水解羟基-OH烃与X取代,不饱和烃与HX或X加成,(醇与HX取代) 22卤素原子(,X)某些醇或卤代烃的消去,炔烃不完全加氢碳碳双键C=C某些醇(,CHOH)氧化,烯氧化,糖类水解,(炔水化) 2醛基-CHO醛氧化, 酯酸性水解, 羧酸盐酸化,(苯的同系物被强氧化剂氧化) 羧基-COOH 酯化反应酯基-COO-二. 官能团的衍变:1. 烃和烃的衍生物转变主线2. 官能团的消除(1)与H加成消除不饱和键; 2(2)消去反应消除卤原子而形成新的C,C双键; (3)消去反应、氧化反应或酯化反应等消除羟基(—OH);(4)加成反应或氧化反应等消除醛基(—CHO); (5)酯水解消除酯基。
人教版选修5化学第三章第四节有机合成知识点练习含复习资料

第四节 有机合成人教版选修5化学第三章第四节有机合成学问点练习含答案学问点一 有机合成的过程1.有机合成的概念有机合成是指利用简洁、易得的原料,通过有机反响,生成具有特定构造和功能的有机化合物。
2.有机合成的任务目的化合物分子骨架的构建和官能团的转化。
3.有机合成的过程4.官能团的引入或转化方法 (1)引入碳碳双键的方法①卤代烃的消去,②醇的消去,③炔烃的不完全加成。
(2)引入卤素原子的方法①醇(酚)的取代,②烯烃(炔烃)的加成,③烷烃、苯及苯的同系物的取代。
(3)引入羟基的方法①烯烃、炔烃及水的加成,②卤代烃的水解,③酯的水解,④醛的复原。
1.推断正误(1)乙醇和溴乙烷发生消去反响都生成乙烯,且反响条件也一样。
( )(2)制取氯乙烷时,可以用乙烷和氯气在光照时反响,也可以利用乙烯和氯化氢发生加成反响。
( )(3)乙烯及氯化氢、水能发生加成反响,说明可以利用烯烃引入卤素原子和羟基。
( ) (4)加聚反响可以使有机物碳链增长,取代反响不能。
( ) 答案:(1)× (2)× (3)√ (4)×2.化合物丙可由如下反响得到:C 4H 10O ――→浓硫酸,△C 4H 8――→Br 2溶剂CCl4丙(C 4H 8Br 2),丙的构造简式不行能是( )A .CH 3CH(CH 2Br)2B .(CH 3)2CBrCH 2BrC .CH 3CH 2CHBrCH 2BrD .CH 3(CHBr)2CH 3答案:A3.以H 2O 、H 218O 、空气、乙烯为原料制取,写出相关反响的化学反响方程式。
有机合成中常见官能团的引入或转化1.卤素原子的引入方法(1)烃及卤素单质的取代反响。
例如: CH 3CH 3+Cl 2――→光照HCl +CH 3CH 2Cl(还有其他的氯代苯甲烷)CH 2===CH —CH 3+Cl 2――→△CH 2===CH —CH 2Cl +HCl (2)不饱和烃及卤素单质、卤化氢的加成反响。
2024届高考化学一轮复习教案(人教版)第十一单元 有机化学 第5讲

第5讲羧酸羧酸衍生物复习目标1.掌握羧酸、羧酸衍生物的典型代表物的结构、性质与相互转化。
2.掌握羧酸及其衍生物与其他有机物的相互转化。
3.了解有机分子中官能团之间的相互影响。
一、羧酸1.概念:由01烃基(或氢原子)与02羧基相连构成的有机化合物,官能团为03—COOH ,饱和一元羧酸的通式为04C n H 2n O 2(n≥1)。
2.分类羧,酸HCOOH )、乙酸、硬脂酸HOOC—COOH )3.羧酸的化学性质羧酸的化学性质主要取决于羧基,反应时的主要断键位置如图:(1)酸的通性(以乙酸为例):乙酸是一种弱酸,其酸性比碳酸01强,在水溶液里的电离方程式为02CH 3COOH CH 3COO -+H +。
可以与Na 、NaOH 、Na 2CO 3、NaHCO 3等反应。
(2)酯化反应:酸脱03羟基,醇脱04氢。
如CH 3COOH +C 2H 185OH浓H 2SO 4△05CH 3CO 18OCH 2CH 3+H 2O 。
4.几种重要的羧酸(1)甲酸:俗名蚁酸,是最简单的饱和一元羧酸。
结构:既有01羧基,又有02醛基,具有羧酸与醛的性质。
△(NH4)2CO3+2Ag↓+2NH3+H2O。
银镜反应:HCOOH+2[Ag(NH3)2]OH――→(2)乙酸:CH3COOH,有强烈刺激性气味的无色液体,低于16.6℃凝结成固体,又称03冰醋酸,04易溶于水和乙醇。
(3)乙二酸:,俗名05草酸,属于还原性酸,可用来洗去钢笔水的墨迹。
(4)苯甲酸:,属于芳香酸,可作防腐剂。
二、羧酸衍生物1.酯(1)结构:羧酸酯的官能团为01(酯基),可表示为,饱和一元羧酸与饱和一元醇所生成酯的通式为02C n H2n O2(n≥2)。
(2)物理性质(3)化学性质酯的水解反应原理06。
07。
无机酸只起08催化作用,碱除起09催化作用外,还能中和水解生成的酸,使水解程度增大。
2.油脂(1)油脂的组成油脂的主要成分是一分子01甘油与三分子02高级脂肪酸脱水形成的酯。
第五章双官能团化合物的切断1

O
O Ph
NMe2
工业生产上,利用β-紫罗兰酮为原料制备维生素A的方法,就 是以Reformatzky反应为基础的
O B rC H 2 C O 2 C 2 H 5
Z n
1 )H + C O 2 C 2 H 5 2 )L iA lH 4
3 )C rO 3 ,P y
C H O C H 3 C O C H 3
C H 3 C O C H C O O C 2 H 5+H O C 2 H 5 N a
p K a = 1 6
2、酯的分子内的缩合(Dieckmann Condensation)
O CO2CH2CH3
O OCCHO22CCHH32CH3
CO2CH2CH3 CO2CH2CH3
O CO2CH2CH3
CO2CH2CH3 O
COOR
C2H 5ONa +CH 3COOC2H 5
CH COOC2H 5 +C2H 5OH CH O
COCH 2COOC2H 5 +ROH
C H 3 C H 2 C O 2 C 2 H 5 +(C O 2 C 2 H 5 )2 草 酸 二 乙 酯
1)C2H5ONaCH3CHCOCO2C2H5
2)H3+O, D
H
O
(2) CH3C OC2H5 +CH2COOC2H5
接受体
给予体
O-CH3C OC2H5 产生氧负离子
CH2COOC2H5
O--
(3) CH3C OC2H5
CH3COCH2COOC2H5 +C2H5O-- 生成产物
CH2COOC2H5
C H 3 C O C H 2 C O O C 2 H 5 + N a O C 2 H 5 p K a = 1 1
2-氰基-5氟溴苄合成工艺

2-氰基-5氟溴苄合成工艺
2-氰基-5-氟溴苄是一种重要的有机合成中间体,通常用于制备药物和农药等化合物。
它的合成工艺通常包括以下步骤:
首先,从适当的起始原料出发,通常是对溴苯进行氰化反应得到2-溴苯腈。
接着,通过氟化反应将2-溴苯腈转化为2-氰基-5-氟溴苯腈。
最后,通过还原或者其他反应将2-氰基-5-氟溴苯腈转化为2-氰基-5-氟溴苄。
具体而言,合成工艺可以分为以下几个步骤:
1. 溴苯的氰化,溴苯和氰化钠等反应生成2-溴苯腈。
2. 溴苯腈的氟化,2-溴苯腈经过适当的氟化试剂(如氟化氢气体)进行氟化反应,生成2-氰基-5-氟溴苯腈。
3. 2-氰基-5-氟溴苯腈的还原或其他反应,将2-氰基-5-氟溴苯腈转化为目标产物2-氰基-5-氟溴苄,可以通过还原反应或者其他适当的官能团转化反应来完成。
需要注意的是,合成工艺中需要考虑反应条件、催化剂的选择、反应物的纯度和反应的控制等因素,以确保产物的纯度和产率。
此外,合成工艺中还需要考虑安全性、环保性等方面的因素,选择合
适的工艺路线和操作条件。
总的来说,2-氰基-5-氟溴苄的合成工艺涉及多个步骤和反应条
件的选择,需要综合考虑多个因素,以确保高效、高产率、高纯度
的合成过程。
2019年高考化学真题专题19 有机化学基础(选修)

专题19 有机化学基础(选修)1.[2019新课标Ⅰ]化合物G是一种药物合成中间体,其合成路线如下:回答下列问题:(1)A中的官能团名称是。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。
写出B的结构简式,用星号(*)标出B 中的手性碳。
(3)写出具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式。
(不考虑立体异构,只需写出3个)(4)反应④所需的试剂和条件是。
(5)⑤的反应类型是。
(6)写出F到G的反应方程式。
(7)设计由甲苯和乙酰乙酸乙酯(CH3COCH2COOC2H5)制备的合成路线(无机试剂任选)。
【答案】(1)羟基(2)(3)(4)C2H5OH/浓H2SO4、加热(5)取代反应(6)(7)【解析】【分析】有机物A被高锰酸钾溶液氧化,使羟基转化为羰基,B与甲醛发生加成反应生成C,C中的羟基被酸性高锰酸钾溶液氧化为羧基,则D的结构简式为。
D与乙醇发生酯化反应生成E,E 中与酯基相连的碳原子上的氢原子被正丙基取代生成F,则F的结构简式为,F首先发生水解反应,然后酸化得到G,据此解答。
【详解】(1)根据A的结构简式可知A中的官能团名称是羟基。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,则根据B的结构简式可知B中的手性碳原子可表示为。
(3)具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式中含有醛基,则可能的结构为。
(4)反应④是酯化反应,所需的试剂和条件是乙醇/浓硫酸、加热。
(5)根据以上分析可知⑤的反应类型是取代反应。
(6)F到G的反应分两步完成,方程式依次为:、。
(7)由甲苯和乙酰乙酸乙酯(CH3COCH2COOC2H5)制备,可以先由甲苯合成,再根据题中反应⑤的信息由乙酰乙酸乙酯合成,最后根据题中反应⑥的信息由合成产品。
具体的合成路线图为:,。
【点睛】本题考查有机物的推断和合成,涉及官能团的性质、有机物反应类型、同分异构体的书写、合成路线设计等知识,利用已经掌握的知识来考查有机合成与推断、反应条件的选择、物质的结构简式、化学方程式、同分异构体的书写的知识。
(完整word版)题库 有机I(选择题) (2)

题库 选择题第六章 对映异构1. 下列物质中具有手性的为( )。
(F 表示特定构型的一种不对称碳原子,a 表示一种非手性基团) (b )A. B.C. D.Cl BrH 3C CH3FaCH 3CCH 3BrCl2. 下列化合物中,有旋光性的是 ( b )A.B.C.D.HHCH 3HCH 3CH 3CH 33. 下列化合物中没有手性的为(E 为含有手性碳的基团) ( d )A.B. C. D.HHC C Cba b a C CH 3H 34. 化合物具有手性的主要判断依据是分子中不具有 (d )A. 对称轴B. 对称面C. 对称中心D. 对称面和对称中心 5. 将手性碳原子上的任意两个基团对调后将变为它的 (c )A. 非对映异构体B. 互变异构体C. 对映异构体D. 顺反异构体 6. “构造”一词的定义应该是 ( )A. 分子中原子连接次序和方式B. 分子中原子或原子团在空间的排列方式C. 分子中原子的相对位置7. 对映异构体产生的必要和充分条件是 ( )A. 分子中有不对称碳原子B. 分子具有手性C. 分子无对称中心 8. 对称面的对称操作是 ( )A. 反映B. 旋转C. 反演 9. 对称轴的对称操作是 ( )A. 反映B. 旋转C. 反演10. 由于σ-键的旋转而产生的异构称作为( )异构A. 构造B. 构型C. 构象 11. 下列各对Fischer 投影式中,构型相同的是( )A. B.H CO 2H OH CH 3HO H CO 2H CH 3HCO 2H OHCH 3H 3C H CO 2HOH和和12. 下列化合物中,有旋光性的是 ( )A.B. C. D.ClClBrH HClBrH H ClH Br HCO 2H OH CH 313. 下列有旋光的化合物是 ( )CO 2HCO 2H A.B. C.D.ClClO 2NHO 2C CO 2H NO 2C C CCH 3CH 3ClH 3C14. 下面化合物分子有手性的是( )A. B.C.D.C C CCH 3HH 3C H 3C C C CPh H PhPh C C CC 2H 5H HH 5C 2C C C C 2H5CH 3HH15. 下列化合物中,具有手性的分子是 ( )A.B.C. D.C C CCH 3H HH 3CHOCO 2HCH 2CO 2HCH 2CO 2HHO 2HO 2HH H16. 下列与C 2H 5OH CH 3H等同的分子是( ) HO C 2H 5CH 3HC 2H 5OHHCH 3HCH 3OH C 2H 5A. B. C.17. H 3C H H BrC 2H 5CH 3与 Br H H CH 3CH 3C 2H 5为( ) A. 对映异构体 B. 位置异构体 C. 碳链异构体 D. 同一物质18. HBr CH 3C 2H 5的对映体是 ( )C.A. B.HBr C 2H 5CH 3H 5C 2CH 3BrHH 3CC 2H 5HBr19. H 3C CH CH 3H与 H 3C CH CH 3H是什么关系( )A. 对映异构体B. 位置异构体C. 碳链异构体D. 同一化合物参考答案第六章:1.B 2.B 3.D 4.D 5.C 6.A 7.B 8.A 9.B 10.C 11.A 12.C 13.C 14.D 15.A 16.C 17.D 18.A 19.D第七章 芳烃1. 下列化合物发生亲电取代反应活性最高的是 ( )A. 甲苯B. 苯酚C. 硝基苯D. 萘2. 下列物质中不能发生Friedel-Crafts (付-克)反应的是 ( )A. 甲苯B. 苯酚C. 苯胺D. 萘 3. 下列物质不具有芳香性的是 ( )A. 吡咯B. 噻吩C. 吡啶D. 环辛四烯 4. 下列化合物进行硝化反应时,最活泼的是 ( )A. 苯B. 对二甲苯C. 间二甲苯D. 甲苯5. 下列物质发生亲电取代反应的活性顺序为a. 氯苯 b. 苯酚 c. 苯甲醚 d.硝基苯 e. 苯( )A.b >c >e >a >dB.a >b >c >d >eC.d >a >b >c >eD.e >d >c >b >a 6. 下列化合物进行硝化反应时,最活泼的是 ( )A. 苯B. 对二甲苯C. 甲苯 7. 苯环上的亲电取代反应的历程是 ( )A. 先加成—后消去B. 先消去—后加成C. 协同反应 8. 物质具有芳香性不一定需要的条件是 ( )A. 环闭的共轭体B. 体系的π电子数为4n+2C. 有苯环存在 9. 以下反应过程中,不生成碳正离子中间体的反应是 ( )A.SN1B.E1C.芳环上的亲核取代反应D.烯烃的亲电加成 10. 下列化合物不能进行Friedle-Crafts (付-克)反应的是 ( )A. 甲苯B. 苯酚C. 硝基苯D. 萘 11. 下列化合物哪个没有芳香性? ( )A. 噻吩B. 环辛四烯C. [18]—轮烯D. 奥 12. 下列化合物中,不具有芳香性的是 ( )C.A. B.O+- -D.13. 四种物质发生芳环上亲电取代反应活性最高的是 ( )D.B.C.A.CH 3OHNO 214. 最容易发生亲电取代的化合物是 ( )D.B.C.A.NH 2ClNO 2CH315. 下列化合物中具有芳香性的是 ( )A. B. C.D.Cl ClCl+16. 下列环状烯烃分子中有芳香性的是 ( )A.B.C.D.+17. 苯乙烯用浓的KMnO 4氧化,得到 ( )CH 2CO 2HCH(OH)CH 2OHCH 2CO 2HCO 2HA.B.C.D.18.下列化合物酸性最强的是()C.A.B.D.NO 2CH 3CH 3参考答案第七章:1.B 2.C 3.D 4.C 5.A 6.B 7.A 8.C 9.C 10.C 11.B 12.B 13.B 14.A 15.B 16.B 17.C 18.A第九章 卤代烃1. 一般说来SN2反应的动力学特征是 ( )A.一级反应B. 二级反应C. 可逆反应D. 二步反应 2. 卤代烷的烃基结构对SN1反应速度影响的主要原因是 ( )A. 空间位阻B. 正碳离子的稳定性C. 中心碳原子的亲电性D. a 和c 3. 在卤素为离去基团的SN 反应中,Br 离去倾向比Cl 大的原因是 ( )A. Br 的电负性比Cl 小B. Br 的半径比Cl 大C. 溴离子的亲核性强D. C-Br 键能键能比C-Cl 键能小4. 在N ,N-二甲基甲酰胺(DMF )等非质子极性溶剂中卤素负离子的亲核性大小次序为F ->Cl ->Br ->I -的原因是 ( )A.与卤素负离子的碱性顺序一致B. 这些溶剂的极性小C. 与溶剂形成氢键造成的D. 溶剂使卤素负离子几乎完全裸露5. Walden转化指的是反应中( )A. 生成外消旋化产物B. 手型中心碳原子构型转化C. 旋光方向改变D. 生成对映异构体6. 手型碳原子上的亲核取代反应,若邻位基团参预了反应,则产物的立体化学是( )A. 构型保持B. 构型转化C. 外消旋化D. A、B、C都不对7. 在含水丙酮中,p-CH3OC6H4CH2Cl的水解速度是C6H5CH2Cl的一万倍,原因是( )A.甲氧基的-I效应B. 甲氧基的+E效应C. 甲氧基的+E效应大于-I效应D. 甲氧基的空间效应8. Grignard试剂指的是( )A. R-Mg-XB. R-LiC. R2CuLiD. R-Zn-X9. 试剂I-、Cl-、Br-的亲核性由强到弱顺序一般为( )A. I->Cl->Br-B. Br->Cl->I-C. I->Br->Cl-D. Br->I->Cl-10. 化合物A. C6H5CH2X、B. CH2=CHCH2X、C. CH3CH2X、D. (CH3)2CHX发生SN2反应的相对速度次序为( )A. A>B>C>DB. A≈B>C>DC. B>C>D>AD. C>D>A>B11. SN2反应中,产物分子若有手性的话,其构型与反应物分子构型的关系是( )A. 相反B. 相同C. 无一定规律12. 烃的亲核取代反应中,氟、氯、溴、碘几种不同的卤素原子作为离去基团时,离去倾向最大的是( )A. 氟B. 氯C. 溴D. 碘13. SN2反应历程的特点是( )A. 反应分两步进行B. 反应速度与碱的浓度无关C. 反应过程中生成活性中间体R+D. 产物的构型完全转化14. 比较下列各离子的亲核性大小A .HO-;B. C6H5O- ; C. CH3CH2O- ;D. CH3COO- ( )A. C>A>B>DB. D>B>A>CC. C>A>D>BD. B>C>D>A15. 下列情况属于SN2反应的是( )A. 反应历程中只经过一个过渡态B. 反应历程中生成正碳离子C. 溶剂的极性越大,反应速度越快D. 产物外消旋化16. 在亲核取代反应中,主要发生构型转化的反应是( )A. SN1B. SN2C. E2D. E117. 脂肪族卤代烃发生消去反应中, 两种常见的极端历程是( )A. SN1和SN2B. E1和E2C. 匀裂和异裂18. SN2反应的特征是:(ⅰ)生成正碳离子中间体;(ⅱ)立体化学发生构型翻转;(ⅲ)反应速率受反应物浓度影响,与亲核试剂浓度无关;(ⅳ)在亲核试剂的亲核性强时容易发生。
鲁科版高中化学选修五第二章 官能团和有机化学反应 烃的衍生物3、醛和酮 糖类第二课时教学课件 (共2

学习目标
1、理解醛和酮的主要化学性质(氧化反应和还原反 应),并从反应条件、生成物种类等角度对比醛、 酮性质的差异。
2、能利用醛、酮的主要化学反应实现醛、酮到羧酸、 醇等烃的衍生物之间的相互转化。
3、通过对醛的氧化反应实验的探究,增强实验能力; 通过实验的应用体会化学与生活的密切联系。
__________________________________________ 。
4/25/2020
【答案】 (1)取少量柠檬醛加入到新制银氨溶液 中,水浴加热,有银镜出现,证明柠檬醛分子结构中含有醛基
[用新制Cu(OH)2悬浊液检测也可] (2)取上层溶液少许,用稀硫酸酸化,再加入溴水,溴水退色 ,证明柠檬醛分子结构中含有碳碳双键
Ag++NH3·H2O=AgOH↓+ NH4+ A[AggO(NHH+23)N2]H++3·OHH2O-=+2H2O 或:AgOH+2NH3·H2O=
实验探究
b.与新制氢氧化铜的反应
——即与新制氢氧化铜悬浊液反应
新制Cu(OH)2的配制方法: 操作:在试管里加入10% NaOH溶液 2mL,滴入2%CuSO4溶液4~6滴,振荡 后加入乙醛溶液0.5mL,加热。
催化氧化
O -C-H O
O -C-O-H
2CH3CHO+O2 催化剂 2CH3COOH
燃烧氧化 2CH3CHO + 5O2 点燃 4CO2 + 4H2O
4/25/2020
实验探究
a.银镜反应---与银氨溶液的反应
银氨溶液的配制方法: 取一洁净试管,加入1 ml 2%的 AgNO3溶液,再逐滴滴入2%的稀氨 水,至生成的沉淀恰好溶解。
2023年高考化学总复习第一部分考点指导第七章有机化学基础 第5讲生物大分子与合成高分子

第5讲生物大分子与合成高分子【课标要求】1.能列举典型糖类物质,能说明单糖、二糖和多糖的区别与联系,能探究葡萄糖的化学性质,能描述淀粉、纤维素的典型性质。
2.能辨识蛋白质结构中的肽键,能说明蛋白质的基本结构特点,能判断氨基酸的缩合产物、多肽的水解产物。
能分析说明氨基酸、蛋白质与人体健康的关系。
3.能辨识核糖核酸、脱氧核糖核酸中的磷酯键,能基于氢键分析碱基的配对原理。
能说明核糖核酸、脱氧核糖核酸对于生命遗传的意义。
4.能对单体和高分子进行互相推断,能分析高分子的合成路线,能写出典型的加聚反应和缩聚反应的反应式。
5.能举例说明塑料、合成橡胶、合成纤维的组成和结构特点,能列举重要的合成高分子化合物,说明它们在材料领域中的应用。
【学科素养】1.证据推理与模型认知:能通过结构预测有机物的性质或分析解释化学性质,从结构特征认识性质,进一步体会结构与性质的关系。
2.变化观念与平衡思想:有机合成中官能团的引入与转化,设计合成路线,认识有机化合物之间的相互转化关系,发展“变化观念”的学科思想。
3.科学探究与创新意识:能列举物质组成和测定的仪器分析方法,能运用仪器分析的数据或图表推测简单物质的组成和结构;能对实验方案、实验过程和实验结论进行评价,提出进一步探究的设想。
4.科学态度与社会责任:能从“绿色化学”的角度设计、评价和优化有机化合物的合成方案,并能处理或解决生产和生活中的化学问题。
考点考题考点一:生物大分子2021山东等级考第7题2021湖南选择考第2题2020天津等级考第4题2018全国卷Ⅰ第7题考点二:合成高分子2019全国Ⅱ卷第7题2019上海高考第8题2018北京高考第10题考点三:有机合成路线的设计2021全国甲卷第36题2021全国乙卷第36题2021山东等级考第20题2020全国Ⅰ卷第36题分析近五年全国高考试题,高考命题在本讲有以下规律:1.从考查题型和内容上看,高考命题以选择题和非选择题呈现,考查内容主要有以下两个方面:(1)考查生物大分子的性质及应用。
2020高考化学总复习课堂练习:有机合成及有机推断

有机合成及有机推断有机合成与有机推断题是高考命题选考题中的经典题型,该题型虽然命题形式较为稳定,但命题背景新颖,角度灵活,是高考试题中具有较高选拔性功能的题目之一。
通常考查的知识点包括有机物分子式的确定、结构简式的书写、官能团种类的辨认、反应类型的判断、有机化学反应方程式的书写、同分异构体数目的判断与书写,以及有机合成路线的设计等;大多以框图转化关系形式呈现,能够很好地考查学生综合分析问题和解决问题的能力,以及获取信息并整合信息和对知识的迁移应用能力。
该题型解题的关键是明确反应条件,分析反应前后物质的变化,特别是有机物碳骨架和官能团的变化,并理解运用题目所给信息,找准问题的切入点是解题的关键。
题型一有机合成1.有机合成中官能团的转化(1)官能团的引入引入官能团①烃、酚的取代;引入卤素原子②不饱和烃与HX 、X 2的加成;③醇与氢卤酸(HX)反应①烯烃与水加成;引入羟基②醛酮与氢气加成;③卤代烃在碱性条件下水解;④酯的水解①某些醇或卤代烃的消去;引入碳碳双键②炔烃不完全加成;③烷烃裂化①醇的催化氧化;引入碳氧双键②连在同一个碳上的两个羟基脱水;③含碳碳三键的物质与水的加成①醛基氧化;引入羧基②烯烃、炔烃、苯的同系物的氧化(一般被酸性KM n O 4溶液氧化)③酯、肽、蛋白质的水解,羧酸盐的酸化引入方法(2)官能团的消除①通过加成反应可以消除不饱和键(双键、三键、苯环);②通过消去、氧化或酯化反应等消除羟基;③通过还原或氧化反应等消除醛基;④通过消去或水解消除卤素原子;⑤通过水解反应消除酯基、肽键。
(3)官能团的保护①酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH变为—ONa将其保护起来,待氧化后再酸化将其转变为—OH。
②碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键。
③氨基(—NH2)的保护:如在对硝基甲苯合成对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2,防止KM n O4氧化—CH3时,—NH2(具有还原性)也被氧化;又如在用对氨基甲苯合成对氨基苯甲酸的过程中应先用盐酸把氨基转化为盐,等把—CH3氧化成—COOH之后,再用NaOH溶液重新转化为氨基。
河北省高考化学有机合成与推断题说明(讲义)(1)

2023年河北省高考化学有机合成与推断题说明 (2023年河北,18).2,5二羟基对苯二甲酸()DHTA 是一种重要的化工原料,广泛用于合成高性能有机颜料及光敏聚合物;作为钠离子电池的正、负电极材料也表现出优异的性能。
利用生物质资源合成DHTA 的路线如下: 已知:222)H /H O1)NaNH +→ 回答下列问题:(1)A B →的反应类型为 。
(2)C 的结构简式为 。
(3)D 的化学名称为 。
(4)G H →的化学方程式为 。
(5)写出一种能同时满足下列条件的G 的同分异构体的结构简式 。
(a)核磁共振氢谱有两组峰,且峰面积比为3:2;(b)红外光谱中存在C=O 吸收峰,但没有O H -吸收峰;(c)可与NaOH 水溶液反应,反应液酸化后可与3FeCl 溶液发生显色反应。
(6)阿伏苯宗是防晒霜的添加剂之一。
试以碘甲烷()3CH I 、对羟基苯乙酮()和对叔丁基甲苯[]为原料,设计阿伏苯宗的合成路线 。
(无机试剂和三个碳以下的有机试剂任选) 考查目标有机合成是最具创造性的学科领域之一,其魅力在于不断合成新分子,创造新物质,为生命及材料科学的创新发展奠定物质基础,是有机化学的核心。
本题以2,5二羟基对苯二甲酸(DHTA)及阿伏苯宗的合成为情境,考查考生对有机化合物命名、结构确定、官能团性质、基本有机反应等基础知识的掌握和运用,同时考查获取信息、分析问题、解决问题的能力,测试考生证据推理与模型认知、科学探究与创新意识的化学学科核心素养的发展水平。
试题分析2,5二羟基对苯二甲酸(DHTA )的合成路线:(1)本问考查考生对有机反应类型的掌握。
根据反应物A 及产物B 的结构及反应条件等信息,在催化剂存在下,反应物A 中的碳碳双键与H 2发生加成反应,形成碳碳单键,生成产物B 。
因此A→B 为碳碳双键的催化加氢反应,属于加成反应。
另一方面,根据有机化学对氧化还原反应的理解,加氢或失氧的反应为还原反应,失氢或加氧的反应为氧化反应,则该反应属于还原反应。
有机合成中的官能团转化反应

有机合成中的官能团转化反应官能团转化反应在有机化学中占有重要地位,它是合成有机化合物的关键步骤之一。
通过官能团转化反应,可以将一个有机化合物转化成具有不同官能团的另一个有机化合物,拓展化合物结构的多样性,并为进一步合成更复杂的有机分子奠定基础。
本文将介绍有机合成中常见的官能团转化反应,包括醇的氧化、脱羧、脱水等。
1. 醇的氧化反应醇的氧化反应是官能团转化反应中的重要一环。
常见的醇的氧化反应有以下几种:(1) 醇的烷氧化:将醇中的碳氢键氧化为羟基,得到醛或酮。
常用的氧化剂有高锰酸钾(KMnO4)、氯铬酸(H2Cr2O7)等。
(2) 醇的酯化:将醇中的羟基与酸酐反应,生成酯。
此反应通常需要酸性条件和催化剂,如硫酸。
(3) 醇的脱氧:通过脱除醇中的水分子,生成烯烃。
此反应通常需要较高的温度和催化剂,如磷酸或磷酸酯。
2. 脱羧反应脱羧反应是将羧酸中的羧基脱除,生成酰基化合物的反应。
常见的脱羧反应有以下几种:(1) 羧酸的酯化:通过与醇反应,将羧酸中的羧基转化为酯基。
此反应通常需要酸性条件和催化剂,如硫酸。
(2) 羧酸的酰卤化:通过与卤素酰化剂反应,将羧酸中的羧基转化为卤代酰基。
常用的酰卤化剂有氯化磷(PCl3)、氯化亚砜(SOCl2)等。
(3) 羧酸的脱羧:通过加热或与酸性催化剂反应,将羧酸中的羧基脱除,生成烯烃或炔烃。
此反应通常需要高温和催化剂,如磷酸或磷酸酯。
3. 脱水反应脱水反应是将有机化合物中的水分子脱除,生成双键或多键的反应。
常见的脱水反应有以下几种:(1) 醇的脱水:通过加热或与酸催化剂反应,将醇中的羟基和邻接的氢原子脱除,生成烯烃。
此反应通常需要高温和催化剂,如浓硫酸。
(2) 羧酸的脱水:通过加热或与酸催化剂反应,将羧酸中的羟基和羧基脱除,生成酰亚胺。
此反应通常需要高温和催化剂,如浓硫酸。
(3) 醛或酮的脱水:通过加热或与酸催化剂反应,将醛或酮中的羟基和邻接的氢原子脱除,生成烯烃。
此反应通常需要高温和催化剂,如浓硫酸。
药物化学第二章

A. 溶于水、乙醇或氯仿 b. 含有易氧化的吩嗪嗪母环
C. 与硝酸共热后显红色 d. 与三氧化铁试液作用,显兰紫色
E. 在强烈日光照射下,发生光化毒反应
2-8、盐酸氯丙嗪在体内代谢中一般不进行的反应类型为
A. N-氧化 b. 硫原子氧化
C. 苯环羟基化 d. 脱氯原子
A. pKa B. 脂溶性
C . 5位取代基的氧化性质 D. 5取代基碳的数目
E. 酰胺氮上是否含烃基取代
2-37、巴比妥类药物的性质有:
A. 具有内酰亚胺醇-内酰胺的互变异构体 B. 与吡啶和硫酸酮试液作用显紫蓝色
C. 具有抗过敏作用 D. 作用持续时间与代谢速率有关
E. pKa值大,在生理pH时,未解离百分率高
E. 侧链去n-甲基
2-9、造成氯氮平毒性反应的原因是
A. 在代谢中产生毒性的氮氧化合物 B. 在代谢中产生毒性的硫醚代谢物
C. 在代谢中产生毒性的酚类化合物 D. 抑制β受体
E. 氯氮平产生的光化毒反应
2-10、不属于苯并二氮卓的药物是
A. 地西泮 B. 氯氮卓
C. 唑吡坦 D. 三唑仑
第二章 中枢神经系统药物
术语解释
1、巴比妥类药物(barbiturates agents):具有5,5二取代基的环丙酰脲结构的一类镇静催眠药。20世纪初问市的一类药物,主要由于5,5取代基的不同,有数十个各具药效学和药动学特色的药物供使用。因毒副反应较大,其应用已逐渐减少。
2、内酰胺-内酰亚胺醇互变异构(lactam- lactim tautomerism):类似酮-烯醇式互变异构,酰胺存在酰胺-酰亚胺醇互变异构。即酰胺羰基的双键转位,羰基成为醇羟基,酰胺的碳氮单键成为亚胺双键,两个异构体间互变共存。这种结构中的亚胺醇的羟基具有酸性,可成钠盐。如下图:
有机物的官能团和基团

有机物的官能团和基团一、官能团和基团的定义官能团是有机化合物中影响其化学性质和反应类型的部分,具有特定的原子组成和结构。
基团则是构成有机分子的基本单元,具有一定的化学性质和结构特点。
二、常见的官能团和基团1.碳碳双键(C=C):存在于烯烃类化合物中,具有不饱和结构,可发生加成反应。
2.碳碳三键(C≡C):存在于炔烃类化合物中,具有更强的不饱和性,也可发生加成反应。
3.羟基(-OH):存在于醇类化合物中,具有氢原子的亲水性,可发生取代、氧化等反应。
4.醛基(-CHO):存在于醛类化合物中,具有羰基的氧化性,可发生加成、氧化等反应。
5.羰基(C=O):存在于酮类化合物中,具有氧化性,可发生加成、缩合等反应。
6.羧基(-COOH):存在于羧酸类化合物中,具有酸性,可发生中和、酯化等反应。
7.氨基(-NH2):存在于胺类化合物中,具有碱性,可发生取代、缩合等反应。
8.卤素原子(-X,X为F、Cl、Br、I):存在于卤代烃中,具有独特的反应性,可发生水解、取代等反应。
三、官能团和基团对有机物性质的影响官能团和基团的类型和位置对有机物的物理性质(如沸点、熔点、溶解度等)和化学性质(如反应性、稳定性等)具有重要影响。
例如,碳碳双键的存在使烯烃具有较高的反应活性,而羟基的存在使醇类化合物具有亲水性。
四、官能团和基团的识别和检测通过有机化学反应和光谱学方法(如红外光谱、核磁共振光谱等)可以识别和检测有机物中的官能团和基团。
例如,红外光谱可以用来确定分子中官能团和基团的类型,核磁共振光谱可以用来确定官能团和基团的位置。
五、官能团和基团的变化官能团和基团在有机反应中可以发生变化,如加成、取代、氧化、还原等。
这些变化是有机合成和有机化学研究的基础。
例如,醇类化合物可以通过脱水反应生成醚类化合物,烯烃可以通过聚合反应生成高分子化合物。
六、官能团和基团的应用官能团和基团的存在和变化在有机合成中具有重要意义。
通过官能团的引入和变化,可以调控分子的性质和功能,实现特定化学反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
MeOH, r.t./5mm
100%
OH
9
立体化学
直链化合物的立体化学可以由 Cram规则预测,但不 对称诱导效果还是不高。 环状化合物由于刚性的构象,不对称诱导效果较好。
OH H H O O OH H
NaBH4/CeCl3
HO
99%
LiBHR3
98%
10
如果使用手性的还原试剂则可以得到较 好的不对称诱导效果
11
(4) 将羰基还原到CH2基团
12
(5) 酰胺的还原
N O
BH3 .THF
N
94%
R CONH2
NaBH4/CoCl 2
R CH2NH2 70%
LiAlH4 可以
13
三、C-X键还原
14
5-2-2 氧化 (Oxidation)
一、氧化类型 二、非官能团化碳的氧化 三、C-C重键中的碳原子氧化 四、醇氧化到醛酮或酸 五、氧化重排 六、C-CC=C
CHO R R' O
7
(2) 还原酯到醛
带有大体积取代基的氢化铝可以将酯还 到醛。
MeO OMe OSiR3 CO2Me )2 DIBAL -78oC/0.5h MeO OMe OSiR3 94% CHO
DIBAL = AlH(
8
(3) 共轭羰基的还原
LiAlH4本身不还原双键。
NaBH4/CeCl3
CO2H 97%
31
氧化为酮 Jones’oxidation
O H H OH H CrO3/H2SO4 H2O,acetane 90%
O
32
Collin’s oxidation:
OH o HO H o o H H o OH OH OH CrO3Py2/Py O OH o o OH H MnO2/THF O HO 91% 89%
23
三、C-C重键中的碳原子氧化
(1)环氧化
CO3H Cl
O + 99% O :
endo
1%
MCPBA
66%
电荷密度大 的双键优先
O
MCPBA 71% KOBu-t 60%
Br2 100%
Br Br
O
Br Br
O
24
(2)双羟基化
OsO4 O OAc 1) OsO4Py2 H H O
O O O O
O NaBH4 : (LiBH4) R H , R
O R' , R
O NR'2
LiAlH4: 所有的羰基
6
(1) 醛的选择性还原
带有吸电子基的硼烷可以选择性地还原醛。
CH2OH NBu4 BH3CN/ r.t. PH = 4 R R' ~ 90% ~ O + R R' CH2OH OH ~ 5% ~
H
OH H H HO
O
O
DDQ/dioxane 75%
H
Cl Cl O CN CN
DDQ =
33
五、氧化重排
34
NOH
PhSO2Cl NaOH/H2O HCl
O O S N O Ph
O
PhSO3 + OH
NH 95%
O O
KMnO4/MgSO4 H2O/acetone
MeO
CO2H
80%
CH3O
OH OH OAc O OH OH
2) Na2SO3
1) OsO4Py2 2) NaHSO3
OH OH
顺式反应
25
(3)臭氧化
CHO
Hale Waihona Puke O3CHO1 mol O3/-78oC
O CHO
90%
26
(4) 硼氢化氧化
OH R CH=CH R
1 1) BH3
2) H2O2
R C CH2 R1
HO
1) BH3 2) H2O2
CH2OH
CHO
90%
CH2OH
Ag2CO3
CHO 95%
29
Moffatt-Pfitzner & Oppenauer
30
氧化为酸
R CH2OH
CrO3Py2
R CO2H CHO CO2H
CH2OH
MnO2/hexane
74%
MnO2/NaCN AcOH/MeOH
95% CHO
AgO / H2O, THF
75%
27
(5)炔键的氧化
CO2Na
O KMnO4 PH 7 CO2Na O
92% C CH
Tl(NO3)3 HClO4/H2O
CO2H 80%
28
四、醇氧化到醛酮或酸
到醛 CH3(CH2)14CH2OH 1,CrO2(OBu-t)2 CH3(CH2)14CHO 2,H2CrO 4 MnO2/0oC 95%
O
KMnO4/MgSO4
CO2H CO2H
80%
35
六、C-CC=C:
N 1,Hg(OAc)2 2,HClO4 N 65% SeO2/t-BuOH O O 1,LDA/THF 2,PhSeBr Ph 87% O H H O H DDQ O 88% O Na I O4 Ph NaHCo3 SePh 72% O O Ph 70% N + N
一、 氢 化
二、羰基还原
三、C-X键还原
2
一、 氢化(Hydrogenation)
H2/Pd-C Cl 82%
Cl
H2/Lindlar cat.
Lindlar cat. = Pd-BaSO4
25%
3
4
cis and trans
*金属催化氢化主要 是cis,金属-液氨中 氢化主要是反式。
5
二、羰基还原 (Reduction of Carbonyl Group)
5-2 官能团转化
(Functional Group Interconversions) 我们已经知道官能团在合成设计中的重要性, 但官能团转换的方法有哪些呢?本节介绍最基 本的方法--还原与氧化。
5-2-1 还原(Reduction)
5-2-2 氧化(Oxidation)
1
5-2-1 还原(Reduction)
36
以下是否氧化就难说:
Br O LiCO3/LiBr DMF H OH H H O TsNHNH2 H O O 90% O H O S CH3 O O O S O O H O O N NHTs MeLi 100% 96% H
OH O OH CH3SO2Cl/SO2 Me3Py/DMF
37
15
一、氧化类型
C
H
C OH C Cl
enzymes etc. ArICl2
16
Tl(NO3)3
17
18
19
二、非官能团化碳的氧化
SeO2 57%
H OH
SeO2
OH
70%
O CrO2 + O 16%
20
50%
CrO3Py2
O
95%
AcO Hg(OAc)2 HOAC CO2H KMnO4 KOH/H2O H OH CO2H 79% 80%
21
O
H H H AcO H H H
O2/P(OEt)3/NaOBu-t
O OH 73%
CO2Et CO2Et 1, LDA 2,Mo III O(O2)2 OH 85%
Ph O SeO2/H2O
Ph O O
这些试剂中SeO2用得最多。
22
机理
O Se O O H H Se O O H OH H 2O Se O O O OH Se H O
