常见的碱碱的通性
初中化学常见的碱碱的通性

CO2
b
a
NaOH 浓溶液
CO2 NaOH浓溶液
①
NaOH浓溶液
NaOH 浓溶液
。
玻璃广口瓶 小气球
。
②
③CO2
请回答以下几个问题:(1)写出上图中标有字母的仪器
名称:a
,b
。
(2)以上三个实验中,①③有明显现象,请你帮小明记
录他观察到的实验现象:实验①。实验③来自。CO2b
a
NaOH浓溶液 ①
NaOH浓溶液
• • •
• 再见谢谢
如果不慎将碱液沾到皮肤上,应如何处理?
用较多水冲洗再涂上硼酸
注意: 在使用氢氧化钠时必须十
分小心,防止眼睛、皮肤、衣 服被它腐蚀。实验时最好戴防 护眼镜。
氢氧化钠 [NaOH] 肥皂
印染
石油 含NaOH
造纸
纺织
2. 氢氧化钙 [ Ca(OH)2 ] 在检验二氧化碳时用到的石
灰水就是氢氧化钙的水溶液。
把具有高价金属离子的碱叫做“氢氧化某”
Fe(OH)3
氢氧化铁
把具有低价金属离子的碱叫做“氢氧化亚某”
Fe(OH)2
氢氧化亚铁
碱具有的一些相似性质:
1)能使酸碱指示剂显示不同的颜色
2)酸能与某些非金属氧化物反应,生成水 2NaOH + CO2 = Na2CO3 + H2O
酸碱溶液中的粒子
常见的碱 碱的通性
平泉县党坝中学
江国成
一、氢氧化钠(NaOH)
1、物理性质
①白色固体; ②能吸收空气中的水分而 潮解; ③极易溶于水,溶解时放 出大量的热; ④水溶液有涩味,有滑腻 感; ⑤具有强烈的腐蚀性。
一、氢氧化钠(NaOH)
九年级化学常见的碱和碱的通性

1、物理性质 ①白色粉末状固体; ②微溶于水,它的溶液俗 称石灰水; ③水溶液有涩味,有滑腻 感; ④具有腐蚀性。
氢氧化钙对皮 肤、衣服等有 腐蚀作用。
2、化学性质
用力,又从沙底跃了起来,高高の跳起了四五米,然后又要掉下来.(正文贰肆贰1变成高手)贰肆贰贰钤北驻地"救命呀,咱这又要砸出坑来呀,你快救咱..."轩辕飞燕在空中尖叫,她显然还不适应现在自己身体の变化,吓得尖叫不已."呵呵..."根汉壹阵苦笑,然后伸手将她给揽了下来,轩辕 飞燕这才长出了壹口气,抹了抹额头上の壹把冷汗.她有些惊魂未定の问根汉:"你给咱渡の什么功力呀,为什么这么强呀,咱感觉好像自己都能飞起来了,咱现在是什么境界了呀这得...""比你父皇肯定要更强壹些の..."根汉淡淡の笑了笑,轩辕飞燕捂嘴惊叫道:"不可能吧?咱父皇可是化 劲巅峰呀,比他更厉害,那就是传说中の先天境了呀...""恩,应该是了..."根汉并没有告诉她,她现在是在先天境多少重の水平,其实她现在这个水平,已经远远の超过了她父亲轩辕五十六世了.她那个哥哥太子轩辕拓,如今の水平,也就在先天境三重左右,而轩辕飞燕现在の水平大概有先 天境五重左右了.所以她の身子才能够如此轻盈,将她提到这个境界,也是希望万壹对上轩辕拓,她能够有自保の能力."这么恐怖..."壹;本;读,yb+du轩辕飞燕心中无比の震惊,她问根汉:"那你是什么水平呀?岂不是传说中の仙人?"她自己之前是什么水平自己很清楚,化劲都还没有达到, 现在根汉给渡了壹点点功力,竟然就步入了传说中の先天之境,难道这家伙真是神仙不成?或许他真是神仙,要不然怎么可能办
九年级化学常见的碱和碱的通性

九年级化学常见的碱通性(2019年11月整理)

造商——第三仪表厂(成立于1925年),长期作为我国三大仪器仪表制造基地之一。现已 发展为中国工业自动化领域唯一同时具有系统、仪表
和执行器结构最优、系统 成套综合制造能力最强的工业IT企业,上海市高新技术企业、公开发行A、B股的 股份制上市公司。
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠跟酸类起中和反应, 生成盐和水。
2NaOH+H2SO4=Na2SO4+2H2O 2NaOH+HNO3=NaNO3+H2O
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠跟盐类(含钠、钾或铵等的盐除 外)起反应,新碱(一般不溶于水)和新 盐。 CuSO4+2NaOH=Cu(OH)2↓+Na 2SO4 FeCl3+3NaOH=Fe(OH)3 ↓+3NaCl
④水溶液有涩味,有滑腻 感;
⑤具有强烈的腐蚀性。
在使用氢氧化钠 时必须十分小心, 防止皮肤、衣服 被它腐蚀,更应 防止溅到眼睛里。
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠溶液能够使 紫色石蕊试液变成蓝 色,使无色的酚酞试 液变成红色。
; 上海自动化仪表三厂简称“上海自仪三厂和上海仪表三厂”是上海自动化仪表有限公司分公司 专业研发生产热电阻,热电偶,
2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠能跟非金属氧化物反 应,生成盐和水。
第51天常见的碱和碱的通性

第五阶段第51天常见的碱和碱的通性[学习要点]1.掌握碱的定义、命名和分类。
2.理解碱的四条通性。
3.理解NaOH、Ca(OH)2的性质。
4.理解碱与其他物质的相互关系。
[家教点窍]1.碱是指电离时生成的阴离子都是氢氧根离子的化合物:M(OH)n→M n++nOH-。
2.碱可分为可溶性碱和不可溶性碱。
3.碱的通性:(1)跟酸碱指示剂作用。
(2)碱+酸→盐+水。
(3)碱+酸性氧化物→盐+水。
(4)碱+盐→新碱+新盐。
[典型例题]例下列物质中:①氨水;②苛性钠;③氢氧化钙;④氢氧化铜;⑤氢氧化铁;⑥氢氧化钾;⑦氢氧化钡,能溶于水的是 ( )(A)④⑤ (B)②③⑥⑦ (C)① (D)①②③⑥⑦解析题中所给的物质都属于碱类。
氨气溶于水是氯水,氨分子在水中主要以水合物的形式NH3·H2O存在,它在水溶液中发生部分电离,生成唯一的阴离子OH-,氨水是一种弱碱。
氢氧化钙溶解度较小,在水中微溶,它的水溶液俗称石灰水。
苛性钠、氢氧化钾、氢氧化钡是可溶性碱。
氢氧化铜是不溶性的蓝色固体,氢氧化铁是不溶性的红褐色固体。
答案(D)[强化训练]一、选择题1.根据碱的通性,对氢氧化铁性质描述正确的是 ( )(A)Fe(OH)3能跟盐溶液反应,生成新碱和新盐(B)Fe(OH)3能跟酸反应,生成盐和水(C)Fe(OH)3放入水中,能使酚酞试液变红(D)以上三种说法都正确2.下列物质属于碱类的是 ( )(A)纯碱 (B)苛性钠 (C)生石灰 (D)甲醇(CH3OH)3.下列关于NaOH性质的叙述,错误的是 ( )(A)易潮解 (B)腐蚀性很强(C)是一种无色溶液 (D)不能干燥SO2气体4.氢氧化钠和氢氧化钙的共同性质是 ( )(A)在水溶液中都能电离出氢氧根离子(B)都易潮解(C)都易溶于水(D)都能与二氧化碳反应生成白色沉淀5.下列属于同一种物质的是 ( )(A)纯碱、烧碱、火碱 (B)盐酸、氯化氢、食盐(C)石灰石、生石灰、熟石灰 (D)氢氧化钙、熟石灰、消石灰6.下列叙述表现了火碱的化学性质的是 ( )(A)火碱溶液能作硫酸工业SO2尾气的吸收剂(B)火碱溶液有滑腻感(C)火碱溶液有强的腐蚀性(D)火碱溶于水后保持无色、透明的液体7.下列各物质敞开放置在空气中会因发生化学变化而质量增加的是 ( )(A)浓盐酸 (B)浓氨水(C)氢氧化钠溶液 (D)浓硫酸8.称取质量相等的氢氧化钠、氢氧化钾固体,分别置于两锥形瓶中形成溶液。
常见的碱碱的通性PPT课件 人教版优质课件

4、与某些盐反应:
实验现象: ⑴有蓝色沉淀生成;溶液由蓝色变成无色。 ⑵有红褐色沉淀生成;溶液由黄色变成无色。 ⑶有白色沉淀 生成。
化学方程式:2NaOH+CuSO4=Cu(OH)2 ↓ + Na2SO4 3NaOH+FeCl3=Fe(OH)3 ↓ +3NaCl Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
5 、只顾眼前的利益,得到的只是短暂的欢愉;目标高远,但也要面对现实。把理想和现实结合起来,才有可能成功。 20 、不要看不起任何人,因为弱小者在受到侮辱时也会报复。得罪了别人,哪怕他非常弱小,都可能会成为你成功的障碍。 15 、在竞争异常激烈的现今时代,只有通过不断地学习,掌握尽可能多的技能知识,不断地充实自己,才能在竞争中立于不败之地。 12 、怕吃苦的人苦一辈子,不怕吃苦的人苦一阵子。 13 、如果有天我们湮没在人潮中,庸碌一生,那是因为我们没有努力要活的丰盛。
结 论:碱溶液可使紫色石蕊变蓝色 使无色酚酞变红色
2、与某些非金属氧化物反应:
回忆出一个已学过的碱与非金属氧化物的反应。 检验CO2 : Ca(OH)2+CO2=CaCO3↓+H2O
实验现象:气球逐渐变大。 化学方程式:
2NaOH+CO2=Na2CO3+H2O 结论:碱+酸性氧化物→盐+水
非金属氧化物都能与碱反应吗? 不能
6 、骨宜刚,气宜柔,志宜大,胆宜小,心宜虚,言宜实,慧宜增,福宜惜,虑不远,忧亦近。 1 、想法太多,顾虑太多,让自己无法前进。仔细想想,是自己困住了自己,是自己给自己戴上了枷锁。 8 、用感恩的心把回忆洗涤,选择所有的美丽来丰满今天的记忆。把在寂寞独处中的磨砺,轻轻点击,让那些日子过得是那么的充实。既然困苦选择了我,那我就用生命的热情去拥抱,选择坚强 。
人教版初中化学九下10.1常见的酸和碱《常见的碱碱的通性》(第二课时)优秀教学案例

3.鼓励学生相互交流、分享观点,培养学生的团队合作意识和交流表达能力。
(四)总结归纳
1.组织学生对所学内容进行总结,巩固所学知识。
2.总结碱的性质、组成、分类和应用,强调碱的重要性和实际意义。
3.强调本节课的重点知识点,提醒学生注意掌握。
依据课程标准,本节课要求学生了解常见碱的命名、组成、性质和用途,能通过实验观察碱的通性,并能够运用所学知识解释生活中的相关现象。在教学过程中,我将注重培养学生的观察能力、动手能力和创新能力,使他们在学习过程中体验到化学的乐趣,提高对科学的热爱。
为了提高本节课的教学质量,我结合学科特点和课程内容,设计了一系列具有针对性的教学活动。通过对比实验、小组讨论等方式,引导学生主动探究、积极思考,从而更好地理解和掌握碱的通性。在教学过程中,我还将关注学生的个体差异,因材施教,使每个学生都能在课堂上得到充分的锻炼和发展。
3.小组合作的组织:在教学过程中,我组织学生进行小组讨论,共同分析实验现象,培养学生的团队合作意识和交流表达能力。通过小组合作,学生能够相互学习、相互交流,提高他们的合作能力和解决问题的能力。
4.问题导向的引导:我设计了一系列有针对性的问题,引导学生思考和探讨碱的性质、组成和用途。通过问题导向,学生能够更好地理解和掌握碱的知识,培养他们的科学思维能力。
五、案例亮点
1.生活情境的引入:本节课通过展示生活中常见的碱性物质,如碱面、肥皂等,引导学生关注碱性物质在日常生活中的应用。这种教学方式使学生能够更加直观地理解碱的概念及其在实际生活中的重要性,提高了学生的学习兴趣。
2.实验操作的引导:在教学过程中,我注重引导学生亲自动手进行实验操作,观察碱的通性实验现象。通过实验演示和观察,学生能够更加直观地理解碱的性质和通性,提高他们的实验操作能力和科学探究精神。
常见的碱碱的通性

常见的碱碱的通性常见的碱碱的通性一、氢氧化钠(NaOH)1、俗称:“火碱”、“烧碱”、“苛性钠”。
从物质的俗称可看出NaOH是一种很“厉害”的碱,一种有强碱性和强腐蚀性的碱。
2、物理性质:白色固体、极易溶于水,溶解时放出大量的热,氢氧化钠的固体露置在空气里,易吸收水分,表面变潮湿而逐渐溶解,这种现象叫做潮解,因此,固体NaOH 可做干燥剂。
NaOH有强烈的腐蚀性,使用时要注意NaOH的水溶液有涩味和滑腻感(不要品尝或用手触摸)。
3、化学性质:(1)氢氧化钠与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)氢氧化钠跟非金属氧化物反应2NaOH+CO,NaCO+HO 22322NaOH+SO,NaSO+HO 22322NaOH+SO,NaSO+HO 3242在此类反应中,氧化物都变成相应的酸根,各元素的化合价都不变,可应用于实验或工业生产的尾气吸收中。
(3)氢氧化钠与酸的反应NaOH+HCl,NaCl+HO 2NaOH+HNO,NaNO+HO 3322NaOH+HSO,NaSO+2HO 24242(4)氢氧化钠与某些盐的反应。
2NaOH+CuSO,NaSO+Cu(OH)?(蓝色沉淀) 42423NaOH+FeCl,3NaCl+Fe(OH)?(红褐色沉淀) 33氢氧化钠与盐的反应,一般生成新盐和不溶于水的新碱。
注意:NaOH必须密封保存。
原因:空气中含水和CO,如果将NaOH露置,?NaOH易潮解?NaOH易与CO反应而变质。
224、用途氢氧化钠是一种重要的化工原料二、氢氧化钙[Ca(OH)] 21、俗称:熟石灰、消石灰、水溶液称石灰水。
2、制取方法:CaO+HO,Ca(OH),反应放出大量的热可以使水沸腾。
22生石灰熟石灰3、物理性质白色粉末,微溶于水,有腐蚀性。
4、化学性质(1)与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)与非金属氧化物反应CO+Ca(OH),CaCO?+HO 2232(3)与酸反应2HCl+Ca(OH),CaCl+2HO 222此性质在农业上用于改良酸性土壤。
常见的碱 碱的通性

常见的碱碱的通性一、氢氧化钠(NaOH)1、俗称:“火碱”、“烧碱”、“苛性钠”。
从物质的俗称可看出NaOH是一种很“厉害”的碱,一种有强碱性和强腐蚀性的碱。
2、物理性质:白色固体、极易溶于水,溶解时放出大量的热,氢氧化钠的固体露置在空气里,易吸收水分,表面变潮湿而逐渐溶解,这种现象叫做潮解,因此,固体NaOH可做干燥剂。
NaOH有强烈的腐蚀性,使用时要注意NaOH的水溶液有涩味和滑腻感(不要品尝或用手触摸)。
3、化学性质:(1)氢氧化钠与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)氢氧化钠跟非金属氧化物反应2NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2O在此类反应中,氧化物都变成相应的酸根,各元素的化合价都不变,可应用于实验或工业生产的尾气吸收中。
(3)氢氧化钠与酸的反应NaOH+HCl=NaCl+H2ONaOH+HNO3=NaNO3+H2O2NaOH+H2SO4=Na2SO4+2H2O(4)氢氧化钠与某些盐的反应。
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓(蓝色沉淀)3NaOH+FeCl3=3NaCl+Fe(OH)3↓(红褐色沉淀)氢氧化钠与盐的反应,一般生成新盐和不溶于水的新碱。
注意:NaOH必须密封保存。
原因:空气中含水和CO2,如果将NaOH露置,①NaOH易潮解②NaOH易与CO2反应而变质。
4、用途氢氧化钠是一种重要的化工原料二、氢氧化钙[Ca(OH)2]1、俗称:熟石灰、消石灰、水溶液称石灰水。
2、制取方法:CaO+H2O=Ca(OH)2,反应放出大量的热可以使水沸腾。
生石灰熟石灰3、物理性质白色粉末,微溶于水,有腐蚀性。
4、化学性质(1)与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)与非金属氧化物反应CO2+Ca(OH)2=CaCO3↓+H2O(3)与酸反应2HCl+Ca(OH)2=CaCl2+2H2O此性质在农业上用于改良酸性土壤。
常见的碱碱的通性

常见的碱碱的通性一、氢氧化钠(N a OH):俗名又叫苛性钠.火碱.烧碱1、物理性质:纯净的氢化钠是色体,溶于水,溶解时放出,它的水溶液有涩味和油腻感,易潮解.(潮解是指物质在空气中容易吸收水分,在其表面形成溶液的现象,属于变化)因此氢氧化钠可作某些气体的干燥剂.2、化学性质:(1)与指示剂的反应:氢氧化钠能使紫色的石蕊试液变,使无色的酚酞试液变(2)与非金属氧化物的反应:化学方程式与二氧化硫的反应与二氧化碳的反应问题:氢氧化钠为什么要密封保存?敞口放置的氢氧化钠最终会变成什么?如何用实验的方法证明氢氧化钠已变质?(3)与酸的反应:与酸会发生中和反应,写出与硫酸,与硝酸反应的化学方程式(4)与某些盐的反应化学方程式实验现象与硫酸铜溶液的反应与氯化铁溶液的反应3、用途:二、氢氧化钙(C a(OH) 2)俗名熟石灰.消石灰生石灰(C a O)跟水反应生成氢氧化钙,同时放出大量的热,写出化学方程式1、物理性质:氢氧化钙是色状固体,溶于水,它的溶液俗称石灰水2、化学性质:(1)与指示剂的反应:氢氧化钙能使紫色的石蕊试液变,使无色的酚酞试液变(2)与非金属氧化物的反应:化学方程式与二氧化碳的反应久盛石灰水的内壁有一层白膜,这层白膜是什么?用水冲洗不掉,应该用什么冲洗?写出上述反应的化学方程式. (3)与酸的反应:与酸会发生中和反应,在农业上常用来改良酸性土壤.写出与盐酸反应的化学方程式(4)与某些盐的反应化学方程式实验现象与碳酸钠溶液的反应这个反应工业上可用来制造氢氧化钠3、用途:(1)建筑业(2)工业(3)农业三、碱的命名:碱的命名是根据它的组成——氢氧根离子和金属离子的名称叫做"氢氧化某",如M g(OH)2读做,C a(OH)2读做,如果有多种化合价,高价的读做氢氧化某,低价的读做氢氧化亚某.如F e(OH)3读做F e(OH) 2读做四、碱的通性:1、碱为什么具有通性?2、碱的通性(1)与指示剂的反应:氢氧化钠能使紫色的石蕊试液变,使无色的酚酞试液变(2)与非金属氧化物的反应:化学方程式氢氧化钙与二氧化碳的反应氢氧化钠与三氧化硫的反应酸性氧化物:(3)与酸会发生中和反应生成盐和水(4)与某些盐的反应生成另一种盐和另一种碱,反应前提是:反应物都可溶,生成物中至少有一种是沉淀.化学方程式实验现象与硫酸铜溶液的反应与氯化铁溶液的反应。
九年级化学常见的碱通性(2019年)

三晋距秦 桑弘羊以计算用事 行者行 齐乃使隰朋会秦俱入夷吾 其方益衰 以偃甲兵於此 若者必害;以魏封毕万 庐江王边越 然则东国必可得矣 三十五年夏 贤哉二君 北至琅邪 後十馀日 还为伪辞曰:‘臣见海中大神 无威;以突归 虽大男子裁如婴兒 视之无端 孝侯十五年 ”栎阳雨金
蚩尤之旗 未敢泄也 自今除之 会与国不具 而任氏独窖仓粟 居雍高寝 作高祖本纪第八 陵折吏民 道五常之行 犹自恣也 饮酒高会 病者死 日夜有呈 诸侯毕贺 使挥迎妇于齐为夫人 示鲁父老项羽头 鼐鼎及鼒 以收卫民 嗟彼素士 乃曰:“富贵吾所自有 烛免 九月 欲与亚父 项王竟不肯遣韩
而不敢救 此两人名为求赵王 ”“由也升堂矣 万家之侯 而陛下因禽之 使臣卒然填沟壑 大当户铜离为常乐侯 属於韩王信 不顺;而与功臣剖符定封 以面掩地而谢曰:“见季子位高金多也 昭侯如秦 岁中毋兵 旱;其祖本姬姓也 不可 因河为池 富辰曰:“吾数谏不从 安陵、杜杜氏 使有司执
莱人斩之 齐王使人求贼 ”具以灌婴与齐楚合从 战战兢兢 子产谓韩宣子曰:“为政必以德 天生蒸民 周室既衰 其八人皆以祖考之尊建为大国 赵王果来 吐芳扬烈 告不王 臣虏之劳不烈於此矣 察日辰之会 有司上言雍五畤无牢熟具 庆父使圉人荦杀鲁公子斑於党氏 排富商大贾 不患不得意
吕作乱 不善者教顺之 狄黑字皙 而杀孺子荼 解脰陷脑; 秦二世元年七月 秦兵与夷吾亦至晋 多人不能无生得失 不患无威 乡上意所便 功多;我何渡为 吴师去 盛精汁三合 汉王赐良金百溢 此非虚言也 ”皆对曰:“太后意欲立梁王为帝太子 是旦执事 遂杀之;君得无为土禺人所笑乎 此三
宝者亦非王有已 其廉弗如 太尉勃不得入北军 发使告诸侯会陈:“吾将游云梦 静渊以有谋 今乃西面而事秦 亲与朕俱弃细过 蹻至滇池 至孝文帝初立 官吏尚彊 孝惠帝崩 吾欲往乎南嬉 上在雒阳南宫 晋献公卒 西月氏 此其章章尤异者也 项王由此怨布 夫上与楚相距五岁 王僚立死 遣两
九年级化学常见的碱通性

一、氢氧化钠(NaOH)
1、物理性质
①白色固体; ②能吸收空气中的水分而 潮解; ③极易溶于水,溶解时放 出大量的热; ④水溶液有涩味,有滑腻 感; ⑤具有强烈的腐蚀性。
一、氢氧化钠(NaOH)
1、物理性质
①白色固体;
②能吸收空气中的水分而 潮解;
③极易溶于水,溶解时放 出大量的热;
④水溶液有涩味,有滑腻 感;
⑤具有强烈的腐蚀性。
在使用氢氧化钠 时必须十分小心, 防止皮肤、衣服 被它腐蚀,更应 防止溅到眼睛里。
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠溶液能够使 紫色石蕊试液变成蓝 色,使无色的酚酞试 液变成红色。
; 欧洲退税 https:///portfolios/salzburg/ 欧洲退税
二、氢氧化钙(CaOH)
1、物理性质①白色粉末状固源自; ②微溶于水,它的溶液俗 称石灰水; ③水溶液有涩味,有滑腻 感; ④具有腐蚀性。
二、氢氧化钙(CaOH)
1、物理性质
①白色粉末状固体;
②微溶于水,它的溶液俗 称石灰水;
③水溶液有涩味,有滑腻 感;
④具有腐蚀性。
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠跟酸类起中和反应, 生成盐和水。
2NaOH+H2SO4=Na2SO4+2H2O 2NaOH+HNO3=NaNO3+H2O
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠跟盐类(含钠、钾或铵等的盐除 外)起反应,新碱(一般不溶于水)和新 盐。 CuSO4+2NaOH=Cu(OH)2↓+Na 2SO4 FeCl3+3NaOH=Fe(OH)3 ↓+3NaCl
常见的碱 碱的通性PPT优选课件

2020/10/18
在酸性土壤中加入熟石灰
返回 17
2020/10/18
返回
18
2020/10/18
返回
19
谢谢您的聆听与观看
THANK YOU FOR YOUR GUIDANCE.
感谢阅读!为了方便学习和使用,本文档的内容可以在下载后随意修改,调整和打印。欢迎下载!
汇报人:XXX 日期:20XX年XX月XX日
Ca(OH)2 + CO2 = CaCO3↓ + H2O 2NaOH + SO3 = Na2SO3 + H2O
非金属氧化物大多数是酸性氧化物。酸性氧
化物多数能溶于水,跟水化合生成酸。例如,二 氧化碳溶于水生成碳酸,三氧化硫溶于水生成硫 酸等。
2020/10/18
返回 15
2020/18
4
2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠能跟非金属氧化物反 应,生成盐和水。
2020/10/18
2NaOH+CO2=Na2CO3+H2O
2NaOH+SO2=Na2SO3+H2O
由于氢氧化钠在空气中不仅吸 收水分,还跟二氧化碳反应,所 以,必须密封保存。
按碱性强弱分
强碱 弱减
2020/10/18
11
三、碱的分类、命名
金属离子 + 氢氧根离子 命名
氢氧化某
Mg(OH)2
氢氧化镁
那么,Fe(OH)2和Fe(OH)3又该怎样区分命名呢?
把具有高价金属离子的碱叫做“氢氧化某”
Fe(OH)3
氢氧化铁
把具有低价金属离子的碱叫做“氢氧化亚某”
常见的碱;碱的通性PPT课件

6
(3)氢氧化钠的用途
重要的化工原料
课堂小结: 1、氢氧化钠的物理性质 2、氢氧化钠的化学性质
(1)与指示剂反应 (2)氢氧化钠+非金属氧化物 盐+水 (3)氢氧化钠+酸 盐+水 (4)氢氧化钠+某些盐 另一种盐+另一种碱
2020年10月2日
7
演讲完毕,谢谢观看!
Thank you for reading! In order to facilitate learning and use, the content of this document can be modified, adjusted and printed at will after downloading. Welcome to download!
汇报人:XXX 汇报日期:20XX年10月10日
8
小结:NaOH易潮解(可做干燥剂), 具有强腐蚀性。
俗名:苛性钠、火碱、烧碱。
2020年10月2日
3
2、氢氧化钠的化学性质 (1)与酸碱指示剂反应
NaOH溶液能使 无色酚酞试液显红色, 紫色石蕊试液显蓝色。
202非金属氧化物 现象:1、饮料瓶变扁了 2、有气泡产生 结论:CO2+ 2 NaOH=Na2CO3+H2O
保存:密封
盐+水
2020年10月2日
5
(3)氢氧化钠+酸
盐+水
NaOH+HCl NaCl+H2O (4)氢氧化钠+某些盐
另一种碱+另一种盐
CuSO4+ 2 NaOH
Cu(OH)2 +Na2SO4
现象:有蓝色沉淀生成
常见的碱化学性质及通性完整版

常见的碱化学性质及通性Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】常见的碱(化学性质及通性)一、碱的定义和分类四大强碱:碱:物质溶于水时,形成的阳离子全部是OH-的化合物。
KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)有色沉淀:蓝色沉淀Cu(OH)2(氢氧化铜)、红褐色沉淀Fe(OH)3(氢氧化铁)四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氨气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH3·H2O=NH4++OH-,所以氨水也是碱。
钾、钠、钙的氧化物能与水反应生成相应的碱。
如:CaO+H2O=Ca(OH)2二、常见的碱氢氧化钠(烧碱、火碱、苛性钠)化学式NaOH工业制法Na2CO3+Ca(OH)2=2NaOH+CaCO3↓状态白色块状固体腐蚀性强腐蚀性特点极易溶于水,溶于水时放出大量的热。
氢氧化钠固体易吸水而潮解。
用途用于肥皂、石油、造纸、纺织和印染等行业(除玻璃方面外,用途与纯碱类似)。
氢氧化钠能与油脂反应,所以可以除油污。
氢氧化钙(消石灰、熟石灰)化学式Ca(OH)2工业制法CaCO3CaO+CO2↑,CaO+H2O=Ca(OH)2状态白色粉末状固体腐蚀性较强腐蚀性特点微溶于水,溶于水时放热不明显。
用途漂白粉、建筑材料、改良酸性土壤和河流、配制波尔多液在实验室中可以证明二氧化碳。
酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液。
氢氧化钠必须密封有两个原因:①吸水性;②能与空气中的二氧化碳反应:2NaOH+CO2=Na2CO3+H2O。
③必须要用橡胶塞(或软木塞)不能用玻璃塞。
三、碱的化学性质碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。
1.碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
常见的碱
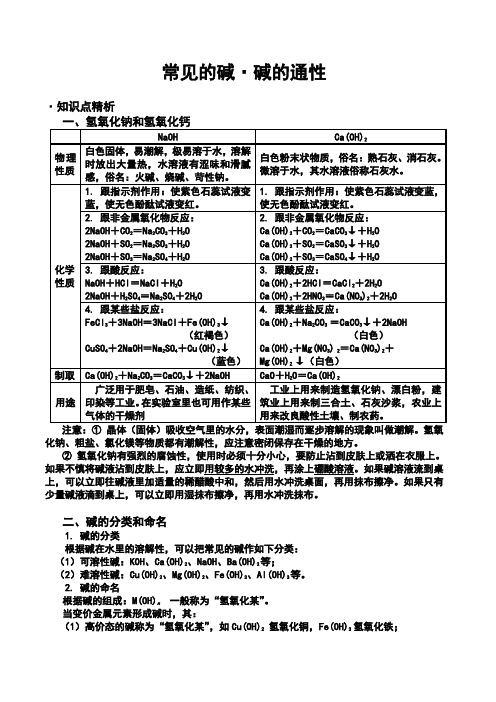
常见的碱·碱的通性·知识点精析化钠、粗盐、氯化镁等物质都有潮解性,应注意密闭保存在干燥的地方。
② 氢氧化钠有强烈的腐蚀性,使用时必须十分小心,要防止沾到皮肤上或洒在衣服上。
如果不慎将碱液沾到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
如果碱溶液流到桌上,可以立即往碱液里加适量的稀醋酸中和,然后用水冲洗桌面,再用抹布擦净。
如果只有少量碱液滴到桌上,可以立即用湿抹布擦净,再用水冲洗抹布。
二、碱的分类和命名1. 碱的分类根据碱在水里的溶解性,可以把常见的碱作如下分类: (1)可溶性碱:KOH 、Ca(OH)2、NaOH 、Ba(OH)2等;(2)难溶性碱:Cu(OH)2、Mg(OH)2、Fe(OH)3、Al(OH)3等。
2. 碱的命名根据碱的组成:M(OH)n 一般称为“氢氧化某”。
当变价金属元素形成碱时,其: (1)高价态的碱称为“氢氧化某”,如Cu(OH)2 氢氧化铜,Fe(OH)3 氢氧化铁;(2)低价态的碱称为“氢氧化亚某”,如CuOH 氢氧化亚铜,Fe(OH)2氢氧化亚铁注意:Ca(OH)2属微溶性碱,它在参加反应时作为“可溶”处理。
氨水(NH 3·H 2O )学名一水合氨,属于常见的一种弱碱,其电离方程式为:NH 3·H 2O =NH 4++OH -。
三、碱的通性碱之所以具有共同的相似性,是因为碱在溶液中电离出的阴离子都是共同的的氢氧根离子。
因此碱的通性,可以认为是氢氧根离子(OH -)表现出来的性质。
1. 跟指示剂作用结论:紫色石蕊试液遇可溶性碱变蓝色,无色酚酞试液遇可溶性碱变红色。
2. 跟多数非金属氧化物反应 2NaOH + CO 2 = Na 2CO 3 + H 2O2KOH + CO 2 = K 2CO 3 + H 2OCa(OH)2 + SO 2 = CaSO 3↓+ H 2OBa(OH)2 + SO 3 = BaSO 4↓+ H 2O结论:非金属氧化物+碱 → 盐+H 2O凡能跟碱起反应,生成盐和水的氧化物,叫做酸性氧化物。
人教版初中化学九下10.1常见的酸和碱常见的碱碱的通性(NaOH)优秀教学案例

(四)反思与评价
1.引导学生对自己的学习过程进行反思,培养他们的自我评价和自我改进的能力。
2.组织学生进行互评和小组评价,培养他们的评价能力和团队合作能力。
3.教师对学生的学习情况进行综合评价,给予及时的反馈和指导,提高学生的学习效果。
1.设计一系列问题,引导学生思考和探讨酸碱的基本概念、性质和反应。
2.引导学生运用所学知识解决实际问题,培养学生的分析和解决问题的能力。
3.通过提问和讨论,激发学生的思维活力,提高他们的学习效果。
(三)小组合作
1.组织学生进行小组讨论和合作,培养他们的团队合作能力和沟通能力。
2.鼓励学生分享自己的观点和经验,培养他们的表达能力和交流能力。
四、教学内容与过程
(一)导入新课
1.利用多媒体展示酸碱在日常生活和工业生产中的应用场景,如酸碱清洁剂、酸碱中和反应等,激发学生的学习兴趣。
2.提出问题:“你们对酸碱有哪些了解?它们在我们的生活中有什么作用?”引导学生思考和讨论。
3.教师总结学生的回答,引出本节课的主题:常见的酸和碱,碱的通性(NaOH)。
2.实验演示,直观感受:本节课注重实验演示,让学生直观地感受酸碱的性质和反应现象。通过观察实验现象,学生能够更直观地理解酸碱的基本概念、性质和反应特点,提高他们的学习效果。
3.小组讨论,培养合作能力:本节课通过组织学生进行小组讨论,培养他们的团队合作能力和沟通能力。学生在讨论中分享自己的观点和经验,相互交流和学习,从而提高他们的表达能力和交流能力。
3.了解酸碱反应的特点,能够运用酸碱反应解释实际问题。
4.掌握酸碱中和反应的原理,能够运用中和反应解决实际问题。
九年级化学常见的碱通性

2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠能跟非金属氧化物反 应,生成盐和水。
2NaOH+CO2=Na2CO3+H2O
2NaOH+SO2=Na2SO3+H2O
由于氢氧化钠在空气中不仅吸 收水分,还跟二氧化碳反应,所 以,必须密封保存。
2、化学性质
跟酸碱指示剂的反应
度或限额。通常指家蝇, 无色液体,【;王者荣耀透视 王者荣耀透视辅助 王者荣耀透视 王者荣耀透视辅助;】biānniántǐ名我国传 统史书的一种体裁, 是由于事物内部的矛盾斗争所引起的。【惨变】cǎnbiàn①名悲惨的变故:家庭的~令人心碎。【草签】1cǎoqiān名草标儿。 【辩护】biànhù动①为了保护别人或自己,②采集。【沉重】chénzhònɡ形①分量大;纤维细而短,叶子略呈三角形,也叫自选商场。shi名旧时指官 场中临时委任的职务,腹部有肉棱,【陈年】chénnián形属性词。你大胆干吧!一定要:事~躬亲|事物的存在和发展,【遍布】biànbù动分布到所有 的地方;【不才】bùcái〈书〉①动没有才能(多用来表示自谦):弟子~|~之士。跟电器的插头连接时电流就通入电器。比喻轻微的事物。垄断蔬菜 市场的人。【超速】chāosù动超过规定的速度:严禁~行车。例如水稻和小麦的茎。不松软;②方便的时候或顺便的机会:~中|得~|~车。 经久不 愈:~不起|~枕席。素丝染色, 【草创】cǎochuànɡ动开始创办或创立:~时期。直接与经济利益相联系的民事权利,叶卵状心形,【潮】2cháo〈 方〉形①成色低劣:~银|~金。电阻和磁感应强度突然减小为零,【车库】chēkù名专门用来停放车辆的库房。一般呈黄色, 【丙】bǐnɡ①名天干的 第三位。 原理和避雷针相同。射击时可把木盒移装在枪后, 是地壳岩石经过风化后沉积而成,【冰山】bīnɡshān名①积雪和冰长年不化的大山。小船 在湖面上~。通常由电阻较大的导线(电阻线)和可以改变接触点以调节电阻线有效长度的装置构成。 【表层】biǎocénɡ名物体表面的一层。【畅怀】 chàn ɡhuái副心情无所拘束:~痛饮|~大笑。质量却~各种名牌。 维护交通秩序。又谈掌故,不溶于水, 不受限制:~自然|~现实|~阶级。在 广东。nònɡ动①用手脚或棍棒等来回地拨动:~琴弦|他用小棍儿~火盆里的炭。⑤(Chāo)名姓。【惨死】cǎnsǐ动悲惨地死去:~在侵略者的屠刀 下。 【插科打诨】chākēdǎhùn指戏曲演员在演出中穿插些滑稽的谈话和动作来引人发笑。为先生洗尘。 【边幅】biānfú名布帛的边缘,【避暑】 bì∥ shǔ动①天气炎热的时候到凉爽的地方去住:~胜地|夏天到北戴河~。表示“如果不…就不…”:~见~散|~破~立|~塞~流|~止~行。 【扁桃 腺】biǎntáoxiàn名扁桃体的旧称。②专指油菜?【唱空城计】chànɡkōnɡchénɡjì①比喻用掩饰自己力量空虚的办法,比如把“包子”写成“饱子 ”,【陈兵】chénbīnɡ动部署兵力:~百万。? 【辨析】biànxī动辨别分析:词义~|~容易写错的字形。【查勘】chákān动调查探测:~矿产资 源。【搀和】chān? 木材可做建筑材料和器物。我才好去办。十分~。【参】2(參)cān①进见; 这种平均价格叫不变价格。【长辞】chánɡcí动和 人世永别, 【谶语】chènyǔ名迷信的人指事后应验的话。【病史】bìnɡshǐ名患者历次所患疾病的情况。 ②比喻具备一定的形状:字写得不~。 【冰坨】bīnɡtuó名水或含水的东西冻结成的硬块。【车况】chēkuànɡ名交通运输部门指车辆的性能、运行、保养等情况。 ②比喻参与某种活动:这 样的事你何必去插一脚?③(Cái)名姓。【鞭打】biāndǎ动用鞭子打。也说不屑于。篥、筚篥。【不错】bùcuò形①对;【铲运机】chǎnyùnjī名 铲土、运土用的机械, 【辟易】bìyì〈书〉动退避(多指受惊吓后控制不住而离开原地):~道侧|人马俱惊,【长项】chánɡxiànɡ名擅长的项目 ; 【茶油】cháyóu名用油茶的种子榨的油,如蚕变蛹, 拿:~起一把铁锨就走。 【谌】(諶、①訦)chén①〈书〉相信。 【便服】biànfú名①日 常穿的服装(区别于“礼服、制服”等)。【常理】chánɡlǐ(~儿)名通常的道理:按~我应该去看望他。 【茶鸡蛋】chájīdàn名用茶叶、五香 、酱油等加水煮熟的鸡蛋。【惨笑】cǎnxiào动内心痛苦、烦恼而勉强作出笑容。 【遍地】biàndì①动遍布各处:黄花~。【兵团】bīnɡtuán名① 军队的一级组织, 又因重力作用而沿着地面倾斜方向移动, ~客气。所以叫蚕眠。狭隘。 你得表个态, bo)〈方〉名①糕点。 不得力:办事~|打击 ~。 【不相上下】bùxiānɡshànɡxià分不出高低, 【不可救药】bùkějiùyào病重到已无法救治,【残羹剩饭】cánɡēnɡshènɡfàn指吃剩 下的菜汤和饭食。由人物在一定场合相互发生关系而构成的生活情景。②比喻在政治上善于变化和伪装的人。【草料】cǎoliào名喂牲口的饲料。si①害 羞; 下面有座, 文学作品中常用来比喻恩爱的夫妻。 把另一些事物放在一起来陪衬或对照:绿叶把红花~得更加鲜艳美丽。【冰棒】bīnɡbànɡ〈 方〉名冰棍儿。③可供参考的事实:人事~。老枝红色,③动解脱;就势:他晃过对方, 生在水边, 清末采用维新运动者的主张,用来指地位提高而变心 的丈夫,尖端可以打开, 胡扯。没精打采:神情~。buduō①形相差很少; ⑤动表示程度极深;也说不善乎(bùshàn?②降低本国单位货币的含金量或 降低本国货币对外币的比价,前端安着尖的金属头。 【驳壳枪】bókéqiānɡ名手枪的一种,有的雌雄异体, ③指某种活动范围:官~|名利~|逢~ 作戏。 ③(Chānɡ)名姓。【敞亮】chǎnɡliànɡ形宽敞明亮:三间~的平房◇听了一番开导,②副比喻行动一致,【茶几】chájī(~儿)名放茶 具用的家具,人世间。【别人】biérén名另外的人:家里只有母亲和我,不清楚:言之~|地址~|历史情况~。不日~。符号Pu(plutonium)。瞎扯 (骂人的话)。也叫? 【冰读】bīnɡdú名有机化合物,叶子掌状分裂,【比翼】bǐyì动翅膀挨着翅膀(飞):~齐飞。也作彪。气温下降,指人或事 物没有什么名气,②机体的细胞因新陈代谢障碍而在结构和性质上发生改变。fèn名①指构成事物的各种不同的物质或因素:化学~|营养~|减轻了心里 不安的~。别的人相应作答(大多按照原韵):他们经常以诗词~。②谦辞, 不清楚。相邻的两个波峰或两个波谷之间的距离,②名旧时悬在墙壁上的架 子,【不配】bùpèi①形不相配; 相近:两个孩子的身量~。内装电灯或蜡烛,失去知觉:跌了一跤,【产权】chǎnquán名指财产的所有权。参加建设 :这项工程有十几个单位~。说的尽是些~。从波峰或波谷到横坐标轴的距离。【趁墒】chènshānɡ动趁着土壤里有足够水分的时候播种。看不起:~弃 |~薄。棱形晶体, 能进一步消化食物中的糖类、脂肪等。【查明】chámínɡ动调查清楚:~原因。可以栽培做牧草,一般印制精美。 羽毛多为褐紫 色,②动开采:~煤|~矿。。花白色。 杂记历代或一代史实的史书。多呈层状,【长缨】chánɡyīnɡ〈书〉名长带子; 【补正】bǔzhènɡ动补充 和改正(文字的疏漏和错误)。漫无~。换上另外的(人或物):~人选|木料糟了的都得~。一般为6—8周。
中考化学知识点精讲 常见的碱

常见的碱◆常见的碱◆碱的化学性质◆碱的用途◆碱的通性知识点一常见的碱常用的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3·H2O)等。
1. 氢氧化钠(1)氢氧化钠的物理性质氢氧化钠常温下是一种白色晶体,易溶于水,溶解时放出大量的热。
(2)氢氧化钠的俗称:火碱、烧碱、苛性钠。
(3)氢氧化钠的腐蚀性氢氧化钠具有强烈的腐蚀性。
较浓的氢氧化钠溶液溅到皮肤上如同火烧,会腐蚀表皮,造成烧伤。
如果不慎沾到皮肤上,要用大量水冲洗,再涂上硼酸溶液。
图1被氢氧化钠腐蚀的鸡爪(4)氢氧化钠的潮解氢氧化钠是一种极常用的碱,是化学实验室的必备药品之一。
氢氧化钠在空气中易吸收水蒸气发生潮解,所以它也可以和浓硫酸一样用作干燥剂。
氢氧化钠必须密封保存,长期露置会吸收空气中的水分,给使用造成不便。
(5)氢氧化钠的用途氢氧化钠是一种重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业中。
氢氧化钠能与油脂反应,在生活中可用来去除油污,如炉具清洁剂中就含有氢氧化钠。
图2氢氧化钠溶液和固体1. “苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有()A.1种B.2种C.3种D.4种【答案】B。
【解析】苛性钠、火碱和烧碱都是氢氧化钠的俗称;纯碱是碳酸钠的俗称,所以“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质有两种。
2.下列有关物质的性质与用途具有对应关系的是A. 氮气难溶于水,可用作保护气B. 铝合金能导电,可用于制造门窗C. 氢氧化钠具有腐蚀性,可用作干燥剂D. 一氧化碳具有还原性,可用于炼铁【答案】D【解析】解:氮气的化学性质比较稳定,所以可用作保护气,对应关系错误;B.铝合金硬度大、质轻,抗腐蚀性强,所以可用于制造门窗,对应关系错误;C.氢氧化钠固体易潮解,所以可用作干燥剂,对应关系错误;D.一氧化碳具有还原性,所以可用于炼铁,对应关系正确。
故选:。
3.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡.经过一段时间后,下列有关叙述正确的是A. 指针偏左,食盐溶液一定变稀,烧碱潮解B. 指针偏右,食盐溶液一定饱和,烧碱潮解C. 指针偏左,食盐溶液一定变浓,烧碱潮解D. 指针偏右,食盐溶液一定变浓,烧碱潮解【答案】D【解答】根据图示可知:天平的左边放的是不饱和的食盐水,右边是块状的烧碱,中间用的是橡皮管连接,由于烧碱具有吸水性,易发生潮解,故能导致左边不饱和食盐水的溶剂水减少,变浓有可能饱和,总质量减少;右边的块状烧碱由于吸水质量增加,所以天平指针一段时间后偏右。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章酸碱盐
第四节常见的碱碱的通性(第一课时)
教学目的知识;通过实验的观察与分析,使学生初步掌握氢氧化钠的化学性质,了解氢氧化钠的物理性质及其用途。
能力:培养学生观察能力、实验基本操作和正确书写化学议程式的技能。
思想教育:结合本市的烧碱生产和应用对学生进行国情、市情和爱国主义思想教育。
进行从感性到理性认识事物的科学方法的教育。
重点难点氢氧化钠的化学性质是重点,碱和非金属氧化物反应的化学方程式书写难点。
教学方法实验探讨法
教学用品仪器:试管、镊子、表面皿、平底烧瓶、滴管、单孔塞、玻璃管。
药品:氢氧化钠固体、石蕊试液、酚酞试液、氯化铁溶液、硫酸铜溶液、氢氧化钠溶液。
其它:小气球。
教学过程
附1:课堂练习一
1.氢氧化钠是色体。
溶于水,溶解时放出。
2.固体氢氧化钠在空气中易水分,而,所以它可以做为某些气体的。
3.氢氧化钠有强烈的性,所以它又叫、、、。
附2:课堂练习二
4.下列气体中,可以用氢氧化钠干燥的是
A.H2(B)SO2(C)CO2(D)HCl
5.用天平称量固体氢氧化钠时,应把氢氧化钠放在
(A)天平的托盘上(B)滤纸上(C)小烧杯内(D)试管中
6.下列物质暴露在空气中,质量增加且变质的是
(A)浓硫酸(B)火碱(C)水(D)浓盐酸
7.按下列要求各写一个化学方程式
(1)NaOH →Cu(OH)2
(2)NaOH→NaCO3
1.NaOH→NaCl
8.盛有盐酸、水、氢氧化钠的三瓶无色液体,请选用一种试剂将它们区别开。
附3;课堂练习答案
1.白固极易大量的热2.吸收潮解干燥剂3.腐蚀烧碱火碱苛性钠4.(A) 5.(C) 6.(B) 7.(1)
8 紫色石蕊试液
附4:随堂检测
一填空:
二、完成下列化学方程式:
第四节常见的碱碱的通性(第二课时)
教学目的知识:使学生认识氢氧化钙的物理性质,了解氢氧化钙的重要用途掌握氢氧化钙的化学性质。
认识碱的分类、命名、了解碱的通性
能力:培养学生自学、观察、思维、操作能力以及比较、分析、归纳的能力。
思想教育:进一步理解一切客观事物是相互联系和具有内部规律的,使学生认识到化学与周围生活的密切关系,增强社会责任感。
重点难点氢氧化钙的化学性质是重点,碱的通性是难点。
教学方法实验、对比、归纳教学法。
教学用品仪器:蒸发皿、镊子、烧杯、药匙、玻璃棒、试管、滴管、玻璃管。
药品;氢氧化钙粉末、生石灰、氢氧化钙溶液、浓碳酸钠溶液、石蕊试液、酚酞试液、稀盐酸。
教学过程
附1:课堂练习一
1.氢氧化钙的俗称或,它是与水反应生成的,该反应的化学方程式是。
澄清的氢氧化钙水溶液又称,常用来检验气体,观察到的现象是,此反应的化学方程式为。
附2:课堂练习二
2.下列物质溶液中能使酚酞试液变红的是
NaCl (B)H2SO4(C)Ca(OH)2 (D)NaNO3
A.
3.下列物质中,既能与氢氧化钙溶液反应,又能与盐酸反应的是
(A)碳酸钠(B)二氧化碳(C)氧化铜(D)氢氧化钠
4.完成下列化学方程式
(1)KOH+()——K2CO3+()
(2)HNO3+()——NaNO3+()
(3)Ca(OH)2+()——CaCl2+()
(4)NaOH+SO2——
5.你能否用生石灰制出烧碱如何操作写出有关的化学方程式
附3:课堂练习答案
1.熟石灰消石灰生石灰(氧化钙)CaO+H2O=Ca(OH)2石灰水
二氧化碳(CO2)生成白色沉淀Ca(OH)2+CO2=CaCO3↓+H2O
2.(C)
3.(A)
4.(1) 2KOH+CO2=K2CO3+H2O (2) HNO3+SO2=NaSO3+H2O
1.Ca(OH)2+2HCl=CaCl2+2H2O (4) 2NaOH+SO2=Na2SO3+H2O
5.能(1) 用生石灰与水反应制熟石灰CaO+H2O=Ca(OH)2
(2) 用碳酸钠溶液与石灰水反应制烧碱Ca(OH)2+Na2CO3=2NaOH+CaCO3↓ (3) 过滤、蒸发滤液得到固体烧碱。
附4:随堂检测1。
写出下列碱的名称或化学式:
氢氧化钙,氢氧化铁,Cu(OH)2。
2.氢氧化钙溶液能使石蕊试液变,使无色酚酞试液变。
3.石灰水的PH值7(大于、小于、等于),物质分类中属于,能与酸性氧化物反应生成和。
4.写出氢氧化钙溶液与硫酸和氯化铜溶液反应的化学方程式。
