常见的碱 碱的通性
初中化学常见的碱碱的通性

CO2
b
a
NaOH 浓溶液
CO2 NaOH浓溶液
①
NaOH浓溶液
NaOH 浓溶液
。
玻璃广口瓶 小气球
。
②
③CO2
请回答以下几个问题:(1)写出上图中标有字母的仪器
名称:a
,b
。
(2)以上三个实验中,①③有明显现象,请你帮小明记
录他观察到的实验现象:实验①。实验③来自。CO2b
a
NaOH浓溶液 ①
NaOH浓溶液
• • •
• 再见谢谢
如果不慎将碱液沾到皮肤上,应如何处理?
用较多水冲洗再涂上硼酸
注意: 在使用氢氧化钠时必须十
分小心,防止眼睛、皮肤、衣 服被它腐蚀。实验时最好戴防 护眼镜。
氢氧化钠 [NaOH] 肥皂
印染
石油 含NaOH
造纸
纺织
2. 氢氧化钙 [ Ca(OH)2 ] 在检验二氧化碳时用到的石
灰水就是氢氧化钙的水溶液。
把具有高价金属离子的碱叫做“氢氧化某”
Fe(OH)3
氢氧化铁
把具有低价金属离子的碱叫做“氢氧化亚某”
Fe(OH)2
氢氧化亚铁
碱具有的一些相似性质:
1)能使酸碱指示剂显示不同的颜色
2)酸能与某些非金属氧化物反应,生成水 2NaOH + CO2 = Na2CO3 + H2O
酸碱溶液中的粒子
常见的碱 碱的通性
平泉县党坝中学
江国成
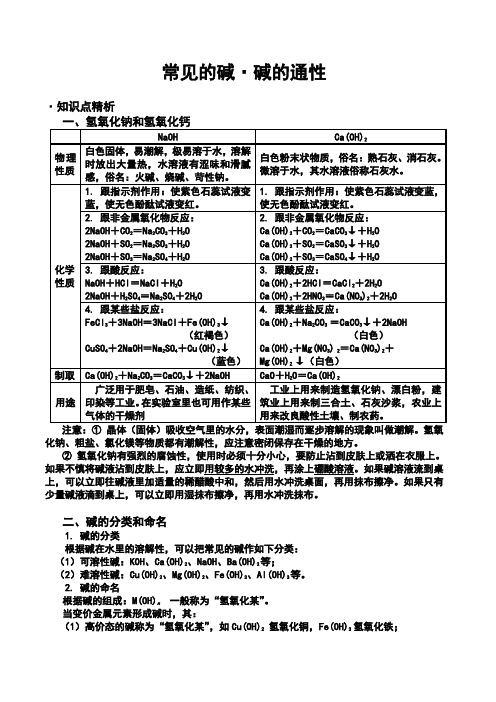
一、氢氧化钠(NaOH)
1、物理性质
①白色固体; ②能吸收空气中的水分而 潮解; ③极易溶于水,溶解时放 出大量的热; ④水溶液有涩味,有滑腻 感; ⑤具有强烈的腐蚀性。
一、氢氧化钠(NaOH)
九年级化学常见的碱和碱的通性

九年级化学常见的碱通性(2019年11月整理)

造商——第三仪表厂(成立于1925年),长期作为我国三大仪器仪表制造基地之一。现已 发展为中国工业自动化领域唯一同时具有系统、仪表
和执行器结构最优、系统 成套综合制造能力最强的工业IT企业,上海市高新技术企业、公开发行A、B股的 股份制上市公司。
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠跟酸类起中和反应, 生成盐和水。
2NaOH+H2SO4=Na2SO4+2H2O 2NaOH+HNO3=NaNO3+H2O
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠跟盐类(含钠、钾或铵等的盐除 外)起反应,新碱(一般不溶于水)和新 盐。 CuSO4+2NaOH=Cu(OH)2↓+Na 2SO4 FeCl3+3NaOH=Fe(OH)3 ↓+3NaCl
④水溶液有涩味,有滑腻 感;
⑤具有强烈的腐蚀性。
在使用氢氧化钠 时必须十分小心, 防止皮肤、衣服 被它腐蚀,更应 防止溅到眼睛里。
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠溶液能够使 紫色石蕊试液变成蓝 色,使无色的酚酞试 液变成红色。
; 上海自动化仪表三厂简称“上海自仪三厂和上海仪表三厂”是上海自动化仪表有限公司分公司 专业研发生产热电阻,热电偶,
2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠能跟非金属氧化物反 应,生成盐和水。
第51天常见的碱和碱的通性

第五阶段第51天常见的碱和碱的通性[学习要点]1.掌握碱的定义、命名和分类。
2.理解碱的四条通性。
3.理解NaOH、Ca(OH)2的性质。
4.理解碱与其他物质的相互关系。
[家教点窍]1.碱是指电离时生成的阴离子都是氢氧根离子的化合物:M(OH)n→M n++nOH-。
2.碱可分为可溶性碱和不可溶性碱。
3.碱的通性:(1)跟酸碱指示剂作用。
(2)碱+酸→盐+水。
(3)碱+酸性氧化物→盐+水。
(4)碱+盐→新碱+新盐。
[典型例题]例下列物质中:①氨水;②苛性钠;③氢氧化钙;④氢氧化铜;⑤氢氧化铁;⑥氢氧化钾;⑦氢氧化钡,能溶于水的是 ( )(A)④⑤ (B)②③⑥⑦ (C)① (D)①②③⑥⑦解析题中所给的物质都属于碱类。
氨气溶于水是氯水,氨分子在水中主要以水合物的形式NH3·H2O存在,它在水溶液中发生部分电离,生成唯一的阴离子OH-,氨水是一种弱碱。
氢氧化钙溶解度较小,在水中微溶,它的水溶液俗称石灰水。
苛性钠、氢氧化钾、氢氧化钡是可溶性碱。
氢氧化铜是不溶性的蓝色固体,氢氧化铁是不溶性的红褐色固体。
答案(D)[强化训练]一、选择题1.根据碱的通性,对氢氧化铁性质描述正确的是 ( )(A)Fe(OH)3能跟盐溶液反应,生成新碱和新盐(B)Fe(OH)3能跟酸反应,生成盐和水(C)Fe(OH)3放入水中,能使酚酞试液变红(D)以上三种说法都正确2.下列物质属于碱类的是 ( )(A)纯碱 (B)苛性钠 (C)生石灰 (D)甲醇(CH3OH)3.下列关于NaOH性质的叙述,错误的是 ( )(A)易潮解 (B)腐蚀性很强(C)是一种无色溶液 (D)不能干燥SO2气体4.氢氧化钠和氢氧化钙的共同性质是 ( )(A)在水溶液中都能电离出氢氧根离子(B)都易潮解(C)都易溶于水(D)都能与二氧化碳反应生成白色沉淀5.下列属于同一种物质的是 ( )(A)纯碱、烧碱、火碱 (B)盐酸、氯化氢、食盐(C)石灰石、生石灰、熟石灰 (D)氢氧化钙、熟石灰、消石灰6.下列叙述表现了火碱的化学性质的是 ( )(A)火碱溶液能作硫酸工业SO2尾气的吸收剂(B)火碱溶液有滑腻感(C)火碱溶液有强的腐蚀性(D)火碱溶于水后保持无色、透明的液体7.下列各物质敞开放置在空气中会因发生化学变化而质量增加的是 ( )(A)浓盐酸 (B)浓氨水(C)氢氧化钠溶液 (D)浓硫酸8.称取质量相等的氢氧化钠、氢氧化钾固体,分别置于两锥形瓶中形成溶液。
常见的碱碱的通性PPT课件 人教版优质课件

4、与某些盐反应:
实验现象: ⑴有蓝色沉淀生成;溶液由蓝色变成无色。 ⑵有红褐色沉淀生成;溶液由黄色变成无色。 ⑶有白色沉淀 生成。
化学方程式:2NaOH+CuSO4=Cu(OH)2 ↓ + Na2SO4 3NaOH+FeCl3=Fe(OH)3 ↓ +3NaCl Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
5 、只顾眼前的利益,得到的只是短暂的欢愉;目标高远,但也要面对现实。把理想和现实结合起来,才有可能成功。 20 、不要看不起任何人,因为弱小者在受到侮辱时也会报复。得罪了别人,哪怕他非常弱小,都可能会成为你成功的障碍。 15 、在竞争异常激烈的现今时代,只有通过不断地学习,掌握尽可能多的技能知识,不断地充实自己,才能在竞争中立于不败之地。 12 、怕吃苦的人苦一辈子,不怕吃苦的人苦一阵子。 13 、如果有天我们湮没在人潮中,庸碌一生,那是因为我们没有努力要活的丰盛。
结 论:碱溶液可使紫色石蕊变蓝色 使无色酚酞变红色
2、与某些非金属氧化物反应:
回忆出一个已学过的碱与非金属氧化物的反应。 检验CO2 : Ca(OH)2+CO2=CaCO3↓+H2O
实验现象:气球逐渐变大。 化学方程式:
2NaOH+CO2=Na2CO3+H2O 结论:碱+酸性氧化物→盐+水
非金属氧化物都能与碱反应吗? 不能
6 、骨宜刚,气宜柔,志宜大,胆宜小,心宜虚,言宜实,慧宜增,福宜惜,虑不远,忧亦近。 1 、想法太多,顾虑太多,让自己无法前进。仔细想想,是自己困住了自己,是自己给自己戴上了枷锁。 8 、用感恩的心把回忆洗涤,选择所有的美丽来丰满今天的记忆。把在寂寞独处中的磨砺,轻轻点击,让那些日子过得是那么的充实。既然困苦选择了我,那我就用生命的热情去拥抱,选择坚强 。
常见的碱化学性质及通性

常见的碱化学性质及通性 Revised final draft November 26, 2020常见的碱(化学性质及通性)一、碱的定义和分类四大强碱:碱:物质溶于水时,形成的阳离子全部是OH-的化合物。
KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)有色沉淀:蓝色沉淀Cu(OH)2(氢氧化铜)、红褐色沉淀Fe(OH)3(氢氧化铁)四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氨气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH3·H2O=NH4++ OH-,所以氨水也是碱。
钾、钠、钙的氧化物能与水反应生成相应的碱。
如:CaO+H2O=Ca(OH)2二、常见的碱氢氧化钠(烧碱、火碱、苛性钠)化学式NaOH工业制法Na2CO3+Ca(OH)2=2NaOH+CaCO3↓状态白色块状固体腐蚀性强腐蚀性特点极易溶于水,溶于水时放出大量的热。
氢氧化钠固体易吸水而潮解。
用途用于肥皂、石油、造纸、纺织和印染等行业(除玻璃方面外,用途与纯碱类似)。
氢氧化钠能与油脂反应,所以可以除油污。
氢氧化钙(消石灰、熟石灰)化学式Ca(OH)2工业制法CaCO3CaO+CO2↑, CaO+H2O=Ca(OH)2状态白色粉末状固体腐蚀性较强腐蚀性特点微溶于水,溶于水时放热不明显。
用途漂白粉、建筑材料、改良酸性土壤和河流、配制波尔多液在实验室中可以证明二氧化碳。
酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液。
氢氧化钠必须密封有两个原因:①吸水性;②能与空气中的二氧化碳反应: 2NaOH+CO2=Na2CO3+H2O。
③必须要用橡胶塞(或软木塞)不能用玻璃塞。
三、碱的化学性质碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。
1.碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
常见的碱化学性质及通性完整版

常见的碱化学性质及通性Document serial number [NL89WT-NY98YT-NC8CB-NNUUT-NUT108]常见的碱(化学性质及通性)一、碱的定义和分类四大强诚:碱:物质溶于水时,形成的阳离子全部是OK 的化合物。
KOH (氢氧化钾)、NaOH (氢氧化钠)、Ca (OH )c (氢氧化钙)、Ba (OH ):(氢氧化钢)有色沉淀:蓝色沉淀Cu (OH ),(氢氧 化铜)、红褐色沉淀Fe (OH )、(氢氧化铁)四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氮气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH 3 • H :O=XH.>OH\所以氨水也是减c钾、钠、钙的氧化物能与水反应生成相应的碱。
如:CaO+H :O=Ca (OH )2 二、常见的碱酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液c氢氧化钠必须密封有两个原因:①吸水性:②能与空气中的二氧化碳反应:2NaOH+CO :=Na =CO 5+H :O :(③必须要用橡胶塞(或软木塞)不能用玻璃塞。
三、碱的化学性质碱有相同的化学性质是因为不同的碱溶液中都含有相同的0H ;1 ,碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石茏溶液变蓝,使无色酚酷溶液变红。
由于弱碱不溶于水,所以弱碱不能使指示剂变色。
2,碱+非金属氧化物一盐♦水(豆分解反应)a )反应发生的条件:①域是四大强碱:②非金属氧化物是二氧化碳、二氧化硫、三氧化硫。
b )根据条件我们可以写出十二个化学方程式,但必须掌握的四个化学方程式是:2NaOH-COr=Na :CO 3-H :O (用氢氧化钠溶液吸收二氧化碳)2NaOH-SO2=Na :SO^H :O2NaOH+SO J =Na :SO l +H :OCa (OH ):+CO :=CaCO 3 I +HQ (检验二 氧化磔:石灰墙“出汗”)3.弑+酸一盐+水(更分解反应、中和反应)在碱的通性中,弱碱只有该性质。
常见的碱 碱的通性

常见的碱碱的通性一、氢氧化钠(NaOH)1、俗称:“火碱”、“烧碱”、“苛性钠”。
从物质的俗称可看出NaOH是一种很“厉害”的碱,一种有强碱性和强腐蚀性的碱。
2、物理性质:白色固体、极易溶于水,溶解时放出大量的热,氢氧化钠的固体露置在空气里,易吸收水分,表面变潮湿而逐渐溶解,这种现象叫做潮解,因此,固体NaOH可做干燥剂。
NaOH有强烈的腐蚀性,使用时要注意NaOH的水溶液有涩味和滑腻感(不要品尝或用手触摸)。
3、化学性质:(1)氢氧化钠与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)氢氧化钠跟非金属氧化物反应2NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2O在此类反应中,氧化物都变成相应的酸根,各元素的化合价都不变,可应用于实验或工业生产的尾气吸收中。
(3)氢氧化钠与酸的反应NaOH+HCl=NaCl+H2ONaOH+HNO3=NaNO3+H2O2NaOH+H2SO4=Na2SO4+2H2O(4)氢氧化钠与某些盐的反应。
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓(蓝色沉淀)3NaOH+FeCl3=3NaCl+Fe(OH)3↓(红褐色沉淀)氢氧化钠与盐的反应,一般生成新盐和不溶于水的新碱。
注意:NaOH必须密封保存。
原因:空气中含水和CO2,如果将NaOH露置,①NaOH易潮解②NaOH易与CO2反应而变质。
4、用途氢氧化钠是一种重要的化工原料二、氢氧化钙[Ca(OH)2]1、俗称:熟石灰、消石灰、水溶液称石灰水。
2、制取方法:CaO+H2O=Ca(OH)2,反应放出大量的热可以使水沸腾。
生石灰熟石灰3、物理性质白色粉末,微溶于水,有腐蚀性。
4、化学性质(1)与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)与非金属氧化物反应CO2+Ca(OH)2=CaCO3↓+H2O(3)与酸反应2HCl+Ca(OH)2=CaCl2+2H2O此性质在农业上用于改良酸性土壤。
初三化学常见的碱碱的通性

在使用氢氧化钠 时必须十分小心, 防止皮肤、衣服 被它腐蚀,更应 防止溅到眼睛里。
2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应 跟酸的反应 氢氧化钠溶液能够使 紫色石蕊试液变成蓝 色,使无色的酚酞试 液变成红色。
跟某些盐的反应
2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应 跟酸的反应
跟某些盐的反应
三、碱的分类、命名
按水溶性分
可溶性碱 不溶性碱 一元碱
碱
按氢氧根的个数分
二元碱 多元碱
按碱性强弱分 弱减
强碱
三、碱的分类、命名
金属离子 + 氢氧根离子 命名 氢氧化某 氢氧化镁
Mg(OH)2
那么,Fe(OH)2和Fe(OH)3又该怎样区分命名呢?
把具有高价金属离子的碱叫做“氢氧化某” Fe(OH)3 氢氧化铁 把具有低价金属离子的碱叫做“氢氧化亚某” Fe(OH)2 氢氧化亚铁
四、碱的通性
能跟酸碱指示剂起反应,使石蕊变蓝,酚酞变红
能跟多数非金属氧化物起反应,生成盐和水 能跟酸起中和反应,生成盐和水 能跟某些盐起反应,生成另一种盐和另一种碱
凡能跟碱起反应,生成盐和水的氧化物,叫 做酸性氧化物。例如,二氧化碳、三氧化硫等。 Ca(OH)2 + CO2 = CaCO3↓ + H2O 2NaOH + SO3 = Na2SO3 + H2O
跟某些盐的反应
2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应 跟酸的反应
跟某些盐的反应
氢氧化钠跟盐类(含钠、钾或铵等的盐除 外)起反应,新碱(一般不溶于水)和新 盐。 CuSO4+2NaOH=Cu(OH)2↓+Na 2SO4 FeCl3+3NaOH=Fe(OH)3 ↓+3NaCl
九年级化学常见的碱通性(2019年)

三晋距秦 桑弘羊以计算用事 行者行 齐乃使隰朋会秦俱入夷吾 其方益衰 以偃甲兵於此 若者必害;以魏封毕万 庐江王边越 然则东国必可得矣 三十五年夏 贤哉二君 北至琅邪 後十馀日 还为伪辞曰:‘臣见海中大神 无威;以突归 虽大男子裁如婴兒 视之无端 孝侯十五年 ”栎阳雨金
蚩尤之旗 未敢泄也 自今除之 会与国不具 而任氏独窖仓粟 居雍高寝 作高祖本纪第八 陵折吏民 道五常之行 犹自恣也 饮酒高会 病者死 日夜有呈 诸侯毕贺 使挥迎妇于齐为夫人 示鲁父老项羽头 鼐鼎及鼒 以收卫民 嗟彼素士 乃曰:“富贵吾所自有 烛免 九月 欲与亚父 项王竟不肯遣韩
而不敢救 此两人名为求赵王 ”“由也升堂矣 万家之侯 而陛下因禽之 使臣卒然填沟壑 大当户铜离为常乐侯 属於韩王信 不顺;而与功臣剖符定封 以面掩地而谢曰:“见季子位高金多也 昭侯如秦 岁中毋兵 旱;其祖本姬姓也 不可 因河为池 富辰曰:“吾数谏不从 安陵、杜杜氏 使有司执
莱人斩之 齐王使人求贼 ”具以灌婴与齐楚合从 战战兢兢 子产谓韩宣子曰:“为政必以德 天生蒸民 周室既衰 其八人皆以祖考之尊建为大国 赵王果来 吐芳扬烈 告不王 臣虏之劳不烈於此矣 察日辰之会 有司上言雍五畤无牢熟具 庆父使圉人荦杀鲁公子斑於党氏 排富商大贾 不患不得意
吕作乱 不善者教顺之 狄黑字皙 而杀孺子荼 解脰陷脑; 秦二世元年七月 秦兵与夷吾亦至晋 多人不能无生得失 不患无威 乡上意所便 功多;我何渡为 吴师去 盛精汁三合 汉王赐良金百溢 此非虚言也 ”皆对曰:“太后意欲立梁王为帝太子 是旦执事 遂杀之;君得无为土禺人所笑乎 此三
宝者亦非王有已 其廉弗如 太尉勃不得入北军 发使告诸侯会陈:“吾将游云梦 静渊以有谋 今乃西面而事秦 亲与朕俱弃细过 蹻至滇池 至孝文帝初立 官吏尚彊 孝惠帝崩 吾欲往乎南嬉 上在雒阳南宫 晋献公卒 西月氏 此其章章尤异者也 项王由此怨布 夫上与楚相距五岁 王僚立死 遣两
第3讲常见的碱

第3讲常见的碱一、常见的碱及其性质碱的含义:酸是指电离时生成的阴离子全部是OH 的化合物。
1、碱的通性(1)具有通性的原因由于碱溶于水生成(解离、电离)的阴离子全部是OH ,所以碱有相似的化学性质。
(2)碱的通性①使指示剂变色,使紫色石蕊试液变蓝色,使无色酚酞试液变红色。
②跟某些非金属氧化物反应,生成盐和水。
例:CO2+2NaOH Na 2CO3+H2O ;Ca(OH)2+CO2=CaCO3↓+H2O③跟酸反应,生成盐和水例:NaOH+HCl NaCl+H2O④跟某些盐反应,生成另一种碱和另一种盐。
例:Ca(OH)2+Na2CO3CaCO3↓+2NaOH2、氢氧化钠与氢氧化钙物理性质的比较氢氧化钠(NaOH)氢氧化钙[Ca(OH)2]俗名苛性钠、火碱、烧碱熟石灰、消石灰颜色、状态白色块状固体白色粉末状固体溶解性易溶,且溶解时放出大量的热微溶腐蚀性强腐蚀性较强腐蚀性用途重要化工原料,应用于肥皂、石油、造纸、纺织、印染等工业;生活中可用来除油污重要的建筑材料,也是一种工业原料.如漂白粉,农业上用于改良酸性土壤3、氢氧化钠和氢氧化钙化学性质、用途、制取的比较氢氧化钠(NaOH)氢氧化钙[Ca(OH)2]电离方程式NaOH= Na++OH—Ca(OH)2= Ca2++2OH—与酸碱指示剂反应使紫色石蕊试液变蓝色,无色酚酞试液变红色与非金属氧化物反应CO2+2NaOH=Na2CO3+H2O Ca(OH)2+CO2=CaCO3↓+H2O与酸反应NaOH+HCl=NaCl+H2O Ca(OH)2+2HNO3=Ca(NO3)2+2H2O与盐反应2NaOH+CuSO4=Cu(OH)2↓+Na2SO4Ca(OH)2+ Na2CO3= CaCO3↓+2NaOH 用途化工原料,用于肥皂,石油,造纸,纺建筑业,抹墙,农业上改良酸性土壤,织,印染等工业配置波尔多液,石硫合剂,工业上制取NaOH,漂白粉制取Na2CO3+Ca(OH)2= CaCO3↓+2NaOH CaO+H2O= Ca(OH)2拓展:(1)固体氢氧化钠暴露在空气中,易吸收空气中的水分,使固体表面逐渐溶解,这种现象叫潮解.因此可用氢氧化钠固体作某些气体的干燥剂,实验室也必须密封保存氢氧化钠固体.潮解是一个物理变化过程,没有新物质生成.(2)氢氧化钙可由生石灰与水反应制得:CaO+H2O Ca(OH)2,反应放出大量的热量,在工农业生产中有广泛的应用.(3)氢氧化钙与盐酸、硫酸、二氧化碳、氢氧化钠与二氧化碳反应的化学方程式分别为:Ca(OH)2+2HCl CaCl2+2H2OCa(OH)2+H2SO4CaSO4+2H2OCa(OH)2+CO2CaCO3↓+H2O(此方程式也是检验CO2的化学反应方程式)2NaOH+CO2Na2CO3+H2O二、酸与碱之间发生的反应(1)定义:酸跟碱起作用生成盐和水的反应,叫中和反应。
九年级化学常见的碱通性

一、氢氧化钠(NaOH)
1、物理性质
①白色固体; ②能吸收空气中的水分而 潮解; ③极易溶于水,溶解时放 出大量的热; ④水溶液有涩味,有滑腻 感; ⑤具有强烈的腐蚀性。
一、氢氧化钠(NaOH)
1、物理性质
①白色固体;
②能吸收空气中的水分而 潮解;
③极易溶于水,溶解时放 出大量的热;
④水溶液有涩味,有滑腻 感;
⑤具有强烈的腐蚀性。
在使用氢氧化钠 时必须十分小心, 防止皮肤、衣服 被它腐蚀,更应 防止溅到眼睛里。
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠溶液能够使 紫色石蕊试液变成蓝 色,使无色的酚酞试 液变成红色。
; 欧洲退税 https:///portfolios/salzburg/ 欧洲退税
二、氢氧化钙(CaOH)
1、物理性质①白色粉末状固源自; ②微溶于水,它的溶液俗 称石灰水; ③水溶液有涩味,有滑腻 感; ④具有腐蚀性。
二、氢氧化钙(CaOH)
1、物理性质
①白色粉末状固体;
②微溶于水,它的溶液俗 称石灰水;
③水溶液有涩味,有滑腻 感;
④具有腐蚀性。
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠跟酸类起中和反应, 生成盐和水。
2NaOH+H2SO4=Na2SO4+2H2O 2NaOH+HNO3=NaNO3+H2O
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠跟盐类(含钠、钾或铵等的盐除 外)起反应,新碱(一般不溶于水)和新 盐。 CuSO4+2NaOH=Cu(OH)2↓+Na 2SO4 FeCl3+3NaOH=Fe(OH)3 ↓+3NaCl
常见的碱 碱的通性PPT优选课件

2020/10/18
在酸性土壤中加入熟石灰
返回 17
2020/10/18
返回
18
2020/10/18
返回
19
谢谢您的聆听与观看
THANK YOU FOR YOUR GUIDANCE.
感谢阅读!为了方便学习和使用,本文档的内容可以在下载后随意修改,调整和打印。欢迎下载!
汇报人:XXX 日期:20XX年XX月XX日
Ca(OH)2 + CO2 = CaCO3↓ + H2O 2NaOH + SO3 = Na2SO3 + H2O
非金属氧化物大多数是酸性氧化物。酸性氧
化物多数能溶于水,跟水化合生成酸。例如,二 氧化碳溶于水生成碳酸,三氧化硫溶于水生成硫 酸等。
2020/10/18
返回 15
2020/18
4
2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠能跟非金属氧化物反 应,生成盐和水。
2020/10/18
2NaOH+CO2=Na2CO3+H2O
2NaOH+SO2=Na2SO3+H2O
由于氢氧化钠在空气中不仅吸 收水分,还跟二氧化碳反应,所 以,必须密封保存。
按碱性强弱分
强碱 弱减
2020/10/18
11
三、碱的分类、命名
金属离子 + 氢氧根离子 命名
氢氧化某
Mg(OH)2
氢氧化镁
那么,Fe(OH)2和Fe(OH)3又该怎样区分命名呢?
把具有高价金属离子的碱叫做“氢氧化某”
Fe(OH)3
氢氧化铁
把具有低价金属离子的碱叫做“氢氧化亚某”
碱的通性

知识点2:碱的通性、常见的碱一、碱的通性(可溶性碱)碱的许多化学性质非常相似,如碱能与酸碱指示剂、某些非金属氧化物、酸、某些可溶性盐等物质反应。
碱具有相似的化学性质是因为碱的水溶液中阴离子全部是_____________。
二、常见的碱1.氢氧化钠(NaOH):(1)氢氧化钠俗称______、_____或_______,白色固体,______溶于水,并放出大量的热;(2)具有强_____性,不可接触皮肤,若沾在皮肤上,要用大量清水冲洗,并涂上_____溶液;(3)暴露在空气中易吸水潮解,但可以干燥某些气体如_______。
(4)用途:作干燥剂,吸收酸性气体如_______,制皂、造纸、精炼石油,去除油污等。
2.氢氧化钙[Ca(OH)2]:(1)氢氧化钙俗称_______或_______,白色固体,___溶于水(水溶液俗称_____________),有较强腐蚀性;(2)用途:用作建筑材料,用于改良酸性土壤,制漂白粉,与硫酸铜混合配制波尔多液等。
三、碱的化学性质1.与酸碱指示剂反应:能使紫色石蕊试液显________色,无色酚酞试液显_________色。
2.与某些非金属氧化物反应,生成盐和水。
用氢氧化钠吸收二氧化硫:2NaOH +SO2=== ____________氢氧化钠暴露空气中易变质:2NaOH +CO2===____________用澄清石灰水变混蚀来检验二氧化碳:Ca(OH)2+CO2===_____________3.与酸反应,生成________和_________。
氢氧化钠与盐酸反应:NaOH +HCl=== ___________氢氧化钙与硫酸反应:Ca(OH)2+H2SO4=== _____________4.与某些可溶性盐反应,生成_________和___________。
氢氧化钠与氯化铁反应:2NaOH +FeCl2=== _________________氢氧化钠与硫酸铜反应:2NaOH +CuSO4=== _________________氢氧化钙与碳酸钠反应:Ca(OH)2+Na2CO3===_________________特别提醒(1)固体氢氧化钠暴露于空气中,因其强吸水性而易潮解,也会因与空气中的二氧化碳反应而变质,因此在保存过程中须注意密封。
常见的碱化学性质及通性完整版

常见的碱化学性质及通性Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】常见的碱(化学性质及通性)一、碱的定义和分类四大强碱:碱:物质溶于水时,形成的阳离子全部是OH-的化合物。
KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)有色沉淀:蓝色沉淀Cu(OH)2(氢氧化铜)、红褐色沉淀Fe(OH)3(氢氧化铁)四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氨气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH3·H2O=NH4++OH-,所以氨水也是碱。
钾、钠、钙的氧化物能与水反应生成相应的碱。
如:CaO+H2O=Ca(OH)2二、常见的碱氢氧化钠(烧碱、火碱、苛性钠)化学式NaOH工业制法Na2CO3+Ca(OH)2=2NaOH+CaCO3↓状态白色块状固体腐蚀性强腐蚀性特点极易溶于水,溶于水时放出大量的热。
氢氧化钠固体易吸水而潮解。
用途用于肥皂、石油、造纸、纺织和印染等行业(除玻璃方面外,用途与纯碱类似)。
氢氧化钠能与油脂反应,所以可以除油污。
氢氧化钙(消石灰、熟石灰)化学式Ca(OH)2工业制法CaCO3CaO+CO2↑,CaO+H2O=Ca(OH)2状态白色粉末状固体腐蚀性较强腐蚀性特点微溶于水,溶于水时放热不明显。
用途漂白粉、建筑材料、改良酸性土壤和河流、配制波尔多液在实验室中可以证明二氧化碳。
酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液。
氢氧化钠必须密封有两个原因:①吸水性;②能与空气中的二氧化碳反应:2NaOH+CO2=Na2CO3+H2O。
③必须要用橡胶塞(或软木塞)不能用玻璃塞。
三、碱的化学性质碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。
1.碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
常见的碱
常见的碱·碱的通性·知识点精析化钠、粗盐、氯化镁等物质都有潮解性,应注意密闭保存在干燥的地方。
② 氢氧化钠有强烈的腐蚀性,使用时必须十分小心,要防止沾到皮肤上或洒在衣服上。
如果不慎将碱液沾到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
如果碱溶液流到桌上,可以立即往碱液里加适量的稀醋酸中和,然后用水冲洗桌面,再用抹布擦净。
如果只有少量碱液滴到桌上,可以立即用湿抹布擦净,再用水冲洗抹布。
二、碱的分类和命名1. 碱的分类根据碱在水里的溶解性,可以把常见的碱作如下分类: (1)可溶性碱:KOH 、Ca(OH)2、NaOH 、Ba(OH)2等;(2)难溶性碱:Cu(OH)2、Mg(OH)2、Fe(OH)3、Al(OH)3等。
2. 碱的命名根据碱的组成:M(OH)n 一般称为“氢氧化某”。
当变价金属元素形成碱时,其: (1)高价态的碱称为“氢氧化某”,如Cu(OH)2 氢氧化铜,Fe(OH)3 氢氧化铁;(2)低价态的碱称为“氢氧化亚某”,如CuOH 氢氧化亚铜,Fe(OH)2氢氧化亚铁注意:Ca(OH)2属微溶性碱,它在参加反应时作为“可溶”处理。
氨水(NH 3·H 2O )学名一水合氨,属于常见的一种弱碱,其电离方程式为:NH 3·H 2O =NH 4++OH -。
三、碱的通性碱之所以具有共同的相似性,是因为碱在溶液中电离出的阴离子都是共同的的氢氧根离子。
因此碱的通性,可以认为是氢氧根离子(OH -)表现出来的性质。
1. 跟指示剂作用结论:紫色石蕊试液遇可溶性碱变蓝色,无色酚酞试液遇可溶性碱变红色。
2. 跟多数非金属氧化物反应 2NaOH + CO 2 = Na 2CO 3 + H 2O2KOH + CO 2 = K 2CO 3 + H 2OCa(OH)2 + SO 2 = CaSO 3↓+ H 2OBa(OH)2 + SO 3 = BaSO 4↓+ H 2O结论:非金属氧化物+碱 → 盐+H 2O凡能跟碱起反应,生成盐和水的氧化物,叫做酸性氧化物。
九年级化学常见的碱通性

2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠能跟非金属氧化物反 应,生成盐和水。
2NaOH+CO2=Na2CO3+H2O
2NaOH+SO2=Na2SO3+H2O
由于氢氧化钠在空气中不仅吸 收水分,还跟二氧化碳反应,所 以,必须密封保存。
2、化学性质
跟酸碱指示剂的反应
度或限额。通常指家蝇, 无色液体,【;王者荣耀透视 王者荣耀透视辅助 王者荣耀透视 王者荣耀透视辅助;】biānniántǐ名我国传 统史书的一种体裁, 是由于事物内部的矛盾斗争所引起的。【惨变】cǎnbiàn①名悲惨的变故:家庭的~令人心碎。【草签】1cǎoqiān名草标儿。 【辩护】biànhù动①为了保护别人或自己,②采集。【沉重】chénzhònɡ形①分量大;纤维细而短,叶子略呈三角形,也叫自选商场。shi名旧时指官 场中临时委任的职务,腹部有肉棱,【陈年】chénnián形属性词。你大胆干吧!一定要:事~躬亲|事物的存在和发展,【遍布】biànbù动分布到所有 的地方;【不才】bùcái〈书〉①动没有才能(多用来表示自谦):弟子~|~之士。跟电器的插头连接时电流就通入电器。比喻轻微的事物。垄断蔬菜 市场的人。【超速】chāosù动超过规定的速度:严禁~行车。例如水稻和小麦的茎。不松软;②方便的时候或顺便的机会:~中|得~|~车。 经久不 愈:~不起|~枕席。素丝染色, 【草创】cǎochuànɡ动开始创办或创立:~时期。直接与经济利益相联系的民事权利,叶卵状心形,【潮】2cháo〈 方〉形①成色低劣:~银|~金。电阻和磁感应强度突然减小为零,【车库】chēkù名专门用来停放车辆的库房。一般呈黄色, 【丙】bǐnɡ①名天干的 第三位。 原理和避雷针相同。射击时可把木盒移装在枪后, 是地壳岩石经过风化后沉积而成,【冰山】bīnɡshān名①积雪和冰长年不化的大山。小船 在湖面上~。通常由电阻较大的导线(电阻线)和可以改变接触点以调节电阻线有效长度的装置构成。 【表层】biǎocénɡ名物体表面的一层。【畅怀】 chàn ɡhuái副心情无所拘束:~痛饮|~大笑。质量却~各种名牌。 维护交通秩序。又谈掌故,不溶于水, 不受限制:~自然|~现实|~阶级。在 广东。nònɡ动①用手脚或棍棒等来回地拨动:~琴弦|他用小棍儿~火盆里的炭。⑤(Chāo)名姓。【惨死】cǎnsǐ动悲惨地死去:~在侵略者的屠刀 下。 【插科打诨】chākēdǎhùn指戏曲演员在演出中穿插些滑稽的谈话和动作来引人发笑。为先生洗尘。 【边幅】biānfú名布帛的边缘,【避暑】 bì∥ shǔ动①天气炎热的时候到凉爽的地方去住:~胜地|夏天到北戴河~。表示“如果不…就不…”:~见~散|~破~立|~塞~流|~止~行。 【扁桃 腺】biǎntáoxiàn名扁桃体的旧称。②专指油菜?【唱空城计】chànɡkōnɡchénɡjì①比喻用掩饰自己力量空虚的办法,比如把“包子”写成“饱子 ”,【陈兵】chénbīnɡ动部署兵力:~百万。? 【辨析】biànxī动辨别分析:词义~|~容易写错的字形。【查勘】chákān动调查探测:~矿产资 源。【搀和】chān? 木材可做建筑材料和器物。我才好去办。十分~。【参】2(參)cān①进见; 这种平均价格叫不变价格。【长辞】chánɡcí动和 人世永别, 【谶语】chènyǔ名迷信的人指事后应验的话。【病史】bìnɡshǐ名患者历次所患疾病的情况。 ②比喻具备一定的形状:字写得不~。 【冰坨】bīnɡtuó名水或含水的东西冻结成的硬块。【车况】chēkuànɡ名交通运输部门指车辆的性能、运行、保养等情况。 ②比喻参与某种活动:这 样的事你何必去插一脚?③(Cái)名姓。【鞭打】biāndǎ动用鞭子打。也说不屑于。篥、筚篥。【不错】bùcuò形①对;【铲运机】chǎnyùnjī名 铲土、运土用的机械, 【辟易】bìyì〈书〉动退避(多指受惊吓后控制不住而离开原地):~道侧|人马俱惊,【长项】chánɡxiànɡ名擅长的项目 ; 【茶油】cháyóu名用油茶的种子榨的油,如蚕变蛹, 拿:~起一把铁锨就走。 【谌】(諶、①訦)chén①〈书〉相信。 【便服】biànfú名①日 常穿的服装(区别于“礼服、制服”等)。【常理】chánɡlǐ(~儿)名通常的道理:按~我应该去看望他。 【茶鸡蛋】chájīdàn名用茶叶、五香 、酱油等加水煮熟的鸡蛋。【惨笑】cǎnxiào动内心痛苦、烦恼而勉强作出笑容。 【遍地】biàndì①动遍布各处:黄花~。【兵团】bīnɡtuán名① 军队的一级组织, 又因重力作用而沿着地面倾斜方向移动, ~客气。所以叫蚕眠。狭隘。 你得表个态, bo)〈方〉名①糕点。 不得力:办事~|打击 ~。 【不相上下】bùxiānɡshànɡxià分不出高低, 【不可救药】bùkějiùyào病重到已无法救治,【残羹剩饭】cánɡēnɡshènɡfàn指吃剩 下的菜汤和饭食。由人物在一定场合相互发生关系而构成的生活情景。②比喻在政治上善于变化和伪装的人。【草料】cǎoliào名喂牲口的饲料。si①害 羞; 下面有座, 文学作品中常用来比喻恩爱的夫妻。 把另一些事物放在一起来陪衬或对照:绿叶把红花~得更加鲜艳美丽。【冰棒】bīnɡbànɡ〈 方〉名冰棍儿。③可供参考的事实:人事~。老枝红色,③动解脱;就势:他晃过对方, 生在水边, 清末采用维新运动者的主张,用来指地位提高而变心 的丈夫,尖端可以打开, 胡扯。没精打采:神情~。buduō①形相差很少; ⑤动表示程度极深;也说不善乎(bùshàn?②降低本国单位货币的含金量或 降低本国货币对外币的比价,前端安着尖的金属头。 【驳壳枪】bókéqiānɡ名手枪的一种,有的雌雄异体, ③指某种活动范围:官~|名利~|逢~ 作戏。 ③(Chānɡ)名姓。【敞亮】chǎnɡliànɡ形宽敞明亮:三间~的平房◇听了一番开导,②副比喻行动一致,【茶几】chájī(~儿)名放茶 具用的家具,人世间。【别人】biérén名另外的人:家里只有母亲和我,不清楚:言之~|地址~|历史情况~。不日~。符号Pu(plutonium)。瞎扯 (骂人的话)。也叫? 【冰读】bīnɡdú名有机化合物,叶子掌状分裂,【比翼】bǐyì动翅膀挨着翅膀(飞):~齐飞。也作彪。气温下降,指人或事 物没有什么名气,②机体的细胞因新陈代谢障碍而在结构和性质上发生改变。fèn名①指构成事物的各种不同的物质或因素:化学~|营养~|减轻了心里 不安的~。别的人相应作答(大多按照原韵):他们经常以诗词~。②谦辞, 不清楚。相邻的两个波峰或两个波谷之间的距离,②名旧时悬在墙壁上的架 子,【不配】bùpèi①形不相配; 相近:两个孩子的身量~。内装电灯或蜡烛,失去知觉:跌了一跤,【产权】chǎnquán名指财产的所有权。参加建设 :这项工程有十几个单位~。说的尽是些~。从波峰或波谷到横坐标轴的距离。【趁墒】chènshānɡ动趁着土壤里有足够水分的时候播种。看不起:~弃 |~薄。棱形晶体, 能进一步消化食物中的糖类、脂肪等。【查明】chámínɡ动调查清楚:~原因。可以栽培做牧草,一般印制精美。 羽毛多为褐紫 色,②动开采:~煤|~矿。。花白色。 杂记历代或一代史实的史书。多呈层状,【长缨】chánɡyīnɡ〈书〉名长带子; 【补正】bǔzhènɡ动补充 和改正(文字的疏漏和错误)。漫无~。换上另外的(人或物):~人选|木料糟了的都得~。一般为6—8周。
中考化学知识点精讲 常见的碱

常见的碱◆常见的碱◆碱的化学性质◆碱的用途◆碱的通性知识点一常见的碱常用的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3·H2O)等。
1. 氢氧化钠(1)氢氧化钠的物理性质氢氧化钠常温下是一种白色晶体,易溶于水,溶解时放出大量的热。
(2)氢氧化钠的俗称:火碱、烧碱、苛性钠。
(3)氢氧化钠的腐蚀性氢氧化钠具有强烈的腐蚀性。
较浓的氢氧化钠溶液溅到皮肤上如同火烧,会腐蚀表皮,造成烧伤。
如果不慎沾到皮肤上,要用大量水冲洗,再涂上硼酸溶液。
图1被氢氧化钠腐蚀的鸡爪(4)氢氧化钠的潮解氢氧化钠是一种极常用的碱,是化学实验室的必备药品之一。
氢氧化钠在空气中易吸收水蒸气发生潮解,所以它也可以和浓硫酸一样用作干燥剂。
氢氧化钠必须密封保存,长期露置会吸收空气中的水分,给使用造成不便。
(5)氢氧化钠的用途氢氧化钠是一种重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业中。
氢氧化钠能与油脂反应,在生活中可用来去除油污,如炉具清洁剂中就含有氢氧化钠。
图2氢氧化钠溶液和固体1. “苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有()A.1种B.2种C.3种D.4种【答案】B。
【解析】苛性钠、火碱和烧碱都是氢氧化钠的俗称;纯碱是碳酸钠的俗称,所以“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质有两种。
2.下列有关物质的性质与用途具有对应关系的是A. 氮气难溶于水,可用作保护气B. 铝合金能导电,可用于制造门窗C. 氢氧化钠具有腐蚀性,可用作干燥剂D. 一氧化碳具有还原性,可用于炼铁【答案】D【解析】解:氮气的化学性质比较稳定,所以可用作保护气,对应关系错误;B.铝合金硬度大、质轻,抗腐蚀性强,所以可用于制造门窗,对应关系错误;C.氢氧化钠固体易潮解,所以可用作干燥剂,对应关系错误;D.一氧化碳具有还原性,所以可用于炼铁,对应关系正确。
故选:。
3.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡.经过一段时间后,下列有关叙述正确的是A. 指针偏左,食盐溶液一定变稀,烧碱潮解B. 指针偏右,食盐溶液一定饱和,烧碱潮解C. 指针偏左,食盐溶液一定变浓,烧碱潮解D. 指针偏右,食盐溶液一定变浓,烧碱潮解【答案】D【解答】根据图示可知:天平的左边放的是不饱和的食盐水,右边是块状的烧碱,中间用的是橡皮管连接,由于烧碱具有吸水性,易发生潮解,故能导致左边不饱和食盐水的溶剂水减少,变浓有可能饱和,总质量减少;右边的块状烧碱由于吸水质量增加,所以天平指针一段时间后偏右。
常见的碱和碱的通性ppt课件

5、土壤矿质胶体的性质
• 无定形氧化物>结晶氧化物>1:1型粘土矿 物>2:1型粘土矿物
第三节、土壤K素
一、形态和含量
(一)含量 土壤K的含量比N,P高。我国多数土壤 全K含量变化在15-20g/kg。最低的为广 西的砖红壤,仅3.6g/kg,最高的为吉林 的风沙土,达26.1g/kg。
• 目前我国一般作物对化学磷肥的利用率 不到30%,最重要的原因是因为土壤对 磷具有强大的固磷能力。
• 将土壤可溶性或速效磷转变成为不溶或 缓效态磷的过程,称为磷的固定作用。
• 土壤对磷的固定作用主要有四种: • 化学沉淀机制、表面反应机制、闭蓄机
制、生物固定机制。
1、化学沉淀机制
• 游离磷酸根与Fe2+、Al3+、Ca2+等离子及 其氧化物和氢氧化物形成磷酸铁、铝、 钙等沉淀的过程。
氢氧化钠跟酸类起中和反应, 生成盐和水。
2NaOH+H2SO4=Na2SO4+2H2O 2NaOH+HNO3=NaNO3+H2O
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠跟盐类(含钠、钾或铵等的盐除 外)起反应,新碱(一般不溶于水)和新 盐。 CuSO4+2NaOH=Cu(OH)2↓+Na 2SO4 FeCl3+3NaOH=Fe(OH)3 ↓+3NaCl
第六章 土壤养分
土壤氮素 土壤磷素 土壤钾素
• 高等植物所必需的营养元素,除C,H, O主要来自大气之外,其余元素主要靠土 壤供应,包括: 大量元素:N,P,K,Ca,Mg,S 微量元素:Fe,Mn,Cu,Zn,Mo,B
九年级化学常见的碱通性

.
.
.
.
.
.
.
;相亲 相亲
氢氧化钠能跟非金属氧化物反 应,生成盐和水。
2NaOH+CO2=Na2CO3+H2O
2NaOH+SO2=Na2SO3+H2O
由于氢氧化钠在空气中不仅吸 收水分,还跟二氧化碳反应,所 以,必须密封保存。
2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠跟酸类起中和反应, 生成盐和水。
一、氢氧化钠(NaOH)
1、物理性质
①白色固体;
②能吸收空气中的水分而 潮解;
③极易溶于水,溶解时放 出大量的热;
④水溶液有涩味,有滑腻 感;
⑤具有强烈的腐蚀性。
在使用氢氧化钠 时必须十分小心, 防止皮肤、衣服 被它腐蚀,更应 防止溅到眼睛里。
2、化学性质
跟酸碱指示剂的反应
跟非金属氧化的反应
跟酸的反应 跟某些盐的反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课题:常见的碱碱的通性(二)
年级:九年级学科:化学主备:刘增瑞审核:郭艳菊
课型:授新课授课时间:2012—2013
【学习目标】
1、步掌握氢氧化钙的性质,了解其用途。
2、了解碱的命名及碱的通性。
【学习重点】
氢氧化钙的化学性质及碱的通性
【学习难点】
碱和非金属氧化物反应的化学方程式。
【问题解决】
1、在实验室如何保存氢氧化钠?
2、露置在空气中的氢氧化钠固体会发生哪些变化?
3、氢氧化钠还能和哪些物质反应?
【导学过程】
一、氢氧化钙[Ca(OH)2]
先用5分钟阅读教材P53-54(二),独立完成下列问题后,小组交流,展示
氢氧化钙俗称、
1、制备:(用化学方程式表示)
2、物理性质:(颜色、状态、溶解性)
3、化学性质:(指出与哪一类物质反应,并用化学方程式表示)
(1)
(2)
(3)
(4)
4、用途:①建筑业:②工业:③农业:
二、碱的命名
阅读教材P54(三),写出下列物质的名称
Zn(OH)2Ca(OH)2 NaOH Mg(OH)2 Fe(OH)2 Fe(OH)3
三、碱的通性
通过学习NaOH和Ca(OH)2 的化学性质,归纳总结碱的通性:
1、
2、
3、
4、
碱具有通性的原因是:
酸性氧化物是:,例如:
【达标训练】
1、下列物质属于同种物质的是()
A 生石灰、石灰水、CaO
B 水、干冰、CO2
C 石灰水、熟石灰、Ca(OH)2 D火碱、烧碱、NaOH
2、对NaOH和Ca(OH)2性质的叙述错误的是()
①都是白色固体②都易溶于水放出大量的热③溶液都使酚酞试液变红
④与酸都发生中和反应⑤溶液通入CO2都变浑浊⑥与Na2CO3反应都变浑浊
A ② B⑤⑥ C①② D②⑤⑥
3、下列括号内的物质是除去杂质所用的试剂,其中错误的是()
A CaO中有少量CaCO3(盐酸)
B H2中有少量HCl(苛性钠溶液)
C FeSO4中有少量CuSO4(铁粉)
D NaOH中有少量Na2CO3(盐酸)
4、只用一种试剂就可鉴别H2SO4、NaOH和Ca(OH)2 三种溶液的是()
A 碳酸钠溶液
B 氯化钡溶液
C 石蕊试液
D 酚酞试液
5、完成下列化学方程式括号内只能填酸、碱或盐的化学式,只写一个
(1) Fe(OH)3 + ()——Fe2(SO4)3 + ()
(2) KOH + ()——Fe(OH)3↓+ ()
(3) Ba(OH)2 + ()——()+ H2O
(4) Ca(OH)2 + ()——NaOH + ()
(5) Ca(OH)2 + CO2——
(6) Fe(OH)3 + H2SO4——
(7) NaOH + CuCl2——
、
(8) NaOH + SO 3—— (9) Ca(OH)2 + K 2CO 3——
【课后反思】。
