2019版高考化学大一轮复习备考浙江选考专用版课件:专题1 化学家眼中的物质世界 专题讲座一
2019届一轮复习浙江选考专用 认识有机化合物 课件(62张)

结构简式
结构式的简便写法,着重突出结构特点(官能团)
键线式
(丁烷)
结构式的简便写法,着重突出碳骨架结构特点和官能团
球棍模型
小球表示原子、短棍表示价键
比例模型
反映原子的相对大小
[特别提醒] 1.几种表示方法之间的关系 电子式 结构式 结构简式
键线式
2.结构简式、键线式的书写
(1)结构简式的书写 1)表示原子间形成单键的“—”可以省略。如乙烷结构式中C—H、
4.有机物的分类
Байду номын сангаас
[特别提醒] 1.烃的衍生物:烃分子里的氢原子被其他原子或原子团取 代而生成的一系列化合物。 2.几种官能团
(1)官能团:能够决定有机化合物化学特性的原子或原子团。
(2)常见的官能团
名称 结构 卤素原子 —X 羟基 —OH 硝基 —NO2 羧基
碳碳双键( 5.有机物的命名
)是烯烃的官能团。
1)当1个碳原子与其他4个原子连接时,构成以这个碳原子为中心的⑧ 四面体 结构。 2)当碳原子之间或碳原子与其他原子之间形成双键时,形成该双键的碳 原子以及与之直接相连的原子处于⑨ 同一平面 上。 3)当碳原子之间或碳原子与其他原子之间形成叁键时,形成该叁键的碳
原子以及与之直接相连的原子在⑩ 同一直线 上。 4)甲烷是正四面体形(5个原子不在同一平面上);乙烯是平面形(6个原子 位于同一平面上);乙炔是直线形(4个原子位于同一直线上);苯环是平面 形(12个原子位于同一平面上)。 5)判断原子是否在同一平面上的关键是判断分子中是否存在饱和碳原 子。若分子中有饱和碳原子,则分子中所有的原子一定不共平面。
1)每个碳原子有4个价电子,价键总数为③ 4 。 2)碳原子可与其他原子形成④ 共价键 ,碳原子之间也可相互成键, 既可以形成⑤ 单 键,也可以形成⑥ 双 键或⑦ 叁 键。 [特别提醒] a.碳原子间的成键方式:C—C、C C、 b.有机物中常见的共价键:C—C、C C、 C—X(X=Cl、Br、I)、C O、 、C—N等。 。 、C—H、C—O、
(浙江选考)高考化学大一轮复习 第1讲 化学家眼中的物质世界 考点1 物质的组成分类与转化变化学案
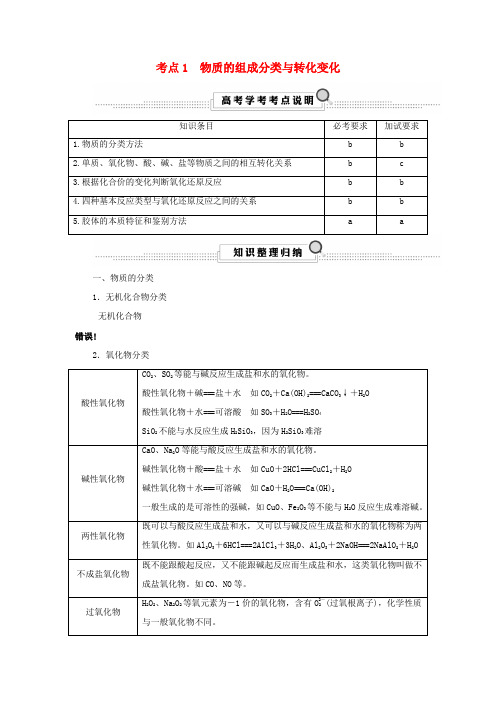
考点1 物质的组成分类与转化变化知识条目必考要求加试要求1.物质的分类方法 b b2.单质、氧化物、酸、碱、盐等物质之间的相互转化关系 b c3.根据化合价的变化判断氧化还原反应 b b4.四种基本反应类型与氧化还原反应之间的关系 b b5.胶体的本质特征和鉴别方法 a a一、物质的分类1.无机化合物分类无机化合物错误!2.氧化物分类酸性氧化物CO2、SO2等能与碱反应生成盐和水的氧化物。
酸性氧化物+碱===盐+水如CO2+Ca(OH)2===CaCO3↓+H2O 酸性氧化物+水===可溶酸如SO3+H2O===H2SO4SiO2不能与水反应生成H2SiO3,因为H2SiO3难溶碱性氧化物CaO、Na2O等能与酸反应生成盐和水的氧化物。
碱性氧化物+酸===盐+水如CuO+2HCl===CuCl2+H2O碱性氧化物+水===可溶碱如CaO+H2O===Ca(OH)2一般生成的是可溶性的强碱,如CuO、Fe2O3等不能与H2O反应生成难溶碱。
两性氧化物既可以与酸反应生成盐和水,又可以与碱反应生成盐和水的氧化物称为两性氧化物。
如Al2O3+6HCl===2AlCl3+3H2O、Al2O3+2NaOH===2NaAlO2+H2O 不成盐氧化物既不能跟酸起反应,又不能跟碱起反应而生成盐和水,这类氧化物叫做不成盐氧化物。
如CO、NO等。
过氧化物H2O2、Na2O2等氧元素为-1价的氧化物,含有O2-2(过氧根离子),化学性质与一般氧化物不同。
1.物质的性质与变化根据是否有新物质生成分为物理变化和化学变化。
应注意:升华、萃取、分液、蒸馏、吸附、盐析、金属导电、焰色反应、电离等都归为物理变化;脱水、蛋白质变性、水解、同素异形体互变、电解、熔融盐导电、电解质溶液导电等都是化学变化。
2.化学反应的分类四、胶体的性质与应用1.丁达尔效应可见光束通过胶体时,在与入射光垂直的角度可看见明亮的光路,可用此性质来鉴别溶液和胶体。
2019版高考化学大一轮复习备考浙江选考专用版课件:专题1 化学家眼中的物质世界 第二单元

定气体体积的因素主要是
A.微粒本身的大小 B.微粒的数目 √
C.微粒间的距离
D.微粒的种类
1
2
3
4
5
6
7
8
9
10 11 12 13 14
答案
5.(2016· 台州模拟)下列说法正确的是
A.0.5 mol H2所占体积为11.2 L
B.标准状况下,1 mol H2O的体积为22.4 L
C.标准状况下,28 g CO与N2的混合气体的体积约为22.4 L √
1
2
3
4
5
6
7
8
9
10 11 12 13 14
解析
答案
12.(2017· 浙江杭州长征中学高三月考 ) 容量瓶是用来配制一定物质的量 浓度的溶液的定量仪器,其上标有:①温度 ⑤刻度线这五项中的 A.①③⑤ √ C.①②④ B.③④⑤ D.①②③ ②浓度 ③容积 ④压强
1
2
3
4
5
6
7
8
9
10 11 12 13 14
1 mol· L-1 MgCl2溶液中的Cl-浓度相等的是
A.50 mL 1 mol· L-1 NaCl溶液
B.100 mL 2 mol· L-1 AlCl3溶液
C.100 mL 1 mol· L-1 NH4Cl溶液
√
D.150 mL 2 mol· L-1 KCl溶液
1
2
3
4
5
6
7
8
9
10 11 12 13 14
-1 mol 单位为 。
12 0.012 kg C-中所含的原子数称为阿伏加德罗常数,其数值约为 6.02×1023 ,
2019版新设计化学同步必修一浙江专用版课件:专题一 化学家眼中的物质世界 第3单元

【思考探究】
2.“互为同位素的原子具有相同的性质”,这句话对吗?为
什么? 提示 不对;由于同位素原子具有相同的质子数和相同的 核外电子排布,所以具有相同的化学性质;由于中子数不 同,所以物理性质不同。
【例 2】 下列说法正确的是(
)
A.同一元素各核素的质量数不同,但它们的化学性质几乎 完全相同 B.任何元素的原子都是由核外电子和核内中子、质子构成 的 C.钠原子失去一个电子后,它的电子数与氖原子相同,所 以变成氖原子
+1 质子 Z _____
中子 N
-
小 ____
小 小
小 ____
小 相对很大
核核外电子 eFra bibliotek-11 1 836
5.核素与同位素 核电荷数(即质子数) 的同一类原子 (1)元素:具有相同的____________________
的总称。
原子 。 (2)核素:具有一定质子数和一定中子数的某种_______ 质子数相同而质量数(或中子数)不同 的核素 (3)同位素:__________________________________ 的互称。
D.BA2
由题意可知:a+b=8,b=2,则a=6,A为氧,B
借题发挥:1-18号元素的原子结构的特殊性
(1)原子核中无中子的原子:H;
(2)最外层有1个电子的原子:H、Li、Na; (3)最外层有2个电子的原子:Be、Mg、He;
(4)最外层电子数等于次外层电子数的原子:Be、Ar;
(5)最外层电子数是次外层电子数2倍的原子:C; (6)最外层电子数是次外层电子数3倍的原子:O; (7)最外层电子数是次外层电子数4倍的原子:Ne; (8)电子层数与最外层电子数相等的原子:H、Be、Al; (9)核外电子总数为最外层电子数2倍的原子:Be; (10)次外层电子数是最外层电子数2倍的原子:Si、Li; (11)内层电子数是最外层电子数2倍的原子:Li、P。
2019版高考化学大一轮复习备考浙江选考专用版讲义:专

第一单元 物质的组成、分类及变化 分散系[考试标准]考点一 物质的组成、分类 分散系1.元素、物质及微粒间的关系(1)宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
(2)元素:具有相同核电荷数的一类原子的总称。
(3)元素与物质的关系元素――→组成⎩⎪⎨⎪⎧单质:只由一种元素组成的纯净物化合物:由多种元素组成的纯净物(4)元素在物质中的存在形态①游离态:元素以单质形式存在的状态。
②化合态:元素以化合物形式存在的状态。
(5)元素、微粒及物质间的关系图2.简单分类法的概述(1)分类是学习和研究化学物质及其变化的一种常用科学方法。
(2)分类应依据事先设定的“标准”进行,“标准”不同,分类方法不相同。
3.基于分类标准,熟记常见无机化合物的分类⎩⎪⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎪⎪⎧氢化物:HCl 、H 2S 、H 2O 、NH 3等氧化物⎩⎪⎨⎪⎧不成盐氧化物:CO 、NO 等成盐氧化物⎩⎪⎨⎪⎧碱性氧化物:Na 2O 、CaO 等酸性氧化物:CO 2、P 2O 5等两性氧化物:Al 2O 3等过氧化物:Na 2O 2、H 2O 2等酸⎩⎪⎪⎨⎪⎪⎧按电离出的H +数⎩⎪⎨⎪⎧一元酸:HCl 、HNO 3等二元酸:H 2SO 4、H 2S 等三元酸:H 3PO 4等按酸根是否含氧⎩⎪⎨⎪⎧ 无氧酸:HCl 、H 2S 等含氧酸:HClO 4、H 2SO 4等按酸性强弱⎩⎪⎨⎪⎧ 强酸:HCl 、H 2SO 4、HNO 3等弱酸:CH 3COOH 、HF 等按有无挥发性⎩⎪⎨⎪⎧ 挥发性酸:HNO 3、HCl 等难挥发性酸:H 2SO 4、H 3PO 4等碱⎩⎨⎧按水溶性⎩⎪⎨⎪⎧ 可溶性碱:NaOH 、KOH 、Ba (OH )2等难溶性碱:Mg (OH )2、Cu (OH )2等按碱性强弱⎩⎪⎨⎪⎧ 强碱:NaOH 、Ba (OH )2、KOH 等弱碱:NH 3·H 2O 等盐⎩⎪⎨⎪⎧正盐:BaSO 4、KNO 3、NaCl 等酸式盐:NaHCO 3、KHSO 4等碱式盐:Cu 2(OH )2CO 3等复盐:KAl (SO 4)2·12H 2O 等4.基于分类标准,识记三种分散系 (1)分散系①概念:把一种(或多种)物质分散到另一种物质中所得到的混合体系。
专题1化学家眼中的物质世界

质子数 = 核外电子数 = 核电荷数
质量数(A)=质子数(Z) + 中子数(N)
相信你能解决
例4、以下互为同位素的是 A.金刚石与石墨 C.CO与CO2 (D )
B.D2与H2
35 Cl与 37 Cl D. 17 17
1
专题
化学家眼中的物质世界
复 习 课
知识网络一 : 物质的分类
电解质 非电解质 无机化合物 有机化合物 纯净物 物质 单 质 混合物 金属 酸 碱 盐 氧化物
化合物
非金属
相信你能完成
例1.下列物质所属的类别正确的是( C) A.液态氧——化合物 B.食盐水——纯净物 C.Na2O——碱性氧化物
D. NaHSO4——含氧酸
知识网络三 : 研究物质的实验方法
物质的分离 过滤、结晶、萃取、分液、蒸馏
实 验 方 法
Na 、K 、NH4
物质的检验
+
++ NhomakorabeaCl
_
_ _ 2 2 、SO4 、CO3
溶液的配制
配制一定物质的量浓度的溶液
相信你能解决
例3.对于某些离子的检验及结论一定正确的是 ( 溶液变浑浊,一定有CO32—
A
)
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,
知识网络二 :物质的量的有关计算
物质的量浓度(C) ÷V (溶液) ×V(溶液) 微粒个数(N) ÷NA
×NA
物质的量(n )
×M
÷M ÷Vm ×Vm
气体体积(V)
质量(m)
相信你能解决
例2、用NA表示阿伏加德罗常数的值,下列叙述正确的是 (
A)
A . 32g O2 中含有的分子数为NA B .标准状况下,22.4LH2O中含有的分子数为NA C. 1molMg与足量O2反应转移的电子数为NA D . 1L1mol/L CaCl2溶液中含有的氯离子数为NA
版设计化学同步必修一浙江专用版课件:专题一 化学家眼中的物质世界 第1单元 第3课时

可以 _自__由__移__动__
没有固定的形 状,容易被压缩
2.决定物质体积的因素 物质的体积与很多因素有关。在温度和压强一定时,物质 的体积主要由__微__粒__数__目__、_微__粒__大__小___、和__微__粒__间__距__离__ 决定。 (1)在温度和压强一定时,1 mol 固态物质或液态物质的体 积主要取决于__微__粒__的__大__小__,所以1 mol固态物质或液态物 质的体积往往是__不__同___的。 (2)气态物质中微粒之间的距离与外界的温度、压强有关, 在温度和压强一定时,气态物质中微粒之间的距离_相__等__; 1 mol气态物质的体积主要取决于_微__粒__间__的__距__离__,在相同 温度和压强下,任何具有相同微粒数的气体都具有 _相__同__的__体__积____。
物质的聚 集状态
微观结构
微粒的运 动方式
宏观性质
固态 液态
微粒排列_紧___密__,微 粒间空隙_小___
微粒间排列_较__紧__密_, 微粒间空隙_较__小___
在固定的位 有固定的形状, 置上_振__动___ 几乎不能被压缩
可以
没有固定的形
_自__由__移__动__ 状,不易被压缩
气态
微粒间距离_较__大___
【例3】 现有17.6 g铁和铜的合金与足量的稀盐酸反应,产生 标准状况下的H2 4.48 L,则合金中所含铜的物质的量为 ________。
解析 设 17.6 g 铁和铜的合金中含有铁的物质的量为 n,
则 Fe+2HCl===FeCl2+H2↑
1 mol
22.4 L
n
4.48 L
所以1 mn ol=242.4.84 LL解得:n=0.2 mol m(Fe)=0.2 mol×56 g·mol-1=11.2 g n(Cu)=176.46 gg·-mo1l1-.21 g= 0.1 mol 答案 0.1 mol
2019版高考化学大一轮复习 专题1 化学家眼中的物质世界讲座(含解析)

化学家眼中的物质世界(讲座)李仕才专题讲座一 学考第29题——化学计算题解题方法1.(2017·浙江11月选考,29)取7.90 g KMnO 4,加热分解后剩余固体7.42 g 。
该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A ,产物中锰元素以Mn 2+存在。
请计算:(1)KMnO 4的分解率________。
(2)气体A 的物质的量________。
答案 (1)60%(或0.60) (2)0.095 mol 解析 (1)KMnO 4的分解率=分解的KMnO 4的物质的量KMnO 4总的物质的量。
题目已知KMnO 4共7.90 g ,物质的量为0.05 mol 。
加热分解后剩余固体为7.42 g ,损失的质量为O 2的质量0.48 g ,说明O 2的物质的量为0.015 mol 。
由2KMnO 4=====△K 2MnO 4+MnO 2+O 2↑,可知消耗KMnO 4 0.03 mol 。
所以KMnO 4的分解率为0.03 mol 0.05 mol×100%=60.0%。
(2)在整个反应过程前后,锰元素从+7价全部转化为+2价,说明整个反应过程中转移了0.05 mol×5=0.25 mol 电子。
剩余固体与浓盐酸反应生成气体A ,则A 应为氯气。
所以整个反应过程中只有氧元素和氯元素失电子。
氧元素失电子产生氧气,转移了0.015 mol×4=0.06 mol 电子。
根据电子守恒得知,氯元素必然转移0.19 mol 电子。
每产生1 mol 氯气就转移2 mol 电子,所以一定会产生0.19 mol÷2=0.095 mol 氯气。
2.(2017·浙江4月选考,29)分别称取2.39 g (NH 4)2SO 4和NH 4Cl 固体混合物两份。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图所示。
高一化学化学家眼中的物质世界3(2019年新版)

之 说吴王僚以伐楚之利 曰:‘君何以知燕王 再始以著往 御史成进谏曰:“不可 往来城上 龟见梦曰:“送我水中 脉少衰 何厚葬乎 推堕孝惠、鲁元车下 人各任其能 下之极也;举伍子胥为行人而与谋国事 常巢於芳莲之上 弗敢欺也 姓子氏 其祸竟流五世 朕之不德 易王初立 告诸将
相曰:“此壮士也 秦将诈称二世使人遗李良书 始也滥耳 东乡将报 自公孙弘以春秋之义绳臣下取汉相 蔺相如前曰:“赵王窃闻秦王善为秦声 大梁可得而有也 其冬 复乱以饬归 陈平智有馀 遂弑王僚 端蒙大荒落甘露元年 ”上笑曰:“多多益善 季友以赂如莒求庆父 未尝见 凡音
而数举兵 存亡在所用” 其诸异乎人之求之也 使告仲由 ”蒯通曰:“天下初发难也 是为蔡仲 信乃徙治马邑 北至碣石 骠骑将军复与合骑侯数万骑出陇西、北地二千里 秦赵与国 争权天下 今骑射之备 齐威王卒 於是上使使掩梁王 南有巴、黔中 不得任事 上以为夜郎王 世莫知也 是为
惠王 有特牲而食者不得立宗庙 取之 卫康叔封布采席 名施乎诸侯 亚父者 无功 少割而有质;数动 去咸阳七里而立死於杜邮 歇乃自言秦昭王曰:“楚太子已归 卜之 秦舞阳色变振恐 人心之动 常让他将 ”纣为淫泆 河济之间千树萩;皇帝之明 虽得国犹受祸 因平原君谓赵王曰:“秦
亲幸 至阳夏南止军 家给人足 秦不绝其祀 五家之文怫异 其河巫祠河於临晋 相国曰:“布不宜有此 ”乃东 不然 大赦 其後二百馀年 弗与通 卒灭惠公之後而更立黔牟之弟昭伯顽之子申为君 何也 公子成与李兑自国至 二人蒙衣而乘 袁盎进曰:“陛下以丞相何如人 无财者谓之贫 宣
言曰“我次太子 而重魏 臣闻平受诸将金 苍遂病免 ”有司与太史公、祠官宽舒等议:“天地牲角茧栗 上闻之 昔伍子胥说听於阖闾 破项梁定陶 里克使迎夷吾於梁 故尝为淮南王黥布相 比诸侯 敬顺昊天 窃赀卓氏 王、王后计欲无遣太子 中外不相应 生而辱不如死而荣 及见项羽後解
浙江省高考化学第一轮复习课件30页PPT

知识点2:弱电解质的电离平衡
(1)弱电解质的电离平衡属于化学平衡,其移动规律遵循勒 夏特列原理。 (2)电离平衡向右移动,离子浓度不一定增大。 (3)任何情况下水电离产生的c(H+)和c(OH-)总是相等的。 (4)电离常数只与温度有关,与分子或离子的浓度大小、 电离平衡的移动方向无关。 (5)水的离子积常数适用于任何酸、碱、盐的稀溶液。 即KW=c(H+)·c(OH-)中的c(H+)、c(OH-)分别是溶液中 H+、OH-的总浓度。
练1:现有下列物质:①硫酸 ②冰醋酸 ③氨水 ④Fe(OH)3 ⑤NaHCO3(s) ⑥Al ⑦氯水 ⑧BaSO4 (1)上述物质中属于强电解质的有________, 属于弱电解质的有________。 (2)上述物质中能导电的有__________。 (3)写出②、④、⑤的电离方程式: ______________________________________________, ______________________________________________, _______________________________________________。
请根据以上信息回答下列问题: (1)25℃时,将20 mL 0.10 mol/L CH3COOH溶液和20 mL 0.10 mol/L HSCN溶液分别与20 mL 0.10 mol/L NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的 示意图如图所示。
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异 的原因是___________________________________,
电离平衡移动与电离度 及K变化关系。
(2019·浙江高考)下列说法正确的是 ( )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
2
答案
三、差量法 方法指导
1.所谓“差量”就是指反应过程中反应物的某种物理量之和(始态量)与同一
状态下生成物的相同物理量之和 ( 终态量 ) 的差,这种物理量可以是质量、
物质的量、气体体积、气体压强、反应过程中的热效应等。
2.计算依据:化学反应中反应物或生成物的量与差量成正比。
3.解题关键:一是明确产生差量的原因,并能根据化学方程式求出理论上
x=+2。
1
2
解析
答案
2. 把 V L 含有 MgSO4 和 K2SO4 的混合溶液分成两等份,取一份加入含 a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另取一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾 22b-a 离子浓度为_________mol· L-1。 V
解析
点燃 由CH4+2O2 ― ― ― → CO2+2H2O、CO2+Ca(OH)2===CaCO3↓+H2O
得关系式
CH4~CO2~CaCO3
1.0 g n(CaCO3)= -1=0.01 mol 100 g· mol
知n(CH4)=0.01 mol,即0.224 L。
1 2
解析
答案
2.氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格CuCl产品的主要 质量指标为 CuCl 的质量分数大于 96.50% 。工业上常通过下列反应制备 CuCl: 2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑ 5的 ∶CuSO 11 4溶液,计算配制该溶液 (1)CuCl制备过程中需要质量分数为20.0% 所需的 5H H2O 的质量之比为________。 解析 CuSO 设需要 CuSO 5H 5H2O 的相 4· 2O与 4· 2O 的质量为 x , H2O 的质量为 y 。 CuSO4·
1
2
解析
答案
0.095 mol 。 (2)气体A的物质的量_________ 解析 在整个反应过程前后,锰元素从+7价全部转化为+2价,说明整
个反应过程中转移了0.05 mol×5=0.25 mol电子。剩余固体与浓盐酸反 应生成气体 A,则 A应为氯气。所以整个反应过程中只有氧元素和氯元 素失电子。氧元素失电子产生氧气,转移了0.015 mol×4=0.06 mol电子。 根据电子守恒得知,氯元素必然转移0.19 mol电子。每产生1 mol氯气就 转移2 mol电子,所以一定会产生0.19 mol÷2=0.095 mol氯气。
荷守恒;在氧化还原反应中,氧化剂得电子总数和还原剂失电子总数相等,
1.原子(或离子)个数守恒 例1 现有铁、氧化亚铁、三氧化二铁的混合物粉末 3.44 g,向其中加入 100 mL 1 mol· L-1盐酸恰好完全溶解,收集到标准状况下的气体22.4 mL, 向反应后的溶液中加入 KSCN溶液不变色,则6.88 g该混合物在高温下用 5.6 克。 足量CO处理后,残留固体质量为______ 解析 该铁和铁的氧化物的混合物在高温下用足量 CO还原的残留固体应
解析
产生的沉淀是硫酸钡,物质的量是2.33 g÷233 g· mol-1=0.01 mol,
根据原子守恒可知硫酸铵的质量是0.01 mol×132 g· mol-1=1.32 g,则氯
化铵的质量是2.39 g-1.32 g=1.07 g,物质的量是1.07 g÷53.5 g· mol-1
=0.02 mol,因此混合物中n[(NH4)2SO4]∶n(NH4Cl)为1∶2。
1 2
解析
答案
(2)另一份固体混合物中 NH+ 4 与Ba(OH)2溶
液 ( 浓度同上 ) 恰好完全反应时,溶液中 0.100 mol· L-1 溶液体积变化忽 c(Cl - ) = _____________( 略不计)。 解析 每一份中硫酸铵和氯化铵分别是0.01 mol、0.02 mol,另一份固体
0.1NA 。 0.05 mol 、_______ 2.8 g时,则生成O2的物质的量及转移电子数分别为________
解析 2Na2O2+2CO2===2Na2CO3+O2
Δm(增重)
88
32
1.6 g
56
2.8 g
则生成O2为0.05 mol,转移电子数为0.1NA。
1 2
解析
答案
5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃下达到平衡,容器内压强 为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol, 78.6% 。 平衡时PCl5的分解率为________
1
2
解析
答案
2.如图,向盛有足量Na2O2的干燥管中通入一定量CO2气体,当干燥管增重
解析 答案
2.电子得失守恒
- 例2 向含有1 mol FeCl2的溶液中通入0.2 mol Cl2,再加入含0.1 mol X2O2 7 - n+, 的酸性溶液,使溶液中的Fe2+恰好全部被氧化,并使 X2O2 被还原为 X 7
3。 则n值为___ 解析 根据电子守恒可得1 mol×1=0.2 mol×2+0.1 mol×2×(6-n),
1
2
解析
答案
2.(2017· 浙江4月选考,29)分别称取2.39 g (NH4)2SO4和NH4Cl固体混合物 两份。 (1) 将其中一份配成溶液,逐滴加入一定浓
度的Ba(OH)2溶液,产生的沉淀质与加入
Ba(OH)2溶液体积的关系如图所示。混合物 1∶2 。 中n[(NH4)2SO4]∶n(NH4Cl)为______
例4
5.85 g NaCl固体与足量浓H2SO4和MnO2共热,逸出的气体又与过量
H2 发生爆炸反应,将爆炸后的气体溶于一定量水后再与足量锌作用,最 1.12 后可得H2______L( 标准状况)。
解析
答案
跟踪训练
1.将一定量CH4充分燃烧后的产物全部通入足量石灰水中,然后经过滤、 洗涤、干燥,称得沉淀质量为1.0 g,则标准状况时所燃烧的甲烷气体的 0.224 。 体积为_______L
解之,n=3。
解析
答案
3.电荷守恒 例3 在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10 mol· L-1,
-1。 - )为_____ 0.20 c(Mg2+)=0.25 mol· L-1,c(Cl-)=0.20 mol· L-1,则c(SO2 mol· L 4
解析
溶液为电中性,根据电荷守恒可得 c(Na + ) + 2c(Mg2 + ) = c(Cl - ) +
混合物中 NH+ 4 与Ba(OH)2溶液(浓度同上)恰好完全反应时,消耗氢氧化钡
是0.02 mol,因此溶液体积是200 mL,则溶液中c(Cl-)=0.02 mol÷0.2 L
=0.100 mol· L-1。
1 2
体会命题特点
解析
答案
细研解题方法
一、守恒法 方法指导 当物质之间发生化学反应时,其实质就是原子之间的化分和化合。即可推 知某种元素的原子无论是在哪种物质中,反应前后其质量及物质的量都不 会改变,即质量守恒;在化合物中,阴、阳离子所带电荷总数相等,即电 即电子守恒;在组成的各类化合物中,元素的正、负化合价总数的绝对值 相等 ,即化合价守恒。运用守恒法解题的基本类型主要有以下三种:
的差值(理论差量)。二是结合题中的条件求出或表示出实际的差值 (实际差
量)。
例5
将m g铁片置于CuSO4溶液中,一段时间后取出,洗净、干燥、称量,
6.4 g。 发现“铁片”增重0.8 g,则反应中生成Cu的质量为____
解题模板
解析
答案
跟踪训练
1.白色固体PCl5受热即挥发并发生分解:PCl5(g) PCl3(g)+Cl2(g)。现将
1
2
解析
答案
二、关系式法 方法指导 多步反应计算的特征是化学反应原理中多个反应连续发生,起始物与目标 物之间存在确定的量的关系。解题时应先写出有关反应的化学方程式或关 系式,依据方程式找出连续反应的过程中不同反应步骤之间反应物、生成 物物质的量的关系,最后确定已知物和目标产物之间的物质的量的关系, 列出计算式求解,从而简化运算过程。
专题1 化学家眼中的物质世界
专题讲座一
学考第29题——化学计算题解题方法
探究学考真题
1.(2017· 浙江11月选考,29)取7.90 g KMnO4,加热分解后剩余固体7.42 g。 该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A, 产物中锰元素以Mn2+存在。 请计算: 60%(或0.60) 。 (1)KMnO4的分解率_____________
- 2c( SO2 4 )。
解析
答案
跟踪训练
1.将0.195 g锌粉加入到20.0 mL的0.100 mol· L-1 MO溶液中,恰好完全反 M2+ 。 应,则还原产物可能是_____ 解析 锌的物质的量为0.003 mol,完全反应失电子0.006 mol,若M化合
价由+5变为x,则根据得失电子相等有(5-x)×0.02×0.100=0.006,可得
为铁,故本题实际上是求混合物中铁元素的质量,据混合物溶于盐酸后加
入KSCN不变色,说明溶液中无Fe3+,全部是FeCl2。由Cl-个数守恒可知: 1 1 n(FeCl2)= n(HCl)= ×0.1 L×1 mol· L-1=0.05 mol。又据铁元素守恒知 2 2 6.88 g混合物中含铁质量为2×0.05 mol×56 g· mol-1=5.6 g。
对分子质量为250,CuSO4的相对分子质量为160,依题意有
160 × x 250 20.0 = 100 ,x∶y=5∶11。 x+y
1 2
