第一章第二节原子结构与元素性质
第二节原子结构与元素的性质
第一章原子结构与性质
第二节原子结构与元素的性质
教学目标:
(一)知识与技能:
1、使学生了解电离能的概念及其内涵,认识主族元素电离能的变化规律,知道电离能与元素化合价的关系。
2、使学生知道主族元素电负性与元素性质的关系,认识主族元素电负性的变化规律。
3、使学生体会原子结构与元素周期律的本质联系。
(二)过程与方法:
运用演绎推理和数据分析掌握电离能和电负性在元素周期表中的变化规律。
(三)情感态度与价值观:
通过电负性电离能的逐步引入,感受科学家们在科学创造中的丰功伟绩,体会量变引起质变,内因是变化的根据的辨证唯物主义思想。
本节知识框架:
教学重点难点:
1、电离能、电负性的含义和它们的一般变化规律
2、核外电子排布与元素周期表周期、族的划分
3、元素的电离能、电负性、化合价的关系
教学媒介:多媒体演示
教学素材:
素材1:主族元素原子得失电子能力的变化趋势
素材2、元素的化合价
化合价是元素性质的一种体现。
观察思考:为什么钠元素的常见价态为+1价,镁元素的为+2价,铝元素的为+3价?化合价与原子结构有什么关系?
素材3、第三周期元素的第一电离能变化趋势图
素材4、同主族元素的第一电离能变化示意图
教学方法:诱导——启发式、演绎推理和逻辑探究相结合教学教学过程:。
高中化学选修3教案:第一章第二节原子结构与元素的性质

第二节原子结构与元素的性质一、教材分析本节课是人教版化学选修3第一章第二节的教学内容,是在必修2第一章《物质结构元素周期律》, 选修3第一章第一节《原子结构》基础上进一步认识原子结构与元素性质的关系。
本节教学内容分为两部分:第一部分在复习原子结构及元素周期表相关知识的基础上,从原子核外电子排布的特点出发,结合元素周期表进一步探究元素在周期表中的位置与原子结构的关系。
第二部分在复习元素的核外电子排布、元素的主要化合价、元素的金属性与非金属性变化的基础上,进一步从原子半径、电离能以及电负性等方面探究元素性质的周期性变化规律。
本节教学需要三个课时,本教学设计是第一课时的内容。
总的思路是通过复习原子结构及元素周期表的相关知识引入新知识的学习,然后设置问题引导学生进一步探究原子结构与元素周期表的关系,再结合教材中的“科学探究”引导学生进行问题探究,最后在学生讨论交流的基础上,总结归纳元素的外围电子排布的特征与元素周期表结构的关系。
根据新课标的要求,本人在教学的过程中采用探究法,坚持以人为本的宗旨,注重对学生进行科学方法的训练和科学思维的培养,提高学生的逻辑推理能力以及分析问题、解决问题、总结规律的能力。
二、教学重点1、原子结构与元素周期表的关系及原子核外电子排布的周期性变化。
2、电离能得定义及与原子结构之间的关系。
3、电负性及其意义。
三、教学难点1、电离能得定义及与原子结构之间的关系2、电离能得定义及与原子结构之间的关系3、电负性的应用。
四、教学方法复习法、延伸归纳法、讨论法、引导分析法1. 可以以问题思考的形式复习原子结构、元素周期律和元素周期表的相关知识,引导学生从元素原子核外电子排布特征的角度进一步认识、理解原子结构与元素在周期表中位置的关系。
2. 对于电离能和电负性概念的教学,应突出电离能、电负性与元素性质间的关系。
在了解电离能概念和概念要点的基础上,重点引导学生认识、理解元素电离能与元素性质间的关系。
高二人教版化学选修三教案集:1.2原子结构与元素的性质1

第一章原子结构与性质第二节原子结构与元素的性质教学目标1、进一步认识周期表中原子结构和位置、价态、元素数目等之间的关系2、知道外围电子排布和价电子层的涵义3、认识周期表中各区、周期、族元素的原子核外电子排布的规律4、知道周期表中各区、周期、族元素的原子结构和位置间的关系教学过程〖复习〗必修中什么是元素周期律?元素的性质包括哪些方面?元素性质周期性变化的根本原因是什么?〖课前练习〗写出锂、钠、钾、铷、銫基态原子的简化电子排布式和氦、氖、氩、氪、氙的简化电子排布式。
一、原子结构与周期表1、周期系:随着元素原子的核电—荷数递增,每到出现碱金属,就开始建立一个新的电子层,随后最外层上的电子逐渐增多,最后达到8个电子,出现稀有气体。
然后又开始由碱金属到稀有气体,如此循环往复——这就是元素周期系中的一个个周期。
例如,第11号元素钠到第18号元素氩的最外层电子排布重复了第3号元素锂到第10号元素氖的最外层电子排布——从1个电子到8个电子;再往后,尽管情形变得复杂一些,但每个周期的第1个元素的原子最外电子层总是1个电子,最后一个元素的原子最外电子层总是8个电子。
可见,元素周期系的形成是由于元素的原子核外屯子的排布发生周期性的重复。
2、周期表我们今天就继续来讨论一下原子结构与元素性质是什么关系?所有元素都被编排在元素周期表里,那么元素原子的核外电子排布与元素周期表的关系又是怎样呢?说到元素周期表,同学们应该还是比较熟悉的。
第一张元素周期表是由门捷列夫制作的,至今元素周期表的种类是多种多样的:电子层状、金字塔式、建筑群式、螺旋型(教材p15页)到现在的长式元素周期表,还待进一步的完善。
首先我们就一起来回忆一下长式元素周期表的结构是怎样的?在周期表中,把能层数相同的元素,按原子序数递增的顺序从左到右排成横行,称之为周期,有7个;在把不同横行中最外层电子数相同的元素,按能层数递增的顺序由上而下排成纵行,称之为族,共有18个纵行,16 个族。
第一章 第二节 第1课时 原子结构与元素周期表 课件高二下学期化学人教版(2019)选择性必修2

第四周期第ⅠB族、ds区 第四周期第ⅠA族、s区
02
构造原理与元素周期表
三、元素周期表的分区
例3.下列说法正确的是( C ) A.所有金属元素都分布在d区和ds区 B.最外层电子数为2的元素都分布在s区 C.元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素 D.基态原子的p能级上半充满的元素不一定位于p区
第二节 原子结构与元素的性质
第1课时 原子结构与元素周期表
PART 01
01
元素周期律、元素周期系和元素周期表
一、基本概念
1.原子序数
1869年,门捷列夫按相对原子质量从小到大的顺序将元素排列 起来,得到一个序列,并从最轻的元素氢开始编号,称为原子 序数。
现代化学中的原子序数的排列依据由相对原子质量修改为核电 荷数(质子数)。
02
构造原理与元素周期表
二、核外电子排布与族的关系
1.主族元素
主族序数
ⅠA
列数
1
价电子排布式 ns1
价电子数
1
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2
13
14
15
16
17
ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5
2
3
4
5
6
7
主族元素的价层电子就是最外层电子,全部在ns能级或nsnp能级 主族序数=价层电子数=最外层电子数
3d74s2
9
Ni 10
3d84s2 10
Cu 11 ⅠB 3d104s
1
11
Zn 12 ⅡB 3d104s
2
12
①除镧系和锕系元素,副族元素的价层电子都在(n-1)d和ns能级
高中化学选修3《物质结构和性质》第一单元第二节《原子结构与元素的性质》课件

二、元素周期律
元素的性质随着原子序数的递增而呈周期性 变化——元素周期律
1、原子半径(r)
(1)共价半径rc:单质分子中,共价 单键结合的两原子核间距离的一半 (2)van der Waals半径rv:单质分子 晶体中相邻分子间两个非键合原子核 间距离的一半 (3)金属半径是指金属单质的晶体 中相邻两个原子核间距离的一半
同理
例如:
E+ (g) - e- E 2+ (g)
I2
Li(g) e Li (g)
2 3
I1 520.2kJ mol
1
Li (g) e Li2 (g)
I 2 7298 .1kJ mol1
1
Li (g) e Li (g) I3 11815 kJ mol
S区
p区 d区
ⅠA、ⅡA
ns1-2 ns2np1-6
ⅢA~ⅦA和零族
ⅢB~ⅦB和Ⅷ族 (n-1)d1-9ns1-2
ds区 ⅠB、ⅡB
(n-1)d10ns1-2
f区 镧系和锕系(n-2)f0-14(n-1)d0-2ns2
4、过渡元素
①全部副族元素都称为过渡元素。包括d区、ds 区和f区的元素。其中镧系和锕系元素称为内过 渡元素 ②过渡元素原子的最外层电子数较少,除钯外都 只有1~2个电子,所以它们都是金属元素。 ③它们的(n-1)d轨道未充满或刚充满,或f轨道也未充 满,所以在化合物中常有多种氧化值,性质与主族元 素 有较大的差别。
IA 1 IIA IIIA IVA VA VIA VIIA
VIIIA
2
3 4 5 6 7 IIIB IVB VB VIB VIIB VIIIB IB IIB
原子结构与性质知识点归纳
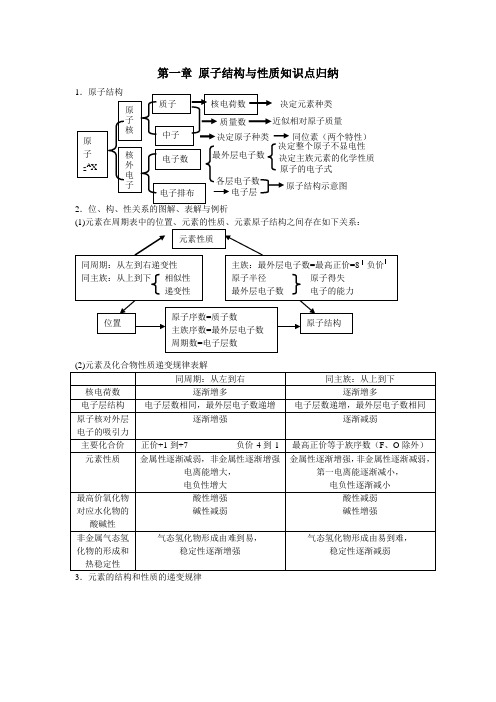
第一章 原子结构与性质知识点归纳2.位、构、性关系的图解、表解与例析3.元素的结构和性质的递变规律同位素(两个特性)4.核外电子构成原理(1)核外电子是分能层排布的,每个能层又分为不同的能级。
(2)核外电子排布遵循的三个原理:a .能量最低原理b .泡利原理c .洪特规则及洪特规则特例(3)原子核外电子排布表示式:a .原子结构简图 b .电子排布式 c .轨道表示式 5.原子核外电子运动状态的描述:电子云 6.确定元素性质的方法1.先推断元素在周期表中的位置。
2.一般说,族序数—2=本族非金属元素的种数(1 A 族 除外)。
3.若主族元素族序数为m ,周期数为n ,则: (1)m/n<1时为金属,m/n 值越小,金属性越强:(2)m/n>1时是非金属,m/n 越大,非金属性越强;(3)m/n=1时是两性元素。
随着原子序数递增① 原子结构呈周期性变化② 原子半径呈周期性变化③ 元素主要化合价呈周期性变化④ 元素的金属性与非金属形呈周期性变化⑤ 元素原子的第一电离能呈周期性变化⑥ 元素的电负性呈周期性变化元素周期律 排列原则① 按原子序数递增的顺序从左到右排列 ② 将电子层数相同的元素排成一个横行 ③ 把最外层电子数相同的元素(个别除外),排成一个纵行周期 (7个 横行) ① 短周期(第一、二、三周期)② 长周期(第四、五、六周期)③ 不完全周期(第七周期)性质递变 原子半径主要化合价元 素 周期表族(18 个纵行) ① 主族(第ⅠA 族—第ⅦA 族共七个) ② 副族(第ⅠB 族—第ⅦB 族共七个) ③ 第Ⅷ族(第8—10纵行) ④结构第二章 分子结构与性质复习1.微粒间的相互作用(2)共价键的知识结构2.分子构型与物质性质(1)微粒间的相互作用σ键π键 按成键电子云 的重叠方式极性键 非极性键一般共价键 配位键离子键 共价键 金属键 按成键原子的电子转移方式 化学键 范德华力氢键 分子间作用力本质:原子之间形成共用电子对(或电子云重叠) 特征:具有方向性和饱和性σ键特征 电子云呈轴对称(如s —s σ键、 s —p σ键、p —p σ键)π键 特征电子云分布的界面对通过键轴的一个平面对称(如p —p π键)成键方式共价单键—σ键共价双键—1个σ键、1个π键共价叁键—1个σ键、2个π键 规律 键能:键能越大,共价键越稳定键长:键长越短,共价键越稳定键角:描述分子空间结构的重要参数用于衡量共价键的稳定性 键参数 共 价 键定义:原子形成分子时,能量相近的轨道混合重新组合成一组新轨道sp 杂化 sp 2杂化sp 3杂化 分类 构型解释: 杂化理论sp 杂化:直线型sp 2杂化:平面三角形sp 3杂化:四面体型杂化轨道理论 价电子理论 实验测定 理论推测 构型判断 分 子 构 型共价键的极性 分子空间构型决定因素由非极性键结合而成的分子时非极性分子(O 3除外),由极性键组成的非对称型分子一般是极性分子,由极性键组成的完全对称型分子为非极性分子。
第一章 原子结构与性质课件 高中化学人教版(2019)选择性必修二

向后
首页
尾页
结束
向前
第一章 原子结构与性质 第一节 原子结构
构造原理
原子核外电子排列
能级
能层
一
二
三
四
五
六
七
符号
K
L
M
N
O
P
Q
最多电子数
2
8
18
32
50
72
98
能层
能层
K
L
M
N
…
能级
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
…
最多电子数
2
2
6
2
6
10
2
6
10
14
…
2n2
能量增加
能层
K
L
M
N
…
能级
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
…
最多电子数
2
2
6
2
6
10
2
6
10
14
…
第一章 原子结构与性质 第一节 原子结构
Fe(26):
向后
首页
尾页
结束
向前
三 构造原理与电子排布
构造原理
能层
K
L
M
N
…
能级
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
…
最多电子数
2
2
第一章第二节原子结构与元素的性质 第一课时

第一章原子结构与性质第二节原子结构与元素的性质【知识梳理】一、元素周期系1、含义:元素按其原子核电荷数递增排列的序列。
2、元素周期系的形成(1)每一周期从________元素开始到________元素结束,最外层电子排布从________递增到________(第一周期除外),但元素周期系的周期不是单调的,每一周期里元素的数目不总是一样多。
(2)元素形成周期系的根本原因是________________________发生周期性的重复。
(3)根据构造原理得出的核外电子排布,可以解释元素周期系的基本结构。
例如:第一周期从________开始,以________结束;其余各周期总是从________能级开始,以________能级结束,其间递增的核电荷数(或电子数)就等于每个周期里的元素数。
二、元素周期表的分区1、元素周期表的分区(1)根据核外电子的排布分区按电子排布式中最后填入电子的________可将元素周期表分为s、p、d、f共4个区,而第IB、第ⅡB族这2个纵列的元素的核外电子因先填满了________能级而后再填充________能级而得名ds区。
(2)根据元素的金属性和非金属性分区【正误判断】(1)价电子一定是最外层电子()(2)元素的价电子数一定等于其所在族的族序数()(3)同一族元素的价电子数一定相同()(4)基态原子的N层上只有一个电子的元素,一定是第IA族元素()(5)原子的价电子排布为(n-1)dn6~8ns2的元素一定是过渡元素()【课后作业】1.下列有关元素周期表分区的说法错误的是()A.p区不包含副族元素B.第五周期有15种f区元素C.d区、ds区均不存在非金属元素D.s区所有元素的p能级电子均为全满或全空状态2.核电荷数为52的元素,在元素周期表中的位置是()A.第五周期ⅡA族B.第四周期ⅡA族C.第五周期ⅡA族D.第五周期ⅡA族n-1d ns(a、b均是大于0的整数),下列有关说法正确的是()3.已知某元素基态原子的价层电子排布式为()a bA.该元素位于元素周期表的d区B.该元素位于元素周期表的ds区C.该元素的族序数为a+b D.该元素一定为金属元素4.下列说法正确的是()A.6C的电子排布式1s22s22p2y,违反了泡利不相容原理B.价电子排布为5s25p1的元素位于第五周期第ⅡA族,是p区元素C.电子排布式(22Ti)1s22s22p63s23p10违反了洪特规则D.ns电子的能量一定高于(n-1)p电子的能量4.下列说法正确的是()A.6C的电子排布式1s22s22p2y,违反了泡利不相容原理B.价电子排布为5s25p1的元素位于第五周期第ⅡA族,是p区元素C.电子排布式(22Ti)1s22s22p63s23p10违反了洪特规则D.ns电子的能量一定高于(n-1)p电子的能量5.在元素周期表中非金属元素最多的区是()A.s区B.p区C.d区D.ds区6.闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域,号称“崛起的第三金属”。
人教版选修三 1.2《原子结构与元素的性质》

③判断化合物中元素化合价的正 负
例:NaH中,Na:0.9 H:2.1
Na显正价,H显负价
[思考4]对角线规则:某些主族元素与右 下方的主族元素的有些性质相似,被称为 对角线原则。请查阅电负性表给出相应的 解释?
因为它们电负性的大小比较接近
1、只要有坚强的意志力,就自然而然地会有能耐、机灵和知识。2、你们应该培养对自己,对自己的力量的信心,百这种信心是靠克服障碍,培养意志和锻炼意志而获得的。 3、坚强的信念能赢得强者的心,并使他们变得更坚强。4、天行健,君子以自强不息。5、有百折不挠的信念的所支持的人的意志,比那些似乎是无敌的物质力量有更强大 的威力。6、永远没有人力可以击退一个坚决强毅的希望。7、意大利有一句谚语:对一个歌手的要求,首先是嗓子、嗓子和嗓子……我现在按照这一公式拙劣地摹仿为:对 一个要成为不负于高尔基所声称的那种“人”的要求,首先是意志、意志和意志。8、执着追求并从中得到最大快乐的人,才是成功者。9、三军可夺帅也,匹夫不可夺志也。 10、发现者,尤其是一个初出茅庐的年轻发现者,需要勇气才能无视他人的冷漠和怀疑,才能坚持自己发现的意志,并把研究继续下去。11、我的本质不是我的意志的结果, 相反,我的意志是我的本质的结果,因为我先有存在,后有意志,存在可以没有意志,但是没有存在就没有意志。12、公共的利益,人类的福利,可以使可憎的工作变为可 贵,只有开明人士才能知道克服困难所需要的热忱。13、立志用功如种树然,方其根芽,犹未有干;及其有干,尚未有枝;枝而后叶,叶而后花。14、意志的出现不是对愿 望的否定,而是把愿望合并和提升到一个更高的意识水平上。15、无论是美女的歌声,还是鬓狗的狂吠,无论是鳄鱼的眼泪,还是恶狼的嚎叫,都不会使我动摇。16、即使 遇到了不幸的灾难,已经开始了的事情决不放弃。17、最可怕的敌人,就是没有坚强的信念。18、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下 去。19、意志若是屈从,不论程度如何,它都帮助了暴力。20、有了坚定的意志,就等于给双脚添了一对翅膀。21、意志坚强,就会战胜恶运。22、只有刚强的人,才有神 圣的意志,凡是战斗的人,才能取得胜利。23、卓越的人的一大优点是:在不利和艰难的遭遇里百折不挠。24、疼痛的强度,同自然赋于人类的意志和刚度成正比。25、能 够岿然不动,坚持正见,度过难关的人是不多的。26、钢是在烈火和急剧冷却里锻炼出来的,所以才能坚硬和什么也不怕。我们的一代也是这样的在斗争中和可怕的考验中 锻炼出来的,学习了不在生活面前屈服。27、只要持续地努力,不懈地奋斗,就没有征服不了的东西。28、立志不坚,终不济事。29、功崇惟志,业广惟勤。30、一个崇高 的目标,只要不渝地追求,就会居为壮举;在它纯洁的目光里,一切美德必将胜利。31、书不记,熟读可记;义不精,细思可精;惟有志不立,直是无着力处。32、您得相 信,有志者事竟成。古人告诫说:“天国是努力进入的”。只有当勉为其难地一步步向它走去的时候,才必须勉为其难地一步步走下去,才必须勉为其难地去达到它。33、 告诉你使我达到目标的奥秘吧,我唯一的力量就是我的坚持精神。34、成大事不在于力量的大小,而在于能坚持多久。35、一个人所能做的就是做出好榜样,要有勇气在风 言风语的社会中坚定地高举伦理的信念。36、即使在把眼睛盯着大地的时候,那超群的目光仍然保持着凝视太阳的能力。37、你既然期望辉煌伟大的一生,那么就应该从今 天起,以毫不动摇的决心和坚定不移的信念,凭自己的智慧和毅力,去创造你和人类的快乐。38、一个有决心的人,将会找到他的道路。39、在希望与失望的决斗中,如果 你用勇气与坚决的双手紧握着,胜利必属于希望。40、富贵不能淫,贫贱不能移,威武不能屈。41、生活的道路一旦选定,就要勇敢地走到底,决不回头。42、生命里最重 要的事情是要有个远大的目标,并借助才能与坚持来完成它。43、事业常成于坚忍,毁于急躁。我在沙漠中曾亲眼看见,匆忙的旅人落在从容的后边;疾驰的骏马落在后头, 缓步的骆驼继续向前。44、有志者事竟成。45、穷且益坚,不坠青云之志。46、意志目标不在自然中存在,而在生命中蕴藏。47、坚持意志伟大的事业需要始终不渝的精神。 48、思想的形成,首先是意志的形成。49、谁有历经千辛万苦的意志,谁就能达到任何目的。50、不作什么决定的意志不是现实的意志;无性格的人从来不做出决定。我终 生的等待,换不来你刹那的凝眸。最美的不是下雨天,是曾与你躲过雨的屋檐。征服畏惧、建立自信的最快最确实的方法,就是去做你害怕的事,直到你获得成功的经验。 真正的爱,应该超越生命的长度、心灵的宽度、灵魂的深度。生活真象这杯浓酒,不经三番五次的提炼呵,就不会这样可口!人格的完善是本,财富的确立是末能力可以慢 慢锻炼,经验可以慢慢积累,热情不可以没有。不管什么东西,总是觉得,别人的比自己的好!只有经历过地狱般的折磨,才有征服天堂的力量。只有流过血的手指才能弹 出世间的绝唱。对时间的价值没有没有深切认识的人,决不会坚韧勤勉。第一个青春是上帝给的;第二个的青春是靠自己努力的。不要因为寂寞而恋爱,孤独是为了幸福而 等待。每天清晨,当我睁开眼睛,我告诉自己:我今天快乐或是不快乐,并非由我所遭遇的事情造成的,而应该取决于我自己。我可以自己选择事情的发展方向。昨日已逝,
第一章 第二节 第2课时 元素周期律-高二化学人教版(2019)选择性必修2课件

03
电负性
二、电负性的应用
3.判断化合物中元素化合价的正负
电负性数值大的元素原子吸引电子的能力强,元素的化合价 通常为负价;
电负性数值小的元素原子吸引电子的能力若,元素的化合价 通常为正价。
例3.电负性:H为2.1,C为2.5,Si为1.8, 则CH4中碳元素化合价为_-__4_价_,氢元素化合价为_+__1_价_; SiH4中硅元素化合价为_+__4_价_,氢元素化合价为-__1_价__
02
电离能
三、逐级电离能
1.逐渐电离能的变化趋势
同一元素原子的逐级电离能 越来越大。
首先失去的是能量最高的电 子,故第一电离能最小;失 去电子后形成阳离子,所带 正电荷对电子的吸引力更强, 从而逐级电离能越来越大。
02
电离能
三、逐级电离能
2.逐渐电离能与主族元素的价电子数及化合价的关系
主族元素的逐级电离能在逐 渐增大的过程中会发生一次 突变,因为电子是分层排布 的,相较于外层电子,内层 电子很难失去。
Y
原子核外s能级上的电子总数与p能级上的电子总数相等,但 第一电离能都高于同周期相邻元素
Z 其价电子中,在不同形状的原子轨道中运动的电子数相等
N 只有一个不成对电子
请完成下列空白(请填元素符号) : (1)写出各元素的元素符号:W:__H__ 、X:__O__、Y:_M__g_、Z:__S_i _、N:__C_l_。 (2)X、Y和Z三种元素的原子半径由大到小的顺序:_M__g_>_S_i_>_O__。
注意:不能将电负性1.8作为划分金属和非金属的绝对标准, 如锑、铅、铋等金属元素的电负性均为1.9。
03
电负性
二、电负性的应用
2.判断化学键的类型
《原子结构与元素的性质 》

第二课时
28
复习:
1.原子的电子排布与周期的划分 ns1 → ns2np6(第一周期除外)
碱金属 稀有气体
2.族序数与价电子数的关系
主族元素:族序数=原子的最外层电子数 =价电子数 副族元素:大多数族序数 =(n-1)d+ns的电子数 =价电子数
29
3.按电子排布,可把周期表里的元素 划分为5个区,哪5个区?这些区分别 有几个纵列?外围电子排布为?
选修3课件
第一章 原子结构与性质
第二节 原子结构与元素的性质 (第一课时)
一 、原子结构与元素周期表
知识回顾
元素周期表的结构
知识回顾:元素周期表的结构
第1周期:2 种元素
短周期
第2周期:8 种元素
第3周期:8 种元素 第4周期:18 种元素
周期
长周期
第5周期:18 种元素
(横行)
第6周期:32 种元素 镧57La – 镥71Lu 共15 种元素称镧系元素
不完全周期
第7周期:26种元素 锕89Ac – 铹103Lr 共15 种元素称锕系元素
周期序数 = 电子层数(能层数)
知识回顾:元素周期表的结构 Ⅰ A , Ⅱ A , Ⅲ A , Ⅳ A ,Ⅴ A , Ⅵ A , Ⅶ A 主族:
共七个主族
族
副族: Ⅰ B , Ⅱ B , Ⅲ B , Ⅳ B ,Ⅴ B , Ⅵ B , Ⅶ B
6s1———————————————6s2 6p6 周期系:原子核外电子的排布发生周期性的重复。
9
科学探究 1.原子的电子排布与周期的划分
(1)结合周期表,我们会发现,每一周期的第 碱金属 一种元素(除第一周期外)是 ________, 1 ns 最外层电子排布为______,每一周期的最后 稀有气体 一种元素都是 ___________, 这些元素的最 外层电子排布除He为1s2 外,其余都是
第一章第二节《原子结构与元素的性质》全课时(人教版选修三)

1.元素周期表有几个周期?这几个周期如 何分类? 2.每一周期包含多少种元素? 3.元素周期表有一个纵行?分为几个族?这 几个族如何分类? 4.从左到右依次是什么族?
原子核外电子排布与周期的划分
写出以下四组原子的电子排布式,探寻规律 第1周期:H、He 第2周期:Li、C、O、Ne 第3周期:Na、Si、S、Ar 第4周期:K、Cr、Cu、Kr 除第一周期外,每周期原子核外电子排布从填 s p 充____能级开始,充满_____能级结束。 元素的周期数 每周期元素种数 该元素的最大能层数 相应能级组中原子轨 道所能容纳的电子数
电离能
第一电离能(I1) 气态电中性基态原子失去一个电子转化为气态 基态正离子所需要的最低能量叫做第一电离能。
第二电离能(I2)
原子的+1价气态基态正离子再失去一个电子所 需要的能量叫做第二电离能。
电离能变化规律
①同一周期内随着原子序数的增加,元素的第 增大 一电离能总体呈________的趋势,但有曲折, ⅡA ⅢA ⅤA ⅥA 就I1而言,____族>____族,____族>____族。 碱金属 同一周期内,_________的第一电离能最小, 稀有气体 __________的第一电离能最大。 I1(C)<I1(O)<I1(N)
元素 Al
B
Be C
CI F
Li
Mg N
Na O
P
S
Si
电负 1.5 2.0 1.5 2.5 3.0 4.0 1.0 1.2 性
3.0 0.9 3.5 2.1 2.5 1.8
5.解释对角线原理
课堂练习
根据周期律对角线规则,金属铍与铝单质及其化
合物的性质相似,又知AlCl3熔沸点较低,易升华, 试回答下列问题:
人教版化学《元素周期表》精美课件

1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
二、元素周期表
1.原子的电子排布与族的划分 主族元素价电子 ns1~2或ns2np1~5 族序数=价电子数
零族元素价电子 ns2np6(He除外)
过渡元素价电子
第一章 原子结构与性质
第二节 原子结构与元素性质
第一课时
知识回顾:一、元素周期表的结构(由周期与族构成)
短周期
周期 (横行)
长周期
第1周期(H--He):2 种元素 第2周期(Li--Ne):8 种元素 第3周期(Na--Ar):8 种元素
第4周期(K--Kr):18 种元素 第5周期(Rb--Xe):18 种元素 第6周期(Cs--Rn):32 种元素 第7周期(Fr--Og) :32种元素
ⅠB~ⅡB族 (n-1)d10ns1~2 族序数=最外层电子数 ⅢB~ⅦB族 (n-1)d1~5ns1~2 族序数=价电子数
1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
练一练
已知某元素的原子序数是25,写出该元素原子的 价电子层结构式,并指出该元素周期表 课件 人教版高中化学选修三
1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
随着核电荷数的递增,电子填充遵循构造原理, 每一周期里元素数目随着周期序号的递增渐渐增 多。元素周期系周期发展如同螺壳上的螺旋。
1 . 2 . 1原子结构与元素周期表 课件 人教版高中化学选修三
(1)同一周期元素结构和性质具有一定的递变性;从左到
人教版高中化学选择性必修第2册 第一章 原子结构与性质 第二节 原子结构与元素的性质,

⑥周期序数越大,该周期所含金属元素一般越多。
你认为正确的是( )
A.①⑥
B.①②③⑤⑥
C.①④⑥
D.②③⑤
题型诀
题型诀
变式练 1-2[山西太原五中 2021 高二月考]下列各组基态原子中,彼此化学性质一定相似的是( ) A.最外层都只有一个电子的 X、Y 原子 B.原子核外 L 层上有 8 个电子的 X 原子与 M 层上有 8 个电子的 Y 原子 C.2p 轨道上有 3 个未成对电子的 X 原子与 3p 轨道上有 3 个未成对电子的 Y 原子 D.原子核外电子排布式为 1s2 的 X 原子与原子核外电子排布式为 1s22s2 的 Y 原子
题型诀
题型1 原子结构与元素周期表 例 1[陕西长安一中 2021 高二月考]具有下列电子层结构的基态原子或离子,以下有关其对应的元素在 周期表中的位置说法正确的是( ) A.最外层电子排布为 1s2 的原子和最外层电子排布为 2s2 的原子,所对应的两元素一定在同一主族 B.3p 能级上有 1 个空轨道的原子和 4p 能级上有 1 个空轨道的原子,所对应的两元素一定在同一主族
题型诀
题型诀
题型2 核外电子排布与元素周期表的分区
例 2[河北唐山一中 2020 高二月考]在研究原子核外电子排布与元素周期表的关系时,人们发现价层电 子排布相似的元素集中在一起。据此,人们将元素周期表分区,并以最后填入电子的能级符号作为该区的符 号,如图所示。
(1)在 s 区中,族序数最大、原子序数最小的元素,基态原子的价电子的电子云形状为________。 (2)在 d 区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为___________________________, 其中较稳定的是________(填离子符号)。 (3)在 ds 区中,族序数最大、原子序数最小的元素,基态原子的价层电子排布式为________________。 (4)在 p 区中,第二周期第ⅤA 族元素基态原子的价层电子排布图为________________。 (5)当今常用于核能开发的元素是铀和钚,它们在________区中。
第二节 原子结构与元素的性质课件-高二化学人教版2019选择性必修2

(2)对角线规则 ① 在元素周期表中,某些主族元素与右下方的主族元素(如图)的有些性 质是相似的(如锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是 过氧化物),这种相似性被称为对角线规则。
② 处于“对角线”位置的元素,它们的性质具有相似性。 微点拨:对角线规则是一种经验规律的总结,不适合所有元素、主要
一、元素周期系和元素周期表
1869年,门捷列夫制作了历 史上第一张周期表,按照相对 原子质量从小到大的排列起来, 并从最轻的元素氢开始进行编 号。第1—7族分主副族,第八 族称为过渡元素(第八族是铁、 钴、镍等“三素组”)。
门捷列夫周期表
维尔纳的特长式周期表 维尔纳周期表前五个周期的元素种类被完全确定—2、8、8、18、 18,但第六、七周期因镧系和锕系元素种类未知而未定。
6、预言119号元素基态原子最外层电子排布;预言第八周期有多少种元素。 提示:119号元素的基态原子最外层电子排布为8s1。第八周期应有50 种元素。
4、元素周期表的分区
(1)按金属元素与非金属元素分区 金属与非金属交界处元素的性质特点:
在元素周期表中位于金属和非金属分界线 上的元素兼有金属和非金属的性质,位于 此处的元素(如硼、硅、锗、砷、锑等) 常被称为半金属或类金属(一般可用作半 导体材料)。
Be 2OH BeO22 H2
Al2O3 2OH 2AlO2 H2O
BeO 2OH BeO22 H2O
Al(OH)3 3H =Al3 3H2O Be(OH)2 2H =Be2 2H2O
高中化学选择性必修二 第1章第2节 原子结构与元素的性质 讲义

第二节原子结构与元素的性质一、元素周期律、元素周期系和元素周期表1.元素周期律:元素性质随着原子核电荷数递增发生周期性的递变。
2.元素周期系:按其原子核电荷数递增排列的序列称为元素周期系。
这个序列中的元素性质随着核电荷数递增发生周期性重复。
3.元素周期表:呈现元素周期系的表格。
【注】元素周期系只有一个,元素周期表多种多样。
二、构造原理与元素周期表1.核外电子排布与周期的划分(1)电子排布与周期划分的本质联系根据构造原理得出的核外电子排布可以解释元素周期系中每个周期的元素数。
第一周期从1s1开始,以1s2结束,只有两种元素。
其余各周期总是从n s能级开始,以n p结束,而从n s能级开始以n p结束递增的核电荷数(或电子数)就等于每个周期里的元素数。
(2)规律:①周期序数=电子层数。
②本周期包含的元素种数=对应能级组所含原子轨道数的2倍=对应能级组最多容纳的电子数。
2.核外电子排布与族的划分(1)划分依据:取决于原子的价电子数目和价层电子排布。
(2)特点:同族元素的价电子数目和价层电子排布相同。
(3)规律①对主族元素,同主族元素原子的价层电子排布完全相同,价层电子全部排布在n s 或n s 、n p 轨道上(见下表)。
价层电子数 = 族序数。
③稀有气体元素:价电子排布为n s2n p6(He除外)。
三、元素周期表1.元素周期表的结构2.元素周期表的分区(1)根据核外电子排布根据核外电子排布式中最后填入电子的能级符号可把周期表里的元素划分成4个区:s区、p区、d区和f区(除ΙB、ⅡB族外。
)(2)根据元素金属性与非金属性①金属元素和非金属元素的分界线为沿B、Si、As、Te、At与Al、Ge、Sb、Po之间所画的一条连线,非金属性较强的元素处于元素周期表的右上角位置,金属性较强的元素处于元素周期表的左下角位置。
②处于d区、ds区和f区的元素全部是金属元素。
s区的元素除氢外,也全部是金属元素。
【注】p区元素价电子不都是n s2n p1~6,如He元素的价电子为2s2。
【高中人教版全套教师用书】选修3物质结构与性质

第一章原子结构与性质本章说明一、教学目标1. 了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。
2. 了解能量最低原理,知道基态与激发态,知道原子核外电子在一定条件下会发生跃迁产生原子光谱。
3. 了解原子核外电子的运动状态,知道电子云和原子轨道。
4. 认识原子结构与元素周期系的关系,了解元素周期系的应用价值。
5. 能说出元素电离能、电负性的涵义,能应用元素的电离能说明元素的某些性质。
6. 从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。
二、内容分析1. 地位与功能本章是在学生已有原子结构知识的基础上,进一步深入地研究原子的结构,从构造原理和能量最低原理介绍了原子的核外电子排布以及原子光谱等,并图文并茂地描述了电子云和原子轨道;在原子结构知识的基础上,介绍了元素周期系、元素周期表及元素周期律。
总之,本章按照课程标准要求比较系统而深入地介绍了原子结构与元素的性质,为后续章节内容的学习奠定基础。
尽管本章内容比较抽象,是学习难点,但作为本书的第一章,教科书从内容和形式上都比较注意激发和保持学生的学习兴趣,重视培养学生的科学素养,有利于增强学生学习化学的兴趣。
通过本章的学习,学生能够比较系统地掌握原子结构的知识,在原子水平上认识物质构成的规律,并能运用原子结构知识解释一些化学现象。
2. 内容的选择与呈现根据课程标准对“物质结构与性质”模块的要求,本章依据本模块的“主题1 原子结构与元素的性质”的要求进行内容的选取,充分考虑了初中化学和化学2中的原子结构知识的基础,注意知识的衔接与深化。
在第一节“原子结构”中,在学生已有知识的基础上,教科书不再重复建立原子结构的概念,而是直接建立核外电子的能层(即“电子层”)和能级(即“电子亚层”)的概念,给出每一能层有几个能级,每个能级最多可以容纳几个电子,教科书没有介绍原子核的组成;有了能层和能级的概念,直接给出构造原理,并根据构造原理进行核外电子排布;有了构造原理,又由构造原理引出了能量最低原理,并同时引出了基态和激发态的概念,以及原子光谱;由于在第二章介绍共价键时需要涉及电子云和原子轨道等概念,该节在描述原子核外电子的运动状态时介绍了这两个概念,有了原子轨道的概念,结合原子核外电子的轨道排布式,简单介绍了泡利原理和洪特规则。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
复习 元素:具有相同核电荷数的一类原子的总称 核素:含有一定数目质子和中子的一种原子 同位素:质子数相同中子数不同的 同一种元素的不同原子 核电荷数=核内质子数=核外电子数=原子序数
质量数A= 质子数Z+ 中子数N
一、原子结构与元素周期表
1、周期 元素周期表的横行
①特点 同周期元素电子层数相同 同周期元素从左至右原子依次序数递增
2.从下表的电离能数据中你能发现一些问题吗?如:电 离能的数值大小与原子核外电子排布的关系、金属元 素与非金属元素的区别等。请提出并作适当的解释。
I1 I2 I3 I4 I5 I6 I7 I8 元 素 KJ/mol KJ/mo KJ/mo KJ/mo KJ/mo KJ/mol KJ/mo KJ/mo l l l l l l
2.同一周期元素的第一电离能从左到右呈增大趋势。 为什么? 3.同一主族元素的第一电离能从上到下逐渐减小。 为什么? 4.在同一周期中第一电离能最小的是碱金属元素,最大的 是稀有气体元素。 为什么?
5.在第二周期中Be和N元素及第三周期中Mg和P的第一 电离能大于相邻的元素的第一电离能。 为什么?
总结一下
(3) He Ne Ar ;(4)Na Al S P 答案(1) Li Na K ; (2)N C Be B
(3) He Ne Ar; (4) P S Al Na
问题4:短周期元素A、B,A元素的最外层电子数等于最 内层上的电子数;B元素最外层电子数是最内层上电子数 的3倍。试判断A、B可能有的元素并写出它们的原子电 子排布式;比较当A、B在同一周期时它们的第一电离能 数值大小关系。
参考答案:因为碱金属元素原子的外围电子排布 式为nS1,在同周期中(除稀有气体)原子半径最 大,核对外层电子引力最小,最容易失去最外层 的一个电子,所以碱金属元素的第一电离能在同 一周期中最小。而稀有气体元素原子的外围电子 排布式为nS2nP6(He为1S2),是稳定结构,在同 一周期中最难失去电子,所以在同一周期中稀有 气体的第一电离能最大。
答案: (1) x(2) x(3)√(4) x
3、根据2n2的规律推算第一到第四电子 层最多可以容纳的电子数目为 。
(6. 2,8,8,18)
4、已知某原子的电子分布是 1s22s22p63s23p63d104s24p1 ( 1 ) 这 元 素 的 原 子 序 数 是 多 少 ? (2)这元素属第几周期? 第几族?是主族元素 还是过渡元素? (3)哪些电子是这个原子的价电子。 答案:
提示:从同主族的原子结构变化来回答。
参考答案:因为同一主族从上到下,随着核电荷 数的增加,电子层数增加,原子半径增大,核对 外层电子的引力减小,失电子所需的能量减小, 元素第一电离能逐渐减小。
4.在同一周期中第一电离能最小的是碱金属元 素,最大的是稀有气体元素。为什么?
提示:从它们的原子的外围电子排布式和原子结构的特 点来思考。
3.元素第一电离能的变化规律 同一周期从左到右元素的第一电离能总体上是呈 提示:锂离子和镁离子的电子 逐渐增大趋势; 排布式为:
+: 1S2 是稳定结构; Li 同一主族从上到下,元素第一电离能逐渐减小。 Mg2+:1S2 2S22P6,它的P轨道为 即元素第一电离能随着元素核电荷数的递增呈 全充满,结构稳定。如果它们 现周期性变化。 再要失去电子,所需的能量就 很大。 4.电离能知识的应用:
Li C O 520 1086 1314 7295 2351 3387 11815 4619 5298 6220 7466 37818 10986 47216 13320 71307 84048
第一章 原子的结构与性质
第二节 原子结构与元素性质 (第一课时) 博爱县第一中学 高一(3)班 作课教师:张立原
知识与技能目标:
• 1、掌握原子半径的变化规律 • 2、能说出元素电离能的涵义,能应用元素的电离能说明 元素的某些性质 • 3、进一步形成有关物质结构的基本观念,初步认识物质 的结构与性质之间的关系 • 4、认识主族元素电离能的变化与核外电子排布的关系 • 5、认识原子结构与元素周期系的关系,了解元素周期系 的应用价值 • 6、能说出元素电负性的涵义,能应用元素的电负性说明 元素的某些性质
5.在第二周期中Be和N元素及第三周期中Mg和 P的第一电离能大于它们相邻的元素的第一电 离能。为什么?
提示:请同学们先写出Be、B、N、O、Mg、Al、P、S 的电子排布式,并作比较。 Be:1S2 2S22P0 (B:1S2 2S22P1) N:1S2 2S22P3 (O:1S2 2S22P4) Mg:1S2 2S22P6 3S23P0 (Al:1S2 2S22P6 3S23P1) P:1S2 2S22P6 3S23P3 (S:1S2 2S22P6 3S23P4) 我们知道:当原子核外电子排布在能量相等的轨道 上形成全空(P0、d0、f0)或半充满(p3、d5、f7)或全 充满(p6、d10、f14)结构时原子处于能量较低状态(即 洪特规则特例),所以失电子所需能量较大,即 I1较大。 而Be、N、Mg、P元素的原子结构恰好满足这一点,所 以导致它们的第一电离能大于它们相邻元素。
练习: 1 、判断下列各基态元素原子的电子排布式是 正 确 还 是 错 误 , 如 果 错 误 在 空 格 中 改 正 。 (1)Li:1s2 ( ) _______;
(2)Be: 1s22s1 2p1( )________;
(3)O: 1s22s2 2px22py2( ) _______;
(4)K: 1s22s2 2p63s2 3p63d1( ) ________; (5)Cu: 1s22s2 2p63s2 3p63d94s1 ( ) ______。
(1) 31(2) 4;IIIA;主族元素.(3) 4s24p1
第一章 原子的结构与性质
第二节 原子结构与元素性质 (第二课时)
二、元素周期律
元素周期律:元素的性质随着原子序数 的递增而呈周期性的变化
1、原子半径
决定因素 层数 层数多半径大 电子间斥力大 核电 核电荷数大半径小 正负电荷 荷数 间引力大
同周期主族元素:从左至右原子半径递减 同主族元素:从上至下原子半径递增 电子层结构相同的离子原子序数小的半径大!
2、电离能
①第一电离能 气态电中性基态原子失去一个电子转 化为气态基态正离子所需最低能量 同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能 利用逐级电离能判断化合价
答案: (1) √(2) x; 1s22s2 (3) x; 1s22s2 2px22py12pz1(4) x; 1s22s2 2p63s2 3p64s1 (5) x; 1s22s2 2p63s2 3p63d104s1
2、判断下列表达是正确还是错误 (1)1s22p1属于基态; ( ) (2)1s22s2 2p63s2 3p63d54s1属于激发态; ( ) (3)1s22s2 2p62d1属于激发态; ( ) (4)1s22s2 2p63d1属于基态; ( )
参考答案:从表中数据可知: Li元素的I2远大于I1, 第二电离能:是指+ 1价气态离子失去一个电子 因此Li容易失去第一个电子,而不易失去第二个电子; 形成+2价气态离子所需的最低能量称该元素的 即Li易形成Li+,而不易形成Li2+ 。镁元素的 I 1、 I 2 ... 第二电离能。用 I2表示。类似用I3、I4 表示元素 相差不大,I3远大于它们,说明镁容易失去两个电子, ...电离能等。 的第三、四 而不易失去第三个电子,因此镁易形成Mg2+,而不 易形成Mg3+。 观察分析下表电离能数据回答问题: I1 KJ/mol I2 KJ/mol 元素 Li 520 7295 Mg 738 1451 I3 KJ/mol 11815 7733
②周期的组成
短 周 期 长 周 期 周期序数 起始原子序数 终止原子序数 元素种类 1 2 2 一 3 10 8 二 11 18 8 三 19 36 18 四 37 54 18 五 55 86 32 六 87 118/112 32/26 七
第七周期也称为不完全周期
镧系:57~71 锕系:89~103
拓展思考题: 1.用表中提供的数据解释:为什么钠原子的最外层电子 数是1而镁原子的最外层电子数为2?
元素 Na Mg
I1 KJ/mol 496 738
I2 KJ/mol 4562 733
参考答案:钠元素I1远小于I2、I3,说明钠原子核外有 一个电子离核远,受核的引力小,易失去;同时也说明 I2、I3代表的电子与I1代表的电子不在同一电子层,所 以钠原子的最外层电子数为1。而镁元素的I1和I2相差不 大,说明它们代表的电子是在同一电子层,I3远大于I1、 I2,说明I3代表的电子与I1、I2代表的电子不在同一电子 层,所以镁原子最外层的电子数为2。
问题: 解释为什么锂元素易形成Li+,而不易形成Li2+; 镁元素易形成Mg2+,而不易形成Mg3+?
3.元素第一电离能的变化规律
观察分析下图元素第一电离能的变化情况,寻找它们的 变化有哪些规律?同时你是否还能发现一些问题?请讨 论总结。
规律和问题: 1.总体上:金属元素的第一电离能都 较小 ,非金属元 素和稀有气体元素的第一电离能都 较大 。 为什么?
2、族 元素周期表的纵行
A结尾 ,ⅠA~ⅦA 7 主族:
族 16
B结尾 , ⅢB~ⅦB,ⅠB,ⅡB 7 副族: 1 Ⅷ族:
1 0族:
副族、Ⅷ族通称过渡元素,过渡金属 特点: 主族元素族序数=原子最外层电子数 一些族的别名
3、分区 按最后填入电子所属能级符号
ds区除外
s区 ⅠA、ⅡA 1、2 两列 d区 ⅢB~ⅦB、 Ⅷ 3 ~ 7、8 ~ 10 八列 ds区 ⅠB、ⅡB 11、12两列 p区 ⅢA~ⅦA、O 13 ~ 17、18 六列 f区
2.同一周期元素的第一电离能 从左到右元素的第 一电离能总体上是呈增大趋势。 为什么?
