2019安徽高中化学竞赛结构化学第八章金属的结构和性质习题答案不全语文
高中结构化学试题及答案

高中结构化学试题及答案一、选择题(每题2分,共20分)1. 原子半径最大的元素是:A. 氢B. 氧B. 钠D. 氟2. 以下哪个元素的电子排布不是按照能量最低原理排列的?A. 氢B. 锂C. 氮D. 氧3. 化学键中,哪种键的性质是“头对头”的?A. 离子键B. 共价键C. 金属键D. 氢键4. 以下分子中,哪个是极性分子?A. CO2B. CH4C. H2OD. C2H45. 以下哪种化合物属于共价化合物?A. NaClC. H2OD. Fe6. 原子核外电子的排布遵循哪一条规则?A. 能量最低原理B. 泡利不相容原理C. 洪特规则D. 所有上述规则7. 以下哪种物质是离子晶体?A. 金刚石B. 石墨C. 食盐D. 干冰8. 以下哪种物质是金属晶体?A. 金刚石B. 石墨C. 铜D. 石英9. 以下哪种物质是分子晶体?A. 金刚石B. 石墨C. 铜D. 冰10. 以下哪种物质是原子晶体?A. 金刚石B. 石墨D. 冰答案:1. C 2. D 3. B 4. C 5. C 6. D 7. C 8. C 9. D 10. A二、填空题(每空1分,共10分)11. 原子中电子数等于________,质子数等于________。
12. 化学键的类型主要有________、________和金属键。
13. 根据分子的极性,分子可以分为________分子和极性分子。
14. 离子晶体是由________构成的,而金属晶体是由________构成的。
15. 原子晶体具有高硬度和高熔点的特性,这是因为它们具有________结构。
答案:11. 中子数,质子数 12. 离子键,共价键 13. 非极性 14. 离子,金属原子 15. 紧密排列的原子三、简答题(每题5分,共10分)16. 请简述什么是共价键,并给出一个例子。
17. 请解释什么是金属键,并说明金属晶体的一般特性。
答案:16. 共价键是由两个原子之间共享一对电子而形成的化学键。
安徽高中化学竞赛-结构化学8金属的结构和性质

第二层球堆上去, 为了保持最密堆积, 应放在第一层的 空隙上。每个球周围有6个空隙, 只可能有3个空隙被第 二层球占用。
立方最密堆积(A1)
第
三
层
球
有
六方最密堆积(A3)
两
种
放
法
8.3.1 立方最密堆积(A1)
cubic closest packing (ccp)
6) 对称性:
c 轴方向有
密置层与c 轴垂直,只有在垂直于c 的方向 易滑移
A1 A3堆积对比
共 同 点:
不 同 点:
都为最密堆积 配位数一样 12 球数:正八面体空隙数: 正四面体空隙数=1:1:2
一样,74.05%
A1可划出立方晶胞,对称性高于A3; A1型堆积在4个方向上有密置层面,比A3多。 A1型金属具有更突出的延展性,质地柔软。
位数不同引起的,配位数越高,半径越大。
配位数: 12 8
6
4
相对半径比: 1 0.97 0.96 0.88
一般书后表中给出的金属原子半径以配位数为12,若 其配位数不为12可换算。
(1/2, 1/2, 1/2) (1/2, 0, 0)
(0, 1/2, 0)
正八面体空隙
(0, 0, 1/2)
5) 空间利用率
(100)面
6) 特征对称元素: 43 3
3
3 3
八个顶点所对应的与四 个3垂直方向上都有密 置层,所以易滑动。
(111)面
8.3.2 六方最密堆积(A3)
hexagonal closest packing (hcp)
空带
空带
满带 n型半导体
2020高中化学竞赛无机化学(修订版)08分子结构第一节离子键等(共85张)

HCl 键的离子性 = 0.18/1 × 100% = 18%
一些物质的分子偶极矩 (×1030 Cm)
分 H2 Cl2 N2 O2 CO2 CS2 CH4 SO2 H2O NH3 HF HCl HBr HI 子 式
0 0 0 0 0 0 0 5.33 6.17 4.9 6.37 3.57 2.67 1.40
(A) 电荷数: NaCl 、MgO (B) 离子半径:d = r + r+
r r+
• 可由实验求得离子半径 • 常用的离子半径数据: Pauling 表8-4 (p 168) 、附录12 (p 320)
离子半径的规律 (a) 负离子 > 正离子 :F (133 pm) > Na+ (98 pm)
磁矩为矢量, m
铁磁性、顺磁性、逆磁性物质: 1. 逆磁性物质: ① 分子中所有电子已配对,上述 磁矩互相抵销,净磁场为 0。 ② 在外磁场诱导下,产生“诱导 磁矩”,但方向与外磁场相反— 在外磁场中,部分磁力线被推开。
铁磁性、顺磁性、逆磁性物质
2. 顺磁性物质: ①有未成对电子,净磁场不为0,但较弱。 ②“诱导磁矩”与外磁场方向一致,外磁场
分子的(电)极性 分子的极性大小用“偶极矩”来衡量。
偶极矩 (Dipole moment, ) 是矢量。 = q d
d: 正、负电荷重心之间的距离 (m) q: 偶极上电荷量C (coulomb) 电子电荷 为 1.60×1019 C,d 常为1012 m ,
即pm级,故 常为1030 C•m数量级。
共价性 8 82.4 30
Note: 没有100%的离子键. 对于NaCl :
△X = X(Cl) X(Na) = 3.16 – 0.93 = 2.23
2019安徽高中化学竞赛—结构化学模拟题Word版含答案

安徽高中化学竞赛-结构化学模拟题六一、单项选择题(每小题2分,共40分)1.一维势箱解的量子化由来:()① 人为假定② 求解微分方程的结果③ 由势能函数决定的④ 由微分方程的边界条件决定的2.氢原子基态电子几率密度最大的位置在r =()处① 0② a 0③ ∞ ④ 2 a 0 3.的简并态有几个(相对H 而言)?( )① 16 ② 9 ③ 7④ 34.对He +离子实波函数和复波函数,下列结论哪个不对?( )① Mz 相同 ② E 相同 ③ M 2相同 ④ 节面数相同 5.He +体系的径向节面数为:( )① 4 ② 1③ 2④ 06.立方势箱中时有多少种状态?( ) ① 11 ② 3 ③ 4④ 27.由类氢离子薛定谔方程到R ,○H ,Φ方程,未采用以下那种手段?( )① 球极坐标变换② 变量分离③ 核固定近似 ④ 线性变分法8.电子自旋是:( )① 具有一种顺时针或逆时针的自转 ② 具有一种类似地球自转的运动③ 具有一种非空间轨道运动的固有角动量 ④ 因实验无法测定,以上说法都不对。
9. σ型分子轨道的特点是:( )① 能量最低 ② 其分布关于键轴呈圆柱形对称 ③ 无节面④ 由s 原子轨道组成 10. 属于下列点群的分子哪个为非极性分子?( )m 43ψpy 2ψ121-ψ321ψ2287m ah E<①D6h②C s③C3v④C∞v11. 分子轨道的含义是:()①分子空间运动的轨迹②描述分子电子运动的轨迹③描述分子空间轨道运动的状态函数④描述分子中单个电子空间运动的状态函数12. 羰基络合物Cr(CO)6中,CO与Cr生产配键以后,CO的键长()①变长②变短③不变④加强13. 一般而言,分子的电子、振动和转动能级差的大小顺序为:()①ΔEe>ΔEv>ΔEr ②ΔEe>ΔEr>ΔEv③ΔEe<ΔEv<ΔEr ④ΔEe<ΔEv>ΔEr14. 若1HCl和2HCl的力常数k e相同,则下列物理量哪个相同(按刚性转子-谐振子模型处理)()①转动常数②特征频率③核间距④以上都不是15. 金属铜采取A1型(ABC)最密堆积,则其点阵型式为()①立方F ②立方I③六方H ④四方底心16. 晶体按其特征对称元素可以划分为多少晶系?()①32 ②8③7 ④1417. 已知金属Cs具有立方体心的晶胞,则其配位数为:()①12 ②8③7 ④1418. AgF属于NaCl型晶体,一个晶胞中含有多少个Ag+?()① 6 ② 4③ 2 ④ 119. CsCl晶体属于什么点阵型式?()①简单立方②面心立方③体心立方④六方20. 有一AB型离子晶体,若r+ / r- =0.57,则正离子的配位数为:()① 4 ② 6③8 ④12二、多项选择题(每小题1分,共5分)1. 下列各电子运动状态中,哪几种不可能存在?( )① ②③ ④⑤2. 下列分子那些不存在离域大π键?()① CH 3CH 2CH 3 ② CO 2③ 丁二烯④ CH 2=CHCH 2CH 2CH=CH 2⑤ 苯3. 下列分子(或离子)中,哪些是顺磁性的?()① F 2② B 2 ③ O 2+④ N 2⑤ CO4. 立方晶系中,下列哪种点阵型式不存在?( )① 立方H ② 简单立方P③ 体心立方I④ 面心立方F⑤ 六方P5. 下列哪些不属于类氢离子?( )① He +② Li 2+③ Be 3+ ④ Li +⑤ Be 2+三、填空题(每空1分,共5分)1. 由于电子是全同粒子,同时电子波函数是___________(对称,反对称)的,因此多电子的波函数需用Slater 行列式波函数来描述。
高考结构化学考试题及答案

高考结构化学考试题及答案高考是每个学生都非常重要的一段时间,而结构化学作为其中的一门科目,也是备受关注的考试内容之一。
这门科目注重学生对化学结构和其相关概念的理解与应用能力,因此考试题目往往较为复杂。
下面,我们将介绍一些常见的高考结构化学考试题目及其答案,希望能对同学们复习和应对考试有所帮助。
一、选择题选择题作为结构化学考试中常见的一种题型,看似简单实则需要学生对知识的理解和应用程度都有一定的要求。
下面是一个例子:题目:下列化合物中,哪一种是盐酸(HCl)?A.氯化镁(MgCl2)B.硝酸(HNO3)C.氯化钾(KCl)D.硫酸(H2SO4)答案:选C。
氯化钾是黄色固体,是盐酸和氯化钾溶液常用的化学试剂,可用作酸性反应的催化剂。
二、计算题在结构化学考试中,计算题涵盖了化学方程式、分子式和摩尔质量计算等内容,需要学生熟练掌握相关的计算方法。
以下是一个例子:题目:已知反应A + B -> C,已知反应物A的质量为2克,B的质量为3克。
如果反应完全,C的质量是多少克?答案:反应物A和B的质量之比为2:3,根据反应的化学方程式,1mol A和1mol B反应生成1mol C。
根据反应物质量的相对分子质量,可以计算出A为1mol,B为1.5mol。
C的质量为1mol,相对分子质量乘以摩尔数,即C的质量为(1 x 相对分子质量)克。
三、填空题填空题考察的是学生对知识点的掌握以及快速运算能力。
以下是一个例子:题目:一种化合物由碳、氢、氧三种元素组成,样品中含有20g的碳、5g的氢。
如果样品的摩尔质量为40g/mol,求样品中氧的质量。
答案:样品总质量为20g + 5g = 25g。
由摩尔质量可以得知每摩尔样品中的质量为40g。
通过计算可以得到摩尔数,再乘以氧元素的相对原子质量,即可得到氧的质量。
四、解答题解答题要求学生综合运用所学的化学知识和理论进行分析和解释。
以下是一个例子:题目:请解释为什么铁的密度比铝要大?答案:密度是物质的质量和体积之比。
(整理)高中化学竞赛——晶体结构和性质
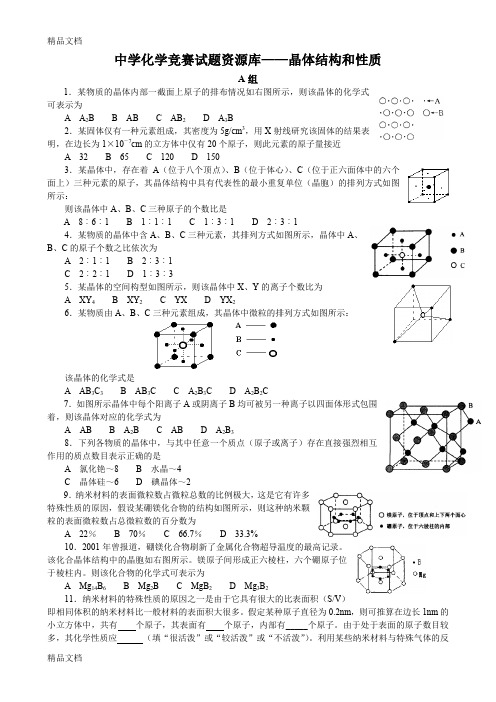
中学化学竞赛试题资源库——晶体结构和性质A组1.某物质的晶体内部一截面上原子的排布情况如右图所示,则该晶体的化学式可表示为A A2B B ABC AB2D A3B2.某固体仅有一种元素组成,其密度为5g/cm3,用X射线研究该固体的结果表明,在边长为1×10-7cm的立方体中仅有20个原子,则此元素的原子量接近A 32B 65C 120D 1503.某晶体中,存在着A(位于八个顶点)、B(位于体心)、C(位于正六面体中的六个面上)三种元素的原子,其晶体结构中具有代表性的最小重复单位(晶胞)的排列方式如图所示:则该晶体中A、B、C三种原子的个数比是A 8︰6︰1B 1︰1︰1C 1︰3︰1D 2︰3︰14.某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶体中A、B、C的原子个数之比依次为A 2︰1︰1B 2︰3︰1C 2︰2︰1D 1︰3︰35.某晶体的空间构型如图所示,则该晶体中X、Y的离子个数比为A XY4B XY2C YXD YX26.某物质由A、B、C三种元素组成,其晶体中微粒的排列方式如图所示:该晶体的化学式是A AB3C3B AB3C C A2B3CD A2B2C7.如图所示晶体中每个阳离子A或阴离子B均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为A AB B A2BC ABD A2B38.下列各物质的晶体中,与其中任意一个质点(原子或离子)存在直接强烈相互作用的质点数目表示正确的是A 氯化铯~8B 水晶~4C 晶体硅~6D 碘晶体~29.纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某硼镁化合物的结构如图所示,则这种纳米颗粒的表面微粒数占总微粒数的百分数为A 22%B 70%C 66.7%D 33.3%10.2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。
该化合晶体结构中的晶胞如右图所示。
镁原子间形成正六棱柱,六个硼原子位于棱柱内。
2019安徽高中化学竞赛结构化学第八章金属的结构和性质习题答案不全语文

一选择题1、CsCl晶体中,每个铯离子周围紧靠着的氯离子数目是( c )(A)4个(B)6个(C)8个(D)12个2、在离子晶体中,决定正离子配位数的关键因素是( A)(A) 正负离子半径比 (B) 正负离子电价比 (C) 正负离子电负性之比3、对于二元离子晶体,下列哪一式成立:( B )(A) n+/n-=Z-/Z+=CN-/CN+ (B) n-/n+=Z-/Z+=CN-/CN+ (C) n+/n-=Z-/Z+=CN+/CN-4、马德隆(Madelung)常数与离子晶体的哪种因素有关:( B)(A) 化学组成 (B) 晶体结构型式 (C) 离子键长5、Ge晶体(A4,即金刚石结构)的空间利用率(堆积系数)小于W晶体(A2),它们的晶胞中的原子数目是( B )(A) Ge<W (B) Ge>W (C) Ge=W6. NaCl与CaF2晶体的相同之处是:( B)(A) 结构基元 (B) 负离子堆积方式 (C) 点阵型式7. 4:4是下列哪一种晶体的CN+/CN-:( C)(A) CsCl (B) NaCl (C) 六方ZnS8. 对于CaF2晶体,“简单立方”一词描述的是它的( B )(A) 负离子堆积方式 (B) 点阵型式 (C) 正离子堆积方式9. 某种离子晶体AB被称为NaCl型, 这指的是( B)(A) 它的化学组成 (B) 它的结构型式 (C) 它的点阵型式二简答题1.已知金属Ni为A1型结构,原子间最近接触距离为249.2pm试计算:(1)Ni立方晶胞参数;(2)金属Ni 的密度(以g×表示);(3)画出(100),(110),(111)面上原子的排布方式。
1. (1) 352.4pm(2) 8.91g·cm-32. 已知金属钛为六方最密堆积结构,金属钛原子半径为146pm,试计算理想的六方晶胞参数。
2. a=b=292pm, c=477pm3. 计算A2型体心立方密堆积的空间利用率。
结构化学练习题带答案

结构化学复习题一、选择填空题第一章量子力学基础知识1.实物微粒和光一样,既有性,又有性,这种性质称为性。
2.光的微粒性由实验证实,电子波动性由实验证实。
3。
电子具有波动性,其波长与下列哪种电磁波同数量级?(A)X射线 (B)紫外线(C)可见光(D)红外线4。
电子自旋的假设是被下列何人的实验证明的?(A)Zeeman (B)Gouy (C)Stark (D)Stern-Gerlach5。
如果f和g是算符,则(f+g)(f—g)等于下列的哪一个?(A)f2-g2;(B)f2—g2-fg+gf; (C)f2+g2; (D)(f—g)(f+g)6.在能量的本征态下,下列哪种说法是正确的?(A)只有能量有确定值;(B)所有力学量都有确定值;(C)动量一定有确定值; (D)几个力学量可同时有确定值;7.试将指数函数e±ix表示成三角函数的形式——--——8.微观粒子的任何一个状态都可以用来描述; 表示粒子出现的概率密度。
9。
Planck常数h的值为下列的哪一个?(A)1.38×10-30J/s (B)1.38×10—16J/s (C)6。
02×10—27J·s (D)6.62×10—34J·s 10。
一维势箱中粒子的零点能是答案: 1.略。
2。
略. 3。
A 4。
D 5.B 6。
D 7.略 8.略 9。
D 10。
略第二章原子的结构性质1。
用来表示核外某电子的运动状态的下列各组量子数(n, 1, m, m s)中,哪一组是合理的?(A)2,1,—1,—1/2;(B)0,0,0,1/2; (C)3,1,2,1/2; (D)2,1,0,0。
2。
若氢原子中的电子处于主量子数n=100的能级上,其能量是下列的哪一个: (A)13。
6Ev;(B)13。
6/10000eV; (C)-13。
6/100eV;(D)—13.6/10000eV;3.氢原子的p x状态,其磁量子数为下列的哪一个?(A)m=+1;(B)m=—1;(C)|m|=1; (D)m=0;4.若将N原子的基电子组态写成1s22s22p x22p y1违背了下列哪一条?(A)Pauli原理;(B)Hund规则;(C)对称性一致的原则;(D)Bohr理论5。
安徽高中化学竞赛结构化学 第二章 原子的结构和性质习题

一选择题1、电子自旋是电子( c )A 、具有一种类似地球自转的运动B 、具有一种非轨道的运动C 、具有一种空间轨道外的顺逆时针的自转D 、具有一种空间轨道中的顺逆时针的自转2、下列分子中哪些不存在大π键( a )A. CH 2=CH-CH 2-CH=CH 2B. CH 2=C=OC. CO(NH 2)2D.C 6H 5CH=CHC 6H 53、某原子的电子组态为1s 22s 22p 63s 14d 1,其基谱项为( a )A 3DB 1DC 3SD 1S4、已知类氢波函数ψ2px 的各种图形,推测ψ3px 图形,下列结论不正确的是( b ):A 、角度部分图形相同B 、电子云相同C 、径向分布不同D 、界面图不同5、单个电子的自旋角动量在z 轴方向上的分量是:( d )6、具有的π 键类型为:( a )A 、109πB 、108πC 、99πD 、119π7、 下列光谱项不属于p 1d 1组态的是( c )。
A. 1P B . 1D C. 1S D. 3F8、对氢原子和类氢离子的量子数l ,下列叙述不正确的是( b )。
A l 的取值规定m 的取值范围B 它的取值与体系能量大小有关C 它的最大可能取值由解方程决定D 它的取值决定了|M| = )1(+l l9、通过变分法计算得到的微观体系的能量总是( c )。
A 等于真实体系基态能量B 大于真实体系基态能量C 不小于真实体系基态能量D 小于真实体系基态能量10、已知类氢波函数Ψ2px 的各种图形,推测Ψ3px 图形,下列说法错误的是( b )A 角度部分的图形相同B 电子云图相同C 径向分布函数图不同D 界面图不同11、对氢原子Φ方程求解,下列叙述有错的是( c ).A. 可得复函数解Φ=ΦΦim m Ae )(.B. 由Φ方程复函数解进行线性组合,可得到实函数解.C. 根据Φm (Φ)函数的单值性,可确定|m |=0,1,2,……l根据归一化条件1)(220=ΦΦΦ⎰d m π求得π21=A12、He +的一个电子处于总节面数为3的d 态,问电子的能量应为−R 的 ( c ).A.1B.1/9C.1/4D.1/1613、电子在核附近有非零几率密度的原子轨道是( d ).A.Ψ3PB. Ψ3dC.Ψ2PD.Ψ2S14、5f 的径向分布函数图的极大值与节面数为( a )A. 2,1B. 2,3C.4,2D.1,315、线性变分法处理H +2过程中,认为H ab =H ba ,依据的性质是( d )A. 电子的不可分辨性B. 二核等同性C .Ψa .Ψb 的归一性 D. Hˆ的厄米性 16.、Fe 的电子组态为[Ar]3d 64s 2,其能量最低的光谱支项为( a )A. 5D 4B. 3P 2C. 5D 0D. 1S 017、 对于极性双原子分子AB ,如果分子轨道中的一个电子有90%的时间在A 的轨道中, 10%的时间在 B 的轨道上,描述该分子轨道归一化形式为( c )A.b a φφϕ1.09.0+= B .b a φφϕ9.01.0+= C. b a φφϕ316.0949.0+= D. b a φφϕ11.0994.0+=18、氢原子的轨道角度分布函数Y 10的图形是( c )(A )两个相切的圆 (B )“8”字形(C )两个相切的球 (D )两个相切的实习球19、B 原子基态能量最低的光谱支项是( a )(A )2/12P (B )2/32P (C )03P (D )01S20、下列波函数中量子数n 、l 、m 具有确定值的是( d )(A ))3(xz d ϕ (B ))3(yz d ϕ (C ))3(xy d ϕ (D ))3(2z d ϕ21、如果0E 是一维势箱中电子最低能态的能量,则电子在E 3能级的能量是( c )(A )20E (B )40E (C )90E (D )180E22、氢原子3P 径向函数对r 做图的节点数为( b )(A )0 (B )1 (C )2 (D )323. Y (θ,φ)图 (B )A .即电子云角度分布图,反映电子云的角度部分随空间方位θ,φ的变化B. 即波函数角度分布图,反映原子轨道的角度部分随空间方位θ,φ的变化C. 即原子轨道的界面图,代表原子轨道的形状和位相24. 为了写出原子光谱项,必须首先区分电子组态是由等价电子还是非等价电子形成的。
结构化学习题解答(第八章)

rC C (1 a / 4) 2 (1 b / 4) 2 (1 c / 4) 2 a 3 4 3 356.7 pm 4 154.4 pm 密度D ZM / NV (8 12.0 g / 6.02 1023 ) /(356.7 1010 cm) 3 3.51g cm
[8.31] 已知NaCl晶体立方晶胞参数a=563.94pm实验测得衍射 111的衍射角θ=5.100,求实验所用X射线的波长。 [解 ]: 2 2 2 1/ 2 hkl
d
a /(h k l )
563.94 pm / 3 325.59 pm d 2 sin 325.59 pm 2 sin 5.10 57.9 pm
[8.26] 用Cu Kα射线测得某晶体的衍射图,从中量得 以下数据。试查PDF卡片,鉴定此晶体可能是什么。 2θ/(0) 27.3 31.8 45.5 53.9 56.6 66.3 75.5 I/I0 18 100 80 5 21 20 20
[解]:利用PDF卡片鉴定晶体时,需先把衍射角2θ数据 换算成d值(d=λ/2Sinθ)如下:(λ=154.2pm) 2θ/(0) 27.3 31.8 45.5 53.9 56.6 66.3 75.5 d/pm 326.7 281.4 199.4 170.1 162.6 141.0 125.9 I/I0 18 100 80 5 21 20 20 按这组d-I/I0值查表,得知它为NaCl晶体。
rTi O (0.31a) 2 (0.31a) 2 0.438a 0.438 458pm 201pm
[8.19] 金属镍的立方晶胞参数a=352.4pm,试求d200,d111,d220。 [解]:立方晶系的衍射指标hkl和衍射面间距dhkl的关系为:
安徽高中化学竞赛-结构化学模拟题及答案(共三套)

安徽高中化学竞赛-结构化学模拟题一一、单选题 (30)1、下列波函数中量子数n 、l 、m 具有确定值的是( )(A ))3(xz d ϕ (B ))3(yz d ϕ (C ))3(xy d ϕ (D ))3(2z d ϕ 2、如果0E 是一维势箱中电子最低能态的能量,则电子在E 3能级的能量是( )(A )20E (B )40E (C )90E (D )180E 3、化合物CO 2、CO 和(CH 3)2CO 中,碳氧键键长是( )(A )CO 最长,CO 2最短 (B )CO 2最长,(CH 3)2CO 最短 (C )一样长 (D )CO 最短,(CH 3)2CO 最长 4、测不准关系的含义是指( )(A ) 粒子太小,不能准确测定其坐标; (B )运动不快时,不能准确测定其动量(C ) 粒子的坐标的动量都不能准确地测定; (D )不能同时准确地测定粒子的坐标与动量 5、下列状态为氢原子体系的可能状态是( );该体系能量为( ): A 、2ψ310+3ψ41-1 B 、2ψ221+3ψ32-1C 、2ψ21-1+3ψ342+3ψ410D 、3ψ211+5ψ340+5ψ2106、类氢体系的某一状态为Ψ43-1,该体系的能量为( )eV ,角动量 大小为( ), 角动量在Z 轴上的分量为( )。
A 、-R/4B 、-R/16C 、-2R/9、D 、 -h/2πE 、-h/πF 、-2h/2π/2 /2/2H I πππ5、7、 下列算符为线性算符的是:( )A 、sine xB 、d 2/dx 2 D 、cos2x8、通过变分法处理氢分子离子体系,计算得到的体系能量总是:( ) A 、等于真实体系基态能量 B 、大于真实体系基态能量 C 、不小于真实体系基态能量 D 、小于真实体系基态能量9、对于SP 杂化轨道:Ф1=C 11фs +C 12фpx Ф2=C 21фs +C 22фpx 其归一化条件是指:( ) A 、C 112+C 122=1 B 、C 212+C 222 =1C 、αk /βk =1/2D 、C 112+C 212=110、红外光谱由分子内部( )能量跃迁引起。
结构化学习题答案

结构化学习题答案结构化学是化学学科中的一个重要分支,它研究原子、分子和晶体的结构以及它们的性质。
以下是一些结构化学习题的答案示例:1. 原子轨道的能级顺序:- 根据量子力学理论,原子轨道的能级顺序通常遵循以下顺序:1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f。
2. 分子的几何构型:- 例如,水分子(H2O)的几何构型是弯曲的,因为氧原子与两个氢原子形成共价键,并且氧原子上有两对孤对电子。
3. 分子的极性:- 一个分子是否具有极性取决于其分子内电荷分布的对称性。
如果电荷分布不均匀,分子就是极性的。
例如,二氧化碳(CO2)分子是非极性的,因为它是线性的,电荷分布对称。
4. 晶体的点群对称性:- 晶体的点群对称性是指晶体结构中原子排列的对称性。
例如,立方晶体具有高对称性,其点群为O_h。
5. 分子轨道理论:- 分子轨道理论用于描述分子中电子的分布。
根据这一理论,原子轨道可以组合形成分子轨道,这些分子轨道可以是成键的、非键的或反键的。
6. X射线衍射分析:- X射线衍射是一种用于确定晶体结构的技术。
当X射线与晶体相互作用时,它们会被晶体中的原子散射,产生衍射图案,这个图案可以用来推断晶体的原子排列。
7. 化学键的类型:- 化学键主要包括共价键、离子键和金属键。
共价键是由两个原子共享电子对形成的,离子键是由电子从一个原子转移到另一个原子形成的,而金属键是由金属原子之间的电子云形成的。
8. 分子间力:- 分子间力包括范德华力、氢键和偶极-偶极相互作用。
这些力影响分子的物理性质,如沸点和溶解性。
9. 晶体缺陷:- 晶体缺陷包括点缺陷、线缺陷(如位错)和面缺陷(如晶界)。
这些缺陷可以影响晶体的物理和化学性质。
10. 配位化合物的结构:- 配位化合物是由中心金属原子或离子与配体通过配位键连接形成的。
结构化学课后习题答案

结构化学课后习题答案结构化化学课后习题答案一、化学键与分子结构1. 选择题a) 正确答案:D解析:选择题中,选项D提到了共价键的形成是通过电子的共享,符合共价键的定义。
b) 正确答案:B解析:选择题中,选项B提到了离子键的形成是通过电子的转移,符合离子键的定义。
c) 正确答案:C解析:选择题中,选项C提到了金属键的形成是通过金属原子之间的电子云重叠,符合金属键的定义。
d) 正确答案:A解析:选择题中,选项A提到了氢键的形成是通过氢原子与高电负性原子之间的吸引力,符合氢键的定义。
2. 填空题a) 正确答案:共价键解析:填空题中,根据问题描述,两个非金属原子之间的键称为共价键。
b) 正确答案:离子键解析:填空题中,根据问题描述,一个金属原子将电子转移到一个非金属原子上形成的键称为离子键。
c) 正确答案:金属键解析:填空题中,根据问题描述,金属原子之间的电子云重叠形成的键称为金属键。
d) 正确答案:氢键解析:填空题中,根据问题描述,氢原子与高电负性原子之间的吸引力形成的键称为氢键。
二、有机化学1. 选择题a) 正确答案:C解析:选择题中,选项C提到了烷烃是由碳和氢组成的,符合烷烃的定义。
b) 正确答案:D解析:选择题中,选项D提到了烯烃是由含有一个或多个双键的碳原子组成的,符合烯烃的定义。
c) 正确答案:B解析:选择题中,选项B提到了炔烃是由含有一个或多个三键的碳原子组成的,符合炔烃的定义。
d) 正确答案:A解析:选择题中,选项A提到了芳香烃是由芳香环结构组成的,符合芳香烃的定义。
2. 填空题a) 正确答案:醇解析:填空题中,根据问题描述,含有羟基(-OH)的有机化合物称为醇。
b) 正确答案:醚解析:填空题中,根据问题描述,含有氧原子连接两个碳原子的有机化合物称为醚。
c) 正确答案:酮解析:填空题中,根据问题描述,含有羰基(C=O)的有机化合物称为酮。
d) 正确答案:酯解析:填空题中,根据问题描述,含有羧基(-COO)的有机化合物称为酯。
结构化学习题答案第8章

第八章晶体的结构与晶体材料小组成员:张海娟(070601301)翁琳琳(070601302)董炎玲(070601303)汤龙女(070601304)陈爱玲(070601305)朱泽艺(070601343)1 用晶体结构的能带理论解释导体、半导体和绝缘体的区别。
答:能带结构可以解释固体中导体、半导体、绝缘体三大类区别的由来。
材料的导电性是由“传导带”中含有的电子数量决定。
当电子从“价带”获得能量而跳跃至“传导带”时,电子就可以在带间任意移动而导电。
一般常见的金属材料,因为其传导带与价带之间的“能隙”非常小,在室温下电子很容易获得能量而跳跃至传导带而导电,而绝缘材料则因为能隙很大(通常大于9 电子伏特),电子很难跳跃至传导带,所以无法导电。
一般半导体材料的能隙约为1 至3 电子伏特,介于导体和绝缘体之间。
因此只要给予适当条件的能量激发,或是改变其能隙之间距,此材料就能导电。
2、金属键和共价键中离域电子有何本质不同?试用费米能级解释之。
答:自旋为半整数(1/2 等)的电子是“费米子”,故金属中的“自由”电子氛1服从费米——狄拉克统计分布规律:f F-D=e( E -E F ) / kT +1式中f F-D为电子在能级E 上的概率,E F 为费米能级,k 为玻耳兹曼常数,T为1热力学温度。
根据f F-D=当E<E F,则f F-D=1;e( E -E F ) / kT +1,T=0K 时,有当E>E F,则f F-D=0;当E=E F,则f F-D=1/2;由f F-D的行为可以看出,费米能级是0K 时电子所能占据的最高能级。
只有0K 时,电子才能完全按能量最低原理充满整个低能级。
而对于能量等于E F 的量子状态其被电子填充的概率仅为1/2。
当T>0K 时,如E-E F=kT时f F-D=0.27,由此可见,在一般温度下,金属中的电子在能级上的分布情况是:绝大部分较低能级被电子充满,但当一部分较高的能级在未被完全充满时,就有电子去占据更高能级了,这是金属具有良好导电性的原因。
结构化学习题

结构化学习题习题类型包括:选择答案、填空、概念辨析、查错改正、填表、计算、利用结构化学原理分析问题;内容涵盖整个课程,即量子力学基础、原子结构、分子结构与化学键、晶体结构与点阵、X射线衍射、金属晶体与离子晶体结构、结构分析原理、结构数据采掘与QSAR等;难度包括容易、中等、较难、难4级;能力层次分为了解、理解、综合应用。
传统形式的习题,通常要求学生在课本所学知识范围内即可完成,而且答案是唯一的,即可以给出所谓“标准答案”。
根据21世纪化学演变的要求,我们希望再给学生一些新型的题目,体现开放性、自主性、答案的多样性,即:习题不仅与课本内容有关,而且还需要查阅少量文献才能完成;完成习题更多地需要学生主动思考,而不是完全跟随教师的思路;习题并不一定有唯一的“标准答案”,而可能具有多样性,每一种答案都可能是“参考答案”。
学生接触这类习题,有助于培养学习的主动性,同时认识到实际问题是复杂的,解决问题可能有多钟途径。
但是,这种题目在基础课中不宜多,只要有代表性即可。
以下各章的名称与《结构化学》多媒体版相同,但习题内容并不完全相同。
第一章量子力学基础1.1 选择题(1) 若用电子束与中子束分别作衍射实验,得到大小相同的环纹,则说明二者(A) 动量相同(B) 动能相同(C) 质量相同(2) 为了写出一个经典力学量对应的量子力学算符,若坐标算符取作坐标本身,动量算符应是(以一维运动为例)(A) mv (B) (C)(3) 若∫|ψ|2dτ=K,利用下列哪个常数乘ψ可以使之归一化:(A) K(B) K2 (C) 1/(4) 丁二烯等共轭分子中π电子的离域化可降低体系的能量,这与简单的一维势阱模型是一致的,因为一维势阱中粒子的能量(A) 反比于势阱长度平方(B) 正比于势阱长度(C) 正比于量子数(5) 对于厄米算符, 下面哪种说法是对的(A) 厄米算符中必然不包含虚数(B) 厄米算符的本征值必定是实数(C) 厄米算符的本征函数中必然不包含虚数(6) 对于算符Ĝ的非本征态Ψ(A) 不可能测量其本征值g.(B) 不可能测量其平均值<g>.(C) 本征值与平均值均可测量,且二者相等(7) 将几个非简并的本征函数进行线形组合,结果(A) 再不是原算符的本征函数(B) 仍是原算符的本征函数,且本征值不变(C) 仍是原算符的本征函数,但本征值改变1.2 辨析下列概念,注意它们是否有相互联系, 尤其要注意它们之间的区别:(1) 算符的线性与厄米性(2) 本征态与非本征态(3) 本征函数与本征值(4) 本征值与平均值(5) 几率密度与几率(6) 波函数的正交性与归一性(7) 简并态与非简并态1.3 原子光谱和分子光谱的谱线总是存在一定的线宽,而且不可能通过仪器技术的改进来使之无限地变窄. 这种现象是什么原因造成的?1.4 几率波的波长与动量成反比. 如何理解这一点?1.5 细菌的大小为微米量级, 而病毒的大小为纳米量级. 试通过计算粗略估计: 为了观察到病毒, 电子显微镜至少需要多高的加速电压.1.6 将一维无限深势阱中粒子的波函数任取几个, 验证它们都是相互正交的.1.7 厄米算符的非简并本征函数相互正交. 简并本征函数虽不一定正交, 但可用数学处理使之正交. 例如,若ψ1与ψ2不正交,可以造出与ψ1正交的新函数ψ’2ψ’2=ψ2+cψ1试推导c的表达式(这种方法称为Schmidt正交化方法).1.8 对于一维无限深势阱中粒子的基态, 计算坐标平均值和动量平均值, 并解释它们的物理意义.1.9 一维无限深势阱中粒子波函数的节点数目随量子数增加而增加. 试解释: 为什么节点越多, 能量越高. 再想一想: 阱中只有一个粒子, 它是如何不穿越节点而出现在每个节点两侧的?1.10 下列哪些函数是d2/dx2的本征函数: (1) e x (2) e2x(3) 5sin x(4) sin x+cos x(5)x3. 求出本征函数的本征值.1.11 对于三维无限深正方形势阱中粒子, 若三个量子数平方和等于9, 简并度是多少?1.12 利用结构化学原理,分析并回答下列问题:纳米粒子属于介观粒子,有些性质与宏观和微观粒子都有所不同. 不过,借用无限深势阱中粒子模型,对纳米材料中的“量子尺寸效应”还是可以作一些定性解释.例如: 为什么半导体中的窄能隙(<3eV)在纳米颗粒中会变宽, 甚至连纳米Ag也会成为绝缘体?第二章原子结构2.1 选择题(1) 对s、p、d、f 原子轨道进行反演操作,可以看出它们的对称性分别是(A) u, g, u, g (B) g, u, g, u (C) g, g, g, g(2) H原子的电离能为13.6 eV, He+的电离能为(A) 13.6 eV (B) 54.4 eV (C) 27.2 eV(3) 原子的轨道角动量绝对值为(A) l(l+1)2(B) (C) l(4) p2组态的原子光谱项为(A) 1D、3P、1S(B) 3D、1P、3S(C) 3D、3P、1D(5) Hund规则适用于下列哪种情况(A) 求出激发组态下的能量最低谱项(B) 求出基组态下的基谱项(C) 在基组态下为谱项的能量排序(6) 配位化合物中d→d跃迁一般都很弱,因为这种跃迁属于:(A) g←/→g(B) g←→u(C) u←/→u(7) Cl原子基态的光谱项为2P,其能量最低的光谱支项为(A) 2P3/2(B) 2P1/2(C) 2P02.2 辨析下列概念,注意它们的相互联系和区别:(1) 复波函数与实波函数(2) 轨道与电子云(3) 轨道的位相与电荷的正负(4) 径向密度函数与径向分布函数(5)原子轨道的角度分布图与界面图(6)空间波函数、自旋波函数与自旋-轨道(7)自旋-轨道与Slater行列式(8)组态与状态2.3 请找出下列叙述中可能包含着的错误,并加以改正:原子轨道(AO)是原子中的单电子波函数,它描述了电子运动的确切轨迹. 原子轨道的正、负号分别代表正、负电荷. 原子轨道的绝对值平方就是化学中广为使用的“电子云”概念,即几率密度. 若将原子轨道乘以任意常数C,电子在每一点出现的可能性就增大到原来的C2倍.2.4(1) 计算节面对应的θ;(2) 计算极大值对应的θ;(3) 在yz平面上画出波函数角度分布图的剖面, 绕z轴旋转一周即成波函数角度分布图. 对照下列所示的轨道界面图,从物理意义和图形特征来说明二者的相似与相异.2.5 氢原子基态的波函数为试计算1/r的平均值,进而计算势能平均值<V>, 验证下列关系:<V> = 2E= -2<T>此即量子力学维里定理,适用于库仑作用下达到平衡的粒子体系(氢原子基态只有一个1s电子,其能量等于体系的能量) 的定态, 对单电子原子和多电子原子具有相同的形式.2.6 R. Mulliken用原子中电子的电离能与电子亲合能的平均值来定义元素电负性. 试从原子中电子最高占有轨道(HOMO)和最低空轨道(LUMO)的角度想一想,这种定义有什么道理?2.7 原子中电子的电离能与电子亲合能之差值的一半, 可以作为元素化学硬度的一种量度(硬度较大的原子,其极化率较低).根据这种定义,化学硬度较大的原子,其HOMO与LUMO之间的能隙应当较大还是较小?2.8 将2p+1与2p-1线性组合得到的2p x与2p y, 是否还有确定的能量和轨道角动量z分量?为什么?2.9 原子的轨道角动量为什么永远不会与外磁场方向z重合, 而是形成一定大小的夹角? 计算f轨道与z轴的所有可能的夹角.为什么每种夹角对应于一个锥面, 而不是一个确定的方向?2.10 快速求出P原子的基谱项.2.11 Ni2+的电子组态为d8, 试用M L表方法写出它的所有谱项, 并确定基谱项. 原子光谱表明, 除基谱项外, 其余谱项的能级顺序是1D<3P<1G<1S, 你是否能用Hund规则预料到这个结果?2.12 d n组态产生的谱项, 其宇称与电子数n无关, 而p n组态产生的谱项, 其宇称与电子数n有关. 为什么?2.13 试写出闭壳层原子Be的Slater行列式.2.14 Pauli原理适用于玻色子和费米子, 为什么说Pauli不相容原理只适用于费米子?第三章双原子分子结构与化学键理论3.1 选择题(1) 用线性变分法求出的分子基态能量比起基态真实能量,只可能(A) 更高或相等(B) 更低(C) 相等(2) N2、O2、F2的键长递增是因为(A) 核外电子数依次减少(B) 键级依次增大(C) 净成键电子数依次减少(3) 下列哪一条属于所谓的“成键三原则”之一:(A) 原子半径相似(B) 对称性匹配(C) 电负性相似(4) 下列哪种说法是正确的(A) 原子轨道只能以同号重叠组成分子轨道(B) 原子轨道以异号重叠组成非键分子轨道(C) 原子轨道可以按同号重叠或异号重叠,分别组成成键或反键轨道(5) 氧的O2+ , O2 , O2- , O22-对应于下列哪种键级顺序(A) 2.5,2.0, 1.5, 1.0(B) 1.0, 1.5,2.0, 2.5(C) 2.5,1.5, 1.0 2.0(6) 下列哪些分子或分子离子具有顺磁性(A) O2、NO (B) N2、F2(C) O22+、NO+(7) B2和C2中的共价键分别是(A)π1+π1,π+π(B)π+π,π1+π1 (C)σ+π,σ3.2 MO与VB理论在解释共价键的饱和性和方向性上都取得了很大的成功, 但两种理论各有特色. 试指出它们各自的要点(若将两种理论各自作一些改进, 其结果会彼此接近).3.3 考察共价键的形成时, 为什么先考虑原子轨道形成分子轨道, 再填充电子形成分子轨道上的电子云, 而不直接用原子轨道上的电子云叠加来形成分子轨道上的电子云?3.4 “成键轨道的对称性总是g, 反键轨道的对称性总是u”. 这种说法对不对? 为什么?3.5 一般地说, π键要比σ键弱一些. 但在任何情况下都是如此吗? 请举实例来说明.3.6 N2作为配位体形成配合物时, 通常以2σg电子对去进行端基配位(即N ≡ N→), 而不以1πu电子对去进行侧基配位。
安徽化学竞赛真题答案及解析

安徽化学竞赛真题答案及解析近年来,安徽化学竞赛的相关题目备受关注。
参加竞赛的学生们都渴望能够获得一份答案及解析,以便提升自己的学习能力和竞争力。
为了帮助这些学生更好地备战竞赛,本文将对安徽化学竞赛的真题进行解析。
一、选择题1. 某元素的原子核外壳层电子数为4,其原子半径最大的可能原子数是?A. 2B. 8C. 10D. 18答案:B. 8解析:根据元素的电子排布规律,第一层能容纳2个电子,第二层能容纳8个电子,所以原子核外壳层电子数为4时,其最大可能的原子数是8。
2. 烷烃是一类只包含碳和氢元素的有机化合物,其中,判断下列说法中正确的是?A. 烷烃的分子中碳原子的电子形成sp杂化轨道B. 烷烃的分子中碳原子的电子形成sp2杂化轨道C. 烷烃的分子中碳原子的电子形成sp3杂化轨道D. 烷烃的分子中碳原子的电子形成d杂化轨道答案:C. 烷烃的分子中碳原子的电子形成sp3杂化轨道解析:烷烃的分子中碳原子的电子形成sp3杂化轨道,每个碳原子上有四个单独的sp3杂化轨道,形成单键。
因此,选项C是正确的。
二、填空题1. 以下哪个元素在元素周期表中的位置靠前?答案:锂解析:根据元素周期表的排列特点,元素的位置是按照原子序数递增的顺序排列的。
因此,锂的原子序数较小,位置靠前。
2. 氯离子Cl-在水中溶解时发生下列反应:Cl- + H2O → ?答案:HOCl + OH-解析:氯离子在水中溶解时发生电离反应,生成次氯酸和氢氧根离子。
三、解答题1. 请解释下列现象:当过量氢气与氧气在点燃后形成水时,容器外会有明亮的火焰。
解析:当过量的氢气与氧气按照化学计量比点燃时,反应迅速进行,生成大量的水。
由于水的液体形态,当氢气和氧气反应后产生的水蒸气密度较大,不易升腾,因此在反应过程中密封于反应容器内。
而容器外的氢气和氧气则继续燃烧,产生能量并散发出明亮的火焰。
四、综合题某个物质在室温下形成固体,但在高温下会熔化为液体,同时能够导电。
结构化学习题解答8(北大)

mol
1
3
面心立方结构中晶胞参数a与原子半径R的关系为a 2 2R,
因此,铝的原子半径为:
R a 404.9 pm 22 22
143.2 pm 根据Bragg方程
2dhkl sin
得:
sin
2d hk l
将立方晶系面间距dhkl、晶胞参数a和衍射指标hkl间的关系式
(c) 设锡的摩尔质量为M,灰锡的密度为DSn(灰)晶胞中的原子 数为Z,则:
M DSn(灰)a 3 N / Z 5.75 g cm3 (648 .9 10 10 cm)3 6.022 10 23 mol 1
8 118 .3g mol 1
即锡的相对原子质量为118.3 (d) 由题意,白锡的密度为:
a3 N 429 1010 cm 3 6.022 1023 mol 1
0.967g cm3
(c)d110
12
a 12 02
1/ 2
429 pm 2
303.4 pm
[8.16] 金属铂为体心立方结构,a=330pm,试求: (a)钽的原子半径; (b)金属钽的理论密度(Ta的相对原子质量为181); (c)(110)面间距; (d)若用λ=154pm的X射线,衍射指标为220的衍射角θ是 多少度?
16.7g cm3
(c)(110)点阵面的间距为:
d110
a
330pm
12 12 02
2
233pm
(d) 根据Bragg方程
2dhkl•sinθ=λ
得:
sin 220
2d 220
2
金属单质的结构(奥赛初赛)-10修
高中化学奥林匹克竞赛初赛培训
金属单质
金属的晶体构型(无色为复杂构型或无晶体结构 金属的晶体构型(无色为复杂构型或无晶体结构)
3
高中化学奥林匹克竞赛初赛培训
金属单质
2.1 等径圆球的密堆积
金属单质由同种原子组成,同种原子的电负性, 金属单质由同种原子组成,同种原子的电负性,半径相 同,由于能量最低原理的作用,金属单质的性质可以归结为 由于能量最低原理的作用, 径圆球的密堆积问题 问题。 等径圆球的密堆积问题。
金属单质
在100多种化学元素中, 金属约占80%. 100多种化学元素中, 金属约占80%. 多种化学元素中 它们有着许多相似的性质:不透明, 它们有着许多相似的性质:不透明, 有金 属光泽, 能导电传热, 富有延展性. 属光泽, 能导电传热, 富有延展性. 金属 的这些性质是金属内部电子结构及晶体结 构的外在反映. 构的外在反映. 弄清金属及合金晶体中化 学键的本质及结构与性能之间的关系是材 料科学的重大课题之一, 料科学的重大课题之一, 也是结构化学的 重要任务. 重要任务.
63 2 2 mmc
分数数坐标为: 分数数坐标为: (0, 0, 0), (2/3,1/3,1/2)
或 (0, 0, 0), (1/3,2/3,1/2)
球数与空隙数之比: 球数与空隙数之比:
球数 :八面体空隙数 :四面体空隙数 = 1 :1 :2
空间利用率为: 空间利用率为 17
74.05%
高中化学奥林匹克竞赛初赛培训
13
高中化学奥林匹克竞赛初赛培训
金属单质
注:当以A1型堆积为例时,以晶胞顶点球为坐标 当以A1型堆积为例时, A1型堆积为例时 原点, 原点,在
± a, ± b, ± c
2018安徽高中化学竞赛-结构化学 第三章 双原子分子的结构和性质习题答案不全

一选择题1、基态H 2+的电子密度最大处在( b )A. H 核附近B. 两核连线中点C. 离核无穷远处 2、下列状态为氢原子体系的可能状态是( a );该体系能量为( e ): A 、2ψ310+3ψ41-1 B 、2ψ221+3ψ32-1C 、2ψ21-1+3ψ342+3ψ410D 、3ψ211+5ψ340+5ψ210111111:() :13() :()139********R E F R H R -+-+-+3、对于氢原子和类氢离子的径向分布曲线D(r)―r 图,下列叙述错误的是 ( d )。
A 径向峰数与节面数都与n. . l 有关B 核周围电子出现的几率为0C l 相同,n 愈大,则最高峰离核愈远D 最高峰所对应的r 处,电子出现几率密度最大。
4、类氢体系的某一状态为Ψ43-1,该体系的能量为( b )eV ,角动量大小为( h ),角动量在Z 轴上的分量为( d )。
A 、-R/4B 、-R/16C 、-2R/9、D 、 -h/2πE 、-h/πF 、-2h/2π/2 /2/2H I πππ5、氢原子基态电子径向几率分布的极大值在( b ) (A )r=0处 (B )r=a 0处 (C )r=2a 0处 (D )r=∞处6、苯、苯胺、苯胺盐酸盐三者的紫外可见光谱之间( a ) (A )苯和苯胺盐酸盐很相似 (B )苯和苯胺很相似 (C )苯胺和苯胺盐酸盐很相似 (D )两者不相似7、3种配合物:①-24HgI ②4)(CO Ni ③+262)(O H Mn 中有d-d 跃迁光谱的是( c )(A )① (B )② (C )③ (D )②和③8、 苯胺虽然不是平面型分子,但-NH 2与苯环之间仍有一定程度的共轭。
据此判断( A )A.苯胺的碱性比氨弱B.苯胺的碱性比氨强C.苯胺的碱性与氨相同 9、 下列哪种说法是正确的 ( C )A .原子轨道只能以同号重叠组成分子轨道B .原子轨道以异号重叠组成非键分子轨道C .原子轨道可以按同号重叠或异号重叠,分别组成成键或反键轨道10、 用线性变分法求出的分子基态能量比起基态真实能量,只可能( B)(A) 更高或相等 (B) 更低 (C) 相等 11、 N 2、O 2、F 2的键长递增是因为(A)(A) 核外电子数依次减少 (B) 键级依次增大 (C) 净成键电子 数依次减少12、 下列哪一条属于所谓的“成键三原则”之一:(B)(A) 原子半径相似 (B) 对称性匹配 (C) 电负性相似13、 下列哪种说法是正确的( B)(A) 原子轨道只能以同号重叠组成分子轨道 (B) 原子轨道以异号重叠组成非键分子轨道(C) 原子轨道可以按同号重叠或异号重叠,分别组成成键或反键轨道14、 氧的O 2+ , O 2 , O 2- , O 22-对应于下列哪种键级顺序( A)(A) 2.5, 2.0, 1.5, 1.0 (B) 1.0, 1.5, 2.0, 2.5 (C) 2.5, 1.5, 1.0 2.015、 下列哪些分子或分子离子具有顺磁性( B)(A) O 2、NO (B) N 2、F 2 (C) O 22+、NO+16、 B 2和C 2中的共价键分别是( A )(A )π1+π1,π+π (B )π+π,π1+π1 (C )σ+π,σ二 填空题1、2H 、2CO 、4CH 、HCl 分子有红外光谱的是 。
结构化学参考答案

结构化学参考答案结构化学参考答案结构化学是一门研究物质分子结构及其性质的学科,它在化学领域中具有重要的地位。
在结构化学中,我们通过对物质的分子结构进行分析和研究,来揭示物质的性质和反应机理。
本文将以结构化学参考答案为主题,探讨结构化学的基本原理和应用。
一、结构化学的基本原理结构化学的基本原理是基于物质的分子结构来解释和预测其性质。
分子结构由原子之间的键连接所决定,不同的键类型和键的排列方式会导致物质的不同性质。
例如,碳原子可以形成单键、双键或者三键,通过这些键的连接方式,我们可以得到不同的有机化合物,如烷烃、烯烃和芳香烃等。
通过分析分子结构,我们可以预测物质的化学性质,如溶解度、酸碱性等。
二、结构化学的应用1. 药物设计与发现结构化学在药物设计与发现中发挥着重要的作用。
通过对药物分子的结构进行分析和研究,可以预测药物的活性和选择性。
结构化学工具如分子对接和药物设计软件可以帮助研究人员设计出更有效的药物分子,并加速药物研发过程。
2. 材料科学结构化学在材料科学中也有广泛的应用。
通过对材料分子结构的研究,可以了解材料的性质和性能。
例如,通过改变聚合物分子的结构,可以调控材料的力学性能和热稳定性。
结构化学的研究可以为材料的设计和合成提供指导,促进新材料的开发和应用。
3. 环境保护结构化学在环境保护领域中也具有重要的意义。
通过对环境中有害物质的分子结构进行分析,可以了解其毒性和生物降解性。
结构化学的研究可以帮助我们设计出更有效的环境治理方法,并预测有害物质的迁移和转化过程,为环境保护工作提供科学依据。
三、结构化学的发展趋势随着科学技术的不断进步,结构化学也在不断发展和演变。
在过去的几十年里,结构化学主要依赖实验手段来研究分子结构,如X射线衍射和核磁共振等。
然而,随着计算机技术的发展,计算化学的兴起为结构化学提供了新的研究方法。
通过计算化学模拟,我们可以预测分子结构和性质,加速研究过程,降低实验成本。
此外,结构化学在大数据和人工智能的支持下也有了更广阔的应用前景。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一选择题
1、CsCl晶体中,每个铯离子周围紧靠着的氯离子数目是( c )
(A)4个(B)6个(C)8个(D)12个
2、在离子晶体中,决定正离子配位数的关键因素是( A)
(A) 正负离子半径比 (B) 正负离子电价比 (C) 正负离子电负性之比
3、对于二元离子晶体,下列哪一式成立:( B )
(A) n+/n-=Z-/Z+=CN-/CN+ (B) n-/n+=Z-/Z+=CN-/CN+ (C) n+/n-=Z-/Z+=CN+/CN-
4、马德隆(Madelung)常数与离子晶体的哪种因素有关:( B)
(A) 化学组成 (B) 晶体结构型式 (C) 离子键长
5、Ge晶体(A
4,即金刚石结构)的空间利用率(堆积系数)小于W晶体(A
2
),
它们的晶胞中的原子数目是( B )
(A) Ge<W (B) Ge>W (C) Ge=W
6. NaCl与CaF
2
晶体的相同之处是:( B)
(A) 结构基元 (B) 负离子堆积方式 (C) 点阵型式
7. 4:4是下列哪一种晶体的CN
+/CN
-
:( C)
(A) CsCl (B) NaCl (C) 六方ZnS
8. 对于CaF
2
晶体,“简单立方”一词描述的是它的( B )
(A) 负离子堆积方式 (B) 点阵型式 (C) 正离子堆积方式
9. 某种离子晶体AB被称为NaCl型, 这指的是( B)
(A) 它的化学组成 (B) 它的结构型式 (C) 它的点阵型式
二简答题
1.已知金属Ni为A1型结构,原子间最近接触距离为249.2pm试计算:
(1)Ni立方晶胞参数;
(2)金属Ni 的密度(以g×表示);
(3)画出(100),(110),(111)面上原子的排布方式。
1. (1) 35
2.4pm
(2) 8.91g·cm-3
2. 已知金属钛为六方最密堆积结构,金属钛原子半径为146pm,试计算理想的六方晶胞参数。
2. a=b=292pm, c=477pm
3. 计算A2型体心立方密堆积的空间利用率。
3. 68.02%
4. Al为立方晶胞, 晶胞参数a=404.2pm, 用CuKα辐射(λ=154.16pm)观察到以下衍射: 111,
200,311,222,400,331,420,333和511
(1) 判断晶胞点阵形式;
(2)计算(110), (200)晶面间距;
(3)计算参照基矢(λ*)的倒易晶格大小。
4. (1) 面心立方
(2) d111=233.34pm, d200=202.08pm
(3) V*=0.05552
5. 金属钽给出的粉末X光衍射线的sin2θ值如下:
粉末线序数波长sin2θ粉末线序数波长sin2θ
1 0.11265 7 0.76312
2 0.22238 8 0.87054
3 0.33155 9 0.87563
4 0.44018 10 0.97826
5 0.54825 11 0.98335
6 0.65649
X射线的波长各为()λ = 1.542,()λ = 1.541,()λ = 1.544,试确定的晶系、点阵形式,对上述粉末线进行指标化并求出晶胞参数。
5. 立方体心点阵, 110,200,211,220,310,222, 321,400,330 a=330.5pm
6.α-Fe为立方晶系,用Cu 射线(=154.18pm)作粉末衍射,在h k l类型衍射中,
h+k+l=奇数的系统消光。
衍射线经指标化后,选取222衍射线,=68.69°,试计算晶胞参数。
已知α-Fe的密度为7.87g.cm-3,Fe的相对原子质量为55.85,问a-Fe晶胞中有几个Fe原子。
请画出α-Fe晶胞的结构示意图,写出Fe原子的分数坐标。
6. a=286.65pm Fe(0,0,0, ; 1/2,1/2,1/2)
7.金属钽属于体心立方结构,(231)晶面间距为1.335,求金属钽的密度。
7. 16.7g×cm-3 (110)晶面间距233pm
8.金属锌的晶体结构是略微歪曲的六方密堆积,a = 2.664,c = 4.945,每个晶胞含两
个原子,坐标为(0,0,0),(,,),求原子。
8. R(Zn-Zn)=291.18pm
9.金属钠为体心立方结构,a = 429 pm,计算:
(1)Na的原子半径;
(2)属钠的理论密度;
(3)110)面的。
9. (1) a=185.8pm
(2) ρ=0.967g×cm-3
(3)d110=303.3pm
10.Ni是心立方金属,晶胞参数a = 352.4 pm,用Cr Kα辐射(λ= 229.1 pm)拍粉末图,列出可能出现的谱线的衍射指标及其衍射角(θ)的数值。
10. 可能出现衍射指标: 111, 200, 220, 311, 222, 400, 331¼
11.灰锡为刚石型结构,晶胞中包含8个Sn原子,晶胞参数a = 648.9 pm。
(1)写出晶胞中8个Sn原子的分数坐标;
(2)算出Sn的原子半径;
(3)灰锡的密度为5.75g·cm-3,求Sn的原子量;
(4)白锡属四方晶系,a = 583.2 pm,c = 318.1 pm,晶胞中含4个Sn原子,通过计算说明由白锡转变为灰锡,体积是膨胀了,还是收缩了?
(5)白锡中Sn-Sn间最短距离为302.2 pm,试对比灰锡数据,估计哪一种锡的配位数高。
11. (1) 0,0,0; 1/2,1/2,0; 1/2,0,1/2; 0,1/2,1/2; 1/4,1/4,1/4;3/4,3/4,1/4;3/4,1/4,3/4;1/4,3/4,3/4
(2) r Sn=140.5pm
(3) 原子量118.3
(4) 体积膨胀
(5) 白锡配位数高
12.Cu属立方面心晶系, 晶胞边长a=361pm, 若用波长154pm的X射线,
(1)预测粉末衍射最小3个衍射角
(2)计算Cu的密度.
12. (1) 21°41', 25°15', 37°06' ¼
(2) 8.97g×cm-3
13.CuSn合金属NiAs型结构,六方晶胞参数a=419.8pm,c=509.6pm ,晶胞中原子的分数坐
标为:Cu: 0,0,0; 0,0,; Sn: ; 。
(1)算Cu-Cu的最短距离;
(2)Sn原子按什么型式堆积?
(3)Cu原子周围的原子围成什么多面体空隙?
13. (1) R(Cu-Cu)=254.8pm
(2) 六方最密堆积
( 3) 八面体空隙
14.有一黄合金含Cu75% ,Zn25%(质量分数),晶体的密度为8.5,晶体属立方面心点阵结构,晶胞中含4个原子,相对原子质量分别为:Cu 63.5 ,Zn 65.4 。
(1)求算Cu和Zn所占原子百分数;
(2)每个晶胞中含合金的质量;
(3)晶胞体积多大
(4)统计原子的原子半径多大?
14. (1) Cu 75.5% Zn 24.5%
(2) 4.25´10-22g
(3) V=5.0´10-23
(4) r=130pm
15.AuCu无序结构为立方晶系,晶胞参数a = 385 pm [如图左],其有序结构为四方晶系[如图右]。
若合金结构由(a)转变为(b)时,晶胞大小看作不变,
请回答:
(1)无序结构的点阵型式和结构基元;
(2)有序结构的点型式、结构基元和原子分数坐标;
(3)用波长154 pm的X射线拍粉末图,计算上述两种
结构可能在粉末图中出现的衍射线的最小衍射角(θ)数值。
15. (1) 无序结构面心立方结构基元为Cu1-x Au x, 是个统计原子
(2)有序结构为简单四方,可用图中顶点与底心Au原子构成更小的四方晶胞, Cu 位于体心位置,一个Cu与一个Au构成结构基元Au(0,0,0) Cu(1/2,1/2,1/2)
(3)无序结构是fcc, 最小衍射指标(111),22.3°有序结构简单四方, 最小衍射指标(001),11.5°。
