应用动力学方法在线检测Vero细胞培养过程中的摄氧率
细胞活力检测方法

细胞活力检测方法细胞活力是指细胞的生存状态和生理功能的活跃程度,是评价细胞健康状况的重要指标。
细胞活力的检测方法多种多样,包括形态学观察、生化指标检测、细胞增殖和凋亡检测等。
下面将介绍几种常见的细胞活力检测方法。
首先,形态学观察是最直观的细胞活力检测方法之一。
通过显微镜观察细胞的形态、大小、颜色等特征,可以初步判断细胞的活力状态。
健康的细胞通常具有完整的形态结构、清晰的细胞核和丰富的细胞质,而受损或死亡的细胞则可能出现细胞浑浊、变形、脱落等现象。
其次,生化指标检测是常用的细胞活力评估方法之一。
通过检测细胞内的生化指标如ATP含量、蛋白质合成率、酶活性等,可以客观地评价细胞的代谢活力和功能状态。
例如,ATP是细胞内能量的主要来源,其含量的变化可以反映细胞的能量代谢情况,从而间接反映细胞的活力水平。
另外,细胞增殖和凋亡检测也是常用的细胞活力检测方法。
细胞增殖能力是细胞活力的重要指标之一,可以通过细胞计数、增殖标记物检测等方法来评估。
而细胞凋亡是细胞程序性死亡的一种形式,通过检测细胞凋亡标记物如DNA片段化、凋亡蛋白表达等,可以评估细胞的凋亡程度,从而间接反映细胞的活力状态。
除了上述方法外,还有一些新兴的细胞活力检测技术,如细胞荧光染色、细胞电生理检测、细胞代谢组学分析等,这些方法在评价细胞活力方面具有一定的优势和应用前景。
综上所述,细胞活力的检测方法多种多样,每种方法都有其特点和适用范围。
在实际应用中,可以根据具体的研究目的和条件选择合适的方法进行细胞活力检测,从而更准确地评价细胞的生理状态和功能状态,为细胞生物学研究和临床诊断提供有力支持。
促Vero细胞生长效能(培养瓶法)的检测标准操作规程SOP09-118-00 2011
正文1 试验用细胞、试剂、器材与设备1.1 Vero细胞。
1.2 MEM 培养基,胰蛋白酶消化液,PBS,0.4%台盼蓝。
1.3 待检牛血清,对照血清。
1.4 25cm2细胞培养瓶,注射器,吸管,血球计数板,盖玻片,移液枪,枪头。
1.5 倒置显微镜,显微镜,二氧化碳培养箱。
2 试验方法2.1 将长满单层的Vero细胞消化计数后分瓶,共分种4瓶,8ml/瓶,使接种终浓度为4.0±2.0×104 个/ml,多余的细胞悬液弃掉,分别补足MEM至7.2ml。
2瓶分别加入标准对照血清0.8ml,另外2瓶分别加入待检血清0.8ml。
标记后放入培养箱培养。
2.2 培养72小时后,将待检血清组细胞消化计数后传代,接种终浓度为4.0±2.0×104 个/ml,培养基为含10%待检血清的MEM,多余的细胞悬液弃掉。
标准对照血清组细胞消化计数后传代,接种终浓度为4.0±2.0×104 个/ml,培养基为含10%待检血清的MEM,多余的细胞悬液弃掉。
2.3 连传3代,分别计数每代的初始浓度(X)和终浓度(Y),按下式进行计算每代的倍增次数:A=log(Y/X),求出供试品和标准对照品三代培养细胞倍增次数的平均值(A)。
24 结果判定4.1 粗制胎牛血清和胎牛血清:培养Vero细胞72小时, A>3.2。
4.2 粗制特级新生牛血清和特级新生牛血清:培养Vero细胞72小时, 2.8<A≤3.2。
4.3 粗制优级新生牛血清和优级新生牛血清:培养Vero细胞72小时, 2.5<A≤2.8。
4.4 当培养Vero细胞72小时,A小于等于2.5时,判定待检血清不符合细胞培养要求。
4.5 标准对照血清培养Vero细胞72小时,细胞倍增次数(A)不低于相应等级的标准。
5 做好记录。
6 附件:促Vero细胞生长效能的测定记录,文件编号:SOP09-118-a-00。
促Vero细胞生长效能的测定记录。
Vero 细胞 HCP(宿主残留蛋白)ELISA试剂盒说明书分析

Vero 细胞HCP(宿主细胞蛋白)Vero细胞宿主蛋白酶联免疫检测目录#F500预期用途该试剂盒用于检测用Vero 细胞.生产的制品中是否有宿主蛋白残留。
仅供研究和工业生产,不能用于人和动物的诊断。
总结与说明病毒疫苗或其他治疗用蛋白在Vero细胞中表达使商业用大量生产药物原料产品的经济简便方法。
生产和纯化这些产品的过程中会残留Vero细胞中的一些蛋白质(称为宿主细胞蛋白,HCPs)而造成污染。
这种污染可以减少药物的疗效,引发毒副反应和免疫学反应,因此最好在实际生产制品过程中将HCPs降低到最低水平。
一些利用抗体来除HCPs的免疫学方法,如Western Blot 和ELISA被广泛使用。
虽然Western blot是一种检测HCPs的有效方法,但它受到了一些限制。
因为它过程复杂且技术依赖性强,需要操作者对结果进行分析解释。
而且,它在本质上是一种定性检测,不能定量分析。
Western blot的敏感性易受被检测样品量的影响,也受目的产品浓度的干扰。
因此Western blot可用来检测纯化上游的蛋白质,而对纯化下游或终产品的检测灵敏度与特异性较低。
本试剂盒中用到的ELISA方法克服了Western Blot的缺点,将敏感度提高了100倍。
ELISA操作简单、客观、可获得半定量的结果,是纯化工艺,过程控制,常规质量检测的最佳选择。
这个试剂盒可与纯化过程中残留的可独立污染产品的所有HCPs反应,就这个意义上来说,这个试剂盒是通用的。
用Vero细胞轻度裂解物获得抗体并经亲和纯化,得到的最终抗体可以与用于生产各种病毒疫苗和蛋白质产品的四种商用细胞系反应。
这一分析表明,绝大多数HCP存在于各种Vero细胞系和纯化过程中。
如果你需要一个更为敏感和特异性的方法去检测样品中的HCP量,Cygnus Technologies公司为你推荐一个优于2D Western blot的方法,我们将这个方法称为2D HPLC-ELISA。
8发酵工艺控制1

(三)影响供氧的因素 N = K La . (C*-CL) 1、影响氧传递推动力的因素 (C*-CL) 是氧传递的推动力,因此只有提高 C*,降低CL 。但不符合生产现状或要求。 2、影响K La 的因素 经生产实践证明,影响K La 的主要因 素有搅拌、空气流量、发酵液的理化性质 等。可用下列经验式表示它们之间的关系:
2.氮源 影响:同样包括种类和浓度的影响。 工业生产中采用的措施: 1)混合使用 2)在发酵过程中补加氮源。
3.磷酸盐 在工业生产中,通过在基础培养基中控制磷 酸盐的亚适量,来减少磷酸盐的抑制作用。
二、基质浓度对发酵的影响及控制 1.影响: 基质浓度过低,不能满足菌体生长的需求; 基质浓度过丰富,也会影响菌体生长和产物的 合成。
8.4营养基质的影响及控制
一、营养基质种类的影响及控制 1.碳源 碳源种类的影响:速效碳源有利于菌体的快速 生长,但其分解产物有明显的阻遏作用;缓慢利用 的碳源有利于延长代谢产物的合成。 碳源浓度的影响:碳源丰富易造成繁殖过剩, 对产物合成及氧的传递造成不良的影响。 在工业上的控制,一般采用二者混合使用,并 控制一定的浓度,在发酵过程中采用补料分批发酵 的方法。
K La= K〔(P/V)α· s)β· app)-ω〕 (υ (η P/V 发酵罐搅拌功率kW/m3 υs 罐体垂直方向的空气直线速度m/h ηapp 发酵液的表观粘度Pa·s K 经验常数 α β –ω 经验常数,与搅拌器、空气分布器的形状 等有关,一般通过实验测定。 实验侧得α值在0.75~1.0, β在0.4~ 0.72,
8.9二氧化碳的影响及控制
一、二氧化碳对发酵的影响
1、发酵液中的二氧化碳对微生物的生长速 度具有刺激或抑制作用。 1)刺激作用:称之为CO2效应。 环状芽孢杆菌、大肠杆菌和链孢霉的突 变株需30%的浓度。 2) 抑制作用:酵母菌,青霉素菌丝形态 随着CO2的增加形态发生改变,如青霉菌 由丝状变为球状或酵母状细胞。
生物制药技术使用中的监测方法与结果解读指南

生物制药技术使用中的监测方法与结果解读指南随着生物制药技术的不断发展,越来越多的生物药物被开发和应用于临床治疗中。
在生物制药的生产过程中,监测方法的选择和结果的解读至关重要,因为这直接关系到药物的质量和疗效。
本文将介绍一些常见的生物制药技术使用中的监测方法,并提供一些结果解读的指南。
一、细胞培养监测方法在生物药物制造过程中,细胞培养是关键环节之一,因为生物药物通常是使用细胞来产生的。
常见的细胞培养监测方法包括细胞密度测定、细胞活力测定和细胞产物测定。
1. 细胞密度测定:细胞密度是指单位体积内细胞的个数,通常使用显微镜计数法或细胞计数仪来测定。
细胞密度的变化可以提供有关细胞增殖和死亡情况的信息,利于调整培养条件。
2. 细胞活力测定:细胞活力是指细胞的活动状态和功能活跃程度,通常使用细胞染色法、酶活性测定或细胞内特定蛋白的表达来测定。
细胞活力的监测可以评估细胞的健康状况,以及细胞内代谢产物的表达和积累情况。
3. 细胞产物测定:细胞产物是指细胞培养过程中产生的目标蛋白或其他生物活性物质。
常用的测定方法包括酶活性测定、免疫学方法(如ELISA或Western blot)和质谱分析等。
细胞产物的测定有助于评估生产过程中产物的质量和纯度。
二、病原体检测方法生物制药过程中使用的细胞培养系统可能存在病原体污染风险,因此对病原体的监测非常重要。
常见的病原体检测方法包括核酸检测、免疫学检测和生物学检测。
1. 核酸检测:核酸检测是一种直接检测病原体核酸序列的方法,包括PCR、实时荧光PCR和基因芯片等。
核酸检测方法具有高度的敏感性和特异性,可以快速准确地检测到病原体的存在。
2. 免疫学检测:免疫学检测通过检测体液中的病原体特异性抗体或抗原来间接地检测病原体的存在。
常用的免疫学检测方法包括酶联免疫吸附试验(ELISA)、免疫荧光分析和免疫印迹等。
3. 生物学检测:生物学检测主要包括细菌培养和病毒滴度测定等。
通过对样品进行培养或使用细胞系进行感染,可以检测到病原体的存在,并测定其数量。
名词解释题库

1、发酵工程:是将DNA重组及细胞融合技术、组学及代谢网络调控技术、过程工程优化与放人技术等新技术与传统发酵工程融合,大大捉高传统发酵技术水平,拓展传统发酵应用领域和产品范围的•种现代工业生物技术理论与工程技术体系(新•代工业生物技术)。
2、固体发酵:根据培养物的物理状态分类的•种发酵方式。
发酵培养物为固态。
3、液体发酵:液体发酵是相对于固体和半固体发酵而言,是从培养基的状态对发酵的•个分类。
4、厌氧发酵:厌氧微生物在隔绝空气不与分了态氧接触的情况下进行的发酵过程。
•般适用于微生物作用于有机化合物的分解代谢,反应时放出气体同时产生热量。
5、好氧发酵:利用微生物在有氧气存在的情况下生成并积累微生物菌体或代谢产物。
6、深层培养:又称通气搅拌技术,采用机械通气搅拌,使得好气性发酵进行大规模生产。
7、深层液体发酵:即微生物细胞在•个密封的发酵罐内,通入无菌空气进行发酵。
8、深层固体发酵:是浅盘固体发酵的•种发展,如厚层通气床,固体发酵罐等,用于工业生产。
9、分批发酵:根据物料和产物的进出方式进行分类的•种发酵方式,所有物料(除去空气,消泡剂,酸碱调节剂外〉•次加入发酵罐,灭菌、接种、培养,最后整个罐的内容物放出,进行产物回收。
10、补料分批发酵:在分批培养过程中补入新鲜的料液,以克服营养不足而导致的发酵过早结束的缺点。
在此过程中只有料液的加入没有料液的取出,所以发酵结束时发酵液体积比发酵开始时有所增加。
11、连续发酵:以•定的速度向发酵罐内添加新鲜培养基,同时以相同的速度流出培养液,使培养物在近似恒定的状态下生长的培养方法。
12、半连续发酵:在补料分批培养的基础上间歇放掉部分发酵液(带放)称为半连续培养。
某些品种采取这种方式,如四环素发酵。
13、营养缺陷型(auxotroph):指原菌株由于发生了基因突变,致使合成途径中某步麋发生缺陷,而丧失了合成某些营养物质(氨基酸、维生素、碱基等)的能力。
14、原养型(PrOtOtropħ):营养缺陷型菌株经回复突变或重组变异后产生的菌株,其营养要求在农型上与野生型相同。
Vero细胞最标准的培养方法可以参考ATCC

Vero细胞最标准的培养方法可以参考ATCC:增殖培养:Propagation: ATCC complete growth medium: Minimum essential medium (Eagle) with 2 mM L-glutamine and Earle's BSS adjusted to contain 1.5 g/L sodium bicarbonate, 0.1 mM non-essential amino acids, and 1.0 mM sodium pyruvate, 90%; fetal bovine serum, 10%Temperature: 37.0CAtmosphere: air, 95%; carbon dioxide (CO2), 5%传代:Subculturing: Protocol:Remove and discard culture medium.Briefly rinse the cell layer with 0.25% (w/v) Trypsin- 0.53 mM EDTA solution to remove alltraces of serum that contains trypsin inhibitor.Add 2.0 to 3.0 ml of Trypsin-EDTA solution to flask and observe cells under an inverted microscope until cell layer is dispersed (usually within 5 to 15 minutes).Note: To avoid clumping do not agitate the cells by hitting or shaking the flask while waiting for the cells to detach. Cells that are difficult to detach may be placed at 37°C to facilitatedispersal.Add 6.0 to 8.0 ml of complete growth medium and aspirate cells by gently pipetting.Add appropriate aliquots of the cell suspension to new culture vessels.Incubate cultures at 37°C。
发酵重点1-8

1、发酵工程的基本定义?发酵工程:是利用微生物的生长繁殖和代谢活动来大量生产人们所需产品过程的理论和工程技术体系,是生物工程与生物技术学科的重要组成部分。
发酵工程也称作微生物工程,该技术体系主要包括菌株选育与保藏、菌种的扩大生产、微生物代谢产物的发酵生产和分离纯化制备,同时也包括微生物生理功能的工业化利用。
2、提出研发一个发酵新产品的可能路线发酵生产工艺流程除某些转化过程外,典型的发酵工艺过程大致可以划分为以下6个基本过程①用作种子扩大培养及发酵生产的各种培养基的配制;②培养基、发酵罐及其附属设备的灭菌;③扩大培养有活性的适量纯种,以一定比例将菌种接入发酵罐中;④控制最适的发酵条件使微生物生长并形成大量的代谢产物;⑤将产物提取并精制,以得到合格的产品;⑥ 回收或处理发酵过程中所产生的三废物质。
3、发酵工业的特点①常温常压下进行的生物化学反应,条件较温和②较廉价的原料生产较高价值的产品③通过生物体的自适应调节来完成,反应专一性强,可以得到较为单一的代谢产物④可以产生比较复杂的高分子化合物⑤不受地理、气候、季节等自然条件的限制,可以根据订单安排通用发酵设备来生产多种多样的发酵产品1、为什么需要进行微生物菌种改良?①提高目标产物的产量生产效率和效益!②提高目标产物的纯度,减少副产物可有效降低产物分离成本。
③改良菌种性状,改善发酵过程改变和扩大菌种所利用的原料范围、提高菌种生长速率、保持菌株生产性状稳定、提高斜面孢子产量、改善对氧的摄取条件并降低需氧量及能耗、增强耐不良环境的能力(如耐高温、耐酸碱、耐自身所积累的过量代谢产物)、改善细胞透性以提高产物的分泌能力等。
④改变生物合成途径,以获得高产的新产品2、你认为菌种筛选过程中最关键的环节是什么?筛选方法(1)平皿快速检测法肉眼可观察的变化。
显色法、变色圈法、透明圈法、生长圈法和抑制圈法…(2)形态变异的利用(3)高通量筛选(high throughput screening)3、如果尽量保持菌种不发生退化?(1)控制传代次数基因的变化往往发生在复制和繁殖过程中,繁殖越颇繁,复制的次数越多,基因发生变化的机会也就越多。
细胞培养vero实验报告

Vero细胞传代培养实验报告一、实验原理体外培养的原代细胞或细胞株要在体外持续地培养就必须传代,以便获得稳定的细胞株或得到大量的同种细胞,并维持细胞种的延续。
培养的细胞形成单层汇合以后,由于密度过大生存空间不足而引起营养枯竭,将培养的细胞分散,从容器中取出,以1:2或l:3以上的比率转移到另外的容器中进行培养,即为传代培养。
细胞“一代”指从细胞接种到分离再培养的一段期间,与细胞世代或倍增不同。
在一代中,细胞培增3~6次。
细胞传代后,一般经过三个阶段:游离期、指数增生期和停止期。
细胞接种2~3天分裂增殖旺盛,是活力最好时期,称指数增生期(对数生长期),适宜进行各种试验。
二、器材和液体的准备①.细胞培养器材:培养箱、超净工作台、倒置显微镜、25m培养瓶、5ml移液管、1ml枪头;②. 细胞培养溶液:配制好的PBS液、DMEM培养液(10%血清)、胰酶溶液。
(均已过滤灭菌, 37℃预热)③.其他器材及灭菌用品:计时器、无菌手套、75%酒精、镊子、棉球、废液缸。
三、实验操作①.将长成单层的Vero细胞从二氧化碳培养箱中取出,在超净工作台中吸出瓶内的培养液,加入3~5ml的PBS溶液洗涤一次后吸出,加入1ml胰酶溶液,左右晃动培养瓶使胰酶溶液平铺在细胞表面。
放入37℃,5%二氧化碳培养箱中放置3分钟。
②.在倒置显微镜下观察被消化的细胞,如果细胞变园,相互之间不再连接成片,这时应立即在超净台中将消化液吸出,加入2ml新鲜培养液,反复吹打,制成细胞悬液。
③.将细胞悬液吸出1ml废弃后,将培养瓶中培养液添加至5ml左右,盖好瓶塞,送回37℃,5%二氧化碳培养箱中,继续进行培养。
④. 记录细胞生长情况。
四、无菌操作的注意事项①.在无菌操作中,一定要保持工作区的无菌清洁。
为此,在操作前要认真地洗手并用75%乙醇消毒。
将要放入超净工作台的器材均需放入前喷洒75%酒精灭菌。
操作前30分钟起动超净台紫外灭菌后打开吹风,酒精棉球擦拭超净工作台面。
灭活疫苗(Vero细胞)对照细胞外源因子检查记录

品名:批号:
代次:生产单位:
1. 检验依据:《中华人民共和国药典》2015年版三部□本企业注册标准□
其它:□2.检验方法:细胞形态观察及红细胞吸附法
3.操作规程:SOP-04-13-3905《肠道病毒71型灭活疫苗(Vero细胞)对照细胞外源因子检查SOP》
4. 判定标准:阴性对照细胞形态正常,血吸附试验结果为阴性;阳性对照细胞出现病变,且血吸附试验结果为阳性;供试品细胞形态正常(至少有80%的对照细胞培养物存活),且血吸附试验结果为阴性,判供试品符合规定。
5. 检验操作:
5.1 材料和设备
5.1.1试剂
5.1.2 仪器
5.1.3 用具及耗材
品名:{ProductName} 批号:{BatchNo}
2 试验步骤
5.2.1.试验前清场
5.2.2 操作步骤
5.2.3试验后清场
品名:{ProductName} 批号:{BatchNo} 6.结论:
检验人:检验日期:复核人:复核日期:。
KLA的测定
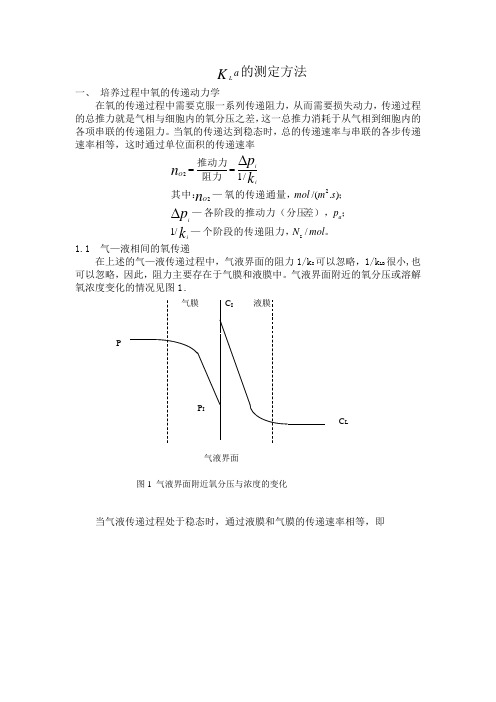
a K L的测定方法一、 培养过程中氧的传递动力学在氧的传递过程中需要克服一系列传递阻力,从而需要损失动力,传递过程的总推力就是气相与细胞内的氧分压之差,这一总推力消耗于从气相到细胞内的各项串联的传递阻力。
当氧的传递达到稳态时,总的传递速率与串联的各步传递速率相等,这时通过单位面积的传递速率。
个阶段的传递阻力,—;差),各阶段的推动力(分压—;氧的传递通量,—其中:阻力推动力mol N p s m mol k p n k p n iaiO iiO //1)./(/1s222∆∆==1.1 气—液相间的氧传递在上述的气—液传递过程中,气液界面的阻力1/k I 可以忽略,1/k LB 很小,也可以忽略,因此,阻力主要存在于气膜和液膜中。
气液界面附近的氧分压或溶解1。
当气液传递过程处于稳态时,通过液膜和气膜的传递速率相等,即;/);../(;/);../(/;/;/;;;/1/1/1/1223**33I**2C s m s m mol s m s m mol m mol m mol m mol k p k K p K p C p C P C p p p p p p K C C k C C K Pp k p p n LaG LaG aLLaia i aLLL L I GG iO 液膜传质系数,—气膜传质系数,—传质系数,以氧浓度为推动力的总—总传质系数,以氧分压为推动力的的—;平衡的液相氧浓度与—平衡的氧分压与—;液相主体氧浓度—气液界面氧浓度—气液界面氧分压,—气液界面氧分压,—气相主体氧分压,—其中:-=-=-=-= 根据亨利定律HC p =其中H 是亨利常数。
对于难容气体(如氧),气膜传递阻力与液膜传递阻力之比忽略不计,即1/Hk G <<1/k L ,因此k L ≈K L 。
在单位体积培养液中,氧的传递速率为()。
比表面积,—传递速率,单位体积培养液中的氧—其中:323*/);./(OTR OTR m m a s m mol a C C K LL -=通常将K L 与a 合并在一起,作为一个参数处理,称为容量传递系数(S -1)。
细胞活力测定方法

细胞活力测定方法
以下是 6 条关于细胞活力测定方法的内容:
1. 嘿,你知道吗?有一种超简单的细胞活力测定方法,就像我们判断水果新鲜不新鲜一样直观!比如说,咱可以用台盼蓝染色法呀。
想象一下,细胞就像一个个小果子,通过这种染色,就能清楚地知道哪些是有活力的,哪些已经“不行了”。
这不是很神奇吗?
2. 哇塞,细胞活力测定还可以用 MTT 法呢!这就好像是给细胞们来一场特别的“考试”,那些活力满满的细胞就能顺利通过。
就像是运动场上的健儿们,活力强的就能在比赛中脱颖而出。
你说是不是很有意思?
3. 嘿呀!还有一种细胞活力测定方法叫荧光素酶报告基因法。
这就像是给细胞装上了小小的“信号灯”,活力强的细胞就会让这信号灯闪闪发亮。
比如说,在研究某些基因功能的时候,用这个方法就能清楚地看到细胞的活力变化啦,太酷啦!
4. 告诉你哦,细胞活力测定还能用流式细胞术!这不就像是给细胞们来一次精准的“点名”嘛。
可以快速又准确地知道细胞活力的情况。
就好比在人群中,一下子就能找出那些充满活力的人一样,真牛啊!
5. 哇哦,细胞活力测定的方法之一是细胞计数法呢!这就好像我们数星星一样,去数数有多少活力的细胞。
比如说在培养细胞的过程中,通过这种方法来看看细胞有没有好好生长,是不是很实用呀?
6. 哈哈,还有一种细胞活力测定的好方法——CCK-8 法哟!就如同给细胞们举办一场欢乐的“派对”,活力强的细胞就会在这场派对中尽情展现自己。
在药物筛选等方面,这个方法可厉害啦,能快速知道药物对细胞活力的影响。
怎么样,很神奇吧?
我的观点结论:这些细胞活力测定方法都各有特点和优势,在不同的研究和应用场景中都能发挥重要作用呢!。
应用动力学方法在线检测Vero细胞培养过程中的摄氧率

复杂, 故计算困难, 本文通过实验方法校 1 3 I J 3 5 K常数不全, [ ] !, ) 正% 所得结果与文献值基本一致 。 "
图! 细胞密度和 $ ) * 随时间的变化 细胞密度 ". #.$ ) *
图B 空气中氧在水 (# 和培养基 (# $B) $() 中的饱和浓度测定结果
图) $ ) * 与细胞密度的关系
收稿日期: , 修回日期: 。 ! / / / 0 % 1 0 2 ! $ % % % 0 % 2 0 ! 1 基金项目: 部分得到上海市启明星计划的资助。 " 联系人。
, 。反应器工作体积为 ! , 微载体浓度 1Y / 。 O ? G ? R C S 8) 7 $= = 、 用空气、 氧气、 氮气和二氧化碳气体积分调节控制 Z <H & 7 $ 溶氧 (6 控制转速 2 / , 温度 3) 1 % N 空气饱和度; %!# 14 ; ? A 2 " 7 6 U。 其中取 !; % & ( & ’ 细胞计数:每天取样 ! 次, = 样品加入 / 混合均匀后置于 % 7 ! N结晶 紫 和 % 7 !; ( ) = 柠 檬 酸 溶 液,
’ ( ) * ! "+ ( * # % % % , ) . $
! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! !
积分得: % & ’ 材料
以9 ( / 对/ 作图, 得一直线, 其斜率即为 8 $ 0 0 +。 % /) 9 (非洲绿猴肾) 细胞由中国药物生物制品检定所 % & ’ & % ’ 3 4 ( 惠赠, 代次为! 。 $ / ! ! 2 ! (@ 美国) 。使用前添加 ! % & ’ & ’ I J K J L M > B, % N 新生小牛 血清 (华东理工大学动物细胞与组织工程研究室) 。 (Q % & ’ & ( 用于 ’ 3 4 (细胞培养的贴壁介质为 > O ( E 3 P2 F : 4 0 . , ) 微载体, 先用 浸泡 , 灭菌后 ; : R ? :M ? ( O 3 R FS T 3 E 3 A Q M S $ #F 再用 Q 并用培养基浸泡置于培养箱过夜, 使用前 M S洗!次, 倾去培养基后再接入细胞。 % & ( 实验方法 % & ( & % 细胞培养:种子细胞由置于 2 & U、 1 N> B $ 培养箱 的扁瓶提供。当处于对数生长期的细胞达到所需密度时用
Vero细胞培养制备森林脑炎病毒实验研究-免疫学论文-基础医学论文-医学论文

Vero细胞培养制备森林脑炎病毒实验研究-免疫学论文-基础医学论文-医学论文——文章均为WORD文档,下载后可直接编辑使用亦可打印——摘要:目的比较3 L转瓶及14 L篮式生物反应器培养病毒制备的森林脑炎灭活疫苗的产量及质量。
方法分别采用3 L转瓶及14 L 篮式生物反应器培养Vero细胞,3 L转瓶培养细胞96 h后感染SZV 株森林脑炎病毒(MOI=0.01、0.04、0.1及0.4), 培养至8096 h收获第1次,每隔48 h收获1次(500 m L/次);14 L生物反应器培养Vero细胞7 d后感染SZV株森林脑炎病毒(MOI=0.01、0.04、0.1及0.4), 感染后96 h开始流加病毒维持液,并收获病毒液,每24 h收获1015 L.两种培养方式收获的森林脑炎病毒液经超滤浓缩、-丙内酯灭活、柱层析纯化后获得疫苗原液,并进行相关检定。
结果4种MOI感染Vero细胞,采用3 L转瓶方式培养可连续收获67次,病毒液产量为33.5 L, 收获液平均滴度为7.4 lgLD50/m L;采用14 L篮式生物反应器培养可连续收获14 d, 病毒产量140160 L, 收获液平均滴度高达8.4 lgLD50/m L.两种方法制备森林脑炎灭活疫苗原液各项质量指标均合格,且14 L篮式生物反应器制备原液的效力及蛋白含量优于3 L转瓶。
结论应用生物反应器培养工艺制备Vero细胞森林脑炎灭活疫苗的产量及质量高于转瓶培养工艺,本实验为生物反应器制备Vero细胞森林脑炎灭活疫苗的大规模生产及工艺改进奠定了基础。
关键词:14L篮式生物反应器;3L转瓶;森林脑炎灭活疫苗;森林脑炎是由森林脑炎病毒引起的自然疫源性疾病[1], 是一种急性病毒性传染病,也是一种危害人类健康的重要传染病[2-3].接种疫苗是控制该病流行最经济有效的措施[4].Vero细胞是世界卫生组织(WHO)推荐用于疫苗生产的传代细胞,已成功用于多种人用疫苗的研究及生产[5], 如人用狂犬病疫苗、出血热疫苗、乙脑疫苗等,可进行连续培养,多次收获[6].同时,Vero细胞可通过高密度罐培养的方式增加产量[7].本研究通过采用3 L转瓶和14 L篮式生物反应器两种培养方式培养Vero细胞,并用于制备森林脑炎病毒收获液,经纯化后获得森林脑炎灭活疫苗,参照《中国药典》三部(2010版)[8]要求及本公司自定标准进行检测,并将结果进行比较,现报道如下。
Vero细胞的微载体培养_放大过程中的接种工艺

79
90
100
100
贴壁率, 结果如表 2。从表中 3 U nder the m icro scope, 1 000 m icrocarriers w ere num bered random ly and the
p lating rate w as defin ited as:
可以看出, 当新球比例增加 时, 细胞贴壁率降低, 同时贴
三次, 再用戊二醛固定, 样品由华东理工大学分析测试中心电镜室处理后拍照。
2 结果与讨论
2. 1 细胞生长状态对球转球的影响 转瓶中微载体浓度为 3g L , 当微载体上细胞分别长到: ① 微载体上没有完全被细胞贴
满, ② 微载体上已被细胞贴满, ③ 微载体上的细胞已长成多层时, 补加新的微载体 2g L , 以后 每天取样计数光球数和满球率, 结果如表1。从表1可以看出, 当微载体上细胞已长到致密单 层时补加微载体, 可使新的微载体上较快地有细胞贴附, 贴壁率很快达到 100% , 其他两种情 况需要较长时间贴壁率才能达到 100%。 这可能由于球间转移方式是通过细胞粘附搭桥生长 或单个细胞迁居生长[6]。 当细胞生长旺盛时, 细胞搭桥生长或迁居生长能力强; 当微载体上细 胞长满时, 细胞向外生长的趋势明显, 因而更易进行球转球 (见图 1)。因此, 当微载体上已被细 胞贴满时, 补加适量微载体进行球转球时机最好。
© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved.
第6期
张 立等: V ero 细胞的微载体培养
·661·
2. 2 新老球比例对球转球 的影响
3∶3 3∶2 2∶1
酶标法相对定量检测Vero细胞疫苗中宿主细胞蛋白

酶标法相对定量检测Vero细胞疫苗中宿主细胞蛋白田博;丁志芬【期刊名称】《中国生物制品学杂志》【年(卷),期】2005(18)2【摘要】目的建立定量检测Vero细胞疫苗中宿主细胞蛋白(hostcellprotein ,HCP)的方法,并用该方法检测Vero细胞乙脑疫苗中HCP含量。
方法模拟Vero细胞疫苗生产工艺 ,制备Vero细胞HCP及其免疫血清 ,经过DEAEProteinASepharoseCL -4B亲和层析 ,制备纯化的抗Vero细胞HCPIgG。
通过对检测条件的优化 ,确立了酶标法相对定量检测Vero细胞疫苗中宿主细胞蛋白的方法 ,并用该方法对Vero细胞乙脑疫苗的收获物、中间产品及纯化样品收样前杂蛋白中HCP进行定量分析。
结果该方法可以检测Vero细胞疫苗加入保护剂前任何阶段产品中HCP含量。
结论ELISA法可以相对定量检测Vero细胞HCP的含量。
【总页数】4页(P159-161)【关键词】Vero细胞;定量检测;宿主细胞;酶标法;蛋白;乙脑疫苗;含量;收获;保护剂;样品【作者】田博;丁志芬【作者单位】北京生物制品研究所【正文语种】中文【中图分类】Q813.11;R512【相关文献】1.检测流感疫苗中宿主细胞DNA残留量的地高辛标记探针杂交法的建立 [J], 李贝贝;周琳婷2.磁珠法结合定量PCR检测肠道病毒71型灭活疫苗中宿主细胞DNA残留量的验证及应用 [J], 张静静;毕利利;王斌;宋路萍;安文琪;马小伟;梁雪爽;郭冰峰;荆新蕊;马超援;张少宁3.乙肝基因工程疫苗中宿主细胞DNA的检测 [J], 祁自柏;米山彻夫4.SYBR-Green实时定量PCR用于Vero宿主细胞DNA残留量的检测 [J], 胡广宏;寇桂英;包红;余黎;周旭5.Vero细胞疫苗生产过程中宿主细胞蛋白含量分析 [J], 田博;丁志芬因版权原因,仅展示原文概要,查看原文内容请购买。
应用光敏生物素探针检测Vero细胞乙脑疫苗中细胞残余DNA

应用光敏生物素探针检测Vero细胞乙脑疫苗中细胞残余
DNA
石慧颖;刘小琳;丁志芬
【期刊名称】《中国生物制品学杂志》
【年(卷),期】1993(6)4
【摘要】用国产光敏生物素,标记Veto细胞全DNA,通过与疫苗中同源DNA的狭缝杂交,检测Vero细胞乙脑疫苗中细胞残余DNA含量。
检测灵敏度可达1pg。
探针稳定长达一年。
杂交反应特:异性高,结果重复性好。
与同位素探针相比,生物素标记探针简便、经济、快速、稳定。
由本法测得,Vero细胞乙脑粗制疫苗中,含DNA 为200~400pg/0.5ml;超滤浓缩苗为4×10~4~6×10~6pg/0.5ml;通过柱层析和沉淀法提纯的疫苗则分别低于60pg/0.5ml和1pg/0.5ml。
本法同样适用于传代细胞制备的其它生物制品中细胞残余DNA的检测。
【总页数】3页(P175-177)
【关键词】光敏生物素;探针;乙脑;疫苗;DNA
【作者】石慧颖;刘小琳;丁志芬
【作者单位】卫生部北京生物制品研究所
【正文语种】中文
【中图分类】R392-33
【相关文献】
1.应用地高辛标记探针检测以Vero传代细胞制备人用狂犬疫苗中残余细胞DNA 含量 [J], 窦志勇;鲁宏;钱浩
2.地高辛标记探针检测Vero细胞残余DNA试验条件的改进 [J], 何晓燕;许峰;窦佳;何荣;金程;江贤木;张佳丽;金晓中;高春润;恽冬泽;张玉慧
因版权原因,仅展示原文概要,查看原文内容请购买。
一种篮式生物反应器内Vero细胞计数方法的建立

一种篮式生物反应器内Vero细胞计数方法的建立周蕾;陈建民;王鑫;宋云增;张春枝【期刊名称】《大连工业大学学报》【年(卷),期】2018(037)003【摘要】传统的篮式生物反应器因构造特殊,在进行Vero细胞培养时,无法取样进行直接细胞计数.实验通过活细胞计数仪,采用双电极电容法直接测量反应器内的活Vero细胞释放的电容,并将其转换为细胞数量,建立一种间接进行Vero细胞计数的方法.通过反应器内Vero细胞生长繁殖所消耗的葡萄糖量来计算所获得的细胞数,对篮式生物反应器Vero细胞培养阶段进行控制.结果表明,Vero细胞在生物反应器内培养5d,累积消耗葡萄糖230g,所获得的细胞数为1.2×1011~1.3×1011个.建立了Vero细胞数与葡萄糖消耗之间的关系,即每消耗1g葡萄糖可供5.345×108个Vero细胞生长.【总页数】4页(P163-166)【作者】周蕾;陈建民;王鑫;宋云增;张春枝【作者单位】大连工业大学生物工程学院,辽宁大连 116034;大连雅立峰生物制药有限公司,辽宁大连 116620;大连雅立峰生物制药有限公司,辽宁大连 116620;大连雅立峰生物制药有限公司,辽宁大连 116620;大连雅立峰生物制药有限公司,辽宁大连 116620;大连工业大学生物工程学院,辽宁大连 116034【正文语种】中文【中图分类】Q819【相关文献】1.应用生物反应器建立人用冻干狂犬病疫苗(Vero细胞)生产工艺的研究 [J], 李志强;袁延宝;郑淑媛;代长海;张夫坤;顾丹阳;戚凤春2.易操作且具有高细胞量的密闭系统——一种培养Vero细胞生产副粘病毒的新型生物反应器 [J], 申斐;王玮;谢萍;3.应用篮式生物反应器培养1A_5杂交瘤细胞及单克隆抗体分泌 [J], 李云富;王妍;李健平;张秀霞;迟春萍;滕洪刚;关晓峰;王秋香4.篮式生物反应器制备Vero细胞乙型脑炎灭活疫苗 [J], 张晋;张月兰;赵玉秀;王辉;马乐;马可;牛志彬;梁宏阳5.应用篮式生物反应器和新型载体连续培养CHO-C_(28)细胞HBsAg的表达 [J], 王妍;李志强;叶世德因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
% 材料和方法
% & % 原理 反应器 在应用动力学方法测定 ’ 3 4 (细胞 B C D 过程中, 内培养液的氧平衡可由下式表示: E 0 " ( ( ) + 0 0) 4 5 ! 78 ;3 9 :; E / " 与气相氧分压平衡的液相氧浓度, 式中: / ; 培养 0 ; ; ( ) = 0: ;: 基中实际溶氧浓度, / ; / / ; ; ; ( ) = 3 4 5 细胞摄氧率: ; ; ( ) = F (体积氧传递系数) : / 。 8= : ! F 在细胞培养过程中在线检测 3 为消除表面通气 4 5 时, 的影响, 需要在培养液上方通以氮气, 此时气相中氧分压为
! "卷#期 $ % % %年 &月
生 物 工 程 学 报 ! " # $ % & % ’ ( ) * $ + , ( # ( / % 0 " $ ( , ( -. 1 2
’ ( ) * ! "+ ( * # % % % , ) . $
! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! !
. B。通过在培养 成良好的线性关系, 其斜率 ’C ( 为* @ H ) AJ
前、 后分别对 ’C 结果证明在细胞培养过程中可 ( 进行测定, 作为常数。
反 ! / " / $ ’C ( 的测定:在细胞培养开始前实验测定 ’C (, 应器的搅拌速率、 温度、 通气流量均与培养过程中测定 $ ) * 时一致。采用表面通气方式以 B / @ $C + , - 的氮气赶走培养 液上腔的空气, 记录溶氧随时间的变化, 由式 ( ) 以C ( / ) % 5 ) 对时间+ 作图, 斜率即为 ’C % (。 ; ! / " / % 细胞摄氧率 $ ) * 在线检测:细胞培养过程中在线 检测 $ 首先使溶氧上升到? 切断空气、 氧气 ) * 时, $ %以上, / 和二氧化碳气体, 然后用B @ $C + , -的氮气通入培养液上方 以吹去空气, 记录溶氧 ( 随时间的变化。由式 ? * % !! * %) ( ) 计算 $ ( ) *。
[ ] $ 本文在相关研究 的基础上, 提出一种在 ! 7 1=> 3 ) ) ? 0
经济、 可靠的 ’ 3 4 (细胞 3 4 5 的测定方 @ 3 A反应器中简单、 法, 通过测定 3 准确地了解细胞的生理状态, 为 4 5 来快速、 在流加和灌注培养中及时调整灌注时间和速率、 决定补料时 间和补料策略提供了可靠的依据。
" , 根据亨利定律, , 积分式 ( ) 得: % 0 ! ; 为%
流加和灌注培养已被广泛应用于动物细胞培养, 以获得 高活性、 高密度的细胞和高的产物得率。在这些培养过程 中, 一般通过离线检测关键参数 (如细胞密度、 营养和代谢产 物的浓度) 来人为调整灌注速率和补料策略, 但是, 当细胞密 度较高时, 由于细胞代谢旺盛使得培养的微环境变化很快, 这就需要更加频繁快速地调整操作条件, 从而导致因频繁取 样和离线分析所带来的污染危险及大量人力、 物力的浪费。 这在大规模细胞培养过程中是不可取的。因此, 要建立大规 模、 高效动物细胞培养过程, 有必要研究和探索在线检测技 术, 以实时掌握细胞培养过程所处的状态。 在微生物发酵过程中, 摄氧率 (3 一般采用分析进、 4 5) 出口气体成分的方法来测定, 而在一般动物细胞培养过程 (和微生物相比) , 使得分析装 中, 由于动物细胞 3 4 5 很小
积分得: % & ’ 材料
以9 ( / 对/ 作图, 得一直线, 其斜率即为 8 $ 0 0 +。 % /) 9 (非洲绿猴肾) 细胞由中国药物生物制品检定所 % & ’ & % ’ 3 4 ( 惠赠, 代次为! 。 $ / ! ! 2 ! (@ 美国) 。使用前添加 ! % & ’ & ’ I J K J L M > B, % N 新生小牛 血清 (华东理工大学动物细胞与组织工程研究室) 。 (Q % & ’ & ( 用于 ’ 3 4 (细胞培养的贴壁介质为 > O ( E 3 P2 F : 4 0 . , ) 微载体, 先用 浸泡 , 灭菌后 ; : R ? :M ? ( O 3 R FS T 3 E 3 A Q M S $ #F 再用 Q 并用培养基浸泡置于培养箱过夜, 使用前 M S洗!次, 倾去培养基后再接入细胞。 % & ( 实验方法 % & ( & % 细胞培养:种子细胞由置于 2 & U、 1 N> B $ 培养箱 的扁瓶提供。当处于对数生长期的细胞达到所需密度时用
图( , ( / ) 随时间的变化 % % * .
葡萄糖消耗和乳酸生成之间的关系 & ’ " ! " # 与细胞密度、 $ / L 3 8 5细胞以 !EB *I 3 4 4 + C 的密度接种到 B @ $ C& 3 4 4 , M 定时取样测定细胞密度、 葡萄糖 N 3 -反应器中进行批培养, 和乳酸浓度, 同时在线检测 $ ) *。其细胞密度和 $ ) *随 , 时间的变化如图 ! 所示。以 $ ) * 对细胞密度作图得图 )
复杂, 故计算困难, 本文通过实验方法校 1 3 I J 3 5 K常数不全, [ ] !, ) 正% 所得结果与文献值基本一致 。 "
图! 细胞密度和 $ ) * 随时间的变化 细胞密度 ". #.$ ) *
图B 空气中氧在水 (# 和培养基 (# $B) $() 中的饱和浓度测定结果
图) $ ) * 与细胞密度的关系
& 结果与讨论
! & ’ ! % " 的实验测定 空气中氧在水和培养基中的饱和浓度测定结果如图 B ! 所示。由图中曲线可见, 氧在培养基中的饱和浓度% " 仅为 ! $ ) 水中饱和浓度% ( A %。在常压 B @ * B EB * F G 和! ? @ A # & 的A 时, 纯氧在水中溶解度为 B / , 则水中溶氧与空 @ * ? A )+ + 5 4 C ! ! / , 因此% 气平衡时的饱和浓度% @ ( ( )+ + 5 4 C * @ B H " & 为* "D ! ! / 。 C % % + + 5 4 " 与 & 之间的差别主要是由于培养基中含有大 量无机离子、 蛋白质、 氨基酸等物质, 使得氧的溶解度降低, [ ] 其传统的校正法是用 1 由于培养基成分 3 I J 3 5 K! 公式计算,
收稿日期: , 修回日期: 。 ! / / / 0 % 1 0 2 ! $ % % % 0 % 2 0 ! 1 基金项目: 部分得到上海市启明星计划的资助。 " 联系人。
, 。反应器工作体积为 ! , 微载体浓度 1Y / 。 O ? G ? R C S 8) 7 $= = 、 用空气、 氧气、 氮气和二氧化碳气体积分调节控制 Z <H & 7 $ 溶氧 (6 控制转速 2 / , 温度 3) 1 % N 空气饱和度; %!# 14 ; ? A 2 " 7 6 U。 其中取 !; % & ( & ’ 细胞计数:每天取样 ! 次, = 样品加入 / 混合均匀后置于 % 7 ! N结晶 紫 和 % 7 !; ( ) = 柠 檬 酸 溶 液,
应用动力学方法在线检测 ! " # $细胞培养过程中的摄氧率
周亚竞 谭文松" 赵 佼 华 平 孙祥明 俞俊棠
(华东理工大学生物反应器工程国家重点实验室 上海 $ ) % % $ 2 &
关键词 ’ 3 4 (细胞,在线检测,摄氧率 文献标识码 8 中图分类号 5 6 ! 2 7 !
文章编号! ( ) % % % 0 2 % " ! $ % % % % # 0 % 1 $ 1 0 % 2
表$ 氧解析对 ! " # 测定的影响 / $ / $ : : * 图! 累积葡萄糖消耗、 氧消耗、 乳酸生成之关系
!" 累积氧消耗 "" 累积乳酸生成
/ / ! " # ! " # & ’ 0 ’ ’ # 1 2 3 4 5 ! " #9"! " #2 " $ " $ ・ ・ ・ ・ ( ( % % & ’ 8 % % & ’ 8 + / ( / ! " #9 $ 6 7 ’ ’ 2 % 8) " $) " $) / / 6 ; ) ) * 6 ; ) * $ 6 ; ! ) = 6 ; < > : $ ; ! 6 6 : ; 6 + 6 : ; ) < 6 : ; ! + 6 : ; > ) 6 : ; < + 6 6 ; 6 $ : 6 6 ; 6 * < 6 6 ; 6 + ) ! 6 ; $ 6 = 6 6 ; $ < $ 6 6 ; : ) ) 6 6 ; : * $ 6 6 ; : * = 6 6 ; $ < ! 6 6 ; $ < > 6 6 ; $ $ 6 ) 6 ; $ * ! 6 6 ; $ ! > 6 6 ; $ = 6 6 6 ; : > + 6 6 ; ) : ! $ 6 ; ) ) ! 6 6 ; ) * $ ! 6 ; : > + 6 6 ; : < = 6 6 ; < = $ 6 6 ; + + = 6 6 ; ! = + 6 6 ; * : + ) 6 ; ) * * : 6 ; : < ) ) 6 ; : < $ 6 6 ; : > 6 = 6 ; ) : = > 6 ; ) ! ) 6
