重要有机化合物的紫外吸收光谱.
第9章 紫外吸收光谱
第九章 紫外吸收光谱分析
▲溶液酸碱性对紫外光谱的影响
总结 规律
(a)苯酚的UV光谱图
(b)苯胺的UV光谱图
仪器分析 学习指导
第九章 紫外吸收光谱分析
结论:
溶液从中性变为碱性时,吸收峰发生红 移,表明该化合物为酸性物质; 如果化合物溶液从中性变为酸性时,吸 收峰发生蓝移,表明化合物为碱性物质。
第九章 紫外吸收光谱分析
共轭多烯的K带吸收位置λmax ,可利用伍 德沃德(Woodward)规则来进行推测。
该公式为: max= 母体二烯烃
取代基对共轭 双烯 λmax的影 响具有加和性
+ 环外双键 + 延伸双键 + 共轭体系上取代烷基
+ 共轭体系上取代的助色基
仪器分析 学习指导
第九章 紫外吸收光谱分析
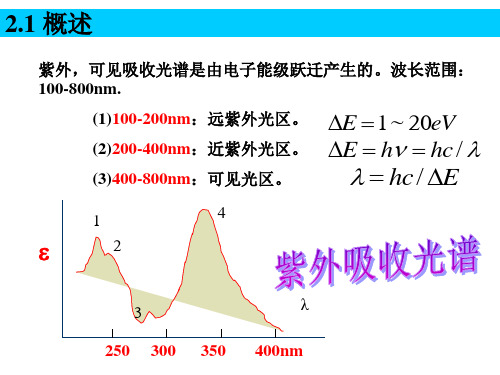
σ→σ*
E、π→σ*
C、n→σ* D、
仪器分析 学习指导
第九章 紫外吸收光谱分析
3、指出下述各对化合物中,哪一个化合物 能吸收波长较长的光(只考虑π→π*跃迁)
(3) CH2=CH-CH2-CH=CHNH2及 CH3-CH=CH-CH=CHNH2
仪器分析 学习指导
第九章 紫外吸收光谱分析
4、已知某化合物在己烷中的λmax为327nm,
电子跃迁光谱,吸收光波长范围
紫外吸收光谱 200400 nm(近紫外区),主要
分
用于含共轭结构化合物分析。
子
吸
电子跃迁光谱,吸收光波长范
收 可见吸收光谱 围400750 nm ,主要用于有色
光
物质的定量分析。
谱
红外吸收光谱 分子振动光谱,吸收光波长范围
2.51000 m , 主要用于有机化合 物结构鉴定。
紫外吸收光谱(UV)
2.3 有机化合物基团分类
1)发色基团(200-400nm产生吸收的基团) n *, *
C
C, C
O ,
C
N,
O N O
*,n *
2)非发色基团(200-400nm不产生吸收的基团)
3)助色基团 本身为非发色基团,使发色基团吸收位置 移向 长波。 n *.助色能力 –F<CH3<-Cl<-Br<OH<OCH3<-NH2< -NHCH<-N(CH3)2<-NHC5H6<O-
⑴无环、非稠环二烯母体:
max= 基+nii
基-----是由非环或六环共轭二烯母体决定的基准值
max=217 nm
⑵异环(稠环)二烯母体:
max=214 nm
⑶同环(非稠环或稠环)二烯母体:
max=253 nm nii---是由双键上取代基种类和个数决定的校正项
190
210
230
250
270
290
310
330
350
370
¨¤ ² ³ nm
2)脂肪烃不饱和化合物
H
ⅰ单烯烃 C=C
H c c H
发色基团, 但
* 200nm.
max=162nm
助色基团取代
-OR 30(nm)
H
* (K带)发生红
-Cl 5(nm) CH3 5(nm)
移。
取代基 -SR -NR2 40(nm)
350
400
0.1 弱带
红位移——向长波长位移
兰位移——向短波长位移 浓色效应——摩尔吸光系数max增加 浅色效应——摩尔吸光系数max减少 强带——max≥ 104(多为允许跃迁)
有机化合物的紫外可见吸收光谱
1:1
3:1
1.0
2.0 3,0 c(R)/c(M)
25
2. 等摩尔连续变化法: cM + cR = c(常数)
M:R=1:1
M:R=1:2
0.5
cM/c
0 0.2 0.4 0.6 0.8 1
0.33
cM/c
0 0.2 0.4 0.6 0.8 1
M + nR �������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������
各类化合物的紫外光谱

max= 255 nm ( = 250)
B带
2018年10月5日6时42分
LiuXinling
第2章 紫外吸收光谱
波谱分析
单取代苯:
烷基取代苯:烷基无孤电子对,对苯环电子结构产生
很小的影响。由于有超共轭效应,一般 导致 B 带、E2带红移。
助色团取代苯:助色团含有孤电子对,它能与苯环 π
电子共轭。使 B 带、E 带均移向长波
2018年10月5日6时42分
LiuXinling
第2章 紫外吸收光谱
波谱分析
2018年10月5日6时42分
LiuXinling
第2章 紫外吸收光谱
波谱分析
计算举例:
2018年10月5日6时42分
LiuXinling
第2章 紫外吸收光谱
波谱分析
2018年10月5日6时42分
LiuXinling
LiuXinling
第2章 紫外吸收光谱
波谱分析
2.3.4 共轭有机化合物的紫外吸收
1. 共轭体系的形成使吸收移向长波方向
共轭烯烃的π π*跃迁 均为强吸收带, ≥10000,
称为K带。
共轭体系越长,其最大吸收越移往长波方向, 且出现多条谱带。
2018年10月5日6时42分
LiuXinling
2018年10月5日6时42分
LiuXinling
第2章 紫外吸收光谱
波谱分析
2.3.2 烯、炔及其衍生物
非共轭 *跃迁, λmax位于190nm以下的远紫外区。 例如:乙烯 165nm(ε 15000),乙炔 173nm C=C与杂原子O、N、S、Cl相连,由于杂原子的助色 效应, λmax红移。
2.取代基对羰基化合物的影响 当醛、酮被羟基、胺基等取代变成酸、酯、酰胺时,
第二章--紫外光谱

这组数据对应于下面哪个化合物?
AC2 HC2 H B C 2 C H C H C H C H C H 2H
C
CH CH
D
CC HC HC HH
?4
乙酰乙酸乙酯存在酮式和烯醇式互变异 构体,今有两张紫外光谱图,一张在 204nm有弱吸收,另一张在245nm有强吸 收,请判断哪一张是烯醇式。
优点是仪器普及、操作 简单而且灵敏度高
Chapter 2 紫外光谱
§2-1紫外吸收光谱的基本知识 §2-2常见有机物的紫外吸收光谱 §2-3溶剂对吸收光谱的影响 §2-4紫外光谱的解析与应用
§2-1紫外吸收光谱的基本知识
紫外吸收光谱是由于分子中价电子的跃 迁而产生的。 一、紫外吸收光谱的波长范围 二、紫外光谱图的组成 三、电子跃迁的类型 四、常用术语
σ*
σ*
E
л*
n л
σ
σ
C3C H2C HH=2C C2C H H2C H C3H H CH3OC3H
N(C 2CH 3 H )3
§2-2常见有机物的紫外吸收光谱
一、饱和烃及其取代衍生物 二、不饱和烃 三、羰基化合物 四、芳香烃的紫外光谱
一、饱和烃及其取代衍生物
★饱和烃的最大吸收峰一般小于190nm,处于真空紫外 区。如甲烷125nm,乙烷135nm。
甲苯的U图
?
图2-7 a 苯的紫外光谱图 b取代苯与苯紫外光谱的比较
分析:
H C
H H
苯环与甲基的超共轭效应
3、助色团取代苯的紫外光谱
★助色团含有孤电子对,它能与苯环 π 电子 共轭。使 B 带、E 带均移向长波方向。且吸 收强度都增加,精细结构消失。例如苯胺
有机化合物的紫外吸收光谱

08:51:49
配位场的跃迁
以金属配合物的电子吸收光谱为例, 以金属配合物的电子吸收光谱为例,产生机理有 三种类型: 三种类型: 配位体微扰的金属离子d-d电子跃迁和f-f电子 跃迁摩尔吸收系数ε很小,对定量分析意义不大。 很小,对定量分析意义不大。 金属离子微扰的配位体内电子跃迁 金属离子的微扰, 金属离子的微扰,将引起配位体吸收波长和 强度的变化。变化与成键性质有关, 强度的变化。变化与成键性质有关,若静电引力 结合,变化一般很小。若共价键和配位键结合, 结合,变化一般很小。若共价键和配位键结合, 则变化非常明显。 则变化非常明显。 电荷转移吸收光谱 辐射下,分子中原定域在金属M轨道上的电 辐射下,分子中原定域在金属 轨道上的电 荷转移到配位体L的轨道 或按相反方向转移, 的轨道, 荷转移到配位体 的轨道,或按相反方向转移, 所产生的吸收光谱
08:51:49
溶剂对紫外吸收光谱的影响
(一) 溶剂极性对紫外吸收光谱的影响 1、n→π *跃迁所产生的吸收峰随溶剂极性的 增加而向短波方向移动。 增加而向短波方向移动。
例如,异丙叉丙酮CH 例如,异丙叉丙酮CH3COCH=C(CH3)2发生 n→π *跃迁吸收 的光波波长在正己烷中为329nm 在氯仿中为315nm 329nm, 315nm, 的光波波长在正己烷中为329nm,在氯仿中为315nm,在 甲醇中为309nm 在极性最大水中则为305nm 309nm, 305nm。 甲醇中为309nm,在极性最大水中则为305nm。
08:51:49
第二章 紫外吸收光谱 分析法
一、 有机化合物的紫外吸收光谱
有机化合物结构中价电子类型: 有机化合物结构中价电子类型: 按分子轨道理论,分子中外层价电子有三种:σ 按分子轨道理论,分子中外层价电子有三种: 电子、 电子。 电子、π电子和n电子。 一般对应于4种类型的跃迁: 一般对应于4种类型的跃迁: (1) N-V跃迁:基态轨道→反键轨道,σ→σ* 跃迁:基态轨道→反键轨道, π→π* 跃迁:未成键n电子→反键轨道, (2) N-Q跃迁:未成键n电子→反键轨道, n→σ* n →π* 跃迁: 电子→高能级→ (3) N-R跃迁: σ电子→高能级→分子离子 电荷迁移跃迁:电荷从化合物的一部分→ (4) 电荷迁移跃迁:电荷从化合物的一部分→另一 部分
波谱分析第六章UV谱

b.二取代苯:
Ⅰ.对位二取代苯
若两个取代基属同一类型,则E2带红移值由红移效应 最大的基团决定;若两个取代基属不同类型,则E2 带红移值由二者协同作用决定,且红移增值大于二 者单取代的红移增值之和。
Ⅱ.邻位和间位二取代苯
此类二取代苯不论取代基是何类型,对E2带红移值的 贡献大致等于两个取代基红移值增值之和。
根据量子理论,光子(或电磁辐射)的能量为: E=hν=hc/λ=hcσ 紫外光的能量与化学键的能量相仿,有足够的能量
使分子进行光化学反应。
6.1.2.紫外吸收光谱的产生及其表示方法
1.分子中价电子在电子能级间跃迁产生紫外吸收光 谱;
分子和原子一样,也有它的特征分子能级,这些能 级是由分子内部运动决定的。分子内部运动包括① 电子围绕原子核的运动;②分子内原子在平衡位置 附近的振动;③分子绕其重心的转动;④分子重心 的平移;⑤分子中各基团的内旋转。
b. Woodward-Fieser规则只适合成串共轭的分子, 不适合交叉共轭的分子。交叉共轭体系只能选取一 个,分叉上的双键不算延长双键。
同环双键母体 253
五个取代烷基5×5 两个环外双键5×2
288nm(285nm)
c.选择较长共轭体系作为母体。若同时存在同环双 键和异环双键时,应选取同环双键作为母体。
(3)含不饱和杂原子化合物:例如:醛、酮、酯、酰胺、 酰氯、睛、重氮、硝基、亚硝基、亚砜等。此类化合物可发 生σ→σ*,n→σ*,π→π*和n→π*其中n→π*(R吸收带) 跃迁所需能量较低,吸收带处在近紫外区,易于检测,可用 于结构分析,只不过吸收强度弱。
对于醛、酮类化合物,R带在270~300 nm,εmax=10~ 20L·mol-1·cm-1
紫外光谱在有机化合物结构分析中的应用

紫外光谱在化合物结构分析中的应用【摘要】紫外-可见光谱(ultraviolet一Visiblespeetroseopy,UV-Vis),也简称为紫外光谱(UV),属于吸收光谱的一种。
由于紫外光谱本身有许多特点:测量灵敏和准确度高,应用范围广,对很多金属元素和非金属元素及其化合物都能进行测定,也能定性或定量的测定大部分有机化合物;此外,仪器的价格比较便宜,操作简便、快速,易于普及推广,至今仍是有机化合物结构鉴定的重要工具。
因此,本文首先介绍紫外光谱用于定性分析的依据和一般规律,然后归纳了影响紫外-可见光谱的一些因素,最后举例说明紫外光谱在化合物结构分析中的应用。
【关键词】紫外-可见光谱定性分析影响因素结构分析光谱数据前言紫外吸收光谱是分子中最外层价电子在不同能级轨道上跃迁而产生的,它反映了分子中价电子跃迁时的能量变化与化合物所含发色基团之间的关系。
UV谱图的特征首先取决于分子中含有的双键数目、共轭情况和几何排列,其次取决于分子中的双键与未成键电子的共轭情况和其周围存在的饱和取代基的种类和数目,它主要提供了分子内共轭体系的结构信息[1]。
通常UV谱图组成比较简单,特征性不是很强,但用它来鉴定共轭发色基团却有独到之处。
UV吸收谱带的位置和摩尔消光系数的数值,一般无法判断官能团的存在,但它能提供化合物的结构骨架及构型、构象情况,因此至今仍为一项重要的测试分子结构的有用手段。
紫外-可见吸收光谱是化学分析中常用的一种快速、简便的分析方法,广泛用于有机[2-3]、无机[4]、生化[5]、涂料[6]、药物[7]等领域和国民经济部门[8]。
紫外光谱用于定性分析的依据和一般规律利用紫外光谱定性分析应同时考虑吸收谱带的个数、位置、强度以及形状。
从吸收谱带位置可以估计被测物结构中共轭体系的大小;结合吸收强度可以判断吸收带的类型,以便推测生色团的种类。
注意所谓吸收带的形状主要是指其可反映精细结构,因为精细结构是芳香族化合物的谱带特征。
紫外可见吸收光谱

例1:
H2C
C
C
CH2
CH3 CH3
基本值 两个烷基叏代 计算值 实测值 λmax λmax 217nm 2×5=10nm 227 nm 226 nm
例2:
基本值: 一个环外双键
217 nm 5nm
四个烷基叏代
计算值 实测值 λmax λmax
20nm
242 nm 243 nm
解析示例
化合物C10H16由红外光谱证明有双键和异丙基,其紫外 光谱 max=231 nm,加氢只能吸收2摩尔H2,确定结构。 解: ①计算丌饱和度 = 3;两个双键;环? ②max=231 nm,共轭? ③可能的结构
光源 单色器
第二节 紫外—可见分光光度计
general process
样品室 检测器 显示
1. 光源
在整个紫外光区或可见光谱区可以収射连续光谱,具 有足够的辐射强度、较好的稳定性、较长的使用寿命。
可见光区:钨灯作 为光源,波长范围 320~2500 nm。紫 外区:氢、氘灯。収射 185~400 nm的连续 光谱。
2.1 紫外可见光谱曲线
采用连续光源照射,记录吸收后光谱曲线。
表示方法:A-
特性参数: max→最大吸收波长:吸收强度最大处对应的波长。 max →在最大吸收波长的摩尔吸光系数。
二、紫外可见光谱产生机理
1.有机物紫外可见吸收光谱 ultraviolet spectrometry of organic compounds (1)有机化合物分子中电子类型: σ电子、π电子、n电子。
间二甲苯263nm =200 1,3,5三甲苯266nm =200
六甲苯 272nm =200
苯在乙醇中的紫外吸收光谱
有机化合物的紫外吸收光谱

R2 -C6H4 -COR
R1为烷基时的基本值 R1为H时的基本值 R1为OH时的基本值 R2为下列基团时
烷基
-OH -OR
-O-
-Cl
-Br
-NH2 -NHAc
-NR2
K吸收带波长λ/nm
246 250
230 邻位 间位 对位
3
3 10
7
7
25
11
20 78
0
0
10
2
2
15
13 13 58
20 20 45 20 20 85
εmax=1.74N× 104
式 中 A— 取 代 基 数 目
N— 共 轭 双 键 数
R—末端含双键的环数 E—环外双键数
三、芳族化合物的紫外吸收光谱
苯是最简单的芳香族化合物,它的紫外吸收光谱有三 个吸收带,其吸收波长分别为184nm(E1带 ε=47000)、 203nm(E2或K带ε=7000 )和256nm(B带ε≈200))。 B带的吸收强度比较弱,在非极性溶剂中或呈气体状态时出 现精细结构。当苯环上的一个氢原子或两个氢原子被其他 基团取代时,吸收带波长将发生变化。除个别取代基外, 绝大多数取代基都能使吸收带红移,E1带将移动185-220n m、E2带将移到205-250nm、B带将移到260-290nm。当 取代基含有n电子时,则在275-330nm范围将出现R吸收带。
O RC-R1
C-C、C=O、C-H
σ→σ* 、π→π*、 n→σ* 、n →π*
乙醛 290nm、丙酮280nm, 吸收强度较弱,εmax≤100,
3、醇、醚、含氮、含硫化合物及卤化物
A、醇、醚 ROH ROR1
σ→σ* 、n→σ*
紫外光谱(UV)

→ *跃迁:红移; ;
h
21
轨道极性: n >π* >π
π*
π*
Δ En π
Δ Ep
Δ En n
非极性溶剂
Δ Ep
非极性溶剂
极性溶剂
极性溶剂
极性增大使π—π*红移,n—π*跃迁蓝移,精细结构消失,吸收峰减少,并使吸收 曲线趋于平滑。
h
22
溶剂效应对丙酮紫外吸收的影响
n—π*跃迁蓝移
1-己烷 2-95%乙醇 3-水
紫外光谱
学习要求 概述 紫外吸收光谱的基本原理 影响紫外吸收光谱的主要因素 各类有机化合物的紫外光谱 紫外分光光度计结构与实验技术 紫外吸收光谱的应用
h
1
学习要求: 1.了解用价键和分子轨道理论描述有机分子中电 子激发的一般过程。区别π-π*和n-π*的跃迁。 2、了解紫外吸收光谱基本原理 。 3、理解K带、B带、R带、红移、蓝移等术语。 4、熟悉各类化合物的紫外光谱吸收特征。 5、初步掌握紫外光谱在有机化合物结构鉴定中 的应用。 重点:紫外光谱在有机化合物结构鉴定中的应用 难点:电子跃迁的类型及其吸收带与分子结构之间关系
Io g ε= 4 .0 9
一般 ε> 5000为强吸收 为强带 = 1000~5000为中吸收 < 1000为弱吸收 为弱带
h
14
影响摩尔吸光系数ε的因素: 分子偶极矩变化、跃迁几率。电子跃迁类型
n* 跃迁,吸收强度很弱: < 100 。禁阻跃迁。
n 轨道与 轨道在空间取向不同。由于 n 轨道的电子与 π 电
h
SR 45 85
C l 5 20
29
2、 使n—π*最大吸收向短波位移(蓝移)。
常见有机化合物的紫外可见吸收光谱ppt课件

火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
溶液的颜色与光吸收的关系
完全吸收
光谱示意 复合光 表观现象示意
完全透过
吸收黄色光
物质呈现颜色与吸收光波长的关系见下表。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
第一节 基本原理
一、光的基本特性 1.光的波动性 光是一种电磁波,电磁波可以用周期T(s)、
频率( עHz)、波长λ(nm)和波数σ(cm-1) 等参数描述。它们之间的关系为: =1/T=c/λע /cעσ=1/λ=
互作用。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
4.偏离朗伯一比尔定律的原因
定量分析时,通常液层 厚度是相同的,按照比尔 定律,浓度与吸光度之间 的关系应该是一条通过直 角坐标原点的直线。但在 实际工作中,往往会偏离 线性而发生弯曲。
透光度T (透射比)Transmittance
定义透光度:
T It I0
T 取值为0.0 ~ 1.0 全部吸收 ~~~~ 全部透射
吸光度A (Absorbance)
定义吸光度 :
A 取值为 0.0 ~∞
二者关系为:
A lg I 0 It
全部透射~~~全部吸收
A = lg(1/T) = -lgT
尿素的紫外吸收光谱_概述及解释说明

尿素的紫外吸收光谱概述及解释说明1. 引言1.1 概述尿素是一种重要的有机化合物,在医药、农业和工业等领域具有广泛的应用。
了解尿素在紫外光谱中表现出的特点和行为对于进一步研究其性质和应用具有重要意义。
本文旨在对尿素的紫外吸收光谱进行概述和解释,深入探究其吸收峰特征、浓度变化规律以及温度对吸收峰位置和形状的影响。
1.2 文章结构本文共分为五个部分。
首先,引言部分将介绍文章的背景和目的,并概括阐述文章结构。
然后,第二部分将介绍尿素紫外吸收光谱基础知识,包括紫外光谱简介、尿素及其特性介绍以及尿素紫外吸收原理。
第三部分将详细介绍实验方法与样品准备,包括实验仪器与试剂介绍、样品制备与处理方法以及实验步骤详解。
接下来,第四部分将展示并讨论尿素的紫外吸收光谱分析结果,探讨不同溶剂中尿素吸收峰的特征分析、不同浓度下尿素吸收峰强度变化规律以及温度对吸收峰位置和形状的影响。
最后,第五部分将总结主要发现并展望未来工作方向。
1.3 目的本文旨在系统地概述和解释尿素的紫外吸收光谱特性,揭示其在不同条件下的表现,并为进一步研究尿素的性质和应用提供参考。
通过对其在不同溶剂中吸收峰特征、浓度变化规律以及温度影响等方面进行深入研究,可以更好地了解尿素的光谱行为和结构特点。
同时,文章还将探讨当前研究中存在的局限性,并展望未来可能开展的工作方向,以期推动该领域的进一步发展。
(以上内容为人工智能助手生成,仅供参考)2. 尿素的紫外吸收光谱基础知识:2.1 紫外光谱简介:紫外光谱是一种用于研究物质电子能级跃迁的一种分析技术。
根据分子内电子的跃迁能级,可以将紫外光谱分为两个区域,即紫外A区(200-400纳米)和紫外B区(280-320纳米)。
在这个范围内,许多有机化合物以及某些无机物质都会吸收特定波长的紫外光。
2.2 尿素及其特性介绍:尿素是一种有机化合物,由碳、氮、氧和氢元素组成。
它具有白色晶体形式,在水中可以溶解并形成无色溶液。
尿素是生物体中重要的有机化合物之一,在人和动物的代谢过程中发挥着重要角色。
在紫外可见吸收光谱中可获得的主要信息

在紫外可见吸收光谱中可获得的主要信息紫外可见吸收光谱可以提供各种化合物的结构和化学性质方面的重要信息。
具体来说,从紫外可见吸收光谱中可以获得以下主要信息:
1. 分子结构信息:在紫外可见光谱中,分子的各种化学官能团能够吸收不同波长的光,这可以提供关于分子结构的信息。
通过观察分子吸收光谱的形状和位置,可以确定分子的基本结构和官能团,并确定它们的位置和连接方式。
2. 化学键信息:分子中的不同化学键对紫外光的吸收有不同的影响。
通过分析吸收带的位置和形状,可以确定分子中特定桥键的存在、数量和强度。
这些信息可以用于确定分子的化学式和结构、表征化学键的类型和状态等。
3. 色度信息:颜色是由物体对光吸收和反射的不同方式所决定的。
在紫外可见吸收光谱中,颜色的信息可以用于确定样品的光谱特征。
如果样品吸收光谱在紫外光区域内有强烈的吸收带,则可能是有色的,并且能够指示分子中存在具有强烈吸收光的结构基团。
此外,颜色也可以用于确定分子的纯度和浓度。
4. 溶液浓度信息:在紫外可见吸收光谱中,溶液中的光吸光强度与溶液浓度之间存在一定的关系。
这种关系可以用于测定溶液的浓度,并通常用于确定有机化合物的浓度和酸碱性质等。
5. 反应活性信息:化学反应可能会在其分子中引入或消除基团,从而导致吸收光谱的变化。
通过比较反应的前后光谱,可以确定化学反应中产生的新产物的类型和数量。
总之,紫外可见吸收光谱是分析和表征化学物质中主要的一种工具,提供了有关分子结构、化学键、色度、相浓度和反应等方面的重要信息。
bca紫外吸收光谱

BC(蛋白质或肽链)稀释至适当的浓度,并与BCA试剂按照一定比 例混合。
bca紫外吸收光谱
2. 反应:将混合物在适当的温度和时间下反应,使BCA试剂与样品中的酰胺键发生反应。 3. 吸光度测量:使用紫外可见光谱仪,设置波长为560 nm,测量混合物的吸光度。 4. 建立标准曲线:使用已知浓度的蛋白质标准品,按照相同的步骤进行反应和吸光度测量 ,建立标准曲线。 5. 计算样品浓度:根据样品的吸光度值和标准曲线,计算出样品中酰胺键的浓度。
bca紫外吸收光谱
BCA紫外吸收光谱是一种常用的分析方法,用于测定蛋白质或肽链中存在的酰胺键的数量 。BCA(Bicinchoninic Acid)试剂是一种常用的试剂,可以与蛋白质中的酰胺键发生反应 ,形成紫色的络合物。该络合物在560 nm处具有最大吸收峰,因此可以通过测量560 nm处 的吸光度来确定蛋白质或肽链中的酰胺键的数量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
λmax=λ基+Σniλi
λ基 是由非环和六圆环共轭二烯母体结构决定的基准
值。
λi和ni是由双键上取代基的种类和个数决定的校正项 。
17:35:59
λmax=λ基+Σniλi
分子中与共轭体 系无关的孤立双键 不参与计算;
•
• 不在双键上的取 代基不进行校正; • 环外双键是指在某 一环的环外并与该 环直接相连的双键 (共轭体系中)。
苯环上有烷基取代时,苯的B吸收带(254nm)要 发生红移,E2带没有明显变化。 甲苯峰显著红位移是
4 3
B带 E2带 B带
由于烷基C-H键的σ电子
与苯环产生σ—π超共轭引 起的,同时烷基苯的 B 吸 收带的精细结构减弱或消 失。
17:35:59
㏒ε
2 1 0
苯
苯胺 甲苯
200 220 240 260 280 300 波长λ (nm) (b)
17:35:59
计算α ,β —不饱和羰基化合物λ
max
17:35:59
14.4.4 芳烃化合物
1.苯
苯的 π→π* 跃迁应为一个谱带 。实际观察到苯的紫外吸收光谱在 184 nm、204 nm和256 nm附近出现 三个吸收谱带。
㏒ε
5 4 3 2 1 0
E1
带
E2 B带
苯
180 200 220 240 260 280 波长λ (nm) (a)
17:35:59
例
17:35:59
例
17:35:59
表
17:35:59
表
17:35:59
14.4.3 羰基化合物
醛、酮、脂肪酸及其衍生物酯、酰氯、酰胺等 σ →σ *跃迁, n→σ*跃迁, n→π *跃迁,
π →π *跃迁。
17:35:59
1.饱和醛、酮
特征谱带:n→π *跃迁(R带): λmax= 270~300 nm,弱带(ε= 10~50); n→σ*跃迁:λmax= 170~190nm(ε = 103~105); π→π*跃迁: λmax<150nm。
第十四章 紫外-吸收光谱 分析法
Ultraviolet spectrophotometry
14.4.1 饱和烃与饱和 烃衍生物 14.4.2 不饱和脂肪烃 14.4.3 羰基化合物 14.4.4 芳烃化合物
第四节 重要有机化合 物的紫外吸收光谱
UV of organic compounds
17:35:59
则来估算 。
17:35:59
计算α ,β —不饱和羰基化合物λ
max伍德沃德-菲泽
规则
C C C C C Y O
乙醇溶剂中
λmax=λ基+Σniλi
17:35:59
计算α ,β —不饱和羰基化合物λ
规则
max伍德沃德-菲泽
17:35:59
计算α ,β —不饱和羰基化合物λ
max
使π→π*跃迁所需能量ΔE降低,所以红移距离更大。
5 4
㏒ε
E1
带
4
E2பைடு நூலகம்B带
苯
E2带 B带
B带
3
㏒ε
3 2 1 0
2 1 0
苯
苯胺 甲苯
180 200 220 240 260 280 波长λ (nm) (a)
17:35:59
200 220 240 260 280 300 波长λ (nm) (b)
(1) 烷基取代苯衍生物
E1
带
E2 B带
苯
强带,E2带。
1A1g →1B2u跃迁:~256nm精细
结构的弱带,B带。
17:35:59
180 200 220 240 260 280 波长λ (nm) (a)
2. 取代苯衍生物的紫外-可见吸收光谱
单取代苯衍生物的 E2 带和 B 带都产生红移且有一定增
色效应。尤其对含 n电子的取代基,由于 n—π共轭效应,
(2)助色团取代苯衍生物
含有 n 电子的基团取代: -OH 、 -NH2 等,与苯环发生 n—π 共轭效应,使 E 带和 B 带发生红移,强度也增加, 且B带精细结构消失。 苯胺盐酸盐的紫外吸收 和苯相近。
14.4.1 饱和烃与饱和烃衍生物
1. 饱和烃σ →σ *跃迁;
2. 饱和烃衍生物, σ →σ
*
,n→σ *跃迁;
3. 都缺少生色团,位于远紫外区,在紫外-可见光区 无吸收,“透明”; 4. 常用作测定化合物紫外-可见吸收光谱时的溶剂。
17:35:59
表
17:35:59
14.4.2 不饱和脂肪烃
17:35:59
苯的紫外-可见吸收光谱
电子间的相互作用,实际上苯的激发态由于电子 之间的相互作用裂分为 1E1u 、 1B1u 和 1B2u 三种能态,所 以π→π*跃迁产生三个吸收带。 1A1g→1E1u 跃迁: ~184nm ,强 带,E1带。 1A1g →1B1u跃迁:~204nm中等
㏒ε
5 4 3 2 1 0
17:35:59
不饱和醛、酮
当共轭双键数目, π→π*跃迁吸收带 (K带 )红移有时 会掩盖弱的n→π*跃迁吸收带(R带); 极性溶剂和取代基 (如烷基 )使 π→π* 跃迁吸收带 (K带 )
发生红移,使n→π*跃迁吸收带(R带)发生蓝移;
取代基和溶剂对 α,β— 不饱和羰基化合物(包括不饱
和酸酯)π→π*跃迁λmax的影响也可由伍德沃德-菲泽规
C=O,C=C,发色团; 孤立 时: “加合” ; 共轭( α,β—不饱和醛及酮)时: C=C的 π→π*跃迁能量 ΔΕ变小。 K带(π→π*)将由单个乙烯键的λmax=165 nm(εmax≈104) 红移到λmax=210~250nm(εmax≈104); R 带 (n→π*) 将由单独羰基的 λmax=270 ~ 290nm ( εmax<100 )红移到λmax=310~330nm(εmax<100)。
17:35:59
2.饱和脂肪酸及其衍生物
含有羰基,且助色团(OH、Cl、Br、OR、NR2、SH
等)直接与羰基碳原子相连,n—π共轭。
π→π*跃迁所需能量ΔΕ 变小,发生红移; n→π* 跃 迁 所 需 能 量 ΔΕ变大,发生蓝移; 与醛酮差异大,易区分。
17:35:59
表
17:35:59
3.不饱和醛、酮
单烯烃、多烯烃和炔烃等;都含有 π电子,产生 π→π*跃 迁。双键共轭使最高成键轨道与最低反键轨道之间的能量 差减小,波长增加。
17:35:59
伍德沃德-菲泽(Wood Ward-Fieser)规则
共轭多烯(不多于四个双键)π→π*跃迁吸收带的最 大吸收波长,可以用经验公式伍德沃德-菲泽( Wood Ward-Fieser)规则来估算。
