标准菌种管理作业指导书2015
标准菌种管理规程

标准菌种管理规程目的:规范药品微生物学检定用菌的管理,最大限度降低变异率,确保菌种的溯源性与稳定性,从而确保微生物学检验结果的准确可靠。
职责: QC 主管负责菌种的申购、接受、保存、分发,微生物检验员负责菌种的确认、传代、使用及销毁。
范围:本规程适用于检定用菌种的管理,包括菌种的申购、保存、传代、使用及销毁等。
内容:1术语标准菌种是指由中国药品生物制品检定所医学微生物菌种保藏管理中心提供的冷冻干燥菌。
传代用菌种是指用标准菌种制备的采用特定保存方法长期固定保存的菌种,用于传代及制备工作用菌种。
工作用菌种是指用标准菌种或传代用菌种接种至普通琼脂斜面培养后,作为日常工作使用的菌种。
菌种的代是指将其接种至一新鲜培养基上或培养基内,每萌发一次即称为一代,从菌种保藏中心获得的冷冻干燥菌种为第0 代。
2.标准:2.1 检定菌的申购QC主管每年根据检定菌种的使用情况(包括临时检验需要),提出购买计划,交由质量管理部部长审批后,向中检所菌种保藏中心或省(市)药检所购买冻干菌种(标准菌种);也可以直接向省(市)药检所购买传代用菌种,购买时,需询问与确定菌种的代数,以便传代时控制代数。
2.2 检定菌的接收菌种到达实验室后,由QC主管接收菌种,检查其名称和数量,以及每一支的完整性,同时将菌种的所有信息,填写在《检定菌接收记录》(附表 1)上,内容包括:名称、数量、编号(无编号者按检定菌种的编号原则编号)、代数、来源、接收日期、接收人等,贴好标签并储存于 2-8?C直到需要使用时。
储存期最长不超过 5 年。
2.3 检定菌的保存2.3.1 工作用菌种的保存工作用菌种采用斜面低温保存法。
将菌种接种在适宜的固体斜面培养基上,待菌生长充分以后,转移至2~8℃冰箱中保存。
此法仅用于工作用菌种的短期保存,并应随时检查其污染杂菌和变异等情况,发现异常情况,经应灭活处理后销毁。
保存时间根据菌种种类而不同,细菌: 1 个月;酵母菌: 2 个月;霉菌及芽胞: 3 个月。
微生物培养基配制及菌种管理作业指导书草稿

**HB-CZ******环境监测站培养基配制及标准菌种的管理作业指导书HB-CZ-085制定人:批准人:批准日期:实施日期:培养基配制及标准菌种的管理作业指导书1适用范围本作业指导书适用于无菌实验室培养基配制和标准菌种、参照菌种的管理。
2内容2.1培养基配制2.1.1实验室中各种培养基按实验需要进行配制,每次配制应有记录。
2.1.2配制好的培养基,不宜存放过久,以少量勤配为宜,存放于0~4℃,可保存7天。
2.2标准菌种的管理2.2.1实验室内保存的标准菌种必须从认可的收集途径获得。
2.2.2标准菌种必须进行确认试验。
2.2.3菌种传代从供应商处购买的冷冻干燥的菌种为第0代,冷冻干燥的原始菌种开启后转种后为第1代,直至到第3代为工作菌种。
按菌种说明书要求复溶所转菌种并转接于适当的营养琼脂培养基内,作为第一代。
经菌种特性鉴定后,挑取纯菌落制成浓菌悬液用于制备甘油冷冻管,作为第二代。
将第二代保存,另取1支第二代冷冻保存管转种于平板和斜面培养基上,平板上的菌种制成冷冻保存管(第三代);斜面养基适当温度培养后作为工作用菌种(第三代)。
将(第三代)菌种冷冻或低温保存用于试验。
应及时进行菌种传代,避免菌种失活老化。
当工作菌种代数小于5时,可直接用上代工作菌种转接下代工作用菌种。
转接第四代,直至四代转为五代。
标准菌种的传代次数不得超过5代。
2.2.4菌种确认每次传代中至少要对菌种进行形态学观察和革蓝染色检查,必要时应做菌种鉴定试验,所有被确认受到污染的菌种应及时销毁,不得用于常规实验。
用于总大肠菌群和粪大肠菌群项目检验的大肠埃希菌的特性如下:2.2.4.1形态特征: G-直短杆状杆菌、无芽胞、有周身鞭毛,能运动。
有菌毛。
2.2.4.2培养特性:兼性厌氧,营养要求不高,普通营养琼脂培养基上生长良好,形成较大的圆形、光滑、湿润、灰白色的菌落。
2.2.4.3分离培养:伊红美兰培养基(EMB平板)上呈现深紫黑色,具有金属光泽的菌落;紫黑色,不带或略带金属光泽的菌落;淡紫红色,中心色较深的菌落。
标准菌株质量控制作业指导书

标准菌株质量控制作业指导书1、目的:对微生物标准菌株的验收、复活、确认、转代、储存、使用、废弃等进行规定,确保标准菌株符合要求,保证检测结果。
2、职责:2.1、检测中心主任负责标准菌株资源的配备。
2.2、微生物检测室工作人员负责标准菌株的有效储存和正确的使用。
3、要求:3.1供应商的选择:选择有资质的标准菌株的合格供应商,每批标准菌株必须有附件的供应商的合格证或检测报告,来证明所采购的标准菌株是合格的。
3.2标准菌株和验收菌株一到实验室,一定要记录好菌株号和标准菌株来源,确保溯源性清楚。
同时,还应尽可能多的菌株信息,如:标准菌株名称和数量、生产日期、接收日期和有无破损等。
3.3冻干标准菌株的复活:3.3.1、开启产品包装:先用70%酒精棉擦拭外包装,从凹口处撕开产品外包装,撕掉标签上的拉片,将其贴于菌株保藏管上。
3.3.2、复活:选择合适的培养基和培养条件(根据生产商说明)进行复活。
冻干菌株的传代次数不得超过5代,从标准菌株保藏中心购买的冻干标准菌株为第F0代。
捏管帽处安瓿瓶(仅一次)使其释放水合液体。
垂直握住安瓿瓶并轻拍之,使液体流入含小球的管底。
通过挤捏压碎小球使其与液体混合,立即将拭子浸于水合液体。
挤压并旋转拭子,接种于初级培养平板,接种圈的直径约为25mm,用一无菌接种环在先前接种区域划线10-20次,促使分离出单菌落。
同时吸出部分菌液接种胰蛋白胨大豆肉汤管,副溶血性弧菌接种3%氯化钠胰蛋白胨大豆肉汤管。
将接种好的平板和管立即进行培养。
细菌培养温度通常为25℃或37℃。
多数冻干菌株会在几天后长出,但是少数菌会表现出延滞期延长的现象,需要将正常培养时间加倍。
复活后的菌株为F1代。
3.3.3将TSB生长的浓菌液吸0.5mL于菌株保藏管充分混匀后将液体吸出,将保藏管-18℃保存1-3年为标准储备菌株F2代。
将平板上生长的良好菌株接种于营养琼脂斜面(副溶血性弧菌用3%氯化钠营养琼脂)36℃培养24h当作工作菌株,为W3代,记录为F2代。
菌种管理作业指导书

6.1《采购控制程序》
6.2《微生物实验室安全操作指导书》
6.3《化妆品卫生规范》
6.4 GB/T 4789食品卫生微生物学验7 记录表格无
3.2 微生物检测人员负责提出菌种采购需求、菌种接收、传代、保存及废弃菌种培养物的销毁,负责填写菌种的使用和销毁记录等。
4 概念
原代:指自权威菌种保藏中心购买回的原始冻干菌种或标准菌株。从其中(未经培养)转接出来并经过培养而得的菌种为第一代;从第一代转接出来并经过培养而得的菌种为第二代;每经过一次转接和培养即为一代,依此类推。以上菌株也可通称为标准菌种。具体的各菌种培养温度与时间参照菌种说明书或证明文件。
5.2.2验收时应检查其外包装,数量及菌种外观。要求外观无破损,标识正确清楚,数量正确,并有标准菌种编号和溯源性证明资料。
5.2.3实验室收到菌种后检测人员应按有关说明书资料及菌种的生理生化特性调查菌种的分类、性状、适合生长的培养基和保存条件,以及有否危害的情况,为使用人员提供必要的使用知识及注意事项。同时应填写相关验收记录。
5.3.7控制传代次数。根据菌种特性和实际保存情况规定最多传代次数,传代次数一般不超过5次,时间不超两年。
5.3.8根据需要及时提供菌种,并且应是正常、无变异的。
5.3.9 菌种操作应在无菌条件进行,防止杂菌污染。在使用过程中如出现杂菌污染或菌种性能下降,应及时更换新的菌种。
5.4菌种的保存
5.4.1菌种保存时就作好标识,标明名称、编号、购买日期或传代日期、传代次数。
5.6菌种的销毁
使用完毕的原种、保存菌种、工作菌种及其废弃培养物等,均应及时监督人员监督销毁人员进行销毁。销毁方式为:121℃高压灭菌30分钟。并对销毁效果进行不定期抽查确认。确认方式为:取销毁完毕的液体或培养物适量,接种至无菌检测用培养基(如硫乙醇酸盐液体培养基)中培养,无浑浊发生,并填写相应记录。
011-菌种使用管理程序---检验科作业指导书
检验科作业指导书
菌种使用管理程序
文件编号:
版本: 生效日期: 页码: 第1页共 7 页
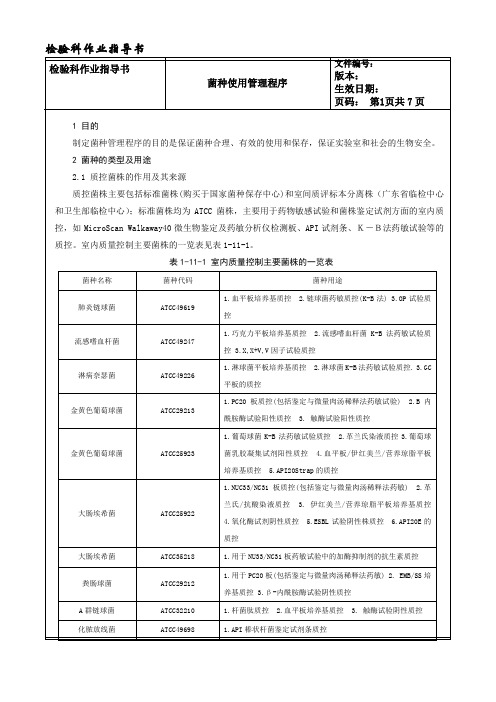
1 目的 制定菌种管理程序的目的是保证菌种合理、有效的使用和保存,保证实验室和社会的生物安全。 2 菌种的类型及用途 2.1 质控菌株的作用及其来源 质控菌株主要包括标准菌株(购买于国家菌种保存中心)和室间质评标本分离株(广东省临检中心 和卫生部临检中心);标准菌株均为 ATCC 菌株,主要用于药物敏感试验和菌株鉴定试剂方面的室内质 控,如 MicroScan Walkaway40 微生物鉴定及药敏分析仪检测板、API 试剂条、K-B法药敏试验等的 质控。室内质量控制主要菌株的一览表见表 1-11-1。
1.API 20C 的质控
流感嗜血杆菌
ATCC10211
1.API NH 的质控 2.HTM 平板质控
2.2 临床分离株
日常工作中的临床分离株,可按需要进行留取菌种保存,主要应用于流行病学调查和实验科研等。
3 菌种的保存方法
3.1 平板 4℃保存法
此法只适合短期保存菌种,可用于每周转种的质控参考菌株的保存,方法是将要用的菌株转种于
表 1-11-1 室内质量控制主要菌株的一览表
菌种名称
菌种代码
菌种用途
肺炎链球菌 流感嗜血杆菌 淋病奈瑟菌 金黄色葡萄球菌 金黄色葡萄球菌
大肠埃希菌
ATCC49619 ATCC49247 ATCC49226 ATCC29213 ATCC25923
ATCC25922
1.血平板培养基质控 2.链球菌药敏质控(K-B 法) 3.OP 试验质 控 1.巧克力平板培养基质控 2.流感嗜血杆菌 K-B 法药敏试验质 控 3.X,X+V,V 因子试验质控 1.淋球菌平板培养基质控 2.淋球菌 K-B 法药敏试验质控. 3.GC 平板的质控 1.PC20 板质控(包括鉴定与微量肉汤稀释法药敏试验) 2.B 内 酰胺酶试验阳性质控 3. 触酶试验阳性质控 1.葡萄球菌 K-B 法药敏试验质控 2.革兰氏染液质控 3.葡萄球 菌乳胶凝集试剂阳性质控 4.血平板/伊红美兰/营养琼脂平板 培养基质控 5.API20Strap 的质控 1.NUC33/NC31 板质控(包括鉴定与微量肉汤稀释法药敏) 2.革 兰氏/抗酸染液质控 3. 伊红美兰/营养琼脂平板培养基质控 4.氧化酶试剂阴性质控 5.ESBL 试验阴性株质控 6.API20E 的 质控
菌种传代与保藏作业指导书

菌种传代与保藏作业指导书1、标准菌得来源标准菌株必须购买具备资质得菌种保藏中心提供得冷冻干燥菌种(0代)(提供菌种证书)。
2、标准菌得验收从菌种保藏中心购买得原始菌种管就是玻璃安瓿装得冻干菌,接收同时应检查就是否有随菌种附有得相关资料。
接收菌种时应检查安瓿得数量与名称,与每一支安瓿得完整性。
在相应得菌种接收记录上记上所有得关于菌种得信息,如名称、数量与接收日期等。
在菌种安瓿及菌种管上粘贴标签,内容包括:菌种名称、菌种代号、代次、接收日期、接收人、贮存条件、有效期至。
新购入得0代原始菌种储存于-20℃,有效期为三年。
购买得已接种好得菌种斜面(3代)应检查菌种管就是否完好。
储存于2~ 8 ℃,有效期为3个月。
3、标准菌得复苏、复壮及标准储备菌株得制备3、1物品及试剂:接种针、酒精灯、移液管、75%酒精及75%酒精棉球3、2培养基改良马丁琼脂培养基:用于霉菌复苏、复壮、营养肉汤培养基:用于金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌、乙型副伤寒沙门菌、短小芽孢杆菌、铜绿假单胞菌复苏、复壮。
3、3操作步骤:a、打开洁净工作台。
b、在安瓿得外表面用75%得酒精擦拭并让其自然风干。
c、用一小砂轮在安瓿得上部划一条线,用手轻轻将安瓿掰开(开启安瓿时必须小心,因为安瓿遇热时可能会破裂)。
d、以无菌方法用一无菌吸管从已准备好得上述液体培养基中移取0、5~0、8 ml到安瓿中。
e、轻轻地旋转安瓿以使冻干菌种与液体培养基充分混合并完全溶解。
f、用无菌吸管将安瓿内菌液全部转接到相应得液体培养基。
g、根据安瓿上所标明得不同菌种类型而将其培养于相应得温度(细菌培养温度30~35℃,培养18~24小时;真菌培养温度23~28℃,培养3~5天。
观察就是否浑浊,浑浊说明菌种复苏生长;若不浑浊,细菌应延长培养时间至7天,真菌应延长培养时间至14天,若仍未浑浊,灭菌处理。
h、取经复苏后得上述细菌菌液8-10ml至液体培养基中按g项操作对菌种进行复壮。
菌种传代与保藏指导书

菌种验收、传代与保藏作业指导书1.目的为确保菌种管理的正确操作性,制定本作业指导书。
2.适用范围适用于实验室各菌种。
3.职责检验员负责菌种的验收、传代与保藏。
4.内容4.1定义标准菌株是指由国内或国际菌种保藏机构保藏的,遗传学特性得到确认和保证并可追溯的菌株。
传代用菌种是指用标准菌株制备的采用特定保存方法长期固定保存的菌种,用于传代及制备工作用菌种。
工作用菌种是指用标准菌株或传代用菌种接种至普通琼脂斜面培养后,作为日常工作使用的菌种。
菌种的代是指将其接种至一新鲜培养基上或培养基内,每培养一次即称为一代。
所有传代用菌种和工作用菌种的传代次数应严格控制,原则上不得超过5代(从菌种保藏机构获得的标准菌株为第0代),以防止过度传代增加菌种变异和污染的风险。
4.2标准菌的来源标准菌株需有明确来源,应可溯源至国内或国际认可的菌种保藏中心的标准菌株。
4.3标准菌的验收新购买的标准菌株应检查是否随菌种附有菌种证书。
接收时还应检查菌种数量和名称及每一支包装的完整性。
在相应的菌种验收记录上记上所有的关于菌种的信息,如名称、数量和验收日期等。
新购入的标准菌株储存于-20℃冰箱。
4.4菌种的复苏与传代根据不同的菌种保存方法和保存形式,选择适宜的方法无菌开启菌种。
应减少开启过程对菌种活力的影响,且不要引入外部污染。
经冷冻干燥安瓿保存的菌种:先用适宜的消毒剂擦拭安瓿后,用砂轮在安瓿上部1/3处划痕,将安额管顶部烧热,将无菌水滴于加热处使顶部出现裂纹,用无菌器具轻叩裂纹处上部,开启安瓿管的顶端,用适宜的缓冲液或液体培养基溶解菌块,并转移至新鲜的培养基上培养。
甘油小瓷珠保存法保存的菌种:取出冻存管并用力摇晃,使管内瓷珠分散。
无菌条件下拧开冻存管,用无菌的接种环(接种针)或镊子取出1个小瓷珠,拧紧瓶盖。
尽可能快地将冻存管放回原来的保存环境,温度过多改变将减弱细菌的生产能力。
取出的小瓷珠可以直接放在平板培养基上作划线接种,或者直接置于适合的液体培养基中培养。
ATCC菌种管理作业指导书

ATCC cultures have been cited in national and international standards for many years. Examples include the standards promulgated by the National Committee for Clinical Labora-tory Standards (NCCLS) for the healthcare community and the United States Pharmacopeia (USP) for the pharmaceutical and biopharmaceutical industries. Cultures are used in performance testing of products, as positive and negative controls, as indica-tor organisms, and as identification standards.Though the use of microbiological standards is widely accepted there is still some confusion as to specific labora-tory guidelines, especially when determining the number of subcultures allowed beyond the reference strain. As recently as January and June 2003 discussions about passages took place on the Pharmaceutical Microbiological Mail List (PMFLIST) (1-3). This article will attempt to clear up some of this confusion and provide some definitions and recommendations.Strain definitionsThe confusion starts with the different names that are ascribed to these cultures. In various NCCLS and USP publica-tions these cultures are called control strains, standard cultures, reference strains, test strains, and quality control strains. These terms can generally be used interchangeably, though the pref-erence seems to be reference strain or reference culture. Both the NCCLS and USP agree that reference strains should come from a reliable source; both organizations cite ATCC. There is agreement that the reference strains from ATCC are subcul-tured to make “stock cultures,” which are subcultured weeklyor monthly to make the “working cultures” used daily. Working cultures are often kept as slants, and it is these subcultures that raise the questions about passages from the original reference strain.A subculture is a passage. The USP26 Antimicrobial Effec-tiveness Testing, section 51 states:“For the purposes of the test, one passage is defined as the transfer of organisms from an established culture to fresh medium. All transfers are counted.” (4)This definition was recently updated in the Pharmacopeial Previews to read:“One passage is defined as the transfer of organisms froma viable culture to fresh medium with growth of the micro-organisms. Any form of subculturing is considered to be a transfer/passage.” (5)This updated definition is preferable. The earlier definition left questions about the meaning of “an established culture.” There were several questions raised on the PMFLIST as to whether the frozen or freeze-dried vial from ATCC was an established cul-ture. To some, the phrase “established culture” implied a grow-ing culture. It is clear, however, that these frozen or freeze-dried vials of reference strains from ATCC are indeed “viable” cultures.A passage involves growing the microorganism with fresh medium, either on solid agar or in broth. Resuscitating frozen or freeze-dried cultures by thawing or rehydrating is not by itself considered a passage. Thus subculturing the reference strain from ATCC’s frozen or freeze-dried vial to the stock culture is the first passage. Subculturing stock cultures to working cultures is the second passage from the original reference strain. Any sub-sequent subculture is another cumulative passage. Authenticity of culturesAnother term used by commercial sources other than ATCC is “ATCC derived.” A culture is derived from the ATCC reference strain by subculturing�in other words, one or more passages. In most cases it is not known how many passages are used by the com-mercial source to produce their cultures. Some commer-cial sources charge a premium for cultures certified to be “only” two passages from the ATCC. The NCCLS recognizes reliable commercial sources for reference strains. However, you must take into account that these cultures are at least one or two passages from the ATCC reference strains.Maintaining culturesThe USP recommends a seed lot system to maintain refer-ence strains in laboratories. In this system the ATCC reference strain is subcultured to several replicates at one time, all of which are within one passage. These replicates of the stock culture are the seed vials for the laboratory. The seed stock is subcultured, the second passage, to make replicates of working cultures. This is the same system that the ATCC uses to minimize passages in its culture collection (Figure 1).But how many passages are recommended or acceptable in the laboratory? There is agreement that the number of pas-sages should be minimized to reduce the possibility of phe-notypic variations, genetic drift, and contamination as muchas possible, but standards organizations differ as to how many passages are acceptable.Over the years the recommendations from the NCCLS have varied. The least specific recommendations call for subcultur-ing stock cultures weekly with new working cultures subcul-tured monthly, with no maximum number of passages noted. Another NCCLS standard recommends up to three subcultures of the stock cultures and up to three subcultures of the working cultures (6). This would add up to up to seven passages fromReference Strains: How Many Passages are Too Many?P.O. Box 1549, Manassas, VA 20108 | TEL 800 638 6597 or 703 365 2700 | FAX 703 365 2750 | No. 6the original ATCC reference culture (one to make the first stock culture, plus three subcultures and three additional subcul-tures).USP standards have been more specific. USP clearly states that the working cultures used for testing should not be more than five passages from the ATCC reference culture. The USP26 states:“The viable microorganisms used in this test must not be more than five passages from the original ATCCculture.” (4)The USP26 also contains the following definition:“Microbial Strains – Where a microbial strain is cited andidentified by its ATCC catalog number, the specified strain shall be used directly or, if subcultured, shall be used notmore than five passages removed from theoriginal strain.” (7)The recommendation of five passages or less from the ATCC reference culture has been broadly accepted in the healthcare community and the pharmaceutical and biophar-maceutical industries. ATCC agrees with this recommendation.Utilizing cold storageStorage temperature of stock and working cultures can affect growth characteristics and viability. The NCCLS recom-mendations include storage at −50°C to −70°C for one yearor below −70°C indefinitely (5), or −20°C or below (preferably below −70°C) for “prolonged” storage (8). Storage of slantsis recommended at 2 to 8°C for either one week (8,9) or two weeks (10). The USP26 recommends storage in liquid nitrogen or a mechanical freezer below −50°C.For long-term storage of frozen cultures, ATCC recom-mends the vapor phase of liquid nitrogen or a mechanical freezer at −80°C. Immersion in liquid nitrogen is not recom-mended. Frozen cultures may be kept at −20°C for short-term storage (less than one month). Do not store frozen cultures in a freezer with a defrost cycle; this will expose the cultures to higher temperatures. Freeze-dried cultures should be stored at 2 to 8°C. Slants can be kept at 2 to 8°C for up to a week.In conclusion, the ATCC recommendations are:1. ATCC reference strains should be subcultured to repli-cate stock cultures in the laboratory. Stock cultures canbe subcultured for working cultures weekly, typicallykept as slants. A seed lot system is recommended.2. A passage is defined as a subculture involving growth ofthe viable microorganism with fresh medium. Thawingor rehydrating ATCC reference cultures is not a passage.3. Microorganisms for standard protocols should be usedwithin five passages of the ATCC reference culture.4. Frozen cultures should be stored in the vapor phase ofliquid nitrogen or in a mechanical freezer at −80°C orbelow. Freeze-dried cultures should be stored at 2 to8°C. Slants may be stored at 2 to 8°C for up to a week. References1. Friedel B. Culture passage guidelines. In: PMFLIST Archives [Inter-net]. [The Pharmaceutical Microbiology Mail List] 2003 Jan 2.Available from: /archives/pmflist.html 2. Kramer, K. Seed stock culture. In: PMFLIST Archives [Internet]. [ThePharmaceutical Microbiology Mail List] 2003 June 10. Availablefrom: /archives/pmflist.html3. Anger, Claude. Seed stock culture. In: PMFLIST Archives [Internet].[The Pharmaceutical Microbiology Mail List] 2003 June 11. Avail-able from: /archives/pmflist.html4. U.S. Pharmacopeia. Antimicrobial Effectiveness Testing. In: U.S.Pharmacopeia 26th rev. Rockville, MD: U.S. Pharmacopeia; 2003,2nd Supplement <51>.5. U.S. Pharmacopeia. Microbiological Good Laboratory Practices,<1117>. Pharmacopeial Forum 29(3): Pharmacopeial Previews,2003.6. NCCLS. Quality assurance for commercially prepared microbio-logical culture media. 2nd ed. Wayne, PA: NCCLS; M22-A2, 1996. 7. U.S. Pharmacopeia. General Notices. In: U.S. Pharmacopeia 26threv. Rockville, MD: U.S. Pharmacopeia; 2003, 2nd Supplement.8. NCCLS. Performance standards for antimicrobial disk susceptibil-ity tests. 8th ed. Wayne, PA: NCCLS; M2–A8, 2003.9. NCCLS. Performance standards for antimicrobial disk and dilutionsusceptibility tests for bacteria isolated from animals; approvedstandard. 2nd ed. Wayne, PA: NCCLS; 2002.10. NCCLS. Reference method for broth dilution antifungal suscep-tibility testing of yeasts; approved standard. Wayne, PA: NCCLS;M27-A, 1997.Reprinted from ATCC Connection 23(2): 6-7, 2003.© 2003 ATCC. All rights reserved. ATCC is a registered trademark of the American Type Culture Collection.Reference Strains: How Many Passages are Too Many? Figure 1. Seed lot system.ATCC Culture Passage 0Stock Cultures Passage 15 Replicates Working Cultures Passage 25 Replicates。
食用菌菌种管理办法(2015年修订)-中华人民共和国农业部令2015年第1号

食用菌菌种管理办法(2015年修订)正文:----------------------------------------------------------------------------------------------------------------------------------------------------食用菌菌种管理办法(2006年3月27日农业部令第62号公布,2013年12月31日农业部令2013年第5号、2014年4月25日农业部令2014年第3号、2015年4月29日农业部令2015年第1号修订)第一章总则第一条为保护和合理利用食用菌种质资源,规范食用菌品种选育及食用菌菌种(以下简称菌种)的生产、经营、使用和管理,根据《中华人民共和国种子法》,制定本办法。
第二条在中华人民共和国境内从事食用菌品种选育和菌种生产、经营、使用、管理等活动,应当遵守本办法。
第三条本办法所称菌种是指食用菌菌丝体及其生长基质组成的繁殖材料。
菌种分为母种(一级种)、原种(二级种)和栽培种(三级种)三级。
第四条农业部主管全国菌种工作。
县级以上地方人民政府农业(食用菌,下同)行政主管部门负责本行政区域内的菌种管理工作。
第五条县级以上地方人民政府农业行政主管部门应当加强食用菌种质资源保护和良种选育、生产、更新、推广工作,鼓励选育、生产、经营相结合。
第二章种质资源保护和品种选育第六条国家保护食用菌种质资源,任何单位和个人不得侵占和破坏。
第七条禁止采集国家重点保护的天然食用菌种质资源。
确因科研等特殊情况需要采集的,应当依法申请办理采集手续。
第八条任何单位和个人向境外提供食用菌种质资源(包括长有菌丝体的栽培基质及用于菌种分离的子实体),应当报农业部批准。
第九条从境外引进菌种,应当依法检疫,并在引进后30日内,送适量菌种至中国农业微生物菌种保藏管理中心保存。
第十条国家鼓励和支持单位和个人从事食用菌品种选育和开发,鼓励科研单位与企业相结合选育新品种,引导企业投资选育新品种。
06菌种保存、传代管理作业指导书

菌种保存、传代管理制度1.目的为保证实验室标准菌株保藏及传代规范有效,保证工作菌株储存制定本作业指导书。
2.适用范围适用本实验室保藏具有菌种标准号的标准菌株及本实验室在检测中分离的已证明菌株。
3.来源1.1微生物实验室使用的参照菌种来源有二:一是从标准菌株提供单位购买获得的标准菌株,二是从本实验室日常检测中分离到的阳性菌株。
1.2实验室如需购买某种标准菌株,则由微生物检测相关人员提出申请并填写《耗材采购申请单》,经技术负责人批后,从标准菌株提供单位购买具有标准号的有证标准菌株。
1.3 实验室在日常检测中发现的阳性菌株如需留存,由生物安全员提出申请并填写《菌种、毒种(株)阳性标本保管目录登记表》,经技术负责人审批后,进行存。
4.验收、验证4.1购买的标准菌株到达实验室由试剂管理员与生物安全员共同进行验收,主要观察和核对其包装、名称、标识、编号、有无破损、污染以及瓶塞紧否等外观状态,并填写《物质验收入库登记表》与《菌种、毒种(株)阳性标本保管目录登记表》,验收合格的菌株存放于指定冰箱;验收不合格的菌株及时退货,并让发货单位重新发货。
4.2标准菌株验收后由生物安全员组织有关人员对购买的标准菌株进行复活传代后,验证确认鉴定,并填写《菌种、毒种(株)验证记录表》。
验证合格菌株存放于指定冰箱;验证不合格菌株及时退货,并重新申请购买。
4.3实验室自留菌株因在检测过程中已经过确认,无需重新验证。
5.保存与传代5.1经过确认的新菌种(包括购买的标准菌株、实验室自留的阳性菌株以及这二者传代后得到的子代菌株)保存在菌种室的专用冰箱,冰箱由生物安全员实行双人双锁管理。
5.2购买的标准品初次使用时,应大量增殖,菌种保存采用斜面传代、琼脂斜面加固体石腊封管、磁珠冷冻保存等方法,即接种后 37℃培养 18h 左右,用上述方法处理、塞上橡皮塞、并做好有关标识,用斜面传代、琼脂斜面加液体石腊管置 0-5℃5.3专用冰箱保存,磁珠置-20℃以下保存。
标准菌种管理规程

标准菌种管理规程目的:规范药品微生物学检定用菌的管理,最大限度降低变异率,确保菌种的溯源性与稳定性,从而确保微生物学检验结果的准确可靠。
职责:QC主管负责菌种的申购、接受、保存、分发,微生物检验员负责菌种的确认、传代、使用及销毁。
范围:本规程适用于检定用菌种的管理,包括菌种的申购、保存、传代、使用及销毁等。
内容:1 术语标准菌种是指由中国药品生物制品检定所医学微生物菌种保藏管理中心提供的冷冻干燥菌。
传代用菌种是指用标准菌种制备的采用特定保存方法长期固定保存的菌种,用于传代及制备工作用菌种。
工作用菌种是指用标准菌种或传代用菌种接种至普通琼脂斜面培养后,作为日常工作使用的菌种。
菌种的代是指将其接种至一新鲜培养基上或培养基内,每萌发一次即称为一代,从菌种保藏中心获得的冷冻干燥菌种为第0代。
2.标准:检定菌的申购QC主管每年根据检定菌种的使用情况(包括临时检验需要),提出购买计划,交由质量管理部部长审批后,向中检所菌种保藏中心或省(市)药检所购买.冻干菌种(标准菌种);也可以直接向省(市)药检所购买传代用菌种,购买时,需询问与确定菌种的代数,以便传代时控制代数。
检定菌的接收菌种到达实验室后,由QC主管接收菌种,检查其名称和数量,以及每一支的完整性,同时将菌种的所有信息,填写在《检定菌接收记录》(附表1)上,内容包括:名称、数量、编号(无编号者按检定菌种的编号原则编号)、代数、来源、接收日期、接收人等,贴好标签并储存于2-8?C直到需要使用时。
储存期最长不超过5年。
检定菌的保存工作用菌种的保存工作用菌种采用斜面低温保存法。
将菌种接种在适宜的固体斜面培养基上,待菌生长充分以后,转移至2~8℃冰箱中保存。
此法仅用于工作用菌种的短期保存,并应随时检查其污染杂菌和变异等情况,发现异常情况,经应灭活处理后销毁。
保存时间根据菌种种类而不同,细菌:1个月;酵母菌:2个月;霉菌及芽胞:3个月。
传代用菌种的保存采用甘油冷冻管保藏法或液体石蜡保存法。
ATCC菌种管理作业指导书

ATCC cultures have been cited in national and international standards for many years. Examples include the standards promulgated by the National Committee for Clinical Labora-tory Standards (NCCLS) for the healthcare community and the United States Pharmacopeia (USP) for the pharmaceutical and biopharmaceutical industries. Cultures are used in performance testing of products, as positive and negative controls, as indica-tor organisms, and as identification standards.Though the use of microbiological standards is widely accepted there is still some confusion as to specific labora-tory guidelines, especially when determining the number of subcultures allowed beyond the reference strain. As recently as January and June 2003 discussions about passages took place on the Pharmaceutical Microbiological Mail List (PMFLIST) (1-3). This article will attempt to clear up some of this confusion and provide some definitions and recommendations.Strain definitionsThe confusion starts with the different names that are ascribed to these cultures. In various NCCLS and USP publica-tions these cultures are called control strains, standard cultures, reference strains, test strains, and quality control strains. These terms can generally be used interchangeably, though the pref-erence seems to be reference strain or reference culture. Both the NCCLS and USP agree that reference strains should come from a reliable source; both organizations cite ATCC. There is agreement that the reference strains from ATCC are subcul-tured to make “stock cultures,” which are subcultured weeklyor monthly to make the “working cultures” used daily. Working cultures are often kept as slants, and it is these subcultures that raise the questions about passages from the original reference strain.A subculture is a passage. The USP26 Antimicrobial Effec-tiveness Testing, section 51 states:“For the purposes of the test, one passage is defined as the transfer of organisms from an established culture to fresh medium. All transfers are counted.” (4)This definition was recently updated in the Pharmacopeial Previews to read:“One passage is defined as the transfer of organisms froma viable culture to fresh medium with growth of the micro-organisms. Any form of subculturing is considered to be a transfer/passage.” (5)This updated definition is preferable. The earlier definition left questions about the meaning of “an established culture.” There were several questions raised on the PMFLIST as to whether the frozen or freeze-dried vial from ATCC was an established cul-ture. To some, the phrase “established culture” implied a grow-ing culture. It is clear, however, that these frozen or freeze-dried vials of reference strains from ATCC are indeed “viable” cultures.A passage involves growing the microorganism with fresh medium, either on solid agar or in broth. Resuscitating frozen or freeze-dried cultures by thawing or rehydrating is not by itself considered a passage. Thus subculturing the reference strain from ATCC’s frozen or freeze-dried vial to the stock culture is the first passage. Subculturing stock cultures to working cultures is the second passage from the original reference strain. Any sub-sequent subculture is another cumulative passage. Authenticity of culturesAnother term used by commercial sources other than ATCC is “ATCC derived.” A culture is derived from the ATCC reference strain by subculturing�in other words, one or more passages. In most cases it is not known how many passages are used by the com-mercial source to produce their cultures. Some commer-cial sources charge a premium for cultures certified to be “only” two passages from the ATCC. The NCCLS recognizes reliable commercial sources for reference strains. However, you must take into account that these cultures are at least one or two passages from the ATCC reference strains.Maintaining culturesThe USP recommends a seed lot system to maintain refer-ence strains in laboratories. In this system the ATCC reference strain is subcultured to several replicates at one time, all of which are within one passage. These replicates of the stock culture are the seed vials for the laboratory. The seed stock is subcultured, the second passage, to make replicates of working cultures. This is the same system that the ATCC uses to minimize passages in its culture collection (Figure 1).But how many passages are recommended or acceptable in the laboratory? There is agreement that the number of pas-sages should be minimized to reduce the possibility of phe-notypic variations, genetic drift, and contamination as muchas possible, but standards organizations differ as to how many passages are acceptable.Over the years the recommendations from the NCCLS have varied. The least specific recommendations call for subcultur-ing stock cultures weekly with new working cultures subcul-tured monthly, with no maximum number of passages noted. Another NCCLS standard recommends up to three subcultures of the stock cultures and up to three subcultures of the working cultures (6). This would add up to up to seven passages fromReference Strains: How Many Passages are Too Many?P.O. Box 1549, Manassas, VA 20108 | TEL 800 638 6597 or 703 365 2700 | FAX 703 365 2750 | No. 6the original ATCC reference culture (one to make the first stock culture, plus three subcultures and three additional subcul-tures).USP standards have been more specific. USP clearly states that the working cultures used for testing should not be more than five passages from the ATCC reference culture. The USP26 states:“The viable microorganisms used in this test must not be more than five passages from the original ATCCculture.” (4)The USP26 also contains the following definition:“Microbial Strains – Where a microbial strain is cited andidentified by its ATCC catalog number, the specified strain shall be used directly or, if subcultured, shall be used notmore than five passages removed from theoriginal strain.” (7)The recommendation of five passages or less from the ATCC reference culture has been broadly accepted in the healthcare community and the pharmaceutical and biophar-maceutical industries. ATCC agrees with this recommendation.Utilizing cold storageStorage temperature of stock and working cultures can affect growth characteristics and viability. The NCCLS recom-mendations include storage at −50°C to −70°C for one yearor below −70°C indefinitely (5), or −20°C or below (preferably below −70°C) for “prolonged” storage (8). Storage of slantsis recommended at 2 to 8°C for either one week (8,9) or two weeks (10). The USP26 recommends storage in liquid nitrogen or a mechanical freezer below −50°C.For long-term storage of frozen cultures, ATCC recom-mends the vapor phase of liquid nitrogen or a mechanical freezer at −80°C. Immersion in liquid nitrogen is not recom-mended. Frozen cultures may be kept at −20°C for short-term storage (less than one month). Do not store frozen cultures in a freezer with a defrost cycle; this will expose the cultures to higher temperatures. Freeze-dried cultures should be stored at 2 to 8°C. Slants can be kept at 2 to 8°C for up to a week.In conclusion, the ATCC recommendations are:1. ATCC reference strains should be subcultured to repli-cate stock cultures in the laboratory. Stock cultures canbe subcultured for working cultures weekly, typicallykept as slants. A seed lot system is recommended.2. A passage is defined as a subculture involving growth ofthe viable microorganism with fresh medium. Thawingor rehydrating ATCC reference cultures is not a passage.3. Microorganisms for standard protocols should be usedwithin five passages of the ATCC reference culture.4. Frozen cultures should be stored in the vapor phase ofliquid nitrogen or in a mechanical freezer at −80°C orbelow. Freeze-dried cultures should be stored at 2 to8°C. Slants may be stored at 2 to 8°C for up to a week. References1. Friedel B. Culture passage guidelines. In: PMFLIST Archives [Inter-net]. [The Pharmaceutical Microbiology Mail List] 2003 Jan 2.Available from: /archives/pmflist.html 2. Kramer, K. Seed stock culture. In: PMFLIST Archives [Internet]. [ThePharmaceutical Microbiology Mail List] 2003 June 10. Availablefrom: /archives/pmflist.html3. Anger, Claude. Seed stock culture. In: PMFLIST Archives [Internet].[The Pharmaceutical Microbiology Mail List] 2003 June 11. Avail-able from: /archives/pmflist.html4. U.S. Pharmacopeia. Antimicrobial Effectiveness Testing. In: U.S.Pharmacopeia 26th rev. Rockville, MD: U.S. Pharmacopeia; 2003,2nd Supplement <51>.5. U.S. Pharmacopeia. Microbiological Good Laboratory Practices,<1117>. Pharmacopeial Forum 29(3): Pharmacopeial Previews,2003.6. NCCLS. Quality assurance for commercially prepared microbio-logical culture media. 2nd ed. Wayne, PA: NCCLS; M22-A2, 1996. 7. U.S. Pharmacopeia. General Notices. In: U.S. Pharmacopeia 26threv. Rockville, MD: U.S. Pharmacopeia; 2003, 2nd Supplement.8. NCCLS. Performance standards for antimicrobial disk susceptibil-ity tests. 8th ed. Wayne, PA: NCCLS; M2–A8, 2003.9. NCCLS. Performance standards for antimicrobial disk and dilutionsusceptibility tests for bacteria isolated from animals; approvedstandard. 2nd ed. Wayne, PA: NCCLS; 2002.10. NCCLS. Reference method for broth dilution antifungal suscep-tibility testing of yeasts; approved standard. Wayne, PA: NCCLS;M27-A, 1997.Reprinted from ATCC Connection 23(2): 6-7, 2003.© 2003 ATCC. All rights reserved. ATCC is a registered trademark of the American Type Culture Collection.Reference Strains: How Many Passages are Too Many? Figure 1. Seed lot system.ATCC Culture Passage 0Stock Cultures Passage 15 Replicates Working Cultures Passage 25 Replicates。
标准菌种管理作业指导书2015

标准菌种管理作业指导书一、目的规范微生物学标准菌种的管理,最大限度降低变异率,确保菌种的溯源性与稳定性,从而确保微生物学检验结果的准确可靠。
二、适用范围本作业指导书适用于微生物学标准菌种的管理,包括菌种的申购、保存(藏)、传代、使用及销毁等。
三、程序1.菌种的申购微生物主管根据菌种的使用情况(包括临时检验需要)按需要购买,填写《实验室设备、标准物质、消耗品采购登记表》提出购买申请,交由技术总监批准后,由行政办公室向有购买菌种资质的供应商购买原始标准菌种,购买时,须确定菌种的编号。
2. 菌种的接收和领用菌种到达实验室后,由微生物主管与一名检验人员两人共同接收和领用菌种,检查其名称和数量,以及每一支的完整性,同时将菌种的所有信息,填写在《微生物标准菌种接收、领用、保藏、传代、使用和销毁记录表》上,内容包括:菌种名称、数量、菌种号、代数、来源、接收和领用日期、人员等,并将其暂贮存于菌种冰箱中,在一周内必须完成转种(即将原始标准菌种复苏传代成标准储存菌株)。
3. 菌种的保存(藏)菌种保存(藏)必须由具备相应技能的专业技术人员操作,保存(藏)菌种的容器表面应贴有相应的标签,内容包括:菌种名称、菌种号、传代数、接种日期、人员等。
标准储存菌株是由原始标准菌种经过一代转接后获得的同种菌株;工作菌株是由标准储存菌株转接后获得的同种菌株。
实验室根据该类微生物的特点和生存条件,结合实验室自身的情况,实验室的标准储存菌株采用甘油冻存保藏法,于-18℃以下菌种冰箱保存(藏),保存限期为1年;工作菌株采用液体石蜡保藏法,于2℃~8℃菌种冰箱保存(藏),弧菌为常温保存(藏),保存限期为1年。
4. 菌种的传代和确认原始标准菌种、标准储备菌株和工作菌株每次传代的菌种都必须对其做关键诊断试验,可依据国家标准或行业内受各方公认的方法进行。
每次试验的结果均应详细记录,具体内容包括标准菌种的名称、菌号、来源、菌种生长的培养基、孵育条件、生存条件、关键诊断试验及确认试验人等。
实验室菌种的使用和管理

xxx食品检测中心作业指导书1。
目的规范实验室菌种的收集、使用、保管程序;确保实验室的安全。
2.范围本管理细则适用于实验室菌种的使用和管理。
3。
职责3.1菌种保管员:按照本指导书做好菌种的收集、转种、使用、保存和发放以及销毁工作. 3。
2科室负责人:负责监督菌种的使用及管理。
4.管理细则本实验室保存的菌种仅包括一部分致病性较弱的三类细菌、一部分无致病能力的普通细菌和常见真菌。
不包括病毒、螺旋体、衣原体、立克次体;保存的菌种主要用于各类培养基、检测试剂的性能测试和质量控制。
4.1在本实验室保管的菌种名4。
1。
1保留工作菌种:大肠杆菌A TCC25922、鼠伤寒沙门氏菌50013、福氏志贺氏菌2a ATCC12022、副溶血性弧菌200904—1、金黄色葡萄球菌A TCC25923、表皮葡萄球菌ATCC12228溶血性链球菌23310、铜绿假单胞菌10211、普通变形杆菌,克雷伯氏杆菌,小肠结肠炎耶森氏菌ATCC 23715 、单核增生李斯特菌ATCC19111、枯草芽胞杆菌ATCC6633b 、蜡状芽胞杆菌A TCC11778、白色念珠菌A TCC10231、酿酒酵母ATCC9763、黑曲霉菌、展青霉菌、黄曲霉菌。
4。
1.2常规检测,科研分离得到的有保留价值的三类/四类菌种根据需要可继续保留;如果在食品中分离到二类/一类菌种,及时送上级单位进一步鉴定,并按规定立即销毁。
本实验室不保存一类、二类菌种。
4.2 菌种的保管4.2.1实验室菌种保存于专用的菌种室。
4.2。
2菌种保管员及科室负责人双人双锁负责保管菌种.4.2.3使用菌种需提出申请、经科室负责人批准后,向菌种保管员领用。
4。
2。
4菌种应按规定的时间定期转种,一般每转种3代做一次鉴定,如发现污染或变异应及时处理。
4。
2。
5保管人员工作变动时应作好交接工作。
4。
3 菌种的使用和保存4。
3.1菌种的类别4.3.1。
1实验室内的标准菌种根据用途不同,分为储存菌种、传代用菌种和工作用菌种。
菌种传代与保藏作业指导书

菌种传代与保藏作业指导书1.标准菌的来源标准菌株必须购买具备资质的菌种保藏中心提供的冷冻干燥菌种(0代)(提供菌种证书)。
2.标准菌的验收从菌种保藏中心购买的原始菌种管是玻璃安瓿装的冻干菌,接收同时应检查是否有随菌种附有的相关资料。
接收菌种时应检查安瓿的数量和名称,和每一支安瓿的完整性。
在相应的菌种接收记录上记上所有的关于菌种的信息,如名称、数量和接收日期等。
在菌种安瓿及菌种管上粘贴标签,内容包括:菌种名称、菌种代号、代次、接收日期、接收人、贮存条件、有效期至。
新购入的0代原始菌种储存于-20℃,有效期为三年。
购买的已接种好的菌种斜面(3代)应检查菌种管是否完好。
储存于2〜8℃,有效期为3个月。
3.标准菌的复苏、复壮及标准储备菌株的制备3.1物品及试剂:接种针、酒精灯、移液管、75%酒精及75%酒精棉球3.2培养基改良马丁琼脂培养基:用于霉菌复苏、复壮.营养肉汤培养基:用于金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌、乙型副伤寒沙门菌、短小芽孢杆菌、铜绿假单胞菌复苏、复壮。
3.3操作步骤:a.打开洁净工作台。
氏在安瓿的外表面用75%的酒精擦拭并让其自然风干。
c.用一小砂轮在安瓿的上部划一条线,用手轻轻将安瓿掰开(开启安瓿时必须小心,因为安瓿遇热时可能会破裂)。
d.以无菌方法用一无菌吸管从已准备好的上述液体培养基中移取0.5〜0.8ml到安瓿中。
e.轻轻地旋转安瓿以使冻干菌种和液体培养基充分混合并完全溶解。
f.用无菌吸管将安瓿内菌液全部转接到相应的液体培养基。
g.根据安瓿上所标明的不同菌种类型而将其培养于相应的温度(细菌培养温度30〜35℃,培养18〜24小时;真菌培养温度23〜28℃,培养3〜5天。
观察是否浑浊,浑浊说明菌种复苏生长;若不浑浊,细菌应延长培养时间至7天,真菌应延长培养时间至14天,若仍未浑浊,灭菌处理。
h.取经复苏后的上述细菌菌液8-10ml至液体培养基中按g项操作对菌种进行复壮。
以无菌技术向复壮后的菌种中加入100ml20%的无菌甘油混匀,1-2ml/管分装于冻存管。
菌种管理规范

菌种管理规范一、引言菌种管理是指对菌种的采集、保存、鉴定、记录和分发等工作进行规范管理的过程。
菌种管理的规范性对于科学研究、工程应用和产业发展具有重要意义。
本文旨在制定一套菌种管理规范,以确保菌种的质量和可追溯性,促进菌种资源的有效利用和保护。
二、菌种采集1. 采集地点:选择适宜的环境和条件进行采集,确保采集到的菌种具有代表性。
2. 采集方法:采用无菌的工具进行采集,避免外源性污染。
3. 采集数量:根据菌种的需求和研究目的,合理确定采集数量,确保采集到足够的样本。
三、菌种保存1. 保存容器:选择适宜的保存容器,如培养基斜面、液体培养基、冷冻管等,确保菌种的存活和稳定性。
2. 保存条件:根据菌种的特性和保存方式,确定适宜的保存条件,如温度、湿度、光照等,确保菌种的长期保存。
3. 多样性保存:对于重要的菌种资源,应进行多样性保存,包括冷冻保存、干燥保存、液氮保存等,以防止单一保存方式的失败。
四、菌种鉴定1. 鉴定方法:采用标准化的鉴定方法,如形态学观察、生理生化特性检测、份子生物学鉴定等,确保鉴定结果的准确性和可靠性。
2. 鉴定记录:详细记录菌种的鉴定信息,包括鉴定方法、鉴定结果、鉴定依据等,便于后续的查询和使用。
五、菌种记录1. 菌种信息:建立完整的菌种信息数据库,包括菌种的名称、来源、鉴定信息、保存方式等,确保菌种的可追溯性和信息的准确性。
2. 记录内容:记录菌种的基本信息、保存情况、使用情况等,及时更新菌种的相关信息。
六、菌种分发1. 分发方式:根据菌种的需求和使用者的要求,选择合适的分发方式,如提供活菌、冻干菌、DNA提取物等。
2. 分发记录:记录菌种的分发情况,包括分发时间、分发数量、接收单位等,确保分发的准确性和追溯性。
七、菌种质量控制1. 菌种污染检测:定期对保存的菌种进行污染检测,确保菌种的纯度和无污染。
2. 菌种活力检测:定期对保存的菌种进行活力检测,确保菌种的存活和活力。
3. 菌种鉴定验证:定期对保存的菌种进行鉴定验证,确保鉴定结果的准确性和可靠性。
菌种管理规范

菌种管理规范
标题:菌种管理规范
引言概述:菌种管理是实验室工作中非常重要的一环,正确的菌种管理规范不仅可以保证实验结果的准确性,还可以避免实验室事故的发生。
本文将从菌种的采集、保存、传播、鉴定和处置等方面详细介绍菌种管理规范。
一、菌种的采集
1.1 确保采集环境的清洁和无菌
1.2 使用正确的采集工具和方法
1.3 标注采集信息准确完整
二、菌种的保存
2.1 选择适当的保存方法和条件
2.2 定期检查保存状态并进行更新
2.3 建立完善的菌种保存档案
三、菌种的传播
3.1 严格控制菌种传播途径
3.2 定期清理传播工具和设备
3.3 建立传播记录并及时更新
四、菌种的鉴定
4.1 使用标准鉴定方法和工具
4.2 确保鉴定结果的准确性和可靠性
4.3 建立鉴定记录并保存至少两年
五、菌种的处置
5.1 定期清理过期或失活的菌种
5.2 采取正确的处置方法,避免环境污染
5.3 建立菌种处置记录并及时更新
结语:菌种管理规范是实验室工作中不可或缺的一部分,正确的菌种管理可以保证实验室的安全和实验结果的准确性。
希望本文介绍的菌种管理规范能够帮助读者更好地管理实验室中的菌种,确保实验工作的顺利进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
标准菌种管理作业指导书
一、目的
规范微生物学标准菌种的管理,最大限度降低变异率,确保菌种的溯源性与稳定性,从而确保微生物学检验结果的准确可靠。
二、适用范围
本作业指导书适用于微生物学标准菌种的管理,包括菌种的申购、保存(藏)、传代、使用及销毁等。
三、程序
1.菌种的申购
微生物主管根据菌种的使用情况(包括临时检验需要)按需要购买,填写《实验室设备、标准物质、消耗品采购登记表》提出购买申请,交由技术总监批准后,由行政办公室向有购买菌种资质的供应商购买原始标准菌种,购买时,须确定菌种的编号。
2. 菌种的接收和领用
菌种到达实验室后,由微生物主管与一名检验人员两人共同接收和领用菌种,检查其名称和数量,以及每一支的完整性,同时将菌种的所有信息,填写在《微生物标准菌种接收、领用、保藏、传代、使用和销毁记录表》上,内容包括:菌种名称、数量、菌种号、代数、来源、接收和领用日期、人员等,并将其暂贮存于菌种冰箱中,在一周内必须完成转种(即将原始标准菌种复苏传代成标准储存菌株)。
3. 菌种的保存(藏)
菌种保存(藏)必须由具备相应技能的专业技术人员操作,保存(藏)菌种的容器表面应贴有相应的标签,内容包括:菌种名称、菌种号、传代数、接种日期、人员等。
标准储存菌株是由原始标准菌种经过一代转接后获得的同种菌株;工作菌株是由标准储存菌株转接后获得的同种菌株。
实验室根据该类微生物的特点和生存条件,结合实验室自身的情况,实验室的标准储存菌株采用甘油冻存保藏法,于-18℃以下菌种冰箱保存(藏),保存限期为1年;工作菌株采用液体石蜡保藏法,于2℃~8℃菌种冰箱保存(藏),弧菌为常温保存(藏),保存限期为1年。
4. 菌种的传代和确认
原始标准菌种、标准储备菌株和工作菌株每次传代的菌种都必须对其做关键诊断试验,可依据国家标准或行业内受各方公认的方法进行。
每次试验的结果均应详细记录,具体内容包括标准菌种的名称、菌号、来源、菌种生长的培养基、孵育条件、生存条件、关键诊断试验及确认试验人等。
经确认符合的菌种方可使用或继续留种,确认不符合的菌种必须遗弃并销毁。
标准储备菌株和工作菌株的传代应根据菌种的特性、保存目的、保存方式、保存环境条件的不同而确定,标准储备菌株和工作菌株的传代培养次数不得超过5代,并作好传代记录。
具体的实验操作必须在二级生物安全实验室(Biosafety level 2, BSL-2)进行,不得造成环境污染和交叉污染。
5. 菌种的保管
实验室应指定专人负责菌种的保管,双人双锁,并建立所保管的
菌种名录清单,确保菌种安全,防止其丢失或损坏,确保其完整。
保管人员变动时,必须严格交接手续。
所保管的菌种,不能随意转让其他单位和个人,需要时应按国家相关部门的规定执行。
6. 菌种的使用
微生物主管和检验人员根据日常检验或验证试验等情况,使用工作菌株后及时填写《微生物标准菌种接收、领用、保藏、传代、使用和销毁记录表》,以便追踪菌种使用历史。
7. 菌种(废弃)的销毁
下列情况的菌种或培养物或被污染的器具等,必须采用121℃、30分钟湿热灭活处理:
1)新一代菌种制备成功后的上一代菌种;
2)使用完后的菌种和带有标准菌种的器具和培养物;
3)菌种超过传代次数;
4)凡被污染、变异、可疑等异常情况菌种;
5)其他应废弃的菌种。
由微生物检验人员进行灭活处理,并有第二人在场监督,两人共同销毁,并记录好销毁方法、销毁日期及销毁人。
编制:批准:
日期:日期:。
