化学式 和化学用语
化学用语集锦
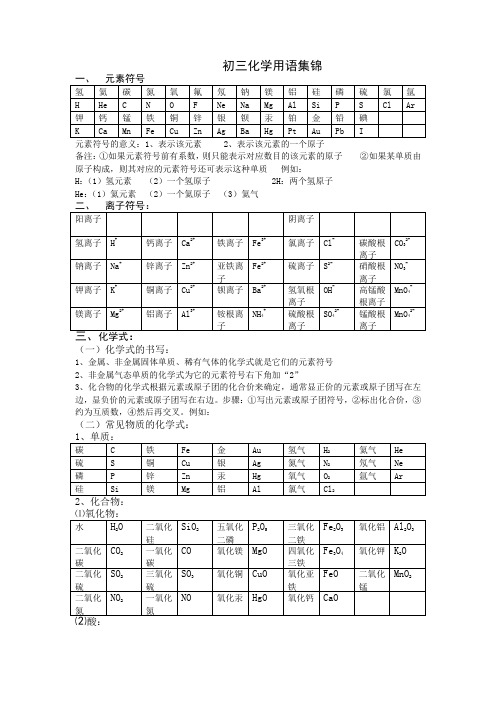
初三化学用语集锦元素符号的意义:1、表示该元素 2、表示该元素的一个原子备注:①如果元素符号前有系数,则只能表示对应数目的该元素的原子②如果某单质由原子构成,则其对应的元素符号还可表示这种单质例如:H:(1)氢元素(2)一个氢原子 2H:两个氢原子He:(1)氦元素(2)一个氦原子(3)氦气(一)化学式的书写:1、金属、非金属固体单质、稀有气体的化学式就是它们的元素符号2、非金属气态单质的化学式为它的元素符号右下角加“2”3、化合物的化学式根据元素或原子团的化合价来确定,通常显正价的元素或原子团写在左边,显负价的元素或原子团写在右边。
步骤:①写出元素或原子团符号,②标出化合价,③约为互质数,④然后再交叉。
例如:(二)常见物质的化学式:其他:过氧化氢 H2O2甲烷 CH4乙醇 C2H5OH 醋酸CH3COOH 葡萄糖C6H12O6尿素 CO(NH2)2O附录一、常见物质的颜色1、固体的颜色2、溶液中离子的颜色3、沉淀的颜色二、火焰的颜色三、离子的共存离子能否共存取决于两种离子相遇后能否生成水、气体或沉淀,如能生成上述物质则离子不能共存。
常见的有:1、H+和OH-会反应会生成H2O2、NH4+和OH-生成NH3和H2O3、H+和CO32-会生成H2CO3,分解后生成H2O和CO2气体4、Ca2+和CO32-会生成CaCO3沉淀,Cu2+、Fe3+与OH-会生成Cu(OH)2、Fe(OH)3沉淀,Ag+与Cl-生成AgCl沉淀,Ba2+与SO42-、CO32-生成BaSO4和BaCO3沉淀。
初中全部化学方程式方程式:4H2O+3Fe 高温Fe3O4+4H2式量: 72 168 232 8描述:赤热的铁跟水蒸气反应生成四氧化三铁和氢气。
方程式:4FeS2+11O2 高温2Fe2O3+8SO2式量: 480 352 320 512描述:燃烧硫铁矿(主要成分是FeS2)生成Fe2O3和SO2方程式:C+O2 点燃CO2式量: 12 32 44 描述:碳在氧气中充分燃烧方程式:S+O2 点燃SO2式量: 32 32 64 描述:硫粉在空气中燃烧方程式:4P+5O2 点燃2P2O5式量: 124 160 284 描述:红磷在空气中燃烧方程式:3Fe+2O2 点燃Fe3O4式量: 168 64 232 描述:铁在氧气中燃烧方程式:2C2H2+5O2 点燃4CO2+2H2O式量: 52 160 176 36 描述:方程式:CH4+2O2 点燃CO2+2H2O式量: 16 64 44 36 描述:甲烷在空气中燃烧方程式:2H2+O2 点燃2H2O式量: 4 32 36 描述:氢气中空气中燃烧方程式:2Mg+O2 点燃2MgO式量: 48 32 80 描述:镁在空气中燃烧方程式:2Cu+O2 △2CuO式量: 127 32 159 描述:铜在空气中受热方程式:4Al+3O2 △2Al2O3式量: 108 96 204 描述:铝在空气中燃烧方程式:2KClO3 △2KCl+3O2↑式量: 245 149 96描述:加热氯酸钾方程式:2KClO3MnO2△2KCl+3O2↑式量: 245 149 96描述:加热氯酸钾(有少量的二氧化锰)方程式:2KMnO4 △K2MnO4+MnO2+O2↑式量: 316 197 87 32 描述:加热高锰酸钾方程式:NH4HCO3 △NH3↑+H2O+CO2↑式量: 79 17 18 44 描述:方程式:Cu2(OH)2CO3 △2CuO+CO2↑+H2O式量: 221 159 44 18描述:加热碱式碳酸铜方程式:2HgO △2Hg+O2↑式量: 434 402 32 描述:方程式:2H2O 电解2H2↑+2O2↑式量: 36 4 64描述:水在直流电的作用下分解方程式:Zn+H2SO4 ZnSO4+H2↑式量: 65 98 161 2描述:锌和稀硫酸方程式:Mg+H2SO4 MgSO4+H2↑式量: 24 98 120 2描述:镁和稀硫酸方程式:Zn+2HCl ZnCl2+H2↑式量: 65 73 136 2描述:锌和稀盐酸方程式:Fe+2HCl FeCl2+H2↑式量: 56 73 127 2描述:铁和稀盐酸方程式:ZnO+2HCl ZnCl2+H2O 式量: 81 73 136 18描述:方程式:8Al+3Fe3O4 点燃9Fe+4Al2O3式量: 216 696 504 408 描述:方程式:Al2O3+3H2SO4 Al2(SO4)3+3H2O 式量: 102 294 342 54描述:方程式:CuO+H2 △Cu+H2O式量: 79.5 2 63.5 18描述:氢气还原氧化铜方程式:CuSO4+2NaOH Na2SO4+Cu(OH)2↓式量: 159.5 80 142 97.5描述:方程式:Fe3O4+4CO 高温3Fe+4CO2式量: 232 112 168 176描述:一氧化碳还原四氧化三铁方程式:Fe2(SO4)3+6NaOH 2Fe(OH)3↓+3Na2SO4式量: 400 240 214 426 描述:方程式:MnO2+4HCl △MnCl2+2H2O+Cl2↑式量: 87 146 126 36 71 描述:方程式:2C2H6+7O2 点燃4CO2+6H2O式量: 60 224 176 108描述:方程式:Cu+4HNO3 Cu(NO3)2+2NO2↑+2H2O 式量: 63.5 252 187.5 92 36描述:方程式:Zn+CuSO4 ZnSO4+Cu式量: 65 159.5 161 63.5描述:方程式:2Al+3H2SO4 Al2(SO4)3+3H2↑式量: 54 294 342 6描述:铝和稀硫酸方程式:C2H4+3O2 点燃2CO2+2H2O式量: 28 96 88 36描述:方程式:2Na+2H2O 2NaOH+H2↑式量: 46 36 80 2描述:方程式:CO2+C 高温2CO式量: 44 12 56 描述:方程式:CuO+CO △Cu+CO2式量: 79.5 28 63.5 44 描述:一氧化碳还原氧化铜方程式:2CO+O2 点燃2CO2式量: 56 32 88 描述:一氧化碳在氧气中燃烧方程式:2CuO+C △2Cu+CO2↑式量: 159 12 127 44 描述:木炭还原氧化铜方程式:2Fe2O3+3C 高温4Fe+3CO2↑式量: 320 36 224 132 描述:焦炭还原氧化铁方程式:CO2+H2O H2CO3 式量: 44 18 62描述:二氧化碳溶解于水方程式:H2CO3 H2O+CO2↑式量: 62 18 44描述:碳酸不稳定而分解方程式:CaCO3 高温CaO+CO2↑式量: 100 56 44描述:高温煅烧石灰石方程式:CaCO3+CO2+H2O Ca(HCO3)2式量: 100 44 18 162描述:方程式:Ca(HCO3)2 CaCO3↓+H2O+CO2↑式量: 162 100 18 44描述:方程式:CaCO3+2HCl CaCl2+H2CO3式量: 100 73 111 62描述:方程式:CaCO3+2HCl CaCl2+H2O+CO2↑式量: 100 73 111 18 44描述:大理石与稀盐酸反应方程式:C+H2O 高温CO+H2↑式量: 12 18 28 2描述:方程式:Na2CO3+2HCl 2NaCl2+H2O+CO2↑式量: 106 73 188 18 44 描述:碳酸钠与稀盐酸反应方程式:C2H5OH+3O2 点燃2CO2+3H2O式量: 46 96 88 54 描述:酒精在空气中燃烧方程式:2CH3OH+3O2 点燃2CO2+4H2O式量: 64 96 88 72 描述:方程式:Fe+H2SO4 FeSO4+H2↑式量: 56 98 152 2描述:方程式:Fe+CuSO4 FeSO4+Cu 式量: 56 159.5 152 63.5描述:方程式:Fe2O3+6HCl 2FeCl3+3H2O式量: 160 219 325 54描述:方程式:Cu(OH)2+2HCl CuCl2+2H2O式量: 97.5 73 134.5 36描述:方程式:AgNO3+HCl AgCl↓+HNO3式量: 170 36.5 143.5 63描述:方程式:Fe2O3+3H2SO4 Fe2(SO4)3+3H2O 式量: 160 294 400 54描述:方程式:Cu(OH)2+H2SO4 CuSO4+2H2O式量: 97.5 98 159.5 36描述:方程式:BaCl2+H2SO4 BaSO4↓+2HCl式量: 208 98 233 73描述:方程式:ZnO+2HNO3 Zn(NO3)2+H2O式量: 81 126 189 18描述:方程式:Mg(OH)2+2HNO3 Mg(NO3)2+2H2O 式量: 58 126 148 36描述:方程式:CuO+H2SO4 CuSO4+H2O式量: 79.5 98 159.5 18描述:方程式:NaOH+HCl NaCl+H2O式量: 40 36.5 58.5 18描述:方程式:2NaOH+CO2 Na2CO3+H2O式量: 80 44 106 18描述:方程式:2NaOH+SO2 Na2SO3+H2O式量: 80 64 126 18描述:方程式:2NaOH+H2SO4 Na2SO4+2H2O式量: 80 98 142 36描述:方程式:NaOH+HNO3 NaNO3+H2O式量: 40 63 85 18描述:方程式:2NaOH+CuSO4 Cu(OH)2↓+Na2SO4 式量: 80 159.5 97.5 142描述:方程式:3NaOH+FeCl3 Fe(OH)3↓+3NaCl式量: 120 162.5 107 175.5描述:方程式:CaO+H2O Ca(OH)2式量: 56 18 74描述:生石灰(CaO)溶于水生成熟石灰Ca(OH)2方程式:Ca(OH)2+SO3 CaSO4+H2O式量: 74 80 136 18描述:方程式:Ca(OH)2+CO2 CaCO3↓+H2O式量: 74 44 100 18描述:方程式:Ca(OH)2+Na2CO3 CaCO3↓+2NaOH 式量: 74 106 100 80描述:方程式:2NaOH+SO3 Na2SO4+H2O式量: 80 80 142 18描述:方程式:Zn+CuSO4 ZnSO4+Cu式量: 65 159.5 161 63.5描述:方程式:Hg(NO3)2+Cu Cu(NO3)2+Hg式量: 325 63.5 187.5 201描述:方程式:NaOH+NH4NO3 NaNO3+NH3↑+H2O 式量: 40 80 85 17 18。
化学用语

化学用语作者:张炳腾来源:《广东教育·高中》2011年第12期化学用语是富有特色的化学语言,它贯穿于化学的始终,是化学试题的重要组成部分。
正确理解和规范使用化学用语是《考纲》的要求。
原子结构示意图、电子式、结构简式的书写及正误判断,化学方程式的书写,质量守恒定律的应用等都是历年高考的热点。
以新知识介绍为载体,考查对化学用语的理解和规范使用将是高考的命题模式。
一、表示物质组成的化学用语1.元素符号、离子符号。
(1)元素符号:元素是原子核里质子数(即核电荷数)相同的一类原子的总称。
每一种元素都有一个国际上统一的符号,它既可以表示一种元素,又可以表示这种元素的一个原子。
如Cl既可以表示氯元素,又可以表示一个氯原子。
(2)离子符号:带电的原子或原子团称为离子。
用以表示各种离子的符号称为离子符号。
如Fe2+(二价铁离子)、Fe3+(三价铁离子)、NH4+(铵根离子)、O2-(氧离子)、O22-(过氧根离子)、HCO3-(碳酸氢根离子)、MnO4-(高锰酸根离子)、AlO2-(偏铝酸根离子)等。
2. 原子结构示意图。
3. 元素的化合价。
化合价是指一种元素一定数目的原子与其他元素一定数目的原子化合的性质。
同种元素因其存在形式不同,其化合价有所不同。
①单质中元素的化合价为零。
②化合物中,元素正、负化合价的代数和为零,且金属元素为正价。
对于离子化合物,元素化合价的数值就等于该元素的一个原子得失电子的数目。
化合价的正负与离子所带电荷一致。
对于共价化合物,元素化合价的数值就等于该元素的一个原子跟其他元素的原子形成共用电子对的数目。
化合价的正负由共用电子对的偏移来决定的。
共用电子对偏向哪一种原子哪一种元素就显负价,共用电子对偏离哪一种原子哪一种元素就显正价。
③一般来说,非金属元素与氢元素化合时,非金属元素显负价;非金属元素与氧元素化合时,非金属元素显正价。
【例1】国际上已禁止民用产品使用石棉制品,避免人体吸入石棉纤维而诱发肺病。
化学用语元素符号、离子符号及化学式

化学用语部分一.书写元素符号氢______ 氧_______ 氮_______ 碳_______ 氖_______钠_______ 镁_______ 铝_______ 磷_______ 硫_______氯_______ 钙_______ 钾_______ 锰_______ 铁_______铜______ 银_______ 钡_______ 锌________ 汞_______碘_______ 硅_______ 氟_______二、书写化学式水________ 氧化汞_________ 氧化铜_________氧化铁_________ 氧化亚铁__________ 氧化铝___________ 氧化钠___________ 硝酸铜_____________ 硝酸汞_________二氧化锰____________ 二氧化碳_________ 二氧化硫_________ 四氧化三铁__________ 一氧化碳________ 硝酸亚铁_______二氧化碳_____________ 盐酸_________ 硫酸__________硝酸______________ 碳酸___________ 高锰酸钾________锰酸钾___________ 氧气________ 氮气__________氯气___________ 氖气______________ 氢气___________金________ 镁________ 氯化铜__________氯化银_________ 氯化铁___________ 氯化亚铁__________ 氯化镁_________ 氯化钡__________ 碳酸钙__________碳酸钠___________ 碳酸镁___________ 碳酸钡_________硫酸钠__________ 硫酸铜__________ 硫酸钙___________ 硫酸钡___________ 硫酸铝__________ 硝酸银__________硝酸钾__________三、用符号表示氢离子_________ 氧离子_________ 氯离子________硫离子_________ 5个氮原子___________ 2个氧离子_________钙离子_________ 镁离子__________ 钡离子_______ 钠离子________ 亚铁离子_________ 铁离子__________ 铜离子_______铝离子________氢氧根离子_______碳酸根离子_________硫酸根离子_________铵根离子_________ 高锰酸根离子______________锰酸根离子______________ 氯酸根离子_________5个氮原子___________ 2个氧离子_________化学用语部分二.书写元素符号氢______ 氧_______ 氮_______ 碳_______ 氖_______钠_______ 镁_______ 铝_______ 磷_______ 硫_______氯_______ 钙_______ 钾_______ 锰_______ 铁_______铜______ 银_______ 钡_______ 锌________ 汞_______碘_______ 硅_______ 氟_______二、书写化学式水________ 氧化汞_________ 氧化铜_________氧化铁_________ 氧化亚铁__________ 氧化铝___________ 氧化钠___________ 硝酸铜_____________ 硝酸汞_________二氧化锰____________ 二氧化碳_________ 二氧化硫_________ 四氧化三铁__________ 一氧化碳________ 硝酸亚铁_______二氧化碳_____________ 盐酸_________ 硫酸__________硝酸______________ 碳酸___________ 高锰酸钾________锰酸钾___________ 氧气________ 氮气__________氯气___________ 氖气______________ 氢气___________金________ 镁________ 氯化铜__________氯化银_________ 氯化铁___________ 氯化亚铁__________ 氯化镁_________ 氯化钡__________ 碳酸钙__________碳酸钠___________ 碳酸镁___________ 碳酸钡_________硫酸钠__________ 硫酸铜__________ 硫酸钙___________ 硫酸钡___________ 硫酸铝__________ 硝酸银__________硝酸钾__________三、用符号表示氢离子_________ 氧离子_________ 氯离子________硫离子_________ 5个氮原子___________ 2个氧离子_________钙离子_________ 镁离子__________ 钡离子_______ 钠离子________ 亚铁离子_________ 铁离子__________ 铜离子_______铝离子________氢氧根离子_______碳酸根离子_________硫酸根离子_________铵根离子_________ 高锰酸根离子______________锰酸根离子______________ 氯酸根离子_________5个氮原子___________ 2个氧离子_________。
初三化学用语及常见物质的化学式

初三化学用语及常见物质的化学式一、化学用语:①元素符号(熟记下列元素名称、符号)书写原则:一大二小符号涵义:一种元素、该元素的一个原子、(少数还可表示一种单质;因为金属、稀有气体、常温下固态非金属单质都可以直接用元素符号表示);如N、O等只有二个含义;Fe、C、Ar等有三个含义。
元素符号前的系数表示原子个数。
②离子符号书写:元素符号电荷数+或-(电荷数=1时,1省略)离子符号前的系数表示离子个数。
例:2Mg2+前面的“2”表示二个镁离子,后面的“2”表示每个镁离子带2个单位的正电荷。
常见的离子:钠离子Na+钾离子K+钙离子Ca2+镁离子Mg2+锌离子Zn2+ 氢离子H+银离子Ag+铝离子Al3+钡离子Ba2+ 铜离子Cu2+氧离子O2-氯离子Cl-硫离子S2-亚铁离子Fe2+铁离子Fe3+常见的原子团的离子:硫酸根离子SO42 - 碳酸根离子CO32 -硝酸根离子NO3 -氢氧根离子OH - 铵根离子N H+氯酸根离子Cl O3 –磷酸根离子P O43 -4③化合价+或-化合价数值+2书写:元素符号(原子团)例:Mg表示:镁元素的化合价为+2价。
离子和化合价书写的区分:离子符号数写前戴歪帽,化合价数写后戴正帽。
常见元素化合价口诀:一价钾钠氯氢银,二价氧钡钙镁锌,三铝四硅三五氮磷;二三铁二四碳,二四六硫价齐全,铜汞二价最常见,单质元素是O价。
常见元原子团素化合价口诀一价铵硝氢氧高锰氯酸根,二价碳硫亚硫锰酸根,三价只有根磷酸根。
任何化合物中各元素的化合价代数和为O。
④单质化学式的书写:双原子单质分子:氢气H2氧气O2氮气N2 氟气F2 氯气Cl2 溴Br2 碘I2;多原子单质分子:臭氧O3、C60等其它单质一般用元素符号表示:1;由原子构成的单质:a:金属单质:铁F e 铜Cu 钙Ca铝Al 镁Mg 锌Zn等;b:稀有气体单质:氦气He、氖气Ne、氩气Ar等;c:某些固体非金属单质:碳C 硅Si;2;由分子构成的非金属单质:硫S 磷P 等。
化学常见用语

(一)化学用语1.元素符号:氢H 氦He锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne钠Na 镁Mg 铝Al 硅Si 磷P硫S 氯Cl 氩Ar钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn 铁Fe 锡Sn 铅Pb (氢H)铜Cu 汞Hg 银Ag 铂Pt 金Au2.化学式:气体:氧气O2氢气H2氮气N2氯气Cl2二氧化碳CO2二氧化硫SO2一氧化碳CO 二氧化氮NO2甲烷CH4氨气NH3氯化氢HCl固体:白色:五氧化二磷P2O 5氧化镁MgO 氯酸钾KClO3碳酸钙CaCO3硫酸钡BaSO4氯化银AgCl 生石灰CaO 熟石灰Ca(OH) 2黑色:木炭C 氧化铜CuO 四氧化三铁Fe3O4二氧化锰MnO2蓝色:胆矾CuSO4 . 5H2O 氢氧化铜Cu(OH) 2绿色:碱式碳酸铜Cu2 (OH) 2CO3红褐色:氧化铁(铁锈)Fe2O3氢氧化铁Fe(OH) 3常见的酸:硫酸H2SO4盐酸HCl 硝酸HNO3碳酸H2CO3常见的碱:氢氧化钠(烧碱,火碱,苛性钠)NaOH 熟石灰Ca(OH) 2常见的盐:氯化钠NaCl 氯化钡BaCl2硝酸银AgNO3碳酸钠(纯碱)Na2CO3氯化铁FeCl33.离子符号:氢离子H+钠离子Na+镁离子Mg2+氯离子Cl--离子Ag+钙离子Ca2+钡离子Ba2+硫离子S2--硝酸根离子NO3--氢氧根离子OH-- 硫酸根离子SO42--碳酸根离子CO32--4.化学方程式:化合反应:木炭充分燃烧:木炭不完全燃烧:硫的燃烧:磷的燃烧:铁丝燃烧:镁条燃烧:氢气燃烧:一氧化碳燃烧:碳还原二氧化碳:二氧化碳与水反应分解反应:加热氯酸钾:加热高锰酸钾:加热碱式碳酸铜:电解水:煅烧石灰石:氢氧化铁受热分解:碳酸分解:氧化汞受热分解:置换反应:锌和稀硫酸反应,镁和稀硫酸反应:铁和稀盐酸反应:木炭还原氧化铜:氢气还原氧化铜:锌和硫酸铜溶液反应:复分解反应:二氧化碳通入澄清石灰水:实验室制取二氧化碳:碳酸钠与盐酸反应:其他反应类型:甲烷燃烧:一氧化碳还原氧化铜:炼铁的原理:(一)化学用语1.元素符号:氢_______ 氦_______锂Li 铍Be 硼B 碳______ 氮______ 氧_____ 氟F 氖_______钠____镁____铝___ 硅_______ 磷_______ 硫_______ 氯______ 氩_______钾______ 钙______ 钠______ 镁______ 铝______ 锌_______ 铁_______锡Sn 铅Pb (氢_______)铜_______ 汞_______ 银_______ 铂Pt 金Au2.化学式:A.气体:氧气_______ 氢气_______ 氮气_______ 氯气_______ 二氧化碳_______ 二氧化硫_______ 一氧化碳_______ 二氧化氮_______甲烷_______ 氨气_______ 氯化氢_______B.常见物质颜色:____色:五氧化二磷_______ 氧化镁_______ 氯酸钾_______ 碳酸钙_______ 硫酸钡_______ 氯化银_______ 生石灰_______ 熟石灰_______镁_______、铝_______、纯铁_______、水银_______、白磷_______、碳酸钙_______、碳酸钡___________色:木炭_______ 氧化铜_______ 四氧化三铁_______ 二氧化锰_______无色:水、金刚石、许多无色溶液、大多数气体。
化学用语(2)

一、复习策略(一)化学式1、化合物化学式的读法(1)单质的读法:若为气体,读作“某气”,如N2(氮气);若不为气体,读元素名称,如Fe(铁)。
(2)化合物化学式的读法①由两种元素组成的化合物,一般读作:“某化某”,从后向前读。
如NaCl(氯化钠)。
②有时要读出各元素的原子个数,但“1”一般不读出,如Fe3O4(四氧化三铁);若两种元素组成不同的物质,某元素的原子个数不同,且其中一化学式中该元素的原子个数为1,此时“1”要读出,如CO2(二氧化碳),CO(一氧化碳)。
③某些具有可变化合价的元素,在显高价时读作“某化某”,在显低价时读作“某化亚某”,如FeCl3与FeCl2分别读作氯化铁与氯化亚铁。
2、化学式的写法(1)单质化学式的写法①单原子构成的单质(稀有气体、金属及一些固态非金属单质):用元素符号表示。
②多原子构成分子的单质:在元素符号右下角写上构成分子的原子的数目。
如氧气:O2。
(2)化合物化学式的写法①正价元素在前,负价元素在后[氨(NH3)除外],每种元素的原子数目写在符号右下角;②当某组成元素原子个数是1时,1省略。
如:CO。
③化学式中原子团的数目≥2时,原子团必须加“()”,表示原子团数目的数字标在“()”的右下方,数目为l时,不写“()”和数字。
如Al2(SO4)3、NaOH等(二)化合价1、化合价的表示方法通常在元素符号或原子团的正上方用+n或-n表示,如等。
2、化合价规律(1)化合价有正价和负价①氢元素通常显+1价,氧元素显-2价。
②金属元素一般显正价。
③非金属与金属或氢化合时,非金属显负价;非金属与氧元素化合时,非金属显正价。
④一些元素在不同物质中可显不同的化合价。
如:Fe有+2、+3价。
(2)在化合物里正负化合价的代数和为0。
(3) 元素的化合价是在形成化合物时表现出来的一种性质,在单质中元素的化合价为零。
3、常见原子团的化合价(三)常见物质的用途(根据用途写化学式)可做冰箱除臭剂的是活性炭;能用于人工降雨的是干冰;能用来蒸馒头的盐是纯碱;瓦斯的主要成份是甲烷;可用于制作电极和铅笔芯的是石墨;可用作食品干燥剂的是生石灰;可用作调味和防腐剂的是食盐;天然存在的最硬物质金刚石;常用于抢救病人的气体是氧气;可用于金属表面除锈的是稀盐酸或稀硫酸;用作粮食瓜果保护气的是氮气等;农业上用来配制农药波尔多液的是硫酸铜;用来冶炼金属的气体氧化物是一氧化碳;理想的高能燃料是氢气;可用于灭火的是二氧化碳;可用作建筑材料的是石灰石厨房调味品中pH<7的是食醋;含氮量最高的化肥是尿素;用于农作物气肥的是二氧化碳。
化学用语汇总

一、物质的化学名称、俗名和化学式汞(水银)Hg 硫(硫磺)S 氧化钙(生石灰)CaO 固体二氧化碳(干冰)CO2氧化铁(铁锈的主要成分)Fe2 O 3 碳酸钙(大理石、石灰石的主要成分)CaCO3碱式碳酸铜(铜绿)Cu2 (OH)2 CO3氯化钠(食盐)NaCl 甲烷(沼气)CH4乙醇(酒精)C2 H5 OH 乙酸(醋酸)CH3 COOH碳酸钠(纯碱)Na2 CO3 硫酸铜晶体(蓝矾、胆矾)CuSO4·5H2O氢氧化钠(烧碱、火碱、苛性钠)NaOH 氢氧化钙(熟石灰、消石灰)Ca(OH)2水煤气:氢气和一氧化碳的混合物爆鸣气:氢气和氧气的混合物二、物质的化学式A 单质:由同种(或一种)元素组成的纯净物。
1、金属单质钡钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金Ba K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au2、非金属单质氢气H2 氧气O2氮气N2氯气Cl2氟气(F2)溴(Br2 ) 碘(I2)碳C 硅Si 磷P 硫S 臭氧(O3)3、稀有气体氦气He 氖气Ne 氩气ArB 化合物:由不同种元素组成的纯净物。
(一)有机物:含碳元素的化合物(除CO、CO2和CO32-的化合物)甲烷 CH4 乙醇C2H5OH 甲醇 CH3OH 乙酸 CH3 COOH 乙炔 C2 H2尿素CO(NH2)2(二)氧化物:由两种元素组成,其中一种是氧元素的化合物。
1、非金属氧化物(大部分非金属氧化物通常是酸性氧化物,跟水化合成同价的含氧酸)水一氧化碳二氧化碳二氧化硅五氧化二磷二氧化硫三氧化硫H2 O CO CO2 SiO2 P2 O5 SO2 SO32、金属氧化物氧化钡氧化钾氧化钙氧化钠氧化镁氧化铝氧化锌BaO K2 O CaO Na2 O MgO Al2 O3 ZnO 氧化铁氧化亚铁四氧化三铁氧化铜氧化亚铜氧化汞氧化银二氧化锰Fe2 O3 FeO Fe3 O4 CuO Cu2 O HgO Ag2 O MnO2(三)酸:名称中最后一个字是“酸”,通常化学式的第一种元素是“H ”硫酸盐酸硝酸磷酸氢硫酸碳酸亚硫酸H2 SO4 HCl HNO3 H3 PO4 H2 S H2 CO3 H2 SO3(四)碱:由金属离子和氢氧根离子构成,碱的名称通常有“氢氧化某”化学式的最后面是“OH”(五)盐:由金属离子和酸根离子构成碱 1、碳酸盐 2、硫酸盐 3、硝酸盐 4.氯化物 5.亚硫酸盐氢氧化钾碳酸钾硫酸钾硝酸钾氯化钾亚硫酸钾KOH K2 CO3 K2SO4 KNO3 KCl K2SO3氢氧化钠碳酸钠硫酸钠硝酸钠氯化钠亚硫酸钠NaOH Na2 CO3 Na2SO4 NaNO3 NaCl Na2SO3碳酸银硫酸银硝酸银氯化银Ag2 CO3 Ag2 SO4 AgNO3 AgCl氨水碳酸铵硫酸铵硝酸铵氯化铵NH3 ·H2 O NH4)2 CO3(NH4)2SO4 NH4 NO3 NH4 Cl氢氧化钙碳酸钙硫酸钙硝酸钙氯化钙亚硫酸钙Ca(OH)2 CaCO3 CaSO4 Ca(NO3)2 CaCl2 CaSO3氢氧化钡碳酸钡硫酸钡硝酸钡氯化钡Ba(OH)2 BaCO3 BaSO4 Ba(NO3 )2 BaCl2氢氧化镁碳酸镁硫酸镁硝酸镁氯化镁Mg(OH)2 MgCO3 MgSO4 Mg(NO3 )2 MgCl2氢氧化铜碳酸铜硫酸铜硝酸铜氯化铜Cu(OH)2 CuCO3 CuSO4 Cu(NO3 )2 CuCl2氢氧化锌碳酸锌硫酸锌硝酸锌氯化锌Zn(OH)2 ZnCO3 ZnSO4 Zn(NO3 )2 ZnCl2硝酸汞氯化亚铜Hg(NO3)2 CuCl氢氧化亚铁碳酸亚铁硫酸亚铁硝酸亚铁氯化亚铁Fe(OH)2 FeCO3 FeSO4 Fe(NO3 )2 FeCl2氢氧化铁硫酸铁硝酸铁氯化铁Fe(OH)3 Fe2(SO4)3 Fe(NO3 )3 FeCl3氢氧化铝硫酸铝硝酸铝氯化铝Al(OH)3 Al2(SO4)3 Al(NO3 )3 AlCl36、酸式盐(多元酸里的氢部分被金属取代,H夹在中间)碳酸氢钠NaHCO3,碳酸氢钙Ca(HCO3 )2磷酸二氢钠NaH2 PO4磷酸二氢钾KH2 PO4硫酸氢钠NaHSO4,硫酸氢钾KHSO47、碱式盐(化学式的中间有“OH”):碱式碳酸铜Cu2(OH)2 CO38、其他盐高锰酸钾KMnO4 锰酸钾K2MnO4 氯酸钾KClO3硫化钠Na2 S碘酸钾 KIO3亚硝酸钠NaNO2硫化钾K2S初中化学方程式一、化合反应1、木炭在氧气中燃烧(氧气充足):C+O2CO22、木炭在氧气中燃烧(氧气不充足):2C+ O2 2CO3、铁丝在氧气中燃烧:3Fe+2O2Fe3O44、氢气在空气中燃烧:2H2+O22H2O5、硫在空气中燃烧: S+O2SO26、磷在空气中燃烧:4P+5O22P2O57、镁带在空气中燃烧:2 Mg+O22MgO 8、铜在空气中加热: 2Cu+O2 2CuO9、一氧化碳在空气中燃烧:2CO+ O2 2CO2 10、铝与氧气反应形成保护膜:4Al+3O2===2Al2O311、二氧化碳与水的反应:CO2+H2O=== H2CO3 12、二氧化硫与水的化合:SO2+H2O=== H2SO3 (亚硫酸)13、生石灰与水化合:CaO+H2O===C a(O H)2(放热)二、分解反应14、加热氯酸钾和二氧化锰的混合物:2KClO32KCl+3O2↑15、加热高锰酸钾制氧气:2KMnO4K2MnO4+MnO2+O2↑实验室制取氧气MnO216、用过氧化氢制氧气:2H2O2 2H2O+O2↑17、高温煅烧石灰石:CaCO3 CaO+CO2↑18、碳酸不稳定分解:H2CO3 === H2O+CO2↑ 19、电解水:2H2O 2H2↑+O2↑三、置换反应20、锌和稀硫酸反应(实验室制取氢气):Zn+H2SO4===ZnSO4+H2↑21、铁和稀硫酸:Fe+H2SO4===FeSO4+H2↑22、镁和稀硫酸:Mg+H2SO4===MgSO4+H2↑23、铝和稀硫酸:2Al+3H2SO4===Al2(SO4)3+3H2↑24、锌和稀盐酸反应:Zn+2HCl===ZnCl2+H2↑25、铁和稀盐酸:Fe+2HCl===FeCl2+H2↑26、镁和稀盐酸:Mg+2HCl===MgCl2+H2↑27、铝和稀盐酸:2Al+6HCl===2AlCl3+3H2↑28、氢气还原氧化铜:H2+CuO Cu+H2O29、木炭还原氧化铜:C+2CuO2Cu+CO2↑30、铁和蓝色硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu31、铜与硝酸银溶液反应:Cu+2AgNO3===2Ag+Cu(NO3)2四、复分解反应32、用石灰石与稀盐酸制取二氧化碳:CaCO3+2HCl===CaCl2+H2O+CO2↑(实验室制取二氧化碳)33、稀盐酸和碳酸钠反应:2HCl+Na2CO3===2NaCl+H2O+CO2↑34、稀盐酸和碳酸氢钠反应:HCl+NaHCO3===NaCl+H2O+CO2↑35、稀盐酸和碳酸钾(草木灰的成分):2HCl+K2CO3===2KCl+H2O+CO2↑36、稀盐酸和氢氧化钠:HCl+NaOH===NaCl+H2O37、稀盐酸和氢氧化钙:2HCl+Ca(OH)2===CaCl2+2H2O38、氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3===AlCl3+3H2O39、稀硫酸和氢氧化钠:H2SO4+2NaOH===Na2SO4+2H2O40、硫酸和氢氧化钙:H2SO4+Ca(OH)2===CaSO4+2H2O41、稀盐酸除铁锈:6HCl+Fe2O3===2FeCl3+3H2O42、氧化铜与稀盐酸反应:2HCl+CuO===CuCl2+H2O43、稀硫酸除铁锈:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O44、硫酸和硝酸钡:H2SO4+Ba(NO3)2===BaSO4↓+2HNO345、硫酸和碳酸钾:H2SO4+K2CO3===K2SO4+H2O+CO2↑↓+2KNO346、硝酸钡和碳酸钾:Ba(NO3)2+K2CO3=== BaCO347、氢氧化钠与硫酸铜溶液:CuSO4+2NaOH===Cu(OH)2↓(蓝色)+Na2SO448、氢氧化钠与氯化铁溶液:3NaOH+FeCl3===Fe(OH)3↓(红褐色)+3NaCl49、碳酸钠与石灰水:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH50.硝酸银溶液与盐酸: AgNO3 + HCl ===AgNO3↓+HNO351、硝酸铵与氢氧化钠:NH4NO3 + NaOH = NaNO3 + NH3 ↑ + H2O五、其他类型反应52、二氧化碳与澄清石灰水的反应:CO2+Ca(OH)2===CaCO3↓+H2O53、苛性钠在空气中变质:2NaOH+CO2===H2O+Na2CO354、苛性钠吸收二氧化硫气体:2NaOH+SO2===H2O+Na2SO3 (亚硫酸钠)55、烧碱溶液和三氧化硫反应:2NaOH+SO3===H2O+Na2SO456、一氧化碳还原氧化铜:CO+CuO Cu+CO257、一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO258、一氧化碳还原四氧化三铁:4CO+Fe3O4 3Fe+4CO259、甲烷在空气中燃烧:CH4+2O2CO2+2H2O60、酒精在空气中燃烧:C2H5OH+3O22CO2+3H2O一、化合反应1、木炭在氧气中燃烧(氧气充足):2、木炭在氧气中燃烧(氧气不充足):3、铁丝在氧气中燃烧:4、氢气在空气中燃烧:5、硫在空气中燃烧:6、磷在空气中燃烧:7、镁带在空气中燃烧:8、铜在空气中加热:9、一氧化碳在空气中燃烧:10、铝与氧气反应形成保护膜:11、二氧化碳与水的反应:12、二氧化硫与水的化合:13、生石灰与水化合:二、分解反应141516、用过氧化氢制氧气:氧气17、高温煅烧石灰石:18、碳酸不稳定分解:19、电解水:三、置换反应20、锌和稀硫酸反应(实验室制取氢气):21、铁和稀硫酸:22、镁和稀硫酸:23、铝和稀硫酸:24、锌和稀盐酸反应:25、铁和稀盐酸:26、镁和稀盐酸27、铝和稀盐酸:28、氢气还原氧化铜:29、木炭还原氧化铜:30、铁和蓝色硫酸铜溶液反应:31、铜与硝酸银溶液反应:四、复分解反应32、用石灰石与稀盐酸制取二氧化碳:(实验室制取二氧化碳)33、稀盐酸和碳酸钠反应:34、稀盐酸和碳酸氢钠反应:35、稀盐酸和碳酸钾(草木灰的成分):36、稀盐酸和氢氧化钠:37、稀盐酸和氢氧化钙:38、氢氧化铝药物治疗胃酸过多:39、稀硫酸和氢氧化钠:40、硫酸和氢氧化钙:41、稀盐酸除铁锈:42、氧化铜与稀盐酸反应:43、稀硫酸除铁锈:44、硫酸和硝酸钡:45、硫酸和碳酸钾:46、硝酸钡和碳酸钾47、氢氧化钠与硫酸铜溶液:48、氢氧化钠与氯化铁溶液:49、碳酸钠与石灰水:50.硝酸银溶液与盐酸:51.硝酸铵与氢氧化钠:五、其他类型反应52、二氧化碳与澄清石灰水的反应:53、苛性钠在空气中变质54、苛性钠吸收二氧化硫气体:55、烧碱溶液和三氧化硫反应:56、一氧化碳还原氧化铜57一氧化碳还原氧化铁:58、一氧化碳还原四氧化三铁:59、甲烷在空气中燃烧60、酒精在空气中燃烧:。
常见的化学用语

13.设问: 氧化钙能和水反应生成氢氧化钙, 那么氧化铜能否和水反应得到氢氧化铜 呢。如不能则怎样设计实验使氧化铜变 成氢氧化铜,写出有关反应的图示式。 方案一: CuO CuCl2 Cu(OH)2
方案二 :
CuO
CuSO4
Cu(OH)2
14.讨论:1.怎样从氧化铁制得氢氧化铁?
2.从氧化铜制取铜可以用几种方法?
② BaCl2 Na2CO3
③ CaCO3 Na2CO3 BaCl2
1、一种单质和一种化合物反应生成另外两种物质一定是置 换反应吗? CH4+2O2 点燃 CO2+2H2O 2、两种物质反应生成另外两种化合物一定是复分解反应吗? 3、两种化合物反应生成另外两种化合物,一定是复分解反 应吗? SO2+2NaOH=Na2SO3+H2O 3、两种物质反应生成一种单质和一种化合物,一定是置换 反应吗? 高温 3CO+Fe O 2Fe+3CO2 2 3 4、生成盐和水的反应一定是中和反应吗? 金属氧化物+酸/非金属氧化物+碱
化合物化学式:氯酸钾 KClO3 氯化钾 KCl 锰 酸钾 K2MnO4 硫酸锌 ZnSO4 硫酸 H2SO4 硫酸镁 MgSO4 氢氧化钙 Ca(OH)2 硫酸铜CuSO4 碳酸钙 CaCO3 碳酸 H2CO3 盐酸 HCl 高锰酸钾 KMnO4 酒精C2H5OH 甲烷CH4 氯化钙 CaCl2
分别用简单图示你设计的变化途径
1. Fe2O3 FeCl3 Fe(OH) 3
Fe2(SO4)3
2.(1) CuO (2) CuO Cu CuCl2 CuSO4
Fe(OH) 3
Cu
4、在CaCO3 → CaO → Ca(OH)2→NaOH的各步转化中,所属的 基本反应类型不包括( A) A、置换反应 B、分解反应 C、化合反应 D、复分解反应
中考化学11微专题考点详解:专题04 化学用语 化学式 化合价 化学方程式(教师版含解析)

专题04 化学用语 化学式 化合价 化学方程式元素符号、离子符号、化学式一、元素符号的原子,核电荷数一定相同,而核电荷数相同的粒子不一定属于同种元素,如Na +和 NH 4+;③同种元素的离子因所带的电荷数不同,性质也不同,如Fe 2+和Fe3+;④同种原子和其所形成的离子一定是同种元素,如Na 和Na +。
在元素符号前加数字,该符号只表示微观意义,表示几个该原子,如5Fe 表示5个铁原子。
二、离子符号1.离子符号的表示方法:在元素符号的右上角用“+”或“-”表示离子的电性,数字表示离子所带的电荷数,数字在前、正负号在后,当数字为1时,省略不写,如Na +、Cl -。
2.离子符号的意义:离子符号前面的化学计量数表示离子个数。
3.确定离子所带电荷数的方法:离子所带的电荷数等于该原子失去或得到电子的数目。
(1)原子中:核电荷数=质子数=核外电子数,如Na 、Mg 、O 、Cl 。
(2)阳离子中:核电荷数=质子数>核外电子数,如Na +、Mg 2+。
表示每个镁离子带2个单位正电荷表示2个镁离子(3)阴离子中:核电荷数=质子数<核外电子数,如Cl-、O2-。
4.原子团:在许多化学反应里,作为一个整体参加,好像一个原子一样,这样的原子的集团,叫做原子团。
如:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH 其中OH-、CO32-作为整体参加反应。
注意:原子团并不是在任何反应中都保持不变。
如:在碳酸盐与酸反应时,碳酸根离子变成了二氧化碳:CaCO3+2HCl==CaCl2+CO2↑+H2O;氯酸钾受热分解,氯酸根离子分解产生氧气:2KClO3MnO2△2KCl+3O2↑。
5.离子的颜色:有些离子在水溶液中呈现不同颜色,如Fe3+呈黄色、MnO4-呈紫色,铜离子呈蓝色。
三、化学式1.概念:用元素符号和数字表示物质组成的式子2.表示的意义:3.化学式书写:1.(2022年四川省泸州市中考)“结构决定性质”是化学的核心观念。
化学用语之化学式

碳元素、一个碳原子、碳单质 碳元素、一个碳原子、 C:_______________________ :
氮气、一个氮分子 氮气、 N2:_________________ 2个银原子 2Ag:__________ : 2个银原子 个过氧化氢分子 3H2O2:3个过氧化氢分子 ______________ 3+:______ Fe 铁离子
2.化学式的写法: 2.化学式的写法: 化学式的写法
(1)单质化学式的书写 单质化学式的书写: 单质化学式的书写 金属、 ①金属、固体非金属和稀 有气体用元素符号表示它 们的化学式。 们的化学式。 例:C S P Si Fe Cu Ca
②某些气体非金属单质的 每个分子由多个原子构成。 每个分子由多个原子构成。 化学式在元素符号右下角 写上每个分子中的原子个数。 写上每个分子中的原子个数。 (例:H2 O2 N2 Cl2 O3)
⑵氯化物(含氯元素的化合物) 氯化物(含氯元素的化合物) 氯元素-1价另一元素为正价 氯元素 价另一元素为正价 1.氯化氢 氯化氢HCl 2.氯化钾 KCl 氯化氢 氯化钾 3.氯化银 氯化银AgCl 4.氯化钠 NaCl 氯化银 氯化钠 5.氯化铜 氯化铜CuCl2 6.氯化钙 CaCl2 氯化铜 氯化钙 7.氯化镁 氯化镁MgCl2 8.氯化锌 ZnCl2 氯化镁 氯化锌 9.氯化亚铁 氯化亚铁FeCl2 10.氯化钡 BaCl2 氯化亚铁 氯化钡 11.氯化铁 氯化铁FeCl3 12.氯化铝 AlCl3 氯化铁 氯化铝
由正价的A 由正价的A元素或原子团和负价的 B元素或原子团组成的化合物的化学 式可写成: 式可写成:
AB +1 +2 +3 -1 AB AB2 AB3 -2 A2B AB A2B3
化学式在化学用语系列中

化学式在化学用语系列中,处于承上启下的地位,前有元素符号和化合价知识,这是书写化学式的基础;后有化学方程式和电离方程式等,这又是以化学式为基础的,其中如有一个化学式错误,则全式毫无意义,若再以这样的错误化学方程式作依据进行化学计算,则错得更远,真可谓是“失之毫厘,差之千里”。
可见,掌握书写化学式的要领,直接影响着其他化学用语、其他化学知识和技能的学习。
初中化学中,出现的不同物质的化学式有一百多个。
记忆和书写物质的化学式,绝不能靠死记硬背,而应掌握其书写要领,只要常写常练,便能较快地达到熟练的程度。
要正确书写物质的化学式,一是要熟练记忆元素符号,二是书写化合物的化学式时,要熟练记忆常见元素和原子团的化合价,三是书写化合物的化学式要符合各元素正负化合价的代数和为零的原则,四是掌握书写化学式的一般方法。
总起来说,这就是书写化学式的要领。
化学式的一般写法是:(1)单质的化学式除H2、O2、N2、F2、Cl2、Br2和I2七种单质为双原子分子外,其余单质(惰性气体、金属单质和固态非金属单质等)都是以元素符号表示其化学式。
(2)化合物的化学式书写时一般规律是先读后写,后读先写;排好顺序,写好角号。
一般将显正价的元素或原子团写在左边,显负价的元素或原子团写在右边。
其书写步骤是:定位、标价、交叉约简和检验四步。
例如:写出氧化铝、磷酸、氢氧化铜和硫酸铁的化学式。
①定位:确定元素或原子团的顺序。
AlO、HPO4、CuOH、FeSO4②标价:正确地在各元素或原子团的上方标出化合价。
③交叉约简:将化合价的绝对值交叉写在对方元素或原子团的右下方,能约简的要约为最简约数。
原子或原子团的个数为1时,通常1省去不写。
原子团在2个或2个以上时,应加上括号。
④检验:当正价总数与负价总数之和为零时,化学式正确。
Al2O3、H3PO4、Cu(OH)2、Fe2(SO4)3上述步骤是对初学者而言,写得多了,熟练了,便可得心应手一次写出。
要注意的是,化学式表示某物质的组成,因此,只有某种物质是确实存在的,表示这种物质的化学式才有意义。
2024年新九年级化学上册讲练(人教版)第11讲 物质组成的表示(化学式与化合价)(原卷版)

化学式与化合价一、化学式与化学用语1.用表示纯净物组成的式子叫做化学式。
2.化学式的书写物质类别书写方法举例单质金属直接用元素符号来表示(I 2除外)铁:稀有气体氖气:固体非金属碳:气态非金属(稀有气体除外)在元素符号的右下角写上原子个数氢气:臭氧:化合物正左负右硫酸铝:3.化学式表示的意义(由分子构成的物质)分类意义以H 2O 为例宏观表示一种物质水表示物质的组成元素水是由氢、氧两种元素组成的微观表示1个分子1个水分子表示分子的构成1个水分子是由2个氢原子和1个氧原子构成的二、化学式中数字的含义1.写在元素符号或化学式前面的数字,表示原子或分子个数。
如:2S 表示2个硫原子,2H 2O 表示2个水分子,只表示微观意义,不表示宏观意义。
2.写在化学式中元素符号右下角的数字,表示1个分子中所含该元素的原子个数。
如:H 2O 中“2”表示1个水分子中有2个氢原子。
三、化合价1.意义:化合价是元素的一种性质,它用来表示原子之间相互化合的数目。
2.数值:由1个原子或形成的对决定的。
3.表示方法:在元素符号或原子团的,先写,再写,数值是1时,。
4.常见元素化合价:K 、、Ag 、是+1价;Ca 、、Ba 、、Hg 是+2价;是+3;是-2价,是+2或+3,Cl 是-1最常见,单质价永不变。
5.规律(1)单质中元素化合价为;(2)在化合物中,各元素正负化合价的代数和为。
(3)在同一物质中,同种元素化合价可以,如:NH 4NO 3(4)同一元素在不同化合物中可以显示化合价。
(5)金属元素与非金属元素形成的化合物,化合价为正,化合价为负。
如:NaCl 非金属元素组成的化合物正价元素在前,负价元素在后。
6.化合价的计算考点1:化学式与意义【例1】(2024·陕西宝鸡·三模)含义丰富的化学符号是独特的化学语言,根据下列符号回答:原子团SO 4NO 3OHNH 4名称硫酸根碳酸根硝酸根铵根化合价-2价-2价-1价-1价+1价离子符号CO 32-OH -NO-⑤N2①2CH4②Al3+③2H④3(1)具有宏观含义的是(填序号)。
第二编重点题型突破篇专题1化学用语(精讲)练习

专题一化学用语1.化学用语的含义化学用语包括的内容:(1)化学用语包括:元素符号、离子符号、化学式、化合价、化学方程式及用来说明元素符号、离子符号、化学式、化学方程式含义的语言,都称为化学用语。
(2)用来表示微粒结构的图形、图示,如表示分子结构模型、原子结构示意图都属于化学用语。
2.通常所指的化学用语,主要是指元素符号、离子符号、化学式、化学反应方程式。
,中考专题精讲)元素符号:以H和Fe为例说明元素符号的意义【特别提醒】元素符号前面加数字后,整体符号无宏观意义。
化学式(常考点)1.以H2和H2O为例说明化学式的意义【特别提醒】化学式的前面加数字后,整体符号无宏观意义。
2.化学式中数字表示的意义(以水为例)离子符号的意义(以Mg2+、SO2-4为例)结构图、图示、模型和相关意义(常考点)1.原子结构示意图(以镁原子为例)2.图示为元素周期表中表格(以镁为例)化学方程式(必考点),中考题型分类示例)化学符号【例1】(2017达州中考)请用合适的化学用语填空: (1)3个磷原子________。
(2)铵根离子________。
(3)2个甲烷分子________。
(4)氧化铝中铝元素的化合价________。
【解析】化学符号既能表示宏观意义,又能表示微观含义,熟悉化学符号的各种含义,才能应用所给的信息,完成相应符号的书写。
【答案】(1)3P ;(2)NH +4;(3)2CH 4;(4)Al +32O 31.(1)化学用语是学习和研究化学的工具,请用化学用语填空: ①两个氢分子__2H 2__; ②氦气__He__; ③亚铁离子__Fe 2+__;④标出氨气中氮元素的化合价__N -3H 3__。
(2)在O 2、CO 2、H 2O 2中,每种物质中都含有__氧元素__,每种物质的1个分子中都含有__2个氧原子__。
化学图示【例2】(2017河北中考)如图所示的是氧原子结构示意图和硫元素在元素周期表中的信息。
有关化学用语的复习

化 学 用 语
物质变化用语
元素符号 化合价符号 离子符号 化学式 化学方程式
原子结构示意图 物质结构用语 离子结构示意图 相对原子质量 化学量用语 相对分子质量
化学符号周围数字表示的意义。 化学符号周围数字表示的意义
表示化合价的 数值、 数值、正负
+m -
n+ -
一个离子所 带电荷的数 值、正负
表示粒子 个数
+1
2H
为例, 以CO2为例,叙述 化学式的含义。 化学式的含义。
下列物质化学式你记好了么? 下列物质化学式你记好了么
单质: 单质 非金属:氧气、氮气、氢气、 氯气) 非金属 氧气、氮气、氢气、碳、硫、磷 (氯气) 氧气 稀有气体:氦气、氖气、 稀有气体:氦气、氖气、氩气 金属: 金属:铁、汞、铜、铝 化合物: 化合物: 氧化物:二氧化硫、四氧化三铁、氧化铁、 氧化物:二氧化硫、四氧化三铁、氧化铁、 其它:氯酸钾、高锰酸钾、碳酸钙 其它:氯酸钾、高锰酸钾、碳酸钙……
则氮化镓的化学式是
。
你能总结出书写化学式时有 哪些规律
。
下图形象地表示某反应前后反应物与生成 物分子及其数目的变化, 物分子及其数目的变化, 、 、、 分别 表示A、 、 三种不同的分子 三种不同的分子。 表示 、B、C三种不同的分子。该反应的化 学方程式中A、 、 前的化学计量数之比为 学方程式中 、B、C前的化学计量数之比为 (B)
氢气和氧气之间发生化学反应的过 可用下列图示微观描述。 程,可用下列图示微观描述。 ( 表示氧原子 表示氢原子 )
点燃 (反应前 ) (反应后)
1写出该反应的化学方程式。 写出该反应的化学方程式。 写出该反应的化学方程式 2除化学方程式本身表示的意义外, 除化学方程式本身表示的意义外, 除化学方程式本身表示的意义外 从上图中你还能得到哪些信息? 从上图中你还能得到哪些信息?
化学用语及化学反应方程式

Ⅰ.化学用语一.输记下列元素名称.符号:1.O 氧 H 氢 N 氮 Cl 氯 C 碳 P 磷 S 硫2.K 钾 Ca 钙 Na 钠 Mg 镁 Al 铝 Zn 锌 Fe 铁 Cu 铜 Hg 汞 Ag 银 Mn 锰 Ba 钡二.熟记下列物质的化学式:1.单质:H2氢气氢气 O2氧气氧气 N2氮气氮气C 碳 P 磷 S 硫 Fe 铁 Cu 铜 Hg 汞 2.化合物(1)氧化物:H2O 水 CO2二氧化碳二氧化碳 CO 一氧化碳一氧化碳 SO2二氧化硫二氧化硫 SO3三氧化硫三氧化硫 P2O5五氧化二磷五氧化二磷Fe2O3氧化铁氧化铁 Fe3O4四氧化三铁四氧化三铁 CaO 氧化钙氧化钙 MgO 氧化镁氧化镁 CuO 氧化铜氧化铜 ZnO 氧化锌氧化锌 FeO 氧化亚铁氧化亚铁 MnO2二氧化锰二氧化锰Na2O 氧化钠 (2)酸:HCl 盐酸盐酸 H2SO4硫酸硫酸 HNO3硝酸硝酸 H3PO4磷酸磷酸 H2CO3碳酸碳酸H2SO3亚硫酸 (3)碱:NaOH 氢氧化钠氢氧化钠 KOH 氢氧化钾氢氧化钾 Ca(OH)2氢氧化钙氢氧化钙 Ba(OH)2氢氧化钡氢氧化钡 Cu(OH)2氢氧化铜氢氧化铜 Fe(OH)3氢氧化铁氢氧化铁 Fe(OH)2氢氧化亚铁氢氧化亚铁 Al(OH)3氢氧化铝氢氧化铝Mg(OH)2氢氧化镁 (4)盐:NaCl 氯化钠氯化钠 Na2CO3碳酸钠碳酸钠 ZnCl2氯化锌氯化锌 CaCl2氯化钙氯化钙 KCl 氯化钾氯化钾 Na2SO4硫酸钠硫酸钠CuSO4硫酸铜硫酸铜 AgCl 氯化银氯化银 FeCl3氯化铁氯化铁 FeCl2氯化亚铁氯化亚铁 AlCl3氯化铝氯化铝 FeSO4硫酸亚铁硫酸亚铁Fe2(SO4)3硫酸铁硫酸铁 ZnSO4硫酸锌硫酸锌 CaCO3碳酸钙碳酸钙 BaCl2氯化钡氯化钡 BaSO4硫酸钡硫酸钡 KClO3氯酸钾氯酸钾KMnO4高锰酸钾锰酸钾 K2MnO4锰酸钾锰酸钾 KNO3硝酸钾硝酸钾 Cu(NO3)2硝酸铜硝酸铜 Hg(NO3)2硝酸汞硝酸汞 NH4Cl 氯化铵氯化铵 NH4NO3硝酸铵硝酸铵 (NH4)2SO4硫酸铵硫酸铵 NH4HCO3碳酸氢铵碳酸氢铵 NaHCO3碳酸氢钠碳酸氢钠Cu2(OH)2CO3碱式碳酸铜(5)有机物:CH4甲烷甲烷 C2H5OH 乙醇(酒精) CH3OH 甲醇甲醇CH3COOH 乙酸(醋酸) CO(NH2)2尿素 三熟记下列元素在化合物中的化合价:(1)+1 +1 +1 +1 +2 +2 +2 +2 +2 +3 +2 +3H K Na Ag Ca Mg Zn Ba Cu Al Fe(FeO) Fe(Fe2O3)(2)-2 -1 -2 O Cl S(3)+1 -1 -1 -1 -1 -2 -2 -2 -2 -3 -1NH4 OH NO3 ClO3 MnO4(KMnO4) MnO4(K2MnO4) CO3 SO4 SO3 PO4 HCO3四.熟记下列化学方程式:(一)化合反应1.木炭在氧气中燃烧:C+O2=点燃=CO22.硫在氧气中燃烧:S+O2=点燃=SO23.镁在空气中燃烧:2Mg+O2=点燃=2MgO4.铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O45.磷在氧气中燃烧:4P+5O2=点燃=2P2O56.铜在空气中加热:2Cu+O2=△=2CuO7.氢气在氧气中燃烧:2H2+O2=点燃=2H2O8.一氧化碳在空气中燃烧:2CO+O2=点燃=2CO29.碳不充分燃烧:2C+O2(不充分)=点燃=2CO10.二氧化碳通过灼热的碳层:CO2+C=高温=2CO11.二氧化碳与水反应:CO2+H2O=H2CO311'.氧化钠溶于水:Na2O+H2O=2NaOH11''.生石灰和水化合:CaO+H2O=Ca(OH)211'''.三氧化硫溶于水:SO3+H2O=H2SO4(二)分解反应:=2KCl+3O2↑↑12.氯酸钾与二氧化锰共热(实验室制O2):2KClO3=(MnO2=△=2KCl+3O2=K2MnO4+MnO2+O2↑↑13.加热高锰酸钾:2KMnO4=△=K2MnO4+MnO2+O2=2CuO+H2O+CO2↑↑14.加热碱式碳酸铜:Cu2(OH)2CO3=△=2CuO+H2O+CO2=2H2↑+O2↑15.电解水:2H2O=通电=2H2↑+O2↑:H2CO3=H2O+CO2↑16.碳酸不稳定分解:H2CO3=H2O+CO2↑17.高温煅烧石灰石:CaCO3=高温=CaO+CO2↑=CaO+CO2↑5H2O=△=CuSO4+5H2O:CuSO4·5H2O=18.硫酸铜晶体受热失去结晶水:CuSO4·18'.氢氧化铜受热分解:Cu(OH)2=△=CuO+H2O(三)置换反应H2):Zn+H2SO4=ZnSO4+H2↑19.锌和稀硫酸反应(实验室制H2):Zn+H2SO4=ZnSO4+H2↑:Zn+2HCl=ZnCl2+H2↑20.锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑:Fe+2HCl=FeCl2+H2↑21.铁和盐酸:Fe+2HCl=FeCl2+H2↑:Fe+H2SO4=FeSO4+H2↑22.铁和稀硫酸:Fe+H2SO4=FeSO4+H2↑23.氢气还原氧化铜:H2+CuO=△=Cu+H2O=2Cu+CO2↑24.木炭还原氧化铜:C+2CuO=高温=2Cu+CO2↑=4Fe+3CO2↑25.碳还原氧化铁:3C+2Fe2O3=高温=4Fe+3CO2↑26.铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO427.铜和硝酸汞溶液:Cu+Hg(NO3)2=Hg+Cu(NO3)228.氢气还原氧化铁:3H2+Fe2O3=△=2Fe+2H2O:2Al+3H2SO4=Al2(SO4)3+3H2↑29.铝和稀硫酸:2Al+3H2SO4=Al2(SO4)3+3H2↑:2Na+2H2O=2NaOH+H2↑30.钠和水反应:2Na+2H2O=2NaOH+H2↑(四)复分解反应CO2):CaCO3+2HCl=CaCl2+H2O+CO2↑ 31.大理石和稀盐酸(实验室制CO2):CaCO3+2HCl=CaCl2+H2O+CO2↑:2NaOH+CuSO4=Cu(OH)2↓+Na2SO432.氢氧化钠和硫酸铜:2NaOH+CuSO4=Cu(OH)2↓+Na2SO433.碳酸钠和盐酸(灭火器原理):Na2CO3+2HCl=2NaCl+H2O+CO2↑):Na2CO3+2HCl=2NaCl+H2O+CO2↑Cl+H2O+CO2↑34.碳酸钾(草木灰)和盐酸:K2CO3+2HCl=2K:K2CO3+2HCl=2KCl+H2O+CO2↑Cl+H2O+CO2↑35.盐酸和氢氧化钠(中和反应):HCl+NaOH=NaCl+H2O36.硫酸和氢氧化钠溶液:H2SO4+2NaOH=Na2SO4+2H2O:H2SO4+BaCl2=BaSO4↓+2HCl37.硫酸与氯化钡溶液:H2SO4+BaCl2=BaSO4↓+2HCl38.盐酸与硝酸银溶液:HCl+AgNO3=AgCl↓(白)+HNO339.氢氧化钠和氯化铁溶液:3NaOH+FeCl3=Fe(OH)3↓(红褐色)+3NaCl:BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O40.碳酸钡和稀硝酸:BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O:Na2SO4+BaCl2=BaSO4↓+2NaCl41.硫酸钠和氯化钡:Na2SO4+BaCl2=BaSO4↓+2NaCl:NaCl+AgNO3=AgCl↓+NaNO342.氯化钠和硝酸银:NaCl+AgNO3=AgCl↓+NaNO3:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH43.碳酸钠和石灰水:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH44.氢氧化铝和盐酸:Al(OH)3+3HCl=AlCl3+3H2O45.硝酸铵和氢氧化钠:NH4NO3+NaOH=△=NaNO3+H2O+NH3=NaNO3+H2O+NH3↑↑ 46.氢氧化铁和硫酸:2Fe(OH)3+3H2SO4=Fe2(SO4)347.盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O48.氧化铜和硫酸:CuO+H2SO4=CuSO4+H2O(五)其他:49.二氧化碳使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O :CO2+Ca(OH)2=CaCO3↓+H2O50.二氧化碳通入氢氧化钠溶液:CO2+2NaOH=Na2CO3+H2O51.用氢氧化钠溶液吸收二氧化硫:SO2+2NaOH=Na2SO3+H2O52.一氧化碳还原氧化铜:CO+CuO=△=Cu+CO253.一氧化碳还原氧化铁(炼铁):3CO+Fe2O3=高温=2Fe+3CO254.甲烷在空气中燃烧:CH4+2O2=点燃=CO2+2H2O55.乙醇在空气中燃烧:C2H5OH+3O2=点燃=2CO2+3H2O 56.甲醇在空气中燃烧:2CH3OH+3O2=点燃=2CO2+4H2OⅡ.金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au----------------------------------------------→→金属活动性由强逐渐减弱小结:1.只有排在H 前面的金属才能置换出酸里的氢2.只有排在前面的金属才能将排在后面的金属从它的盐溶液中置换出来二.溶液的酸碱度--pH石蕊试液红紫蓝-----------------------------酚酞试液无无红0 1 2 3 4 5 6 7 8 9 10 11 12 13 14│└-┴-┴-┴-┴-┴-┴-┴-┴-┴-┴-┴-┴-┴-┘ ←------------中性----------------------------→→酸性增强碱性增强pH 试纸红黄蓝三.常见物质的颜色.气味等:红色:红P .Cu.Fe2O3红褐色:Fe(OH)3浅绿色:Fe2+盐的溶液黄色:S.Fe3+盐的溶液绿色:Cu2(OH)2CO3紫黑色:KMnO4晶体蓝色:Cu(OH)2.CuCO3.CuSO4·:Cu(OH)2.CuCO3.CuSO4·5H2O.Cu2+5H2O.Cu2+盐的溶液 紫红色:KMnO4溶液黑色:C.Fe 粉.CuO.MnO2.Fe3O4白色:BaSO4.AgCl.MgO.P2O5.CaO.NaOH.Ca(OH)2.CaCO3.KClO3.KCl.NaCl.BaCO3.CuSO4.Na2CO3等无色气体:空气.O2.H2.CO2.CO.CH4.N2.SO2刺激性气味气体:SO2.HCl.HNO3等无色透明:金刚石.干冰以及大部分酸.碱.盐的溶液和酒精.乙酸的溶液四.熟记一些物质的学名.俗名及对应的化学式Hg 汞(水银) CO2二氧化碳(干冰) CO 一氧化碳(煤气) CH4甲烷(沼气天然气) CaO 氧化钙(生石灰) Ca(OH)2氢氧化钙(熟石灰.消石灰) CaCO3碳酸钙(石灰石.大理石) NaCl 氯化钠(食盐) KMnO4高锰酸钾(灰锰氧) C2H5OH 乙醇(酒精) CH3COOH 乙酸(醋酸) NaOH 氢氧化钠(烧碱.苛性钠) Na2CO3碳酸钠(纯碱.苏打) NaHCO3碳酸氢钠(小苏打) HCl 氢氯酸(盐酸) CuSO4·) CuSO4·5H2O5H2O 五水硫酸铜(胆矾.蓝矾) (NH4)2SO4硫酸铵(硫铵) NH4HCO3碳酸氢铵(碳铵) Cu2(OH)2CO3碱式碳酸铜(铜绿) NH4NO3硝酸铵(硝铵) K2CO3碳酸钾(草木灰主要成分)五.化学反应类型1.化合反应:A+B→C :A+B→C2.分解反应:C→A+B :C→A+B3.置换反应:A+BC→B+AC :A+BC→B+AC4.复分解反应:AB+CD→AD+CB1. 镁在空气中燃烧:2Mg + O2 点燃点燃2MgO 2. 铁在氧气中燃烧:3Fe + 2O2 点燃点燃 Fe3O4 3. 铜在空气中受热:2Cu + O2 加热加热2CuO 4. 铝在空气中燃烧:4Al + 3O2 点燃点燃2Al2O3 5. 氢气中空气中燃烧:2H2 + O2 点燃点燃2H2O 6. 红磷在空气中燃烧:4P + 5O2 点燃点燃2P2O5 7. 硫粉在空气中燃烧: S + O2 点燃点燃SO2 8. 碳在氧气中充分燃烧:C + O2 点燃点燃CO2 9. 碳在氧气中不充分燃烧:2C + O2 点燃点燃2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃点燃2CO2 11. 甲烷在空气中燃烧:CH4 + 2O2 点燃点燃CO2 + 2H2O 12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃点燃 2CO2 + 3H2O 13. 葡萄糖缓慢氧化:C6H12O6+6O2点燃6CO2 + 6H2O二.几个分解反应:14. 水在直流电的作用下分解:2H2O 通电通电2H2↑+ O2 ↑2H2↑+ O2 ↑ 15. 加热碱式碳酸铜:Cu2(OH)2CO3 加热加热2CuO + H2O + CO2↑2CuO + H2O + CO2↑ 16. 利用过氧化氢和二氧化锰的混合物制氧气 2 H2O2 = 2H2O+ O2 ↑2 H2O2 = 2H2O+ O2 ↑17. 加热高锰酸钾:2KMnO4 加热加热K2MnO4 + Mn K2MnO4 + MnO2 + O2↑O2 + O2↑O2 + O2↑ 18. 碳酸不稳定而分解:H2CO3 = H2O + CO2↑:H2CO3 = H2O + CO2↑19. 高温煅烧石灰石:CaCO3 高温高温CaO + CO2↑CaO + CO2↑ 20. 加热碳酸氢铵:NH4HNO3加热H2O + CO2↑+NH3↑H2O + CO2↑+NH3↑三.几个氧化还原反应:21. 氢气还原氧化铜:H2 + CuO 加热加热Cu + H2O 22. 木炭还原氧化铜:C+ 2CuO 高温高温2Cu + CO2↑2Cu + CO2↑ 23. 焦炭还原氧化铁:3C+ 2Fe2O3 高温高温4Fe + 3CO2↑4Fe + 3CO2↑ 24. 焦炭还原四氧化三铁:2C+ Fe3O4 高温高温3Fe + 2CO2↑3Fe + 2CO2↑ 25. 一氧化碳还原氧化铜:CO+ CuO 加热加热 Cu + CO2 26. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温高温2Fe + 3CO2 27. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温高温3Fe + 4CO2 四.单质.氧化物.酸.碱.盐的相互关系(1)金属单质金属单质 + 酸 -------- 盐 + 氢气氢气(置换反应) 28. 锌和稀硫酸反应:Zn + H2SO4 === ZnSO4 + H2↑:Zn + H2SO4 === ZnSO4 + H2↑29. 铁和稀硫酸反应:Fe + H2SO4 =:Fe + H2SO4 === FeSO4 + H2↑== FeSO4 + H2↑== FeSO4 + H2↑ 30. 镁和稀硫酸反应:Mg + H2SO4 === MgSO4 + H2↑:Mg + H2SO4 === MgSO4 + H2↑ 31. 铝和稀硫酸反应:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑ 32. 锌和稀盐酸反应:Zn + 2HCl === ZnCl2 + H2↑:Zn + 2HCl === ZnCl2 + H2↑ 33. 铁和稀盐酸反应:Fe + 2HCl === FeCl2 + H2↑:Fe + 2HCl === FeCl2 + H2↑ 34. 镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑:Mg+ 2HCl === MgCl2 + H2↑ 35. 铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 + 3:2Al + 6HCl === 2AlCl3 + 3H2↑H2↑H2↑(2)金属单质金属单质 + 盐(溶液) ---另一种金属另一种金属 + 另一种盐 36. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 37. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu 38. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物碱性氧化物 +酸 -------- 盐 + 水 39. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O 40. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O 41. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O 42. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O 43. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O 44. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物酸性氧化物+碱 -------- 盐 + 水 43.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 = Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O :Ca(OH)2 + CO2 == CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O :Ca(OH)2 + SO2 == CaSO3 ↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O 49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O 50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 == CuCl2 + 2H2O 51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O 52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 = FeCl3 + 3H2O 53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O 54.硫酸和烧碱反应:H2SO4 + 2NaOH = Na2SO4 + 2H2O 55.硫酸和氢氧化钾反应:H2SO4 + 2KOH = K2SO4 + 2H2O 56.硫酸和氢氧化铜:H2SO4 + Cu(OH)2 = CuSO4 + 2H2O 57. 硫酸和氢氧化铁:3H2SO4 + 2Fe(OH)3= Fe2(SO4)3 + 6H2O 58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O 59.氨水和硫酸反应:2NH3·:2NH3·H2O+H2SO4==(NH4)2SO4+2H2O H2O+H2SO4==(NH4)2SO4+2H2O(6)酸 + 盐 -------- 另一种酸另一种酸+ 另一种盐 59.大理石与稀盐酸:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 60.(灭火器原理): Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑): Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 61.碳酸镁与稀盐酸: MgCO3 + 2HCl = MgCl2 + H2O + CO2↑: MgCO3 + 2HCl = MgCl2 + H2O + CO2↑ 62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3:HCl + AgNO3 === AgCl↓ + HNO3 63.硫酸和碳酸钠:Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑:Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ 64.硫酸和氯化钡溶液:H2S :H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl O4 + BaCl2 = BaSO4 ↓+ 2HCl O4 + BaCl2 = BaSO4 ↓+ 2HCl(7)碱 + 盐 -------- 另一种碱另一种碱 + 另一种盐:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 65氢氧化钠与硫酸铜:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4:3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl66氢氧化钠与氯化铁:3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl:2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl:2NaOH + CuCl2 = Cu(OH)2↓ + 2NaClCa(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH 69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH (8)盐 + 盐 ----- 两种新盐:NaCl + AgNO3 = AgCl↓ + NaNO370.氯化钠和硝酸银:NaCl + AgNO3 = AgCl↓ + NaNO3:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl71.硫酸钠和氯化钡:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO45H2O 加热:CuSO4·5H2O76. 硫酸铜晶体受热分解:CuSO4·加热 CuSO4 + 5H2O5H2O:CuSO4 + 5H2O ==== CuSO4·5H2O 77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·。
专题12 化学式与化学用语(解析版)

专题十二化学式与化学用语【复习目标】1、了解化学式的概念及涵义,掌握一些简单化学式的写法和读法,理解化学式前和化学式中有关数字的不同涵义;2、掌握化合价中元素化合价的一些规律,熟记一些常见的化合价,并学会根据化学式计算化合价的方法,能利用化合价推求化学式;3、了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量计算物质的组成;4、掌握不同位置的数字的含义。
【命题解读】1、化学式的意义及相关计算:本考点常以选择题和计算题的形式进行考查,考查的命题点有:该化学式的元素组成、原子构成、物质的分类、相对分子质量、原子个数比、元素质量比、某元素质量分数。
通常在物质类别上借助有机物的化学式来考查意义及相关计算。
2、化合价的计算:本考点常以选择题和填空与简答题的形式进行考查,考查的命题点有:结合新信息,直接计算出化学式中某元素的化合价、判断化合价的正误等。
3、化学用语:本考点常以选择题和填空题的形式进行考查,考查的命题点有:根据给出的信息,描述化学符号所表示的意义;判断化学符号与所描述的意义是否对应等。
【考点梳理】考点1:化学式考点2:化学式的计算1.化学式量(相对分子质量):化学式量=化学式中各原子的相对原子质量的总和。
2.元素的质量比:化合物中各元素的质量比=各元素原子的相对原子质量乘以原子个数的比值。
3.元素的质量分数:某化合物中某元素的质量分数=某元素原子的相对原子质量总和除以化学式量。
4.化合物中某元素的质量:化合物中某元素的质量=元素的质量分数乘以化合物的质量。
考点3:化合价1、数值:由1个原子得失电子数或形成的共用电子对决定的。
2、表示方法:在元素符号或原子团的正上方,先写正负号,再写数值,数值是1时,不省略。
3、常见元素或原子团的化合价:4(2)在化合物中,各元素正负化合价的代数和为零。
(3)在同一物质中,同种元素化合价可以不同,如:NH4NO3(4)同一元素在不同化合物中可以显示不同化合价。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、初中常见化学物质的名称.分类及化学式
一、单质
1、非金属单质。
固体有:碳C (金刚石、石墨) ;硅Si;硫S;红磷(白磷)P;碘I2 ;
液体有:溴Br2 ;
气体有:氧气O2 ;氮气N2;氢气H2;氯气Cl2 ;氟气F2;
(稀有气体有:氦气He ;氖气Ne ;氩气Ar 等)
2、金属单质。
钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn 铁Fe 锡Sn 铅Pb
铜Cu 汞Hg 银Ag 铂Pt 金Au 锰Mn、钡Ba
二、化合物(无机化合物)
1、氧化物
①非金属氧化物有:
水H2O 过氧化氢(双氧水)H2O2一氧化碳CO 二氧化碳CO2
二氧化氮NO2 五氧化二磷P2O5 二氧化硫SO2
②金属氧化物有:
氧化钠Na2O 氧化镁MgO 氧化铝Al2O3 氧化钾K 2O 氧化钙CaO(生石灰) 氧化锌ZnO 氧化亚铁FeO 氧化铁Fe2O3 四氧化三铁Fe3O4 氧化铜CuO 氧化汞HgO 氧化银Ag 2O 二氧化锰MnO2 氧化钡Ba O
2、酸:盐酸HCl 硫酸H2SO4碳酸H2CO3硝酸HNO3 磷酸H3PO4
3、碱:
氢氧化钠NaOH (苛性钠、火碱、烧碱) ;氢氧化钙Ca(OH)2(熟石灰、消石灰);
氢氧化钾KOH ;氢氧化钡Ba (OH)2 ;氨水NH3·H2O ;氢氧化铜Cu (OH)2 氢氧化铁Fe (OH)3 ;氢氧化亚铁Fe (OH)2 氢氧化铝Al (OH)3 氢氧化镁Mg (OH)2 3、盐:①氯化物:氯化铵NH4Cl
氯化钠NaCl 氯化镁MgCl2 氯化铝AlCl3 氯化钾KCl 氯化钙CaCl2 氯化锌ZnCl2 氯化亚铁FeCl2 氯化铁FeCl3 氯化铜CuCl2 氯化银AgCl 氯化钡Ba Cl2
②硫酸盐:硫酸铵(NH4)2SO4
硫酸钠Na2SO4 硫酸镁MgSO4硫酸铝Al2(SO4)3硫酸钾K 2SO4 硫酸钙CaSO4硫酸锌ZnSO4硫酸亚铁FeSO4 硫酸铁Fe2(SO4)3 硫酸铜CuSO4 硫酸钡BaSO4硫酸氢铵NH4H SO4
③碳酸盐:碳酸铵(NH4) 2CO3
碳酸钠Na2CO3(纯碱)碳酸钾K2CO3碳酸钙CaCO3碳酸钡BaCO3
碳酸氢钠NaHCO3 (小苏打)
④硝酸盐:硝酸铵NH4NO3
硝酸钠NaNO3硝酸镁Mg(NO3)2 硝酸铝Al(NO3)3 硝酸钾KNO3 硝酸钙Ca(NO3)2硝酸锌Zn (NO3)2 硝酸亚铁Fe(NO3)2 硝酸铁Fe(NO3)3 硝酸铜Cu(NO3)2
硝酸钡Ba (NO3)2 硝酸银AgNO3
⑤铵盐:
氯化铵NH4Cl 碳酸铵(NH4) 2CO3碳酸氢铵NH4HCO3硝酸铵NH4NO3
硫酸铵(NH4)2SO4 硫酸氢铵NH4H SO4
⑥其它:
氯酸钾KClO3高锰酸钾KMnO4锰酸钾K2MnO4 氨气NH3
磷酸钙Ca3(PO4)2
三、化合物(有机化合物)
甲烷CH4乙醇(酒精) C2H5OH 醋酸CH3COOH 葡萄糖C6H12O6
甲醛CH2O 尿素CO(NH2) 2
蛋白质糖类维生素等
天然的有机高分子材料:棉(花)、(羊)毛、(蚕)丝、麻、天然橡胶、等
三大合成材料:塑料(聚乙烯、聚氯乙烯、酚醛)、合成纤维(涤沦、锦沦、腈沦)、合成橡胶。
四、附: 物质的组成、构成及分类
组成:物质(纯净物)由元素组成
原子:金属、稀有气体、非金属固体,如:Fe、Ne、S 。
构成分子:氯化氢由氯化氢分子构成。
如H2O、H2、O2、O3、
物质离子:NaCl等由阴.阳离子构成离子化合物
混合物(多种物质)如:空气.天燃气.石油等
分类单质:金属、非金属、稀有气体Fe、O2、Ar。
纯净物(一种元素)
(一种物质)有机化合物,如:CH4
化合物:氧化物,如:H2O、
(多种元素)酸,如:H2SO4
无机化合物碱,如:Ca(OH)2
盐,如:NaCl
三常见离子符号
钾离子:K+钠离子:Na+氯离子:C l–银离子:Ag+、
氢离子:H+钙离子:Ca2+镁离子:Mg2+钡离子:Ba2+、
锌离子:Zn2+汞离子:Hg2+铝离子:Al3+氧离子:O2–、硫离子:S2–铜离子:Cu2+亚铜离子:Cu+铁离子:Fe3+亚铁离子:Fe2+
硝酸根离子:NO3–氢氧根离子:OH–、铵根离子:NH4+
硫酸根离子:SO42–碳酸根离子:CO32–磷酸根离子:PO43–
四、元素符号周围数字的意义
a :表示有a 个R 粒子(原子、分子或离子等)
b :表示一个粒子中含有b 个某原子
c :表示一个R 离子带c 个正(或负)电荷
d :表示(某化合物中)R 元素的化合价为±d 价 例子:○a :○1
、 2 H :2表示“2个氢原子”;
3 H 2O :3表示“3个水分子”;
4 CO 32– :4表示“4个碳酸根离子”;
○
b :○2、4 H 2CO 3 : 2表示“一个碳酸分子中含有2个氢原子”; 3表示“一个碳酸分子中含有3个氧原子”;
○
c :○3、3 SO 42–:2表示“一个硫酸根离子带2个单位负电荷”; 3Fe 2+
: 2表示“一个亚铁离子带2个单位正电荷”; ○d :○4:OH : 1表示“氢氧根的化合价为-1价”; NH 4 : 1表示“铵根的化合价为+1价”;
KClO 3: 5表示氯酸钾中氯元素的化合价为+5价;
O : 2表示“氧元素的化合价为-2价”;
五、 化学式的意义:
○1、表示“水”。
——(宏观意义)表示一种物质;
○2、表示“1个水分子”。
——(微观意义)表示一个分子;
○3、表示“水是由氢元素、氧元素组成”。
——(宏观)表示某物质是由什么元素组成的
○
4、表示“1个水分子由2个氢原子和1个氧原子构成” ; ——(微观)表示某物质的分子由什么粒子构成
六、 元素符号的意义:
+ 1
-1
+5 -2
○1、表示“氧元素”。
——(宏观意义)表示某种元素;
○2、表示“1个氧原子”。
——(微观意义)表示该种元素的一个原子; ○1、表示“碳元素”。
——(宏观意义)表示某种元素; ○2、表示“1个碳原子”。
——(微观意义)表示该种元素的一个原子; ○3、表示“碳”。
——(宏观意义)注意:*有些还可 表示一种单质 ;。
