菌落总数检测操作规程(国标word版)
国标菌落总数检测方法

国标菌落总数检测方法引言:菌落总数是指在一定的培养条件下,菌落形成的数量。
菌落总数检测是食品微生物检验中的一个重要指标,用于评估食品中微生物的污染程度和卫生质量。
本文将介绍国标菌落总数检测方法的步骤和原理。
一、国标菌落总数检测方法的步骤国标菌落总数检测方法主要包括样品制备、平板计数和结果计算三个步骤。
1. 样品制备需要准备好待测样品。
样品通常是食品、水或其他物质,可以是液体或固体。
将样品称取一定的量,然后按照一定的比例与适量的生理盐水进行稀释,以降低样品中菌落的数量,使其适合于后续的菌落计数。
2. 平板计数将制备好的样品溶液均匀地倒入已经凝固的琼脂平板中,然后用无菌铲子或无菌玻璃棒将溶液均匀涂抹在琼脂平板表面。
待琼脂凝固后,将平板倒置放置在恒温培养箱中,以利于菌落的生长。
根据不同的样品特点和需求,可以选择适当的培养温度和时间。
3. 结果计算在菌落生长适宜的条件下,菌落会在琼脂平板上形成。
在菌落形成后,使用计数器或目视观察,对菌落进行计数。
计数时需要遵循一定的规则,如避免重复计数、避免边缘菌落等。
最后,根据计数结果和样品的稀释倍数,计算出菌落总数。
二、国标菌落总数检测方法的原理国标菌落总数检测方法基于微生物在适宜的培养条件下形成可见的菌落的特性进行。
其原理主要包括稀释平板法和菌落计数法。
1. 稀释平板法稀释平板法是菌落总数检测的一种常用方法。
通过将样品与一定量的生理盐水进行稀释,使菌落的数量适于计数。
然后将稀释好的样品均匀涂抹在琼脂平板上,使菌落在琼脂上生长形成可见的菌落。
根据样品的稀释倍数和计数得到的菌落数量,计算出菌落总数。
2. 菌落计数法菌落计数法是国标菌落总数检测方法的关键步骤。
在菌落生长适宜的条件下,菌落会在琼脂平板上形成。
然后使用计数器或目视观察,对菌落进行计数。
计数时需要遵循一定的规则,如避免重复计数、避免边缘菌落等。
最后,根据计数结果和样品的稀释倍数,计算出菌落总数。
三、国标菌落总数检测方法的应用国标菌落总数检测方法广泛应用于食品、饮用水、药品、化妆品等领域。
细菌总数检查标准操作规程

细菌总数检查标准操作规程1目的建立规范细菌总数检查标准操作规程,确保检查操作正确。
2范围适用于本公司的细菌总数检查操作。
3职责4术语及定义无5 内容5.1实验5.1.1仪器设备:电热恒温培养箱、电动移液器、生物安全柜、电子天平、PH计。
水浴锅、研钵、玻璃珠、三角瓶。
5.1.2试剂:生理盐水、卵磷脂吐温80-营养琼脂培养基、吐温80、液体石蜡、0.5%氯化三苯四氮唑。
5.1.3耗材:10 mL刻度移液管、90mm培养皿5.2实验前准备5.2.1检查样本是否保持原有的包装状态。
容器不应有破裂,在检验前不得打开,防止样品被污染。
5.2.2接到样品后,应立即登记,编写检验序号,并按检验要求尽快检验。
5.2.3若只有一个样品而同时需做多种分析,如微生物、毒理、化学等,则宜先取出部分样品做微生物检验,再将剩余样品做其他分析。
5.2.4在检验过程中,从打开包装到全部检验操作结束,均须防止微生物的再污染和扩散,所用器皿及材料均应事先灭菌,全部操作应在符合生物安全要求的实验室中进行。
5.2.2供试品处理5.2.2.1液体样品5.2.2.1.1.水溶性的液体样品,用灭菌吸管吸取10mL 样品加到90mL 灭菌生理盐水中,混匀后,制成1:10 检液。
5.2.2.1.2油性液体样品,取样品10g,先加5mL灭菌液体石蜡混匀,再加10mL灭菌的吐温80,在40℃—44℃水浴中振荡混合10min,加入灭菌的生理盐水75mL(在40℃—44℃水浴中预温),在40℃—44℃水浴中乳化,制成1:10 的悬液。
5.2.2.2膏、霜、乳剂半固体状样品5.2.2.2.1亲水性的样品:称取10g,加到装有玻璃珠及90mL 灭菌生理盐水的三角瓶中,充分振荡混匀,静置15min。
用其上清液作为1:10 的检液。
5.2.2.2.2疏水性样品:称取10g,置于灭菌的研钵中,加10mL 灭菌液体石蜡,研磨成粘稠状,再加入10mL 灭菌吐温80,研磨待溶解后,加70mL 灭菌生理盐水,在40℃—44℃水浴中充分混合,制成1:10 检液。
简述菌落总数检测程序

菌落总数检测程序是一项常见的微生物检测方法,其目的是确定样品中存在的微生物数量,以评估食品、饮料、制药和环境等领域的卫生状况。
本文将介绍菌落总数检测程序的步骤、工具和注意事项。
1. 样品采集首先需要从待测样品中采集适量的样品,并保证样品的代表性和均匀性。
在采样过程中需要使用无菌器具,并避免手部接触样品,以避免污染。
2. 样品预处理为了减少菌落总数检测时的误差,需要对样品进行预处理。
不同样品的预处理方式不同,但通常包括以下步骤:(1)对固体样品进行破碎和混合,确保样品的均匀性;(2)对液态样品进行搅拌或振荡,使样品中的微生物均匀分布;(3)对含有大量背景杂质的样品,如土壤和食品等,需要进行稀释处理,以便于后续操作。
3. 制备培养基制备培养基是菌落总数检测中至关重要的一步。
各种微生物需要不同的培养基进行培养,但是通常使用通用培养基,如营养琼脂培养基、普通琼脂培养基等。
在制备培养基时需要注意以下几点:(1)使用高质量的培养基原料和纯水;(2)遵循制备指南,按照正确的比例和顺序添加各种原料;(3)将培养基加热至沸腾,以杀死其中的细菌和孢子。
4. 分装和接种将经过预处理的样品分装到无菌平板上,并将平板放置在无菌工作台上。
然后使用无菌技术将培养基倒在平板上,并将培养基均匀涂抹。
最后使用无菌的匙子或移液器接种样品,或者将样品滴入培养基中,并确保接种均匀。
5. 培养和计数将接种好的平板在恒温培养箱中培养,通常是在30-37℃下进行。
培养时间因不同的微生物而异,但通常是24-72小时。
在培养过程中需要注意以下几点:(1)确保培养箱内的温度和湿度稳定;(2)避免平板受到震动或移动;(3)遵守无菌技术,以避免污染。
在培养结束后,使用计数器对菌落进行计数。
菌落是指可见的单个微生物群体,通常呈圆形或不规则形状,并具有明显的色彩和质地。
每个菌落代表一个微生物单元,因此可以根据菌落数量来评估样品中的微生物总数。
6. 结果分析根据菌落总数检测结果,可以评估样品的微生物质量。
国标菌落总数检测方法

国标菌落总数检测方法一、引言菌落总数是指在一定条件下,通过菌落计数方法,测定在样品中存在的微生物总数。
它是评价食品、水质和环境卫生状况的重要指标之一。
国标菌落总数检测方法是指根据国家标准规定的菌落总数检测方法进行微生物总数的测定。
本文将详细介绍国标菌落总数检测方法的原理、步骤及其应用领域。
二、原理国标菌落总数检测方法基于菌落形成的原理,通过将待测样品进行适当稀释,并在寒暖培养条件下培养一定时间,然后对形成的菌落进行计数。
根据国家标准,通常采用平板计数法和膜过滤法两种方法进行菌落总数的检测。
平板计数法是将适量的待测样品均匀涂布在含有适宜培养基的平板上,然后在适当温度下进行培养,最后对菌落进行计数。
该方法适用于微生物菌落较多的样品,如食品和水样等。
膜过滤法是将待测样品通过特定的膜过滤器,过滤到含有适宜培养基的培养皿中,然后在适当温度下进行培养,最后对膜上形成的菌落进行计数。
该方法适用于微生物菌落较少的样品,如空气和药品等。
三、步骤1. 样品制备:将待测样品按照国家标准要求进行适当稀释,以确保在培养过程中菌落呈现合适的数量。
2. 平板计数法:将稀释好的样品用无菌棉签均匀涂布在含有适宜培养基的平板上,然后倒扣放置在恰当温度下进行培养。
3. 膜过滤法:将稀释好的样品通过无菌膜过滤器过滤到含有适宜培养基的培养皿中,然后倒扣放置在恰当温度下进行培养。
4. 培养:根据国家标准要求,将培养皿或平板在适当温度下培养一定时间,以促使菌落的生长和形成。
5. 计数:在培养时间结束后,使用显微镜或菌落计数器对菌落进行计数,然后根据国家标准计算出菌落总数。
四、应用领域国标菌落总数检测方法广泛应用于食品、水质和环境卫生等领域。
在食品行业中,菌落总数的检测可以评估食品的卫生状况和微生物污染程度,有助于保障食品的安全性;在水质监测中,菌落总数的检测可以评估水质的卫生状况和微生物污染程度,有助于确保饮用水的安全性;在环境卫生监测中,菌落总数的检测可以评估环境卫生状况和微生物污染程度,有助于维护公共卫生和环境健康。
菌落总数检验操作规程

A.1月桂基硫酸盐胰蛋白胨(LST )肉汤A.1.1成分胰蛋白胨或胰酪胨20.0 g氯化钠5.0 g乳糖5.0 g磷酸氢二钾(K2HPO4)2.75 g磷酸二氢钾(KH2PO4)2.75 g月桂基硫酸钠0.1 g蒸馏水1 000 mL pH 6.8±0.2 制法将上述成分溶解于蒸馏水中,调节pH。
分装到有玻璃小倒管的试管中,每管10 mL 。
121 ℃高压灭菌15 min 。
菌落总数检验操作规程一、目的建立菌落总数检验的标准操作程序,使操作过程规范化。
二、适用范围适用于菌落总数的检验操作。
三、职责1.检验人员严格按检验操作规程进行检验。
2.QC主管监督检查执行情况。
四、程序1.范围本方法适用于食品中菌落总数(Aerobic plate count)的测定2.术语和定义菌落总数:食品检样经过处理,在一定条件下(如培养基、培养温度和培养时间等)培养后,所得每g(mL)检样中形成的微生物菌落总数。
3. 设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:3.1 恒温培养箱:36 ℃±1 ℃,30 ℃±1 ℃。
3.2冰箱:2 ℃~5 ℃。
3.3 恒温水浴箱:46 ℃±1 ℃。
3.4天平:感量为0.1 g。
3.5均质器。
3.6振荡器。
3.7无菌吸管:1 mL(具0.01 mL 刻度)、10 mL(具0.1 mL 刻度)或微量移液器及吸头。
3.8 无菌锥形瓶:容量250 mL、500 mL。
3.9无菌培养皿:直径90 mm。
3.10 pH计或pH比色管或精密pH试纸。
3.11放大镜或和菌落计数器。
4.培养基和试剂4.1 平板计数琼脂培养基:见附录A 中A.1。
4.2 磷酸盐缓冲液:见附录A中A.24.3 无菌生理盐水:见附录A中A.3。
5.检验程序菌落总数的检验程序见图1。
图1 菌落总数的检验程序6.操作步骤6.1 样品的稀释6.1.1 固体和半固体样品:称取25 g 样品置盛有225 mL 磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 r/min~10000 r/min 均质 1 min~2 min,或放入盛有225 mL 稀释液的无菌均质袋中,用拍击式均质器拍打 1 min~2 min,制成1:10 的样品匀液。
菌落总数检测操作规程

微生物检测操作规范1范围本标准规定了食品中菌落总数的测定方法本标准适用于遂平克明面业有限公司方便面生产线微生物控制及验证计划。
本标准适用于遂平克明面业有限公司方便面产品菌落总数、大肠菌群检测。
2 规范性引用标准GB 4789.1-2016《食品安全国家标准食品微生物学检验总则》。
GB/T 4789.3-2003《食品安全国家标准食品微生物学检验大肠菌群计数》。
GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》。
4 设备和材料恒温培养箱:36℃±1℃。
恒温水浴箱:46℃±1℃。
天平:感量为0.1g。
无菌吸管:1ml(具有0.01ml刻度)、10ml(具有0.1ml刻度)。
无菌培养皿:直径90mm。
无菌锥形瓶:容量500ml;或225ml塑料稀释瓶(带内垫,可高温灭菌)。
灭菌试管:16mm×160mm;或10ml-20ml无菌管。
显微镜:10×-100×4 培养基和试剂平板计数琼脂培养基:GB 4789.2-2016 附录A.1。
无菌生理盐水:GB 4789.2-2016 附录A.3。
乳糖胆盐发酵管:按GB/T 4789.3-2003中4.9规定。
伊红美蓝琼脂平板:按GB/T 4789.3-2003中4.25规定。
乳糖发酵管:按GB/T 4789.3-2003中2.2规定。
EC肉汤:按GB/T 4789.28-2003中4.11规定。
格兰仕染色液:按GB/T 4789.3-2003中4.9规定。
5菌落总数检验程序实验前准备移液管、三角瓶、试管包扎、灭菌移液管:洗净烘干后在吸管粗头顶端约0.5cm处,塞上一小段棉花,后用4-5cm宽的报纸或牛皮纸将其以下图所示包扎好。
三角瓶包扎图例将包扎后的器具放入灭菌锅,121℃ 15min灭菌。
a.样品处理面饼样品经粉碎机粉碎后,称取25g粉碎样加入装有225ml无菌生理盐水的稀释瓶内,充分振摇,做成1:10的均匀稀释液。
菌落总数测试片安全操作及保养规程

菌落总数测试片安全操作及保养规程前言菌落总数测试片是在食品、饮料、制药等行业中广泛应用的一种实验室用品,用于检测样品中的微生物数量。
正确的操作和保养,不仅能够保证测试数据的准确性,还能延长设备的使用寿命。
本文档旨在为使用菌落总数测试片的实验室人员提供安全操作及保养规程,以便正确且有效地使用该设备。
安全操作规程1.检测前准备工作在进行菌落总数测试前,需要进行一些准备工作。
•首先,检查试剂盒是否完整、完好。
•其次,需要对实验室进行清洁,确保试样不会受到外来污染。
•最后,检查检测设备是否工作正常。
2.操作步骤具体的菌落总数测试操作步骤如下:1.将手持菌落计瓶插入加热设备中,加热到80℃左右(不要超过90℃)。
2.准备好待测样品,并使用消毒液将样品平台擦拭消毒。
待样品平台干燥后,打开试剂盒,取出测试片。
3.拿起测试片,用过滤棉球沾取少量样品,涂在测试片的圆形区域上,记得不要涂满,要注意对称,以避免对测试结果的影响。
4.将测试片放入一个透明的塑料袋里,将原袋弯角45°折叠,收紧口部,放置在加热设备中,加热时间为30min ± 1min。
5.取出加热设备中的透明袋,打开袋口,拿起测试片,将其反转在富营养液培养皿中,培养时间为48小时± 4小时。
6.在培养后的菌落数量区域,数清菌落数量,并将结果记录在实验记录簿上。
3. 注意事项在使用菌落总数测试片过程中,还需要注意以下事项:1.尽量避免使用过期的试剂盒和菌落计瓶。
2.操作过程中需要佩戴手套和口罩。
3.遵循操作规程,严禁进行任何私自操作或修改设备设置。
4.由专人负责使用和保养设备,不得擅自借用或转移使用。
5.每次操作后,要及时清洗设备以保证设备的清洁度和准确性。
保养规程菌落总数测试片是一种高精度、高灵敏度的实验室设备,因此需要进行专业的保养和维修。
1.日常保养日常保养是延长菌落总数测试片使用寿命和保证测试结果准确性不可缺少的一部分。
菌落总数测定操作规程1

适用范围:食品检样经过处理,在一定条件下培养(如培养基成分、培养温度和时间、pH、需氧性质等),所得1m1(g)检样中所含菌落的总数。
本方法规定的培养条件下所得结果,只包括一群在营养琼脂上生长发育的嗜中温性需氧的菌落总数。
操作内容:
1、检验程序:
2、操作方法:
2.1 以无菌操作,将检样25g(ml)放于含有225ml灭菌生理盐水或其他稀释液的灭菌玻璃
瓶内(瓶内预置适当数量的玻璃珠)或灭菌乳钵内,经充分振摇或研磨做成1:10的均匀稀释液。
2.2 用1ml 灭菌吸管吸取1:10稀释液1ml,注入含有9ml 灭菌生理盐水或其他稀释液的
试管内(注意吸管尖端不要触及管内稀释液),振摇试管混均,做成1:100的稀释液。
2.3 另取1ml 灭菌吸管,按上条操作顺序,做10倍递增稀释液,如此每递增稀释一次,即
换用1支1ml灭菌吸管。
2.4 根据食品卫生标准要求或对检污染情况的估计,选择2-3个适宜稀释度,分别在做10
倍递增稀释的同时,即以吸取该稀释度的吸管移1ml稀释液于灭菌培养皿内,每个稀释度做2个培养皿。
2.5 稀释液移入培养皿后,应及时将凉至46℃营养琼脂培养基注入培养皿约15ml,并转动培
养皿使混合均匀。
同时将营养琼脂培养基倾入加有1ml稀释液灭菌培养皿内作空白对照。
2.6 待琼脂凝固后,翻转平板,置36℃±1℃温箱内培养48h±1h
3、菌落计数方法:
3.1 做平板菌落计数时,可用肉眼观察,必要时用放大镜,以防遗漏。
在记下各平板的菌落
后,求出同稀释度的各平板平均菌落总数。
菌落总数检验操作规程

菌落总数检验操作规程一、实验室准备工作1.准备培养基:根据实验需求选择适当的培养基,如营养琼脂培养基、大肠埃希氏菌选择性培养基等。
注意培养基的成分和质量。
2.准备培养基平板:测量合适的培养基量并加入培养皿中,使用无菌技术将培养基均匀倒入培养皿,标明编号和日期。
二、样品处理1.准备样品:如食品样品,需要将样品称重并加入适当的生理盐水中,用搅拌器或均质仪进行均匀悬浮。
2.稀释样品:根据实验需要,对样品进行系列稀释。
取适量的悬浮样品,依次加入尺量瓶中的生理盐水,振摇均匀。
三、接种培养1.无菌操作:在无菌工作台内进行操作,穿戴好无菌手套,将培养皿放入工作台上,注意防止污染。
2.接种样品:使用无菌移液器,取适量的稀释样品均匀滴入培养皿上。
3.均匀涂布:使用无菌匀涂棒,将样品在培养皿上均匀涂抹,注意避免混入外来微生物。
四、培养条件1.始菌箱:将接种后的培养皿置于始菌箱中,设定适当的温度和湿度(如37℃,24小时)。
2.孵化箱:将始菌箱中的培养皿转移到恒温培养箱中适当孵育时间,保持适宜温度及湿度。
五、菌落计数1.观察菌落:取出培养好的菌落总数平板,放在均匀光源下观察菌落的形态、颜色、大小等特征,标记异常菌落。
2.计数菌落:使用计数器或显微镜对菌落进行计数,记录结果,并用公式计算菌落总数。
每个菌落总数平板至少计数两遍,计算平均值。
六、数据分析与结果判定1.数据分析:对不同样品的检测结果进行归类整理,统计菌落总数的分布情况。
2.结果判定:根据相应的标准或规定,比较样品的检测结果与标准要求,判定样品是否合格。
七、清洗和消毒1.清洗:将培养皿彻底清洗干净,清除残留的培养基和菌落。
2.消毒:将使用过的器材进行高温高压消毒或化学消毒,确保无菌环境。
以上就是菌落总数检验操作规程的简要示例,实验过程中需严格遵守无菌操作规范,并根据具体实验要求进行相应的调整。
在实验过程中,及时记录实验数据,注意安全操作。
实验完成后,对结果进行统计分析和归档保存。
菌落总数国标

菌落总数国标简介菌落总数是一种常见的微生物分析方法,用于评价食品、水源、空气等样品中微生物的污染情况。
通过统计菌落总数,可以了解样品中存在的细菌、真菌和其他微生物的数量,进而进行适当的卫生措施和监测。
在国际上,每个国家或地区都有自己的菌落总数标准。
本文主要介绍中国的菌落总数国标,即GB 4789.2-2016《食品安全国家标准食品微生物学检验检验菌落总数》。
GB 4789.2-2016GB 4789.2-2016是中国食品安全领域的一个国家标准,于2016年开始实施。
它规定了食品检验中菌落总数的检测方法及其评估标准。
适用范围GB 4789.2-2016适用于各类食品中菌落总数的检测,包括肉、禽、水产品、豆制品、果蔬制品等。
该标准主要用于食品生产企业的自检和卫生监督机构的抽检。
检测方法GB 4789.2-2016规定了两种菌落总数的检测方法,即总数平板法和膜过滤法。
以下是这两种方法的简要步骤:总数平板法1.准备含有适宜营养成分的琼脂平板。
2.将样品适当稀释,然后分别在琼脂平板上均匀涂布。
3.将涂布好的平板培养在适当的温度下,通常为30°C,时间为48小时。
4.统计菌落总数,并计算出菌落形成单位(CFU)。
膜过滤法1.准备含有适宜营养成分的琼脂膜。
2.将样品通过膜过滤器,将样品中的微生物过滤到琼脂膜上。
3.将琼脂膜放置在含有适宜营养成分的平板上,然后培养在适当的温度下,通常为30°C,时间为48小时。
4.统计菌落总数,并计算出菌落形成单位(CFU)。
评估标准GB 4789.2-2016根据菌落总数的大小,将食品分为三个级别:一级、二级和三级。
以下是各级别的评价标准:•一级标准:CFU/g或CFU/mL小于100。
•二级标准:CFU/g或CFU/mL介于100到100,000之间。
•三级标准:CFU/g或CFU/mL大于100,000。
根据菌落总数的级别,可以判断食品的卫生状况和微生物污染的程度。
微生物检验操作规程

微生物检验操作规程为规范检验程序,提高检验结果的准确性,要求微生物检验员严格按照本操作规程检验。
样品准备:准确称取10g±1g样品,剪碎后加入到200ml已灭菌的生理盐水中,充分混匀,静置10分钟,待生理盐水样液自然沉降后取上清液作菌落计数,液体样品可用原液直接做样液。
如果被检样品含有大量吸水树脂材料而导致不能吸出足够样液时,稀释量可按每次50ml递增,直至能吸出足够测试用样液。
在计算细菌菌落总数与真菌菌落总数时相应调整稀释度。
1.细菌菌落总数检测方法1)仪器:培养箱35℃±2℃、天平(精确至0.1g)、医用剪刀、吸球、移液管1ml、250ml锥形瓶、平皿、酒精灯。
2)试液:0.9%生理盐水、营养琼脂。
3)步骤:用已灭菌的1ml移液管移取1ml样液,均匀地洒在平皿上,共接种5个平皿。
然后用冷却至45℃左右熔化的营养琼脂培养基15~20ml倒入每个平皿内混合均匀。
待琼脂凝固后翻转平皿做好记号并置35℃±2℃培养48h后,计算平板上的菌落数。
结果计算:X1=A*K/5式中:X1→细菌菌落总数,cfu/g或cfu/mlA→5块营养琼脂培养基平板上的细菌菌落总数K→稀释度4)如果样品菌落总数超过标准的规定,应进行复检。
将留存的复检样品依前法复测2次,2次结果平均值都达到标准规定,则判定被检样品合格,其中有任何1次结果平均值超过标准规定,则判定被检样品不合格。
2.真菌菌落总数检测方法1)仪器:培养箱25℃±2℃、天平(精确至0.1g)、医用剪刀、吸球、移液管1ml、250ml锥形瓶、平皿、酒精灯。
2)试液:0.9%生理盐水、玫瑰红钠琼脂。
3)步骤:用已灭菌的1ml移液管移取1ml样液,均匀地洒在平皿上,共接种5个平皿。
然后用冷却至45℃左右熔化的玫瑰红钠琼脂培养基15~20ml 倒入每个平皿内混合均匀。
待琼脂凝固后翻转平皿做好记号并置25℃±2℃培养7天,分别于3、5、7天观察,计算平板上的菌落数,如果发现菌落蔓延,以前一次的菌落计数为准。
包装饮用水菌落总数的测定方法操作规程

包装饮用水菌落总数的测定方法操作规程操作规程:包装饮用水菌落总数的测定方法1.实验目的:测定包装饮用水中的菌落总数,评估其卫生安全性。
2.实验器材和试剂准备:-高温高压灭菌器-灭菌平板计数器-包装饮用水样品-琼脂培养基-蒸馏水或纯净水-消毒瓶-无菌试管-螺旋体和乳球菌选择性培养基(可选)3.操作步骤:3.1试剂准备和灭菌操作3.1.1准备琼脂培养基:根据生产商提供的说明书,配制琼脂培养基,并根据需要增加适当的抗生素(如螺旋体和乳球菌选择性培养基)。
3.1.2用蒸馏水或纯净水冲洗培养皿,确保其清洁并无细菌污染。
3.1.3将培养皿倒立放在无菌器皿内,进行高温高压灭菌。
3.1.4灭菌完成后,将培养皿平置在无菌工作台上,待培养基凝固。
3.2取样操作3.2.1使用无菌钳子或消毒瓶打开包装饮用水,将样品瓶口擦拭消毒。
3.2.2在无菌条件下,取适量的包装饮用水样品(通常为10mL),加入一支无菌试管中。
3.3平板涂布和培养3.3.1使用无菌针或无菌量杯,从含有样品的无菌试管中取适量样品。
3.3.2将取样的无菌针或无菌量杯沿培养皿表面迅速来回划线,覆盖整个培养基面积。
3.3.3使用一把灭菌的铲子,平均分配样品于培养基上。
3.4培养和计数3.4.1如果使用了螺旋体和乳球菌选择性培养基,则将琼脂培养基培养皿和选择性培养基培养皿分别标记,并进行相应的培养条件。
3.4.2培养皿倒置,置于恒温培养箱中培养(通常为35-37°C,48小时)。
3.4.3按照要求进行菌落计数,包括可见的典型和非典型菌落。
3.4.4记录每个培养皿上菌落的数量。
4.数据处理和结果分析:4.1计算平均菌落总数:将每个培养皿上的菌落数量相加,并除以培养皿总数,得到平均菌落总数。
4.2结果分析和评估:将测得的平均菌落总数与国家或国际标准进行比较,评估包装饮用水的卫生安全性。
5.注意事项:5.1操作过程中严格遵守无菌操作规范,以防止样品污染和结果失真。
菌落总数测定操作规程

1 规范性引用文件:下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,起随后所有的修改单(不包括勘误的内容)或修订版均不适用与本标准,然而,鼓励根据本标准达成的协议的各方研究是否适用这些文件最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
中华人民共和国药典2005 版附录2 抽样方法成品同一批号的产品中至少随机抽取 3 包装样品,取好的样品应用无菌袋装好,检验前不得打开。
3 设备和材料3.1 冰箱0 C〜4°C。
3.2 恒温培养箱:36C±1 C和25土1C3.3 恒温水浴锅:46C±1C。
3.4 电子天平:0g〜500g,精确至0.01g.3.5 可调试移液枪:1ml〜5ml3.6 旋涡混匀器3.7 薄膜过滤器:三联3.8 灭菌吸管:1ml(具0.01ml 刻度)、10ml (0.1ml 刻度)。
3.9 灭菌锥形瓶:500ml,250ml.3.10 灭菌培养皿:直径约90mm3.11 灭菌剪子、镊子、滤头、移液枪头等。
4 试剂和培养基4.5 0.1%2 , 3, 5-三苯基氯化四氮咗溶液121C, 15min灭菌备用。
4.2 磷酸24.1 营养琼脂培养基:取15.2g营养琼脂培养基溶于400ml水中,装入500ml锥形瓶121C, 15min灭菌备用。
4.2 沙氏琼脂培养基:取25.6g 沙氏琼脂培养基溶于400ml 水中,装入500ml 锥形瓶121C, 15min灭菌备用。
4.3 洗脱液:取0.9g氯化钠溶于100水中(加入2 g山梨酸脂80),装入100ml锥形瓶,另外再取0.9%氯化钠溶液分别以9ml/支分装于试管中121C, 15min灭菌备用。
4.4 75% 乙醇溶液4.5 0.1%2 , 3, 5-三苯基氯化四氮咗溶液121C, 15min灭菌备用。
5 操作步骤5.1 检样稀释及培养5.1.1以无菌操作将检样10g(ml)放于含有100mL灭菌生理盐水灭菌玻璃瓶,经充分振摇制成1 :10 的均匀稀释液。
菌落总数检验操作规程

菌落总数检验操作规程目的:该操作规程用于规范公司产品及原料的活菌数量检验操作。
范围:该操作规程适用于公司要求检查该项的产品和原料的菌落总数检验责任人:微生物检验员,QC主管内容:1 技术依据及原理菌落总数计数采用平板菌落计数法,这是活菌计数方法之一。
该方法以在琼脂平板上,样品经过处理在一定条件下培养后,所得1ml(或1g)检样中形成菌落的总数。
测定结果只反映在规定条件下,只包括一群在平板计数琼脂生长发育的嗜中温需氧菌或兼性厌氧菌的菌落总数。
在进行本法测定时,必须严格按本法规定的条件操作,以免产生实验误差。
2 材料、仪器、试剂的准备及基本要求2.1 无菌室2.1.1 结构和要求无菌室面积不超过10m2,高度不超过2.4m,应采光良好、避免潮湿、远离厕所所及污染区,有缓冲间(2个)、操作间组成。
操作间与缓冲间之间应有样品传递窗(箱),出入操作间和缓冲间的门不应直对。
无菌室应六面光滑平整,能耐受清洗消毒。
墙与地面及墙壁、天花板连接处应呈凹弧形,无缝隙,不留死角。
操作间内不得安装下水道。
无菌室照明灯应嵌装在天花板内,室内光照分布均匀,光照度不低于300勒克斯。
缓冲间和操作间均应设置紫外线杀菌灯(2~2.5W/m3), 紫外线杀菌灯距实验台面高度不超过1 m,并定期检查其辐射强度,辐射强度不低于70µW·cm-2(1 m距离),不符合要求的紫外线杀菌灯应即使更换。
2.1.2 温度、湿度无菌室内温度和相对湿度直接影响紫外线杀菌灯的杀菌效果,故应控制温度18~26℃,相对湿度40~60%。
操作间或净化工作台的洁净空气应保持对环境形成正压,压差不低于4.9Pa。
2.1.3 操作间操作间应安装空气除菌过滤层流装置。
洁净度应不低于10000级,局部净化度100级,或放置同等级净化工作台,并准备药物天平,乙醇灯、打火机、大小橡皮乳头等。
2.1.4 缓冲间缓冲间应有洗手盆,无菌衣、帽、口罩、拖鞋等。
(完整版)菌落总数检测操作规程(国标word版)摘要
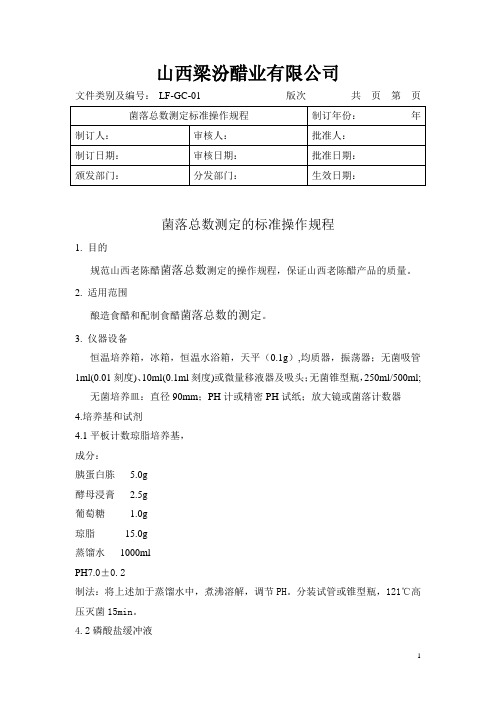
山西梁汾醋业有限公司文件类别及编号:LF-GC-01 版次共页第页菌落总数测定的标准操作规程1. 目的规范山西老陈醋菌落总数测定的操作规程,保证山西老陈醋产品的质量。
2. 适用范围酿造食醋和配制食醋菌落总数的测定。
3. 仪器设备恒温培养箱,冰箱,恒温水浴箱,天平(0.1g),均质器,振荡器;无菌吸管1ml(0.01刻度)、10ml(0.1ml刻度)或微量移液器及吸头;无菌锥型瓶,250ml/500ml;无菌培养皿:直径90mm;PH计或精密PH试纸;放大镜或菌落计数器4.培养基和试剂4.1平板计数琼脂培养基,成分:胰蛋白胨 5.0g酵母浸膏 2.5g葡萄糖 1.0g琼脂15.0g蒸馏水1000mlPH7.0±0.2制法:将上述加于蒸馏水中,煮沸溶解,调节PH。
分装试管或锥型瓶,121℃高压灭菌15min。
4.2磷酸盐缓冲液成分:磷酸二氢钾(KH2PO4) 34.0g蒸馏水500mlPH 7.2制法:贮存液:称取34.0g磷酸二氢钾溶于500ml蒸馏水中,用大约175ml的1mol/L 氢氧化钠溶液调节PH,蒸馏水稀释至1000ml存于冰箱。
稀释液:取贮存液1.25ml,用蒸馏水稀释至1000ml,分装于适宜容器中,121摄氏度高压灭菌15分钟。
4.3无菌生理盐水成分:氯化钠8.5g蒸馏水1000ml制法:8.5克氯化钠溶于100ml蒸馏水中121摄氏度高压灭菌15分钟。
5 检验程序6操作步骤6.1样品的稀释6.1.1固体和半固体样品:称取25 g样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 r/min~10000 r/min 均质1min~2min,或放入盛有225 mL稀释液的无菌均质袋中,用拍击式均质器拍打1 min~2 min,制成1:10的样品匀液。
6.1.2液体样品:以无菌吸管吸取25 mL 样品置盛有225 mL 磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。
菌落总数测定操作规程

1规范性引用文件:下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,起随后所有的修改单(不包括勘误的内容)或修订版均不适用与本标准,然而,鼓励根据本标准达成的协议的各方研究是否适用这些文件最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
中华人民共和国药典2005版附录2 抽样方法成品同一批号的产品中至少随机抽取3包装样品,取好的样品应用无菌袋装好,检验前不得打开。
3设备和材料3.1 冰箱 0℃~4℃。
3.2 恒温培养箱:36℃±1℃和25±1℃3.3 恒温水浴锅:46℃±1℃。
3.4 电子天平:0g~500g,精确至0.01g.3.5 可调试移液枪:1ml~5ml3.6 旋涡混匀器3.7 薄膜过滤器:三联3.8 灭菌吸管:1ml(具0.01ml刻度)、10ml(0.1ml刻度)。
3.9 灭菌锥形瓶:500ml,250ml.3.10 灭菌培养皿:直径约90mm3.11 灭菌剪子、镊子、滤头、移液枪头等。
4试剂和培养基4.5 0.1%2,3,5-三苯基氯化四氮咗溶液121℃,15min灭菌备用。
4.2 磷酸24.1 营养琼脂培养基:取15.2g营养琼脂培养基溶于400ml水中,装入500ml锥形瓶121℃,15min灭菌备用。
4.2 沙氏琼脂培养基:取25.6g沙氏琼脂培养基溶于400ml水中,装入500ml锥形瓶121℃,15min灭菌备用。
4.3 洗脱液:取0.9g氯化钠溶于100水中(加入2 g山梨酸脂80),装入100ml锥形瓶,另外再取0.9%氯化钠溶液分别以9ml/支分装于试管中121℃,15min灭菌备用。
4.4 75%乙醇溶液4.5 0.1%2,3,5-三苯基氯化四氮咗溶液121℃,15min灭菌备用。
5 操作步骤5.1检样稀释及培养5.1.1以无菌操作将检样10g(ml) 放于含有100mL灭菌生理盐水灭菌玻璃瓶,经充分振摇制成1:10的均匀稀释液。
食品微生物学检验菌落总数测定国标

食品微生物学检验菌落总数测定国标1. 前言好啦,今天咱们聊聊一个不那么热门,但绝对重要的话题——食品微生物学检验中的菌落总数测定。
说到这,很多小伙伴可能会皱起眉头,觉得这事儿离自己有点远,实际上,它和我们每天吃的东西密切相关呢!就像那句老话说的:“民以食为天”,吃得安全,咱们才有精力去干其他事情,不是吗?2. 什么是菌落总数?2.1 基本概念首先,菌落总数到底是个啥呢?简单来说,菌落总数就是在特定的培养基上,经过一段时间培养后,能够看到的细菌数量的总和。
这就好比在一块田地里,你数出有多少棵小苗。
哦,对了,当然这些小苗可不是蔬菜,而是一些微小的细菌。
它们可能是有益的,也可能是有害的,所以我们得好好查查!2.2 重要性那么,为啥我们要测这个菌落总数呢?这里面有个“门道”。
如果这个数值过高,说明食品可能被污染了,吃下去就有风险。
想想看,要是你吃的蛋糕上面跑了一群细菌,那可真是“甜蜜的负担”啊,吃了不但没啥好处,还可能拉肚子,这就得不偿失了!所以,了解菌落总数,就像是给食品加了一道安全锁,能让我们更放心地享受美食。
3. 如何进行菌落总数测定?3.1 检测步骤现在,我们来聊聊这个测定是怎么进行的。
一般来说,测定过程分几个步骤,听起来可能有点复杂,但别担心,咱们一步步来,绝对能搞定!首先,咱们需要准备一个无菌的培养基,常见的比如营养琼脂。
这就像是给细菌准备的“豪华酒店”,要干净、舒适,细菌才愿意来入住。
接着,就需要将待测食品样品进行稀释。
想象一下,你的美食是个“大胃王”,可不能让它一口气吃下去太多细菌,不然肚子受不了。
然后,咱们将稀释后的样品倒在培养基上,轻轻摇匀,放入恒温箱中,让细菌们慢慢“开派对”。
大约24到48小时后,打开恒温箱,就能看到小小的菌落在培养基上欢快地生长。
3.2 结果分析等菌落长出来后,就得开始数数了。
数菌落就像数星星,虽然不一定每颗都能看得清楚,但大致上能看到它们的数量。
然后,再根据稀释倍数,计算出样品中细菌的总数。
国标菌落总数检测方法

国标菌落总数检测方法国标菌落总数检测方法是一种常用的微生物检测方法,用于评估给定样品中的微生物污染水平。
该方法可以应用于食品、环境、水源等多个领域,以评估样品中微生物的数量。
下面将详细介绍国标菌落总数检测方法的步骤和原理。
一、步骤1.准备培养基:根据需要进行培养的菌种不同,可以选择适当的培养基。
通常,使用含水解鱼肉膏、蛋白胨、肉汤、大豆胨等成分的富含营养物质的琼脂培养基。
2.准备样品:样品可以是食品、水样、环境表面样品等。
根据不同的样品,采取适当的方法进行取样,确保样品代表性。
3.稀释样品:为了获得适当的菌落数,通常需要对样品进行稀释。
将一定数量的样品与适量的稀释液混合均匀,得到一系列不同浓度的稀释液。
4.涂布方法:将上一步稀释好的样品涂布于琼脂培养基上。
可以采用平板涂布法或膜过滤法。
平板涂布法是将稀释好的样品倒入已凝固的琼脂平板上,用涂布棒均匀涂布。
膜过滤法是将稀释好的样品过滤到已凝固的膜上,将膜放在培养基上。
5.培养条件:根据需要培养的菌种不同,选择合适的培养温度和时间。
一般而言,大多数细菌在30-37℃下培养24-48小时。
6.菌落计数:培养一定时间后,可以观察到样品中的菌落。
使用显微镜或计数板等工具,对菌落进行计数。
7.统计和计算:根据计数结果和稀释倍数,可以计算出原始样品中的菌落总数。
二、原理微生物培养基提供了微生物生长所需的营养物质。
在适当的温度和湿度下,微生物会在培养基上生长形成菌落。
每个菌落代表一种或多种微生物。
根据菌落的形态、大小和颜色等特征,可以初步推测菌种。
计数并统计菌落总数可以评估样品中微生物的数量。
在菌落总数检测方法中,样品的稀释是为了确保菌落的数量适宜且分散均匀。
过高的菌落数量可能导致菌落过于密集,不容易准确计数。
过低的菌落数量可能导致菌落太稀疏,有些菌落容易被忽略。
选择合适的稀释倍数可以使得菌落数量适宜,方便计数并计算菌落总数。
总结起来,国标菌落总数检测方法是一种常用的微生物检测方法,通过样品的稀释、涂布、培养和计数等步骤,评估给定样品中的微生物数量。
菌落总数操作手册

菌落总数操作手册一、引言菌落总数是一种常用的微生物检测方法,用于评估食品、水源和医药产品的微生物污染情况。
本操作手册旨在提供详细的步骤和技巧,帮助实验人员正确、准确地进行菌落总数测试。
二、实验室准备1. 实验室环境:确保实验室内的空气清洁,减少空气中微生物的干扰。
2. 实验室设备准备:2.1 培养基:使用适宜的培养基,如TSA(Trypticase Soy Agar)。
2.2 培养基平板:准备含有适量的培养基的平板,用于菌落生长。
2.3 微量移液器和吸头:用于取样和移液,确保无菌。
2.4 灭菌器:用于灭菌实验室工具和试剂。
2.5 培养箱:用于保存培养基平板在适宜的温度下孵育。
三、样品采集和处理1. 样品采集:根据需要采集待测样品,注意采样工具和容器的无菌处理,防止外界污染。
2. 样品处理:2.1 固体样品:将固体样品称量,加入适量的生理盐水或缓冲液中,进行均匀悬浮。
2.2 液体样品:取适量的液体样品,按照一定比例加入生理盐水或缓冲液中进行稀释。
2.3 混合样品:按照比例混合不同样品,确保样品的均匀分布。
四、菌落计数操作步骤1. 稀释处理:1.1 取适量的悬浮液,加入无菌试管中,加入适量的生理盐水或缓冲液进行一定倍数的稀释,如10^-1、10^-2、10^-3等。
1.2 使用无菌移液器,吸取适量的菌液,均匀涂布在培养基平板表面,用无菌酒精灯杀菌吸头。
1.3 等待菌液均匀渗入培养基平板后,用倒置培养后的平板。
2. 孵育:2.1 将培养基平板放置在培养箱中,设置适当的温度和时间,让菌落生长。
2.2 在孵育期间避免移动或震动培养基平板,以免影响菌落形成。
3. 菌落计数:3.1 使用显微镜观察培养基平板上的菌落,选择合适放大倍率。
3.2 通过目视法或使用计数器进行菌落计数,确保每个菌落仅计数一次。
3.3 记录每个稀释倍数对应的菌落数。
五、结果分析和报告1. 结果计算:1.1 根据需要计算出初始样品中的菌落总数,考虑稀释倍数和计数范围。
(完整版)菌落总数检测操作规程(国标word版)摘要

山西梁汾醋业有限公司文件类别及编号: LF-GC—01 版次共页第页菌落总数测定的标准操作规程1。
目的规范山西老陈醋菌落总数测定的操作规程,保证山西老陈醋产品的质量。
2。
适用范围酿造食醋和配制食醋菌落总数的测定。
3. 仪器设备恒温培养箱,冰箱,恒温水浴箱,天平(0.1g),均质器,振荡器;无菌吸管1ml(0。
01刻度)、10ml(0.1ml刻度)或微量移液器及吸头;无菌锥型瓶,250ml/500ml;无菌培养皿:直径90mm;PH计或精密PH试纸;放大镜或菌落计数器4.培养基和试剂4.1平板计数琼脂培养基,成分:胰蛋白胨 5.0g酵母浸膏 2。
5g葡萄糖 1。
0g琼脂 15.0g 蒸馏水 1000ml PH7.0±0.2制法:将上述加于蒸馏水中,煮沸溶解,调节PH 。
分装试管或锥型瓶,121℃高压灭菌15min 。
4.2磷酸盐缓冲液 成分:磷酸二氢钾(KH 2PO 4) 34。
0g 蒸馏水 500ml PH 7.2 制法:贮存液:称取34。
0g 磷酸二氢钾溶于500ml 蒸馏水中,用大约175ml 的1mol/L 氢氧化钠溶液调节PH,蒸馏水稀释至1000ml 存于冰箱.稀释液:取贮存液1。
25ml,用蒸馏水稀释至1000ml ,分装于适宜容器中,121摄氏度高压灭菌15分钟。
4.3无菌生理盐水 成分:氯化钠 8。
5g 蒸馏水 1000ml制法:8.5克氯化钠溶于100ml 蒸馏水中121摄氏度高压灭菌15分钟。
5 检验程序6操作步骤6。
1样品的稀释6.1.1固体和半固体样品:称取25 g样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 r/min~10000 r/min 均质1min~2min,或放入盛有225 mL稀释液的无菌均质袋中,用拍击式均质器拍打1 min~2 min,制成1:10的样品匀液。
6。
1。
2液体样品:以无菌吸管吸取 25 mL 样品置盛有 225 mL 磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
山西梁汾醋业有限公司
文件类别及编号:LF-GC-01 版次共页第页
菌落总数测定的标准操作规程
1. 目的
规范山西老陈醋菌落总数测定的操作规程,保证山西老陈醋产品的质量。
2. 适用范围
酿造食醋和配制食醋菌落总数的测定。
3. 仪器设备
恒温培养箱,冰箱,恒温水浴箱,天平(0.1g),均质器,振荡器;无菌吸管1ml(0.01刻度)、10ml(0.1ml刻度)或微量移液器及吸头;无菌锥型瓶,250ml/500ml;
无菌培养皿:直径90mm;PH计或精密PH试纸;放大镜或菌落计数器
4.培养基和试剂
4.1平板计数琼脂培养基,
成分:
胰蛋白胨 5.0g
酵母浸膏 2.5g
葡萄糖 1.0g
琼脂15.0g
蒸馏水1000ml
PH7.0±0.2
制法:将上述加于蒸馏水中,煮沸溶解,调节PH。
分装试管或锥型瓶,121℃高压灭菌15min。
4.2磷酸盐缓冲液
成分:
磷酸二氢钾(KH
2PO
4
) 34.0g
蒸馏水500ml
PH 7.2
制法:
贮存液:称取34.0g磷酸二氢钾溶于500ml蒸馏水中,用大约175ml的1mol/L 氢氧化钠溶液调节PH,蒸馏水稀释至1000ml存于冰箱。
稀释液:取贮存液1.25ml,用蒸馏水稀释至1000ml,分装于适宜容器中,121摄氏度高压灭菌15分钟。
4.3无菌生理盐水
成分:
氯化钠8.5g
蒸馏水1000ml
制法:8.5克氯化钠溶于100ml蒸馏水中121摄氏度高压灭菌15分钟。
5 检验程序
6操作步骤
6.1样品的稀释
6.1.1固体和半固体样品:称取25 g样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 r/min~10000 r/min 均质1min~2min,或放入盛有225 mL稀释液的无菌均质袋中,用拍击式均质器拍打1 min~2 min,制成1:10的样品匀液。
6.1.2液体样品:以无菌吸管吸取25 mL 样品置盛有225 mL 磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)
中,充分混匀,制成1:10的样品匀液。
6.1.3用1 mL无菌吸管或微量移液器吸取1:10样品匀液1mL,沿管壁缓慢注于盛有9 mL稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品匀液。
6.1.4按1.4.1.3操作程序,制备10倍系列稀释样品匀液。
每递增稀释一次,换用1次1 mL无菌吸管或吸头。
6.1.5根据对样品污染状况的估计,选择2个~3个适宜稀释度的样品匀液(液体样品可包括原液),在进行10倍递增稀释时,吸取1 mL 样品匀液于无菌平皿内,每个稀释度做两个平皿。
同时,分别吸取1mL空白稀释液加入两个无菌平皿内作空白对照。
6.1.6及时将15 mL~20mL冷却至46℃的平板计数琼脂培养基(可放置于46 ±1℃℃恒温水浴箱中保温)倾注平皿,并转动平皿使其混合均匀。
6.2培养
6.2.1待琼脂凝固后,将平板翻转,36℃±1℃培养48 h±2 h。
水产品30℃±1℃培养72 h±3 h。
6.2.2如果样品中可能含有在琼脂培养基表面弥漫生长的菌落时,可在凝固后的琼脂表面覆盖一薄层琼脂培养基(约4 mL),凝固后翻转平板,按1.4.2.1条件进行培养。
6.3菌落计数
可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应
的菌落数量。
菌落计数以菌落形成单位(colony-forming units,CFU)表示。
6.3.1选取菌落数在30CFU~300CFU之间、无蔓延菌落生长的平板计数菌落总数。
低于30CFU的平板记录具体菌落数,大于300CFU的可记录为多不可计。
每个稀释度的菌落数应采用两个平板的平均数。
6.3.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以2,代表一个平板菌落数。
6.3.3当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。
7结果与报告
7.1菌落总数的计算方法
7.1.1若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每g (mL)样品中菌落总数结果。
7.1.2若有两个连续稀释度的平板菌落数在适宜计数范围内时,按公式(1)计算:
N =∑C/(n1 +0.1n2 )d (1)
式中:
N——样品中菌落数;
∑C——平板(含适宜范围菌落数的平板)菌落数之和;
n1——第一稀释度(低稀释倍数)平板个数;
n2——第二稀释度(高稀释倍数)平板个数;
d——稀释因子(第一稀释度)。
示例:
N =∑C/(n1 +0.1n2 )d
=(232+244+33+35)/[2+(0.1×2)]×10-2=544/0.022=24727
上述数据按1.6.2数字修约后,表示为25000或2.5×104。
7.1.3若所有稀释度的平板上菌落数均大于300 CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
7.1.4若所有稀释度的平板菌落数均小于30 CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
7.1.5若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
7.1.6若所有稀释度的平板菌落数均不在30 CFU~300 CFU之间,其中一部分小于30 CFU或大于300 CFU时,则以最接近30 CFU或300 CFU的平均菌落数乘以稀释倍数计算。
7.2菌落总数的报告
7.2.1菌落数小于100 CFU时,按“四舍五入”原则修约,以整数报告。
7.2.2菌落数大于或等于100 CFU时,第3位数字采用“四舍五入”原则修约后,取前2位数字,后面用0代替位数;也可用10的指数
形式来表示,按“四舍五入”原则修约后,采用两位有效数字。
7.2.3若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延。
7.2.4若空白对照上有菌落生长,则此次检测结果无效。
7.2.5称重取样以CFU/g 为单位报告,体积取样以CFU/mL 为单位报告。
