EDU染色
EDU检测细胞增殖

Brdu中文全名5-溴脱氧尿嘧啶核苷,为胸腺嘧啶的衍生物,可代替胸腺嘧啶在DNA合 成期(S期),活体注射或细胞培养加入,而后利用抗Brdu单克隆抗体,ICC染色,显示增 殖细胞。同时结合其它细胞标记物,双重染色,可判断增殖细胞的种类,增殖速度,对研 究细胞动力学有重要意义。
MTT检测法
MTT检测法主要反映细胞的能量代谢,是检测细胞增殖活力的一种简便准确的方法, 其原理是在活细胞生长和增殖过程中,线粒体内的脱氢酶可将黄色的MTT分解成兰紫色的 甲(Formazan),生成的甲量的多少与细胞的数量和细胞的活力成正比。
羟基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)检测法
C10311 Cell-LightTM EdU 流式细胞仪检测试剂盒 Tel: 028-81391685、13679094941
Ribobio
Cell-Light™ EdU 动物实验 3) 在组织水平上EdU对增殖细胞的标记
Ribobio
EdU适用于人、小鼠、大鼠等活体注射,全面分析组织或器官的细胞 增殖情况,适用于石蜡或冰冻组织切片检测,对活体无副作用。
Ribobio
Cell-Light™ EdU 试验流程
检测方法简便,只需三步即可分 析细胞增殖数据: 1)EdU孵育样品; 2)细胞固定化; 3)Apollo®染料检测EdU。
Tips:
1.建议使用50μM EdU培养基孵育,但您可 以在预实验时根据细胞类型和实验目的,以 一系列浓度(10~100μM)的EdU培养基孵育进 行优化,细胞能太密,一般60%-70%。 2.不同细胞类型之间有一定差异,可以先做 一个时间梯度,找出合适的孵育时间。 3.由于细胞之间的差异,最佳EdU的终浓度 和培养时间可根据具体实验调整,(50μM EdU 培养基用细胞培养液以1:2000的比例稀释 EdU溶液)。 4. EdU孵育时间>24小时宜采用较低浓度, 而EdU孵育时间<45分钟宜采用较高浓度。 检测和DNA染色草种、孵育注意避光。 6.固定好的细胞,不染色,在4℃可存放1个 月。组织切片如暂不检测就不要脱蜡。
瑞博EDU试剂盒C使用说明

C00031
Apollo®567
550nm
565nm
Cy3
C00041
Apollo®643
653nm
667nm
Cቤተ መጻሕፍቲ ባይዱ5
C00033
Hoechst 33342
350nm
461nm
DAPI
注:1)荧光显微镜宜采用Hoechst 33342 和 Apollo® 567进行检测DNA复制活性;
•渗透剂(含% Triton X-100的PBS)
•甘氨酸溶液(2 mg/mL)(去离子水配置)
•细胞固定液(即含4% 多聚甲醛的PBS)
• 96/24/12/6孔培养板
注意:请使用一次性手套,废液请妥善处理。
实验参考
表1EdU培养基及染色反应液的使用量参考
EdU培养基
100 μl
150 μl
200 μl
300 μl
500 μl
2 mL
染色反应液
100 μl
150 μl
200 μl
300 μl
500 μl
2 mL
注:1)*表示贴壁细胞通常采用的培养容器,EdU培养基与染色反应液用量以覆盖细胞为宜;2)悬浮细胞EdU用量请按培养体积而定。
表2EdU孵育时间取决于细胞生长速度
细胞系
细胞周期
~30min
~3h
瑞博EDU试剂盒C使用说明
产品简介
试剂盒应用EdU直接测定细胞内DNA的变化。EdU(5-Ethynyl -2’- deoxyuridine)是一种胸腺嘧啶核苷类似物,能够在时期代替胸腺嘧啶(T)渗入正在复制的DNA分子中,通过基于EdU与Apollo荧光染料的特异性反应快速检测细胞DNA复制活性,适用于细胞增殖、细胞分化、生长与发育、DNA修复、病毒复制、细胞标记示踪等方面的研究,尤其适合进行siRNA、miRNA、小分子化合物及其他药物的筛选实验。
EdU法细胞增殖检测——Brdu方法的革命性突破

EdU法细胞增殖检测——Brdu方法的革命性突破细胞增殖的研究方法有很多,主要包括:BrdU,EdU,CCK8等方法。
其中EdU检测方法是zui新的细胞增殖检测方法。
一、什么是细胞增殖呢?细胞增殖是生物体的重要生命特征,细胞以分裂的方式进行增殖。
单细胞生物,以细胞分裂的方式产生新的个体。
多细胞生物,以细胞分裂的方式产生新的细胞,用来补充体内衰老或死亡的细胞。
二、细胞增殖的意义和方式意义:细胞增殖是生活细胞的重要生理功能之一,是生物体的重要生命特征。
细胞的增殖是生物体生长、发育、繁殖以及遗传的基础。
方式:真核生物的分裂依据过程不同有三种方式,有有丝分裂,无丝分裂,减数分裂。
其中有丝分裂是人、动物、植物、真菌等一切真核生物中的一种zui为普遍的分裂方式,是真核细胞增殖的主要方式。
减数分裂是生殖细胞形成时的一种特殊的有丝分裂。
三、关于EdU检测方法EdU是一种胸腺嘧啶核苷类似物,能够在细胞增殖时期代替T渗入正在复制的DNA分子,通过基于EdU与Apollo®荧光染料的特异性反应检测DNA复制活性,通过检测EdU标记便能准确地反映细胞的增殖情况。
与BrdU检测方法相比,EdU检测方法更快速、更灵敏、更准确。
EdU检测染料只有BrdU抗体大小的1/500,在细胞内很容易扩散,无需DNA变性(酸解、热解、酶解等)即可有效检测,可有效避免样品损伤,在细胞和组织水平能更准确地反映细胞增殖等现象。
细胞增殖伴随着多细胞生物生命体运作的一生,越来越多的研究者们已经把目光集中到了细胞增殖检测,关于细胞增殖检测的方法也在不断更新。
那么到目前为止,研究细胞增殖有哪些手段呢?EdU法检测试剂盒是Brdu方法的革命性突破。
EdU(5-溴-2-脱氧尿嘧啶)试剂盒是一种嘧啶类似物,可以在DNA合成期整合入DNA双链。
通过以上原理图的对比,大家不难发现,EdU法检测细胞增殖,无须抗体,无变性步骤,保持细胞形态和DNA完整性,是一种简单,可靠,省事的创新方法。
BrdU染色原理和步骤

通常在第一种抗体呈色后,再经1%戊二醛固定5~ 10min,重复染色程序,均可获得较满意的染色结 果,分裂细胞核呈棕褐色;显示其它抗原用ALP标记 抗体,则细胞浆为红色(FR)或蓝色(FB)
操作步骤 (1)
(1)细胞以1.5×105 /ml细胞数接种于直 径35 mm培养皿中(内放置一盖玻片), 培养1 d,用含0.4%FBS培养液同步化3 d, 使绝大多数细胞处于G0期。 (2)加入BrdU(储液:1.0 mg/ml,终浓 度为0.03 μg/ml),37℃,孵育40min。 (3)弃培养液,玻片用PBS洗涤3次。 (4)甲醇/醋酸固du单克隆抗体, ICC染色,显示增殖细胞。同时结合其它细胞标记 物,双重染色,可判断增殖细胞的种类,增殖速度, 对研究细胞动力学有重要意义。因组织细胞内无内 源性Brdu存在,所以Brdu应用较广
掺入双链DNA内的Brdu,以氢链与腺嘌呤结合,不能 直接与抗Brdu抗体反应,需经解链使Brdu暴露方能被 染色。常用的解链方法为盐酸加热、蛋白酶处理等,使 DNA双链部分单链化,抗Brdu小鼠单克隆抗体与增殖 细胞核内的Brdu结合,再经酶标抗小鼠IgG抗体孵育、 呈色,显示进入S期细胞的情况。
(5)经固定的玻片空气干燥,0.3%H2O2 -甲醇 30 min灭活内源性氧化酶。 (6)5%正常兔血清封闭。 (7)甲酰胺100℃,5 min变性核酸。 (8)冰浴冷却后PBS洗涤,加1抗即抗小鼠BrdU 单抗(工作浓度1:50),阴性对照加PBS或血清。 (9)按ABC法进行检测,苏木素或伊红衬染,在 显微镜下随机计数10个高倍视野中细胞总数及 BrdU阳性细胞数,计算标记指数(LI)。
BrdU staining protocol
Materials and reagents
EDU实验步骤

EdU细胞增殖(细胞成像)EdU是一种胸腺嘧啶核苷类似物,其连有的炔烃基团在天然化合物中很少见,能够在DNA复制时期代替胸腺嘧啶(T)渗入正在合成的DNA分子中,通过基于Apollo®荧光染料与EdU的特异性反应即可直接并准确地检测出DNA复制活性,广泛应用于细胞增殖、细胞分化、生长与发育、DNA修复、病毒复制等方面的研究,尤其适合进行siRNA、miRNA、小分子化合物及药物的细胞增殖筛选实验。
荧光显微镜检测方法(以96孔板,A549贴壁细胞为例)细胞培养取对数生长期细胞,以每孔4×103~1×105细胞接种于96孔板中,培养至正常生长阶段。
药物处理(可选)客户可以根据实验需要进行各种药物处理。
EdU标记1.1 用细胞培养基按1000:1的比例稀释EdU溶液(试剂A),制备适量50μM EdU培养基;注:1)EdU浓度与孵育时间相关,短时间孵育(<2h)宜采用高浓度(10~50 μM),长时间孵育(>24h)宜采用低浓度(1~10μM);2)如果需配置10μM EdU培养基,需调整为5000:1稀释比例;3)配置好的培养基的保存时间取决于培养基的性质。
注:1)*表示贴壁细胞通常采用的培养容器,EdU培养基与染色反应液用量以覆盖细胞为宜;2)悬浮细胞EdU用量依据培养体积而定。
1.2 每孔加入100μL 50μM EdU培养基孵育2小时,弃培养基;注:1)最佳孵育时间与细胞周期相关(表2),大多数细胞系均可采用2小时孵育时间;2)EdU培养基用量以没过细胞为宜,但需要保证EdU孵育时间内的营养物质持续供给(表1);1.3 PBS清洗细胞1~2次,每次5分钟。
注:清洗目的是将未渗入DNA的EdU洗脱,清洗方式依据不同的细胞类型而定,贴壁不牢的细胞请降低清洗强度。
注:1)EdU孵育时间取决于细胞周期,一般为细胞周期的1/10至1/5,但大多数细胞系均可采用2h孵育时间。
EDU
EdU(5-Ethynyl-2'-deoxyuridine)是一种胸腺嘧啶核苷类似物,其连有的炔烃基团在天然化合物中很少见,能够在DNA复制时期代替胸腺嘧啶(T)渗入正在合成的DNA分子中,基于Apollo荧光染料与EdU的特异性反应即可直接并准确地检测出DNA复制活性,广泛应用于细胞增殖、细胞分化、生长与发育、DNA损伤修复、病毒繁殖等方面的研究,尤其适合进行siRNA、miRNA、小分子化合物及各种药物的细胞增殖及活力筛选实验。
细胞增殖是评价细胞活性、代谢、生理和病理状况的重要指标。
EdU(5-Ethynyl-2'-deoxyuridine)是一种胸腺嘧啶核苷类似物,其连有的炔烃基团在天然化合物中很少见,能够在DNA复制时期代替胸腺嘧啶(T)渗入正在合成的DNA分子中,基于Apollo荧光染料与EdU的特异性反应即可直接并准确地检测出DNA复制活性,广泛应用于细胞增殖、细胞分化、生长与发育、DNA损伤修复、病毒繁殖等方面的研究,尤其适合进行siRNA、miRNA、小分子化合物及各种药物的细胞增殖及活力筛选实验。
超越BrdU传统的免疫荧光染色(BrdU)检测方法需要DNA变性,抗原修复,抗原抗体过夜孵育,操作步骤复杂繁琐。
并且由于BrdU抗体分子较大,嵌入DNA分子中的BrdU无法直接与BrdU 抗体结合,必须先进行DNA变性操作才能使BrdU抗原表位暴露,但变性的程度可能导致错误结果。
如果变性不充分,会导致BrdU难以暴露,无法检测,而且变性过程从边缘向中间渗透,会导致细胞核DNA的变性不均匀,边缘模糊不清。
如果变性过分,则会导致DNA断裂,甚至降解,导致核染不均一。
另外,不同抗体试剂公司的抗体质量不一致,造成难以确保实验重复性,且容易产生假阳性结果。
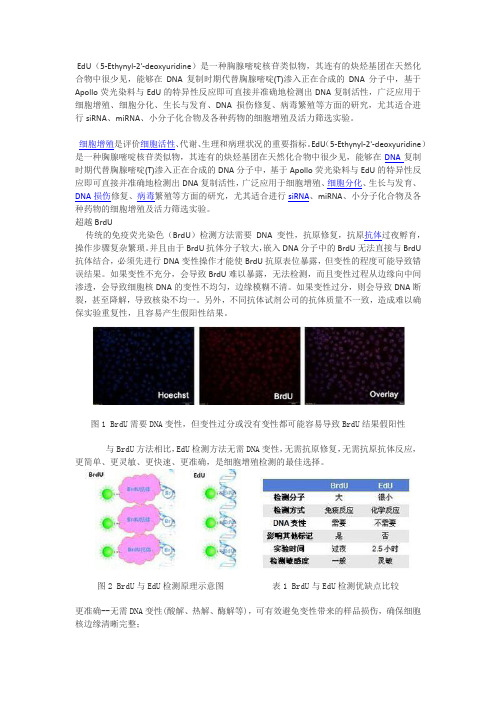
图1 BrdU需要DNA变性,但变性过分或没有变性都可能容易导致BrdU结果假阳性与BrdU方法相比,EdU检测方法无需DNA变性,无需抗原修复,无需抗原抗体反应,更简单、更灵敏、更快速、更准确,是细胞增殖检测的最佳选择。
细胞增殖 检测方法

细胞增殖检测方法
细胞增殖是指细胞数量的增加。
检测细胞增殖可以通过多种方法,其中常用的方法包括:
1. 细胞计数:使用显微镜观察细胞培养物中的细胞数量,并通过计数来得出细胞增殖情况。
2. 晶紫染色法:晶紫染色可以染色细胞核,通过观察染色后细胞数量的增加来判断细胞增殖情况。
染色后的细胞可以在显微镜下观察,并可以使用图像处理软件进行图像分析。
3. DNA含量分析:细胞增殖时DNA含量也会增加,可以通过荧光染料如荧光素琥珀酰胺(Propidium Iodide)染色,使用流式细胞仪来分析DNA含量。
4. 噻吩蓝染色法(MTT法):MTT法使用噻吩蓝(MTT)染料可以评估细胞活性和增殖能力。
活细胞将MTT染料转化为紫色的内盐,通过溶解细胞并测量溶液的吸光度来确定细胞增殖情况。
5. 细胞增殖标记物:细胞增殖标记物如脱氧尿苷(BrdU)或5-乙酰基-2'-脱氧尿苷(EdU)可以被细胞吸收并集成到新合成的DNA中。
这样,在染色时可以使用抗-BrdU或抗-EdU抗体染色,并通过观察标记物阳性细胞的数量来评估细胞增殖情况。
以上方法都可以用于检测细胞增殖情况,选择适合实验需求的方法进行研究。
需要注意的是,不同的方法可能具有不同的准确性和敏感性,因此在实验设计和数据分析过程中需要谨慎操作。
抗肿瘤药物筛选——细胞水平实验丨Edu细胞增殖检测

抗肿瘤药物筛选——细胞水平实验丨Edu细胞增殖检测细胞水平的细胞增殖是生物医学领域非常重要的表型,对细胞增殖的检测是检验药物对肿瘤细胞影响的最主要检测手段。
作为细胞水平检测增殖现象的传统方法,cck8比色法,Edu细胞增殖检测在细胞增殖检测中被广泛应用。
一、传统的肿瘤治疗方法1.外科手术治疗2.放射线治疗3.化学药物治疗众所周知,化疗会产生很多不良反应,比如:骨髓抑制(血细胞减少)、胃肠道反应、脱发、发热、皮疹、心脏毒性、肝脏毒性、神经毒性、泌尿道毒性、局部静脉炎、致畸、致突变、致癌等等。
那么持续不断地寻找更好的抗肿瘤药物势在必行。
天然产物在新药及新药先导化合物的发现中起着不可替代的作用,是结构新颖和作用独特的抗肿瘤化合物的重要来源。
美国国立癌症研究所(NCI)从1955年开始从天然产物中筛选抗肿瘤药物。
目前世界上被批准广泛使用的抗肿瘤药物中,50 %以上来源于天然产物。
那么问题来了~如何进行抗肿瘤药物的筛选?以及主要用到哪些实验方法?实际上,抗肿瘤药物的筛选体系复杂,涉及到宏观到微观水平的一系列实验。
在这里小编,就简要梳理一下抗肿瘤筛选的关键流程吧:二、动物水平的筛选流程:三、细胞水平的筛选①抑制肿瘤细胞增殖实验②诱导肿瘤细胞分化实验③诱导肿瘤细胞凋亡实验④抗肿瘤血管生成实验⑤肿瘤多药耐药性逆转实验⑥抗肿瘤侵袭和转移实验⑦诱导肿瘤细胞自噬实验四、抑制肿瘤细胞增殖实验细胞水平检测增殖现象的传统方法主要有:1)cck8比色法;2)Edu细胞增殖检测;1)cck8比色法CCK8是基于WST-8的一种细胞增殖检测方法,WST-8是一种水溶性四唑盐,常用于评估细胞的代谢活性。
在中性pH值及中间电子受体存在的情况下,被细胞线粒体中的脱氢酶还原为具有高度水溶性的蓝/紫色甲臜产物(formazan)。
生成的甲臜物的数量与活细胞的数量成正比。
用酶联免疫检测仪在450nm波长处测定其光吸收值,可间接反映活细胞数量。
edu实验解读

EDU实验是一种用于研究细胞增殖、细胞分化、生长与发育、DNA损伤修复、病毒复制、细胞标记示踪等方面的技术。
通过EDU实验,可以定量测定细胞增殖速率和细胞周期,还可以研究细胞分化和细胞凋亡等现象。
在EDU实验中,通常会在特定的培养条件下,将标记有EDU的核苷酸引入细胞中,通过与DNA的结合,标记出DNA复制的区域。
随后,通过一系列的固定、洗涤和染色步骤,使用抗体检测出标记的DNA区域,最终通过显微镜观察和图像分析技术,对细胞的增殖情况进行定量分析。
通过EDU实验,可以获得许多有价值的信息,例如细胞增殖速率、细胞周期各时相的长度、细胞分化的方向和程度、细胞凋亡的发生和分布等。
这些信息对于理解细胞生命活动的规律和机制具有重要的意义,对于研究疾病的发生和发展机制、药物研发和癌症治疗等领域也具有广泛的应用价值。
细胞增殖凋亡检验方法

细胞增殖凋亡检验方法细胞增殖和凋亡是细胞生物学中两个重要的过程,对于细胞生长、发育和疾病发展起着关键作用。
因此,研究细胞增殖和凋亡的检验方法对于揭示相关生物学过程以及发现新的治疗靶点具有重要意义。
本文将介绍几种常用的细胞增殖和凋亡检验方法。
一、细胞增殖检验方法1.MTT法MTT法(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑溴化物)是一种常见的细胞增殖检验法。
MTT可以在活细胞内还原生成紫色的福尔马因酸化物,通过测定细胞活性来评估细胞增殖情况。
该方法的优点是简便、快速、应用广泛,但只能评估细胞整体增殖情况。
2. Bromodeoxyuridine(BrdU)标记法BrdU标记法是一种侵入法,可以评估细胞的DNA合成和增殖。
细胞在培养基中加入BrdU,细胞会将其代入新合成的DNA链中。
然后,可以使用抗BrdU抗体来检测BrdU标记的细胞。
该方法对于细胞周期和增殖动力学的研究非常有用。
标记法EdU标记法是一种新兴的细胞增殖检验方法。
与BrdU类似,EdU也是一种DNA合成的标记物,但是与BrdU相比,EdU标记更加简单快速。
EdU可以通过与荧光染料的偶联来进行检测,对于多通道染色非常适用。
1. Annexin V-FITC/PI染色法Annexin V-FITC/PI染色法是一种常用的细胞凋亡检验方法。
Annexin V是一种钙离子依赖性磷脂酰丝氨酸的结合蛋白,在凋亡过程中会在细胞表面表达。
PI是一种DNA染料,用于区分凋亡和坏死细胞。
该方法可以通过流式细胞术或荧光显微镜来评估细胞的凋亡程度。
2. DNA Laddering检测法DNA Laddering检测法是一种检测凋亡的传统方法。
在细胞凋亡过程中,核酸会被酶切为200-300bp的碎片,形成明显的DNA阶梯状图案。
该方法通过DNA琼脂糖凝胶电泳来检测DNA断裂情况。
3.TUNEL法TUNEL法(dUTP尾部标记法)是一种直接检测DNA断裂的方法。
edu组织染色步骤

edu组织染色步骤
edu组织染色步骤如下:
1.切片制备:将组织样本进行切片,确保切片厚度适中,以便后续染色。
2.脱蜡:将切片放入二甲苯中脱蜡,去除切片上的石蜡。
3.脱水:用无水乙醇逐级脱水,以去除切片上的二甲苯。
4.透明:用二甲苯透明切片,使切片更加透明。
5.染色:将切片放入染色液中,进行染色。
edu染色是一种特殊的染色方法,需要使用特定的染色液进行染色。
6.封片:将染色后的切片用封片剂封片,以便观察。
以上是edu组织染色的基本步骤,具体操作可能会因不同的实验室和设备而略有差异。
在操作过程中,需要严格遵守实验室安全规定,确保实验过程的安全和准确性。
edu染色原理范文

edu染色原理范文EDTA染色法是衡量细胞DNA含量和核型分析的常用方法之一、EDTA (乙酸乙二胺四乙酸)是一种常用的螯合剂,具有可溶性和高度稳定性,因此常被用于细胞的染色工作中。
EDTA染色原理主要分为四个步骤,包括样本处理,制备细胞悬液,染色处理和显微观察。
首先是样本处理,通常需要使用酶来去除细胞外基质,以避免粘连和凝集。
常用的酶包括胰蛋白酶、胶原酶和玻璃酶等。
样本还需要通过过滤或离心处理来去除细胞碎片和大颗粒物质。
接下来是制备细胞悬液,通常需要使用含有EDTA的缓冲液来解离细胞。
EDTA可以与镁、钙等离子结合,破坏细胞间的黏附连接,从而使细胞能够单独悬浮在溶液中。
染色处理是EDTA染色法的核心步骤。
在染色溶液中加入DNA染料,如DAPI(4,6-二氨基-2-苯基-吡啶)或Hoechst染料,能够与DNA结合形成复合物。
这些染料可穿透细胞膜进入细胞内,并通过静电作用与DNA直接相互作用。
染色溶液的浓度和处理时间是影响染色质量的重要因素。
最后,通过显微镜观察染色的细胞。
使用螢光显微镜可以观察到DNA的荧光信号,进而测量细胞的DNA含量。
由于DNA含量与细胞的染色体数目相关,因此可以通过测量DNA含量来推断细胞核型。
EDTA染色法具有准确、可靠和反应迅速的优点,广泛应用于肿瘤学、遗传学以及发育生物学等领域。
此外,在细胞循环研究中,EDTA染色法也可以帮助识别细胞凋亡和有丝分裂周期的特定阶段。
总之,EDTA染色法是一种常用的测量细胞DNA含量和核型分析的方法,通过使用EDTA作为螯合剂,将染色剂与DNA结合,可以通过测量DNA含量来推断细胞核型。
这一技术在许多领域具有重要的应用价值。
edu组织染色步骤

edu组织染色步骤1.引言1.1 概述概述在现代医学研究中,组织染色技术是一项非常重要的技术方法,其中edu组织染色步骤是其中的一种常用方法。
通过使用这种染色技术,我们可以更好地观察和研究细胞内的DNA含量和细胞增殖率。
特别是在肿瘤学领域,edu组织染色步骤被广泛应用于对肿瘤细胞增殖能力的研究和评估。
在进行edu组织染色步骤之前,我们首先需要对该技术进行必要的了解和认识。
本文将详细介绍edu组织染色步骤的重要性以及具体操作过程。
通过学习这些内容,读者可以更好地掌握和应用这项技术,为自身的科研工作提供更强有力的支持。
在接下来的章节中,我们将首先探讨edu组织染色步骤的重要性。
我们将介绍这项技术的特点和优势,以及它在生命科学研究中的广泛应用。
通过了解其重要性,读者能够认识到为什么这项技术在现代医学领域中如此重要。
随后,我们将进入具体的操作部分,介绍edu组织染色步骤的实施过程。
我们将详细说明所需材料和操作步骤,并提供实用的技巧和注意事项。
通过学习这些具体操作,读者可以更好地掌握和应用这项技术,从而在自己的研究中取得更准确和可靠的结果。
最后,在结论部分,我们将总结edu组织染色步骤的意义,并展望其未来的发展趋势。
我们将强调这项技术在未来研究中的潜力,并指出可能的优化方向。
通过对这些内容的总结和展望,读者可以更好地理解这项技术的价值和发展前景。
总之,本文将全面介绍edu组织染色步骤的相关内容,包括其概述、重要性和具体操作过程。
通过深入学习这些内容,读者可以更好地掌握和运用该技术,为自己的科研工作提供更为可靠和有效的支持。
希望本文能够对读者在组织染色领域的学习与研究中起到积极的指导和促进作用。
文章结构部分的内容如下:1.2 文章结构为了使读者能够清晰地了解本文的组织和内容,本文将按照以下几个部分展开:引言部分将首先给出本文的概述,介绍edu组织染色步骤的背景和重要性。
随后,将给出文章的整体结构,简要介绍各部分的内容和目的。
edu增殖实验数据统计分析

edu增殖实验数据统计分析
edu增殖的能力是评价细胞、代谢、生理、病理状况、细胞活性、基因毒性等的重要指标之一。
细胞增殖虽然与多种因素有关,比如细胞代谢活性、与细胞增殖相关的蛋白表达、ATP的浓度等等,但是检测细胞增殖现象的最直接最准确的方法就是用荧光探针直接检测遗传物质DNA的合成,这种方法是研究细胞增殖、信号通路、DNA修复及分化等等方向常用的方法。
目前,基于DNA的合成原理,人们最初开发了工具是BrdU染色法,但是这种方法操作耗时长,往往需要过夜处理细胞,操作繁杂,比如需要DNA变性、抗原修复以及抗原抗体反应等操作,后来在BrdU 的基础上,人们开发出了革命性的探针-EdU,这种方法不需要繁杂的操作,节约时间,且反应更灵敏和准确。
并且与MTT/WST-1或者CCK-8这种依靠化学显色法只能得到一个折线图的方法相比,EdU细胞增殖检测法可以得到高清细胞增殖现象数据图,可视化展示数据、更直观、更具视觉效果!
与传统的免疫荧光染色(BrdU)检测方法相比,EdU只有BrdU
抗体大小的1/500,在细胞内更容易扩散,不需要严格的样品变性(酸解、热解、酶解)处理,有效地避免了样品损伤,有助于在组织、器官的整体水平上观测细胞增殖的真实情况,具有更高的灵敏度和更快的检测速度。
悬浮细胞vasa+edu免疫荧光操作流程

悬浮细胞vasa+edu免疫荧光操作流程哎呀,这可是个不简单的活儿啊!今天咱们要说的,就是悬浮细胞vasa+edu免疫荧光操作流程。
听起来好像很高大上的样子,不过别担心,我会用最简单的语言,让你轻松掌握这个技能!咱们得准备好材料。
这里有一个清单:一瓶抗体、一瓶染料、一些载玻片、盖玻片、胶水和显微镜。
对了,还有一颗勇敢的心!第一步,咱们要把抗体和染料混合在一起。
这个过程叫做“孵育”。
你要轻轻地摇晃瓶子,让它们变成一片模糊的液体。
这时候,你会发现,颜色变得越来越漂亮了!这就是抗体和染料在“谈恋爱”,最后变成了我们熟悉的那种颜色。
第二步,咱们要把混合好的液体倒进载玻片里。
这个过程叫做“涂布”。
你要用一把小刷子,把液体均匀地涂在载玻片上。
涂的时候要注意,不要涂太多哦!否则的话,染色效果就不好了。
第三步,咱们要把载玻片放进盖玻片里。
这个过程叫做“封片”。
你要用一只干净的手,把盖玻片慢慢地压在载玻片上。
记住,要用力哦!这样才能把载玻片和盖玻片牢牢地固定在一起。
第四步,咱们要把封好的载玻片放在显微镜下观察。
这个过程叫做“观察”。
你要用显微镜的目镜和物镜,慢慢地调整焦距。
等到你看到了那些漂亮的小点点时,就可以放心地记录下来啦!哎呀,说了这么多,我差点忘了最重要的一步:练习!只有多练习,才能让我们的操作变得更加熟练。
从现在开始,就让我们一起努力吧!悬浮细胞vasa+edu免疫荧光操作流程虽然看起来有点复杂,但只要我们按照步骤来,就一定能够成功。
而且,通过这个过程,我们还可以学到很多关于生物学的知识哦!赶快行动起来吧!。
edu染色原理

edu染色原理edu染色原理,又称“EDU染色体标记技术”,是一种用于研究和诊断遗传病的分子生物学技术。
它能够通过引入一种名为“ethidium bromide”(简称“Edu”)的小分子来标记基因组中的特定DNA序列。
这种技术已经被广泛用于寻找和鉴定遗传病的遗传标志物,以及精确地确定遗传物质的类型和位置。
edu染色原理是一种基于光谱技术的方法,是利用某种特定的光谱成像技术,如紫外-可见光(UV-VIS)、荧光检测和磁共振(MRI)等,将染色剂(如ethidium bromide)与特定的DNA序列相结合,使得染色剂能够结合到DNA上,并显示出荧光或其他特征的形态,从而实现DNA 的染色和检测。
edu染色原理是基于两个重要的化学原理:亲和力和选择性结合。
亲和力是指染色剂与DNA序列之间的相互作用,这种相互作用受到了DNA序列上存在的氨基酸序列的影响,因此,只有具有特定氨基酸序列的DNA序列才能与染色剂结合,而其他不具有特定氨基酸序列的DNA序列则不能与染色剂结合。
选择性结合是指,不同的染色剂对不同的DNA序列有不同的亲和力,因此,只有具有特定氨基酸序列的DNA序列才能与某种染色剂结合,而其他不具有特定氨基酸序列的DNA序列则不能与该染色剂结合。
edu染色原理的基本原理就是利用了这两种原理。
edu染色原理的应用主要有以下几类:首先,可以用来确定DNA序列中的特定区域,例如遗传标记;其次,可以用来研究DNA的表达水平,以及检测特定的基因缺陷;再者,可以用来研究特定基因的结构和功能,以及它们在细胞结构中的分布情况;最后,还可用来研究DNA的结构和改变,以及DNA的复制和修复。
总的来说,edu染色原理是一种用于研究和诊断遗传病的分子生物学技术,利用染色剂(如ethidium bromide)与特定的DNA序列相结合,使得染色剂能够结合到DNA上,并显示出荧光或其他特征的形态,从而实现DNA 的染色和检测,已经被广泛用于寻找和鉴定遗传病的遗传标志物,以及精确地确定遗传物质的类型和位置。
EdU Apollo488 in vitro kit说明书

EdUApollo488in vitro kit货号:CA1172规格:100T保存:室温运输,2-8°C 储存,勿冻存,荧光试剂请避光保存,可稳定储存一年。
产品说明:EdU (5-Ethynyl-2’-deoxyuridine )是一种胸腺嘧啶核苷类似物,能够在细胞增殖时期代替胸腺嘧啶(T )渗入正在复制的DNA 分子中,通过基于EdU 与Apollo 荧光染料的特异性反应快速检测细胞DNA 复制活性,可快速准确的检测细胞的增值能力。
与BrdU 检测方法相比,EdU 检测方法更快速、更灵敏、更准确。
EdU 与T 非常相似,而EdU 染料只有BrdU 抗体的1/500,在细胞内很容易扩散,无需DNA 变性(酸解、热解、酶解等),可有效避免样品损伤,而且无需抗原抗体反应,能在细胞和组织水平更准确地反映DNA 复制活性。
本试剂盒适用于体外培养细胞的增值检测(Apollo488:Ex=490nm ,Em=520nm )。
贴壁细胞宜采用荧光检测方式,适用于荧光显微镜、共聚焦显微镜、高内涵筛选仪检测。
悬浮细胞可在孵育EdU 后进行涂片,涂片后从固定开始跟贴壁细胞采用相同的染色检测流程。
技术参数:Apollo488:最大激发波长(Ex ):490nm ;最大发射波长(Em ):520nm Hoechst 33342:最大激发波长(Ex ):350nm ;最大发射波长(Em ):461nm 实验准备:1.1×PBS (pH 7.2~7.6)2.渗透剂(含0.5%Triton X-100的PBS)3.甘氨酸溶液(2mg/mL)(去离子水配置)4.细胞固定液(含4%多聚甲醛的PBS)5.96/24/12/6孔培养板或培养皿等注意:请使用一次性手套,废液请妥善处理。
操作步骤(仅供参考):试剂浓度规格EdU 溶液(试剂A)1000×20μL Apollo 反应缓冲液(试剂B)20×500μL Apollo 催化剂溶液(试剂C)100×100μL Apollo 荧光染料溶液(试剂D)300×30μL Apollo 缓冲添加剂(试剂E)粉末100mg Hoechst 33342(试剂F)100×150μLBeijing Solarbio Science &Technology Co.,LtdTel:400-968-6088Fax:荧光显微镜检测方法(以96孔板,A549贴壁细胞为例)1、EdU标记1.1.用细胞培养基按1000:1的比例稀释EdU溶液(试剂A),制备适量50μM EdU培养基;注:1)EdU浓度与孵育时间相关,短时间孵育(<2h)宜采用高浓度(10-50μM),长时间孵育(>24h)宜采用低浓度(1-10μM);2)如果需配置10μM EdU培养基,需调整为5000:1稀释比例;3)配置好的培养基建议现配现用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Edu掺入法检测细胞增殖
1.取对数生长期细胞,以每孔4000个细胞接种于96孔板中,培养至对数生长期;
2.用细胞培养基按1000:1的比例稀释Edu溶液(试剂A),制备适量50μM的Edu培养基;
3.每孔加入100μL 50μM Edu培养基孵育1h,弃培养基;
4.PBS清洗细胞1~2次,每次5分钟;
5.每孔加入100μL细胞固定液(即含4%多聚甲醛的PBS)室温孵育30min;
6.每孔加入2mg/mL甘氨酸,脱色摇床孵育5min后,弃甘氨酸溶液;
7.每孔加入100μLPBS,脱色摇床清洗5min,弃PBS;
8.每孔加入100μL渗透剂(0.5%Triton X-100的PBS)脱色摇床孵育10min;PBS清洗1次,5min;
9.每孔加入100μL的1mg/mL DAPI,避光、室温、脱色摇床孵育10min,弃染色反应液;
10.每孔每次加入100μLPBS清洗1~3次;染色完成后,荧光显微镜检测。
