有机化学 第十二章 含氮化合物.ppt
合集下载
有机化学含氮有机化合物

NH+4 + OHRN+H3 + OH-
Kb
=
[ RNH3 ] [ OH ] [RNH2 ]
Kb 碱 b
pKb + pKa = 14
(1)脂肪胺的碱性
气相: (CH3)3N > (CH3)2NH > CH3NH2 > NH3
3°
2°
1°
CH3的+I效应使N上电子云密度增加,与 H+的结合力增加,碱性增强。
NO2 Cl NaHCO3 NO2 35℃
O2N
OH NO2 NO2 OH NO2
⑵ 硝基影响酚的酸性
OH
OH
OH
O2N
NO2
Pka 9.89
NO2 7.15
NO2 0.38
第二节 胺
一、胺的分类和命名
1.分类
根据与N相连的烃基数目
RNH2
1°伯胺 RCH2OH 1°伯醇
R2NH
2°仲胺 RCHR 2°仲醇
当氮上连接三个不同基团时,为手性氮:
··
N H3C
H
C2H5
··
H5C2
N CH3
H
H5C2
CH3 H
N
··
两个对映体间的能垒差很低,室温下迅速 转化,目前尚未能分离。
当氮连接四个不同基团时,两对映体不能 转换:
CH3
N+
C6H5CH2 CH2=CHCH2
C6H5
CH3
C6H5
+N
CH2C6H5
HCHO
HCHO
CH2OH
HOCH2 CHNO2
HOCH2 C CH2OH
CH2OH
CH2OH
硝基化合物PPT课件

C l C H 2 C O O N a + N a N O 2H 2 O O 2 N C H 2 C O O N a 蒸 - C 馏 O 2C H 3 N O 2 C l C H 2 C H 2 C O O N a + N a N O 2H 2 O O 2 N C H 2 C H 2 C O O子结构式:
或
• 两个氮氧键长均为0.121nm
.
3
(2) 硝基的结构
• 硝基的共振结构式
.
4
二. 硝基化合物的制备 (1) 脂肪族硝基化合物的制备:烷烃和硝酸——硝化反应(得混合物作溶剂)
• 主要产物为一硝基化合物;
同时发生碳键的断裂而生成 低级硝基化合物。
实验室制备:
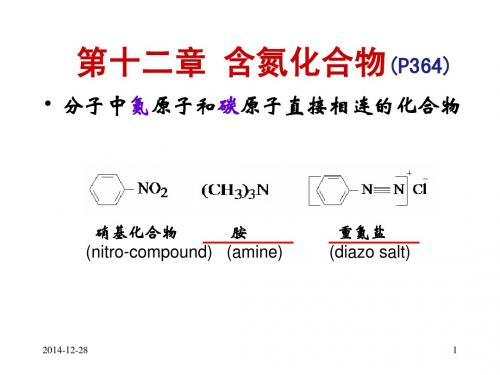
第十二章 含氮化合物
.
ex1it
第一节 硝基化合物 (Nitro Compounds)
一. 硝基化合物的分类、结构和命名
•硝基化合物可看成烃分子中的氢原子被硝基取代后的 衍生物。
(1)一硝基化合物和多硝基化合物 (2)伯、仲、叔硝基化合物(1°,2°,3°硝基化合物)
• 命名——硝基作为取代基:
对应的是几级碳
物是液体,它们具有苦杏仁味;有毒性. • 多硝基化合物在受热时一般易分解而发生爆炸.
硝基化合物的红外光谱
• 脂肪族伯和仲硝基化合物的N-O伸缩振动在1565~1545 cm-1 和 1385~1360 cm-1,叔硝基化合物的N-O伸缩振动在1545~1530 cm-1 和1360~1340 cm-1.
[2H] Ar NH NH Ar
.
氢化偶氮苯衍生物 14
2. 氢化偶氮苯类化合物的重排反应
N H N H
H + N H 2
或
• 两个氮氧键长均为0.121nm
.
3
(2) 硝基的结构
• 硝基的共振结构式
.
4
二. 硝基化合物的制备 (1) 脂肪族硝基化合物的制备:烷烃和硝酸——硝化反应(得混合物作溶剂)
• 主要产物为一硝基化合物;
同时发生碳键的断裂而生成 低级硝基化合物。
实验室制备:
第十二章 含氮化合物
.
ex1it
第一节 硝基化合物 (Nitro Compounds)
一. 硝基化合物的分类、结构和命名
•硝基化合物可看成烃分子中的氢原子被硝基取代后的 衍生物。
(1)一硝基化合物和多硝基化合物 (2)伯、仲、叔硝基化合物(1°,2°,3°硝基化合物)
• 命名——硝基作为取代基:
对应的是几级碳
物是液体,它们具有苦杏仁味;有毒性. • 多硝基化合物在受热时一般易分解而发生爆炸.
硝基化合物的红外光谱
• 脂肪族伯和仲硝基化合物的N-O伸缩振动在1565~1545 cm-1 和 1385~1360 cm-1,叔硝基化合物的N-O伸缩振动在1545~1530 cm-1 和1360~1340 cm-1.
[2H] Ar NH NH Ar
.
氢化偶氮苯衍生物 14
2. 氢化偶氮苯类化合物的重排反应
N H N H
H + N H 2
有机化学 含氮化合物

1°硝基使卤苯易水解、氨解
O N =O
Cl
δ
O N =O
δ
Cl
Cl + NaOH
H2O
OH
200 ℃
Cl 10% NaOH 400 oC 32MPa
Cl NO2 NaOH 溶液 130 oC
OH
ONa NO2 H
OH NO2
Cl NO2 Na2CO3 溶液
100℃ NO2
ONa NO2 H
NO2
OH NO2
N-亚硝基二甲胺
• 俗称二甲基亚硝基胺(Dimethylnitrosamine, NDMA),黄色液体,可 溶于水、乙醇、乙醚、二氯甲烷。由二甲胺与亚硝酸盐在酸性条件下反 应而生成。
• 在环境中广泛存在。生产和使用NDMA的车间空气中,如轮胎厂可达 0.12-1.5μg/m3,皮革厂可达1.2-47μg/m3,火箭燃料厂为36μg/m3。在 鱼、肉等动植食品中可达0.1-300μg/kg。在烟草、蔬菜、谷类中均可检 出。属高毒。经消化道、呼吸道吸收迅速,经皮肤吸收缓慢。主要引起 肝脏损害。
NaOR
CH2N2 + (CH3)2C=CH-COCH3
HgO
(C6H5)2C=NHNH2
(C6H5)2C=N2
重氮二苯甲烷
HNO2, 0 oC
H2N-CH2CO2Et
N2=CHCO2Et
重氮乙酸乙酯
2. 重氮化合物的性质
CH2N2: 有毒气体, b.p., -24oC, 纯净状态易爆炸.大多在乙醚中使用.
O
碳烯 (carbene, 卡宾) 和类碳烯 (carbenoids)
R2C
or
碳烯 (carbene, 卡宾)的制备
第十二章含氮有机化合物05

NO2 Zn NH4Claq
NHOH
10
C.在碱性介质中还原产物比较复杂,具体产物取决
于所有试剂:
氧化偶氮苯
偶氮苯
氢化偶氮苯
11
4、硝基苯的苯环上取代反应:硝基为强的第二类定 位基,间位取代,不发生烷基化和酰基化 5、硝基对邻对位的影响,硝基的邻对位上易于发生 亲核取代:
Cl
1.
OH NO2 NaCO 3aq
比较碱性(给电子能力;或比较其共轭酸的稳定性) (1)芳胺<NH3<脂肪胺)
23
• 苯胺的碱性
N
H H
PKb : 9.37
24
诱导效应
溶剂化效应
R N H OH2 H OH2 H OH2 R2 N H OH2 H OH2 R3 N H O H H
(2)脂肪胺: 气态:NH3<C2H5NH2<(C2H5)2NH<(C2H5)3N 水溶液: NH3<C2H5NH2 <(C2H5)3N <(C2H5)2NH
第十二章含氮有机化合物
• 含氮有机化合物是指分子结构中含有碳氮 键的一类化合物。 • 包括: 胺、氨基酸、腈、硝基化合物、酰胺、 重氮和偶氮化合物、含氮杂环化合物及含 氮生物碱等。
• 含氮有机化合物在自然界中分布很广,不 仅在工业、农业和日常生活中具有重要的 意义,而且在生理过程中起着非常重要的 作用。
NH3
SN2
RNH2 + TsO
-
2、加布里埃尔(Gabriel)合成法
O C C O - + NK
O
+R
X
THF 或 DMF
C NR C O
水 解 或 肼 解
《有机化学》第十二章有机含氮化合物

(电子效应的影响)
:
:
:
:
:
2. 芳胺
NH3 >
NH2
N
H H
综上所述: 脂肪胺 > NH3 > 芳香胺>酰胺
NH2 >
NH
>
N
pkb 9.30
13.80
近乎中性
取代芳胺的碱性:
取代基对芳胺碱性的影响,与其对酚的酸性的影响刚好相反。
在芳胺分子中,当取代基处于氨基的对位或间位时, 给电子基团使碱性↑,而吸电子基团使碱性↓。且取代基 在对位时影响更显著。如:
RNH2 1°
R2NH 2°
R3N 3°
§12-1-2胺的制备方法 1. 氨或胺的烃基化 亲核试剂:NH3、RNH2(以1°胺为宜)。 烃基化试剂:卤代烃
RX + NH3
RNH3+X NH3 RNH2 + NH4+X
2. 腈和酰胺的还原
O
=
CH3
N C6H5
C
CH3
LiAlH4, 醚
CH3
N C6H5
的卤代烃还要高。 (2) 溶解性 硝基化合物的相对密度都大于1,不溶于水。硝基化
合物不仅溶于有机溶剂,而且还溶于浓硫酸。
(3) 多硝基化合物受热易分解而发生爆炸,如:TNT 炸药、2,4,6-三硝基苯酚(俗称:苦味酸)。
但有的多硝基化合物具有类似天然麝香的香气,而被 用作香水、香皂和化妆品的定香剂。如:
硝基中,氮原子和两个氧原子上的p轨道相互重叠, 形成包括O、N、O三个原子在内的共轭体系:
O RN
O
或
R N =O
O
:
由于键长的平均化,硝基中的两个氧原子是等同的
2、 物理性质 (1) b.p: 因-NO2是一个强极性基团,因此硝基化合物具有较
有机化学:第12章 含氮化合物

R4N+X22:46:50
R4N+OH- + X-
Br CO2H + NH3 (1 mol)
NH2 CO2H OH-
NH3+ CO2-
65-70%
PhNH2 + PhCH2Cl
PhNHCH2Ph 96%
Et3N + PhCH2Cl
Et3N+CH2PhClTEBA Triethybenzylammonium chloridel
——3o胺、叔胺
22:46:50
胺的命名
四、芳香族仲胺、叔胺,基前以N-示区 别苯环的取代(P223)
22:46:50
[胺的分类之二:芳香胺、脂肪胺(P222)]
胺的命名
五、结构比较复杂的胺,将氨基为取代 基(P223)
22:46:50
六、二元胺的命名
——[胺的分类之三:一元胺、二元胺等(P222)]
H2NCH2CH2CH2CH2NH2: 1,4-丁二胺
(腐胺)
H2NCH2CH2CH2CH2CH2NH2:1,5-戊二胺
(尸胺) 腐胺、尸胺是肉腐烂时产生的,极臭、剧毒
(P224)
22:46:50
七、季铵类化合物的命名
——胺、铵(P222)
(季铵碱,碱性与KOH相当)
22:46:50 (俗名: 1227——杀菌剂)
22:46:50
胺的命名
原则:
一、简单胺按所含烃基命名(P223)
22:46:50
胺的命名
二、多个烃基时表示出烃基个数(P223)
[胺的分类之一:伯、仲、叔(P222)]
22:46:50
胺的命名
三、烃基不同时先列简单的(P223)
有机化学_第十二章_有机含氮化合物

2 、胺的物理性质
低级胺为气体或易挥发性液体; 高级胺为固体; 芳香胺为高沸点的液体或低熔点的固体; 胺具有特殊的气味; 胺能与水形成氢键; 一级胺和二级胺本身分子间也能形成氢键。
(三)胺的化学反应 1、结构
N H H
H
N
(1) 氨和胺中的N是不等性的 sp3杂化,未共用电子
对占据一个sp3杂化轨道。
甲胺
苯胺
甲基乙基环丙胺
2、IUPAC命名法:
选含氮最长的碳链为母体,称某胺。 N上其它烃基为取代基,并用N定其位
CH3
CH3NH2 methylamine H3C N C2H5 N-ethyl-N,4-di ethylbenzenamine
甲胺
N,4-二甲基-N-乙基苯胺
N,N- dimethyl-3-methyl-2-pentanaime CH N( C H ) 3 2 52
NO 2
(3)磺化反应
NH NH NH HSO NHSO H 2 2 3 4 3 H SO 2 4 1 8 0 ℃ H O 2 SO H 3
*有 未 共 用 电 子 对
R N H 2
*碱 性 *亲 核 性
R N 3
*被 氧 化 剂 氧 化 *有 活 泼 氢 *与 强 碱 作 用
1、胺的碱性和胺盐的生成 (1)产生碱性的原因: N上的孤对电子
(2)判别碱性的方法: 碱的pKb;其共轭酸的pKa;
形成铵正离子的稳定性。
(3)影响碱性强弱的因素: 电子效应:3o胺 > 2o胺 > 1o胺 空间效应:1o胺 > 2o胺 > 3o胺 溶剂化效应:NH3 > 1o胺 > 2o胺 > 3o胺
溶剂化效应是给电子的,N上的H越多,溶剂化效应越大, 形成的铵正离子就越稳定。不同溶剂的溶剂化效应是不同的。
有机化学 第十二章 含氮化合物
胺的化学性质(P374)
结 构 分 析
2014-12-28
18
1、 胺的碱性和成盐反应
1) 胺的碱性
胺的水溶液和氨一样发生解离反应而呈碱性:
Kb值愈大或pKb值愈小则碱性愈强;反之愈弱。
2014-12-28 19
一些胺的pKb值
2014-12-28
20
①
脂肪胺的碱性大于芳香胺
脂肪胺 氨
芳香胺
2014-12-28
6
12. 2. 1 胺的分类、命名和结构(P370)
1 、 胺的分类:
① RNH2:伯胺; R2NH:仲胺; R3N:叔胺 ② RNH2--脂肪胺; ArNH2 --芳香胺 ③ RNH2:一元胺; H2NRNH2:二元胺;多元胺
*注意: 伯、仲、叔胺与伯、仲、叔醇的不同涵义 叔碳
Hofmann 消除的取向
2014-12-28
33
比较:卤代烷的消除取向—Saytzeff 取向 (决定于产物的稳定性)
H H3C CH2 CH ' CH X
H CH2 NaOC2H5 H3C CH2 CH CH
H CH2
主要
主要产物为双键上取代基最多的烯烃。
2014-12-28 34
Hofmann消除取向的解释 (决定于反应物的结构) 从β-氢的位阻和酸性的差别分析
1 含氮化合物的还原 2 酰胺的降解制备 3 氨或胺的烃基化
2014-12-28
50
1、 含氮化合物的还原
(1)硝基化合物的还原
还原剂:H2-Ni(orPt)、Fe(orSn)+HCl、(NH4)2S……
NO2 + 3H 2 NO2
Fe+HCl Ni 常温常压
有机化学第十二章含氮化合物

三、 胺的物理性质
①物态:低级的脂肪族甲胺(二甲胺、三甲胺)、乙胺在 常温下为气体,其他为液体,高级胺为固体;
❖低级的脂肪胺具有难闻的气味:
(CH3)3N H2N(CH2)4NH2
1,4-丁二胺(腐胺)
三甲胺
H2N(CH2)5NH2
1,5-戊二胺(尸胺)
❖芳胺为无色高沸点液体或低溶点固体,气味不如脂肪胺 大,但毒性较大,可透过皮肤吸入。
H2NCH2CH2NH2
H2N
NH2
乙二胺
有机化学第十二章含氮化合物
对苯二胺
3、芳香族仲胺或叔胺命名时,要标出N上的取代基。
CH3 N C2H5
N-甲基-N-乙基苯胺
CH3 N CH3
N,N-二甲基苯胺
4、对比较复杂的胺,是把氨基作为取代基来命名
CH3CHCH2CHCH3
CH3CH2CHCH2CHCH3
含氮的有机化合物可以看作是相应的无机氮化合物的衍生物。 有机含氮化合物的种类很多,范围也很广,它们的结构特征是 含有碳氮键(C—N、C=N、C≡N)有的还含有N—N、N=N、N≡N、 N—O、N=O 及N—H键等。
本章主要讨论胺,简介硝基化合物及有机磷化合物。
❖胺可以看作是氨分子中的氢被烃基取代的衍生物:
··
·
·
··
··
N
H
H
有机化学第十二章含氮化合物
:
:
:
:
:
NH3 >
NH2
N
H H
NH 2 >
NH
>N
RNR R
pkb 9.30
13.80
近乎中性
综上所述: 脂肪胺 > NH3 > 芳香胺 取代芳胺的碱性取决于取代基的性质。
有机-12-12-含氮化合物

CH3COCl
O NHCCH3
=
Br2
O NHCCH3
=
H2O/H+
NH2
Br
Br
硝化: 芳香胺硝化,氨基应加以保护 磺化:苯胺用浓硫酸磺化时,首先生成盐,在加热下失 水生成对氨基苯磺酸(重排)
NH2
c H2SO4
NH3
+H
SO4
-
NH3+
Δ -H2O
内盐 SO3-
四. 个别化合物
H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
Байду номын сангаас
CH3 N CH2CH3 H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
N-甲基-N-乙基环戊胺
芳香胺:把芳香胺作为母体,其它烃基作为取代基
NHCH3 CH2CH3 Cl N-甲基苯胺 N CH2CH3 N,N-二乙基-4-氯苯胺 邻乙基苯胺 NH2 CH2CH3
复杂胺:以烃为母体,以氨基为取代基
R–C≡N R–N=C=O
Ar–N2+Cl-
异氰酸酯
亚胺 R–CH=NH
§12.1 胺
一. 分类、命名
胺可以看作是氨的烃基衍生物 伯胺(一级胺) 仲胺(二级胺) 叔胺(三级胺) 季铵盐(四级铵盐)
RNH2 R2NH R3N R4N+XArNH2 Ar2NH Ar3N
注意:伯/仲/ 叔胺与伯/仲/ 叔卤代烃及 伯/仲/叔醇分 类方法的区 别
脂肪胺亲核性比氨强,氨与卤代烃反应得混合物
季铵盐是强酸强碱盐,不能与碱作用生成季铵碱 季铵盐与AgOH作用因生成卤化银沉淀,可得到季 铵碱
R4N+X- + AgOH R4N+OH- + AgX↓
O NHCCH3
=
Br2
O NHCCH3
=
H2O/H+
NH2
Br
Br
硝化: 芳香胺硝化,氨基应加以保护 磺化:苯胺用浓硫酸磺化时,首先生成盐,在加热下失 水生成对氨基苯磺酸(重排)
NH2
c H2SO4
NH3
+H
SO4
-
NH3+
Δ -H2O
内盐 SO3-
四. 个别化合物
H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
Байду номын сангаас
CH3 N CH2CH3 H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
N-甲基-N-乙基环戊胺
芳香胺:把芳香胺作为母体,其它烃基作为取代基
NHCH3 CH2CH3 Cl N-甲基苯胺 N CH2CH3 N,N-二乙基-4-氯苯胺 邻乙基苯胺 NH2 CH2CH3
复杂胺:以烃为母体,以氨基为取代基
R–C≡N R–N=C=O
Ar–N2+Cl-
异氰酸酯
亚胺 R–CH=NH
§12.1 胺
一. 分类、命名
胺可以看作是氨的烃基衍生物 伯胺(一级胺) 仲胺(二级胺) 叔胺(三级胺) 季铵盐(四级铵盐)
RNH2 R2NH R3N R4N+XArNH2 Ar2NH Ar3N
注意:伯/仲/ 叔胺与伯/仲/ 叔卤代烃及 伯/仲/叔醇分 类方法的区 别
脂肪胺亲核性比氨强,氨与卤代烃反应得混合物
季铵盐是强酸强碱盐,不能与碱作用生成季铵碱 季铵盐与AgOH作用因生成卤化银沉淀,可得到季 铵碱
R4N+X- + AgOH R4N+OH- + AgX↓
有机化学含氮化合物

例:
NH 2 + CH 3 COCl 苯胺 乙酰 苯胺 NHCOCH
3
NHCOCH
HNO
3
3
H2O H+
NH 2
NO 2 对硝基 乙酰 苯胺
NO 2 对硝基 苯胺
5)磺酰化:胺分子中N原子上的H被磺酰基(R—SO2—) 取代,生成磺酰胺。
RNH
2
+
NaOH
SO 2 Cl 苯磺酰 氯
RNHSO
2
苯磺酰 胺
O 2N Cl NO 2 + H 2 O
Na 2 CO
3
O 2N HO NO 2 + HCl
(煮沸)
★ 原因:—NO2 的吸电子作用使苯环上电子密度降低, 亲核取代易发生。 ② 对酚的酸性的影响:邻、对位上的硝基使酚的酸性 增强。如苯酚pka=9.89,邻硝基酚pka=7.17,对硝 基酚pka=7.16;2,4—二硝基酚pka=3.96。—NO2 对间位取代基也有一定影响,但较弱。如间硝基酚 pka=8.28。
N 2+
0~ 5℃
Hale Waihona Puke PH =6NN
N (C H 3 ) 2
N 2C l
OH
OH 0~ 5℃ PH =8
N
N
CH3
N 2C l
CH3
N (C H 3 ) 2 0~ 5℃ PH =6
N
N
N (C H 3 ) 2
II. 胺 类 12.4 胺的结构与命名
1)结构:
R NH 2 (ArNH2 ) 一级胺 ) 伯胺( R 2 NH (Ar NH ) 2 ( 仲胺 二级胺 ) R3N (Ar 3 N ) 叔胺( 三级胺 ) 脂肪胺 芳香胺
NH 2 + CH 3 COCl 苯胺 乙酰 苯胺 NHCOCH
3
NHCOCH
HNO
3
3
H2O H+
NH 2
NO 2 对硝基 乙酰 苯胺
NO 2 对硝基 苯胺
5)磺酰化:胺分子中N原子上的H被磺酰基(R—SO2—) 取代,生成磺酰胺。
RNH
2
+
NaOH
SO 2 Cl 苯磺酰 氯
RNHSO
2
苯磺酰 胺
O 2N Cl NO 2 + H 2 O
Na 2 CO
3
O 2N HO NO 2 + HCl
(煮沸)
★ 原因:—NO2 的吸电子作用使苯环上电子密度降低, 亲核取代易发生。 ② 对酚的酸性的影响:邻、对位上的硝基使酚的酸性 增强。如苯酚pka=9.89,邻硝基酚pka=7.17,对硝 基酚pka=7.16;2,4—二硝基酚pka=3.96。—NO2 对间位取代基也有一定影响,但较弱。如间硝基酚 pka=8.28。
N 2+
0~ 5℃
Hale Waihona Puke PH =6NN
N (C H 3 ) 2
N 2C l
OH
OH 0~ 5℃ PH =8
N
N
CH3
N 2C l
CH3
N (C H 3 ) 2 0~ 5℃ PH =6
N
N
N (C H 3 ) 2
II. 胺 类 12.4 胺的结构与命名
1)结构:
R NH 2 (ArNH2 ) 一级胺 ) 伯胺( R 2 NH (Ar NH ) 2 ( 仲胺 二级胺 ) R3N (Ar 3 N ) 叔胺( 三级胺 ) 脂肪胺 芳香胺
《有机化学》第12章 含氮、磷有机化合物

21
⑶ 磺化反应
苯胺直接磺化时,它首先与硫酸形成盐,得到的是间位氨基苯磺酸。要想使磺酸基 进入氨基的邻、对位,必须先乙酰化,然后再磺化。如果在160℃~180℃加热苯胺 与硫酸生成的硫酸氢盐,也可得到对位取代产物—— 对氨基苯磺酸。这是工业上生 产对氨基苯磺酸的方法。
一般情况下,磺酸基进入氨基的对位。若对位已有取代基,则进入氨基的邻位:萘 胺也会发生类似的反应。例如:
等的良好溶剂,另外一硝基烷毒性不大,用作溶剂较好。虽然它们的分子间不能形成
氢键,但和相对分子质量相近的其它物质相比,却有较高的沸点。例如:
化合物 相对分子质量
CH3NO2 61
CH3COCH3 58
CH3CH2CH2OH 60
沸点/℃
101
56.5
97.2
芳香族的一硝基化合物一般是无色或淡黄色的液体或固体。多硝基化合物则多为黄色
固体,都不溶于水,易溶于有机溶剂如乙醚,四氯化碳等;多硝基化合物具有爆炸性,
可作炸药,例如2,4,6一三硝基甲苯(TNT);有的多硝基化合物具有香味,例如,二
甲苯麝香、酮麝香等可用作香料。
硝基化合物的相对密度都大于1。硝基化合物均有毒,皮肤接触或吸收蒸气能和血液 中的血红素作用而引起中毒。
3
2. 脂肪族硝基化合物的化学性质 ⑴ 还原反应
三硝基烷与亚硝酸不起反应,此性质可用于区别三类硝基化合物。不含α-H原 子的硝基化合物也不发生此反应。
2023/6/13
5
3. 芳香族硝基化合物的化学性质
芳香族硝基化合物由于没有α-H且氮原子处于高氧化态,硝基的强吸电子作用又使 苯环钝化,所以芳香族硝基化合物性质比较稳定,其主要化学性质如下:
⑴ 硝基的还原反应
含氮有机化合物

CH 3
HOOCCH 2CH 2
CH 2CH 2COOH
整理课件
(二) 噻唑
噻唑是无色有臭味的液体,沸点117℃,与水混溶。许多 重要的药物如维生素B1、青霉素G等都含有噻唑环。
H N
O O
S CH3
N
CH3
COOH
青霉素G
整理课件
整理课件
(三) 咪唑
咪唑是无色晶体,熔点90℃~91℃,易溶于水和乙醇,具 有碱性,能与强酸生成稳定的盐。含咪唑环的药物如抗真菌 药克霉唑,抗阿米巴药、抗滴虫药、抗厌氧菌药甲硝唑等。
整理课件
三、重要的酰胺及其衍生物
(一)尿素
尿素简称脲,白色结晶,熔点为133℃,易溶于水和乙醇。
O H2N C NH2
整理课件
1.弱碱性
尿素分子中含有两个氨基,呈弱碱性,可与强酸生成盐。
硝酸脲
整理课件
2.水解反应
脲在酸或碱的催化下,加热时发生水解;在脲酶作用下, 水解反应在常温下就能进行。
CO( 2)2NH +2O脲 H 酶2 +3 CO 2NH CO(2N)2H + 2NaOH 2CO3 + N23aNH
N
N
N
O
S
N H
S
N
NN H
整理课件
一、杂环化合物的分类、命名
(一)分类
杂环
单杂环
五元杂环 六元杂环
苯稠杂环-苯环与杂环稠合 稠杂环
杂稠杂环-杂环与杂环稠合
整理课件
1.五元杂环
O
S
N
N
S
N
H
整理课件
N H
N N H
2.六元杂环
第十二章 含氮有机化合物

CH3 CH3 N
HCl + NaNO2 80C
CH3 N CH3
N=O
翠绿色
H
+
CH3 OH N= =N
桔黄色
N(CH3)2 HCl
OH
CH3
CH3
NaNO2 CH3 N NO CH3 CH3
+
6.氧化 胺比较容易被氧化,尤其是伯芳胺极易被氧化。苯胺在放 置时就会被空气氧化而颜色变深。
NH2 O
HO
+
R
/
CCl
(CH3CO)2O
O C R/ RNH
HO O NH CCH3
NH2
+ CH3COOH
磺化反应(兴斯堡Hinsberg反应):10、20、30胺的反应表 现有区别,可用来鉴定三类胺。
1
0
RNH2
+
O Cl S O
O RNH S O
NaOH
RNO2S
Na+
有酸性
20
R2NH +
O Cl S O
R CH2 NO2
+ NaOH
R CH2 NO2
Na
+ H2O
特点: 硝基化合物含有α-H,可溶于NaOH溶液,不 含α-H的硝基化合物无此性质.
2.还原反应 硝基化合物在不同条件下还原,得到不同的还原物,用强 还原剂还原的最终产物是伯胺.例如,在酸性介质中以Fe 粉还原硝基苯生成苯胺:
稀 Fe 、 HCl NO 2
N H H
:
N
三. 胺的制备 1.腈的还原
RC
N
+2H2
Ni
RCH2NH2
2.硝基化合物的还原
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胺的结构
sp3
o
N
105.9
H3C112.9oH H
R1
N R2
R3
R1
N R2
R3
孤电子对使胺具有亲核性、碱性; 简单手性胺易发生对映体 的互相转变。
氮原子上连有四个不同基团的季铵化合物具有旋光性,
CH3
H5C2
N+ ph CH2CH=CH2
CH3
N+
ph
C2H5
CH2=CHCH2
芳香胺
氮原子为不等性的sp3杂化。(具 N H 有某些sp2 特征)
H
• 物理性质 气味(p186) 10 胺、20胺能形成分子间氢键。(N-H···N)弱于(O-H···O)。
CH3CH2OCH2CH3 34.5oC
(CH3CH2)2NH 56oC
CH3CH2CH2CH2OH 117oC
试推测 a. 相同分子量的伯、仲、叔胺的沸点顺序。
CH3CH2CHCHNHCH3 H3C CH3
3-甲基-2-(N-甲氨基)戊烷
H2N
O COC2H5
4-亚氨基-2-戊酮
对氨基苯甲酸乙酯
[季铵化合物] 将负离子和取代基的名称放在“铵”字前
[(CH3)2CH]4N+I-
碘化四异丙铵
CH3
CH2CH2OH N+ CH3 OHCH3
氢氧化(2-羟乙基) 三甲铵(俗名胆碱)
N(CH3)3
δ+
CH3CH2CH2CH=CH2 + N(CH3)3 + H2O
E2消除 主要得到双键碳上取代基较少的烯烃。
CH3CH2CHCH3 E2 +N(CH3)3 OH -
反应速率快 CH3CH2CH2CH=CH2 动力学控制的产物
CH3CH2CHCH3 E2 CH3CH2=CH2CH3 X
溶于NaOH 呈红色溶液
R2 C NO2 NO
蓝色结晶
NaOH
不溶于NaOH 蓝色不变
4.还原反应
• 硝基化合物可在酸性还原系统中(Fe、Zn、Sn和 盐酸)或催化氢化为胺。
• 硝基苯在酸性条件下用Zn或Fe为还原剂还原,其 最终产物是伯胺。
NO 2
Fe or Zn HCl
NH2
硝基化合物在酸性条件下反应,经过下列几步还原为
NH2 > O2N
NH2
试判断下列化合物的碱性强弱(由强至弱排序)
CH3 N
aN
b
CH3
N
N
c
CH3 N
N
CH3
d
e
D>a>c>e>b>f。
f
NO2
• 胺与酸作用成盐 (分离提纯、胺类化合物的保存)
RNH2 + HX
RNH3+X- OH- RNH2
普鲁卡因:
O
+
(C2H5)2NCH2CH2OC H
1o胺
HCl
CH3CH2CH2N+ NCl重氮盐
用于氨基的定量测定
O CCH2CH3
O + CH3CH2CCl
CH3CH2CH2++Cl- + N2 醇、烯、卤代烃等
重氮化反应
NH2 + NaNO2 + HCl O~5oC
N2+Cl-
Ar(R)NH(或R2NH) + HONO 2o胺
Ar(R)N NO(或R2N NO) N-亚硝基胺 致癌剂
(氧化胺)
氧化胺为四面体构型。氮原子上连不同取代基时:
O-
N+ C6H5 H3C C2H5
O-
N+ H5C2CH3 C6H5
3o胺氧化物的Cope消除反应 氧化胺 碳上连有氢,热分解氧化胺得烯和羟胺。
H
O-
CH3 CH CH2 N+ CH3
CH3
OH CH3 CH CH2 + N CH3
CH3
b. 相同分子量的伯、仲、叔胺在水中的溶解度顺序。
RR RNHNHNH
HHH RNH H
2. 胺的化学性质 1) 碱性和成盐
NHOH N H OH2
RNH2 + H2O
RNH3+ + OH-
胺的氮原子上有孤对电子,能结合水中的质子。
CH3NH2 3.38
(CH3)2NH 3.27
(CH3)3N 4.21
反应经环状过渡态,顺式消除。
CC
H
N+R2
-O
C6H5 C
C2HH5
HD H2O2 C
NMe2
C C + R2NOH
?C6H5
C
D C
C2H5
H
5) 曼尼希(mannich)反应 含活泼氢的化合物与甲醛(或其它醛)及胺类化合物的缩合 反应。
OH
O
H
H+
R C CHR' + H C H + N(CH3)2
第十二章 含氮化合物(p182)
第一节 硝基化合物
一、硝基化合物的分类、结构和命名: 烃分子中的氢原子为硝基取代的衍生物为硝基
化合物 根据烃的不同分类为:脂肪族硝基化合物
芳香族硝基化合物 命名:硝基总是取代基,以相应烃为母体。 举例
对硝基甲苯
结构:硝基结构,为共振杂化体结构 一般表示为 (由一个N=O和一个N→O配位键组成)
活泼氢被胺甲基取代——胺甲基化反应
O RCCHCH2N(CH3)2
R' mannich base
O
O
H
H+
+ H C H + N(CH3)2
O CH2N(CH3)2
H CH3 N
H HCHO
CH3 N
O H O
O HCH + HNR2
H
OH C NR2
H+(-H2O) H
H C
N+R2
OH
OH
R C CH R'
NH2 2)湿 Ag2O
A
B
CH3
CH3
+N(CH3)3 OH-
B
+ N(CH3)3
3) 酰化与磺酰化
• 酰基取代胺氮原子上氢的反应。 (酰化)
NH2
(CH3CO)2O or CH3COCl
NHCOCH3
(n-C4H9)2NH +
COCl
O CN(C4H9-n)2
HO
NH2 (CH3CO)2O HO
• 用途: • 一元氯化硝基苯是橡胶,医药和染料工业的重
要原料。 • 多元硝基化合物是炸药。
2.化学性质
1.酸性 例如硝基甲烷、硝基乙烷、硝基丙烷的
pKa值分别为:10.2、8.5、7.8 。
O R CH2 N O 假酸式(主)
OH NaOH R CH N
O R CH N
Na
O
O
酸式 (较少)
2.与羰基化合物缩合
NH3 4.76
NH2 9.37
O2N
NH2 CH3
NH2
13.0
8.92
碱性强度:脂肪胺 > 氨 > 芳香胺
试从铵正离子的稳定性及胺接受质子的能力方面进行分析。
碱性强度: 二甲胺 > 甲胺 > 三甲胺 (在水溶液中)
从I 效应、位阻等方面讨论。
芳香胺的碱性强弱与芳环上取代基的性质有关。
CH3
NH2 >
NHCOCH3
扑热息痛
• 磺酰基取代胺氮原子上氢的反应
O 磺酰基:(Ar)R S
O
(磺酰化)
RNH2 +
SO2Cl
SO2NHR
兴斯堡(Hinsberg)反应 分离鉴别一级、二级、三级胺
RNH2 R2NH R3N
SO2Cl
SO2NHR NaOH
SO2N- RNa+
SO2NR2 (不溶于NaOH水溶液)
C2H5OH NO2
OH
O2N
NH2
NO2
不同试剂
选择不同位, 但无规律
第二节
CH3 H NHCH3 H OH
ph
D-(-)-麻黄素
胺
N CH3
H
阿托品
OCOCHCH2OH
ph
1. 命名、结构与物理性质
NH3 氨
RNH2 1o胺
R2NH 2o胺
R3N 3o胺
R4N+X季铵盐
季铵化合物:氮原子上连有四个烃基的衍生物
R CH2 NO2 +
R'
C
O H
OH
(R'' )
3.与亚硝酸的反应
OH H
R' C C NO2 H R'
(R'' )
H2O R' C C NO2 H R'
(R'' )
R CH2 NO2 + HONO R2 CH NO2 + HONO
R CH NO2 NO
蓝色结晶
NaOH R C NO2 Na NO
在碱作用下,较少烷基取代的碳原子上的氢优先被消除,生
成双键碳上烷基取代较少的烯烃。
H
H OH -
CH3CH2CH CH CH2
+N(CH3)3
H
H
CH3CH2CH CH CH2 OH-
+N(CH3)3
CH3CH2CH2CH=CH2 + (CH3)3N + H2O
δ-
H
H OH
[ ] CH3CH2CH CH CH2
