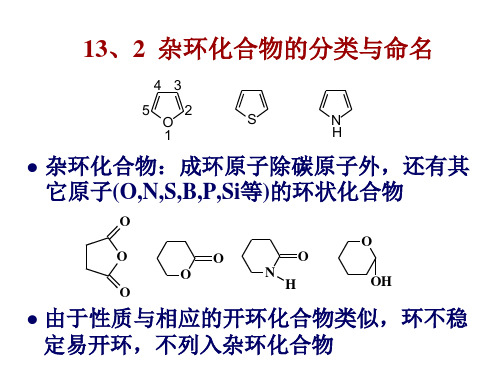
杂环化合物的分类和命名
有机化学---第17章 杂环化合物

、 内酯、环状酸酐等。
环为平面型共轭体系,环内π电子数符合4n+2规 则,具有一定芳香性的杂环化合物。
2
2、杂环化合物的分类
五元杂环, 如 单杂环 六元杂环, 如 杂环化合物 稠杂环 两个以上单杂环稠并
N N N H
O N
N H
S
苯环与单杂环稠并, 如 N H
N
N
3
3、杂环化合物的命名 (1)音译法 ——在同音汉字左边 + 口字旁
N ..
H2SO4,HgSO4 220℃
N
N
NO2
β-硝基吡啶
SO3H
β-吡啶磺酸
34
当吡啶环上连有供电子基团时,将有利于亲电取
代反应的发生;反之,就更难以进行亲电取代反应。
NO2
HNO3,H2SO4
H3 C N CH3
100℃
H3 C
N
CH3
吡啶环也象硝基苯一样,不能发生F―C烷基化和 酰基化反应。
吲哚具有芳香性,亲电取代反应发生在吡咯环上; 吲哚亲电取代反应的活性比苯高,但比吡咯低。 亲电取代反应的位置:
5 4 3 7
E+
1
苯 环
6
N H
2
吡咯环
26
进攻 C2 N H + E
+
进攻 C3
只有一个带有完 E N 2 H 整苯环的共振杂化体。 H 3 E 3 E H H + + N N H H
OH
6
S1
苯并呋喃
1
苯并吡咯 喹啉
N
9 7 8
苯并噻唑
N N
3
5 4
HO
N H
OH
大学有机化学第十一章杂环化合物

环状有机化合物中,构成环的原子除碳原 子外还有其他类型的原子时,这类环状有 机化合物叫做杂环化合物。非碳原子称为 杂原子。最常见的杂原子有O、S、N 。 杂环根据其性质可分为脂杂环和芳杂环。 杂环化合物在自然界中分布广泛,是重要 的、也是最大的一类有机化合物。
一、分类和命名
N HN (in d o le ) H (in d o le ) 吲哚 吲哚
N NH N (p u rin e ) H (p u rin e ) 嘌呤 嘌呤
⑵系统命名法:根据相应的碳环母体命名, 命名时在相应的碳环母体名称前面加上杂原 子的名称。
N H
茂
S S
N H
氮茂 O O
N H
N H
S S O
4γ β 5 α 6 3β 2α
1-硫-3-氮茂 (噻唑) β α
N H N
1,3-二氮苯 (嘧啶)
CH3
O
β α
N
1
一些多杂原子的杂环,有其固定编号。
6 1 5
N N
3
N
7 5 8 6
2 4
N9 H
1,3,7,9-四氮茚 (嘌呤)
当环上连有烃基时,一般以环作为母体。 如连有官能团时,则以环作为取代基。
1.分类: 单杂环:五元杂环和六元杂环 稠杂环:苯环和单杂环稠合、单杂环和单 杂环稠合 2.命名: ⑴音译法:根据杂环的英文名称译音,带 “口”字旁的同音汉字表示。
N NH (pH le ) yrro (p yrro le ) 吡咯 吡咯 N
N N N (p yrim id in e ) (p yrim id in e ) 嘧啶 嘧啶
CH3 N
杂环化合物的命名

环的编号规则
环的编号规则是 按照环的大小和 位置进行编号的。
环的编号规则是 按照环的大小和 位置进行编号的。
环的编号规则是 按照环的大小和 位置进行编号的。
环的编号规则是 按照环的大小和 位置进行编号的。
取代基的命名规则
取代基的命名应 遵循IUPC命名规
则
取代基的命名应 从取代基的母体
开始
取代基的命名应 遵循取代基的优
THNKS
汇报人:
杂环化合物的命名
,
汇报人:
目录
01 杂 环 化 合 物 的 定 义 和分类
03 常 见 杂 环 化 合 物 的
命名示例
05 杂 环 化 合 物 的 命 名
练习
02 杂 环 化 合 物 的 命 名 规则
04 命 名 杂 环 化 合 物 时 的注意事项
Prt One
杂环化合物的定义 和分类
杂环化合物的定义
喹啉衍生物:含有 一个或多个取代基 的喹啉化合物
异喹啉衍生物:含 有一个或多个取代 基的异喹啉化合物
嘌呤类化合物
嘌呤类化合物包括:腺嘌呤、鸟嘌呤、黄嘌呤、次黄嘌呤等
命名规则:根据杂环化合物的结构和性质进行命名
示例:腺嘌呤(denine)、鸟嘌呤(Gunine)、黄嘌呤(Xnthine)、次黄嘌呤 (Hypoxnthine)
嘧啶类化合物
嘧啶类化合物:含有两个氮原子的六元杂环化合物 命名规则:根据氮原子的位置和取代基的不同进行命名 示例:2-甲基嘧啶、3-乙基嘧啶、4-氯嘧啶等 注意事项:命名时需注意氮原子的位置和取代基的顺序
喹啉类化合物
喹啉:含有一个氮 原子的六元杂环化 合物
异喹啉:含有两个 氮原子的六元杂环 化合物
杂环化合物的分类和命名

O2,NaOH Cu2O-HgO,55℃ -COOH
O2,320~350℃ V2O5-TiO2-SiO2
O H-C-C = O H-C-C O
15
2
O
-CHO
O
-CH2OH
O
-COOH
O
-CHO
+(CH3CO)2O
O
-CH=CH-COOH
16
三、噻吩: 噻吩: 制法: 1.制法: 制法 ⑴工业上: 工业上:
-CH3 KMnO ,OH4 △ N -COOH N
还原: 还原:
H2,Pt 或C2H5OH+Na N
N
28
二、喹啉和异喹啉: 喹啉和异喹啉:
存在: 存在:存在于煤焦油或骨焦油中 制备——斯克洛浦合成法: 斯克洛浦合成法: 1.制备 制备 斯克洛浦合成法
- - - CH2-CH-CH2 OH OH OH H2SO4 -3H2O CH2=CH-CHO - H O=C
+H2SO4+靛蓝 △
兰色
反应灵敏
20
四、吡咯
1、制备: 制备: 为催化剂, ⑴工业上用Al2O3为催化剂,呋喃和氨气相反应 工业上用
+NH3 Al2O3 450℃ + H 2O
O
N
⑵工业上还可用乙炔与NH3通过红热的管子 工业上还可用乙炔与 通过红热的管子
2CH -CH - +NH3 △ + H2
N
N
吡啶
喹啉
4
当环上有取代基时: 2.当环上有取代基时: 当环上有取代基时 ⑴以杂环为母体,编号时从杂原子开始,将杂原子编为1号, 以杂环为母体,编号时从杂原子开始,将杂原子编为1 依次1 依次1,2,3······,或与杂原子相邻的碳原子遍为 ,依 ,或与杂原子相邻的碳原子遍为α, 次为α, , 次为 ,β,γ······
杂环化合物的分类与命名
I(CH2)4I
浓 H2SO4 佯盐
噻吩的氢化还原
H2
S MoS2
S
C2H5OH,Na S 化学还原法
+
S
S
二氢噻吩
噻吩的S使催化剂中毒,需用不会被硫毒化的 催化剂,如MoS2
13、4 六员环的结构与性质 一、六员环的结构
..
.
.p
. . N .. sp2
N
未成键的sp2杂化轨道有一对电子,没有参与共轭,N 对C只有吸电子诱导效应,没有共轭效应,使碳上的电 子云密度降低,属缺π电子芳香杂环体系
N 25℃,0.3MPa
N
H
吡啶比呋喃、噻吩、吡咯难 还原,由于偶极矩的存在,比 苯易还原
吡啶与吡咯碱性比较
N
+ KOH
H
N -
K+
吡咯钾
+ HCl N
.HCl N
利用二者酸碱性不同分离
吡啶盐酸盐
一般化合物的碱性顺序
季铵碱>脂肪胺> 氨 > 吡啶 >苯胺> 尿素>酰胺>吡咯
pKb
3-4 4.75 8.6 9.4
呋喃
S
thiophene
噻吩
N
pyrrole
吡咯
N N
imidazole
咪唑
NN
pyrazole
吡唑
N S
thiazole
噻唑
3、稠杂环的命名
N H
indole
吲哚
N
N
NN H
purine
嘌呤
N
quinoline
喹啉
O
benzopyran
杂环类化合物的命名

二唑
4N
N3
4 5
6 7
吲哚
3
2
N
1
9
咔唑
8
1 2
7
3
6
N
H5
4
5
含2个或2个以上杂原子的五元杂环
H4
N
5 N3
1H-四唑
4 5
6
苯骈呋喃 3 2
1N
N2
7
O
1
4 5
苯骈噻唑
N3
4 5
苯骈咪唑
N3
6 7
2
S
1
6 7
2
N H
1
6
六元环—含1个杂原子的六元杂环
4
5
3
吡啶
哌啶
6
2
N
N
1
H
H2 C
α-吡喃 CH2
• 母体部分和取代部分确定后、,各环的绸合位置(即公用 边)需表示清楚,方法如下:
• A 母体各边按单环编号的位置将各边标以a,b,c ,即C 1和C2之间为a,C2和C3之间为b,依次类推。
• B 取代部分根据原单环正常编号顺序,将各原子标以1, 2,3等,若取代部分为纯碳环,应使稠边编号最小。
• C 命名时,在[ ] 内将取代部分的数字列前,母体部分的 字母列后,数字和字母之间用“-”相连,然后将[]放在 取代名称和母体名称之间。
• C 环大小不同,选大环为母体
4 5
6
N
7
3
2
N H
1
d种类不同的,选种类最多的杂环为母体 吡咯骈[2,3-b]吡啶
4
HN
N3
5
N
6
2 咪唑骈[5,4-d]噻唑
【有机化学】杂环化合物

呋喃、噻吩的酰化反应在-C上发生,而吡咯的酰化反 应(不用催化剂)既能在 -C上发生,又能在N上发生。
(6) 呋喃、噻吩、吡咯的傅氏烷基化反应
总体看,在合成上无实用价值。
+ CH2O + HCl S
ZnCl2 0℃
CH2O + HCl ZnCl2, 25oC
ClH2C S
CH2Cl S CH2Cl
2.环的稳定性顺序 (根据离域能的大小) 苯〉噻吩〉吡咯〉呋喃 150 122 90 68
遇氧化剂或酸不稳定
3 吡咯的反应
NBS
N H
HNO 3, ( CH3C O )2O N H
N , SO3 N H
DMF, PO Cl3 N H
Br N H
NO 2 N H
SO 3H N H
C HO N H
+C 6H5N2+C l-
5
1
N H
2α
吡咯(pyrrole)
4
5
3
6 7
2 N H1
苯并吡咯
吲哚 (indole)
四 六元杂环化合物的命名
六元杂环
γ 4
5
3β
6 N 2α 1
吡啶(pyridine)
4
5
3
6
N2
N
1
哒嗪(pyridazine)
γ 4
5
3β
6 O 2α 1
O
4
5
3
6O 2 1
4
5
3
6
2
OO
1
吡喃(pyran) γ-吡喃酮
HNO 2
RO
Zn - HOAc
RO
EtOOC
第10章杂环化合物

第10章杂环化合物第10章杂环化合物§杂环化合物的分类和命名分类1、按照环的多少分类单杂环:常见的是五元杂环和六元杂环,环上的杂原⼦有⼀个或两个。
五元杂环:六元杂环:吡喃没有芳⾹性,⽣成盐后则具有芳⾹性。
稠杂环:由苯环与单杂环或两个以上单杂环稠合⽽成的。
命名常见的基础杂环多数是具有芳⾹性的,命名时作为杂环化合物的母核。
1、⾳译法中⽂名称采⽤⾳译法,⽤带⼝字旁的同⾳汉字表⽰。
对于⽆特定名称的杂环化合物,中国化学会1980年颁布的有机化学命名原则规定:采⽤“杂”字作介词,把杂环看作是相应的碳环母核中碳原⼦被杂原⼦置换后的衍⽣物来命名。
国外现在采⽤的Hantzsch-Widman系统,规范了10元以下⼀般杂环的词尾词⼲的书写格式。
为了正确表明取代基位置,需将杂环母核编号,编号规则主要有:(1)含⼀个杂环原⼦的单杂环,从杂原⼦开始编号。
有时也使⽤希腊字母,把靠近杂原⼦的位置叫做α位,其次是β位,再其次是γ位。
(2)含两个及以上相同杂环原⼦的单杂环,编号从连有氢原⼦的杂原⼦开始,并使另⼀杂原⼦所在位次保持最⼩。
(3)含两个及以上不同杂环原⼦的单杂环,编号从价数⼩杂原⼦开始,价数相同时则从原⼦序数⼩的开始。
因此,常见杂原⼦编号优先顺序为O、S、N。
⼀般常见的稠杂环有特定的编号,或是沿⽤习惯。
§五元杂环化合物结构和物理性质1、结构这三种杂环上的原⼦都是sp2杂化,为平⾯结构。
每个碳原⼦垂直于环平⾯的p轨道有⼀个电⼦,杂原⼦垂直于环平⾯的p轨道有⼆个电⼦。
三种杂环π电⼦数都是6个,符合休克尔规则,都具有⼀定的芳⾹性。
结构特点:杂原⼦sp2杂化,未成键电⼦对在2p轨道上,参与共轭。
从吡咯的共振式看出,杂原⼦氮上部分负电荷分布到了碳原⼦上。
杂原⼦共轭效应是推电⼦的,诱导效应是吸电⼦的。
由于6个π电⼦分布于5个原⼦上,整个环的π电⼦⼏率密度⽐苯⼤,是富电⼦芳环。
因⽽⽐苯环活泼,亲电取代反应⽐苯快得多。
杂环化合物的分类和命名

17.1 杂环化合物的分类和命名 17.1.1分类17.1.2命名1.音译法 以口字傍为杂环标志。
2.系统命名法3.取代杂环的命名① 杂环的编号从杂原子起依次1,2,3 ……(或:α,β,γ……)。
②如环上不止一个杂原子时,则从O 、S 、N 的顺序依次编号。
③ 有两个相同杂原子的,应从连有H 原子或取代基的开始编号。
④ 编号时注意杂原子或取代基的位次之和最小。
17.2 五元杂环化合物 —— 吡咯、呋喃、噻吩17.2.1结构 1.经典结构 2.分子结构据现代物理方法证明:① 呋喃、吡咯、噻吩是一个平面结构。
② 环上的C 原子和杂原子都是以SP 2杂化轨道成键的。
③ 五个没有杂化的P 轨道垂直于环平面,形成闭合共轭体系。
④ 属于富电子芳环。
⑤ 环形π电子分布于杂环平面的上、下两方。
⑥ 共轭能3.芳香性① 符合休克尔规则,π电子数为6。
杂环单杂环五元环六元环苯环与单杂环的稠合杂环(苯并杂环)两个或两个以上单杂环的稠合杂环OSN H稠杂环NN NNN HN②芳香性比较(易取代、难加成、难氧化):苯>噻吩>吡咯>呋喃③解释环的稳定性:苯>噻吩>吡咯>呋喃17.2.2呋喃、噻吩、吡咯的制备帕尔-诺尔合成法:用1,4-二酮合成。
17.2.3化学性质1.亲电取代反应①卤代②硝化乙酰硝酸酯是较为温和的砂化剂,用时临时制备。
③磺化噻吩在室温下可直接磺化,生成溶于水的α-噻吩磺酸。
这个反应常用来除去粗苯中的噻吩。
吡咯和呋喃对酸敏感,吡咯在酸性条件下易聚合;呋喃遇酸要开环,故需与吡啶三氧化硫为磺化剂。
④乙酰化⑤亲电取代反应小结a.亲电取代反应的活性吡咯>呋喃>噻吩>>苯181111B.亲电基团一般进入杂原子的邻位静态时,α-位上的电子云密度较其它位大。
2.加成反应呋喃加成反应的较容易。
3.特征反应①呋喃的双烯特征②吡咯的弱酸性和弱碱性弱酸性吡咯N原子上的H原子都有微弱的酸性酸性比较:苯酚>吡咯>乙醇Ka: 1.3*10-10 10-1510-18弱碱性苯胺>吡咯K b3.8*10-10 2.5*10-144.鉴别反应①呋喃使盐酸浸过的松木片显绿色。
杂环化合物的命名

3-甲基吡咯
4. Br
3-吡啶乙酮
COOH 5.
4-甲基-2-硝基嘧啶
OH N N OH N N H
N H
HO
5-溴-3-吲哚甲酸
26
2,6,8-三羟基嘌呤
1.
+ I N H 3C CH3
2. O
Cl
3. N H 6. N
1、碘化N,N-二 甲基四氢吡咯
2、β-氯代呋喃
3、六氢吡啶 4、α-噻吩磺酸
4 5 6 N 1 3 N2
5 6 N 1 4 N3 2
5 6
4 N N 1
3 2
哒嗪 (pyridazine)
嘧啶 (pyrimidine)
吡嗪 (pyrazine)
(三)、常见的杂环母核
稠杂环化合物 1. 吲哚 吲哚是白色结晶,熔点52.5℃。极稀溶液有香味, 可用作香料,浓的吲哚溶液有粪臭味。素馨花、柑桔 花中含有吲哚。吲哚环的衍生物广泛存在于动植物体 内,与人类的生命、生活有密切的关系。
2-甲基呋喃 (a-甲基呋喃)
CH2CH3 N
4-乙基吡啶 (g-乙基吡啶)
N H
3-硝基吡咯 11 (b-硝基吡咯 )
2.含有两个或两个以上相同杂原子,要使杂原子编号最 小,并将连有氢原子或取代基的杂原子编号定为1号; 含不同杂原子时,按O→S→NH→N的次序编号。
H3C 4
5
N N1 H
3
4
2
Ph
6
5
4 b 2 a 3 N7 S1 1N c 3 2
38
5-苯基 咪唑并[2,1-b]噻唑
3 N 4 c b 5 2 1 5d a 2 Cl N S CH2OH 6 H 1 N3
有机化学-第十三章

3.命名
取代基位号及名称加上母环的名称即为杂环化合物的 名称,例如:
课堂练习
1、命名下列杂环化合物: (1)
Br
(2)
CH3
N
O
NO2
2 – 硝基 – 4 –溴呋喃
3 – 甲基吡啶
杂环化合物的结构与芳香性
一、五元单杂环化合物的结构和芳香性
五元单杂环如呋喃、噻吩、吡咯,在结构上,都符 合 Huckel 的关于芳香性的规则,即环上原子共平面,彼 此以 σ 键相连接,四个碳原子各有一个电子在 p 轨道 上,杂原子有两个电子在 p 轨道上,这些 p 轨道都垂直 于σ 键所在的平面,相互重叠形成大 π 键——闭和的 共轭体系,π 电子数目为4n+2。结构如图所示:
亲电取代反应主要发生在 α 位上
二、定位规律
对五元杂环的亲电取代反应环上取代基有一定的定位 作用,以噻吩为例,说明如下: (1)当 α 位上有邻对位定位基(x)时,亲电试剂(E)主 要进入 5 位,3 位次之:
(2)当 α 位上有间定位基(Y)时,则 E 主要进入 4 位,少量进入 5 位:
近年发现不少天然存在的呋喃或氢化呋喃衍生物,具 有明显的生物活性或药用价值。例如,从重斑病感染的薯 类植物块根中分离的苦味成为含多种呋喃衍生物,如3-呋 喃甲酸,巴他酸(bacatic acid),番薯酮等
二、α-呋喃甲醛
1.来源与制备 呋喃甲醛最初是从米糠中得来,故俗称糠醛,因为这 些农副产品中都含有戊聚糖,在稀酸作用下水解成戊醛糖 ,再进一步脱水环化,得到糠醛:
4)综上所述,它们的芳香性由强到弱的顺序为:
二、六元单杂环化合物的结构和芳香性
吡啶具有六元单杂环的典型结构和苯的结构很相似, 是苯中的一个碳原子被氮原子代替,氮原子以 sp2 杂化 轨道和两个相邻碳原子的 sp2 杂化轨道形成两个 σ 键 。环上每个原子均有一个 p 轨道垂直于环的平面,组成 闭合的6电子大 π 轨道,因此,吡啶环也有芳香性。吡 啶的结构如图所示:
第十二章 杂环化合物

0.1431 0.1361
0.1362 O 0.70D
0.1423 0.1370
0.1714 S 0.51D
芳香性:苯 > 噻吩 > 吡咯 > 呋喃
N H
1.58D
键长
0.1429
0.1371
0.1383 N H
1.81D
8
2、吡咯、呋喃、噻吩的化学性质 (1) 亲电取代反应(Electrophilic Substitution)
N S
浓H2SO4,SO3
N S
1,2-唑取代 在4-位
Br
N
Br2
N AcOH-H2O
H
N N H
N
O2N N
HNO3,H2SO4
N
N
H
H
O2N NH 咪唑环取代在4-位
N
N 发烟H2SO4
S
HgSO4, 250℃ HO3S
N
噻唑环取代以5-位为主
S
25
唑的烷基化或酰基化通常发生在氮原子上。
N CH3I S
碱性:
NH O pKa -2.03
H N O 1.3
H N S 2.4
NH N H 2.5
1,2-唑与1,3-唑的亲电取代反应的活性顺序有:
H N N H 7.0
1,2-唑 1,3-唑
N>
N H
N >
N H
N>
N
S
O
N
> S
N O
24
亲电取代反应
N HNO3,H2SO4 O
O2N N
O
HO3S
H2S
O
NH
3
H2O
H 2S
有机化学17章-杂环化合物

H
N
H2SO4, HgSO4 230 ° 70% C,
吡啶不能起Friedel-Craft反应
N
Br2 300 ° C
三、 六元杂环化合物
(C) 亲核取代反应:与强的亲核试剂起亲核取代反应,主要生成 α-取代产物 。
+
NaNH2 N
H 2O NHNa N NH 2
N
+
C6H5Li N
+
LiH
N
C6H5
二、 五元杂环化合物
吲哚:由苯环和吡咯环稠合而成的,因此也叫做苯并吡咯
CH2COOH N H 吲哚
CH3 N H
N H 3-吲哚乙酸
Br2 CH3COOH
CH3 N H Br
二、 五元杂环化合物
(4) 咪唑和噻唑:较常见的含有两个杂原子的五元杂环化合物
N N H 咪唑 S
N
H C
N
C
H N
H
噻唑
1.分类和命名 分 类:以杂环的骨架为基础 按环的大小——最重要的是五元杂环和六元杂环;
按杂环中杂原子数目的多少——单杂原子的杂环和多
杂原子的杂环; 按环的形式——单杂环和稠杂环
N O furan 呋喃 S thiphene 噻吩 N H pyrrole 吡咯
N pyridine
N quinoline 喹啉
二、 五元杂环化合物
由于五元杂环化合物的高度活泼性及呋喃和吡咯对无机强酸的 敏感性,亲电取代反应需要比较温和的条件
Br2 0~5℃ O CH3C ONO2 -10℃ (CH3CO)2O N H C5H5N SO3 室温 O CH3C CI SnCI4 N H N H N H O SO3 O C CH3 乙醚 Br Br N H NO2 Br Br O Br2 O O 0~5℃ O Br
中国药科大学有机化学课件—第十四章杂 环 化 合 物

(一) 吡啶
1 电子结构
孤电子对 在sp2杂化 轨道上。
共轭效应和诱导效应都是吸电子的
结构:吡啶N是sp2杂化,孤电子对不参与共轭。 反应:碱性较强。环不易发生亲电取代反应但易发生亲核
取代反应。发生亲电取代反应时,环上N起间位定 位基的作用。发生亲核取代反应时,环上N起邻对 位定位基的作用。
2 物理性质
中国药科大学有机化学课件—第十四章杂 环 化 合 物
主要内容
第一节 杂环化合物的分类和命名 第二节 六元杂环化合物 第三节 五元杂环化合物
第一节 杂环化合物的分类和命名
(一)分类
1、脂杂环 三元杂环
没有芳香特征的杂环化合物称为脂杂环。
O (环氧乙烷)
H
N (氮杂环丙烷)
四元杂环 五元杂环 七元杂环
N(CH3)3
发烟 HNO3 / 发烟 H2SO4
NO2 N
取代在 b 位 NO2
N(CH3)3
其它反应现象
Friedel-Crafts 反应
无反应发生
浓 H2SO4 / HgSO4
SO3H
N
220oC
N
Br2 / 浮石 300oC
Br N
环上有给电子基时反应相对较易进行
KNO3 / 浓 H2SO4
N
160℃
N N2H
N NH 2
利用亲核取代反应可制取烃基取代的二嗪。
N
+
3 C 2 C C H 2 C H H 2 L H i乙 醚
N
H C 4 H 9 - n
C 4H 9-n
N i LK M 4nO N
N
丙 酮
N
(3) 氧化
二嗪不易被氧化。若用过酸氧化,得嘧啶单N-氧化物
有机化学-第十七章 杂环化合物

氮杂-2,4,6-环庚三烯
二、命名 1、音译法命名:根据英文音义,用带口字旁的同音汉字
N H (pyrrole) 吡咯
O (furan) 呋喃
N
N (pyrimidine)
嘧啶
N
(quinoline) 喹啉
S (thiophene)
噻吩
N H (indole) 吲哚
N (pyridine)
吡啶
S
α-噻吩磺酸
呋喃和吡咯对及氧化剂都比较敏感,应使用特殊的试 剂乙酰硝酸酯进行硝化,使用吡啶三氧化硫进行磺化。
+
-
N SO3
SO3H
O
O
α-呋喃磺酸
O
CH3 C ONO2
N
(CH3CO)2O,-10℃
N
NO2
H
H
α-硝基吡咯
吡啶比苯难发生亲电取代反应,反应条件要求和硝基 苯差不多;在发生反应时取代基主要进入β-位。
1 α-呋喃甲醛
HO CH CH OH H2SO4
H CH C H Δ CHO
OH OH
+ 3H2O O CHO
糠醛是没有α-氢的醛,化学性质和苯甲醛相似。
浓 NaOH
+
O CHO
O CH2OH O COOH
2 卟啉化合物
卟啉化合物是一类广泛存在于自然界中的化合物,它
们的分子中都含有卟吩环。
2α314 NhomakorabeaNH
N
δ
β
N
HN
8
5
7
γ
6
卟吩环
CH CH2
吡咯的酸性极弱,介于醇和酚之间。
Δ + KOH(固)
杂环化合物的分类和命名

杂环化合物的分类和命名n杂环苯环与单杂环的稠合杂环(苯并杂环)n稠杂环n两个或两个以上单杂环的稠合杂环nnnh17.1.2命名1.音译法以口字倚为杂环标志。
osnnh噻吩呋喃吡啶吡咯pyridinepyrrolefuramthiophene2.系统命名法nosh茂氧田硫田(环戊二烯)氮田nnn苯氮苯1,3-二氮苯3.取代杂环的命名①杂环的编号从杂原子起至依次1,2,3……(或:α,β,γ……)。
②如环上远不止一个卤原子时,则从o、s、n的顺序依次编号。
③存有两个相同卤原子的,需从甘胺h原子或替代基的已经开始编号。
④编号时特别注意卤原子或替代基的位次之和最轻。
h3c54n32nh214534nn13n2n1h52s2-氨基-4-甲基噻唑吡唑1ch31-甲基咪唑17.2五元杂环化合物――吡咯、呋喃、噻吩17.2.1结构1.经典结构nosh2.分子结构呋喃ooo:1s22s22p4噻吩sss:1s22s22p63s23p4吡咯nhnhn:1s22s22p3据现代物理方法证明:①呋喃、吡咯、噻吩是一个平面结构。
②环上的c原子和杂原子都就是以sp2杂化轨道成键的。
③五个没杂化的p轨道旋转轴环路平面,构成滑动共轭体系。
④属富电子芳环。
⑤环形π电子分布于杂环平面的上、下两方。
⑥共轭能共轭能kj/mol3.芳香性①合乎休克尔规则,π电子数为6。
2苯152噻吩125.5吡咯90.4呋喃71.1②芳香性比较(极易替代、容易差率、容易水解):苯>噻吩>吡咯>呋喃③表述环的稳定性:苯>噻吩>吡咯>呋喃17.2.2呋喃、噻吩、吡咯的制备o催化剂退羰基choni280℃o+nh3oal2o3430℃zno-cr2o3-mno2h2o400-415℃nhch3ch2ch2ch3+sch3ch=chch3ch3ch2ch=ch2650℃s+so2s帕尔-诺尔制备法:用1,4-二酮制备。
p2o5rosrrroorp2s5△r`nh2r17.2.3化学性质h+rnhr0.1431nm0.1371nm0.1423nm0.1370nm0.1429nm0.1371nmo0.1383nms0.1714nmn0.1383nm o1.73ds1.90dn1.58d非芳香性的杂环化合物只有诱导效应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
17.1 杂环化合物的分类和命名 17.1.1分类17.1.2命名1.音译法 以口字傍为杂环标志。
2.系统命名法3.取代杂环的命名① 杂环的编号从杂原子起依次1,2,3 ……(或:α,β,γ……)。
② 如环上不止一个杂原子时,则从O 、S 、N 的顺序依次编号。
③ 有两个相同杂原子的,应从连有H 原子或取代基的开始编号。
④ 编号时注意杂原子或取代基的位次之和最小。
杂环单杂环五元环六元环苯环与单杂环的稠合杂环(苯并杂环)两个或两个以上单杂环的稠合杂环O S N H 稠杂环NNN N NH N O S N H 吡咯呋喃噻吩吡啶N pyrrole furam thiophene pyridine N SNH 2H 3C512432-氨基-4-甲基噻唑N HN 12345N N 12345CH 3吡唑1-甲基咪唑O SN HN茂(环戊二烯)氮茂氧茂硫茂NN苯氮苯1,3-二氮苯17.2 五元杂环化合物 —— 吡咯、呋喃、噻吩17.2.1结构 1.经典结构2.分子结构据现代物理方法证明:① 呋喃、吡咯、噻吩是一个平面结构。
② 环上的C 原子和杂原子都是以SP 2杂化轨道成键的。
③ 五个没有杂化的P 轨道垂直于环平面,形成闭合共轭体系。
④ 属于富电子芳环。
⑤ 环形π电子分布于杂环平面的上、下两方。
⑥3.芳香性① 符合休克尔规则,π电子数为6。
O SNH O呋喃O :1S 2 2S 2 2P4噻吩sS: 1S 2 2S 2 2P 6 3S 2 3P 4N H吡咯N: 1S 2 2S 2 2P 3② 芳香性比较(易取代、难加成、难氧化):苯>噻吩> 吡咯>呋喃③ 解释环的稳定性:苯 > 噻吩 > 吡咯 > 呋喃 17.2.2呋喃、噻吩、吡咯的制备帕尔-诺尔合成法:用1,4-二酮合成。
17.2.3化学性质OSN0.1383nm0.1371nm0.1431nm0.1423nm0.1371nm0.1714nm0.1429nm0.1370nm0.1383nmOSNSN1.73D1.90D1.58D1.81D0.51D0.70D非芳香性的杂环化合物只有诱导效应。
芳香体系的杂环化合物有诱导效应和共轭效应。
O280℃Ni 催化脱羰基O650℃C H 3C H 2C H 2C H 3+SSCH 3CH=CHCH 3CH 3CH 2CH=CH2+SO 2SO+NH 3Al 2O 3NHO ORRO R SRN HRR1.亲电取代反应 ① 卤代② 硝化乙酰硝酸酯是较为温和的砂化剂,用时临时制备。
OOOOCl BrCl+呋喃与卤素反应激烈,卤素稍过量,常得到多卤化物。
Cl80%SClCl SCl ClCl Cl+78%36%14%加成产物13%O CH 3CO 2NO 2O O H NO 2H CH 3COO NO 2吡啶35%加成物S+322SNO 2SNO 270%5%N H83%11%HONO 2+N H NO 2N H NO 2N H从偶极矩来看,N 的供电性强,使吡咯上C 原子电子云密度增加的多。
极易取代 。
H80%S95% H 2SO 4SSO 3H 噻吩-2-磺酸③ 磺化噻吩在室温下可直接磺化,生成溶于水的α-噻吩磺酸。
这个反应常用来除去粗苯中的噻吩。
吡咯和呋喃对酸敏感,吡咯在酸性条件下易聚合;呋喃遇酸要开环,故需与吡啶三氧化硫为磺化剂。
④ 乙酰化⑤ 亲电取代反应小结 a .亲电取代反应的活性吡咯 > 呋喃 > 噻吩 >> 苯溴化相对速度: 3*1018 6*1011 5*1011 1O22ON +SO 3-呋喃-2-磺酸吡啶盐3H41%N HN HN H+SO 3-H3H吡咯-2-磺酸吡啶盐90%O 0℃3OC OC H 3N H乙酐N HCOCH 3N HCOCH 3CH 3CO+60%S 34SCOCH 370%乙酐SS+B .亲电基团一般进入杂原子的邻位静态时,α-位上的电子云密度较其它位大。
2.加成反应邻位的电子云密度丰富所以取代发生在α位。
OO3CH 2CH 2CH 2OHN HHO+Br OBr HBrH OOC H 3HH 3C OH CH 3OH-50℃N H-0.06-0.10+0.32O -0.02-0.03+0.10S -0.04-0.06+0.20呋喃加成反应的较容易。
3.特征反应 ① 呋喃的双烯特征② 吡咯的弱酸性和弱碱性弱酸性 吡咯N 原子上的H 原子都有微弱的酸性酸性比较: 苯酚 > 吡咯 > 乙醇Ka : 1.3*10-10 10-15 10-18弱碱性苯胺 > 吡咯K b 3.8*10-10 2.5*10-144.鉴别反应① 呋喃使盐酸浸过的松木片显绿色。
② 噻吩和吲哚醌在硫酸作用下发生兰色反应。
噻吩在浓硫酸的作用下与松木片能呈现兰色反应。
③ 浸盐酸的松木片遇吡咯蒸气显红色。
17.2.4糠醛(α—呋喃甲醛) 1.制备O30℃+外型(主)内型N H- K +gXC 6H 5COCl CH 3I甲苯6H 5N-CH3N H吡咯红树脂化△2.化性 ① 催化加氢② 氧化顺丁烯二酸酐③ 歧化④ 安息香缩合⑤ 合成四氢呋喃作为溶剂(C 5H 8O 4)n 稀酸2水解戊糖OCHOCCH 稀酸△-3H 2OC H O+H 2CuO,Cr O 150℃OC H 2H 2OHOC H OOC OOH4中性或碱性氧化OCHO O O+320℃2O2253O O C H O+ 浓NaOH H 2OHOC OOH+OOCH OC OH OKCN 溶液ONi 催化脱羰基OHClNaCN3.糠醛遇苯胺醋酸盐溶液显深红色。
4.用途:①糠醛是良好的溶剂;②广泛用于油漆及树脂工业; ③合成苯酚糠醛塑料。
17.2.5噻唑和咪唑1.噻唑:是稳定的环,在空气中不会自动氧化。
青霉素G 中四元环内酰胺很不稳定,对酸、碱都很敏感,特别容易被酸水解。
口服后在胃中水解,β内酰胺的四元环打开而失效,现口服青霉素就是将其中-CH 2C 6H 5换为2.咪唑① 碱性比噻唑强。
可与强酸生成稳定的盐。
② 有微弱的酸性。
H 2C CH 2CH 2CNCH 2已二醇还原Ns12345NNC NsNH 3 Cl CH 3C H 2CH 3CH 2CH 2OH嘧啶环噻唑环维生素B 1+-+Cl -N sHOOCCOCH-NH-CO-CH2C 6H 5氢化噻唑环青霉素GCH 3CH 3N N H12345HClN N HN H N H+-N H N HCl -+N S 12345 噻 唑 或1,3-硫氮茂③ 易发生亲电取代反应。
④ 互变异构现象17.2.6吲哚 1.结构靛蓝为蓝色固体,熔点391℃,不溶于水,是我国古代使用得很广泛的一种蓝色染料。
医药上可用作清热解毒剂,治疗腮腺炎。
由于靛蓝不溶于水,因此染色时应先用保险粉(Na 2S 2O 4)将它还原为靛白,靛白能溶于碱溶液,对纤维有很强的亲和力,可以附着于织物上。
将浸过靛白溶液的织物,取出晾干,靛白在空气中很容易被氧化成靛蓝,并牢固地附着在织物纤维上。
靛蓝现已由苯胺为原料合成。
2.性质 与吡咯相似 ① 弱碱性② 也有松木片反应呈红色。
③ 在空气中颜色变深,渐渐变成树脂状。
④ 亲电取代反应(β位)β位的电子云密度较α位大,故进β位 吡咯亲电取代是进入α位。
-N N HNH NaNH2N N-Na +N N Na +-N N H12345NH N12345CH 3CH 34-甲基咪唑5-甲基咪唑N HH NON HCH 3N HON HCH 2COOHβ甲基吲哚β-吲哚乙酸靛蓝(反式)N H-0.065-0.041+0.2817.3 六元杂环化合物17.3.1吡啶1.吡啶的来源和制取吡啶存在于煤焦油、页岩油、骨焦油中。
吡啶的衍生物广泛存在于自然界。
例维生素PP 、维生素B 6。
辅酶Ⅰ及辅酶Ⅱ也含有吡啶环。
工业上从煤焦油提取吡啶和甲基吡啶。
工业上大量的合成:重要的实验室合成法:(汉茨施Hantzsch 合成法)N H3H 2O O70%H97%3KMnO 4O 2OH NH 3N NH 3NC H ≡C H +C H 2OH OC H 3+2322.结构吡啶的键合情况和苯相似。
它们的碳原子和氮原子都认为是sp 2杂化的,吡啶环中五个碳原子和一个氮原子各供一个p 电子,它们的p 轨道与环的平面垂直,互相重叠而成闭合共轭体系。
3.性质① 碱性及其成盐吡啶 > 吡咯 三甲胺 > 吡啶 > 苯胺 PK b 4.2 8.8 9.4苯胺分子中的氮原子上的未共用的电子对和苯环产生p-π,使N 原子上的电子云密度减小,而吡啶分子中N 原子上的未共用的电子对,不参与环上的共轭体系,所以吡啶的碱性比苯胺强。
由于吡啶分子中氮原子的未共用的电子对处于sp 2杂化轨道上,而脂肪胺分子中氮原子的未共用的电子对处于sp 3杂化轨道上。
sp 2杂化轨道s 成份大于sp 3杂化轨道s 成份,离核近,电子更靠近核,不容易与质子结合,所以吡啶的碱性比脂肪胺弱。
② 亲电取代 ·比苯难··进入吡啶环的β位···H +介质对亲电取代不利NN1.17D2.22DC C H ROOC CH 3OHNH HH C O HH C H COORCH 3HO 乙酸乙酯甲醛氨乙酸乙酯N HCOOR CH 3ROOC C H 324HNO 3NCOOR CH 3R OOC CH 3N +CH 3N +CH 3I 290~300℃N CH 3+I -+N +I -CH 3③亲核取代 ·比苯容易 ··进入α位④ 氧化 吡啶环对氧化剂稳定⑤ 还原 较苯容易吡啶和吡咯性质比较:N1.430.841.010.87—δ 1.010.84NNBr NNO 2NSO 3H 39% 3-溴吡啶3-硝基吡啶3-吡啶磺酸N+NaNH 2C 6H 5NMe 22回流N NHNaNNH 2N C H 3KMnO 4β-吡啶甲酸(烟酸)N C OOH-N N C OOH C OOHHNO 3△N H 2/Pt 乙酸N17.3.2嘧啶 1.结构2.性质① 无色结晶,熔点22℃,易溶于水。
② 碱性比吡啶弱得多。
③ 亲电取代反应比吡啶困难。
④ 亲核取代反应比吡啶容易。
17.4喹啉 1.结构2.制备——Skraup 合成法3.化性① 碱性比吡啶稍弱,可与酸成盐(pKa=9.1) ② 亲电取代NN 123456N NHONNHOOHNH 2NNHOOHCH 3尿嘧啶胞嘧啶胸腺嘧啶N1234567NBr +NNNO 23+浓H 2SO 4NH 2CHOH C H 2O HCH 2OH +N84~91%③ 亲核取代④ 还原⑤ 氧化17.5嘌呤及其衍生物1. 尿酸2. 黄嘌呤 3. 咖啡碱、茶碱和可可碱N2NHKMnO 4NNH +HOOCN N HN N 1234567899-H 嘌呤7-H 嘌呤NHN N N 123456789NH N HHN N H尿酸N N H N NO OOOHHOOHN N HHN N H 黄嘌呤NN H N NOOOHHO4. 腺嘌呤、鸟嘌呤N NN N O OCH 3CH 3CH 3咖啡碱N N HN N OOCH 3CH 3茶碱N NHN N OOCH 3CH 3可可碱NHN N N腺嘌呤NH 2NN HHN NO H 2N鸟嘌呤。
