002-3(第二章 烷烃和环烷烃(3))
第2章烷烃和环烷烃.ppt

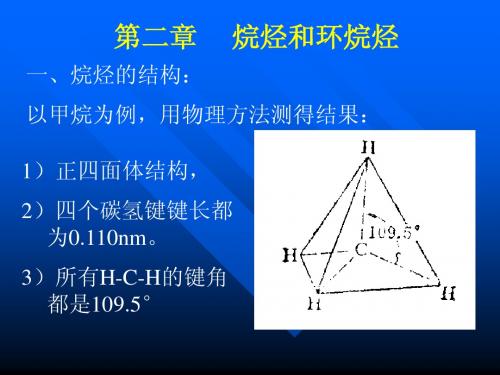
第2章烷烃和环烷烃.ppt第2章烷烃和环烷烃2.1烷烃的结构饱和烃:烷烃链烃不饱和烃:烯烃、炔烃烃(碳氢化合物)(hydrocarbon)环烃脂环烃:环烷烃、环烯(炔)烃芳(香)烃烷烃的通式:CnH2n+2同系列:凡具有同一通式,具有相似的构造和性质,而在组成上相差一个或多个C H2原子团的一系列化合物.同系物:同系列中的各个化合物.例如:CH3OH、CH3CH2OH、CH3CH 2CH2OH甲烷的结构:分子中的碳原子以四个sp3杂化轨道分别与四个氢原子的1s轨道重叠,形成四个等同的C–Hσ键,键角为109.5°,呈正四面体的空间结构,体系最稳定.如图2–1所示.其它烷烃的结构与此类似(图2–2).σ键:两个原子轨道沿键轴方向以头碰头方式重叠所构成的共价键.σ键的形状呈圆柱形沿键轴对称分布,σ键可沿键轴自由旋转.伯、仲、叔、季碳原子和伯、仲、叔氢原子1°2°3°4°1°2°3°一级二级三级四级一级二级三级2.2烷烃的命名法2.2.1普通命名法常用于简单烷烃和烷基的命名命名原则:根据烷烃分子中的碳原子总数叫做某烷.甲、乙、丙、丁、戊、己、庚、辛、壬、癸、十一、十二……“正”某烷:直链烷烃,“正”字可省略.“异”某烷:具有(CH3)2CH(CH2)nCH3结构的烷烃.(CH3)3CCH3(CH3)3CCH2CH3新戊烷新己烷烷基的命名:烷基:从烷烃去掉一个H后剩下的基团,用R表示.要记忆碳原子总数4(包括4)以下的烷基.(见书P22~23)2.2.2系统命名法重点掌握.命名原则:(结合书中例子)1.直链烷烃的命名与普通命名法基本相同,但不加“正”字.2.支链烷烃的命名是以主链为母体,所连的支链做取代基.(1)主链的选择:选择最长的含取代基最多的碳链做主链,以此作为母体,按其碳原子数称某烷.(2)主链的编号:遵循最低系列原则,使取代基的位次之和最小.其次是使较不优先(注:按次序规则排列)的取代基的位次最小.(3)取代基的处理:把取代基的位次、个数和名称依次写在母体名称之前.如果主链上连有多个取代基,相同的取代基应合并,不同的取代基按次序规则(见P51)排列,较优先的取代基后列出.2.3烷烃的同分异构2.3.1烷烃的构造异构只有碳链异构.推出碳链异构体的方法:逐步缩短碳架,去掉重复的构造式.例:写出正己烷所有的构造异构体.2.3.2烷烃的构象异构1.乙烷的构象①构象的定义:由于碳碳单键的旋转,导致分子中原子或基团在空间的不同排列方式.②乙烷的两种典型构象:交叉式构象:能量最低,最稳定,是乙烷的优势构象.重叠式构象:能量最高,最不稳定.两种构象的能量相差不大(12.6kJ·mol-1),室温时分子所具有的动能即能克服这一能垒,足以使各构象间迅速转化,成为无数个构象异构体的动态平衡混合物.室温时乙烷分子大都以最稳定的交叉式构象状态存在.③构象的两种表示方法:锯架式:从侧面观察分子.Newman(纽曼)投影式:沿着C-Cσ键轴观察分子.HHHHHHHHHHHHHHHHHHHHHHHH2.丁烷的构象沿着C2-C3σ键旋转时形成四种典型构象:见P26图能量:对位交叉式邻位交叉式>部分重叠式>全重叠式丁烷在室温下主要以对位交叉式和邻位交叉式构象存在.2.4烷烃的物理性质有机物的物理性质通常是指:物态、沸点、熔点、密度、溶解度、折射率、比旋光度和光谱性质等.通过测定物理常数可以鉴定有机物和分析有机物的纯度.1.状态(常温常压下)(了解)正烷烃:C1~C4C5~C16C17以上气体液体固体2.沸点(b.p.)见表2–1沸点主要与下列因素有关:①分子间vanderWaals引力:包括色散力、诱导力和取向力.分子的极性越大,vanderWaals引力越大.②分子间是否形成氢键.氢键的影响明显.烷烃是非极性或极性很弱的分子,分子间仅存在很弱的色散力∴与分子量相同或相近的其它有机物相比,烷烃的沸点最低.直链烷烃随着碳数的增加,分子间色散力增大,因而沸点逐渐升高.同碳数的烷烃中,直链烃的沸点较高,支链越多,沸点越低.3.熔点(m.p.)(了解)烷烃的熔点也随着碳数的增加而升高,但不像沸点变化那样有规律.4.密度比水轻,<1g·cm﹣35.溶解性根据“极性相似者相溶”的规律,所有烷烃均不溶于水,易溶于非极性或弱极性溶剂如乙醚、苯、CCl4.2.5烷烃的化学性质烷烃由于分子中只含有比较牢固的C-Cσ键和C-Hσ键,所以它们的化学性质不活泼,对一般化学试剂表现出高度稳定性,在室温下与强酸、强剂及强还原剂都不发生反应.但在一定条件下,如高温、高压、光照、加入催化剂等,它们也能发生一些化学反应.2.5.1甲烷的卤代反应紫外光或高温CH4+Cl2CH3Cl+HClCl2Cl2Cl2CH2Cl2CHCl3CCl4反应产物为混合物,但控制适当的反应条件,可使反应主要生成一种卤代物.分子中氢原子被卤素取代的反应称为卤代反应.2.5.2烷烃的卤代反应机理–––自由基链反应(freeradicalchainreaction)反应机理(反应历程):化学反应所经历的途径或过程.只有了解反应机理,才能认清反应的本质,掌握反应的规律,从而达到控制和利用反应的目的.1.以甲烷的氯代反应为例,自由基链反应包括三个阶段:(1)链引发:Cl22Cl·吸热(2)链增长:Cl·+CH4CH3·+HClCH3·+Cl2CH3Cl+Cl·放热类似地Cl·+CH3Cl·CH2Cl+HCl·CH2Cl+Cl2CH2Cl2+Cl·同理生成CHCl3和CCl4(3)链终止:Cl·+Cl·Cl2CH3·+CH3·CH3CH3CH3·+Cl·CH3Cl[了解]自由基反应的引发剂:自由基本身或容易产生自由基的试剂,如过氧化物ROOR′.自由基反应的抑制剂:能抑制自由基生成或降低自由基活性的物质,如酚类.活性氧:人体内O2通过一系列单电子转移反应衍生出的化学性质活泼的含氧物质,如·O2–(超氧化物阴离子自由基)、·OH、H2O2和单线态氧1O2–.活性氧在人体内的作用和危害.2.甲烷氯代反应的能量变化(见图2–6)(1)反应热:生成物与反应物之间的能量差(焓差).负值:放热反应正值:吸热反应(2)活化能和过渡态过渡态:在反应中新的化学键开始形成,旧的化学键被拉长但尚未断裂,体系的能量达到最高点时的结构.活化能:过渡态与反应物之间的能量差,用Ea表示.过渡态越稳定,活化能就越低,反应速率就越快.在一个多步骤的反应中,最慢的一步(Ea值最大)是决定反应速率的步骤.2.5.3烷烃的卤代反应取向CH3CH2CH3+Cl2CH3CH2CH2Cl+CH3CH(Cl)CH3次产物主产物烷烃分子中氢原子的卤代反应活性次序:3°H>2°H>1°H2.5.4自由基的稳定性从反应机理来看,丙烷氯代可生成两种自由基:CH3CH2CH3+Cl·CH3CH2CH2·+CH3CHCH3+HCl更稳定烷基自由基的稳定性次序:R3C·>R2CH·>RCH2·>CH3·(从C–H键离解能或超共轭效应来判断)2.6环烷烃的结构与稳定性环烷烃可分为:小环(三、四碳环)、普通环(五~七碳环)中环、大环.自然界存在的环状化合物多为五元环和六元环,其中六元环最稳定.1.不同环烷烃的稳定性次序:环丙烷环己烷2.结构上的原因:环烷烃中成环碳原子均为sp3杂化对小环(环丙烷、环丁烷)而言,为了成环,环上C–C键间的夹角要偏离正常的109.5°,形成弯曲键(见图2–8),轨道重叠的程度较小而不稳定.此外,环丙烷相邻C–H键都是全重叠式构象,非键原子间的斥力较大.从环丁烷开始,成环碳原子不在同一平面上(见图),轨道重叠的程度有所增大,非键原子间的斥力有所降低,使分子内能降低,稳定性提高.环己烷存在最稳定的椅型构象,环上C–C键间的夹角保持109.5°,所有相邻C–H键都处于较稳定的交叉式构象,环内氢原子之间相距较远,几乎无张力.其它环烷烃:环上C–C键间的夹角虽然能够保持109.5°,但环内氢原子之间比较拥挤而存在扭转张力和空间张力,因此不如环己烷稳定.3.影响环烷烃稳定性的三种张力:角张力:由键角偏差引起的张力.扭转张力:由于环上单键旋转的受阻使构象不易达到内能最低的交叉式排列,非键原子或基团发生相互作用而产生的张力.跨环张力(或称空间张力):在跨环的原子或基团之间,相距小于vanderWaals半径而产生斥力.2.7单环烷烃的同分异构2.7.1单环烷烃的构造异构通式:CnH2n,与单烯烃互为官能团异构.还可因环的大小和环上取代基的不同而形成构造异构.2.7.2单环烷烃的顺反异构环烷烃碳环的C–C单键,因受环的限制而不能自由旋转,所以环上两个或两个以上碳原子各连有一个取代基的环烷烃,可产生顺反异构体.例如:(掌握其画法)H3CCH3HCH3顺–1,2–二甲基环戊烷反–1,2–二甲基环戊烷2.8环烷烃的构象2.8.1环戊烷的构象(了解)优势构象是信封型构象(见P38图)2.8.2环己烷的构象环己烷的典型构象是椅型构象和船型构象.常温下二者可以相互转变,椅型构象比船型构象能量低(23.5kJ·mol–1),是最稳定的优势构象,在平衡混合物中占绝大多数(99.9﹪).椅型构象的透视图:(掌握其画法)为什么椅型构象最稳定?①环上C–C键间的夹角均保持109.5°.②所有相邻C–H键都处于较稳定的交叉式构象.③环内氢原子之间相距较远,不产生斥力.翻环作用:两种椅型构象的互相转变.环己烷实际上是以两种椅型构象互相转化达到动态平衡的形式存在的.HCH3H(较稳定,约占95﹪)CH32.8.3取代环己烷的构象取代基处于横键较稳定.取代基若处于竖键,则存在1,3–双竖键效应(见P39图),分子内能增加而不稳定.当环上有多个取代基时,通常有较多取代基和较大的取代基处于横键是较稳定的优势构象.例如,反–1,4–二甲基环己烷有两种构象:CH3HHCH3HH3CCH3H优势构象顺–1,4–二甲基环己烷的优势构象?顺–1–甲基–2–叔丁基环己烷的优势构象?(见书)反–1–甲基–2–叔丁基环己烷的优势构象?(见书)2.8.4十氢化萘的构象(了解)2.9环烷烃的命名法按成环碳原子数称环“某”烷.若环上有支链,命名时一般以碳环为母体,支链视作取代基.环上碳原子的编号应遵循最低系列原则,其次是使较简单的取代基的位次最小.例:1,2–二甲基–3–乙基环戊烷注:当环上有较复杂的支链时,命名时可将环视作取代基,以支链为母体.2.9.1螺环烃的命名法(了解)2.9.2桥环烃的命名法(了解)2.10环烷烃的性质2.10.1环烷烃的物理性质(了解)与烷烃相似.但熔点、沸点和密度都比相应的烷烃高.2.10.2环烷烃的化学性质1.除小环外的其它环烷烃的化学性质与烷烃相似,可发生自由基卤代反应,很难发生开环加成反应.+Br2–Br+HBr2.小环(环丙烷、环丁烷)的开环加成反应(1)加氢+H2CH3CH2CH2CH3(2)加卤素、氢卤酸+Br2BrCH2CH2CH2BrH3CCH3+HBr(CH3)2C–CH(CH3)2H3CBr碳环开环多发生在连H最多的C和连H最少的C之间.HX中的H加到连H较多的C 上,X加到连H较少的C上.(Markovnikov规则)光或热过渡态反应物反应进程生成物能量紫外光·a键(竖键或直立键)e键(横键或平伏键)紫外光或高温Ni△。
第二章 烷烃和环烷烃

四、烷烃的命名
主链的选择:选择最长的连续碳链为主链, 按此链所含的碳原子数称为“某烷”
5 CH3CH2CHCH2CH3
√ CH2CH2CH2CH3 7
庚烷
26
四、烷烃的命名
若有多个等长碳链时,选具有支链数目最多的为主链
8 8 8
3个支链
2个支链
√
4个支链
27
四、烷烃的命名
主链的编号:主链的碳原子编号从靠近支链的 一端开始,依次用阿拉伯数字标出,使支链位次最 小。(最低系列原则)
三、烷烃的同分异构现象
有机化合物普遍存在同分异构现象。
分子式相同而结构不同的化合物称为同分异构 体,这种现象称为同分异构现象。
在同分异构体中,因分子中原子间的连接次序 或连接方式不同而产生的异构称为构造异构。
CH3 CH3CH2CH2CH2CH3 CH3CHCH2CH3
CH3 CH3-C-CH3
CH3
烷烃分子中氢原子数与碳原子数的比值达到了最高值, 因此也称为饱和烃。
烷烃分子中所用碳原子均为sp3杂化,各原子之间都以单 键(σ键)相连。
甲烷是最简单的烷烃,以甲烷为例介绍一下烷烃的结构。
sp3杂化
2p
2s
基态
激发
2p
2s
激基发态态
sp3杂化
2p
2s 激sp3发杂态化
sp3杂化轨道的形成
四个sp3杂化轨道分别指向正 四面体的四个顶点,C位于正四面 题的中心,两轨道间的夹角为 109o28’。
有机化学
第二章 烷烃和环烷烃
知识要点及考核要求
知识要点及考核要求
知识要点及考核要求
第二章 烷烃和环烷烃
由碳氢两种元素组成的有机化合物称为碳氢化 合物,简称烃。其他有机化合物可视为烃的衍生物。
第二章烷烃和环烷烃
(1)乙烷的构象
H3C CH 3
当C-C键旋转时, 可产生无数个构象
有两种典型conformation:
乙烷的两种典型构象的表示方法
优势构象
交叉式 staggered
H
重叠式 eclipsed
作业:P130 /1, 6, 7 ,8; P105 / 8(3) (4) *C2-C3键旋转 阅读Section 1. Alkanes and Cycloalkanes 全文
翻译 1.1第一段,1.2.2第一段,1.2.3 第四段
CH3 CH3 CH C Br
CH3 CH3
四、环烷烃的异构现象
1. 顺反异构 cis-trans isomer (P84) 环烷烃环中C-C单键受环约束不能自由旋转,导致产生顺反异构
HH
H
CH 3
CH 3 CH 3
顺-1,2-二甲基环丙烷
CH 3 H
反-1,2-二甲基环丙烷
练习:写答出案: 1-甲基-3-乙H基环己烷的顺反异构体CH 3
伯碳(1°):一级碳原子,只与1个其他碳原子直接相连
仲碳(2°):二级碳原子,只与2个其他碳原子直接相连
叔碳(3°):三级碳原子,只与3个其他碳原子直接相连
季碳(4°):四级碳原子,只与4个其他碳原子直接相连
CH3
CH3
H3C
C CH2
3° 2°
H
伯氢(1°H):伯碳上的H
仲氢(2°H):仲碳上的H
练习:预测2-甲基丁烷在室温下进行氯代反应所得的一氯代物
Cl
答 案 : C3 C H H C2C H H 3 +C 2l 光 C3 C H C2 C H H 3
第四讲 第二章 饱和烃:烷烃和环烷烃3

CH3Cl + Cl 一氯甲烷 Cl Cl 4 CH3 CH3 5 CH3 + Cl Cl
3
链终止
Cl + Cl CH3 + CH3
第 四 讲
(3) )
6 甲烷卤化难以停留在一氯代,反应过程比较复杂, 但甲烷卤化难以停留在一氯代,反应过程比较复杂,如链增长阶段 的其它链增长反应: 的其它链增长反应:
第 四 讲
(1) )
例如: 例如: CH3 CH3 + Cl2
+ Cl2
420oC 78%
CH3 CHCl + HCl 氯乙烷
Cl
hv 92.7%
+ HCl 氯(代)环戊烷
上述烃分子中的氢原子被卤原子取代的反应称为卤代反应或卤化反应。 上述烃分子中的氢原子被卤原子取代的反应称为卤代反应或卤化反应。
有 机 化 学
有 机 化 学
2.6 烷烃和环烷烃的化学性质
总体来讲,烷烃和环烷烃化学性质稳定,常温下不易与强酸、强碱、 总体来讲,烷烃和环烷烃化学性质稳定,常温下不易与强酸、强碱、 稳定 强氧化剂、强还原剂等发生反应;但在一定条件下也有一定的反应性能; 强氧化剂、强还原剂等发生反应;但在一定条件下也有一定的反应性能; 烷烃的多数反应都是通过自由基机理进行的。 烷烃的多数反应都是通过自由基机理进行的。 2.6.1 自由基取代反应 烷烃和环烷烃分子中的氢原子被其它原子或基团所取代的反应, 烷烃和环烷烃分子中的氢原子被其它原子或基团所取代的反应,称为 取代反应。通过自由基取代分子中氢原子反应,称为自由基取代反应。 取代反应。通过自由基取代分子中氢原子反应,称为自由基取代反应。 (1)卤化反应 烷烃和环烷烃与卤素( 和环烷烃与卤素 在室温和暗处不发生反应, 烷烃和环烷烃与卤素(Cl2、Br2)在室温和暗处不发生反应,但在光 高温或催化剂条件下,烷烃和环烷烃(小环烷烃除外) 照、高温或催化剂条件下,烷烃和环烷烃(小环烷烃除外)分子中的氢原 子被卤原子取代,生成烃的卤素衍生物和卤化氢。 子被卤原子取代,生成烃的卤素衍生物和卤化氢。
第二章 烷烃和环烷烃
C H3C H2C H2 C H3C H2C H2C H2 C H3C HC H 2 C H3
(正)丁基 Bu 异丁基 i -Bu
C H3C HC H C H3 仲丁基 2 s-Bu C H3 C H3 C C H3 叔丁基 t-Bu
在生理状况下,机体自由基一方面不断产 生,另一方面又不断清除,活性氧处于产生与清 除平衡状态。一旦活性氧的产生和清除失去平衡 ,过多的自由基就会造成对机体的损害,从而引 起多种疾病,并可诱发癌症和导致衰老。 天然抗氧化酶系统:超氧化物歧化酶(SOD) 、 过 氧 化 氢 酶 ( CAT)、 谷 胱 甘 肽 过 氧 化 物 酶 (GSH-Px)
构象异构
(一) 烷烃的构造异构(constitutional isomerism)
戊烷有3种碳链异构体
CH3 CH3CH2CH2CH2CH3 CH3CHCH2CH3
正戊烷 异戊烷
CH3 CH3-C-CH3 CH3
新戊烷
碳原子数 异构体数 4 5 6 7 2 3 5 9
碳原子数 8 9 10 20
异构体数 18 35 75 366 319
天然抗氧剂(自由基清除剂):VE、 Vc、 2巯基乙胺、谷胱甘肽、辅酶Qn(泛醌)、-硫辛酸 等
第二节 环 烷 烃
一、脂环烃的分类和命名
(一) 分类 C3-C4
根 据 环 数 多 少 分
小环 普通环
单脂环烃
C5-C6
C7-C12
中环
C13以上 大环 多脂环烃 桥环 螺环
(二) 命名
1. 单脂环烃: 在相应的烃名前加“环”字;英文名加词头cyclo
2.烷烃和环烷烃(3)

自由基完全消失, 自由基完全消失, 反应终止
甲烷的氯代 甲烷的氯代反应机理的表达 氯代反应机理的表达
(1) (2) (3)
Cl Cl Cl +
hv or
自由基 中间体
链 引发 chain initiation
Cl
+ Cl Cl H + CH3
H
CH3
CH3
+ Cl
Cl
CH3 Cl + Cl
第(2), (3)步反应重复进行 步 (4) (5) (6) Cl Cl CH3 + + + Cl CH3 CH3 Cl Cl CH3 Cl CH3 CH3
I2 :不反应。即使反应, 其逆反应易进行 不反应。即使反应,
CH3I + HI CH4 + I2
2. 甲烷的卤代反应机理(反应机制,反应历程) 甲烷的卤代反应机理(反应机制,反应历程) Machanism) (Reaction Machanism)
什么是反应机理: 什么是反应机理: 反应机理是对反应过程的详细描述,应解释以下问题: 反应机理是对反应过程的详细描述,应解释以下问题: 反应是如何开始的? 反应是如何开始的? 产物生成的合理途径? 产物生成的合理途径? 经过了什么中间体? 经过了什么中间体? 研究反应机理的意义: 研究反应机理的意义: 了解影响反应的各种因素,最大限度地提高反应的产率。 了解影响反应的各种因素,最大限度地提高反应的产率。 发现反应的一些规律,指导研究的深入。 发现反应的一些规律,指导研究的深入。 反应条件起什么作用? 反应条件起什么作用? 决速步骤是哪一步? 决速步骤是哪一步? 副产物是如何生成的? 副产物是如何生成的?
甲烷的氯代 甲烷的氯代反应过程分析 氯代反应过程分析
第二章 烷烃和环烷烃
甲基
CH3CHCH3
乙基
正丙基
CH3CHCH2 CH3
正丁基 CH3
CH3C CH3
CH3 CH3C CH2 CH3
CH3CH2CHCH3
异丙基
仲丁) 主链的选择:选择一个最长的连续碳链为主链(stem chain),按 其所含碳原子数称为某烷,并以此作为母体。当分子中有几个等长 碳链可选择时,应选择含取代基较多的碳链为主链。
H H C H H H H C H H C H H H H C H H C H H C H H
烷烃的来源
•石油(petroleum) •煤(coal)
甲烷
乙烷
丙烷
•天然气(natural gas):甲烷(90%~95%)+乙烷(5%~10%)+其它低沸点烷烃
boling point (oC) < 30 30-200 200-300 300-400 >400 carbon atoms C1-C4 C4-C12 C12-C15 C15-C25 >C25 products Natural gas, methane, propane, butane, liquefied petroleum gas Petroleum ether, ligroin, naphtha, straight-run gasoline Kerosene, heater oil Gas oil, diesel fuel, lubricating oil, waxes, asphalt Residual oil, paraffin waxes, tar
CH3CH2CH2CH3
隔绝空气 CH4 + CH3CH3 + CH3CH2CH3 600oC + CH2 CHCH3 + CH2 CH2 等
第二章烷烃和环烷烃

分子间接触面积大 作用力强
bp:36℃ bp:36℃
CH3
分子间接触面积小 作用力弱
CH3 CH3 CH3 CH3 CH3 CH3 CH3
bp:9.5℃ bp:9.5℃
(四)密度(density) 密度( ) 烷烃是有机化合物中密度最小的一类化 合物, 合物,都小于1g.cm-3。 溶解度( (五)溶解度(solubility) ) 烷烃易溶于非极性、 烷烃易溶于非极性、或极性较小的有机 溶剂。而难溶于水和其它强极性溶剂。 溶剂。而难溶于水和其它强极性溶剂。
五、环烷烃的构象
(一)环丁烷的构象
环丁烷的构象
(二)环戊烷的构象
环戊烷的构象
(三)、环己烷的构象 )、环己烷的构象
1、椅式、船式构象 椅式、
5 1 6 3 2 4 5 3 6 2 1
透视式
4
1 2 6 4 5 3 2
1 4 6 5
纽曼投影式
3
椅式
船式
在椅式构象中, 在椅式构象中,所有相邻的氢都处于交叉式 构象,再加上环的对角上的氢原子距离最大, 构象,再加上环的对角上的氢原子距离最大,这 些因素都使得环己烷的椅式构象具有较高的稳定 性。 在船式构象中C 而在船式构象中C2-C3、C5-C6之间的氢处 于重叠式状态,产生的相斥力较大。 于重叠式状态,产生的相斥力较大。因此船式不 如椅式稳定。分析结果表明, 如椅式稳定。分析结果表明,环己烷船式的内能 要比椅式高29.7kJ/mol 29.7kJ/mol。 要比椅式高29.7kJ/mol。
戊烷异构体的沸点和熔点
正戊烷 沸点/℃ 沸点 ℃ 36 熔点/℃ -130 熔点 ℃ 异戊烷 28 -160 新戊烷 9.5 -17
烷烃的物理性质强调:分子质相同、支链多、沸点低。 烷烃的物理性质强调:分子质相同、支链多、沸点低。 支链多,分子不易接近) (支链多,分子不易接近)
第二章烷烃和环烷烃

与另外三个碳原子相连,剩余一个键与氢结合的碳原子 称为三级碳原子,也称叔碳原子。用3O表示。
与另外四个碳原子相连,不与氢结合的碳原子称为四级 碳原子,也称季碳原子。用4O表示。
C6 H3 C7 H3
H3C1
⑶ 含有双键或叁键的基团。可以认为连有两个或三个相同 的原子。
第一节 烷烃 一 烷烃的结构
在烷烃中,C均以sp3杂化轨道成键,价键分呈四面体形, 且又由于σ键可以自由旋转,所以烷烃的结构不象我们所写的 那样一成不变,而是运动的,一般以锯齿形存在。 甲烷中的碳为sp3杂化,四个杂化轨道完全一样,分别与氢形 成σ键,故呈四面体。这种σ键,电子云重叠是沿键轴方向, 键的旋转不影响电子云的重叠,故可以自由旋转。
序数大小排列,原子序数大(次序大)的基团为较优基团, 原子序数小(次序小)的基团为较小基团,同位素中质量高 的为较优基团。例如:
I>Br>Cl>S>……>C>D>H ⑵ 若取代基为多原子基团,则比较与碳原子相连的原子的
次序大小,若取代基为多原子基团,且与碳直接相连的原子 B均相同时,则比较与B相连的原子的次序大小,比较时,按 原子序数排列,先比较原子序数大的,若相同,再向下依次 比较。
B Staggered
乙烷分子构象转化能量示意图
HAHA
HCHA
HH BA
HAH A
CHH C
HHB B
BHHC
HHAB
AH H
C
H HB
C
CH H
C
HHB B
E
0
HC HC
60
120
180
240
第2章饱和烃:烷烃和环烷烃
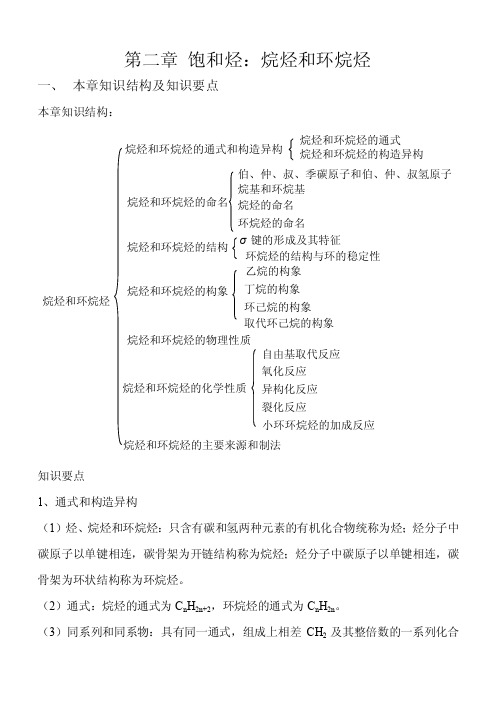
第二章 饱和烃:烷烃和环烷烃一、 本章知识结构及知识要点本章知识结构:知识要点1、通式和构造异构(1)烃、烷烃和环烷烃:只含有碳和氢两种元素的有机化合物统称为烃;烃分子中碳原子以单键相连,碳骨架为开链结构称为烷烃;烃分子中碳原子以单键相连,碳骨架为环状结构称为环烷烃。
(2)通式:烷烃的通式为C n H 2n+2,环烷烃的通式为C n H 2n 。
(3)同系列和同系物:具有同一通式,组成上相差CH 2及其整倍数的一系列化合烷烃和环烷烃烷烃和环烷烃的通式和构造异构烷烃和环烷烃的构造异构烷烃和环烷烃的命名 烷基和环烷基烷烃和环烷烃的结构σ键的形成及其特征环烷烃的结构与环的稳定性 乙烷的构象烷烃和环烷烃的主要来源和制法自由基取代反应氧化反应丁烷的构象烷烃和环烷烃的物理性质烷烃和环烷烃的化学性质 烷烃的命名环烷烃的命名烷烃和环烷烃的构象 环己烷的构象取代环己烷的构象 异构化反应裂化反应小环环烷烃的加成反应烷烃和环烷烃的通式伯、仲、叔、季碳原子和伯、仲、叔氢原子物称为同系列。
同系列中的各化合物互为同系物。
(3)构造异构:分子中原子的连接顺序不同形成的异构体叫构造异构。
2、命名(1)烷烃的命名普通命名法:用甲、乙、丙、丁、戊、己、庚、辛、壬、癸十个字分别表示十个以下碳原子的数目,十个以上的碳原子用汉字数字(十一、十二、十三……)表示,用正、异、等前缀区别同分异构体。
系统命名法:(a)选主链:在分子中选择一条最长的碳链作主链,根据主链的碳原子数叫某烷,将主链以外的其他烷基看作是主链上的取代基。
烷基是由烷烃分子除去一个或几个氢原子剩下的部分,通常用R-表示。
(b)编号:从靠近取代基的一端开始编号,使取代基编号位次最小。
(c)取代基的排列次序:用阿拉伯数字表示取代基位置,用汉字(一、二、三……)表示相同取代基个数,写在取代基名称前面,若含有不同的取代基,则优先级别低的写在前面,优先级别高的写在后面。
(2)环烷烃的命名(a)单环环烷烃:在相应的烷烃名称之前加“环”字,称为“环某烷”。
第二章烷烃和环烷烃
同系物具有相似的化学性质,其物理性质(例如沸 点、熔点、相对密度、溶解度等)一般是随着相对分子 质量的改变而呈现规律性的变化。
2.1.2 烷烃和环烷烃的构造异构
分子式相同的不同化合物叫做同分异构体(简称异构体)。 这种现象叫做同分异构现象。
1°CH3 1°CH3
1° 3°
1°
4° 1°
2°
与伯、仲、叔碳原子相连的氢原子分别称为伯、仲、叔氢原子。不同类型的 氢原子在同一反应中的反应性能是有一定差别。
2.2.2 烷基和环烷基
烷基 :烷烃去掉一个氢原子后留下的原子团
烷烃
烷基
RH
R
环烷基:环烷烃去掉一个氢原子后留下的原子团
环丙基 环丁基 环戊基 环己基 亚烷基:烷烃去掉两个氢原子后留下的原子团
只连有一个碳原子的称为伯碳原子,常以1°表示(一级碳原子);
只连有二个碳原子的称为仲碳原子,常以2°表示(二级碳原子);
只连有三个碳原子的称为叔碳原子,常以3°表示(三级碳原子);
只连有四个碳原子的称为季碳原子,常以4°表示(四级碳原子)。
如:
1° 14°°CH32° 3° 1° CH3—C—CH2—CH—CH3
H HH H–C–C–C–H
H HH 丙烷
C3H8
烷烃通式:CnH2n+2
HHHH H–C–C–C–C–H
HHHH 丁烷
C4H10
这些结构上相似而组成上相邻的两个烷烃的组成都是相差 CH2。CH2 叫做同系列差。
环丙烷 C3H6
环丁烷 C4H8
环戊烷 C5H10
环己烷 C6H12
有机化学第2章_烷烃和环烷烃
以甲烷的氯代反应为例,有如下反应事实: (1)在室温、黑暗中不反应;加热或光照下 进行,一经开始便可自动进行; (2)产物中有少量乙烷; (3)如有氧或有一些能捕捉自由基的杂质存 在,会推迟反应的进行。
以上实验事实,说明该反应是为自由基反应! 自由基反应大多可被光照、高温、过氧化物 所催化,一般在气相或非极性溶剂中进行。
H 一氯甲烷
生成的一氯甲烷还会继续被氯代,生成二氯甲 烷、三氯甲烷和四氯化碳四种产物的混合物。
CH2Cl2
二氯甲烷
CHCl3
三氯甲烷
CCl4
四氯甲烷
(二)卤代反应 2、卤代反应的反应机制
反应机制(反应历程):化学反应所经历的途 径或过程 ,是根据实验事实,对反应做出的 详细描述和理论解释。
研究反应机理的目的是认清反应本质,掌握反 应规律,从而达到控制和利用反应的目的。
σ(s-sp3)
键角为109.5°
σ(s-sp3)
(2)乙烷(CH3CH3)分子的结构
除了H原子的s轨道电子与C原子的sp3轨道 电子以“头碰头”方式重叠形成s-sp3共价键外 ,也存在两个C原子的sp3轨道电子之间的配对
。σ(s-spσσ3) 键键可:沿旋键转轴不“影自响由轨道”重转叠动程;度重叠,程即
自由基
概念:带有孤电子的原子或原子团称为自由基
结构特点:三种可能结构(1)刚性角锥体, (2)迅速翻转的角锥体,(3)平面型。
C
C
C
自由基非常活泼,具有很强的反应活性。
CH2 > CH2 CHCH2 > (CH3)3C > (CH3)2CH
> CH3CH2 > CH3 >
第二章_烷烃和环烷烃

典型烷烃
H H C H H
H H H C C H H H
甲烷 CH4
H H H H C C C H H H H
A: 普通命名法
正戊烷: CH 3 戊烷:
CH 3 CH CH 2 CH 3
CH 2 CH 2 CH 2 CH 3 CH 3 CH 3 C CH 3 CH 3
CH 3
异戊烷:仅在碳链 戊烷:仅在碳链
一末端有两个甲基而 一末端有两个甲基而 无其他支链的结构 无其他支链的结构
新戊烷:专指五或 戊烷:
六个碳烷烃的异构体 中含有季碳原子 中含有季碳原子
一些烷基的名称与表示(2)
R-H - R- - 名称
正丁 基 (butyl) 仲丁 基 (sec-butyl) 异丁 基 (iso-butyl) 叔丁 基 (tert-butyl)
缩写
Bu s-Bu i-Bu
CH3CH2CH2CH2 H CH3CH2CH2CH2 CH3CH2CH CH3 CH3CHCH3 CH3 CH3CHCH2 CH3 CH3 CH3 C CH3
原则二 给取代基编号 (1)从主链距离取代基(支 )从主链距离取代基( 最近的一端开始 的一端开始, 链)最近的一端开始,用阿 拉伯数字编号。 拉伯数字编号。 目的:使取代基编号依次最小 目的:使取代基编号依次最小
3 编号——依次最小
例:取代庚烷
1 7
CH3
2 6
3 5
4
3 5
6 2
1 7
第2章烷烃和环烷烃

英文名
n-butane isobutane
正丁烷 异丁烷
C4
CH3 CH3CHCH3 CH3(CH2)3CH3 CH3 CH3CHCH2CH3
正戊烷
n-pentane
异戊烷
isopentane
C5
CH3 CH3CCH3 CH3
新戊烷
neopentane
异构词头用词头“正”、“异”和“新”等区分 相应的英文词头为 n- (normal)、iso和neo(注意不加“-”) 缺点:C原子数较少时可以采用,若C数较多、支链较多,则无法命名。
各种原子或取代基按先后次序排列的规则称为顺序规则。
规则1:先比较取代基中与主链直接相连的原子按原 子序数由大到小排列,原子序数大的为优先基团。 若为同位素,则质量数高的顺序在前。
I > Br > Cl > F > O > N > C > D > H
不同原子按原子序数排列
同位素按质量 数由高到低的 顺序排列
【学习要求】
1. 了解C原子和H原子的类型以及烷基的概念。 2. 掌握普通命名法和系统命名法的基本原则,并能熟练 命名烷烃和环烷烃。 3. 了解同系物沸点、熔点变化规律。 4. 掌握烷烃和环烷烃的化学性质及影响因素。 5. 掌握构象异构和顺反异构产生的原因、特 点、命名及书写。
第一节
一、 烷烃的命名
烃
环状烃
脂环烃 芳香烃
饱和脂环烃(如环烷烃) 不饱和脂环烃(如环烯烃、环炔烃) 含苯芳烃(如萘、蒽、菲) 非苯芳烃
第一节 烷
一 二 三 四 五
烃
烷烃的命名 烷烃的结构 烷烃的物理性质 烷烃的化学性质 烷烃卤代反应的历程
第2章 烷烃和环烷烃
H H H
H H H
C
C
H H H
H H C H H H
C
C
二、烷烃的通式和同分异构 通式:CnH2n+2
C4H10 CH3CH2CH2CH3 CH3CHCH3 CH3
b.p. m.p.
-0.5ºC -138.3ºC
-11.7 ºC -159.4 ºC
分子式相同,而结构和性质不同的化合物, 分子式相同,而结构和性质不同的化合物, 称为同分异构体。
命名规则为: (1)选主链:选择最长的碳链作主链,按主链的碳 原子数命名为“某烷”。 (2)编号:从靠近支链(取代基)的一端对主链进 行编号,根据支链所连碳原子的编号表示支链的位次。
6 5 4 3 2 1
CH3CH2CH2CHCH2CH3 CH3
3-甲基己烷
(3)命名:将支链的位次、个数、名称写在主体 名称的前面,中间用短线隔开。
sp3杂化轨道的特点: ①形状为葫芦状,一头大,一头小。 ②能量介于s和p轨道之间 ③方向性:四个sp3杂化轨道以 C原子核为中心,分别指向正 四面体的四个顶点。
C
甲烷的形成: 甲烷的形成:
H
C
H
H
H
C
两个原子轨道沿键轴方向重叠形成的共价键叫σ 键;形成σ键的电子叫σ电子 电子 σ键的特点: ① σ电子云对键轴呈圆柱形对称,其键轴在两原 子核的联线上; ②σ键可沿键轴做相对旋转,而不破坏共价键 ③σ键键能较大,较牢固。
1 7 CH2 2
7
CH
CH2
8 CH2 3 CH2
CH3
2 3 4
1 6 5
CH2 CH
6 5
CH2
4
双环[3.2.1]辛烷
第二章烷烃和环烷烃

第二章烷烃和环烷烃授课对象:应用化学、制药工程、化学工程与工艺专业、药学学时安排:5-6h一、教学目的与要求:1、掌握烷烃和环烷烃的结构特征和命名;烷烃和环烷烃的构象异构。
2、掌握烷烃和环烷烃的化学性质的异同点;烷烃和环烷烃的自由基取代及机理;掌握小环的开环加成。
二、教学重点1、烷烃的命名(包括六碳以下的英文命名)。
伯、仲、叔碳原子和氢原子,乙烷与正丁烷的构象;2、烷烃的结构特征:σ键。
卤代自由基反应机理,伯、仲、叔氢的反应活性,伯、仲、叔碳自由基的相对稳定性;3、脂环烃的命名(单环、螺环与桥环),三元、四元环的开环加成。
4、环己烷的椅式构象以及取代环己烷的优势构象规律。
三、教学难点:1、烷烃的英文命名;2、自由基卤代反应机理;3、环己烷的椅式构象,以及取代环己烷的优势构象规律;4、环丙烷的结构;四、教学方法讲授法。
为突出重点,突破难点,拟采用如下教学方法:1、关于烷烃的命名法则因中学的基础较好,应精选例题,边讲边练。
2、对于构象异构应充分利用模型和课件动画,帮助学生树立立体形象。
3、对于自由基反应历程和各级自由基的稳定性,紧扣八隅体的稳定结构和键的离解能来分析。
五、教具电脑、投影仪、Powerpoint课件、球棒模型,教鞭。
六、教学步骤及时间分配导言:烃(Hydrocarbon):碳氢化合物。
简述烃的分类,介绍本章学习的重点要求,强调本章内容是学习后续各章的基础。
1.1 烷烃一、烷烃的结构烷烃的结构特征:碳为sp3杂化;C-H、C-C均为σ键。
σ键特点:键牢固,电子云沿键轴呈圆柱形对称,可自由旋转。
[示CH4、CH3CH3的球棒模型]简述同系列和同系物的概念和重要性:二、烷烃的异构现象(一) 碳链异构(carbon chain isomer ):具有相同分子式,仅由于碳链结构不同而产生的同分异构现象。
如:丁烷(C 4H 10 ): 正丁烷 异丁烷戊烷(C 5H 12): 正戊烷 异戊烷 新戊烷从以上异构体引出:四种类型的碳,三种类型的氢。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H H
H H
•扭转张力
90o
重叠式构象
稳定构象
H H H H
4 3
88o
H
2
2
H
4
H H
1
H2C H2C
3
H
1
H
H H
角张力稍增 加, 扭转张 力明显减小
C1-C2
扭曲式构象
2. 环己烷的结构及构象
环己烷不是平面型分子
如果环己烷的 6 个碳原子在同一平面上: 将有角张力 将有扭转张力
120o
o
CH3CH2CH2CH3
小环化合物与卤素的反应
Br2 / r.t. Br Br
CH2CH2CH2 Cl2 / FeCl3 Cl Cl
(离子型) 加成反应
CH2CH2CH2 Br2 / r.t.
不反应(难开环)
注意区分:
Cl2 / hv Cl
自由基取代反应
小环化合物与 HI 或 H2O/ H2SO4的反应
螺[4. 5]癸烷 spiro[4. 5]decane
除螺C外的碳原子数 (用"."隔开)
1 4 5 3 2 7 6
组成桥环的 碳原子总数
4-甲基螺[2. 4]庚烷
4-methylspiro[2. 4]heptane
编号从小环开始 取代基数目取最小
二.环烷烃的性质
稳定性
普通环 > 中环
环的大小与稳定性
H
4 H 5 3
H H
2
CH3
3 1 6
H
5
4
H H
H
H
H
H
H
CH3与C3为对位交叉
CH3与C3为邻位交叉
优势构象,室温时占95%
2. 二取代环己烷的构象分析
cis-1, 2-二甲基环己烷
CH3
2 1
CH3
2
H CH3 H
1
CH3 CH3
1
2
CH3
1, 2-cis
e, a-
能量相等
a, e-
trans-1, 2-二甲基环己烷
3-甲基-4-环丁基庚烷 4-cyclobutyl-3-methylheptane
2 1 1'
2'
环可作为取代基
3'
3
(称环基) 相同环连结时,可
联环丙烷 bicyclopropane
用词头“联”开头。
桥环烃(Bridged hydrocarbon)的命名
桥头间的碳原子数
2 1 3 4 5
H C(CH3)3 2
2 CH3 1
优势构象
七 烷烃的主要来源和制法
主要来源:石油和天然气。
实验室制法
1). 烯烃加氢
CH3CH=CHCH 3 + H 2 。 25 C,5MPa
Ni,乙醇
CH3CH2CH2CH3
2). Corey-House合成
(CH 3)2CuLi + CH 3(CH 2)3CH2I
(与烯烃通式相同)
(单)环烷烃
桥环烃(稠环)
桥环烃
螺环烃
普通环烷烃的命名
CH3
环丙烷
环己烷
甲基环丙烷
以环为母体,名称 用“环” (英文 用 “cyclo”)开 头。 环外基团作为环上 的取代基
cyclopropane cyclohexane methylcyclopropane
1 2 3 4 1 2 3
扭船式构象
>1.84Å
H H H H H H H H H H H H
扭曲式构象
1. 单取代环己烷的构象分析
甲基环己烷的构象
H
2
1,3-竖键作用
H H C
1
C1-C2
H
6
H
3
H
4
H
2
H H
5
H
H H
5
C5-C4
H3C
1
3
H H H
C1-C2
H
H H
4
H
6
H
C5-C4
H
H
H H
H H3 C H
2 1 6
H H H H H H H H H H H H
偏离109.5o
C-H 重叠
环己烷碳架是折叠的
H H
3
H 2
H
1
H H
H 4 H
3
H
2 5
H 1 H H H
6
H
H H
4
5 H
6
HH
C2, C3, C5, C6 共平面
H H
H
H
H
椅式构象 (chair form)
船式构象 (boat form)
两者互为构象异构体
H 2 H
平面型
H
H 1 H C1-C2 2 H H
H H
C
C H
H
角张力(angle strain): 环的角度与sp3轨道夹 角差别引起的张力
所有C-H 键均为 重叠式构象,有 扭转张力
2. 环丁烷的构象
若为平面型分子
C4-C3
H
4
3
H HH
H H
4
3
2 1
HH
HH
C1-C2
1
•角张力
2
H
H
4) Grignard (格林尼亚)试剂法
将卤代烷与金属镁在干燥的乙醚中反应, 得到格氏试剂RMgX.它是有机化学家最为熟悉且 也是应用最多的金属有机试剂之一,是 Grignard V在20世纪初研究发现的。
RMgX
H2O
RH + Mg(OH)X
本次课小结和要求
环烷烃(普通环烷烃、桥环烃和螺环烃)的命名方法。
2 CH3 1
H H H
CH3
2 2 CH3 1 1
H H CH3 H
CH3
CH3
1, 2-trans
a, a有1. 3-竖键作用
e, e-
优势构象
cis-1, 3-二甲基环己烷
CH3
3 1
有较大的1. 3-竖键作用
CH3
H
H
1
CH3
3
H3C
1 3
CH3
CH3 H
a, a-
e, e-
1, 3-cis
CH3 H
顺反异构体
镜 面
H
CH3
H
CH3
CH3
H
H3C
CH3
H3C
CH3
顺反异构用 “顺”或“反” 注明基团相对位 置。 英文用 “cis”和“trans” 表示。
反-1,3-二甲基环戊烷(两者为对映异构体) (trans-1, 3-dimethylcyclopentane)
4
3
环丙基环己烷 cylcopropylcyclohexane
> 小环
环烷烃的燃烧热数据
每个CH2的燃烧 (KJ/mol) 每个CH2的燃烧热 (KJ/mol)
小 环
C3 C4 C5 C7
环丙烷 环丁烷
697.1 686.1
中 环 大 环
C8 C11 C12
环辛烷 环壬烷 环癸烷 环十四烷 环十五烷
663.8 664.6 663.6 658.6 659.0
5个碳在同一平面上 有角张力(C-C键角接 近120o) 平面碳上的C-H键为重叠 式构象(有较大的扭转张 力)
扭船式构象
>1.84Å
H H H H H H H H H H H H
扭曲式构象
半椅式构象
H H H H H H H H H H H H
5个碳在同一平面上 有角张力(C-C键角接 近120o) 平面碳上的C-H键为重叠 式构象(有较大的扭转张 力)
翻转后,原来的a键转变 为e键,而e键转变为a键
H
3
H
5
H
2 6
H
1
翻转
H H
H
4
H
3 5
H H
6 2 1
H
H
4
H
H
H H
H
H
H H
H H
H
H
椅式构象中C-H键的顺反关系
H H H H H H H
H
H H H
相邻碳上的a键和e键为顺式
两个相邻的a键(或e键)为反式
H
船式构象
H 4 C3-C2 H
小环化合物的催化加氢
H2 / Pt, 50oC or Ni, 80 C
2 2
o
CH3CH2CH3
(打开一根 C-C 键)
H2 / Pt, 50oC
3 1
CH3
3
CH2CH3
or Ni, 80 C
o
CH3CHCH2CH3
1
支链多 较稳定
主要产物
H2 / Pt, 120oC or Ni, 200 C
椅式构象(最稳定)
H
3
H 2
5
H
6
H
1
H H H 3 H
5 4 2
H
1 6
H 4 H C4-C3 H
H
H H
H H
H
H
H
交叉式
C6-C1
2.50Å
H H H H H H H H H
H H
2.49Å
H
H~H之间距离均 大于H的Van der Waal’s半径之和 (2.40Å )
