产品包装变更情况登记表
饮料厂记录表格

饮料有限公司记录表格受控文件清单编号:QR-SOP001-01制定人/日期:审核人/日期:批准人/日期:文件分发/回收记录编号:QR-SOP001-02 文件名称:文件编号:序号:文件更改申请单编号:QR-SOP001-03新建 修改现有文件 作废2. 文件更改申请批准人填写:批准 不批准意见 :签名/日期3. 会审部门/人员 填写:4. 文件审核和批准人填写:同意 不同意意见 :文件审核人 签名/日期同意 不同意意见 :文件批准人 签名/日期受控记录清单制定人/日期:审核人/日期批准人/日期:公司年度内审计划编号:QR-SOP003-01编制人/日期:审核人/日期:批准人/日期:审核实施计划编号:QR-SOP003-02 审核组长:审核员:1.审核目的:2.审核依据:3.审核覆盖产品:4.审核时间:年月日至年月日5.审核组构成:6.现场审核期间被审核方有关人员参加下列活动:首/末次会议:最高管理者及管理者代表和审核有关的管理人员参加。
7.审核安排:审核组长/日期:经理/日期:总裁/日期:审核检查表编号:QR-SOP003-03HACCP体系审核报告报告分发部门/人员:审核组长/日期:经理/日期:总裁/日期:HACCP体系审核首(末)次会议签到表编号:QR-SOP003-05 日期:生产设备清单编号:QR-SOP004-01制定人/日期:审核人/日期:批准人/日期:设备修理记录表编号:QR-SOP004-02不合格品评审记录表编号:QR-SOP005-01评审人: 批准人: 处理人:日期日期日期入库单部门:年月日编号:QR-SOP006-01第一联 存根生 产 单部门: 年 月 日 编号:QR-SOP006-02制定/日期:审核/日期:出 库 单单位: 年 月 日 编号:QR-SOP006-03验收:复核:制单:领料单发料人:领料人:培训记录表编号:QR-SOP007-01培训申请表年度培训计划编号:QR-SOP007-03年份:产品回收计划书QR-SOP008-01 产品名称规格:产品批号:产品代码:产品数量:产品回收原因:产品涉及危害:产品回收类别:制定人/日期:审核人/日期:批准人/日期:产品回收报告QR-SOP008-02编制人/日期:审核人/日期:批准人/日期:监视和测量设备清单编号:QR-SOP010-01制定人/日期:审核人/日期:批准人/日期:监测和测量设备年度校准/ 检定计划制表人/日期: 审核人/日期:HACCP体系确认检查表编号:QR-SOP011-01编写人/日期:审核人/日期:批准人/日期:纠正/预防措施要求表编号:QR-SOP012-01管理评审计划编制/日期:批准/日期:管理评审报告每日生产卫生检查记录表编号:QR-SSOP-01检查人/日期:审核人/日期:有毒化学品出入库登记表编号:QR-SSOP-02有毒化学品清单编号:QR-SSOP-03有毒化学品清单编号: QR-SSOP-03制定人/日期:审核人/日期:批准人/日期:塑二线灌注工序设备运行记录日报表关键限值:①UHT杀菌温度:135±1 ℃;②UHT杀菌时间:≥25 秒监控频率:①每1小时检查1次;②每1小时检查1次注:UHT杀菌为关键控制点PET瓶封盖监控记录表编号:QR-HACCP-002关键限值:①封盖扭力:≥1.5±0.3N·m监控频率:生产开机前/封盖机维修后开机前/生产过程中每1小时/生产结束前每半小时检查1次②封盖外观良好生产时间:年月日生产线:□塑一线□塑二线品种:规格:铁罐封盖监控记录表编号:QR-HACCP-003 关键限值:①迭接率:≥50%;紧密度:≥60% ②封盖外观良好监控频率:生产开机前/封盖机维修后开机前/生产过程中每2小时/生产结束前每半小时检查1次品种:规格:罐型:班次:线别:日期:杀菌釜杀菌监控记录表编号:QR-HACCP-004 关键限值:杀菌釜杀菌温度:121±1 ℃;UHT杀菌时间:≥18分钟监控频率:每釜铝罐进厂检验记录表PET瓶检验报告单编号:QR-WI-002检验员:审核:PET瓶进厂检验记录表编号:QR-WI-003PET塑瓶瓶盖外观/目视抽查记录编号:QR-WI-004PET碳酸饮料瓶检验报告单白砂糖进厂检验表编号:QR-WI-006包装原材料微生物检验报告单编号:QR-WI-007 品种规格:生产产家:检验日期:报告日期:包装原材料微生物检验报告单编号:QR-WI-007 品种规格:生产产家:检验日期:报告日期:瓦楞纸箱/纸托进厂验收报告编号:QR-WI-008 品名:生产日期:材料使用通知单:供应商:到货日期:品控员:单项判定中“√”表示合格,“×”表示不合格。
《食品生产许可证变更申请表》

企业基本情况
(变更前)
企业名称(盖章)
联系人
联系电话
食品生产许可证编号
申请变更项目
申请变更原因
变更情况概述
变更前
变更后
申请人
意见
年月日(盖章)
当地质监局
意意变更。
□同意变更。食品生产许可证编号不变。
年月日(盖章)
备注:1、属于变更食品生产企业名称的,名称变更前后的印章都应加盖;尚无印章的,负责人签字。2、变更情况批准后,应及时通知基层质监局。3、申请生产地址名称变更的需当地质监局盖章确认。
包装审核流程

包装审核流程受控状态:发放编号:编制:品管部审核:批准:包装审核流程1 目的为使包装审核的工作能够在各部门的相互配合下有效快速的完成,同时使我公司包装更加规范化,特制定此流程。
2 适用范围本流程适用于集团公司负责包装的设计审核、制版、印刷等流程的相关部门。
3 职责3.1 研发部负责产品配方中使用的各种原辅料、添加剂的食品安全相关法律法规符合性的审查,并为包装配料标签的设计提供产品的真实配方。
3.2 品管部负责产品名称、包装设计等相关法律、法规符合性的审核。
3.3 品管部负责根据研发部提供的配方表编制包装袋的配料表,同时负责协调各产品相应的生产厂区品控化验室对我公司尚不具备检测能力的其他营养成分外检。
3.4 检验中心负责产品营养标签中能量、蛋白质、脂肪、碳水化合物、钠等五项强制标示项目的检测,做出判定并出具营养成分表。
3.5 市场部负责产品的名称、包装设计、条形码相关法规符合性的审核。
3.6 采购部负责分配新包装的供应商,协调由供应商制版。
3.7 各厂区负责包装与真实配料符合性的监督、审核。
4 工作程序4.1 产品包装设计、印刷的通知4.1.1 新产品通过品尝后,由研发部下发品尝通过通知,由市场部组织研发部、品管部沟通确定新产品的命名,市场部订出推广计划(包括要求提供配料、产品规格、样品数量等)。
4.1.2 常规产品因配方调整需改变配料标签的,由研发部24h之内向市场部、品管部提出纸版更改包装的设计、印刷通知,并将配方提供给品管部,双方填写《配方工艺收到、发放、回收记录表》,同时将样品送检测中心进行营养标签的检测。
4.1.3 因包装相关法律法规的新发布实施、调整等需改变包装标示标签的,由品管部24h之内提出更改包装的设计印刷通知。
需跟客户确定产品标签的包装更改前,相关人员及时与客户沟通包装变更情况,变更后的新包装找客户确认。
(如餐饮客户)各相关部门共同签字确认。
4.1.4 因营销策划需求需更改产品包装的,由市场部24h之内负责向品管部提出包装更改的通知,如果包装更改涉及产品的配方及保质期及贮存方法的更改,要一并通知研发部。
PPAP表格范例

生产件最终批准程序文件报告编号原则1、报告编号由四组数据组成,完整的零件编号形式如下:尾注顺序号供应商代码产品部各科室代码其中□表示字母,表示○阿拉伯数字。
PPAP文件报告编号不能重复。
编号:XXXXXXXXX-05编号:XXXXXXXXX-06编号:XXXXXXXXX-07奇瑞质保部:注:1、本表格由供应商或二级供应商认真填写,要求附工艺流程图,并加盖公章后将原件提交给奇瑞公司质保部;2、本表格作为最终批准的输入之一;3、表格(工序栏)不够可续表;4、关键工序在项目“第x序”前打√,并在工序能力一栏中填写Cpk或Ppk数值,如Cpk=1.33或Ppk=1.67。
第页共页Page of Pages编号:XXXXXXXXX-08第页共页Page of Pages第页共页Page of Pages奇瑞质保部:注:1、本表格由二级供应商认真填写,并加盖二级供应商和供应商公章后将原件提交给奇瑞公司质保部;2、二级供应商变化时,应及时通过奇瑞质保部,以确定是否进行生产件批准。
第页共页Page of Pages编号:XXXXXXXXX-111、本表由二级供应商认真填写,并加盖二级供应商和供应商公章后将原件提交给奇瑞公司质保部;2、本表是最终批准的重要输入之一,如有变动应及时通知奇瑞质保部。
奇瑞采购部:奇瑞采购部:注:1.必要时,供应商应附详细的自审报告;2.在完成各过程的内部批准并确认满足批量生产、供货要求时才可提交本表;3.SQE 尽量携带本表去供应商现场确认;4.在不适用的选项的 ”。
奇瑞采购部:2、版面不够,可附页;3、任何产品变更、物流/运输方式变化导致包装改变时,应向奇瑞物流部门确认是否进行重新认可。
编号:XXXXXXXXX-26第一联汽研院第二联采购部第三联质保部。
药品包装方式变更明细表

6g*10丸/盒
铝塑包装
盒 全市 SHDJ20160200 山西双人药业有限责任公司
6g*8袋
镀铝复合袋
盒 全市 SHDJ20160100 山西双人药业有限责任公司
3g×18袋
复合膜袋
盒 全市 SHDJ20150200 烟台天正药业有限公司
3g*20袋
药用复合膜袋 盒 全市 SHDJ20160100 烟台天正药业有限公司
4
银黄颗粒
—— 颗粒剂(无糖型)
3g*24袋
药用复合膜包装 盒 全市 SHDJ20150300 哈尔滨蒲公英药业有限公司
5
板蓝根颗粒 —— 颗粒剂(无糖型)
3g*20袋
药用复合膜包装 盒 全市 SHDJ20150300 哈尔滨蒲公英药业有限公司
6
板蓝根颗粒 —— 颗粒剂(无糖型)
7 注射用头孢米诺钠 美士灵 粉针剂(溶媒结晶)
9
牛黄上清胶囊 ——
胶囊剂
0.3g*36粒
铝塑
盒 全市 SHDJ20150300 江西天施康弋阳制药有限公司
10
牛黄上清胶囊 ——
胶囊剂
0.3g*24粒
铝塑
盒 全市 SHDJ20150300 江西天施康弋阳制药有限公司
11
枳术宽中胶囊 ——
硬胶囊
0.43g*12粒*3板
铝塑包装
盒 非基层 SHDT20170100 山西双人药业有限责任公司
8g*9袋
镀铝复合袋
盒 全市 SHDJ20160100 山西双人药业有限责任公司
0.37g*12片*3板
铝塑包装
盒 全市 SHDJ20160100 山西双人药业有限责任公司
0.4g*12片*2板
顾客反馈投诉信息登记表
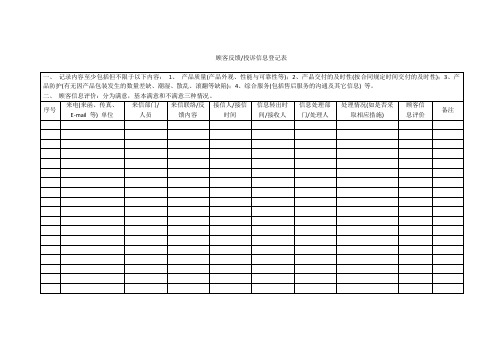
一、记录内容至少包括但不限于以下内容:1、产品质量(产品外观、性能与可靠性等);2、产品交付的及时性(按合同规定时间交付的及时性);3、产品防护(有无因产品包装发生的数量差缺、潮湿、散乱、滚翻等缺陷);4、综合服务(包括售后服务的沟通及其它信息)等。
二、顾客信息评价:分为满意,基本满意和不满意三种情况。
序号பைடு நூலகம்
来电(来函、传真、E-mail等)单位
来信部门/
人员
来信联络/反馈内容
接信人/接信时间
信息转出时间/接收人
信息处理部
门/处理人
处理情况(如是否采取相应措施)
顾客信
息评价
备注
原辅包登记填报说明

原料药登记—填表说明申请人保证:本项内容是各登记机构对于本项登记符合法律、法规和规章的郑重保证,各登记机构应当一致同意。
其他特别申明事项:需要另行申明的事项。
登记号:需填写由“原辅包登记平台”生成的登记号。
版本号:需填写由“原辅包登记平台”生成的版本号。
1.本登记属于:系指如果属于登记国产原料药填写“国产原料药登记”,如果属于登记进口原料药填写“进口原料药登记”,如果属于登记港澳台原料药填写“港澳台原料药登记”。
本项为必填写项目。
2.品种通用名称:应当使用正式颁布的国家药品标准或者国家药典委员会《中国药品通用名称》或其增补本收载的药品通用名称。
本项为必填项目。
3.英文名称:英文名填写INN英文名。
本项为必填项目。
4.包装:系指直接接触原料药的包装材料或容器,如有多个包装材质要分别填写,中间用句号分开,例如“玻璃瓶。
塑料瓶”。
包装规格是指基本包装单元的规格,原料药的基本包装单元,是原料药生产企业生产供上市的原料药最小包装,如:每瓶×毫升,对于按含量或浓度标示其规格的液体、半固体或颗粒,其装量按包装规格填写。
配用注射器、输液器或者专用溶媒的,也应在此处填写。
每一份登记表可填写多个包装规格,不同包装规格中间用句号分开,书写方式为“药品规格:包装材质:包装规格”,例—1—如:“0.25g:玻璃瓶:每瓶30片”,多个规格的按上述顺序依次填写。
本项为必填项目。
5.质量标准:指本项原料药登记所提交药品标准的来源或执行依据。
来源于中华人民共和国药典的,需写明药典版次;属局颁或部颁标准的,需写明何种及第几册,散页标准应写明药品标准编号;来源于进口药品注册标准的,写明该进口注册标准的编号或注册证号;来源于国外药典的,需注明药典名称及版次;其他是指非以上来源的,应该写明具体来源,如自行研究,国产药品注册标准等情况。
本项为必填项目。
6.专利情况:所登记原料药的专利情况应当经过检索后确定,发现本品已在中国获得保护的有关专利或国外专利信息均应填写。
食品生产企业sc许可证申请记录表格

食品生产公司质量安全信息登记表汇总(仅供参与)目录1.原辅材料进货查验记录 ...................................................... 错误!未定义书签。
2.( )原料验收台账 ......................................................... 错误!未定义书签。
3.1()原料货位卡 (4)3.2( )出入库台账 (5)3.3成品出入库记录 (6)4.投料记录 (7)5....)关键控制点记录. (8)6.1包材清洗消毒记录 (9)6.2设备及车间清洗记录 (10)6.3紫外线灯杀菌登记表 (11)7.1消毒液、洗涤剂采购管理记录 (12)7.2( )出入库台账 (13)7.3车间消毒液、洗涤剂配制使用记录 (14)8.过程检查记录 (15)9.产品包装记录 (16)10.1产品检查报告 (17)10.2检查原始记录 (18)11.产品留样记录 (19)12.产品销售台帐 (20)13.运送交付记录 (21)14.防鼠防虫害检查表 (22)15....)温、湿度监控记录.. (23)16.生产设备设施维护保养记录 (24)17.厂区卫生检查记录 (25)18.生产过程微生物监测记录 (26)19.废弃物管理记录 (27)20.不安全食品召回登记表 (28)21.1不合格原辅料解决记录 (29)21.2不合格半成品解决记录 (30)21.3不合格产品记录 (31)22.( )年度职工培训计划 (32)23.培训考核记录 (33)24.职工培训记录 (34)25.工作人员健康记录 (35)26.1食品安全自查记录 (36)26.2自查问题改善表 (40)27.食品安全隐患登记表 (41)29.投诉受理记录 (42)30.食品安全应急演练记录 (43)1.原辅材料进货查验记录(□原料□辅料□添加剂)()年度2.( )原料验收台账()年度填表说明: 本表由供销部门对非获证的初级农产品进行采购验收登记, 每批购进原料依据公司制定的验收标准进行验收。
用品物品申请表格模板(可修改)

申请日期:年月日领取日期:年月日
姓名
部门
职位
序号
所需物品
数量
用途
申请理由
备注
申请人签字
主管பைடு நூலகம்核
经理审核
仓库审核
备注:填写办公用品申请表时,请确保信息准确、完整,以便管理部门能够高效地进行审批和采购工作。同时,遵守公司的相关规定和流程,确保申请的合理性和合规性。
办公用品申请表
申请日期:年月日领取日期:年月日
姓名
部门
职位
序号
所需物品
数量
用途
申请理由
备注
申请人签字
主管审核
经理审核
仓库审核
备注:填写办公用品申请表时,请确保信息准确、完整,以便管理部门能够高效地进行审批和采购工作。同时,遵守公司的相关规定和流程,确保申请的合理性和合规性。
