2018高考化学大一轮学考复习考点突破第二章第6讲离子反应离子方程式课件新人教版
浙江省2018高考化学一轮复习4离子反应 离子方程式课件

-17基础梳理 感悟选考 对点训练
1.(2016· 10· 浙江选考)下列离子方程式正确的是 ( ) A.金属钠和水反应 :Na+2H2O Na+ +2OH-+H2↑ B.用氢氧化钠溶液吸收少量二氧化硫气体: SO2+2OHSO2 3- +H2O C.硫酸铵溶液和氢氧化钡溶液反应:Ba2+ +S O2 BaSO4↓ 4D.碳酸氢钠溶液和过量的澄清石灰水混合: 2+ 2HCOCaCO3↓+CO2 3 +Ca +2OH 3- +2H2O
-1-
知识条目 (1)离子反应的本质及发生的条件 (2)离子方程式
必考要求 b b
加试要求 b b
-2基础梳理 感悟选考 对点训练
1.离子反应的本质与意义
-3基础梳理 感悟选考 对点训练
2.离子方程式的书写 (1)书写方法:
注意:在书写离子方程式时,“改”是关键,只有易溶并且易电离的 物质,才能改写成离子的形式。即只有强酸、强碱和可溶性盐,才 改写成离子的形式。再具体一点,常见的稀硫酸、浓或稀硝酸、浓 或稀盐酸、氢氧化钠、氢氧化钾、氢氧化钡、澄清石灰水、钠盐、 钾盐、铵盐等,改写成离子的形式;弱酸、弱碱、难溶物、气体、 氧化物、单质等都不能写成离子形式。
-8基础梳理 感悟选考 对点训练
(ⅲ)微溶物状态不同,离子方程式不同,如: 石灰乳与碳酸钠溶液混合,离子方程式为 Ca(OH) 2+CO2 CaCO3+2OH3若是澄清石灰水与碳酸钠溶液混合,离子方程式为 Ca2+ +CO2 CaCO3↓ 3(3)离子方程式正误判断: ①看“ ”“ ”“↑”“↓”等是否正确。 ②看表示各物质的化学式是否正确。如 HCO3 不能写成 2+ + CO2 3 +H ,HS O4 通常应写成 S O4 +H ,HCOO 不可写成 COOH 等。 ③看离子反应是否符合客观事实,不可主观臆造产物及反应。如 2Fe+6H+ 2Fe3+ +3H2↑就不符合客观事实。
2018版高考化学一轮总复习第二章化学物质及其变化第6讲离子反应课件

③两性氢氧化物双向电离。如 Al(OH)3 的电离方程 式:H__+_+__A__lO__2-_+__H_2_O______A__l(_O__H_)_3_____A__l3_+_+__3_O__H_-__。
(3)酸式盐。 ①强酸酸式盐完全电离,一步写出。如 NaHSO4 在 水溶液中的电离方程式为 NaHSO4===Na++H++SO24-, 在熔融状态下的电离方程式为 NaHSO4===Na++HSO4-。 ②多元弱酸酸式盐,第一步完全电离,酸式酸根部分 电离。 如 NaHCO3===Na++HCO-3 ,HCO-3 H++CO23-。
①H2SO4 ②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜 ⑦冰醋酸 ⑧氯化氢 ⑨蔗糖 ⑩氨气 ⑪
CO2 ⑫NaHCO3 答案:①④⑦⑧⑫ ⑤⑨⑩⑪ ①④⑧⑫ ⑦
依据元素周期表,突破强、弱电解质的记忆 ⅠA:除 LiOH 外其余都是强碱。 ⅡA:除 Mg(OH)2、Be(OH)2 外其余都是强碱。 ⅢA:Al(OH)3 是两性氢氧化物。 ⅣA:H2CO3、H2SiO3 均为弱酸。
第二章 化学物质及其变化
第 6 讲 离子反应
新课标考纲展示
1.了解电解质的概念, 了解强电解质和弱电 解质的概念。 2.理解电解质在水中 的电离以及电解质溶 液的导电性。 3.了解离子反应的概 念、离子反应发生的 条件。 4.能正确书写离子方 程式。
2016 2015 2014
全国卷三年考情 卷Ⅰ:T27(2)、(4) 卷Ⅱ:T28(2)、(5) 卷Ⅲ:T13、T27(2)、 T28(1) 卷Ⅰ:T10、T36(1) 卷Ⅱ:T12、T28(2)
(5)NaHCO3 在 水 中 发 生 电 离 的 方 程 式 为 NaHCO3=== Na++H++CO23-。( )
2018届高考化学第二轮专题复习离子方程式课件(42张ppt)

(5)将足量的AlCl3溶液加入NaOH溶液中_____________。 (6)NaAlO2溶液与过量的盐酸混合________________。 (7)在标准状况下,将2.24 L Cl2通入含0.1 mol FeBr2的溶液 中______________________________________________。 (8)Ca(HCO3)2溶液中加入过量的NaOH溶液__________。
(3)氧化还原反应中涉及到的“量” 氧化性:Cl2>Br2>Fe3+>I2; 还原性:Cl-<Br-<Fe2+<I- 例如:向FeBr2溶液中通入少量Cl2,反应的离 子方程式为: 2Fe2++Cl2===2Fe3++2Cl-。 向FeBr2溶液中通入过量Cl2,反应的离子方程 式为: 2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。
3.写出下列反应的离子方程式
(1)钠与水的反应________________________________。 (2)澄清石灰水加入盐酸中________________________。 (3)将氨水滴入AgNO3溶液中至过量________________。 (4)小苏打与甲酸溶液混合_____________________。
2.与量有关的离子方程式的书写 (1)生成的产物与过量的物质继续反应的离子反应 例如:NaOH与AlCl3溶液(足量或不足量),NaAlO2 溶液通入CO2(少量或过量),Ba(OH)2溶液通入CO2(少量 或过量),NaAlO2溶液加盐酸(少量或过量),有关的离子 方程式都有区别,这类离子反应,只需注意题所给条件, 判断产物是否与过量物质继续反应,以便确定产物形式。
(2)酸式盐与碱反应涉及到的“量” 书写酸式盐和碱反应的离子方程式时,一般采 用定“1”的规则,即将量相对少的物质定为1 mol, 另一物质溶液中的离子可取任意值,从而确定生成 物的量。但在复习时,不必探究得过深,从历年的 高考试题来看,只限于掌握以下五个反应即可。 ①NaHCO3与Ca(OH)2 ②Ca(HCO3)2和NaOH ③Ca(HCO3)2和Ca(OH)2 ④Ba(OH)2和NaHSO4 ⑤明矾溶液和Ba(OH)2
高考化学一轮复习第2章化学物质及其变化第6讲离子反应离子方程式课件

2.电离方程式
(1)强电解质完全电离,用“___=_=_=___”表示。
写出下列物质在水溶液中的电离方程式。 H2SO4:___H__2S__O_4_=_=_=_2_H__+_+__S_O_24_-_______________; (NH4)2SO4:______(_N__H_4_)2_S_O__4=_=__=_2_N_H__+ 4 _+__S_O_42_-_______; BaSO4:______B__a_S_O_4_=_=_=_B__a_2+_+__S_O__24_-___________; KAl(SO4)2:___K_A__l(_S_O__4)_2_=_=_=_K__+_+__A_l_3+_+__2_S_O__24_-______。
2.弱电解质 弱酸:CH3COOH、HClO、HF、HCN、H2SO3、H2S、H2SiO3、H2CO3、 H3PO4 等; 弱碱:NH3·H2O 以及 Cu(OH)2、Mg(OH)2、Al(OH)3、Fe(OH)3、Fe(OH)2 等难溶于水的碱; 水及少数盐,如(CH3COO)2Pb。
三、电离方程式的书写 1.电解质的电离
(6)Cl2 溶于水 _______________________________________________________________。 (7)过氧化钠溶于水 _______________________________________________________________。 (8)明矾溶于水产生 Al(OH)3 胶体 _______________________________________________________________。
写出下列物质在水溶液中的电离方程式。 NaHSO4:_N__a_H_S_O__4_=_=_=_N_a_+_+__H__+_+__S_O__24-________________________; NaHCO3:___N_a_H__C_O__3=_=_=_N__a_+_+__H_C__O__- 3 _、__H_C__O_- 3____H__+_+__C_O__23-______。
2018届高考化学复习-离子反应化学课件PPT

Na+、Ba2+、NO- 3 、Cl-
高考总复习 一轮复习导学案 ·化学
高考总复习 一轮复习导学案 ·化学
专题一 化学基础知识
课前自测
考点导学
随堂检测
考点1 电解质与非电解质、强电解质与弱电解质
———— 基 础 梳 理 ————
1. 电解质与非电解质
电解质
非电解质
定义
在水溶液里_或__熔融状态 下能导电的_化__合__物__
在水溶液里_和__熔融状态下 都不能导电的_化__合__物__
[解析] 滴入酚酞溶液显红色的溶液显碱性,Cu2+不能大
量共存,A错误;能使红色石蕊试纸变蓝色的溶液显碱性,所给
离子均能大量共存,B正确;由水电离产生的c(H+)=10-13mol·L
-1的溶液呈酸性或碱性,酸性条件下CH3COO- 不能大量共
存,C错误;
pH=1的溶液显酸性,NO
-
3
在酸性条件下具有氧
为Al3++3OH-===Al(OH)3↓,D正确。
高考总复习 一轮复习导学案 ·化学
课前自测
考点导学
随堂检测
专题一 化学基础知识
4. (2016·四川卷)下列关于离子共存或离子反应的说法正确 的是( C )
A. 某无色溶液中可能大量存在:H+、Cl-、MnO- 4 B. pH=2的溶液中可能大量存在:Na+、NH+ 4 、SiO23- C. Fe2+与H2O2在酸性溶液中的反应:
高三化学第一轮复习——《离子反应》专题复习PPT课件

②
BaCl2+Na2SO4 BaSO4↓+2NaCl
② “拆”:将易溶于水且易电离的物质写成离子形式,其
他
①
物质写化学式。如单质、沉淀、气体、难电离物质、
②
氧化物等。
③
Ba2++2Cl-+2Na++SO42- BaSO4↓+2Na++2Cl-
基础知识导航
重点知识归纳
一、离子反应和离子方程式 2 离子方程式及其书写
3.电离及电离方程式 (1)电离:电解质在水溶液中或熔融状态下产生自由移动离子
的过程,电离过程可以用电离方程式表示。 (2)电离方程式
①强电解质:完全电离,用“=”表示。例如:NaCl=NaCl。
②弱电解质:部分电离,用“ ”表示。例如:
NH HO NH OH。
32
4
③多元弱酸分步电离,一般由第一步电离决定。例如:
蔗糖
乙醇
在水溶液和 熔融状态中
不电离
常见物质的溶解性表
K+、Na+、NH4+、NO3-、HCO3-、HSO3- (全部溶于 水) Cl-(不溶银、亚汞) SO42-(不溶钡和铅,CaSO4和Ag2SO4微溶) CO32-、 SiO32- 、 PO43- 、S2- 、 SO32-(溶于水只有钾、 钠、铵,MgCO3微溶) OH-(溶于水只有钾、钠、铵和钡,Ca(OH)2微溶)
基础知识导航
重点知识归纳
二、有关离子方程式的题型 1 离子方程式的正误判断
高考试题的第Ⅰ卷中有关离子方程式正误判断的试题出现 的几率很高,判断离子方程式是否正确时,一般要注意观察以 下几个方面的问题:
③ 观察反应前后电荷是否守恒。
最新-2018高三化学一轮复习 18离子反应课件 精品

• 四反应。指离子间通常能发生的四种类 型的反应,能相互反应的离子显然不能大
量共存。①复分解反应,如Ba2+与SO 、 NH4+与OH-、H+与CH3COO-等;②氧化 还原反应,如Fe3+与I- ,NO (H+)与Fe2+, MnO (H+)与Br-,H+与S2O 等;③双水 解反应,如Al3+与HCO 、Al3+与AlO2- 等;④络合反应,如Fe3+与SCN-等。
• (1)看离子反应是否符合客观事实,不可
主观臆造产物及反应。如2Fe+6H+
===2Fe3++3H2↑就不符合客观事实。
• (2)看
“↑”“↓”等是否正
确。
• (3)看表示各物质的化学式是否正确。如 HCO 不能写成CO +H+,HSO 通常应 写成SO +H+,HCOO-不能写成COOH-
• (5)看电荷是否守恒。如FeCl2溶液与Cl2反 应,不能写成Fe2++Cl2===Fe3++2Cl-, 而应写成2Fe2++Cl2===2Fe3++2Cl-,同 时两边各原子数也应相等。
• (1)理解电解质、非电解质的关键:①化 合物;②在水溶液里或熔融状态下能否导 电(即自身能否电离)。
• 如单质Fe、氯水(混合物)均能导电,但不 是电解质;酒精的水溶液(混合物)不能导 电,但也不是非电解质。
• (2)常见强电解质 • ①“六强酸”:H2SO4、HNO3、HClO4、 HCl、HBr、HI。
• 方案一:焰色反应法
• 用洁净的玻璃棒蘸取未知液X置于酒精灯 外焰上灼烧,观察到火焰呈黄色,则证明 其中不含K+。对上述实验过程中的错误和 疏漏加以纠正、补充:________________、 ________________。
2018年全国卷高考化学知识点专题突破—《离子反应》(知识点归纳总结+真题回访)
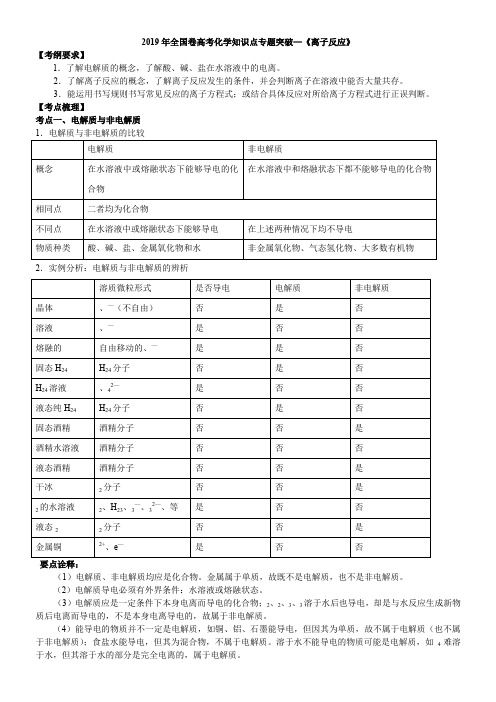
2019年全国卷高考化学知识点专题突破—《离子反应》【考纲要求】1.了解电解质的概念,了解酸、碱、盐在水溶液中的电离。
2.了解离子反应的概念,了解离子反应发生的条件,并会判断离子在溶液中能否大量共存。
3.能运用书写规则书写常见反应的离子方程式;或结合具体反应对所给离子方程式进行正误判断。
【考点梳理】考点一、电解质与非电解质2.实例分析:电解质与非电解质的辨析(1)电解质、非电解质均应是化合物。
金属属于单质,故既不是电解质,也不是非电解质。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质应是一定条件下本身电离而导电的化合物;2、2、3、3溶于水后也导电,却是与水反应生成新物质后电离而导电的,不是本身电离导电的,故属于非电解质。
(4)能导电的物质并不一定是电解质,如铜、铝、石墨能导电,但因其为单质,故不属于电解质(也不属于非电解质);食盐水能导电,但其为混合物,不属于电解质。
溶于水不能导电的物质可能是电解质,如4难溶于水,但其溶于水的部分是完全电离的,属于电解质。
考点二、强电解质与弱电解质1.强电解质与弱电解质的比较要点诠释:电解质的强弱是以电离的程度来区分的,与物质的溶解度、溶液的导电能力没有必然联系。
①4、3等虽然在水中溶解度很小,溶液的导电性很差,但是由于都是离子化合物,溶于水的部分是全部电离的,是强电解质。
②浓氨水的导电性比极稀溶液强,但3·H2O属于弱电解质。
2.电离方程式的书写方法:(1)要求左边书写电解质的化学式,右边写电解质电离出的离子的化学式,不同离子间用加号相连。
强电解质用“”,弱电解质用“”。
如:H24242-;442—;(3)2223—+ ;3·H24+;H2+33(2)电离过程中,元素或原子团的化合价不变。
离子所带电荷数等于它在化合物中显示的化合价。
(3)检查电离方程式书写是否正确时,不仅要检查质量是否守恒(即电离前后原子的种类是否相同和个数是否相等),而且要检查电荷是否守恒(即电离后的阴、阳离子所带负、正电荷总数是否相等)。
高考化学一轮复习-离子反应-离子方程式课件(99张)

反 馈
·
关
真
键 能 力
________( 写 出 主 要 化 学 用 语 , 下 同 ) , NaHS
溶液呈碱性的原因
题 验 收
______________________________________________________。
学 科 素
[答案] HSO-3 H++SO23-
课 后
养
限
应 用
集 训
返 首 页
·
11
3.金属导电与电解质溶液于__自__由__电__子___在电场作用下的定向移动。温度
课 堂
知
反
识 关
升高,金属阳离子振动幅度增大,自由电子定向移动阻力增大,金
·
馈 真
键
题
能 力
属导电性__减__弱___。
验 收
(2)电解质溶液之所以导电,是由于溶液中有自由移动的_离__子___
·
反 馈
关
真
键
题
能
验
力
收
·
·
学 科 素 养 应 用 创 新
A
课
后
限
时
集
B
C
D
训
返 首 页
26
·
必
(1)向 H2SO4 溶液中加入等体积、等物质的量浓度的 Ba(OH)2 溶 课
备
知 识
液。(
)
堂 反 馈
·
关
真
键 能
(2)向 H2S 溶液中通入 Cl2 直至过量。( )
题 验
力
收
(3)向 AgNO3 溶液中通入少量 HCl。( )
课 后
养
限
2018版高考化学二轮复习第二章化学物质及其变化2.2离子反应离子方程式课件

注 意
溶液的导电能力与溶液中离子浓度的大小及所带电荷数 目有关,离子浓度越大,所带电荷数目越多,导电能力越强。
基点小练
1.判断正误(正确的打“√”,错误的打“×”)。 (1)银和食盐水都能导电,都属于电解质 (2)AgCl、BaSO4 等不溶于水,都属于弱电解质 (×) ( ×)
(3)溶液的导电性强弱与溶液中离子浓度及离子所带的电荷数 有关 (4)HClO 是弱酸,但 NaClO 是强电解质 (5)硫酸在水溶液中能完全电离,所以稀硫酸是强电解质 (√) (√ ) (×)
1.电解质与非电解质 (1)电解质:在 水溶液里 或 熔融 状态下能够导电的化 合物。 (2)非电解质:在水溶液里和熔融状态下,都不能导电的
化合物 。
2.强电解质和弱电解质 (1)强电解质:在水溶液中能 全部 电离的电解质。
强电解质
强酸 强碱 绝大多数盐
举例
HCl、H2SO4、HNO3、HClO4、HBr、HI等 KOH、NaOH、Ba(OH)2、Ca(OH)2等 NaCl、BaSO4、CaCO3等
2 H SO H + HSO 、 HSO H + SO ___________________________________________________ 2 3 3 3 3
考什么
高考为标Байду номын сангаас全练题点无盲区备考
?
题点(一)强弱电解质的判断
1.下列说法正确的是 硫化钠溶液的导电能力弱
(
)
A.(2015· 重庆高考)25 ℃时,0.1 mol· L-1 的硫化氢溶液比等浓度的 B.(2014· 福建高考)NaHCO3 的电离方程式为 NaHCO3===Na++
- -
( ×)
2018届高考化学一轮课件离子反应

考点6
考点7
考点8
试做真题
高手必备 萃取高招 对点精练
离子方程式的书写与正误判断 1.(2017江苏,6)下列指定反应的离子方程式正确的是( ) A.钠与水反应:Na+2H2O Na+ +2OH-+H2↑ B.电解饱和食盐水获取烧碱和氯气:2Cl -+2H2O H2↑+Cl 2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸:Ba +OH +H +S O 4 BaSO4↓+H2O D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO+OH 3 CaCO3↓+H2O
考点6
考点7
考点8
试做真题
高手必备 萃取高招 对点精练
3.(2014课标全国,11)下列离子方程式错误的是(
)
2-
A.向 Ba(OH)2 溶液中滴加稀硫酸:Ba2++2OH-+2H+ +S O4 BaSO4↓+2H2O
-
B.酸性介质中 KMnO4 氧化 H2O2:2MnO4 +5H2O2+6H+ 2Mn2++5O2↑+8H2O C.等物质的量的 MgCl 2、Ba(OH)2 和 HCl 溶液混合 :Mg2++2OHMg(OH) 2↓ D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2ePbO2+4H++S O4
不能写成离子形式,C 项错误;明矾溶液中滴入 Ba(OH)2 溶液使 SO4 恰好完全沉淀时,铝离子应完全转化为 AlO2 ,D 项错误。
2-
考点6
高考化学大一轮学考复习考点突破 第二章 第6讲 离子反应 离子方程式课件 新人教版

BD项项非中中电的的NH解H2O3为为非C弱1电电2H解解2质质2O,,1错错1 误误;。CO2
C2H5O
H2O
易错警示
1.溶液中的离子不是它自身电离产生的,不属于电解质,如CO2、SO2、 NH3、SO3等为非电解质。它们与水反应生成的产物H2CO3、H2SO3、 NH3·H2O、H2SO4自身能电离,是电解质。 2.单质、混合物都不是电解质研究的范畴。
(9)NH4Cl溶液呈酸性,其原因是(用离子方程式表示,下同) NH+ 4 +H2O NH3·H2O+H+ 。
Na2S溶液呈碱性,其原因是 S2-+H2O HS-+OH-,HS-+H2O H2S+OH- 。 答案
2.完成下列教材中重要氧化还原反应的离子方程式
(1)用MnO2与浓盐酸共热制Cl2 MnO2+4H++2Cl-==△===Mn2++Cl2↑+2H2O 。 答案
第二章 化学物质及其变化
第6讲 离子反应 离子方程式
考纲要求 1.了解电解质的概念,了解强电解质和弱电解质的概念。 2.理解电解质在水溶液中的电离以及电解质溶液的导电性。 3.了解离子反应的概念、离子反应发生的条件,
能正确书写离子方程式,并能进行有关计算。
内容索引
考点一 电解质及电离 考点二 离子反应和离子方程式 微专题7 用分类思想书写跟量有关的离子方程式 考点三 离子方程式的正误判断 考能提升 探究高考 明确考向 课时作业
②常见的强碱、弱碱
强 碱 NaOH、KOH、Ca(OH)2、Ba(OH)2
③a.弱酸酸式的盐酸弱碱式酸根离N子H不3能·H拆2O开,、如MHgC(OO-3 H、)H2S、-、FHe(SOO-3H等)3;
b.强酸的酸式酸根离子(如 HSO-4 )在水溶液中写成拆分形式,如 NaHSO4 应写成 Na+、H+和 SO24-;而在熔融状态下 HSO-4 不能拆开,应写成 Na+ 和 HSO-4 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.依据元素周期表,熟记常见的强电解质和弱电解质 ⅠA:除LiOH外其余都是强碱。 ⅡA:除Mg(OH)2、Be(OH)2外其余都是强碱。 ⅢA:Al(OH)3是两性氢氧化物,即可看作弱碱,也可看作弱酸。 ⅣA:H2CO3、H2SiO3均为弱酸。 ⅤA:强酸:HNO3 ⅥA:强酸:H2SO4 中强酸:HNO2、H3PO4(也是弱酸);NH3· H2O为弱碱。 弱酸:H2SO3、H2S。
题组二
电离方程式的书写与判断
答案 解析
3.下列物质在指定条件下电离方程式正确的是
2- + A.Na2CO3 溶于水:Na2CO3===Na2 + CO 2 3
+ B.Al(OH)3 酸式电离:Al(OH)3===AlO- + H O + H 2 2
C.NaHS 溶于水 HS-的电离:HS-+H2O
电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同
D.纯净的强电解质在液态时,有的导电,有的不导电
2.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是 A 强电解质 弱电解质 非电解质 稀硫酸 CH3COOH C12H22O11 (蔗糖) B NaCl NH3 CO2 C CaCO3 H3PO4 C2H5OH D HNO3 Fe(OH)3 H2O
第二章 化学物质及其变化
第6讲 离子反应 离子方程式
考纲要求
1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.理解电解质在水溶液中的电离以及电解质溶液的导电性。
3.了解离子反应的概念、离子反应发生的条件,
能正确书写离子方程式,并能进行有关计算。
内容索引
考点一 电解质及电离
考点二 离子反应和离子方程式 微专题7 用分类思想书写跟量有关的离子方程式
H2SO4===2H++SO4- 、 ________________________ NaOH===Na++OH- 离方程式分别为 ______________________ 、
2
2- + (NH ) SO ===2NH + SO 4 2 4 4 4 _________________________ 。
(3)酸式盐的电离。多元强酸酸式盐与多元弱酸酸式盐的阴离子电离方式 不同。
2- NaHSO4===Na +H +SO4 ; 如NaHSO4溶于水中:__________________________
+ +
2- + - - + NaHCO ===Na + HCO HCO3 H +CO3 。 NaHCO3溶于水中:______________________ 3 3 ,___________________
(2) 弱电解质部分电离,用 _____ 表示。多元弱酸的电离分步书写,多元 弱碱的电离一步完成。
2- + - - + H CO H + HCO HCO H + CO 如H2CO3的电离方程式:____________________ 2 3 3 ,___________________ 3 3 。
ⅦA:强酸:HCl、HBr、HI、HClO4等 弱酸:HF、HClO等。
过渡元素中常见的弱碱: Fe(OH)3 、 Fe(OH)2 、 Cu(OH)2 、 Zn(OH)2 等, 它们也都难溶于水。 注意 盐不论难溶、易溶,绝大多数都是强电解质。
深度思考 1.正误判断,正确的打“√”,错误的打“×”
⑦⑧⑨⑪
⑧⑪ ④⑤⑩ ①⑫
(4)
(5) (6) 导电
电解质,但难溶于水
非电解质
既不是电解质,也不是非电解质,但本身能
解题探究
题组一 强、弱电解质概念的理解与判断
1.下列关于强弱电解质的叙述错误的是
答案 解析
A.弱电解质在溶液中部分电离,存在电离平衡
B.在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱
考点三 离子方程式的正误判断 考能提升 课时作业 探究高考 明确考向
考点一
电解质及电离
知识梳理
1.电解质及其分类
①电离
②强电解质
③强酸
④强碱
⑤弱电解质
⑥弱酸
⑦弱碱
⑧水溶液
⑨熔融
2.电解质的电离 自由移动 的离子的过程。 电解质在水溶液中或熔融状态下,电离成_________ (1)强电解质完全电离,用_____ === 表示。如H2SO4、NaOH、(NH4)2SO4的电
H2S+OH-
D.NaHSO4 加热熔化:NaHSO4===Na++HSO- 4
- A项应为Na2CO3===2Na++CO2 3 ;
B项应用可逆号;
C项是HS-的水解。
2- - 4.有八种离子:H+、Na+、Ba2+、Ca2+、OH-、Cl-、SO2 、 CO 4 3 。
(1) 由 两 种 离 子 相 结 合 可 形 成 的 物 质 有 16 种 , 其 中 属 于 酸 的 是
答案 解析
A项中的稀硫酸是混合物,既不是电解质,也不是非电解质,错误; B项中的NH3为非电解质,错误; D项中的H2O为弱电解质,错误。
易错警示 1.溶液中的离子不是它自身电离产生的,不属于电解质,如CO2、SO2、 NH3、SO3等为非电解质。它们与水反应生成的产物H2CO3、 H2SO3 、 NH3· H2O、H2SO4自身能电离,是电解质。 2.单质、混合物都不是电解质研究的范畴。
2. 现有 12 种物质:①Al
⑦NaCl ⑧CaCO3
②稀硝酸
③HNO3
④液氨
⑤CO2
⑥空气Biblioteka ⑨NaHCO3⑩乙醇
⑪Al2O3
⑫石墨
按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置。
序号
(1)
符合的条件
混合物
物质的序号
②⑥ ③
答案
(2)
(3)
电解质,但熔融状态下并不导电
电解质,熔融状态能导电
(1)金属能导电,所以金属是电解质( × )
(2)Cl2的水溶液能导电,所以Cl2是电解质( × )
(3)硫酸在水溶液中能完全电离,所以稀硫酸是强电解质( × )
(4)SO2、NH3的水溶液能导电,所以SO2、NH3均是电解质( × )
(5)BaSO4的水溶液的导电性很弱,故它是弱电解质( × )
(6)弱电解质溶液中存在多种共价化合物分子( √ ) (7)强电解质都是离子化合物,弱电解质都是共价化合物( × ) (8)电解质溶液之所以导电,是由于溶液中有自由移动离子存在。升温, 强电解质溶液、弱电解质溶液导电能力均增强( √ )
