硼砂缓冲液(0.05molL,pH9.3-10.1)
硼酸硼砂缓冲液的配制

硼酸硼砂缓冲液的配制
硼酸硼砂缓冲液是一种常用的实验室缓冲液,用于维持溶液的酸碱度在一定范围内。
它主要由硼酸和硼砂的混合物组成,可以在生物化学实验、分子生物学实验等多个领域中广泛使用。
硼酸硼砂缓冲液的配制方法相对简单,以下是一种常见的配制方法:
材料:
- 硼酸 (H3BO3)
- 硼砂 (Na2B4O7·10H2O)
- 蒸馏水或去离子水
步骤:
1. 准备所需材料并确保所有材料都是干净的。
2. 称取适量的硼酸和硼砂。
缓冲液的酸碱度通常由硼酸与硼砂的比例来控制,常见的比例为1:1或4:1。
3. 将硼酸和硼砂分别加入两个不同的容器中。
4. 使用蒸馏水或去离子水将硼酸和硼砂溶解,搅拌溶解直至完全溶解。
5. 将硼酸溶液和硼砂溶液混合在一起,并搅拌均匀。
6. 使用酸碱度计检测溶液的酸碱度,如果需要调整pH值,可以使用酸或碱来进行调节。
7. 最后,将缓冲液转移到一个干净的容器中,并密封保存。
需要注意的是,硼酸硼砂缓冲液的配制过程中要注意实验室安全操作,避免溅出或接触皮肤和眼睛。
此外,配制的缓冲液应尽快使用或在冷藏条件下保存,以确保其稳定性和有效性。
硼酸硼砂缓冲液的pH范围通常在7.0至9.0之间,可根据实际需要
进行调整。
它在许多实验中被用作DNA和RNA的电泳缓冲液、蛋白质分析缓冲液等,其缓冲效果稳定可靠。
总之,硼酸硼砂缓冲液的配制相对简单,但在实验中起到重要的作用。
正确配制并使用该缓冲液可有效维持溶液的酸碱度,确保实验结果的准确性和可重复性。
常用缓冲溶液的配制及PH计校正溶液配置方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L )242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )9.巴比妥钠-盐酸缓冲液(18℃)10.Tris–盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100三羟甲基氨基甲烷(Tris )HOCH2 CH2OH CHOCH2 NH2分子量=121.14;0. 1M 溶液为12.114克/升。
免疫组化,免疫检测

免疫组化,免疫检测北京华越洋生物-----------------------------------------------DMDC玻片硅化剂(2%) 100ml 免疫组化40% 室温,6个月玻片的硅化,包括盖玻片和载玻片主要由二甲二氯硅烷(DMDC)组成。
玻片硅化试剂盒(APES法) 3×100ml 免疫组化40% 4℃,6个月玻片的硅化,包括盖玻片和载玻片主要由APES、洗涤液、DEPC水组成。
玻片硅化试剂盒(APES法) 3×500ml 免疫组化40% 4℃,6个月玻片的硅化,包括盖玻片和载玻片主要由APES、洗涤液、DEPC水组成。
PBS-Triton去污剂100ml 免疫组化40% 室温,12个月去污主要由PBS、Triton-100组成。
Sorensen磷酸缓冲液(0.1mol/L,pH5.3-8.04)500ml 免疫组化40% 4℃,6个月组织化学常用缓冲液主要由磷酸二氢盐(钠/钾)和磷酸氢二盐(钠/钾)溶液组成,按不同比例混合后获得对用PH值。
pH值可选5.3,5.6,5.91,6.24,6.47,6.64,6.81,6.98,7.17,7.73,8.04。
Sorensen磷酸缓冲液(1×,pH6.2) 500ml 免疫组化40% 4℃,6个月少量细胞趋化实验主要由磷酸氢二钠、磷酸二氢钾、氯化镁、氯化钙组成,终浓度17mM。
Sorensen磷酸缓冲液(10×,pH6.2) 500ml 免疫组化40% 4℃,6个月少量细胞趋化实验主要由磷酸氢二钠、磷酸二氢钾、氯化镁、氯化钙组成,终浓度170mM。
TBS缓冲液(0.02mol/L,pH8.2) 500ml 免疫组化40% 室温,6个月免疫金银染色缓冲液主要由Tris、氯化钠组成。
TBS缓冲液(0.05mol/L,pH7.4) 500ml 免疫组化40% 室温,6个月免疫金银染色缓冲液主要由Tris、氯化钠、叠氮钠、BSA组成。
常用缓冲溶液配制方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)甘氨酸分子量=75.07,0.2mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05mol/L)邻苯二甲酸氢钾分子量=204.23,0.2mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量=14.98,0.2mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量=178.05,0.2mol/L溶液含35.01克/升。
C4H2O7·H2O分子量=210.14,0.1mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①????使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50%?氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1mol/L )柠檬酸C 6H 8O 7·H 2O :分子量210.14,0.1mol/L 溶液为21.01克/升。
柠檬酸钠Na 3 C 6H 5O 7·2H2O :分子量294.12,0.1mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2mol/L ) Na 2Ac·3H 2O 分子量=136.09,0.2mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na 2HPO 4·2H 2O 分子量=178.05,0.2mol/L 溶液为85.61克/升。
Na 2HPO 4·12H 2O 分子量=358.14,0.2mol/L 溶液为71.628克/升。
NaH 2PO 4·2H 2O 分子量=156.01,0.2mol/L 溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH 2PO 4:pKa1=2.12,pKa2=7.21;Na 2HPO 4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH 2PO 4,pH =1~4, 配中性缓冲液:用混合的两种磷酸盐,pH =6~8, 配碱性缓冲液:用Na 2HPO 4,pH =10~12。
常用缓冲溶液配制方法
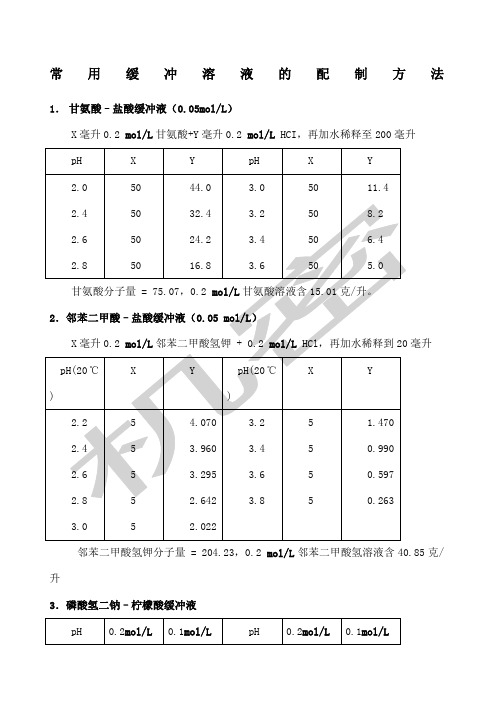
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na 2HPO 4分子量 = 14.98,0.2 mol/L 溶液为28.40克/升。
Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液含35.01克/升。
C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液氢氧柠檬酸C 6H 8O 7·H 2O :分子量210.14,0.1 mol/L 溶液为21.01克/升。
毫升。
Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)NaH 2PO 4·2H 2O 分子量 = 156.01,0.2 mol/L 溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH 2PO 4: pKa1=2.12,pKa2=7.21; Na 2HPO 4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH 2PO 4,pH =1~4,配中性缓冲液:用混合的两种磷酸盐,pH =6~8,配碱性缓冲液:用Na2HPO4,pH=10~12。
用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS(十二烷基硫酸钠)会与钾盐生成难溶的十二烷基硫酸钾。
磷酸盐缓冲液的优点为:①容易配制成各种浓度的缓冲液;②适用的pH 范围宽;③pH 受温度的影响小;④缓冲液稀释后pH 变化小,如稀释10倍后pH 的变化小于9.巴比妥钠-盐酸缓冲液(18℃)三羟甲基氨基甲烷(Tris )HOCH2 CH2OH CHOCH2 NH2分子量=121.14;0. 1M 溶液为12.114克/升。
常用缓冲液配方

常见缓冲液的缓冲范围缓冲液名称及常用浓度缓冲pH范围主要物质分子量MES (2吗啉代乙磺酸) 5.5-6.7 195.2Bis-Tris 5.8-7.2 209.2HEPES 6.8-8.2 238.3PIPES 6.1-7.5 302.4MOPS 6.5-7.9 209.3Tricine 7.4-8.8 179.2TEA (三乙醇胺) 7.4-8.3 149.2甘氨酸-盐酸缓冲液(0.05mol/L) 2.2-5.0 甘氨酸Mr=75.07邻苯二甲酸-盐酸缓冲液(0.05mol/L)2.2-3.8 邻苯二甲酸氢钾Mr=204.23 磷酸氢二钠-柠檬酸缓冲液 2.2-8.0 磷酸氢二钠Mr=141.98柠檬酸-氢氧化钠-盐酸缓冲液 2.2-6.5 柠檬酸Mr=192.06柠檬酸-柠檬酸钠缓冲液(0.1mol/L)3.0-6.6 柠檬酸Mr=192.06 柠檬酸钠Mr=257.96 乙酸-乙酸钠缓冲液(0.2mol/L) 3.6-5.8 乙酸钠Mr=81.76 乙酸Mr=60.05 邻苯二甲酸氢钾-氢氧化钠缓冲液 4.1-5.9 氢钾Mr=204.23磷酸氢二钠-磷酸二氢钠缓冲液(0.2mol/L) 5.8-8.0磷酸氢二钠-磷酸二氢钾缓冲液(1/15 molL) 4.92-8.18磷酸二氢钾-氢氧化钠缓冲液(0.05mol/L) 5.8-8.0巴比妥钠-盐酸缓冲液(18℃) 6.8-9.6 巴比妥钠Mr=206.18 Tris-盐酸缓冲液(0.05mol/L 25℃) 7.10-9.00 三羟甲基氨基甲烷(Tris)Mr=121.14 甘氨酸-氢氧化钠缓冲液(0.05mol/L) 8.6-10.6 甘氨酸Mr=75.07硼砂-氢氧化钠缓冲液(0.05mol/L) 9.3-10.1 硼砂Na2B4O7?10H2O Mr=381.43 碳酸钠-碳酸氢钠缓冲液(0.1mol/L) 9.16-10.83 碳酸钠Mr=286.2 碳酸氢钠Mr=84.0 碳酸钠-氢氧化钠缓冲液(0.025mol/L) 9.6-11.0磷酸氢二钠-氢氧化钠缓冲液10.9-12.0氯化钾-盐酸缓冲液(0.2mol/L) 1.0-2.2 氯化钾Mr=74.55氯化钾-氢氧化钠缓冲液(0.2mol/L)12.0-13.0 氯化钾Mr=74.55参考下图:常见缓冲液的缓冲范围参考下图:常见缓冲液的缓冲范围常用缓冲液的配制方法1.甘氨酸-盐酸缓冲液(0.05M)X ml 0.2M甘氨酸+Y ml 0.2M盐酸再加水稀释至200mlpH X/ml Y/ml pH X/ml Y/ml2.2 50 44.03.0 50 11.42.4 50 32.43.2 50 8.22.6 50 24.23.4 50 6.42.8 50 16.83.6 50 5.0甘氨酸分子量=75.07 0.2M甘氨酸溶液含15.01g/L2.邻苯二甲酸-盐酸缓冲液(0.05M)X ml 0.2M邻苯二甲酸氢钾+Y ml 0.2M盐酸再加水稀释至200mlpH X Y pH X Y2.2 5 4.6703.2 5 1.4702.4 53.960 3.4 5 0.9902.6 53.295 3.6 5 0.5972.8 5 2.6423.8 5 0.2633.0 5 2.032邻苯二甲酸氢钾分子量=2.4.23 0.2M邻苯二甲酸氢钾溶液含40.85g/L3.磷酸氢二钠-柠檬酸缓冲液pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml 2.2 0.40 19.6 5.2 10.72 9.282.4 1.24 18.76 5.4 11.15 8.852.6 2.18 17.82 5.6 11.60 8.402.83.17 16.83 5.8 12.09 7.913.04.11 15.896.0 12.637.373.24.94 15.066.2 13.22 6.783.4 5.70 14.30 6.4 13.85 6.153.6 6.44 13.56 6.6 14.555.453.8 7.10 12.90 6.8 15.454.554.0 7.71 12.29 7.0 16.47 3.534.2 8.28 11.72 7.2 17.39 2.614.4 8.82 11.18 7.4 18.17 1.834.6 9.35 10.65 7.6 18.73 1.274.8 9.86 10.14 7.8 19.15 0.855.0 10.30 9.70 8.0 19.45 0.55Na2HPO4分子量=141.98 0.2M溶液含28.40g/LNa2HPO4·2H2O分子量=178.05 0.2M溶液含35.61g/LC6H8O7·H2O分子量=210.14 0.1M溶液含21.01g/L4.柠檬酸-氢氧化钠-盐酸缓冲液pH 钠离子浓度/M 柠檬酸C6H8O7·H2O/g 氢氧化钠NaOH/g 浓盐酸HCl/ml 终体积/L2.2 0.20 210 84 160 103.1 0.20 210 83 116 103.3 0.20 210 83 106 104.3 0.20 210 83 45 105.3 0.35 245 144 68 105.8 0.45 285 186 105 106.5 0.38 266 156 126 10使用时可以每升中加入1g酚,若最后pH有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
常用缓冲溶液的配置方法
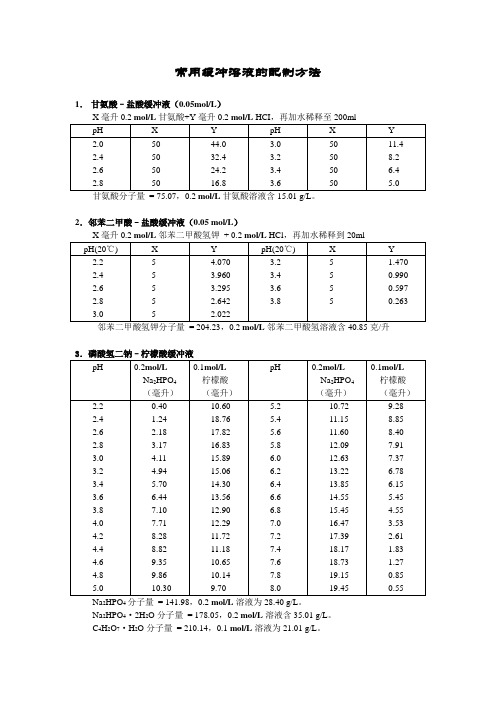
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01 g/L。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01 g/L。
① 使用时可以每升中加入1g 酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
6872柠檬酸钠Na 3 C 6H 5O7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41 g/L 。
227.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2 mol/L )Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量= 156.03,0.2 mol/L溶液为31.21克/升。
Na2HPO4·2H2O分子量= 178.05,1/15M溶液为11.876克/升。
KH2PO4分子量= 136.09,1/15M溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05 mol/L)巴比妥钠盐分子量=206.18;0.04M 溶液为8.25克/升10.Tris –盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100吸收二氧化碳,使用时注意将瓶盖严。
11.硼酸–硼砂缓冲液(0.2M 硼酸根)硼砂Na 2B 4O 7·H 2O,分子量=381.43;0.05M 溶液(=0.2M 硼酸根)含19.07克/升。
常用缓冲液

常用缓冲溶液配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)3.磷酸氢二钠–柠檬酸缓冲液24242178.05,0.2 mol/L 溶液含35.01克/升。
C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液氧化钠溶液或浓盐酸调节,冰箱保存。
②5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3C6H5O7·2H2O:分子量294.12,0.1mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L)227.磷酸盐缓冲液242242分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液24224136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )9.巴比妥钠-盐酸缓冲液(18℃)巴比妥钠盐分子量=206.18;0.04M 溶液为8.25克/升 10.Tris –盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100毫升。
HOCH2 NH2 分子量=121.14; 0. 1M 溶液为12.114克/升。
Tris 溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
11.硼酸–硼砂缓冲液(0.2M 硼酸根)2472硼酸H 2BO 3,分子量=61.84,0.2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
11.硼酸-硼砂缓冲液(0.2M 硼酸根)2472硼酸H2BO3,分子量=61.84, 0.2M溶液为12.37克/升。
常用缓冲溶液配制方法
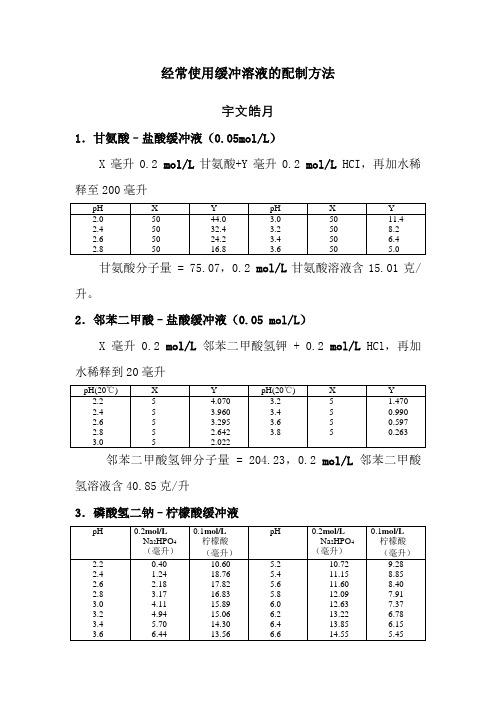
经常使用缓冲溶液的配制方法宇文皓月1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变更,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保管。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L)Na2Ac·3H2O分子量 = 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量 = 358.14,0.2 mol/L溶液为71.628克/升。
NaH2PO4·2H2O分子量 = 156.01,0.2 mol/L溶液为31.202克/升。
硼酸——硼砂缓冲溶液ph值的计算

硼酸——硼砂缓冲溶液ph值的计算
硼酸是一种常用的缓冲剂,可以用来调节溶液的pH值。
在制备硼酸-硼砂缓冲溶液时,需要根据所需的pH值计算出硼酸和硼砂的摩尔浓度比例。
1. 计算所需的硼酸和硼砂的摩尔浓度比例
首先需要确定所需的pH值,然后根据硼酸和硼砂的pKa值计算出它们在溶液中的摩尔比例。
硼酸的pKa值为9.24,硼砂的pKa值为7.5。
在pH等于pKa值的情况下,硼酸和硼砂的比例为1:1。
如果需要制备pH为9的缓冲溶液,那么硼酸和硼砂的摩尔比例为:
[硼酸]/[硼砂] = 10^(pH-pKa) = 10^(9-9.24) = 0.36 也就是说,需要将硼酸和硼砂混合,在摩尔浓度比例为0.36:1的情况下制备缓冲溶液。
2. 计算硼酸和硼砂的浓度
根据摩尔比例,可以计算出硼酸和硼砂的浓度。
假设需要制备1升pH为9的缓冲溶液,那么硼酸的摩尔浓度为:
[硼酸] = 0.36 / (1 + 0.36) * C = 0.22C
其中C为溶液的总浓度,假设为1M,那么硼酸的浓度为0.22M。
同样地,硼砂的浓度为:
[硼砂] = 1 / (1 + 0.36) * C = 0.78C
假设C为1M,硼砂的浓度为0.78M。
3. 计算缓冲溶液的pH值
将硼酸和硼砂按照上述摩尔比例混合后,可以制备pH为9的缓冲溶液。
但实际制备时,由于硼酸和硼砂的pKa值与温度、离子强度等因素有关,需要进行实验验证。
可以通过酸碱滴定或pH计等方法测定缓冲溶液的pH值,进行调整和校准。
注:本文中的计算方法只是一种基本的理论计算方法,实际制备时需要根据具体情况进行调整和优化。
【资料】常用pH缓冲液缓冲液缓冲范围
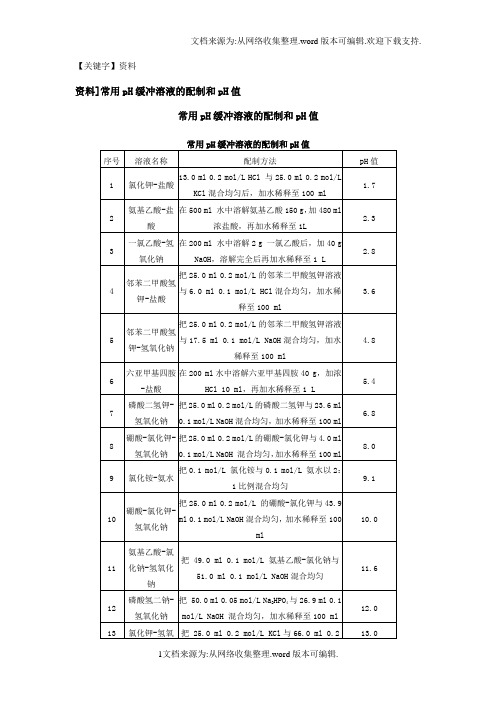
【关键字】资料资料]常用pH缓冲溶液的配制和pH值常用pH缓冲溶液的配制和pH值一、常用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
(三)0.15Mol/L PB液Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。
Na2HPO4·12H2O分子量=358.22 0.15Mol/L溶液含53.7g/L。
NaH2PO4·H2O分子量=138.00 0.15Mol/L溶液含20.7g/L。
NaH2PO4·2H2O分子量=156.03 0.15Mol/L溶液含23.4g/L。
常用缓冲溶液的配制方法

常用缓冲液的配制当缓冲液被稀释或浓缩时,pH也应不变。
其pH值应近似恒定不变,或当其中的离解的阳离子(K+、Na+)或阴离子(Cl-、Br-)被其它种类的离子替换时。
表1—4中给出了响应的配制方法,平衡阳离子为Na+,缓冲液的最终浓度为0.1mol/l,对于其它浓度的缓冲溶液或阳离子种类(通常K+)更好,表中的数据也可供参考。
较稀的或较浓的缓冲溶液,及包含有不同阳离子的溶液,其pH值会与表中的数据稍有出入。
在方法建立过程中,精确的流动相pH值往往并不重要,重要的是每次新配制的流动相的pH值与第一次基本相同(最好控制在±0.02范围内)。
注意,只有当缓冲溶液的pH在缓冲试剂解离常数pKIa±1范围内时,缓冲溶液才具有有效的缓冲容量(如乙酸盐的pKa=4.6,其适宜的pH范围为3.6—5.6)。
表1 低pH值(25℃)磷酸盐缓冲溶液的配制方法溶液A1:0.1M磷酸。
配制精确pH值缓冲液时,所用磷酸需滴定H3PO4的含量。
溶液A2:0.1M磷酸二氢钠溶液,称量13.8g NaH2PO4•H2O溶解于水中,定容于1L容量瓶中。
pH A1体积(ml)A2体积(ml)pH A1体积(ml)A2体积(ml)2.0 565 435 2.8 175 8252.2 455 5453.0 110 8902.4 345 6553.2 55 9452.6 250 750表2 不同pH值(25℃)醋酸缓冲溶液的配制方法溶液A1:0.1M醋酸溶液。
6.0g(5.8ml)冰醋酸溶于水中,定容到1L容量瓶中。
溶液A2:0.1M醋酸钠溶液。
8.2g C2H3O2Na(或13.6g C2H3O2Na•3H2O)溶解于水中定容到1L容量瓶中。
pH A1体积(ml)A2体积(ml)pH A1体积(ml)A2体积(ml)3.6 926 744.8 400 6003.8 880 120 5.0 296 7044.0 820 1805.2 210 7904.2 736 2645.4 176 8244.4 610 3905.6 96 9044.6 510 490表3 不同pH值(25℃)柠檬酸缓冲溶液的配制方法溶液A1:0.1M柠檬酸溶液。
标准缓冲液pH值与温度对照表
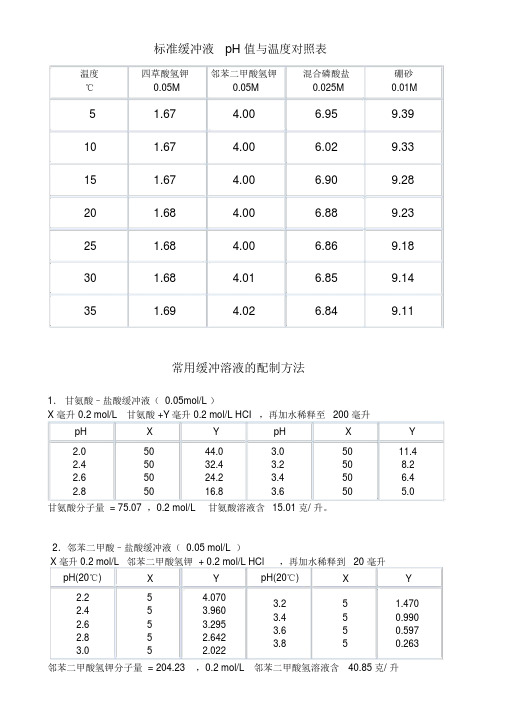
标准缓冲液pH 值与温度对照表温度四草酸氢钾邻苯二甲酸氢钾混合磷酸盐硼砂℃0.05M0.05M0.025M0.01M5 1.67 4.00 6.959.3910 1.67 4.00 6.029.3315 1.67 4.00 6.909.2820 1.68 4.00 6.889.2325 1.68 4.00 6.869.1830 1.68 4.01 6.859.1435 1.69 4.02 6.849.11常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液( 0.05mol/L )X 毫升 0.2 mol/L甘氨酸 +Y毫升 0.2 mol/L HCI,再加水稀释至200 毫升pH X Y pH X Y2.05044.03.05011.42.45032.43.2508.22.65024.23.450 6.42.85016.83.650 5.0甘氨酸分子量 = 75.07 ,0.2 mol/L甘氨酸溶液含15.01 克/ 升。
2.邻苯二甲酸–盐酸缓冲液( 0.05 mol/L )X 毫升 0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20 毫升pH(20℃)X Y pH(20℃)X Y2.25 4.0703.25 1.4702.453.9603.450.9902.653.2953.650.5972.85 2.6423.850.2633.05 2.022邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85 克/ 升3.磷酸氢二钠–柠檬酸缓冲液0.2mol/L0.1mol/L0.2mol/L0.1mol/LpH Na2HPO4柠檬酸pH Na2HPO4柠檬酸(ml)(ml)(ml)(ml)2.20.4010.60 5.210.729.282.4 1.2418.76 5.411.158.852.6 2.1817.82 5.611.608.402.83.1716.83 5.812.097.913.04.1115.896.012.637.373.24.9415.066.213.22 6.783.4 5.7014.30 6.413.85 6.153.6 6.4413.56 6.614.555.453.87.1012.90 6.815.454.554.07.7112.297.016.47 3.534.28.2811.727.217.39 2.614.48.8211.187.418.17 1.834.69.3510.657.618.73 1.274.89.8610.147.819.150.855.010.309.708.019.450.55 Na2HPO4分子量 = 142.98,0.2 mol/L溶液为 28.40克/ 升。
2020年常用缓冲溶液常用浓度及pH范围
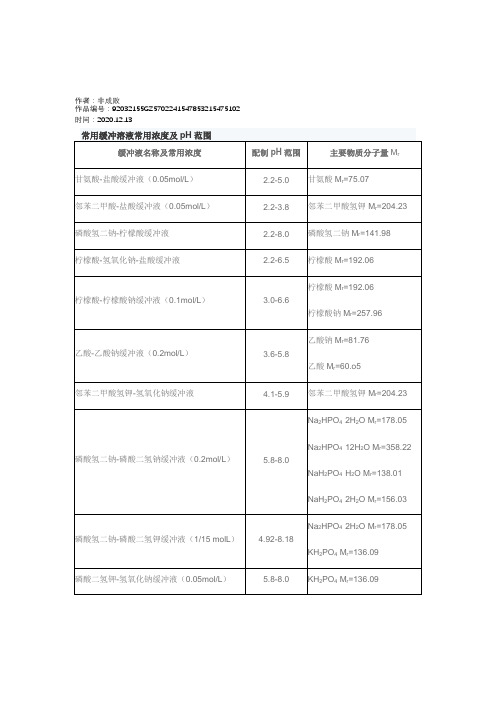
碳酸钠Mr=286.2
碳酸氢钠Mr=84.0
碳酸钠-氢氧化钠缓冲液(0.025mol/L)
9.6-11.0
磷酸氢二钠-氢氧化钠缓冲液
10.9-12.0
Na2HPO4·2H2O Mr=178.05
Na2HPO4·12H2O Mr=358.22
氯化钾-盐酸缓冲液(0.2mol/L)
1.0-2.2
硼砂Na2B4O7·10H2O Mr=381.4
H3BO3Mr=61.84
甘氨酸-氢氧化钠缓冲液(0.05mol/L)
8.6-10.6
甘氨酸Mr=75.07
硼砂-氢氧化钠缓冲液(0.05mol/L)
9.3-10.1
硼砂Na2B4O7·10H2O Mr=381.43
碳酸钠-碳酸氢钠缓冲液(0.1mol/L)
氯化钾Mr=74.55
氯化钾-氢氧化钠缓冲液(0.2mol/L)
12.0-13.0
氯化钾Mr=74.55
作者:非成败
作品编号:92032155GZ5702241547853215475102
时间:2020.12.13
NaH2PO4·2H2O Mr=156.03
磷酸氢二钠-磷酸二氢钾缓冲液(1/15 molL)
4.92-8.18
Na2HPO4·2H2O Mr=178.05
KH2PO4Mr=136.09
磷酸二氢钾-氢氧化钠缓冲液(0.05mol/L)
5.8-8.0
KH2PO4Mr=136.09
巴比妥钠-盐酸缓冲液(18℃)
作者:非成败
作品编号:92032155GZ5702241547853215475102
时间:2020.12.13
常用缓冲溶液常用浓度及pH范围
硼砂ph溶液标准物质

硼砂ph溶液标准物质
硼砂pH曛是一种常用的标准溶液,主要用来测定pH值以及电导率、吸收谱和蒸发残留物。
它也可用来做与温度和样品有关的应用,如温度补偿和稳定性验证。
硼砂pH溶液可以用来校正PH计,以确保它能准确、可靠地测定溶液的pH值。
硼砂标准物质经常用于水处理厂及化学实验室中的pH测定,这是因为它具有非常精确的稳定性和可靠性,可以为pH测定提供准确的、最大的可靠性。
硼砂可以很好地稳定溶液的pH值,其结果也可以更加准确,于是,任何使用pH测定的溶液都可使用硼砂。
硼砂标准物质是一种无机化合物,其主要成分是硼和氢氧化铵,加入水后可以分解成硼酸和硼离子,构成一种硼砂溶液。
硼砂溶液的pH大约在9.2-9.3之间,是一种中性溶液,且其溶液中的硼离子含量很高,在室温下具有优异的稳定性,可以持续多小时,只要控制温度和电导率。
由于它具有良好的稳定性、优异的可靠性和易于使用,因此,硼砂标准溶液是pH测定过程中使用最普遍的溶液。
硼砂标准物质溶液的标定过程是非常复杂的,首先要选择符合要求的原料,以及用于标定的溶液。
然后,根据实验设计的要求,使用精密的仪器和设备,对硼砂标准物质溶液进行标定,可以检测出pH 值,同时对物质进行比较,以评估其稳定性和准确度。
最后,记录标定结果,并将它们进行比较,以确定最终的硼砂标准溶液物质的标准值。
总之,硼砂pH溶液标准物质是一种重要的标准溶液,能够为PH
测定提供准确的、可靠的参考值。
如果想要准确测定pH值,那么就必须使用硼砂标准物质。
通过严格的检验和正确的操作,可以确保标准物质的准确性和稳定性,为技术发展和新产品的评估提供准确的基准。
硼砂溶液配置实验报告(3篇)

第1篇一、实验目的1. 掌握硼砂溶液的配置方法。
2. 熟悉容量瓶、移液管等实验仪器的使用。
3. 了解不同浓度硼砂溶液的配制原理。
二、实验原理硼砂(Na2B4O7·10H2O)是一种重要的无机化工原料,广泛应用于玻璃、陶瓷、洗涤剂、医药等领域。
硼砂溶液的浓度对其应用效果有直接影响,因此,准确配制不同浓度的硼砂溶液至关重要。
硼砂溶液的浓度是指在一定体积的溶液中所含硼砂的物质的量。
其计算公式如下:c = n / V其中,c为溶液浓度(mol/L),n为溶质的物质的量(mol),V为溶液体积(L)。
三、实验用品1. 仪器:100mL容量瓶、移液管、烧杯、玻璃棒、胶头滴管、天平、药匙、滤纸。
2. 药品:硼砂(Na2B4O7·10H2O)。
四、实验步骤1. 称取一定质量的硼砂。
以配置0.1mol/L的硼砂溶液为例,称取1.8645g硼砂(准确至0.0001g)。
2. 将称取的硼砂放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌至完全溶解。
3. 将溶解后的硼砂溶液转移到100mL容量瓶中,用蒸馏水冲洗烧杯和玻璃棒,将冲洗液转移到容量瓶中。
4. 向容量瓶中加入蒸馏水至刻度线,用胶头滴管滴加至凹液面与刻度线相切。
5. 塞紧瓶塞,倒转容量瓶几次,使溶液混合均匀。
6. 配制其他浓度的硼砂溶液时,根据所需浓度和硼砂的摩尔质量,计算所需硼砂的质量,重复以上步骤。
五、实验结果与分析1. 配制0.1mol/L的硼砂溶液,所需硼砂的质量为1.8645g。
2. 配制0.5mol/L的硼砂溶液,所需硼砂的质量为9.32125g。
3. 配制1.0mol/L的硼砂溶液,所需硼砂的质量为18.6425g。
通过以上实验步骤,成功配制了不同浓度的硼砂溶液。
六、实验讨论1. 在配置硼砂溶液时,应注意准确称取硼砂,以保证溶液的浓度准确。
2. 配制过程中,应避免溶液溅出,以免影响浓度。
3. 容量瓶在使用前应检查是否完好,确保配制出的溶液体积准确。
硼砂缓冲液(0.05molL,pH9.3-10.1)

北京雷根生物技术有限公司
硼砂缓冲液(0.05mol/L,pH9.3-10.1)
简介:
平衡盐溶液(Balanced Salt Solution ,BSS)与细胞生长状态下的pH 值、渗透压等环境状态一致,具有维持渗透压、控制酸碱平衡、供给细胞生存代谢所必需的能量和无机盐成分等作用,可满足体外实验中细胞生存并维持一定的代谢的基本需要。
硼砂缓冲液(0.05mol/L,pH9.3-10.1)由硼砂(又称四硼酸钠)、氢氧化钠组成,硼酸根浓度为0.05M ,客户根据可选pH9.3~10.1。
组成:
操作步骤(仅供参考):
1、 按实验具体要求操作。
2、 注意密闭保存,避免挥发。
3、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
编号 名称 IH0208 Storage 硼砂缓冲液(0.05mol/L,pH9.3-10.1) 500ml RT 使用说明书 1份。
硼砂缓冲液配制

硼砂缓冲液配制硼砂缓冲液是一种常用的化学试剂,主要用于调节溶液的酸碱度。
它由硼砂和相应的酸碱盐组成,能够在一定范围内稳定溶液的pH 值,使溶液呈现缓冲效应。
在科学研究、医药生产和实验室应用中,硼砂缓冲液被广泛使用。
硼砂,化学式为Na2B4O7·10H2O,是一种无机盐,常见的天然矿石。
它具有无色结晶体,可溶于水,呈碱性。
硼砂具有很强的缓冲能力,可以稳定溶液的pH值,因此常用于制备缓冲液。
硼砂缓冲液的配制方法多种多样,根据具体需要和实验要求,可以选择不同的配方。
常见的配方包括醋酸钠-醋酸缓冲液、磷酸盐缓冲液、碳酸氢钠-碳酸钠缓冲液等。
这些配方中硼砂作为缓冲剂的作用是调节溶液的pH值,使其在一定范围内保持稳定。
硼砂缓冲液的配制步骤相对简单。
首先,按照所需的浓度和体积计算出硼砂和相应酸碱盐的用量。
然后,将硼砂和酸碱盐分别加入适量的蒸馏水中,充分溶解。
最后,将两个溶液混合并稳定搅拌,直至完全均匀。
硼砂缓冲液的应用范围广泛。
在生物化学和分子生物学实验中,硼砂缓冲液常用于DNA电泳分析,能够稳定DNA的结构和电荷,使其在电场中迁移更加均匀。
在药学和医学领域,硼砂缓冲液可用于制备药物的缓释系统,控制药物的释放速率。
此外,硼砂缓冲液还可以用于酶反应、细胞培养等实验中,保持溶液的稳定性和恒定的酸碱环境。
然而,值得注意的是,硼砂缓冲液也有其局限性。
首先,硼砂缓冲液的pH范围相对较窄,一般在5-9之间。
如果实验需要在其他pH条件下进行,就需要选择其他缓冲液。
其次,硼砂缓冲液在高温条件下会分解,失去缓冲能力。
因此,在高温实验中需要谨慎使用硼砂缓冲液。
硼砂缓冲液是一种常用的化学试剂,具有调节溶液酸碱度的作用。
它的配制方法简单,应用范围广泛,常用于科学研究、医药生产和实验室应用中。
然而,使用硼砂缓冲液时需要注意其pH范围和温度限制,选择适当的缓冲液以满足实验需求。
硼砂缓冲液配制

硼砂缓冲液配制硼砂缓冲液是一种常用的化学试剂,用于调节溶液的酸碱度。
它由硼砂和适量的酸碱盐组成,能够在一定范围内稳定溶液的pH值,起到缓冲作用。
本文将详细介绍硼砂缓冲液的配制方法、应用领域和优势。
一、硼砂缓冲液的配制方法硼砂缓冲液的配制相对简单,一般遵循以下步骤:1. 准备所需材料:硼砂、酸碱盐(如柠檬酸、硼酸)、去离子水和称量瓶、容量瓶等实验器材。
2. 根据所需的pH值范围选择合适的酸碱盐和硼砂的摩尔浓度。
一般情况下,硼砂的浓度为0.1M,酸碱盐的浓度根据具体需求而定。
3. 使用称量瓶准确称量硼砂和酸碱盐的质量。
4. 将称量好的硼砂和酸碱盐分别溶解在去离子水中,搅拌均匀。
5. 将溶解好的硼砂和酸碱盐混合,继续搅拌至溶液均匀。
6. 将混合好的溶液转移到容量瓶中,加入适量的去离子水,使溶液体积达到容量瓶刻度线处。
7. 用瓶塞密封容量瓶,轻轻摇晃使溶液充分混合。
二、硼砂缓冲液的应用领域硼砂缓冲液在生物化学、分子生物学和生物医学等领域都有广泛的应用。
具体应用包括:1. 实验室中常用于调节酶反应体系的pH值,使其保持在特定的范围内,以确保酶的最佳活性。
2. 在细胞培养和组织工程等生物学实验中,可用作细胞培养液的缓冲剂,维持细胞生长环境的稳定。
3. 在基因工程领域,硼砂缓冲液常用于DNA电泳实验中,用于稳定DNA溶液的pH值,以保证电泳结果的准确性。
4. 在医学领域,硼砂缓冲液可以用于制备药物、疫苗和生物诊断试剂,保证其在制备和储存过程中的稳定性。
三、硼砂缓冲液的优势硼砂缓冲液相比其他缓冲液具有以下优势:1. 稳定性好:硼砂缓冲液能够在一定范围内稳定溶液的pH值,不易受外界因素影响。
2. pH范围广:硼砂缓冲液的pH值范围一般在4-9之间,可以满足大部分实验的需求。
3. 成本低廉:硼砂是一种常见的化学试剂,价格相对较低,制备成本不高。
4. 操作简便:硼砂缓冲液的配制方法简单,不需要复杂的设备和操作技巧,适用于实验室和教学实验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京雷根生物技术有限公司
硼砂缓冲液(0.05mol/L,pH9.3-10.1)
简介:
平衡盐溶液(Balanced Salt Solution ,BSS)与细胞生长状态下的pH 值、渗透压等环境状态一致,具有维持渗透压、控制酸碱平衡、供给细胞生存代谢所必需的能量和无机盐成分等作用,可满足体外实验中细胞生存并维持一定的代谢的基本需要。
硼砂缓冲液(0.05mol/L,pH9.3-10.1)由硼砂(又称四硼酸钠)、氢氧化钠组成,硼酸根浓度为0.05M ,客户根据可选pH9.3~10.1。
组成:
操作步骤(仅供参考):
1、 按实验具体要求操作。
2、 注意密闭保存,避免挥发。
3、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
编号 名称 IH0208 Storage 硼砂缓冲液(0.05mol/L,pH9.3-10.1) 500ml RT 使用说明书 1份。
