第一章 有机化合物的结构和性质
人教版高中化学选择性必修第3册 第一章 有机化合物的结构特点与研究方法 第一节 有机化合物的结构特点

③
④
⑤
⑥
⑦ ⑧
请填写下列空白(填编号):
(1)属于脂肪烃的有
。
(2)属于芳香烃的有
。
(3)属于醇类的有
。
(4)属于酚类的有
。
(5)属于羧酸类的有
。
(6)属于酯类的有
。
思路点拨 解答本题首先应明确有机化合物分类的标准,然后根据题目所给有机化合物的组 成和结构进行分类。 解析 ①、③、⑧中只含有C、H两种元素,属于烃类,⑧中含有苯环,属于芳香烃, ①和③属于脂肪烃;④中的羟基连在苯环之外的碳原子上,⑤中含有羟基,属于醇类; ⑥中的羟基直接连在苯环的碳原子上,属于酚类;②和④中含有羧基,属于羧酸;⑦中 含有酯基,属于酯。
(3)立体异构的类型: 顺反异构 、 对映异构 。
判断正误,正确的画“ √” ,错误的画“ ✕” 。
1.
属于芳香族化合物 ( ✕ )
2.
和
于同类物质 ( ✕ )
所含官能团相同,属
3.
中碳原子与氧原子之间是极
性键,在化学反应中容易断裂 ( √ ) 4.所有的有机物都含有官能团,芳香烃的官能团是苯环 ( ✕ ) 提示:不是所有有机物都含有官能团,烷烃没有官能团;苯环不看作官能团。
A.8种 B.9种 C.10种 D.12种
思路点拨 解答本题首先应明确题目有哪些限定条件,分析可以根据限定条件确定什么,再针 对已知结构中的可变因素书写各种符合要求的同分异构体。
解析 有机物C4H9ClO的分子中含有羟基,可以看成1个氯原子取代丁醇中1个氢原 子形成的,丁醇的结构有:CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3、(CH3)3COH、 (CH3)2CHCH2OH 4种。不考虑羟基与氯原子连在同一个碳原子上的情况时:CH3CH 2CH2CH2OH的一氯代物有3种;CH3CH2CH(OH)CH3的一氯代物有3种;(CH3)2CHCH2 OH的一氯代物有2种;(CH3)3COH的一氯代物有1种。
2023版新教材高中化学第一章有机化合物的结构特点与研究方法第一节有机化合物的结构特点第1课时有机

第1课时有机化合物的分类方法有机化合物中的共价键必备知识基础练进阶训练第一层1.三星堆遗址被称为20世纪人类最伟大的考古发现之一,被誉为“长江文明之源”,其中出土的文物是我国古代巴蜀文化的宝贵遗产,反映了当时人们在生活中使用的材料。
下列古代巴蜀地区所使用的各种物品中,其主要成分属于有机物的是( )A.丝绸B.玉器C.陶器D.青铜器2.按碳的骨架对有机化合物进行分类,下列说法正确的是( )3.按碳骨架进行分类,下列关于各有机物的说法中正确的是( )①CH3CH2Cl ②③(CH3)2C===CH2④⑤A.链状烃:①③⑤B.链状烃:①③C.环状烃:②④⑤D.芳香烃:②④4.现代家居装修材料中,普遍存在着甲醛、苯及苯的同系物等有毒物质,如果不注意处理就会对人体产生极大的危害。
按照有机物的分类,甲醛属于醛。
下列各项对有机物的分类方法与此方法相同的是( )①属于环状化合物;②属于链状化合物;④CH3CH2—O—CH2CH3属于醚A.②④B.①②C.②③D.①④5.下列物质的类别与所含官能团都正确的是( )A.酚羟基B.CH3COCH3醚醚键C.醛醛基D.酮酮羰基6.青蒿素是从中药黄花蒿中提取的一种抗疟疾的有效成分,具有抗白血病和免疫调节功能,其结构简式如图所示,青蒿素分子中的官能团为(—O—O—为过氧键)( )A.羧基、醚键B.甲基、羧基C.甲基、酯基D.酯基、醚键7.下列属于官能团的是( )A.—OH B.OH-C.NO2D.—CH38.下列各选项中物质的分子式都相同,其中属于同一类物质的是( )A.B.CH3OCH3和CH3CH2OHC.正戊烷和新戊烷D.9.兴奋剂在英语中称“Dope”,原义为“供赛马使用的一种鸦片麻醉混合剂”。
有的运动员为提高比赛成绩而违规服用的药物大多属于兴奋剂药物刺激剂类。
某种兴奋剂的结构如图:关于该兴奋剂的说法不正确的是( )A.它的分子式为C20H24O3B.从结构上看,它属于酚类C.从结构上看,它属于醇类D.从元素组成上看,它可以在氧气中燃烧生成CO2和水[答题区]10.请根据官能团的不同对下列有机化合物进行分类:(1)芳香烃:________________。
有机化学知识的基本概念第一节有机化合物的组成和结构
强极性键:如C—O、O—H、C—X等键,一般性质活泼, 较易断裂而发生化学反应。
三、结构与性质的关系:
1、结构与物理性质: (1)熔、沸点:分子量越大;分子中支链越少;分子极
性越大的熔沸点越高。 (2)、溶—解C性H:O只等有官分能子团中的含低有级—化O合H物、可—溶N于H2水、。—其CO余O的H
反应基团:C=C、C=O、C≡C、苯环上的键等
C=O + H—H → H—C—O—H (加氢)
C=C + H—CN → H—C—C—CN (加氢氰酸)
C=C + H—X → H—C—C—X (加卤化氢) C=C + H—OH → H—C—C—OH (加水)
加成反应的规律
. 1mol双键需1molH2 ; 1mol叁键需2molH2 .加成反应发生后,碳链结构不变,一般碳原子数目不 变,但加氢氰酸(HCN)后,碳原子数增加一个。
单体分子中一般应含有至少两个可以发
缩
生缩合反应的官能团
聚 特 反应通常发生在官能团上
反 点 高分子链中一般要通过氧、氮等原子相
·能发生银镜反应的物质有:醛、甲酸、甲酸酯、甲酸盐
有机物燃烧的规律: ⑴ N→有N机2、物X燃→烧H时X,各元素的最终产物:C→CO2、H→H2O、 ⑵烃和烃的含氧衍生物完全燃烧后,产物均为CO2和H2O ⑶烃的含氧衍生物燃烧的耗氧量可转化为烃燃烧的耗氧量
⑷1molC消耗1molO2,4molH消耗1molO2 ⑸ Cn符H2合nO通z的式有C机nH物2nO完z全的燃有烧机,物其完产全物燃C烧O规2和律H:2O(符g)合的通体式积相等。 ⑹100℃以上,有机物完全燃烧前后气体体积不变化的规律。
有机化学-第一章-有机化合物的结构和性质

1、离子键的形成和特性 正、负离子通过静电引力而联系起来的化学键叫做离子 键。由离子键形成的化合物叫做离子化合物。
离子键的本质是静电作用力。有极性的。没有方向性、
没有饱和性。
2、共价键的形成与特性 共价键:成键的两个原子各提供一个电子,通过共用 一对电子相互结合的化学键。 配位键:是一种特殊的共价键,它的特点是:形成共 价键的一对电子是由一个原子提供的。有机化合物中 绝大多数化学键是共价键。
H—Cl
μ=1.03D
CH3—Cl
μ=1.87D
H—CC—H
μ=0
共价键的分类
1、按共用电子对的数目分,有单键、双键、叁键等。 2、按共用电子对是否偏移分类,有极性键和非极性键 3、按提供电子对的方式分类,有正常的共价键和配位键。 4、按电子云重叠方式分,有σ键。和π键。
有机化合物中的共价键
(1) 路易斯结构式: 用共用电子的点来表示共价键的结构
有机化学中的酸碱概念 布伦斯特和路易斯酸碱定义 (1) 布伦斯特(B)酸碱
凡是能给出质子的叫酸,凡是能与质子结合的叫碱.在有机 化学中的酸碱一般指此类.
HCl
HSO4-
Cl-
(共轭酸碱)
(既是酸,也是碱)
• 强酸的共轭碱必是弱碱(如:HCl和Cl-) • 弱酸(CH3COOH)的共轭碱是强碱(CH3COO -) • 酸碱的概念是相对的:如H• + CH3—I • ••
CH3—OH + I-
有机化合物的分类
按基本骨架分类 (1) 脂肪族化合物: 分子中碳原子相互结合成碳链或碳环。 (2) 芳香族化合物: 碳原子连接成特殊的芳香环。
(3) 杂环化合物: 这类化合物具有环状结构,但是组成
有机化合物的结构和性质

洪德规则(Hund's rule) 洪德规则
洪德在总结大量光谱和电离势数据的基础上 提出:电子在简并轨道上排布时,将尽可能分 占不同的轨道,且自旋平行[5]。对于同一个电 子亚层,当电子排布处于 全满(s^2、p^6、d^10、f^14) 半满(s^1、p^3、d^5、f^7) 全空(s^0、p^0、d^0、f^0) 时比较稳定。
示例 H:1s^1 F:1s^2∣2s^2,2p^5 ∣ S:1s^2∣2s^2,2p^6∣3s^2,3p^4 ∣ ∣ Cr: 1s^2∣2s^2,2p^6∣3s^2,3p^6,3d^5∣4s^1(注 ∣ ∣ ∣ 意加粗数字,是3d^5,4s^1而不是3d^4,4s^2, 因为d轨道上,5个电子是半充满状态,这里 体现了洪德规则)。
•
1874年范荷夫和勒贝尔建立分子的立体概念, 说明了对映异构和顺反异构现象. • *碳原子总是四价的,碳原子自相结合成键, 构造和构造式 • 分子中原子的连接顺序和方式称为分子的 构造.表示分子中各原子的连接顺序和 • 方式的化学式叫构造式(结构式).用两小点 表示一对共用电子对的构造式叫电子式,用短横 线(-)表示共价键的构造式叫价键式.有时可用只 表达官能团结构特点的化学式,既结构简式.
电子排布
综述
电子在原子轨道的运动遵循三个基本定理: 1、能量最低原理 2、泡利不相容原理 3、洪德定则
能量最低原理 能量最低原理
定义:核外电子在运动时,总是优先占据
能量更低的轨道,使整个体系处于能量最低 的状态。
泡利不相容原理
物理学家泡利在总结了众多事实的基础上提出 :不可能有完全相同的两个费米子同时拥有样的 量子物理态。泡利不相容原理应用在电子排布上 ,可表述为:同一轨道上最多容纳两个自旋相反 的电子。该原理有三个推论 ①若两电子处于同一轨道,其自旋方向一定不 同; ②若两个电子自旋相同,它们一定不在同一 轨道; ③每个轨道最多容纳两个电子。
第一章 有机化合物的结构与性质

3 共价键的断裂
R R X R+ R-
+ + +
X XX+
(均裂) 游离基反应 (异裂) 离子型反应 (异裂) 离子型反应
10
二、有机化合物分子结构与性能 1 分子结构与物理性质 分子结构与一些物理性质的关系
物理性质
分子量
分子极性
分子对称性 范德华引力
C
δ
C
δ
Cl
γ
α
●诱导效应通过化学键传递时,随着传递的化学键增多,诱导效应迅速减弱。 ●诱导效应是一种永久效应,它影响化合物的分子极性。 ●诱导效应的比较标准是氢原子。 * 原子或基团的电负性小于氢的,叫给电子基,用“+I”表示;反之叫吸电 子基,用“-I”表示。 * 常见的吸电子基有:卤素,—NO2,—CN,-COOH,-CF3 -SO3H等。 * 烷基可能是吸电子基,也可能是供电子基,当与不饱和碳原子或电负性比 碳原子大的原子相连时,烷基为供电子基;当与饱和碳原子相连时,烷基表 现为较弱的吸电子基.
同分异构现象: 分子式相同而结构相异,因而其性质也各异的不同化合物,称 为同分异构体. 这种现象叫同分异构现象. 有构造异构和立体异构 (详见第二 章).
3
四、有机化学的研究内容和任务 1、研究内容 天然产物的研究 (分离、提纯有机化合物) 有机化合物的结构测定(化学、物理方法) 有机合成 (结构测定后,找方法: 原料易得) 反应机理的研究(优化条件、提高合成效率; 研究构效关系) 2、有机化学的任务 在人们认识自然,改造自然的过程中发挥有机化学的作用 工业(基因工程,工具)、农业(杂交水稻,农药)、 国防(隐身材料)、民用(衣食住行、医疗)等领域。
4
五、研究有机化合物的一般步骤
有机化合物的结构和性质

• 离解能 —— 一个共价键离解所需的能量 . 指离解特
定共价键的键能.
(4)键的极性和元素的电负性——分子的偶极矩 H—H, Cl—Cl ,成键电子云对称分布于两个原子之 间,这样的共价键没有极性。下列化合物有极性: • H(+)Cl(-), • H3C(+) Cl(-)
部分正电荷(+) 部分负电荷(-)
sp3杂化轨道的图形
碳原子的四个sp3杂化轨道
• 这四个sp3杂化轨道的能量是相等的,每一轨道相等于 1/4 s成分,3/4 p成分.
• C 采取 sp3 杂化轨道与 4 个 H 原子的 s 原子轨道形成 4 个 sp3-s 型 的 C-H 键 (CH4) 比 形 成 CH2 要 稳 定 的 多 .(414×4402)kJ/mol。形成CH4 时仍有约1255 kJ/mol能量释放出。 所以这个体系比形成两个共价键的CH2稳定的多。
(3) 许多有机化合物在常温下为气体 、液体. 常温下为固体的有机化合物,其熔点一般也很低,一 般很少超过300℃,因为有机化合物晶体一般是由较 弱的分子间力维持所致.
(4) 一般有机化合物的极性较弱或没有极性. 水是极性强,介电常数很大的液体,一般有机物难溶 于水或不溶于水 .而易溶于某些有机溶剂 (苯、乙醚、 丙酮 、石油醚).但一些极性强的有机物,如低级醇 、 羧酸 、磺酸等也溶于水. (5) 有机物的反应多数不是离子反应 ,而是分子
如:三大合成材料、合成药物、一些特 殊性能的有机材料
人造心脏
人工肾脏
人工膝关节
人工心脏瓣膜
角膜接触镜,俗称隐形眼镜。目前大量使用的 软质隐形眼镜。隐形眼镜常用以下材料制成: 1.硅氧烷和丙烯酸酯的共聚物(硬) 2.聚甲基丙烯酸羟乙酯(软)
有机化学 第一章 有机化合物的结构与性质

1.2 有机化合物的特点
性质 特点
性质
水中溶解度
无机化合物
易溶于水
有机化合物
大部分不溶于水,除 少数极性分子
1.2 有机化合物的特点
性质 特点
速度慢,副反应多, 产物复杂
乙醇+乙酸=乙酸乙酯,10年 酿酒 茅台:5年、10年、15年
1.2 有机化合物的特点
性质 特点
速度慢,副反应多, 产物复杂
结构 特点
• 同分异构体
分子式相同,而分子的结构不同所 产生的一系列化合物叫做同分异构体 。产生同分异构体的现象叫做同分异 构现象。 可见,分子中碳原子的数目越多, 同分异构体的数目也越多。因此,同 分异构现象也是有机化合物数目众多 的原因之一。
1.2 有机化合物的特点
结构 特点
• 结构复杂
Aspartame 阿斯巴甜 (含苯丙氨酸)
(3)课前要预习,课堂上要认真记好笔记
(4)要认真复习,做好作业
第一章 绪论
1.1 有机化合物与有机化学
1.2 有机化合物的特点
1.3 有机化合物中的共价键
1.4 有机化学中的酸碱概念
1.5 有机化合物的分类
1.6 如何学好有机化学
第一章 绪论
1.1 有机化合物与有机化学
1.2 有机化合物的特点 1.3 有机化合物中的共价键 1.4 有机化学中的酸碱概念 1.5 有机化合物的分类 1.6 如何学好有机化学
多原子分子: 分子偶极矩 = 键的偶极矩的矢量合
H O H
= 6.13 10-30 C m
Cl
C Cl Cl Cl
=0
direction of dip ole moment
O H H H
有机化学教案

有机化学教案第一章第一章有机化合物的结构与性质一. 学习目的和要求1. 掌握有机化学的定义。
2. 掌握有机化合物区别于无机化合物的特点。
3. 掌握共价键理论的要点、共价键的均裂、异裂、共价键的属性及重要参数。
理解有机化合物的特点,从中弄清与无机化合物的主要区别,掌握主要官能团的表达式。
4.理解有机化合物的分类原则样和有机化学中的酸碱理论。
5.掌握有机化合物的分类方法。
6.了解有机化学的发展简史,了解有机化学在生活和生产中的作用,了解有机化学的学习方法。
二. 本章节重点、难点共价键理论、分子轨道理论以及共价键的键参数的概念及应用。
三.教学内容:1.1 有机化学、有机化合物的定义有机化学(Organic Chemistry)是化学学科的一个分支,研究有机化合物的来源、制备、结构、性能以及应用,它的研究对象是有机化合物。
按物质的来源分类,早期化学家把从生物体(植物或动物)中获得的物质定义为有机化合物,无机化合物则被认为是从非生物或矿物中得到的。
当然,我们知道现在绝大多数有机物已不是从天然的有机体内取得,但是由于历史和习惯的关系,仍保留着“有机”这个名词。
现在将有机化合物定义为含碳化合物,所以有机化学就是研究碳化合物的化学。
有机化合物的另一个定义是碳氢化合物及其衍生物体现有有机化合物在结构上的相互联系,所以有机化学也可以称作研究碳氢化合物及其衍生物的化学1.2 有机化合物的特点1 •(1)有机化合物种类繁多、数目庞大(已知有七百多万种、且还在不断增加),组成有(C,H,O, N ,P,S,X等)。
因为1)C原子自身相互结合能力强;2) 结合的方式多种多样(单键、双键、三键、链状、环状)3) 存在同分异构现象(构造异构、构型异构、构象异构)。
(2)物理性质方面特点是1) 挥发性大,熔点、沸点低;2) 水溶性差(大多不容或难溶于水,易溶于有机溶剂)。
(3)化学性质方面的特点是1) 易燃烧;2) 热稳定性差,易受热分解(许多化合物在200~300度就分解);3) 反应速度慢;4) 反应复杂,副反应多1.3共价键有机化合物中的原子都是以共价键结合起来的,从本质上讲,有机化学是研究共价键化合物的化学,因此,要研究有机化学应先了解有机化学中普遍存在的共价键。
徐寿昌主编《有机化学》(第二版)

徐寿昌主编《有机化学》(第二版)篇一:徐寿昌主编(第二版)-课后1-13章习题答案第一章有机化合物的结构和性质无课后习题第二章烷烃1.用系统命名法命名下列化合物:1.(CH3)23)CH3CHCH3CH3CH(CH3)22,3,3,4-四甲基戊烷3-甲基-4-异丙基庚烷2(CH3)345CH33,3-二甲基戊烷 2,6-二甲基-3,6-二乙基辛烷632146.75421 2,5-二甲基庚烷2-甲基-3-乙基己烷 7.2,4,4-三甲基戊烷 2-甲基-3-乙基庚烷2.写出下列各化合物的结构式:1.2,2,3,3-四甲基戊烷2,2,3-二甲基庚烷33CH3CH2CH3333CH32CH2CH2CH333、 2,2,4-三甲基戊烷4、2,4-二甲基-4-乙基庚烷CH3CH333CH33CH3CHCH2CCH2CH2CH335、 2-甲基-3-乙基己烷6、三乙基甲烷CH3CH3CHCHCH2CH2CH3CH2CH3CH3CH2CHCH2CH3CH2CH37、甲基乙基异丙基甲烷 8、乙基异丁基叔丁基甲烷CH3CHCH(CH3)22CH3CH3CH2CHC(CH3)3CH2CHCH3CH30000 3.用不同符号表示下列化合物中伯、仲、叔、季碳原子100CH3C432100012CH312CH3CH301CH32.13323)33304.下列各化合物的命名对吗?如有错误的话,指出错在那里?试正确命名之。
1001.2.6.5.不要查表试将下列烃类化合物按沸点降低的次序排列:(1) 2,3-二甲基戊烷(2) 正庚烷 (3) 2-甲基庚烷(4) 正戊烷 (5) 2-甲基己烷解:2-甲基庚烷>正庚烷> 2-甲基己烷>2,3-二甲基戊烷> 正戊烷(注:随着烷烃相对分子量的增加,分子间的作用力亦增加,其沸点也相应增加;同数碳原子的构造异构体中,分子的支链愈多,则沸点愈低。
)6.作出下列各化合物位能对旋转角度的曲线,只考虑所列出的键的旋转,并且用纽曼投影式表示能峰、能谷的构象。
《有机化学》第一章绪论

《有机化学》第一章绪论一、教学内容本节课的教学内容来自于《有机化学》第一章绪论。
这部分内容主要包括有机化学的基本概念、有机化合物的分类、有机化学反应类型以及有机化合物的结构和性质。
具体内容包括:1. 有机化合物的定义和特点:介绍有机化合物的概念,解释有机化合物的特点,如碳氢化合物的存在、有机化合物的命名规则等。
2. 有机化合物的分类:介绍烷烃、烯烃、炔烃、芳香烃等有机化合物的分类和特点,解释它们的结构差异和性质特点。
3. 有机化学反应类型:介绍加成反应、消除反应、取代反应等有机化学反应类型,解释反应机理和反应条件。
4. 有机化合物的结构和性质:介绍有机化合物的结构特点,如碳原子的四价键、有机化合物的同分异构现象等,解释有机化合物的物理性质和化学性质。
二、教学目标1. 学生能够理解有机化学的基本概念和特点,掌握有机化合物的分类和命名规则。
2. 学生能够了解有机化学反应的类型和机理,理解反应条件和反应产物的关系。
3. 学生能够分析有机化合物的结构和性质,运用有机化学的基本原理解决实际问题。
三、教学难点与重点重点:有机化合物的分类和特点、有机化学反应类型和机理、有机化合物的结构和性质。
难点:有机化合物的结构和性质的理解和应用、有机化学反应机理的掌握。
四、教具与学具准备教具:黑板、粉笔、多媒体教具、有机化合物的模型或图示。
学具:笔记本、笔、有机化合物的结构模型或图示、有机化学反应机理的图示。
五、教学过程1. 引入:通过展示有机化合物的实际例子,如糖类、脂肪、蛋白质等,引起学生对有机化学的兴趣,引出本节课的主题。
2. 讲解:在黑板上用粉笔写出有机化合物的定义和特点,引导学生理解有机化合物的概念和特点。
然后,通过图示和模型,讲解有机化合物的分类和结构特点,如烷烃、烯烃、炔烃、芳香烃等。
3. 示例:通过具体的有机化学反应实例,讲解加成反应、消除反应、取代反应等有机化学反应类型,解释反应机理和反应条件。
4. 练习:给出一些有机化合物的结构和性质的题目,让学生通过观察和分析,回答题目,巩固对有机化合物的结构和性质的理解。
有机化学(叶孟兆编)第一章结构与性质(课件)

1. 有机化学 2.有机化学与农业科学 3.有机化合物的特性 4.有机化合物的结构 5.有机酸碱概念
主要参考书:
1、邢其毅、徐瑞秋、周政、裴伟伟,《基础有机 化学》第二版,上、下册,高等教育出版社。
2、于敬海主编,《有机化学》第一版,科学技术 出版社。 3、曾昭琼主编,《有机化学》第三版,上、下册, 高等教育出版社。 4、胡宏纹主编,《有机化学》第二版,上、下册, 高等教育出版社。
四、共价键的属性
键长 :成键原子的核间距离 键角:两共价键之间的夹角 决定分子 空间构型 → 化学键强度
键能:离解能或平均离解能
键的极性: 成键原子间的电荷分布 → 影响理化性质
几种共价键的键长、键角、键能 C—H C—C C=C C ≡C
键长 // pm 键长 nm
109 0.109
. CH3 . . CH2 . . CH2 + . H + 443.5 kJ· mol -1 . -1 . . H 443.5 kJ· mol + CH + .
-1
. . CH .
. . . . 338.9 kJ·· mol-1
对于同种原子形成的共价键,公用 电子由两个原子核均等“享用”:
上页 下页 首页
三、碳的杂化轨道
价键理论揭示了共价键的本质,但它无法解 释甲烷分子(CH4)中4个碳氢键的键角相同,均为 109°28´的事实。1931 年鲍林在价键理论的基础 上,提出了杂化轨道理论 (orbital hybridization theory):原子在形成分子时,由于原子间的相互 影响,同一个原子内的不同类型、能量相近的原 子轨道可以重新组合成能量、形状和空间方向与 原来轨道完全不同的新的原子轨道。这种重新组 合过程称为杂化,所形成的新的原子轨道称为杂 化轨道(hybridization orbitals)。
徐寿昌主编《有机化学》第二版)

徐寿昌主编《有机化学》(第二版)篇一:徐寿昌主编《有机化学》(第二版)-课后1-13章习题1 第一章有机化合物的结构和性质无课后习题第二章烷烃 1.用系统命名法命名下列化合物:1.(CH3)2CHC(CH3)2 2. CH3CH2CH2CH2CH3 CH3CHCH3 CH3CH(CH3)2 2,3,3,4-四甲基戊烷3-甲基-4-异丙基庚烷2 3. 1 7 8 CH3CH2C(CH3)2CH2CH3 CH3CHCH3CH2CH3 6 4.CHCHCHCH 322223 3 4 5 CH3 3,3-二甲基戊烷2,6-二甲基-3,6-二乙基辛烷6 5.7 5 3 2 1 4 6. 8. 67 5 4 2 1 2,5-二甲基庚烷2-甲基-3-乙基己烷7. 2,4,4-三甲基戊烷2-甲基-3-乙基庚烷2.写出下列各化合物的结构式:1.2,2,3,3-四甲基戊烷2,2,3-二甲基庚烷CH3CH3 CH3 CH2CH3 33 CH3 CH32CH2CH2CH3 3 3、2,2,4-三甲基戊烷4、2,4-二甲基-4-乙基庚烷CH3 CH333 CH3CH3 CH3CHCH2CCH2CH2CH3 3 5、2-甲基-3-乙基己烷6、三乙基甲烷CH3 CH3CHCHCH2CH2CH3 2CH3 CH3CH2CHCH2CH3 2CH3 7、甲基乙基异丙基甲烷8、乙基异丁基叔丁基甲烷CH3CHCH(CH3)2 2CH3 CH3CH2CHC(CH3)3 CH2CHCH3 CH3 3.用不同符号表示下列化合物中伯、仲、叔、季碳原子11. 100343 2 1 00 1 2CH3 1 2CH3CH3 1 CH3 2. 1 3323)333 4.1. 1 2. 3. 4. 5. 6. 5.不要查表试将下列烃类化合物按沸点降低的次序排列:(1) 2,3-二甲基戊烷(2) 正庚烷(3) 2-甲基庚烷(4) 正戊烷(5) 2-甲基己烷解:2-甲基庚烷正庚烷2-甲基己烷2,3-二甲基戊烷正戊烷(注:随着烷烃相对分子量的增加,分子间的作用力亦增加,其沸点也相应增加;同数碳原子的构造异构体中,分子的支链愈多,则沸点愈低。
基础有机化学第3版邢其毅第1章_绪论解析

1.3 有机物的结构
Kekule(1865)——构造式 (原子相互连接的次序和方式)
Kekule和Couper的两个重要基本原则
1.碳原子是四价的
2.碳原子自相结合成键 (分为单,双,叁键,也参与其它 元素连接)
H HC
HC H
CH
HH C
CC
H C CC
H
H
H
CC C
CC C
H C CH
C4H10
• 化学键的键能越大,键越牢固。
(3) 键角
• 键与键之间的夹角。 • 键角与成键中心原子的杂化态有关,也受分子中其他原子的影响。
立体透视式的写法
在纸面上
H
在纸面前方
H
CH H
在纸面后方
(4) 键的极性和诱导效应
a. 键的极性 键的极性是由于成键原子的电负性不同而引起的。 例如:
H Cl , CH3 Cl , CH3 OH
lweis酸 lweis碱
H+ + ClH+ + OH2 BF3 + NH3 AlCl3 + Cl-
HCl H3O+ BF3-NH3 AlCl4-
F FB
F
讨论
⑴ lewis碱就是Brφnsted碱。 如: : NH3 —Brφnsted碱, lewis碱。
⑵ lewis酸则与Brφnsted酸略有不同。 如:H+—lewis酸,非Brφnsted酸; HCl—Brφnsted酸,非lewis酸; BF3和AlCl3 —lewis酸,非Brφnsted酸。
1.1 有机化合物和有机化学
1.1.2 有机化学
有机化学简史 • 1806年,柏则里提出“有机化学”这一名词和“生命力”学说; • 1828年, F.Wohler由氰酸铵NH4OCN合成尿素NH2CONH2; • 1845年Kolbe合成醋酸; • 1854年,柏赛罗合成油脂; • 1850-1900年,合成有机化学时代,煤焦油化学时代; • 1900-1940年,有机化学工业时代,煤焦油→染料、药物、炸药; • 1940年-,石油化工时代,石油→三大合成材料(橡胶、塑料、
《有机化学》辅导 (1)

《有机化学》辅导第一章、有机化合物的结构和命名有机化合物的同分异构:同分异构构造异构碳干异构官能团异构官能团位置异构互变异构立体异构构型异构构象异构顺反异构对映异构非对映异构中国化学会(CCS,Chinese Chemical Society)根据IUPAC命名法结合中文特点制定并公布的《有机化合物命名原则》。
1.取代基的命名烷基:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、叔戊基、新戊基。
烯基:乙烯基、丙烯基、烯丙基。
炔基:乙炔基、丙炔基、炔丙基。
环烷基或芳基:环丙基、环己基、2,4-环戊二烯基、苯基、对甲苯基等。
其他常见的取代基:烷氧基,如-OCH3(甲氧基)、-OCH2CH3(乙氧基)、-OC6H5(苯氧基);酰基,如-CHO(甲酰基)、-COCH3(乙酰基)、-COC6H5(苯甲酰基)、-OCOC6H5(苯甲酰氧基)等。
“亚基”和“次基”:=CH2(亚甲基)、=CHCH3(亚乙基)、-CH2CH2-(1,2-亚乙基)、≡CH(次甲基)、≡CCH3(次乙基)、(亚环己基)等。
2.多取代基化合物的命名若化合物中有两个以上的官能团时,就要选择主体官能团为母体,其他为取代基;顺序如下:羧酸>磺酸>羧酸酯>酰卤>酰胺>腈>醛>酮>醇>酚>硫醇>胺>炔烃>烯烃>醚(烷氧基)>卤代烃>硝基化合物取代基命名次序规则:按前小后大的顺序依次放在母体名称前面(中文命名),英文规则按取代基名称的第一个字母在英文字母顺序表中的次序排列。
3.立体异构体的命名(1)双键的顺反异构(Z 、E 或顺、反) (2)对映体的命名给出的有机化合物构型可能是Newman 投影式,也可能是Fischer 投影式或楔形形式或是锯架式构型,命名时要正确确定手性碳的位置和构型。
如;CH 3CH 3Cl ClHH (2S,3R)-2,3-二氯丁烷COOHOHHO H H(2S,3S)-2,3-二羟基丁二酸COOHClClHH C 2H 5CH 3(2S,3S)-2,3-二氯戊烷(3)环状化合物的命名CH 3CH 2CHCH 2CH 3CH 2CHG 2CH 32-乙基-1-(1-甲基-2-环丙烯基)戊烷CH 3CH 3Cl7,7-二甲基-1-氯二环[2.2.1]庚烷Cl5-氯螺[3.5]壬烷此外,还要注意环状化合物的顺、反异构和对映异构。
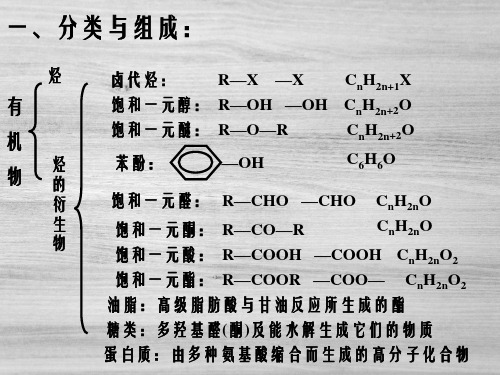
2020版高考大一轮精讲:选修 有机化学基础 1 第1节 有机化合物的组成、结构与性质

或
。
栏目 导引
选修 有机化学基础
(3)该有机物除苯环外还有 2 个碳原子、2 个氧原子及 1 个不饱 和度,能发生银镜反应,能水解,且水解产物之一能与 FeCl3 溶液发生显色反应,说明存在甲酸酚酯结构:
;另外还有一个饱和碳原子、1 个苯环,
结合分子中有 6 种不同化学环境的氢原子可写出其结构简式。
有机
_脂__环__化合物(如
)
化合物环状化合物_芳__香__化合物(如
)
栏目 导引
选修 有机化学基础
(3)按官能团分类 ①官能团:决定化合物特殊性质的_原__子__或__原__子__团__。
②有机物主要类别与其官能团
类别
官能团
代表物名称、结构简式
烷烃
—
甲烷 CH4
烯烃
栏目 导引
选修 有机化学基础
名称
有机物结构的表示方法
结构式
结构简式
键线式
丙烯
CH3—CH==CH2
乙醇
CH3CH2OH
栏目 导引
选修 有机化学基础
名称
结构式
乙酸
结构简式
键线式
CH3COOH
栏目 导引
选修 有机化学基础
题组二 同分异构体的书写及判断
4.(1)写出同时满足下列条件的
的同分异构体的结构
栏目 导引
选修 有机化学基础
2.将下列有机物中所含的官能团用短线连接起来。
A.丙烯
①
B.乙酸乙酯
②—OH
C.苯酚
③
D.乙醛
④—COOH
E.醋酸
⑤—CHO
答案:A—③ B—① C—② D—⑤ E—④
栏目 导引
徐寿昌主编《有机化学》(第二版)_课后1_13章习题答案

第一章 有机化合物的结构和性质无课后习题第二章 烷烃1.用系统命名法命名下列化合物:1.(CH 3)2CHC(CH 3)2CHCH 3CH 32.CH 3CH 2CH CHCH 2CH 2CH 3CH 3CH(CH 3)22,3,3,4-四甲基戊烷 3-甲基-4-异丙基庚烷3.CH 3CH 2C(CH 3)2CH 2CH 34.CH 3CH 3CH 2CHCH 2CH 2CCH 2CH3CHCH 3CH 3CH 2CH 3123456783,3-二甲基戊烷 2,6-二甲基-3,6-二乙基辛烷5.12345676.2,5-二甲基庚烷 2-甲基-3-乙基己烷7.8.12345672,4,4-三甲基戊烷 2-甲基-3-乙基庚烷 2.写出下列各化合物的结构式:1.2,2,3,3-四甲基戊烷 2,2,3-二甲基庚烷CH 3CCCH 2CH 3CH 3CH 3CH 3CH 3CH 3CH 3CHCHCH 2CH 2CH 2CH 3CH 33、 2,2,4-三甲基戊烷4、2,4-二甲基-4-乙基庚烷CH 3C CHCH 3CH 3CH 3CH 3CH 3CHCH 2CCH 2CH 2CH 3CHCH 3CH 3CH 35、 2-甲基-3-乙基己烷6、三乙基甲烷CH 3CH 3CHCHCH 2CH 2CH 3CH 2CH 3CH 3CH 2CHCH 2CH 3CH 2CH 37、甲基乙基异丙基甲烷 8、乙基异丁基叔丁基甲烷CH 3CHCH(CH 3)2CH 2CH 3CH 3CH 2CH C(CH 3)3CH 2CHCH 3CH 33.用不同符号表示下列化合物中伯、仲、叔、季碳原子CH 3CHCH 2CCH 3CH 3CH 2CH 3CCH 3CH 31.13411111122CH 2CH 32402.2401331111CH 3CH(CH 3)CH 2C(CH 3)2CH(CH 3)CH 2CH 324.下列各化合物的命名对吗?如有错误的话,指出错在那里?试正确命名之。
《第一章 第一节 有机化合物的结构特点》教学设计教学反思

《有机化合物的结构特点》教学设计方案(第一课时)一、教学目标1. 理解有机化合物的基本观点。
2. 掌握有机化合物结构的特性。
3. 学会分析有机化合物结构特点的方法。
二、教学重难点1. 教学重点:掌握有机化合物结构特点,如共价键的形成、空间结构等。
2. 教学难点:理解有机化合物结构与无机化合物结构的区别,掌握有机化合物结构的判断方法。
三、教学准备1. 准备教学用具:黑板、白板、投影仪、模型等。
2. 准备教学材料:有机化合物样品、相关图片和视频等。
3. 设计教学活动:组织学生进行实验操作、讨论和总结等。
4. 安排课后作业:要求学生预习下一节课内容,思考有机化合物结构的特点,并尝试自己总结。
四、教学过程:本节课为第一课时,主要是通过一系列的实验和观察,引导学生探索有机化合物的结构特点。
1. 导入:起首,我们会讨论一些有机化合物的性质和用途,然后提出一些问题,比如为什么它们会有这些性质和用途?它们是由什么组成的?这会引发学生对有机化合物结构的兴趣。
2. 实验观察:我们将进行一系列的实验,观察有机化合物在加热、光照、酸碱环境下的变化,以及它们在反应中的变化。
这些实验将帮助学生理解有机化合物的一些基本性质,如稳定性、反应性等。
3. 有机化合物的结构:我们将介绍有机化合物的基本结构单元,如碳链、环状结构、支链等。
这部份内容将通过图片、动画和视频等形式展示,帮助学生更好地理解。
4. 空间结构:我们将介绍有机化合物的空间结构,如椅式构象、船式构象等。
这部份内容可以通过模型和动画展示,帮助学生更好地理解有机化合物的立体结构。
5. 总结与回顾:在课程的最后,我们将回顾所学的内容,并讨论有机化合物在生活中的应用和未来发展趋势。
同时,我们也会引导学生思考如何将所学知识应用到实际生活中。
6. 作业与思考:学生需要完成一些与有机化合物结构相关的作业,并思考一些与有机化合物相关的问题,如如何合成有机化合物、如何设计有机化合物的结构等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
δ CH3 CH2 CH2 Cl
部分负电荷(-)
部分正电荷(+)
电负性——一个元素吸引电子的能力。 偶极矩——正电中心或负电中心的电
荷与两个电荷中心之间的距离d的乘积. (方向性:正到负,一般用符号 表 示 )。 dipole moment qd (D,德拜) 键的偶极矩就是分子的偶极矩。 德拜
有机化学 — 就是研究碳氢化合物及其衍生物的化学. 当然 , 对 CO 、 CO2 、 CO32- 等简单化合物习惯上还 是称作无机化合物.
有机化学包含的主要元素
自 然 界 中 碳 的 循 环
(1) 有机化学——使世界五彩缤纷
(2) 有机化学——保护我们的健康(1)
当归
喹啉
美登素
喹啉(Quinine)——又称金鸡纳碱 。用于治疗和预防 各种疟疾。 美登素(Maytansine)——1972年Kupchan报道的第一 个新型抗癌含氮大环化合物
(2) 有机化学——保护我们的健康(2)
弗莱明1945年获诺贝尔奖
(2) 有机化学——保护我们的健康(3)
(3) 有机化学——为生命提供能源(碳水化合物)
蔗糖
葡萄糖
直链淀粉
(4) 有机化学——是研究生命科学的基础
蛋白酶模型 生命遗传物质
DNA
1953 年, 25 岁的沃森和 35 岁的克里克发 现 DNA 的双螺旋结构。他们的发现照亮 了整个遗传学领域,指引着人们去探究 生命本质的奥秘。
二.有机化学的定义 有机化合物的主要特征 : 都含有碳原子 , 即都是含碳 化合物. 有机化学—就是研究含碳化合物的化学.
Organic Chemistry is the Chemistry of Carbon Compounds
绝大多数有机化合物也都含有氢,从结构上看, 所有的有机化合物都可以看作碳氢化合物以及 从碳氢化合物衍生而得的化合物。
碳的杂化
sp3杂化轨道的图形 • 这四个sp3杂化轨道的能量是相等的,每一轨道相等于 1/4 s成分,3/4 p成分.
• C 采取 sp3 杂化轨道与 4 个 H 原子的 s 原子轨道形成 4 个 sp3-s 型的 C-H 键 (CH4) 比形成 CH2 要稳定的多 .(414 ×4402)kJ/mol。形成CH4 时仍有约1255 kJ/mol能量释放出。 所以这个体系比形成两个共价键的CH2稳定的多。
1.4 有机化合物中共价键的性质
(1) 键长 —— 形成共价键的两个原子的原子核之间的 距离. (不同化合物中同一类型的共价键也可能稍有 不同,平均键长) (2)键角(方向性)——任何一个两价以上的原子,与其它 原子所形成的两个共价键之间的夹角. (3)键能 ——气态原子A和气态原子B结合成A-B分子( 气态)所放出的能量,也就是气态分子A-B理解成A和 B两个原子(气态)时所吸收的能量. 泛指多原子分子中几个同类型键的离解能的平均值.
(符号相同,即:波相相同.成键轨道) (符号不同,即:波相相反.反键轨道)
• 每个分子轨道只能容纳两个自旋相反的电子. • 电子总是首先进入能量低的分子轨道.
反键轨道2=1 - 2
成键轨道1=1 + 2 2个氢原子轨道组成2个氢分子轨道
共价键具有方向性(最大重叠原理): y
1s
y
1s
(4) 一般有机化合物的极性较弱或没有极性. 水是极性强,介电常数很大的液体,一般有机物难溶 于水或不溶于水 .而易溶于某些有机溶剂 (苯、乙醚、 丙酮 、石油醚).但一些极性强的有机物,如低级醇 、 羧酸 、磺酸等也溶于水. (5) 有机物的反应多数不是离子反应 ,而是分子
间的反应.除自由基型反应外,大多数反应需要 一定的时间.
NH4OCN H2N C NH2
Wö hler
1845年Kolbe合成了醋酸;1854年,柏赛罗(M.berthelot) 合成油脂类化合物等……
19 世纪下半叶 , 有机合成得到了快速发展 ,20 世纪初 开始建立了以煤焦油(P121)为原料合成染料、药物 和炸药为主的有机化学工业. 20世纪40年代开始发展了以石油为主要原料的有机 化学工业,特别是生产合成纤维 、合成橡胶 、合成树 脂和塑料为主的有机合成材料工业.
(5) 有机化学——与人民生活紧密相关
(6) 有机化学——与环境污染
淮河上游被化工厂排出物污染
不同工业部门生产中的废物排放量
工业部门 制药 精细化工 大宗化学品 炼油 每吨产品排放的废物(Kg/吨) 25~100 5~20 1~5 ~0.1
(7) 有机化学——与绿色化学
中国环境保护徽
我们只有一个地球: 绿色化学 是我们不断追求的目标。
CH3CHCH3 CH3
碳化合物含有的碳原子数和原子种类越多 ,它的同分 异构体也越多.不同碳原子数的烷烃同分异构体数:
碳原子数
4
异构体数
2 3
9 75
碳原子数
11 13
15 20
异构体数
159 802
4347 366319
5
7 10
二. 构造异构现象 象丁烷和异丁烷异构,只是分子中各原子间相互结 合的顺序不同而引起的,只是构造不同而导致的异构现 象,又叫做构造异构现象. 此外,有机化合物还可由于构型(顺、反;Z、E;R 、S)和构象不同而造成异构现象. 三. 化合物的结构 是指 : 分子中原子间的排列次序 , 原子相互间的立 体位置,化学键的结合状态以及分子中电子的分布状态 等各项内容在内的总称.
二 、分子轨道理论
(1)当原子组成分子时,形成共价键 的电子即运动于整个分子区域; 薛定谔
(2) 分子中价电子的运动状态,即分子轨道,用波函数来描 述;(薛定谔方程的解) (3) 分子轨道由原子轨道线性组合形成(LCAO) ,形 成的轨道数与参与成键的原子轨道数相等.
1=1 + 2 2=1 - 2
1.2.2 有机化合物性质上的特点
•与无机物,无机盐相比,有机化合物一般有以下特点: (1) 大多数有机化合物可以燃烧(如汽油). (2) 一般有机化合物热稳定性较差,易受热分解. 许多有机化合物在200~300℃时就逐渐分解.
(3) 许多有机化合物在常温下为气体 、液体. 常温下为固体的有机化合物,其熔点一般也很低,一 般很少超过300℃,因为有机化合物晶体一般是由较 弱的分子间力维持所致.
• B的核外电子排布:1s22s22p1; • Al 的核外电子排布:3s23p1 BF3(酸) + : NH3 (碱) F3B-NH3 sp3
AlCl3 (酸) + : Cl- (碱) Cl3Al-Cl = AlCl4-
(3)亲电性与亲电试剂 • 路易斯(L)酸 :能接受外来电子对 ,具有亲电性 .
• 强酸的共轭碱必是弱碱(如:HCl和Cl-)
• 弱酸(CH3COOH)的共轭碱是强碱(CH3COO -) • 酸碱的概念是相对的:如HSO4-
(2)路易斯(L)酸碱
• 凡是能接受外来电子对的都叫做酸, • 凡是能给予电子对的都叫做碱. Lewis acid Lewis base
注意——缺电子化合物: 共价性高,有空轨道.
(1) 路易斯结构式: 用共用电子的点来表示共 价键的结构式.
(2) 凯库勒结构式: 用一根短线代表一个共价键.
• • C • + 4H • •
H •• • C H• • ••• H H
路易斯结构式
H
H —C — H
H
凯库勒结构式
凯库勒
一 、量子化学的价键理论:
•原子轨道 — 原子中每个电子的运动状态都可以用一
不同化合物之间的转化(官能团)、碳链的增加和 减少……
1.2.1 有机化合物结构上的主要特点:同分异构现象
一.同分异构现象 分子式相同而结构相异因而其性质也各异的不同 化合物,称为同分异构体,这种现象叫同分异构现象.
例1:乙醇和二甲醚
例2:丁烷和异丁烷
CH3CH2-OH, CH3-O-CH3
CH3CH2CH2CH3
(3)协同反应——有些有机反应过程没有明显分步的共
价键均裂或异裂,只是通过一个环状的过渡态 ,化学键 的断裂和新化学键的生成同时完成而得到产物.
1.6 有机化学中的酸碱概念 1.6.1 布伦斯特和路易斯酸碱定义 (1) 布伦斯特(B)酸碱
• 凡是能给出质子的叫酸,凡是能与 质子结合的叫碱.在有机化学中的酸碱一般指此类. HCl Cl- (共轭酸碱) HSO4(既是酸,也是碱)
有机化学 Organic Chemistry
教材:徐寿昌 主编 高等教育出版社
第一章 有机化合物的结构和性质
中国矿业大学(北京)优秀课程
主讲教师:王启宝
副教授
wqb@
中国矿业大学(北京)化学与环境工程学院
第一章 有机化合物的结构和性质
1.1 有机化合物和有机化学
一.有机化学的发展 1806年柏则里(Berzelius)首先提出(有机化学)名词. 有机化学奠基于18世纪中叶; 生命力学说 1828年F.Wö hler在实验室由氰酸铵(NH4OCN) 合成尿素(NH2CONH2),促进了有机化合物的人 工合成: O
1.2 有机化合物的特点
绝大多数有机物只是由碳,氢,氧,卤素,硫和 磷等少数元素组成,但种类繁多。
碳元素:核外电子排布 1s22s22p2
碳原子相互结合能力很强(碳链和碳环)
碳的同素异形体:
(1)石墨
(2)金刚石
(3)足球烯 (富勒烯)(C60/C70)
335pm
石墨的晶体 结构 (SP2)
金刚石的晶体 结构( SP3)
足球烯 (富勒烯 )(Footballene):单纯由碳元素结合形成 的稳定分子,具有60个顶点和32个面,其中12个面为 正五边形,20个面为正六边形,整个分子形似足球。 具有芳香性。
