杂环化合物的碱性顺序总结
第12章杂环化合物和生物碱

嘌呤(purine)
2、系统命名法
① 从杂原子开始 1,2,3,4……(或用希腊字母α、β、 γ…… ) ② 当环上含有两个或两个以上相同的杂原子时,应使杂原子 所在位次的数字最小 ③ 不止一个杂原子,按O,S,N顺序编号
第十二章 杂环化合物和生物碱 5
4
3
H3C 5 O 2 CH3 1
4 COOH 3 5 2 6 N 1
第十二章 杂环化合物和生物碱 25
嘌呤
N H
N N
N
N
NH2 N N N H
N H
O HN H2N N N H N
N H
Purine
腺嘌呤( A) Carbazole
鸟嘌呤(G)
嘌呤有(Ⅰ)和(Ⅱ)两种互变异构体:
N N N H
N
N N N
NH
(I)9H-嘌呤
(II)7H-嘌呤
第十二章 杂环化合物和生物碱 26
2. 亲核取代 由于氮的吸电子作用,使得吡啶环上电子云密度减低, 不易进行亲电取代,但却有利于亲核取代。例如它与氨基 钠作用,生成α-氨基吡啶。
+ NaNH2 N
-H2 H2O
N
NHNa
N
NH2
3.酸碱性 呋喃、噻吩为中性;吡咯具有弱碱性。吡咯属仲胺,似乎应具 有较强的碱性,但由于氮原子的孤对电子参与形成闭合的共轭体 系,氮原子上的电子密度有所降低,吸引质子的能力降低,因此 吡咯的碱性(pKb=13.6)非常微弱,不但比脂肪族仲胺弱得多, 而且比芳香胺还弱,以至它与酸不能生成稳定的盐;另一方面, 氮原子上的氢原子离解为离子的倾向增大,这就使吡咯反而有弱 酸性,其酸性介与乙醇和苯酚之间,可与固体KOH(或与金属 15 第十二章 杂环化合物和生物碱 K,Na)共热,形成不稳定的盐,遇水即分解。
杂环化合物和生物碱

N H
1H-吡咯
N
2H-吡咯 2H-吡喃
O
4H-吡喃
O
三、常见的杂环化合物的性质 显色反应
⑴ 松木片反应:吡咯蒸汽 + 盐酸浸泡过的松木片→显红色 呋喃 + 盐酸浸泡过的松木片→显绿色
⑵ 噻吩 + 浓硫酸 + 靛红 → 显蓝色
O 5.76 × 10-30C. m S 6.33 × 10-30C. m N H 5.26 × 10-30C. m
黄连
二、吗啡、可待因和海洛因的结构、功能和毒害
R1O
R1
可待因
CH3
R2
H
O R2O
N
CH3
吗啡
海洛因
H
O CCH3
H O CCH3
来源:吗啡和可待因存在于罂粟中。 海洛因是由吗啡人工合成的。 罂粟现在以印度与土耳其为两大主要产地;亚洲方面,以中国、 泰国、缅甸边境的金三角为主要非法种植地区。
罂粟是一年或二年生草本植物,高60~150cm,花期4~6 月,有白色、粉红色、紫红色等;果期6~8月。
杂环化合物
“杂环”就是组成环的原子除 C 外,还含有其它元素的原子, 这些非碳原子统称为杂原子。 原则上二价以上的元素都可成 为杂原子, 但最常见的是 O、S 和 N。
含芳香杂环的药物:
O H 3C N O H N
H3CO
N H CH3OOC
N O O C OCH3 OCH3 OCH3 OCH3
(2)冰毒和摇头丸(苯丙胺类)
是一类具有致幻和成瘾作用的毒品。 冰毒:N-甲基苯异丙胺(去氧麻黄素)
CH3 CH2CHNHCH3
摇头丸(蓝精灵):
O H2C O
CH2CHCH3 NH2
五元杂环化合物的结构和性质.

N NH
HN N
卟 吩
Woodward 20岁获博士学位,30岁当教授,48岁时 (1965年)获诺贝尔化学奖。一生人工合成了20多种结构 复杂的有机化合物,是当之无愧的有机合成大师。
CH=CH2 H3C N
+
CH3 CH=CH2 N
Fe Cl N H3C HOOCCH2CH2 N
-
CH3 CH2CH2COOH
乙 酸 酐 O +CH3COONO 2 -5~-30 C 乙 酸 酐 S +CH3COONO 2 -10 C
0 0
O
NO2
+CH3COOH +CH3COOH
S
NO2
+
N H
N SO3
+
-
C2H4Cl2
100 ¡ æN H来自SO3H+
N
(二)化学性质
(3)磺化反应
+
N H N SO3
+ -
C2H4Cl2
(二)化学性质
3、亲电取代反应
比苯容易,亲电取代反应通常发生在α位上。 亲电取代反应活性:吡咯 >呋喃>噻吩>苯
(1)卤代反应
O
S
+ Br2
二氧六环
0℃
乙醚 0℃
O
S
Br
Br
+ Br2
(二)化学性质 (2)硝化反应
乙 酸 酐 N H +CH3COONO 2 -10 C
0
N H
NO2 +CH3COOH
沸点:吡咯、噻吩和呋喃分别为131℃、84℃、31℃
(二)化学性质
1、酸碱性
吡咯碱性极弱, 氮上的氢原子显示出弱酸性, pKa为17.5, 能与强碱共热成盐。
《有机化学》第13章 杂环化合物和生物碱

4-甲基嘧啶
4-甲基噻唑
⑶ 连有取代基的杂环化合物命名时,也可将杂环作为取代基,以侧链为母体来命名。
4-嘧啶磺酸
β-吲哚乙酸(3-吲哚乙酸)
2-苯并咪唑甲酸乙酯
⑷ 为区别杂环化合物的互变异构体,需标明杂环上与杂原子相连的氢原子所在的位 置,并在名称前面加上标位的阿拉伯数字和大写H的斜体字。
2023/6/13
⑴ 卤代反应
在室温条件下,吡咯、呋喃和噻吩能与氯或溴发生激烈反应,得到多卤代物。将反应 物用溶剂稀释并在低温下进行反应时,可以得到一氯代物或一溴代物。碘化反应需要 在催化剂存在下进行。例如:
2023/6/13
6
(2)硝化反应
在低温条件下,吡咯、呋喃和噻吩能与比较缓和的硝化剂硝酸乙酰酯(CH3COONO2) 发生硝化反应,主要生成α-硝基化合物。例如:
3. 颜色反应
生物碱能与一些试剂发生颜色反应,比如钒酸铵的浓硫酸溶液、浓硝酸、浓硫酸、 甲醛、氨水等,利用此性质可鉴别生物碱。比如莨菪碱遇1%钒酸铵的浓硫酸溶液显 红色,可待因遇甲醛-浓硫酸试剂显紫红色等。
二、重要的生物碱 1. 烟碱 又叫尼古丁,主要以苹果酸盐及柠檬酸盐的形式存在于烟草中。其结构式
2023/6/13
13
血红素是卟啉环与Fe2+形成的配合物;叶绿素是卟啉环与Mg2+形成的配合物,它们的 结构式如下:
血红素在体内与蛋白质结合形成血红蛋白,存在于红细胞中,是人和其他哺乳动物 体内运输氧气的物质。叶绿素是植物进行光合作用不可缺少的物质。
2023/6/13
14
二、呋喃衍生物
呋喃甲醛是最常见的呋喃衍生物,又称为糠醛,它是一种无色液体,沸点为161.7℃, 在空气中易氧化变黑,是一种良好的溶剂。 糠醛是合成药物的重要原料,通过硝化可制得一系列呋喃类抗菌药物,如治疗泌尿 系统感染的药物呋喃坦丁、治疗血吸虫病的药物呋喃丙胺等。
杂环化合物
C H3 HO C HC H2 2
4 5
N3 S
1 2
O 4 - 硝基噁唑
4 - 甲基 - 5 - ( 2' -羟乙基 ) 噻唑
C. 稠杂环有特定的母体和固定的编号
嘌呤 (purine)
D.如果接有 —SO3H、—COOH、—NH2、 —CHO等基团时,杂环为取代基。
COOH CHO N
3-吡 啶甲 酸
等电子体系
N
未参与共轭
N
吡啶电子结构与吡咯不同:
N H
N
2.物理性质
氮原子的电负性较大,使吡啶有较大极性,其偶极距数值较大.
=2.20D
=1.17D
吡啶能与水以任意比例混溶,又能溶解大多数极 性或非极性有机化合物,甚至许多无机盐类,是一个 良好的溶剂。
3.化学性质
γ
δ δ δ δ δ
β α
O
HO CHO O
NaOH
O C O
KCN
CH O
CHO O
O
CH2OH
+
COOH O
HOOCCH2CH2 N H
CH2COOH CH2NH2
卟吩胆色素原:通过生物体内特定酶的作用可转变成 卟啉、叶绿素和维生素B12等重要生物活性物质.
CH2COOH N H
3-吲哚乙酸(植物生长促进剂)
OH N C2H5 N H H3COOC H3CO H N C2H5 N R HO OCOCH3 COOCH3
O
2-呋 喃甲 醛
二、五元杂环化合物
1. 结构与芳香性
(1)呋喃、吡咯和噻吩的结构
C C N C H
C C C O C
杂原子均以sp2 杂化(未杂化 的P上有2个电 子参加成环)
单杂环化合物的化学性质
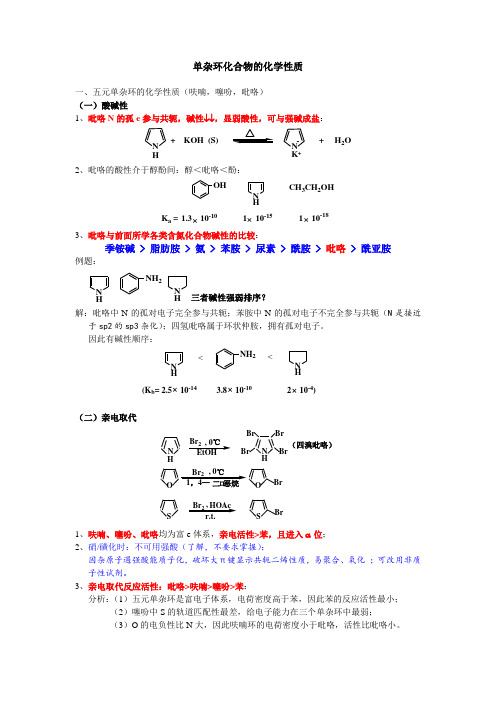
单杂环化合物的化学性质一、五元单杂环的化学性质(呋喃,噻吩,吡咯) (一)酸碱性1、吡咯N 的孤e 参与共轭,碱性↓↓,显弱酸性,可与强碱成盐:+ KOH (S)N K -++ H 2ON H2、吡咯的酸性介于醇酚间:醇<吡咯<酚:N HOHK a =×1.3 10-101 10-181 10-15××CH 3CH 2OH3、吡咯与前面所学各类含氮化合物碱性的比较:季铵碱 > 脂肪胺 > 氨 > 苯胺 > 尿素 > 酰胺 > 吡咯 > 酰亚胺例题:NHN HNH 2三者碱性强弱排序?解:吡咯中N 的孤对电子完全参与共轭;苯胺中N 的孤对电子不完全参与共轭(N 是接近于sp2的sp3杂化);四氢吡咯属于环状仲胺,拥有孤对电子。
因此有碱性顺序:N HNH NH 2<<(K b =×3.8 10-10 2 10-4)2.5 10-14××(二)亲电取代N H O(四溴吡咯)N H Br 2BrBr Br Br, 0℃EtOH Br 2OBrS Br 2HOAcSBr, 0℃,1、呋喃、噻吩、吡咯均为富e 体系,亲电活性>苯,且进入α位;2、硝/磺化时:不可用强酸(了解,不要求掌握):因杂原子遇强酸能质子化,破坏大π键显示共轭二烯性质,易聚合、氧化 ;可改用非质子性试剂。
3、亲电取代反应活性:吡咯>呋喃>噻吩>苯: 分析:(1)五元单杂环是富电子体系,电荷密度高于苯,因此苯的反应活性最小;(2)噻吩中S 的轨道匹配性最差,给电子能力在三个单杂环中最弱;(3)O 的电负性比N 大,因此呋喃环的电荷密度小于吡咯,活性比吡咯小。
(三)加成1、呋喃、噻吩、吡咯芳香性<苯,因此较苯易加成;2、产物失去芳香性,性质类似脂杂环。
N S OHH 2N HH 2H 2H 2H 2N HOS SMoS 2(噻吩能使Pd 中毒)二、六元单杂环的化学性质(吡啶) (一)碱性1、吡啶N 孤e 不参与共轭,因此显碱性:NH Cl -N ++ HCl2、N 孤e 处于sp2杂化轨道,因而碱性↓,碱性介于氨和苯胺之间:CH 3NH 2NH 3NNH 2pK b3.384.768.809.423、与各类含氮化合物碱性比较:季铵碱> 脂胺>氨>吡啶>苯胺>尿素>酰胺>吡咯>酰亚胺(二)亲电取代吡啶属于缺电子体系,环上ρe ↓,因此亲电活性↓,<苯,进入β位:NNBrNO 24SO 3H NN20%71%33%(三)加成(还原)吡啶芳香性<苯,因此比苯易加成(还原),产物为环状仲胺,碱性↑。
医学有机化学--第十一章 杂环化合物

O N N N H
鸟嘌呤(G)(2-氨基-6-羟基嘌呤)
2、尿酸
O HN O N H N H NH O HO N N H N OH N OH
尿酸
2,6,8-三羟基嘌呤
尿酸难溶于水。正常人血浆中含尿酸 2~6mg%。每天由尿中排出0.5~1g。
第十四章
要点
1、杂环化合物的命名结构式的写法
2、五元杂环和六元杂环的化学性质
4-甲 基 嘧 啶
2-羟 基 噻 唑
2-氨 基 咪 唑
5 6 7 8
4 3 N 1 2
CH3
1N
6
NH2
5 3 9 4 7
பைடு நூலகம்
N N H
N
3-甲基异喹啉
6-氨基嘌呤
2、当侧链为羧基、磺酸基、醛基等时:一般把杂环作取代基。
C OOH
C HO O
N
2-呋喃甲醛(糠醛)
3-吡啶甲酸
第二节 五元杂环化合物
一、吡咯、呋喃和噻吩的结构
NO2 N H
O
C H3
N
2-甲基呋喃
α-甲基呋喃
4-丙基吡啶
γ-丙基吡啶
4 3
3-硝基吡咯
β -硝基吡咯
5 6 7 8
C H3
2
3-甲基异喹啉
N
1
②含多个杂原子时:按 O,S,NH,N 的顺序使杂原子的 编号最小。有固定编号的例外。
CH3 4 5 6 N 1 N 3 2
4 5 S 1 N 3 2 OH 4 5 N1 H N3 2 NH2
4.8
8.8
N HC l 或
9.4
+
13.6
N HC l
吡啶盐酸盐
杂环化合物
呋喃、噻吩、吡咯
一个闭合的环状共轭体系
符合休克尔4n+2规则,都具有芳香性
离域能 呋喃、吡咯和噻吩的离域能分别为:
67 kJ· mol-1、 88 kJ· mol-1和117 kJ· mol-1
比苯的离域能(150.5 kJ· mol-1 )低,但比大多数共轭 二烯烃的离域能(约12~28 kJ· mol-1 )要大得多。
Br2
0℃,二
O
口 恶烷
O
Br
(80% )
Cl2
-40℃ , CH3COOH
O
Cl
(64% )
Br2
CH3 COOH
S
Br
(78%)
S
Cl2
50℃
S
Cl
(36%)
I2,HgO
C6H6, 0℃
S
I
(70%)
吡咯极易卤化生成四卤吡咯。
(2)硝化 呋喃和吡咯很易被氧化,遇无机酸容易发生聚合,因而不能 用硝酸硝化。通常用比较温和的非质子硝化试剂,如用硝酸乙酰 酯
茶碱
NH2 N N N N H
咖啡碱
O HN H2N N
可可碱
H N N
腺嘌呤(adenine, A)
鸟嘌呤(guanine, G)
NO2
浓 HNO3
N
o 浓H2SO4, 0C
+
N 50%
N NO2 48%
浓 H2SO4 N 220 C
SO3H
Br
o
N
54%
Br2 , AgSO4 N 浓 H2SO4,
N
+
N 1:1 Br
NO2
浓 HNO3
o N 浓H2SO4, 0C
第十四章杂环化合物与生物碱

有机胺类 如 麻黄碱 等
生物碱 石蒜生物碱 、 长春花生物碱等
第十四章 杂环化合物和生物碱 第二节 生物碱 目录△
二、生物碱的一般性质
(一)性状
生物碱绝大多数是无色的结晶固体,有极少数是无色或有色液 体。如烟碱为液体,小蘖碱是黄色。多数生物碱难溶或不溶于水, 而溶于有机溶剂,如氯仿、乙醚、酒精、丙酮等。它们的盐类一般 均易溶于水。 生物碱一般都有手性,具有旋光性,并多为左旋体和明显的生 理效应。
N H 5.26 × 10-30C. m
O 2.33 × 10-30C. m
S 1.70 × 10-30C. m
N H 6.03 × 10-30C. m
第十四章 杂环化合物和生物碱
第一节 杂环化合物
目录△
3. 化学质 ⑴ 酸碱性
+ KOH(固体) N H
N K+
+ H2O
+ H+ N H H
N H
第一节 杂环化合物
目录△
CH
2
CH2 R
3 4
叶绿素a R= 叶绿素b R= CH2CH3
CH3 CHO
CH3
1
N Mg N
7
N N
5
CH3 H8
CH3
H2C H2C O C
H H O
6
O COOCH3 叶绿醇基
叶绿素
第十四章 杂环化合物和生物碱
第一节 杂环化合物
目录△
(二)吡唑、咪唑和噻唑
N N N H 吡唑 N H 咪唑 S 噻唑 N
H2 , Pd 200~ 400kPa H2 , Pd 150 ℃
α - 苯甲 酰 基 噻 吩
N H
杂环化合物总结
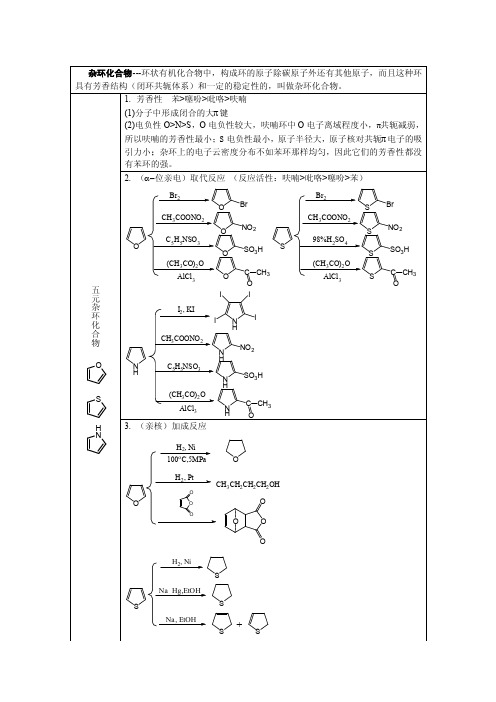
NO2
N
SO3H Br
Br2 H2SO4
+
N
N
Br
KNH2 NH3a, EtOH
N
H
S
S
Na, EtOH
+
S
S
Zn, HAc
N
H2, Ni
H
4. 吡咯的酸碱性
+
N
N
H2, Ni 200oC
N
H
H
H
RMgX
CH3I
N
RH
N
MgXI
N
H
MgX
CH3
KOH,
(1)CO2
(2)H2O
N COOH
N
CO2
K
H O
N H
C OK H3O
N COOH H
C6H5COCl
N O C C6H5
5. 鉴别 呋喃蒸汽遇到被盐酸浸湿过的松木片时,即呈现绿色
噻吩在浓硫酸的存在下,与靛红一同加热显示蓝色
吡咯的蒸汽或其醇溶液,能使进过浓盐酸的松木片变成红色
1. 碱性 (CH3)3N>吡啶>苯胺>吡咯
CH3
+ CH3I
N
280 290oC
+
NI CH3
N CH3 HI
N HI
2. 对氧化作用稳定,氧化侧链
CH2CH3 O
COOH
六
N
N
元 杂
3. 亲电取代,在位,不发生酰基化,烷基化反应
环
Br
化
Br2
合 物
N
N SO3H
H2SO4
N
N
NO2
H2SO4 HNO3 N
含氮杂环化合物碱性排序

含氮杂环化合物碱性排序
新近,有位朋友曾和我提到“氮杂环化合物碱性排序”这个词,对此,我们一
时间都有些不知所措,因为,它让我们感到这个世界之大。
“氮杂环化合物碱性排序”是指由多种氮杂环取代羰基等基团而成的类似化合物,在物理性质和化学反应上,具有一系列重要的特性,因此,有关氮杂环化合物碱性排序的研究得到了广泛的应用和发展,对我们的生活有很大的作用。
“氮杂环化合物碱性排序”的基础上,我们可以运用某种特定的分类办法,将
它们按碱性程度进行排序,是有秩序组织和分析的过程。
这里,主要涉及到以下几种类型:甲基环丙烷、吡咯烷等单环外极碱类,阿拉伯烷基铵等共环外极碱类,吩环烷二胺等芳环碱类,以及芳基事列等混合碱素类。
我们可以大胆设想:此类排序似乎涉及到的学科范围太广,但是,如果能够深
入了解“氮杂环化合物碱性排序”,一定会带给我们很多惊喜;与此同时,它也蕴藏着诸多科学研究的可能性,特别是在生活娱乐方面,它也可以起到不可估量的作用。
综上所述,“氮杂环化合物碱性排序”尚未在我们的日常生活当中被完全把握,但关注它的重要性,让我们有机会去新的领域探索、思考,生活变得有趣而又充实有活力。
杂环化合物及生物碱

H2O C2H5OH i-pr-OH 吡咯
pka 15.7 15.9
~18
16.5
+H
N
N
H
ether + C2H5MgBr N H
+ C2H6 N
MgBr
溴化吡咯镁
吡啶:弱碱,碱性比苯胺强,与强酸 生成盐:
+ HCl
N
N
HCl
用化学方法鉴别: 苯和吡啶;
均相溶液
盐酸
N
分层 N
吡啶和六氢吡啶。
浓H2SO4
+ KNO3 N
NO2 N
完成下列化学反应方程式:
1) O
CH3COONO2 C2H5
OCH3
2) S
HNO3 H2SO4
NO2 3)
S
Br2 醋酸
4)
(CH3CO)2O
N
~200℃
H
吡啶化学活泼性比苯环小,不发生付 -克烃基化和酰化反应。
N
浓H2SO4 N 浓HNO3
OH
N
NO2 Fe/HCl N
一 杂环化合物的分类和命名
根据环母体所 含环的数目
根据杂环是否 有芳香性
单杂环 稠杂环£
芳香杂环
无芳香性杂环
译音命名法: ⑴ 用带口旁的英文名称的同音汉字表
示环,环可作为母体和取代基:
O
S
呋喃
噻吩
(furan) (thiophene)
N H 吡咯 (pyrrole)
N
吡啶 (pyridine)
⑵ 环的编号从杂原子开始:
醋酸-苯胺 红色
O CHO
鉴定糠醛
2. 吲哚和喹啉:
第十四章杂环化合物与生物碱

N H
54
β
3
5 6
6 7
12 α
7 8
N
H
γ
43 β
5
6 12 α N
γ
43β
2
1α N
N
6 1
5
23 4
N
N
7
8 9
N H
第十四章 杂环化合物和生物碱
第一节 杂环化合物 目录△
(三)杂环化合物的命名
O2N S
2 - 硝基噻吩 α - 硝基噻吩
CH3
N 4 - 甲基吡啶 β - 甲基吡啶
2. 系统命名法
系统命名法是在碳环名称前加上杂原子的名称,称为:×杂×× 例如:吡啶的系统名称为:氮杂苯 or 氮苯
(二)杂环母核的编号规则
1. 单个杂原子杂环 2. 多个杂原子杂环 3. 苯稠杂环 4. 稠杂环
第十四章 杂环化合物和生物碱 第一节 杂环化合物 目录△
β4 3β α 51 2α
O
N3 4
4
C H2C H3
Mg
CH3 H
8
N
N 5 CH3
7
6
H2C
H H
O
H 2C C O O C H 3 叶绿醇基
OC O
叶绿素
R= C H3 R= C HO
C6H5
S N
5 - 苯基噻唑
N OH 8 - 羟基喹啉
Br
N
N
H2N
N
N NH2 H
2 , 6 - 二氨基 - 6 - 溴嘌呤
N
N
CH3
β -[2-(N-甲基吡咯烷基)]吡啶
第十四章 杂环化合物和生物碱 第一节 杂环化合物 目录△
杂环化合物与生物碱2

(二)杂环母环的编号规则
含一个杂原子的杂环,从杂原子开始用阿拉 伯数字或从靠近杂原子的碳原子开始用希腊 字母编号。
43
5
2CH3
O
1
4
5
3
6 N2
1
43
5
2
NH1
2-甲基呋喃
吡啶
吡咯
如有几个不同的杂原子时,则按O、S、-NH-、 -N=的先后顺序编号,并使杂原子的编号尽可 能小。
cN db
Sa
1
3 2
d c
N ba
NN
b3
a 21 NN
H
苯并[d]噻唑 吡啶并[2,3-d]嘧啶 吡咯并[2,3-b ]吡
啶
N
1
3 2
d c
N a bN
N
N b a
1 2
SN
N a cb 3 2 1N
吡嗪并[2,3- d ]哒嗪 咪唑并[2,1-b]噻唑
吡啶并[2,3-c]喹啉
4、稠环体系的周边编号
N
N
N
N
H
CHO O
6-氨基嘌呤
2-呋喃甲醛 α-
N
N SH CH3
1-甲基-2-巯基咪唑
β Nα
2 N1 CH3
β-[2-(N-甲基)吡咯啶基]吡啶
CH3
5 6S
4
N
4-甲基吡啶 γ-
9
N 10 1
CH2CH(CH3)N(CH3)2.HCl
10-(2-二甲氨基丙基)吩噻嗪盐酸盐
•
•
Phenobarbital):
2、稠边位置的标示
先按各杂环原来的编号顺序,在基本环各边 标以英文字母a、b、c…,附加环各原子标以1、 2、3…
杂环化合物的碱性顺序总结

杂环化合物的碱性顺序总结
排序应该是:a>c>d>b(吸电子效应,羰基>Cl>OH)。
脂肪胺的碱性强于芳香胺,更强与氮杂芳环的碱性。
所以哌啶的碱性最强。
吡咯的氮的孤对电子参与芳环共轭,但是吡啶类氮原子不参与,有孤对电子,所以吡咯的碱性最弱。
杂环胺碱性比较,应该就是比较氮原子上的那一对孤对电子的活性。
a中N 原子上的孤对电子与共轭双键形成芳香体系,所以,孤对电子的活性最低;b中N原子参与成键了,然后它的那一对孤对电子是在芳香体系外边的,与π键是垂直的关系,基本不受影响。
按碳原子数:
最常见的杂环化合物是五元和六元杂环及苯并杂环化合物等。
五元杂环化合物有:呋喃、噻吩、吡咯、噻唑、咪唑等。
六元杂环化合物有:吡啶、吡嗪、嘧啶、哒嗪等。
稠环杂环化合物有:吲哚、喹啉、蝶啶、吖啶等。
杂环化合物中,最小的杂环为三元环,最常见的是五、六元环,其次是七元环。
杂环的成环规律和碳环一样,最稳定、最常见的杂环也是五元或六元的。
杂环化合物碱性强弱顺序

杂环化合物碱性强弱顺序
碱性是指某物质是亲碱性的程度,也就是说,碱性越高,则越容易形成共轭酸基,使溶液变酸,这是由氢离子换离产生的。
在有机化学中,碱性强弱的顺序主要是指杂环化合物的碱性强弱顺序,它定义着在有机化学反应中各类核碱的反应优势。
代表性的杂环化合物的碱性强弱顺序如下,由强到弱:环氧醇>环内酰胺>苯环内酰胺>苯酚>三环内酰胺>环烷基酸>三环酰胺>环烯酰胺>芳香环内酰胺>四环酰胺>四环烯酰胺>四环环烷。
一般来说,碱性越强的物质更容易形成共轭酸基,使溶液变酸,同样也可以用电离常数更好地反映碱性强弱。
结果发现,电离常数与碱性强弱之间有着较好的相关性,即电离常数越大,碱性越高,反之,电离常数越小,碱性越低。
因此,我们可以大致按照以上杂环化合物的电离常数从大到小的顺序归类,以确定各种杂环化合物的碱性强弱顺序。
另外,由于在不同的反应中,物质可能会发生变化,这可能会影响物质的碱性。
比如,某些化学反应会产生活性基团,例如:羟基团或氧基团,而这些活性基团会增强物质的碱性,对此不利的是,当一种化合物中同时含有碱性和酸性活性基团时,比较困难判断它的碱性强弱。
因此,总之,通过研究不同杂环化合物的电离常数可以大致确
定它们的碱性强弱顺序,但是,它们在不同的反应中的碱性强弱可能也不同,应该根据实际情况来判断。
第12章 杂环化合物和生物碱

O
2p
2s ↓ ↑ ↓ ↑ ↑ ↑
sp 杂化 ↓ ↑ ↑ ↑
2
2p ↓ ↑
末杂化
呋 喃
O
能量
O:1s22s22p4
S 2p 2s ↓ ↑ 能量 ↓↑↑ ↑ sp 杂化 ↓ ↑ ↑↑
2
2p ↓ ↑
噻 吩
S
末杂化
S:1s22s22p63s23p4
N
2p 2s ↓ ↑ 能量 ↑ ↑ ↑
sp2 杂化 ↑ ↑ ↑
CONH2
CHO O
SO3H S
N 3-吡啶甲酰胺
2-呋喃甲醛
2-噻吩磺酸
二、杂环化合物的命名
OH SO3H
N
CH2COOH N H
5-羟基-3-喹啉磺酸
N N COOCH3
3-吲哚乙酸
2-嘧啶甲酸甲酯
二、杂环化合物的命名
(5)有些稠杂环有特定的编号。
6 5 7
1N
N
8
8 7
6 5
9
1
2
2
N
3
吡啶与无机酸反应生成盐,但产物遇 水即分解:
+ HCl
N
N
. HCl
三、氧化反应
吡啶比苯稳定,不易被氧化,一般 都是侧链被氧化,而杂环不被破坏, 结果生成吡啶甲酸。
CH3 N
KMnO4
COOH N
OHHNO3
COOH N COOH
N
△
四、取代反应
1.卤代反应
呋喃、噻吩和吡咯环中的杂原子上 的未共用电子对参与了环的共轭体 系,使环上的电子云密度增加,故 它们都比苯容易发生亲电取代反应, 取代通常发生在α位上。 亲电取代反应的活性:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
杂环化合物的碱性顺序总结
排序应该是:a>c>d>b(吸电子效应,羰基>Cl>OH)。
脂肪胺的碱性强于芳香胺,更强与氮杂芳环的碱性。
所以哌啶的碱性最强。
吡咯的氮的孤对电子参与芳环共轭,但是吡啶类氮原子不参与,有孤对电子,所以吡咯的碱性最弱。
杂环胺碱性比较,应该就是比较氮原子上的那一对孤对电子的活性。
a中N 原子上的孤对电子与共轭双键形成芳香体系,所以,孤对电子的活性最低;b中N原子参与成键了,然后它的那一对孤对电子是在芳香体系外边的,与π键是垂直的关系,基本不受影响。
按碳原子数:
最常见的杂环化合物是五元和六元杂环及苯并杂环化合物等。
五元杂环化合物有:呋喃、噻吩、吡咯、噻唑、咪唑等。
六元杂环化合物有:吡啶、吡嗪、嘧啶、哒嗪等。
稠环杂环化合物有:吲哚、喹啉、蝶啶、吖啶等。
杂环化合物中,最小的杂环为三元环,最常见的是五、六元环,其次是七元环。
杂环的成环规律和碳环一样,最稳定、最常见的杂环也是五元或六元的。
