化学竞赛-课件-12夏令营第十四讲共104页文档
合集下载
高中化学竞赛辅导班全部PPT辅导讲义[全套]:化学竞赛解题方法
![高中化学竞赛辅导班全部PPT辅导讲义[全套]:化学竞赛解题方法](https://img.taocdn.com/s3/m/285f5232eefdc8d376ee3284.png)
化学竞赛试题的解题方法
逆推法 假设法 分析法 排除法 类比法
逆推法
(1999)化合物C是生命体中广泛 存在的一种物质,它的人工合成方 法是: (1)在催化剂存在下甲醇与氨气 反应得到A。 (2)在催化剂存在下乙烯跟氧气 反应得到B。 (3)在水存在下A和B反应得到C 。C的脱水产物的结构如下:
C B
H
处理加工信息的能力
第4题(10分)去年报道,在-55℃令XeF4(A)和C6F5BF2(B)化合 ,得一离子化合物(C),测得Xe的质量分数为31%,阴离子为四氟硼酸 根离子,阳离子结构中有B的苯环。C是首例有机氙(IV)化合物,- 20℃以下稳定。C为强氟化剂和强氧化剂,如与碘反应得到五氟化碘,放 出氙,同时得到B。 4-1 写出 C的化学式,正负离子应分开写。答: 4-2 根据什么结构特征把 C归为有机氙比合物?答: 4-3 写出 C的合成反应方程式。答: 4-4 写出 C和碘的反应。答: 4-5 画出五氟化碘分子的立体结构:答:
特点之二:题目信息量大,但书写量小
特点之三:注重物质的空间构型
今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。 在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干, 一层镁一层硼地相间,图5-1是该晶体微观空间中取出的部分原子沿C轴 方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁 原子投影在同一平面上。 5-1 由图5-1可确定硼化镁的化学式为: 。 5-2 在图5-l右边的方框里画出硼化镁的一个晶胞的透视图,标出该晶 胞内面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球, 硼原子用小黑球表示)。
CH3OH + NH3 CH2 CH2 + O2 O (CH3)3N CH2 CH2
高中化学竞赛辅导全套课件

2HIO3= I2O5+H 2O
I2O5+5CO=I2+5CO2 可以制I2 定量检测CO
O
结构:
O I O I O
O
1.5.2 含氧酸及其盐
基本种类为HOX HXO2 HXO3 HXO4 不同价态的含氧酸的命名:
HBrO4
高
HBrO3
正
HBrO2
亚
HBrO
次
F只有HOF而且不稳定,I无HIO2 能提出纯物
卤化物水解的一般规律:
δ+δδ+δ-
IF5+5HOH
I(OH)5+5HF
氟化剂:2MO+2BrF3=2MnF 2+Br 2+O2+F 2 价键理论: XX` 不杂化
XX`3 XX`3 sp3d sp3d2
XX`7
sp3d3
1.4.3 多卤化物
金属卤化物+卤素互化物
如:I2+I¯
多卤化物
I3¯ K = 730 问题:为什么多卤化物以I的为多,F的最少? 因为多卤化物形成的条件是分子的极化能大于卤化物 的晶格能。I2的极化率高,晶格能低,氟化物晶格能 高,极化率低,不易形成多卤化物
H的I1如何计算? 13.6x1.602x10-19x6.022x1023=1312KJ∙mol-1 > Cl、Br、I的I1 为什么没有Cl+、Br+、I +呢? 回答:H+为全空,Cl+、Br+、I+为nS2nP4不稳定。 卤素的成键特征:有配位能力 AgCl+Cl =[AgCl2] 共价键
1.1 单质
AgCN+CN¯ =[Ag(CN)2]¯ CN¯ 有极强的配位能力,可使一些不溶于水的氰化物溶于
I2O5+5CO=I2+5CO2 可以制I2 定量检测CO
O
结构:
O I O I O
O
1.5.2 含氧酸及其盐
基本种类为HOX HXO2 HXO3 HXO4 不同价态的含氧酸的命名:
HBrO4
高
HBrO3
正
HBrO2
亚
HBrO
次
F只有HOF而且不稳定,I无HIO2 能提出纯物
卤化物水解的一般规律:
δ+δδ+δ-
IF5+5HOH
I(OH)5+5HF
氟化剂:2MO+2BrF3=2MnF 2+Br 2+O2+F 2 价键理论: XX` 不杂化
XX`3 XX`3 sp3d sp3d2
XX`7
sp3d3
1.4.3 多卤化物
金属卤化物+卤素互化物
如:I2+I¯
多卤化物
I3¯ K = 730 问题:为什么多卤化物以I的为多,F的最少? 因为多卤化物形成的条件是分子的极化能大于卤化物 的晶格能。I2的极化率高,晶格能低,氟化物晶格能 高,极化率低,不易形成多卤化物
H的I1如何计算? 13.6x1.602x10-19x6.022x1023=1312KJ∙mol-1 > Cl、Br、I的I1 为什么没有Cl+、Br+、I +呢? 回答:H+为全空,Cl+、Br+、I+为nS2nP4不稳定。 卤素的成键特征:有配位能力 AgCl+Cl =[AgCl2] 共价键
1.1 单质
AgCN+CN¯ =[Ag(CN)2]¯ CN¯ 有极强的配位能力,可使一些不溶于水的氰化物溶于
高中化学竞赛夏令营课件:定量分析化学基础

目前还有一种以聚四氟乙烯塑 料作活塞的新型滴定管,因其耐酸 耐碱又耐腐蚀,可以放置几乎所有
的分析试剂。
2019/11/24
定量化学分析基础
26
2.2使用 1)操作步骤
检漏 洗涤(自来水、蒸馏水、待装液) 装液赶 气泡 初读(准确至0.01mL) 滴定终读 2)酸式滴定管
(a) 擦干活塞窝 (b) 活塞涂凡士林 (c) 旋转活塞至透明
(2)
(3)
(1)精密度与正确度均高;
(2)精密度很高,但准确度不高;
(3) 精密度与准确度均不高;
2019/11/24
定量化学分析基础
8
甲 精密度与准确度均高; 乙 精密度高但准确度较低; 丙 精密度与准确度均低; 丁 精确度很低,准确度较高;
显然,测定结果的精密度高不一定准确度也 高, 而欲得高准确度的测定结果,则必须有高的 精密度来保证。分析结果要求在高精密度下的高 正确度。
察终点有误、观察先入为主等)
2019/11/24
定量化学分析基础
11
2)系统误差的特点
具有单向性和重复性 由于产生系统误差的原因是固定的, 测定结果系统地偏高或系统地偏低;重复 测定时,它会重复出现。 理论上讲,只要找到原因,就可以消 除系统误差对测定结果的影响。 因此,系统误差又称可测误差。
2019/11/24
2019/11/24
定量化学分析基础
20
2. 有效数字的运算规则
2.1数字修约 确定有效数字位数后对多余位数的舍弃 过程,其修约规则为:
四舍六入五留双
当尾数<5时舍弃;尾数>5时则进位;尾数=5时,按 5前面为偶数者舍弃;为奇数者进位,即始终修约为 偶数。如修约四位有效数字:
的分析试剂。
2019/11/24
定量化学分析基础
26
2.2使用 1)操作步骤
检漏 洗涤(自来水、蒸馏水、待装液) 装液赶 气泡 初读(准确至0.01mL) 滴定终读 2)酸式滴定管
(a) 擦干活塞窝 (b) 活塞涂凡士林 (c) 旋转活塞至透明
(2)
(3)
(1)精密度与正确度均高;
(2)精密度很高,但准确度不高;
(3) 精密度与准确度均不高;
2019/11/24
定量化学分析基础
8
甲 精密度与准确度均高; 乙 精密度高但准确度较低; 丙 精密度与准确度均低; 丁 精确度很低,准确度较高;
显然,测定结果的精密度高不一定准确度也 高, 而欲得高准确度的测定结果,则必须有高的 精密度来保证。分析结果要求在高精密度下的高 正确度。
察终点有误、观察先入为主等)
2019/11/24
定量化学分析基础
11
2)系统误差的特点
具有单向性和重复性 由于产生系统误差的原因是固定的, 测定结果系统地偏高或系统地偏低;重复 测定时,它会重复出现。 理论上讲,只要找到原因,就可以消 除系统误差对测定结果的影响。 因此,系统误差又称可测误差。
2019/11/24
2019/11/24
定量化学分析基础
20
2. 有效数字的运算规则
2.1数字修约 确定有效数字位数后对多余位数的舍弃 过程,其修约规则为:
四舍六入五留双
当尾数<5时舍弃;尾数>5时则进位;尾数=5时,按 5前面为偶数者舍弃;为奇数者进位,即始终修约为 偶数。如修约四位有效数字:
初中化学竞赛辅导培训PPT课件(初中科学)

1、物质结构的生长点
(1)原子组成和各微粒间量的关系
(2)1~18号元素原子核外电子排布
(3)元素的化合价应用
例题:若原子核外电子排布的基本规律为最外
层电子数不超过5个,次外层电子数不超过10个,
倒数第三层电子数不超过15个,而各电子层电子
的最大容量仍为2n2,写出并判断第三、四、五
周期的元素分别有
②对于原子: a、质子数=核电核数=核外电子数=原子序数 b、质量数=质子数+中子数;即A=Z+N
赛题举例:(9—6复).我国近年研制成功
一种气体,这种气体的每个分子由质子数为
8、相对原子质量为18的两个原子构成。下
列说法错误的是
()
A.这种气体的相对分子质量为36
B.这种原子的核外不一定有8个电子
均不同;③N2H4是一种化合物;④该反应中 N2O4是还原剂。 则下列选项正确的是 A.①② B.②③ C.①③ D.③④
3、化学反应分类及原理的生长点
(1)氧化还原反应
①判断是否是氧化还原反应 ②判断氧化剂、还原剂等 ③电子转移情况的表示 ④配平问题和得失守恒计算 ⑤氧化性、还原性强弱比较
氧化剂:得到电子(即化合价降低)的反应物 还原剂:失去电子(即化合价升高)的反应物
分
放热反应
热化学方程式
3、化学反应分类及原理的生长点
赛题举例(11—3复)在化学反应aZn+
bHNO3(稀) = cZn(NO3)2+d NO↑+eH2O中, 若e的值为4,则d的值为 ( )
A.1 B. 2 C. 3
D. 4
(11—6初)关于化学反应2N2H4+N2O4= 3N2+4H2O的有关说法: ①该反应属于置换反 应;②该反应中三种含氮物质的氮元素化合价
初中化学竞赛辅导PPT课件

位时间内产生的气体多,赛专题辅导
身第二讲
碳和碳的氧化物【要点归纳】
1、熟悉C、CO、CO2及碳的化合物的性质,能应用它 们之间的相互关系分析和解决实际问题。
2、正确选择制取CO2的方法和装置,并能迁移应用于 其它气体的制法。
(2)先分离出CO,关闭___B_____,打开____A____,发 生反应的化学方程式为_C_O_2_+Ca(OH)2=CaCO3↓+H2O
(或2NaOH+CO2=Na2CO3+H2O)
(3)再分离出CO2,关闭____A____,打开____B____,发生 反应的化学方程式为___C_a_C_O__3+_2_H__C_l=__C_a。Cl2+H2O+CO2↑
是
2NaOH+ CO2=。Na2CO3 +H2O
小明思考:瓶能吞蛋,能不能吐蛋呢?他进行了如下图2的实验, 结果鸡蛋吐了出来。
他加入的试剂p是 稀盐酸,(或稀硫酸等
反应的化学方程式
Na2CO3+ 等反应)
2HCl
=
2NaCl
+H2O
+,CO2↑(或与稀硫酸
吐蛋的原因是
产生的气体,使瓶内压强增有200cm3CO2、CO、O2的混合气体(标准状 况下),假设其中CO2为Xcm3,CO为Ycm3,其余为02(过 量)。某校初三化学实验小组利用以下实验仪器,组装成
一套实验装置,用来测定混合气体中各请回答下列问题:
(1)从针筒压出的气体,从左到右流过的装置连接
(2)鸡蛋是一种具有生命的有机体,它能吸进氧气,
呼出二氧化碳。鸡蛋壳内的气室中二氧化碳的质量分数
应鸡将 入该蛋一盛大完个有于整新石鲜灰空性鸡水气的蛋的中前放试二提入管氧下盛中化,有,水石碳证的灰的明大水质这烧逐量种杯渐分推中变数断加浑热。的,你合将怎理产样性生在:的不气体破导坏 ________。
化学竞赛辅导ppt资料

5.欲鉴别澄清石灰水、盐酸和蒸馏水三瓶失去标
签的无色液体,提供的试剂有:①碳酸钠溶液 ②
紫色石蕊试液 ③无色酚酞试液,只用一种试剂可
将它们鉴别出来的是( ) D
A.只有①
B.只有②
C.①或②
D.①或②或③
第五页,编辑于星期五:十四点 分。
6.若按粗盐提纯的实验步骤对下列各组物质进
行分离,可以达到目的的是( )CD A.从空气中分离出氧气 B.将混入硝酸钾中少量的氯化钠除去
C.从草木灰中提取碳酸钾 D.从氯酸钾制取氧气的残渣中,回收二氧化锰和 氯化钾
第六页,编辑于星期五:十四点 分。
7.下列各组稀溶液中,利用组内物质的相互反 应,就能将各种物质鉴别出来的是( C ) A.Na2CO3、H2SO4、HCl、KNO3 B.CuSO4、KOH、NaCl、NaOH C.Na2SO4、Na2CO3、BaCl2、HNO3 D.NaNO3、MgCl2、KCl、Ba(OH)2
第七页,编辑于星期五:十四点 分。
8.下列各组物质的溶液,不另加任何试剂就能将 它们区别开来的是( )AC
A.CuSO4 HCI NaOH B.KNO3 MgCl2 NaOH
C.Na2CO3 HCl BaCl2
D.NaCl AgNO3 HCl
第八页,编辑于星期五:十四点 分。
9.除去下列物质中的杂质所用的试剂和方法不正
B.④①②⑤③
C.②⑤④①③
D.⑤②④①③
第二页,编辑于星期五:十四点 分。
2.下表是小江同学用多种方法来鉴别物质的情
况,其中完全正确的是 ( ) C 产生白色沉淀,不溶于HNO3
现有一液体推进剂以醇(含碳52%,含氢13%,含氧35%)为燃料,质量分数为90%的H2O2做氧化剂,欲使1Kg该醇燃料完全燃烧,计算 需消耗质量分数为90%的H2O2的质量。
夏令营奥赛化学讲座
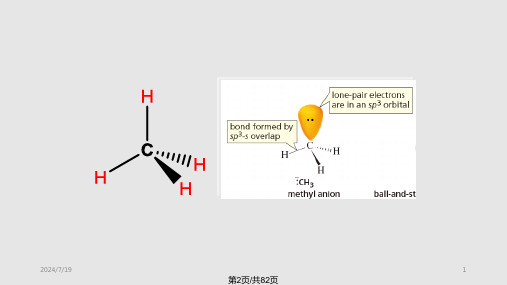
• 构造相同,构型不同并且互呈镜象对映关系的立体异构现象称为对映异构。 • 对映异构体最显著的特点是对平面偏振光的旋光性不同,因此也常把对映异构称为旋光异构或光学异构。
平面偏振光 光是一种电磁波,光波的振动方向与其前进方向
垂直。 普通光在所有垂直于其前进方向的平面上振动。
第9页/共82页
第10页/共82页
第19页/共82页
第20页/共82页
• 手性是判断化合物分子是否具有对映异构(或光学异构)必要和充分的条件,分子具有手性,就一定有对映异构, 而且一定具有旋光性。
• 判断化合物分子是否具有手性,只需要判断分子是否具有对称面和对称中心,凡是化合物分子既不具有对称面, 又不具有对称中心,一般就是手性分子。
H CHH3 CH
3
H CH 3
H
H CH 3
H CH3H
H CH 3
H
H
HH3C H H CH3
H CH3
H
HH
HH H
H HH
H
H
H
CH3
H
H
H CH
3
HH3C H
HH H H H
φ=0º,360º φ=60°
全重叠式 顺交叉式
A
B
φ=120° φ=180° φ=240° φ=300°
部分重叠式 反交叉式 部分重叠式 顺交叉式
CH2=CHCH2
P+ C6H5 Br C6H4OH
Br C6H5 P+ HO C 6 H 4
C6H5
CH 3 NO C2H5
CH 3 O N C6H5
C2H5
第25页/共82页
伯、仲、叔、季碳原子
2024/7/19
2020化学竞赛·有机化学(基础版)·第十四章(高分子化合物)[12 PPT]
![2020化学竞赛·有机化学(基础版)·第十四章(高分子化合物)[12 PPT]](https://img.taocdn.com/s3/m/c7f3b0934693daef5ef73dbc.png)
第一轮复习应讲究记忆,理解与否取决于个人天赋,不可强求。很多同学初学有机常会觉得很多困惑,其实这 是相当正常的,只要坚持不懈的反复看和理解,揣摩,自己是完全有能力学会的,但不建议第一轮复习的时候就什 么都搞懂,一来不实际,二来也相当耗费时间和精力。
第二轮复习应讲究记忆上的理解,稍加一些练习,习题难度不宜过难。对于一些第一次未看的章节要通读一遍, 还是讲究记忆为主,对于难点,重要点,应该反复看加 深印象,比如:羰基化合物,羧酸衍生物等章节。这轮推 荐的书目可以加深一些,比如高教出版社的《有机化学》以及《基础有机化学》。要注意的是,初赛复赛都 不考 反应机理,对于反应机理的揣摩应重在基本理解,记忆一些机理的分类,机理的大致过程以及中间态,但并不需要 对于机理进行严格的记忆以及推导重复,因为 这是一个漫长的过程,有心的同学可以把机理进行总结,这是有机 的核心。第二轮复习一般需要需要看几遍书,习题以课后的习题为主,仍然不建议所有的都看懂, 对于细节允许 有不明白的地方,一切以效率为主
中学生化学奥林匹克竞赛 常见缩写与符号
Ac 乙酰基 CH3CO— Ar 芳基,Ar— n-Bu 正丁基 E 亲电试剂 Et 乙基 Nu 亲核试剂 Ph 苯基 R 烷基 Mt 甲基 Pr 丙基
Δ 反应中的加热符号
一.基本概念 单体、链节、聚合度
(1)结构单元(链节):高聚物中重复出现的最小 的结构.
nCH2 CH2
( CH2 CH2 )n (反应中无小分子放出)
1、缩聚反应的特点
每个单体必须带有两个以上的活性基团。 多数反应是可逆反应,反应中有低分子生成。 缩聚反应是通过一连串反应来完成
2、单体的结构
OH
H
H
H
H2N(CH2)nNH2 HOOC(CH2)nCOOH HOOC(CH2)nNH2 HO(CH2)nOH
第二轮复习应讲究记忆上的理解,稍加一些练习,习题难度不宜过难。对于一些第一次未看的章节要通读一遍, 还是讲究记忆为主,对于难点,重要点,应该反复看加 深印象,比如:羰基化合物,羧酸衍生物等章节。这轮推 荐的书目可以加深一些,比如高教出版社的《有机化学》以及《基础有机化学》。要注意的是,初赛复赛都 不考 反应机理,对于反应机理的揣摩应重在基本理解,记忆一些机理的分类,机理的大致过程以及中间态,但并不需要 对于机理进行严格的记忆以及推导重复,因为 这是一个漫长的过程,有心的同学可以把机理进行总结,这是有机 的核心。第二轮复习一般需要需要看几遍书,习题以课后的习题为主,仍然不建议所有的都看懂, 对于细节允许 有不明白的地方,一切以效率为主
中学生化学奥林匹克竞赛 常见缩写与符号
Ac 乙酰基 CH3CO— Ar 芳基,Ar— n-Bu 正丁基 E 亲电试剂 Et 乙基 Nu 亲核试剂 Ph 苯基 R 烷基 Mt 甲基 Pr 丙基
Δ 反应中的加热符号
一.基本概念 单体、链节、聚合度
(1)结构单元(链节):高聚物中重复出现的最小 的结构.
nCH2 CH2
( CH2 CH2 )n (反应中无小分子放出)
1、缩聚反应的特点
每个单体必须带有两个以上的活性基团。 多数反应是可逆反应,反应中有低分子生成。 缩聚反应是通过一连串反应来完成
2、单体的结构
OH
H
H
H
H2N(CH2)nNH2 HOOC(CH2)nCOOH HOOC(CH2)nNH2 HO(CH2)nOH
化学竞赛夏令营分子结构

化学竞赛夏令营分子 结构
13.09.2023
2
什么是物质结构
{ • 物质
颗粒物质
宏观物质(生物体、机械建筑、天体…) 介观物质(原子、分子、分子聚集体)
能量(场) 微观物质(原子核、电子、基本粒子…)
国际著名学术期刊《STRUCTURE》- 建筑结构 国际著名学术期刊《MOLECULAR STRUCTURE》- 分子结构
原 子 的 能 量 之 和 Ea+Eb , 称 为 推 斥 态 , 不 能 形 成
H2 分子。
若电子自旋反平行的两个氢原子靠近时,两核间
的电子云密度大,系统的能量E 逐渐降低,并低于
两个孤立氢原子的能量之和,称为吸引态。
当两个氢原子的核间距L = 74 pm时,其能量达
到
最低点,Es = 436 kJmol1,两个氢原子之间形
13.09.2023
30
分子轨道和原子轨道一样是一个描述核外电子运动
状态的波函数,两者的区别在于原子轨道是以一
个原子的原子核为中心,描述电子在其周围的运动 状态,而分子轨道是以两个或更多个原子核作为中
心。每个分子轨道i有一个相应的能量Ei。若分子
的总能量为E,则
E = ∑Ni Ei
其中Ni为i 轨道上的电子数目,Ei为i轨道被一个
一方面降低了两核间的正电排斥,另一方面又 增强了两核对电子云密度大的区域的吸引,这 都有利于体系势能的降低,有利于形成稳定的 化学键。
13.09.2023
17
1931年美国化学家鲍林和斯莱特将 其处理H2分子的方法推广应用于其他分 子系统而发展成为价键理论(valence bond theory),简称VB法或电子配对法。
离子键(ionic bond)理论是1916年德国 化学家柯塞尔(W.Kossel)提出的,他认 为原子在反应中失去或得到电子以达到 稀有气体的稳定结构,由此形成的正离 子(positive ion)和负离子(negative ion)以静电引力相互吸引在一起。
13.09.2023
2
什么是物质结构
{ • 物质
颗粒物质
宏观物质(生物体、机械建筑、天体…) 介观物质(原子、分子、分子聚集体)
能量(场) 微观物质(原子核、电子、基本粒子…)
国际著名学术期刊《STRUCTURE》- 建筑结构 国际著名学术期刊《MOLECULAR STRUCTURE》- 分子结构
原 子 的 能 量 之 和 Ea+Eb , 称 为 推 斥 态 , 不 能 形 成
H2 分子。
若电子自旋反平行的两个氢原子靠近时,两核间
的电子云密度大,系统的能量E 逐渐降低,并低于
两个孤立氢原子的能量之和,称为吸引态。
当两个氢原子的核间距L = 74 pm时,其能量达
到
最低点,Es = 436 kJmol1,两个氢原子之间形
13.09.2023
30
分子轨道和原子轨道一样是一个描述核外电子运动
状态的波函数,两者的区别在于原子轨道是以一
个原子的原子核为中心,描述电子在其周围的运动 状态,而分子轨道是以两个或更多个原子核作为中
心。每个分子轨道i有一个相应的能量Ei。若分子
的总能量为E,则
E = ∑Ni Ei
其中Ni为i 轨道上的电子数目,Ei为i轨道被一个
一方面降低了两核间的正电排斥,另一方面又 增强了两核对电子云密度大的区域的吸引,这 都有利于体系势能的降低,有利于形成稳定的 化学键。
13.09.2023
17
1931年美国化学家鲍林和斯莱特将 其处理H2分子的方法推广应用于其他分 子系统而发展成为价键理论(valence bond theory),简称VB法或电子配对法。
离子键(ionic bond)理论是1916年德国 化学家柯塞尔(W.Kossel)提出的,他认 为原子在反应中失去或得到电子以达到 稀有气体的稳定结构,由此形成的正离 子(positive ion)和负离子(negative ion)以静电引力相互吸引在一起。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
拉
60、生活的道路一旦选定,就要勇敢地 走到底 ,决不 回头。 ——左
化学竞赛-课件-12夏令营第十四讲
56、死去何所道,托体同山阿。 57、春秋多佳日,登高赋新诗。 58、种豆南山下,草盛豆苗稀。晨兴 理荒秽 ,带月 荷锄归 。道狭 草木长 ,夕露 沾我衣 。衣沾 不足惜 ,但使 愿无违 。 59、相见无杂言,但道桑麻长。 60、迢迢新秋夕,亭亭月将圆。
56、书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许多人连一 次也不 善于度 过。— —吕凯 特 58好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
60、生活的道路一旦选定,就要勇敢地 走到底 ,决不 回头。 ——左
化学竞赛-课件-12夏令营第十四讲
56、死去何所道,托体同山阿。 57、春秋多佳日,登高赋新诗。 58、种豆南山下,草盛豆苗稀。晨兴 理荒秽 ,带月 荷锄归 。道狭 草木长 ,夕露 沾我衣 。衣沾 不足惜 ,但使 愿无违 。 59、相见无杂言,但道桑麻长。 60、迢迢新秋夕,亭亭月将圆。
56、书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许多人连一 次也不 善于度 过。— —吕凯 特 58好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
