复旦大学 化学系 高翔老师 课件 有机化学(上)第三章-3
合集下载
复旦大学有机化学

甲烷与其它卤素的反应
CH 4
+
X2
hv or ∆
CH 3 X CHX 3
+ +
CH 2 X 2 + CX 4
+ +
HX
CH 4 ( 过 量 ) + CH 4
+
X2
hv or ∆ hv or ∆
CH 3 X CX 4
+
HX HX
X 2( 过 量 )
反应速率: 反应速率: F2 > Cl2 > Br2 > I2 (不反应) 不反应) F2 :反应过分剧烈、较难控制 反应过分剧烈、 Cl2 :正常(常温下可发生反应) 正常(常温下可发生反应) Br2 :稍慢(加热下可发生反应) 稍慢(加热下可发生反应) 主要讨论的内容
甲烷的氯代 甲烷的氯代反应过程分析 氯代反应过程分析
CH4
n CH4 n Cl2
hv or ∆
Cl Cl Cl2
接下页
氯自由基
Cl Cl Cl + Cl
Cl + H CH3
甲基自由基
Cl H + CH3
DH = 242.7 kJ/mol
易 发生
Cl + Cl
有 效碰撞(产生新的自由基)
Cl
Cl
H
CH3
氯代和溴代反应速率的差别 ——决速步骤速率的差别 ——决速步骤速率的差别
X Cl Br + H CH3 X H + CH3
∆H(反应热) Ea(活化能) (
+ 7.5 kJ/mol +73.2 kJ/mol
δ Br
439.3 kJ/mol
pan第三章有机化合物的同分异构现象PPT课件

CH3 CH3
Cl COOH
顺-1,3-二甲基-3-氯环己基甲酸
.
11
第三节、构象异构
构象:在有机物中,由于单键自由旋转而引起的碳原子结合的原子或 原子团的相对位置发生改变,产生了若干不同的空间排列方式。
产生条件:至少有连续的三个单键的化合物
例如: H 2 O 2
HH OO
H OO H
CH 4
一、乙烷的构象
H
2、乙烷构象与分子内能 a.两种极端构象
重
叠 式
H
H
HC HH
C HH
楔形式
交
H
HH
叉 式
HC HH
C
H
楔形式
H
HH H H
H
锯架式
H H
H
H
H H
锯架式 .
HH H
HH
H H
纽曼式
HH
H
H
H HH
纽曼式 14
b.乙烷构象与分子内能
HH HH H H
E
kJ/mol
12.5
H
H
H
H
H
H
H
H
H
H
H
第三章 有机化合物的同分异构现象
目的和要求:
1、了解和掌握异构现象的基本概念,如构造异构,顺反 异构和光学异构现象等;
2、掌握什么是旋光性,手性、分子的手性和对称性;
3、掌握各类有旋光性化合物的结构特征,构型确定和命 名方法;
4、了解消旋化合物的拆分
.
1
本章的教学内容
第一节 构造异构现象 第二节 立体异构现象 第三节 光学异构现象
绕C-2和C-3之间σ键旋转(典型构象):
有机化学ppt课件第三章

共性:同烷烃相似,光照或加热下发生自由基取代反应。 (难氧化)
特性: 小环的开环加成
(1)加氢:
+H2
Ni 400C,常压
CH3CH2CH3
+H2
Ni
1000C,常压 CH3CH2CH2CH3
+H2
Pt 3000C,常压
C H3 C H2 C H2 C H2 C H3
精选课件ppt
9
(2)加溴
+Br2 室温 +Br2 光照
(3)环丙烷衍生物开环位置:取代最多的C与取代最少 的C之间; 加成位置:符合马氏规则。
eg.
Br2
+HBr
CH3
(CH3)2CCHCH2Br Br CH3
(C H3)2C C H C H3
Br
马氏规则:H加成到含H较多的C上,X加成到含H较少的C上。
精选课件ppt
11
3.3 环烷烃的来源和用途
3.4 环的张力
1.环丙烷及环丁烷的结构
2.拜尔张力学说(A.von Baeyer, stain theory) 3.环烷烃的燃烧热 4.张力能
环
产 Enb 非键性相互作用:非键合的两原子或原子团距
生
离小于其范氏半径之和(强烈排斥)
张 力
El 键长变化:两成键原子间距离偏离正常键长;
的 Eθ 键角变化:键角偏离平衡值
BrCH2 CH2 CH2 Br Br
+Br2
光照 或3000C
Br
(3)加溴化氢
+HBr +HBr +HBr
CH3CH2CH2Br
不反应 不反应
精选课件ppt
10
有机化学第三章共56页

在含双键主链的编号遵守 “双键的位次尽可 能小 ”的原则外,若有选择时,编号由Z型双键开 始(Z优先于E):
1
23
7
65
4
4
56 7
32 1
Chapter 3
2. 含 C=N 双键化合物的顺反异构 有机化合物亚胺、肟、腙,羰基缩氨基脲等
3. 含 N=N 双键化合物的顺反异构 偶氮化合物,N上两个基团在π键同侧的为Z式:
H Cl
Me Et (III)
Cl H
Et Me (IV)
mirror
对映体的特点:
除了对偏振光振动平面的旋转方向不同外,对映体的 其他物理性质是相同的;
除了对旋光性的试剂作用不同外,对映体的其他化学 性质是相同的;
三、手性的生物学重要性
全部在研药物的66%是有手性的,其中51%是 单一对映异构体药物。 2019年,全球销售的4750亿美元药品中, 2050亿美元的制剂是单一对映异构体药物。 Chapter 3
(I)
(II)
Chapter 3
F
手性碳标记
H C* Cl
Br
例: CH3C* HC*HCH3 Cl Cl
CH3C* HC* HCH2CH3 Cl Cl
判断分子的手性: 分子与其镜像重合称为非手性分子; 分子与其镜像不重合称为手性分子。
二、对映异构现象
对映异构体 ( enantiomers ) Chapter 3
CH2=CHCH3 和环丙烷 两个化合物。
Chapter 3
C2H6O C4H8O2
OH and CH3 O CH3
Ethanol
Methoxymethane
O
OH and
有机化学课件第三章

Lindlar催化剂 炔烃比烯烃更容易进行催化氢化
CH3 CH3 Pd-CaCO3 H2C CHC CHCH2CH2OH HC C C CHCH2CH2OH + H2 喹啉 80%
选择性 还原
C2H5C CC2H5 + H2 P-2 催化剂
C2H5 C C H 97%
C2H5 H
CH3CH2C C(CH2)3CH3
H
+
C
第二步
C
+
HA
C
C
+
H
A
碳正离子中间体
H
+
C C
H
A C C
+
A
+
C
C A
碳正离子的结构
稳定性
+ C
sp2
平面型,
sp3
角椎型
炔烃加成反应历程
C
C
+
HA H
C
C
+
+A
乙烯形 C+,sp杂化
C H
C+ຫໍສະໝຸດ +AHC
C A
a.卤化氢
CH2 CH2 + HCl AlCl3 130~250 C CH3 CH2Cl
Na, 液NH3, -78 C
o
H
(CH2)3CH3 C C H 97%~99%
CH3CH2
(2) 氢化热与烯烃的稳定性
烯烃 CH2 CH2 氢化热 / kJ· mol-1 137.2 125.9 126.8 118.8 112.5 111.3 119.7 115.5
结论: 反式异构体的稳定性较高 双键碳原子连接烷基数目越多, 烯烃越稳定
《有机化学第三章》PPT课件

2.催化剂的分类 ①异相催化剂:催化剂不溶于有机溶剂,如: Pt黑,Ni粉 ②均相催化剂:催化剂溶于有机溶剂,如: 三苯基膦与氯化铑的络合物
3.氢化热
亲电-加--成-由反亲响电试剂的进攻引起的加成反 响
亲电试剂----具有亲电性能的试剂
烯烃双键具有供电子的性质!
烯烃与卤素的加成反响过程中,发生了 共价键的异裂而形成离子,它是离子型的亲 电加成反响.
H2 CH2 CBr+ Nhomakorabea Br--
H2 C
Cl-
溴翁离子
马氏规那么
一、烯烃的亲电加成反响历程 〔一〕酸性试剂HZ的加成 1.机理:
HCl的加成反响历程
(甲基〔或烷基〕是排斥电子的基团)
CH3 C
H
CH3 C
H
CH3 C
H
H
C CH3
顺-2-丁烯
反-2-丁烯
3.3 physical properties of alkenes
在室温〔25℃〕和0.1MPa压力 下: 2-4 个碳原子的是气体;
5-18 个碳原子的是液体; 十八 个碳原子以上的是蜡状固体
直链烯烃的沸点比带有支链的异构体的略高 一些。
500-600
℃
CH2
CH
CH2
自由基取代反响反响历程:
Cl 自由基取代反响
Cl—Cl 2Cl*
Cl*+H-CH3-CH=CH2*CH2-CH3-CH=CH
*CH2-CH3-CH=CH2+Cl2 Cl-CH2-CH=C
• N- 溴 代 丁 二 酰 亚 胺 〔NBS=Nbromosuccinimide〕 是 一 个 可 以 专 一 性地在烯烃a-氢上加以溴化的试剂,在 有机合成上非常有用,反响经过一个自 由基过程。
3.氢化热
亲电-加--成-由反亲响电试剂的进攻引起的加成反 响
亲电试剂----具有亲电性能的试剂
烯烃双键具有供电子的性质!
烯烃与卤素的加成反响过程中,发生了 共价键的异裂而形成离子,它是离子型的亲 电加成反响.
H2 CH2 CBr+ Nhomakorabea Br--
H2 C
Cl-
溴翁离子
马氏规那么
一、烯烃的亲电加成反响历程 〔一〕酸性试剂HZ的加成 1.机理:
HCl的加成反响历程
(甲基〔或烷基〕是排斥电子的基团)
CH3 C
H
CH3 C
H
CH3 C
H
H
C CH3
顺-2-丁烯
反-2-丁烯
3.3 physical properties of alkenes
在室温〔25℃〕和0.1MPa压力 下: 2-4 个碳原子的是气体;
5-18 个碳原子的是液体; 十八 个碳原子以上的是蜡状固体
直链烯烃的沸点比带有支链的异构体的略高 一些。
500-600
℃
CH2
CH
CH2
自由基取代反响反响历程:
Cl 自由基取代反响
Cl—Cl 2Cl*
Cl*+H-CH3-CH=CH2*CH2-CH3-CH=CH
*CH2-CH3-CH=CH2+Cl2 Cl-CH2-CH=C
• N- 溴 代 丁 二 酰 亚 胺 〔NBS=Nbromosuccinimide〕 是 一 个 可 以 专 一 性地在烯烃a-氢上加以溴化的试剂,在 有机合成上非常有用,反响经过一个自 由基过程。
高等有机化学第三部分3-3.ppt
R-X + Y
. . R X
R +Y
R-X + Y(自由基离子形成)
.R + X
(电子转移)
RY
. or: R + Y-
RY
R Y +R X
R Y+ R X
10
SET的例证之一
.
Y
X +Y
.
(X=I, NO2等)
11
(四) 邻基参与机理(Neighboring-Group) 常有这样的情况: a.反应速度比预期的快 b.构型保留
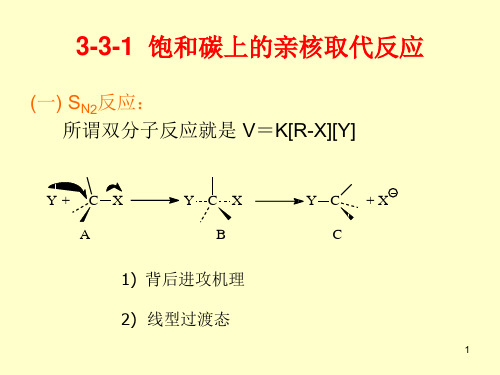
3-3-1 饱和碳上的亲核取代反应
(一) SN2反应: 所谓双分子反应就是 V=K[R-X][Y]
Y+ C X A
YCX B
Y C +X C
1) 背后进攻机理 2) 线型过渡态
1
1) 背后进攻机理
虽然SN2机理是在1937年由Hughs和Ingold 等人正式提出,但早在1893年Walden就发现了 这个取代反应中的构型翻转,所以现在人们又 称Walden翻转。
RX
RX
RX
R +X
紧密
松散
游离的离子
部分构型保留
消旋化
(溶液分隔)
部分保留和彻底的消旋化是SN1的特点。
注意:实际上很少纯粹的SN1或SN2反应,很多是二者都有。
9
(三)SET机理(Single Electron Transfer) 在亲核取代反应中有一类含有自由基或自由基
离子中间体,这类反应是通过SET机理进行的。
Allyl
40
Bn
120
* 位阻小的反应快,烯丙基反应快。
25
高等有机化学第三部分3-2.ppt
H
H
ρ=- 5.090 ,(EtOH,25℃)
8
Hammett常数还可以应用于IR、NMR等物理常数的预测。
注意: a. σp和σm数值有所不同但趋势一致,而邻位取代基的电
子效应无法在Hammett方程中反应,因为它有时所起的作用 不仅仅是电子效应。
b. 虽然Hammett常数得到广泛地应用,但有很多的例外, 即使在没有邻位效应的情况下,它有时也无法将诱导效应和 共轭效应综合考虑。为解决这问题,已经有许多的方法建立, 如H.C.Brown就定义了σ+(给电子)和σ-(吸电子),但都 只适用于很小的范围,没有一个能像Hammett常数应用得那 么广。
3
基团的σp和σm值举例:
GROUP σp
Br
0.26
N=NPh 0.34
CO2R CF3 CN
0.44 0.53 0.70
NO2 N2+
0.81 1.93
σm 0.37 0.28 0.35 0.46 0.62 0.71 1.65
GROUP
σp
I
0.28
CO2H 0.44 COMe 0.47
NH3+ 0.60 SO2Me 0.73 NMe3+ 0.82
KH = 6.5 KD
12
应用:
H C CH3 Br2 O
Br
C CH3 O
KH KD
= 6.1 ,说明决速步骤中有C-H键断裂。
H C CH3 的 O
OH
CH3 Br2 的
Br
CH3 O
13
(三) 二级同位素效应: 同位素取代不是在断裂的 键上(主要 是α、β位)
同样推导得二级同位素效应
例如取代效应:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
L−(+)−乳酸 (+)−
OH
H
复习 2: 外消旋体和内消旋体
COOH H HO OH H COOH
COOH
COOH H H OH OH COOH
+
HO H
H OH COOH
50% % 外消旋体 (±)酒石酸
50% % 内消旋体 meso− meso−酒石酸
旋光纯、外消旋体和内消旋体性质的比较 旋光纯、
若为机理 a —— 产物应无旋光性 产物应无
CH3 H ClH2C CH2CH3 Cl Cl CH3
Cl
−Cl
外消旋体
ClH2C
CH2CH3 Cl Cl
若为机理 b —— 产物仍应有旋光性 产物仍应有
CH3 H ClH2C Cl δ H ClH2C CH3 C δ Cl −H H3CH2C CH3 C Cl CH2Cl
手性助剂
手性底物
O H2O H+ H H2N OMe
Me H +
Ph
回收,可重复使用
选择性地生成对映异构体 选择性地生成对映异构体 例 1: :
Me
1.
BH2
Me H H OH
Me
+
2. H2O2, NaOH
H H HO
前手性分子 (prochiral)
手性试剂 (S, S) 主 要产物 e. e.=72% (R, R)
H
前手性分子
e.e. = 96 %
手性试剂(催化剂) 手性试剂(催化剂)控制选择性
R,R-DIPAMP 手性双膦配体 H3CO
P
P
OCH3
The Nobel Prize in Chemistry 2001
"for their work on chirally catalysed hydrogenation reactions" "for his work on chirally catalysed oxidation reactions"
(±)-丙氨酸 丙
选择性去乙酰基
不对称合成( 不对称合成(Asymmetric Synthsis) Synthsis)
—— 选择性地生成立体异构体 选择性地生成非对映异构体 选择性地生成非对映异构体
例 1:
O
Me H
(1)MeMgI (2)H2O
Me
OH Me H
HO
Me
Me H
+ 次要
手性底物控制选择性
酶解法拆分(利用酶的选择性反应进行拆分) 酶解法拆分(利用酶的选择性反应进行拆分)
例: DL-丙氨酸的酶解拆分 DLCOOH H2N CH3 L−丙氨酸 − H + H CH3 D−丙氨酸 − 外消旋体 COOH 酰基转移酶 H2 N (取自猪肾) H CH3 L−丙氨酸 − 溶于乙醇 + H CH3 D−乙酰丙氨酸 − 不溶于乙醇 COOH NHAc COOH NH2 Ac2O AcHN CH3 H + H CH3 NHAc COOH COOH
d x d c
a
反式 anti
四.立体化学在研究反应和反应机理上的应用
例 1:H. C. Brown对自由基取代机理的证明 Brown对自由基取代机理的证明
X2 R H hv
X2 hv
R
X +
X
H
两种可能机理 两种可能机理
2X
步骤 a
链增长步 骤(决速 步骤) 步骤)有 所区别
X R
+
H X
R X
手性试剂控制选择性 衡量标准:对映体过量,%e.e. (enantiomeric excess) ,%e.e. (e 衡量标准:对映体过量,%
% e.e. = R % - S % = [R] - [S] 100%
+
[R] + [S]
例 2:
CO2H Ph NHCOCH3 H2, [Rh] R,R-DIPAMP 不对称催化氢化 Ph CO2H NHCOCH3
COONa H HO OH H COONH4 HO H COONa H OH COONH4
巴斯德,L. 巴斯德, Louis Pasteur (1822~1895) ~
外消旋的酒石酸钠铵
1848年,巴斯德 年 借助放大镜拆分
仪器拆分(GC, HPLC…) HPLC… 仪器拆分(
GC用手性柱 GC用手性柱
H2N O
COOH NH2
H2N O
COOH NH2
(S)− (S)−天冬酰胺 苦味
(R)− (R)−天冬酰胺 甜味
O
O H3C O Ph H N N O n-Bu H N O n-Bu
N
CH3 O
Ph
麻醉剂 巴比吐酸衍生物
致痉挛
HO HO
NH2 COOH
HO HO
NH2 COOH
(−)−L−DOPA 治疗帕金森氏病
I’ (a, a)
对映异构关系
二.手性分子的获得
1. 手性分子的来源 自然界: 糖类、氨基酸、生物碱、萜类、 自然界: 糖类、氨基酸、生物碱、萜类、甾体化合物 外消旋体的拆分 不对称有机合成反应 2. 获得手性分子的重要意义——药物与人类的关系 获得手性分子的重要意义——药物与人类的关系 构成生命体系的生物大分子的主要部分大多数是以一种 对映体形式存在的。 对映体形式存在的。故药物与其作用也是以手性的方式 进行的, 进行的, 生物体的酶和细胞表面受体是手性的, 生物体的酶和细胞表面受体是手性的, 故对外消旋药物 的识别、消化和降解过程也是不同的。 的识别、消化和降解过程也是不同的。
第三章
立体化学(3) 立体化学(
主要内容
描述立体构性的 D / L 体系 分子的构象与手性(构象对映体) 分子的构象与手性(构象对映体) 获得手性化合物的方法,外消旋体的拆分,不 获得手性化合物的方法,外消旋体的拆分, 对称合成) 对称合成) 立体化学在研究反应和反应机理上的应用
复习 1: 手性碳的绝对构型——R/S 方法 手性碳的绝对构型 绝对构型——R/S
2
C2 转120o HOOC
H
2
H
COOH I
有中心对称 (非手性) 非手性)
沿C2-C3
H II 转60o
无对称性 (手性) 手性)
OH
III
互为镜像
COOH H H OH OH COOH
HOOC
3
H COOH HOOC
H
2
COOH
OH HO
2
OH H H
3
OH
mesomeso-酒石酸
III II 一对构象对映体(构象外消旋体) 一对构象对映体(构象外消旋体)
主要
两 者 为 非对 映 异 构 体
衡量标准:非对映体过量, %d.e. ( diastereomeric excess) 衡量标准:非对映体过量,
[A] - [B] % d.e. = 异构体 A % - 异构体 B % = [A] + [B] 100%
+
例 2:
Ph O H2N H OMe Ph N H Ph OMe 1. 碱 2. MeI N H OMe Me H 主要产 物
COOH H HO OH H COOH +
熔点 : 比重(20o) 水 中溶 解 度 pK1 pK2
COOH H HO OH HO H COOH H
COOH H OH COOH H H
COOH OH OH COOH meso 146-148oC 1.66g / cm3 125g / 100ml 3.23 4.82
X H R X
+ +
R X
步骤 b
X H
+
R X
H X
X R H X
+ +
H X
Brown的实验 Brown的实验
CH3 H ClH2C CH2CH3 CH3 Cl2 hv Cl ClH2C + CH2CH3 H3CH2C CH3 Cl CH2Cl
100% % 旋光异构体
50% %
50% %
外消旋体,无光学活性 外消旋体,
例 2: cis-1, 2-二甲基环己烷 cis- 2CH3
1 CH 3 2 CH3
1
转120o CH3 CH3
2 1
CH3
2
I
有对称面 非手性 平面结构式
无对称面 有手性
CH3
1
II
CH3
2
CH3
2
H3C
1
I
一对构象对映体 (构象外消旋体) 构象外消旋体)
II
例 3: trans-1, 2-二甲基环己烷 trans- 21 2
William S. Knowles
Ryoji Noyori
K. Barry Sharpless
三.反应中的立体化学
取代反应的立体化学
a x bc a x bc a x bc
+ + +
a y bc a y y cb a y bc y
+
y
构型保持 retention
构型转换 reversion 转换) (Walden 转换)
描述立体构性的 D / L 体系(相对构型) 体系(相对构型)
CHO CHO HO H CH2OH
L−(−)−甘油醛
基准物
H
OH CH2OH
CHO H HO H H OH H OH OH CH2OH
D−(+)−葡萄糖 (+)−
D−(+)−甘油醛 (+)−
COOH H CH3
OH
H
复习 2: 外消旋体和内消旋体
COOH H HO OH H COOH
COOH
COOH H H OH OH COOH
+
HO H
H OH COOH
50% % 外消旋体 (±)酒石酸
50% % 内消旋体 meso− meso−酒石酸
旋光纯、外消旋体和内消旋体性质的比较 旋光纯、
若为机理 a —— 产物应无旋光性 产物应无
CH3 H ClH2C CH2CH3 Cl Cl CH3
Cl
−Cl
外消旋体
ClH2C
CH2CH3 Cl Cl
若为机理 b —— 产物仍应有旋光性 产物仍应有
CH3 H ClH2C Cl δ H ClH2C CH3 C δ Cl −H H3CH2C CH3 C Cl CH2Cl
手性助剂
手性底物
O H2O H+ H H2N OMe
Me H +
Ph
回收,可重复使用
选择性地生成对映异构体 选择性地生成对映异构体 例 1: :
Me
1.
BH2
Me H H OH
Me
+
2. H2O2, NaOH
H H HO
前手性分子 (prochiral)
手性试剂 (S, S) 主 要产物 e. e.=72% (R, R)
H
前手性分子
e.e. = 96 %
手性试剂(催化剂) 手性试剂(催化剂)控制选择性
R,R-DIPAMP 手性双膦配体 H3CO
P
P
OCH3
The Nobel Prize in Chemistry 2001
"for their work on chirally catalysed hydrogenation reactions" "for his work on chirally catalysed oxidation reactions"
(±)-丙氨酸 丙
选择性去乙酰基
不对称合成( 不对称合成(Asymmetric Synthsis) Synthsis)
—— 选择性地生成立体异构体 选择性地生成非对映异构体 选择性地生成非对映异构体
例 1:
O
Me H
(1)MeMgI (2)H2O
Me
OH Me H
HO
Me
Me H
+ 次要
手性底物控制选择性
酶解法拆分(利用酶的选择性反应进行拆分) 酶解法拆分(利用酶的选择性反应进行拆分)
例: DL-丙氨酸的酶解拆分 DLCOOH H2N CH3 L−丙氨酸 − H + H CH3 D−丙氨酸 − 外消旋体 COOH 酰基转移酶 H2 N (取自猪肾) H CH3 L−丙氨酸 − 溶于乙醇 + H CH3 D−乙酰丙氨酸 − 不溶于乙醇 COOH NHAc COOH NH2 Ac2O AcHN CH3 H + H CH3 NHAc COOH COOH
d x d c
a
反式 anti
四.立体化学在研究反应和反应机理上的应用
例 1:H. C. Brown对自由基取代机理的证明 Brown对自由基取代机理的证明
X2 R H hv
X2 hv
R
X +
X
H
两种可能机理 两种可能机理
2X
步骤 a
链增长步 骤(决速 步骤) 步骤)有 所区别
X R
+
H X
R X
手性试剂控制选择性 衡量标准:对映体过量,%e.e. (enantiomeric excess) ,%e.e. (e 衡量标准:对映体过量,%
% e.e. = R % - S % = [R] - [S] 100%
+
[R] + [S]
例 2:
CO2H Ph NHCOCH3 H2, [Rh] R,R-DIPAMP 不对称催化氢化 Ph CO2H NHCOCH3
COONa H HO OH H COONH4 HO H COONa H OH COONH4
巴斯德,L. 巴斯德, Louis Pasteur (1822~1895) ~
外消旋的酒石酸钠铵
1848年,巴斯德 年 借助放大镜拆分
仪器拆分(GC, HPLC…) HPLC… 仪器拆分(
GC用手性柱 GC用手性柱
H2N O
COOH NH2
H2N O
COOH NH2
(S)− (S)−天冬酰胺 苦味
(R)− (R)−天冬酰胺 甜味
O
O H3C O Ph H N N O n-Bu H N O n-Bu
N
CH3 O
Ph
麻醉剂 巴比吐酸衍生物
致痉挛
HO HO
NH2 COOH
HO HO
NH2 COOH
(−)−L−DOPA 治疗帕金森氏病
I’ (a, a)
对映异构关系
二.手性分子的获得
1. 手性分子的来源 自然界: 糖类、氨基酸、生物碱、萜类、 自然界: 糖类、氨基酸、生物碱、萜类、甾体化合物 外消旋体的拆分 不对称有机合成反应 2. 获得手性分子的重要意义——药物与人类的关系 获得手性分子的重要意义——药物与人类的关系 构成生命体系的生物大分子的主要部分大多数是以一种 对映体形式存在的。 对映体形式存在的。故药物与其作用也是以手性的方式 进行的, 进行的, 生物体的酶和细胞表面受体是手性的, 生物体的酶和细胞表面受体是手性的, 故对外消旋药物 的识别、消化和降解过程也是不同的。 的识别、消化和降解过程也是不同的。
第三章
立体化学(3) 立体化学(
主要内容
描述立体构性的 D / L 体系 分子的构象与手性(构象对映体) 分子的构象与手性(构象对映体) 获得手性化合物的方法,外消旋体的拆分,不 获得手性化合物的方法,外消旋体的拆分, 对称合成) 对称合成) 立体化学在研究反应和反应机理上的应用
复习 1: 手性碳的绝对构型——R/S 方法 手性碳的绝对构型 绝对构型——R/S
2
C2 转120o HOOC
H
2
H
COOH I
有中心对称 (非手性) 非手性)
沿C2-C3
H II 转60o
无对称性 (手性) 手性)
OH
III
互为镜像
COOH H H OH OH COOH
HOOC
3
H COOH HOOC
H
2
COOH
OH HO
2
OH H H
3
OH
mesomeso-酒石酸
III II 一对构象对映体(构象外消旋体) 一对构象对映体(构象外消旋体)
主要
两 者 为 非对 映 异 构 体
衡量标准:非对映体过量, %d.e. ( diastereomeric excess) 衡量标准:非对映体过量,
[A] - [B] % d.e. = 异构体 A % - 异构体 B % = [A] + [B] 100%
+
例 2:
Ph O H2N H OMe Ph N H Ph OMe 1. 碱 2. MeI N H OMe Me H 主要产 物
COOH H HO OH H COOH +
熔点 : 比重(20o) 水 中溶 解 度 pK1 pK2
COOH H HO OH HO H COOH H
COOH H OH COOH H H
COOH OH OH COOH meso 146-148oC 1.66g / cm3 125g / 100ml 3.23 4.82
X H R X
+ +
R X
步骤 b
X H
+
R X
H X
X R H X
+ +
H X
Brown的实验 Brown的实验
CH3 H ClH2C CH2CH3 CH3 Cl2 hv Cl ClH2C + CH2CH3 H3CH2C CH3 Cl CH2Cl
100% % 旋光异构体
50% %
50% %
外消旋体,无光学活性 外消旋体,
例 2: cis-1, 2-二甲基环己烷 cis- 2CH3
1 CH 3 2 CH3
1
转120o CH3 CH3
2 1
CH3
2
I
有对称面 非手性 平面结构式
无对称面 有手性
CH3
1
II
CH3
2
CH3
2
H3C
1
I
一对构象对映体 (构象外消旋体) 构象外消旋体)
II
例 3: trans-1, 2-二甲基环己烷 trans- 21 2
William S. Knowles
Ryoji Noyori
K. Barry Sharpless
三.反应中的立体化学
取代反应的立体化学
a x bc a x bc a x bc
+ + +
a y bc a y y cb a y bc y
+
y
构型保持 retention
构型转换 reversion 转换) (Walden 转换)
描述立体构性的 D / L 体系(相对构型) 体系(相对构型)
CHO CHO HO H CH2OH
L−(−)−甘油醛
基准物
H
OH CH2OH
CHO H HO H H OH H OH OH CH2OH
D−(+)−葡萄糖 (+)−
D−(+)−甘油醛 (+)−
COOH H CH3
