2016年高考一轮复习高三化学考点课件4-20.热点突破 硝酸的性质及有关实验探究
高三化学硝酸复习PPT精品课件

二、硝酸的化学性质
2、硝酸的不稳定性
4HNO3
△ 或光照
2 H2O + 4 NO2 ↑ + O2 ↑
浓硝酸变黄原因?
分解产生的NO2(红棕色)溶于浓硝 酸中而变黄。
浓硝酸如何保存?
棕色细口试剂瓶中,避光、低温保存。
(不能用橡皮塞)
HNO3
二、硝酸的化学性质
3、硝酸的强氧化性 3CCuu++H8NHON3O(稀3(稀)→)=3Cu(NO3)2+2NO↑+4H2O CCuu++4HHNNOO33((浓浓))→=Cu(NO3)2+2NO2↑+2H2O CC++4HHNNOO33((浓浓))→=CO2↑+4NO2↑+2H2O
Cu ? HNO3 0.1mol
Cu(NO3)2 0.03mol
气体
0.04mol
Cu 0.03mol HNO31120mmoLl/L
Cu(NO3)2 0.03mol
气体
0.05mol
pH= ?
THANKS
FOR WATCHING
演讲人: XXX
PPT文档·教学课件
与含有苯环结构的蛋白质作用,呈黄色。
酸
强氧化 性酸
强酸 硝酸
挥发性 酸
还能与 有机物
反应
三、有关硝酸的计算
⑴ 得失电子守恒
三
个 ⑵ 原子守恒
守
恒 ⑶ 溶液中电荷守恒
Cu 0.03mol
Cu(NO3)2 0.03mol
HNO3 ?
气体 ? 0.05mol
产生的气体与多少升O2混合后通入水中恰好完全吸收?
意
硝酸的性质及其应用PPT课件

还原产物:浓硝酸→NO2 ;稀硝酸→ NO 。 (2)Cu与浓硝酸反应,若Cu足量,产生的气体是 NO和NO2的混合物; (3)Fe与稀硝酸反应,先生成Fe(NO3)3,若Fe过 量,最终生成Fe(NO3)2 .
第10页/共15页
三、有关性质的应用 例:将32.6g铜与140 mL一定浓度的硝酸反应,
铜完全溶解产生的NO和NO2混合气体在标 准状况下的体积为11.2L。请回答: (1)NO的体积 L,NO2 的体积 L. (2)欲使铜与硝酸反应生成的气体在 NaOH 溶液中全部转化为NaNO3,至少需要30%双 氧水 g.
谢谢老师们、同学们! 你们辛苦了!再见!!!
第14页/共15页
谢谢您的观看!
第15页/共15页
第11页/共15页
解析:(1) Cu与硝酸的反应中, 32.6g Cu失电子转
化为Cu2+,HNO3中的氮元素得电子转化为NO2 和NO 。则Cu失去的电子应等于HNO3中的氮 元素得到的电子,设NO2 体积为VL,则NO 的体积为(11.2-V)L,根据得失电子守恒可算 出V。 (2) 32.6g Cu与硝酸的反应后的气体为NO 和NO2,NO和NO2被H2O2氧化为NaNO3转化 过程可C表u 失示→电为→子 :HNO得3电→子 → NO、失N电O子2 → → NaNO3
2013
2014 页/共15页
基础梳理
一、硝酸的物理性质
纯硝酸是一种 无 色、具有刺激性气味的液 体、 易 挥发 、易 溶于水 ;实验室中久置的浓硝酸 略显黄色。
二、硝酸的化学性质
1、具有强酸性 具有酸的通性,但与金属反应 不产生H2
硝酸的性质高三一轮复习课 ppt课件

气体产物有
;
(3)还原产物中NH4+的物质的量分数随
而增大;
(4)请用一句话概括该图反pp映t课出件 的基本结论
10
读图与析图
(5)m mol 铁与极大量的密度为1.35 g·mL-1的硝酸溶液
完全反应放出n L气体(体积在标准状况下测定),此时溶液中
Fe元素的存在方式是
,n 的值最接近
A.22.4m B.33.6m C.44.8m D.67.2m
练习 下列各组粒子在溶液中能大量共存的是 A、NH4+、Na+、OH-、K+ B、NO3-、I-、H+、ClC、Al3+、S2-、Na+、NO3D、OH-、SO32-、Na+、CO32- √
ppt课件
14
练习
1、将1molKNO3和4mol H2SO4溶于1L水,向其中 加入2mol铜粉,充分反应后产生的气体在标准状 况下的体积是(C)
A、5.6L B、11.2L C、22.4L D、33.6L
2、某浓度稀HNO3与金属M反应时,能得到 +2价硝酸盐,反应时M与HNO3的物质的量 之比为5 ∶12,则反应时HNO3的还原产物是
(B)
A、NH4NO3 B、N2 C、N2O D、NO
ppt课件
15
某同学在做镁与一定浓度的硝酸反应时,观察到有
ppt课件
11
总结
不稳定性:特殊性
+5 HNO3
类别:酸性
组成:强氧化性,还原产物有 NO2、NO、N2O、N2、NH4+等
应用
得失电子守恒 N元素守恒
有物 关质 计检 算验
物离 质子 制共 备存
电荷守恒
硝酸一轮复习 ppt课件

王水的组成:
浓HNO3与浓HCl体积比1:3
王水能使金ppt课、件 铂溶解
10
练习:下列物质的溶液在长期放置的过程中因被氧化
而成黄色的是
( CE )
A.浓硝酸 D铁
(3)与非金属反应 与浓HNO3反应时,非金属单质一般被氧化为高
价氧化物或高价含氧酸,硝酸只显示强氧化性。
溶液中的NO3- 和生成的NO(或NO2)中N的物质 的量之和等于原HNO3的物质的量
1、若将12.8g铜跟一定量的浓硝酸反应,铜消 耗完时,共产生5.6L气体(标准状况)。则 所消耗的硝酸的物质的量为__0_.6_5_m_o_l。
2、38.4gCu跟适量的浓HNO3反应,Cu全部反应 后共收集到气体22.4L(标准状况),反应中作 氧化剂的硝酸与总消耗的HNO3的物质的量比 ( A) A、5/11 B、6p/pt1课1件 C、5/6 D、6/5 14
NH4++OH-=NH3↑+H2O C.向(NH4)2SO4溶液中加入适量Ba(OH)2:
Ba2++SO42-=BaSO4↓ D.向浓硝酸中加入铜片:
Cu+4H++2NO3-=Cpupt课2件++2NO2↑+2H2O
9
小 (1)硝酸与金属反应,
既显氧化性又显酸性
结 (2)硝酸与变价金属反应,
生成高价金属硝酸盐
练习 :浅绿色的Fe(NO3)2溶液中存在如下平衡:
Fe2++2H2O
Fe(OH)2+2H+,若向该溶液
中滴加稀盐酸,则溶液的颜色 ( A)
A、变黄
B、绿色变深
C、绿色变浅
D、无变化
ppt课件
5
高三化学高考复习课 硝酸—说课 课件(共26张PPT)

指导思想
宏观
实际情境
微观
性质
反应
酸碱度 浓度 温度
内容分析
大量工业和科研案例显示: 1、硝酸主要起氧化作用; 2、可用硝酸盐和酸的混合溶液替代; 3、常采用混酸溶液,保证酸性环境,充分发挥
NO3-的氧化性; 4、控制浓度、温度实现不同氧化效果; 5、需要关注污染性气体产物的处理。
HNO3
实际情境
优秀ppt公开课ppt免费课件下载免费 课件20 19届高 三化学 高考复 习课 硝酸—说课 课件(共26张PPT)
浓度影响NO3-氧化性的强弱
优秀ppt公开课ppt免费课件下载免费 课件20 19届高 三化学 高考复 习课 硝酸—说课 课件(共26张PPT)
环节三 微观探析
活动4:还有哪些条件影响NO3-的氧化性? 资料:
NO3-
氧化性
反应
c (H+) c(NO3-) 温度
学情分析与教学目标
关于酸性:根据物质类别预测HNO3有酸性 酸性源于H+ 浓度越大,酸性越强
学情分析与教学目标
证据推理 与
模型认知
宏观辨识 与
微观探析
思维框架: 影响条件:酸碱度、浓度、温度 微观层面:NO3-有强氧化性 宏观层面:根据化合价预测HNO3有氧化性
应用实例 钝化金属,常温下的浓硝酸;
抛光铜制品,20-30℃的中等浓度硝酸;
酸洗不锈钢材料,加热的稀硝酸。
课程内容
《普通高中化学课程标准(2017年版)》课程内容 2.5非金属及其化合物 结合真实情境中的应用实例或通过实验探究,
了解氯、氮、硫及其重要化合物的主要性质,认识 这些物质在生产中的应用和对生态环境的影响。
环节三 微观探析
2016年高考一轮复习高三化学考点课件:4-20.热点突破 硝酸的性质及有关实验探究

②2NO+O2==2NO2
【特别提醒】硝酸强氧化性在具体应用中的几点注意
(1)浓硝酸使紫色石蕊试液先变红后褪色。 (2)硝酸能够与几乎所有的金属反应(除 Au、Pt 外),但不生 成氢气;与变价金属反应时,金属能够被氧化为最高价态。 (3)分析离子共存的问题时要注意隐含的硝酸,即酸性条件 - 的硝酸盐溶液,H+和 NO3 共存时相当于稀硝酸,有较强的 氧化性。
第四章
非金属及其化合物
1.考点精讲
考点强化: 硝酸的性质及有关实验 探究
2.典例剖析 3.思维建模 4.变式训练 5.真题演练
数字媒体资源库
1.考点精讲
第2页
返回目录
结束放映
数字媒体资源库
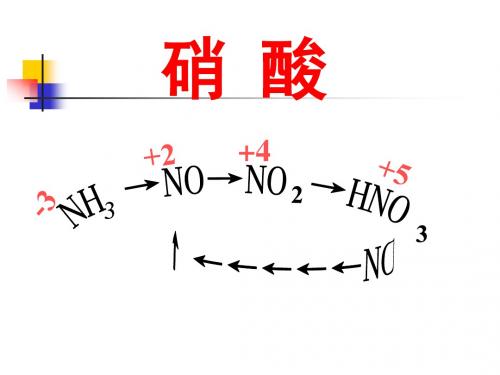
硝酸
1.化学性质
如何体现,请写出 有关的化学方程式
Cu C
H22NO↑ S、SO Na SO3、 2、 2 ①3Cu+8HNO3(稀)===3Cu(NO3)2+ + 4H O 2 2 + HI、Fe ②Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
第4页
返回目录
结束放映
数字媒体资源库
2. 典例剖析
第5页
返回目录
结束放映
数字媒体资源库
【典例】 下列有关实验操作、 现象和解释或结论都正确的是 ( D )。 选项 A B C 实验操作 现象 过量的Fe粉中加入稀 溶液呈红 HNO3,充分反应后, 色 滴入KSCN溶液 AgI沉淀中滴入 稀KCl溶液 Al箔插入稀HNO3中 用玻璃棒蘸取 浓HNO3点到红色石 蕊试纸上
③C+4HNO3(浓) CO2↑+4NO2↑+2H2O
+ 3+ ④3Fe2+ +NO- + 4H ==3Fe + NO↑+ 2H2O 3
高三化学一轮复习——典型的氧化性酸硝酸

高三化学一轮复习——典型的氧化性酸硝酸知识梳理1.物理性质硝酸是无色易挥发的液体,有刺激性气味。
2.化学性质(1)硝酸浓度不同,其还原产物不同,一般为HNO 3(浓)→NO 2,HNO 3(稀)→NO 。
(2)常温下,铁、铝遇浓硝酸能发生“钝化”,并非不反应,故浓硝酸可以用铁桶盛放。
理解应用(1)将浓硝酸存放在无色试剂瓶中,一段时间后观察到溶液变黄,用方程式解释变黄的原因,由此得到启示,如何保存浓硝酸?答案 4HNO 3(浓)===========△或光照2H 2O +4NO 2↑+O 2↑,浓硝酸应保存在棕色试剂瓶中,并置于阴凉处。
(2)用动态观点理解Cu 与浓HNO 3的反应向一定量的浓硝酸中加入过量的铜片。
①反应开始阶段产生 色气体,化学方程式为 。
②反应进行一段时间后又产生无色气体,此时的化学方程式为 。
③待反应停止后,再加入少量的稀硫酸,这时Cu 片上又有气泡产生,原因是 。
答案 ①红棕 Cu +4HNO 3(浓)===Cu(NO 3)2+2NO 2↑+2H 2O②3Cu +8HNO 3(稀)===3Cu(NO 3)2+2NO ↑+4H 2O③加入稀硫酸后,氢离子与原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应(3)将FeO 溶于足量稀硝酸中,固体完全溶解,写出该反应的离子方程式,指出HNO 3表现的性质。
答案 3FeO +10H ++NO -3===3Fe 3++NO ↑+5H 2O ,酸性和强氧化性。
(1)实验室也可用锌粒与稀硝酸制取氢气( )(2)常温下,铁、铝在浓硝酸中的钝化为化学变化( )(3)可用稀硝酸与FeS 固体反应制取H 2S( )(4)过量的铜与浓硝酸反应,产物中一定有NO( )(5)浓硝酸在光照下久置,会变黄( )(6)铜溶于稀硝酸不能体现硝酸的酸性( )(7)炽热的炭在浓硝酸中反应的化学方程式为:C +4HNO 3(浓)=====△CO 2↑+4NO 2↑+2H 2O( )(8)将石蕊溶液滴入浓硝酸中,溶液先变红后褪色( )答案 (1)× (2)√ (3)× (4)√ (5)√ (6)× (7)√ (8)√(1)HNO 3与金属反应一般不能产生H 2。
人教版高三化学复习课件:《硝酸》
金、铂能被王水氧化,王水是浓HNO3和 浓HCl按1:3的体积比混合成的氧化性更强 的溶液.
浓硝酸
浓盐酸
1
:
3
硝酸与金属反应的规律
(1)硝酸几乎能与所有的金属发生氧化还原 反应,除金、铂之外。
(2) Fe、Al、等金属和稀HNO3能反应,但在冷 的浓HNO3中钝化。
(3)不金属与硝酸反应时金属被氧化成相应的硝 酸盐,浓HNO3的还原产物一般是NO2,稀HNO3 还原产物一般是NO。
0.03
0.06
3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O
方法一 1.92g铜粉 n(Cu)=0.03mol, 气体为1.12L n(气体)=0.05mol
Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O
X 4X
2X
3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O
元素守恒法: n(HNO3)=0.05+0.06=0.11mol
Cu与稀HNO3实验改进
清晰的观察无色NO气体的生成
产生NO气体前排净反应器中的空气
气排气 液排气
稳定的气体,既能排净空气 又不与NO气体反应 将反应液装满发生装置
实验设计
仪器:大试管、胶塞、注射器(带胶帽) 棉花、烧杯
药品:稀硝酸、大理石、铜丝、铜片、 NaOH溶液
Fe2+ 、S2-、I-、SO32-等一些还原性的物质 不能与硝酸共存!
例:Fe2+ HNO3 Fe3+ SO32- HNO3 SO42-
注意:这类反应只能在酸性溶液中进行的, 而在中性和碱性溶液中,NO3-几乎与所有 的离子能共存.
高三化学一轮复习《硝酸》

HNO3
光照 或△
NO2 ↑+ + 硝酸如何保存?
??
不稳定性
【思考与交流3】
酸性
怎么说明硝酸具有酸性
【思考与交流4】
氧化性
如何说明硝酸具有 氧化性呢?
【思考与交流5】
氧化性
如何设计实验装置完成铜 与硝酸的反应?
请说出所选试剂、仪器以及 采用的装置。
作品一
硝酸复习课
反应停止后, 打开止水夹, 用注射器抽取干燥管内的气体(事先 已将注射器内原有的空气推出), 关闭止水夹后取下注射器, 并抽取 一定量的空气,观察到的现象是________________。 (4)上述实验完成后,将注射器内的气体通入到 NaOH 溶液中, 其目的是__________________。
硝酸复习课
典例精析
例 1 U 形管是中学化学实验室里的常见仪器,用途非常广泛。 (1)当用 U 形干燥管来干燥 NO 时, 不宜选择的干燥剂是( ) A.无水 CaCl2 B.P2O5 C.浓硫酸 D.碱石灰 E.CaO 固体 (2)某化学兴趣小组欲利用两臂等长的 U 形管验证铜与稀硝 酸反应的气体产物是 NO 而不是 NO2,如图 34-3①所示,用 1.0 mol/L 的稀硝酸加入 U 形管到其高度一半,用胶塞塞好管口, 其中左边胶塞插有螺旋状的铜丝,整个实验过程不再使用其他仪 器。
直通高考2011年湖北省高考题
29.(15分)请回答下列实验室中制取气体的有关问题。 (1)下图是用KMnO4与浓盐酸反应制取适量氯气的简易 装置。
装置B、C、D的作用分别是: B______________________ 向上排空气法收集氯气 ; 安全作用,防止D中的液体倒吸进入集气管B中 C__________________________________________ ; 吸收尾气,防止氯气扩散到空气中污染空气 D_________________________________________.
高三化学一轮复习——硫酸、硝酸

第14讲硝酸、硫酸及其盐【考试要求】常见非金属元素(如H、C、N、O、Si、S、Cl等)①了解常见非金属元素单质及其重要化合物的主要性质及应用。
②了解常见非金属元素单质及其重要化合物对环境质量的影响。
【复习目标】1.会比较硫酸浓稀的区别,能熟练写出相应方程式2.能够通过硫酸的学习,运用“类比”的方法学习硝酸的性质3.能够根据所学知识,对硫酸、硝酸的知识进行综合应用【课前预习区】一、硫酸1、硫酸的物理性质(1)硫酸是一种性酸,溶于水时。
常见浓硫酸,其密度为1.84g/cm3,溶质质量分数为98℅,其物质的量浓度为;稀释浓硫酸时必须将(填操作)。
(2)浓硫酸具有性,常用作干燥剂,但不能干燥、等气体。
2、稀硫酸的化学性质稀硫酸电离方程式稀硫酸具有酸的通性,表现在①②③④⑤3、SO42-离子的检验:取少量待测液与试管中,先加入,现象,再加入,现象。
三、硝酸的性质1、物理性质:硝酸具有性。
敞口浓硝酸会出现现象。
2、化学性质(1)强酸性:酸的通性(2)不稳定性:硝酸或易分解,化学方程式为久置的浓硝酸呈色,因为:存放硝酸时,应放在试剂瓶里,置于冷暗处。
(3)性①与金属反应(除Au、Pt外,大多金属都能与硝酸反应,但都不产生气)a.铜与浓硝酸化学方程式;离子方程式铜与稀硝酸化学方程式离子方程式实验现象。
b.铁、铝遇冷的浓硝酸发生,故可用铁、铝容器运输冷的浓硝酸c. Fe(过量)+ HNO3(稀)—Fe(少量)+ HNO3(稀)—②与非金属(如木炭)反应③与某些还原性化合物反应稀硝酸与Fe2+反应的离子方程式稀硝酸与SO32-反应的离子方程式3、工业制备过程(写出各步反应方程式)第一步(氨的催化氧化):第二步:第三步:第14讲硝酸、硫酸及其盐【课堂互动区】一.浓硫酸的性质【交流研讨1】将50ml18mol/L硫酸溶液中加入足量的铜片并加热,(1)观察到的现象是____________________________________________,(2)硫酸在此反应中的体现的性质是__________________,(3)有关反应的化学方程式_________________________________________。
高考化学一轮复习必考知识点:硝酸

高考化学一轮复习必考知识点:硝酸
以用铝罐车或铁罐车运硝酸)(表现了浓硝酸的什么性质?)
2.浓、稀硝酸与活泼金属反应都不生成氢气(原因?)
3.浓、稀硝酸能与铜、银等不活泼金属反应(表现了硝酸的什么性质?试管中粘附的铜或银用什么来洗?)
4.与金属反应时硝酸的主要还原产物:
(1)、与铜、银等不活泼金属反应,浓硝酸生成NO2,而稀硝酸生成NO
(2)、与锌、镁等活泼金属反应,还原产物比较复杂,其价态随金属活泼性增强和酸的浓度降低而降低,最低可得
NH4+。
(3)、浓、稀硝酸与金属反应中的作用:表现出——酸性、强氧化性(注意:定量计算中应用)
5.稀硝酸与铁反应,如果硝酸过量,生成三价铁盐,如果铁过量,生成二价铁盐(在硝酸与铁的摩尔比的不同溶液中铁元素存在的形式不同)。
2019-2019高考化学一轮复习必考知识点:硝酸的全部内容就为大家分享到这里,查字典化学网预祝考生可以取得更好的成绩。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.考点精讲
考点强化: 硝酸的性质及有关实验 探究
2.典例剖析 3.思维建模 4.变式训练 5.真题演练
1.考点精讲
硝酸
1.化学性质
如何体现,请写出 有关的化学方程式
Cu C
H22NO↑ S、SO Na SO3、 2、 2 ①3Cu+8HNO3(稀)===3Cu(NO3)2+ + 4H O 2 2 + HI、Fe ②Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
பைடு நூலகம்
【特别提醒】硝酸强氧化性在具体应用中的几点注意
(1)浓硝酸使紫色石蕊试液先变红后褪色。 (2)硝酸能够与几乎所有的金属反应(除 Au、Pt 外),但不生 成氢气;与变价金属反应时,金属能够被氧化为最高价态。 (3)分析离子共存的问题时要注意隐含的硝酸,即酸性条件 - 的硝酸盐溶液,H+和 NO3 共存时相当于稀硝酸,有较强的 氧化性。
5.真题演练
【真题】(2009·北京理综,27)某学习小组探究浓、稀硝酸氧化 性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验 表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此 得出的结论是浓硝酸的氧化性强于稀硝酸。 可选药品:浓硝酸、3 mol·L-1 稀硝酸、蒸馏水、浓硫酸、氢 氧化钠溶液及二氧化碳 已知:氢氧化钠溶液不与NO反 应,能与NO2反应。 2NO2+2NaOH===NaNO3+ NaNO2+H2O (1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放 3 mol·L-1稀硝酸、浓硝酸、氢氧化钠溶液 的药品依次是_____________________________________ 。 (2)滴加浓硝酸之前的操作是检查装置的气密性,加入药品,打 通入CO2一段时间,关闭弹簧夹,将装置⑤ 开弹簧夹后________________________________________ 中导管末端伸入倒置的烧瓶内 _______________________________________________ 。 答案显/隐
(3)装置①中发生反应的化学方程式是 Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O ______________________________________________________ 。 将NO2转化为NO ,发生反应的化学方程 (4)装置②的作用是__________________ 3NO2+H2O===2HNO3+NO 式是__________________________________________________ 。 (5)该小组得出的结论依据的实验现象是 装置③中液面上方气体仍为无色,装置④中液面上方气体由 _____________________________________________________ 无色变为红棕色 _____________________________________________________ 。 (6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色 。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同 学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4 个实验来判断两种看法是否正确。这些方案中可行的是(选填序 acd 号字母)____________ 。 a.加热该绿色溶液,观察颜色变化 b.加水稀释该绿色溶液,观察颜色变化 c.向该绿色溶液中通入氮气,观察颜色变化 d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察 颜色变化 转 解析
转 解析
【变式2】 将9 g铜和铁的混合物投入 100 mL稀硝酸中,充 分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续 加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准 状况下1.12 L NO。若向反应后的溶液中加入 KSCN溶液, 溶液不变红,则下列说法正确的是 ( )。 A A.原混合物中铜和铁各0.075 mol B.稀硝酸的物质的量浓度为0.5 mol·L-1 C.第一次剩余4.8 g金属为铜和铁 D .再加入上述 100 mL 稀硝酸,又得到标准状况下 1.12 L NO 【思维点拨】理清反应的先后顺序,准确判断溶解金属的成 分;灵活运用电子得失守恒解题。 转 解析
4.变式训练
【变式 1】 (2014· 吉林长春第一次调研)现有稀硫酸和稀硝酸的 - 混合溶液,已知其中稀硫酸浓度为 4 mol· L 1,稀硝酸的浓度 为 2 mol· L-1。取 10 mL 混合酸,向其中加入过量铁粉,反应 结束后,在标准状况下可收集到气体的体积为(假设 HNO3 只 被还原为 NO)( C )。 A.0.224 L B.0.448 L C.0.672 L D.0.896 L
③C+4HNO3(浓) CO2↑+4NO2↑+2H2O
+ 3+ ④3Fe2+ +NO- + 4H ==3Fe + NO↑+ 2H2O 3
2. 硝酸的工业制法 O2 NH3 NO ①
O2 ②
NO2
H2O ③
HNO3
① 4NH3+5O2
催化剂
4NO+6H2O
③3NO2+H2O===2HNO3+NO
②2NO+O2==2NO2
转 解析
D
3.思维建模
金属与硝酸反应计算题解题建模
1.思维模型
思 维 建 模
金属与硝酸反应计算题解题建模
2.计算中守恒思想的应用 (1)原子守恒法 即溶液中的 NO3 和释放出的 NO(或 NO2)中 N 的物质的
-
思 维 建 模
量之和等于原 HNO3 的物质的量。 (2)得失电子守恒法 根据这个守恒 , 可求出氮元素被还原后的价态 , 根据价 态确定反应物。 (3)电荷守恒法 (4)离子方程式计算法 适用于金属与 H2SO4、HNO3 的混合酸反应时的计算。
2. 典例剖析
【典例】 下列有关实验操作、 现象和解释或结论都正确的是 ( D )。 选项 A B C 实验操作 现象 过量的Fe粉中加入稀 溶液呈红 HNO3,充分反应后, 色 滴入KSCN溶液 AgI沉淀中滴入 稀KCl溶液 Al箔插入稀HNO3中 用玻璃棒蘸取 浓HNO3点到红色石 蕊试纸上 有白色沉 淀出现 无现象 变蓝色后 褪色 解释或结论 稀HNO3将Fe氧 化为Fe3+ AgCl比AgI更难 溶 Al箔表面被 HNO3氧化,形 成致密的氧化膜 浓HNO3具有酸 性和强氧化性
